一种减毒系统及其应用的制作方法
本发明涉及基因工程技术领域,具体涉及一种减毒系统及其应用,尤其涉及一种减毒及其用于疟原虫减毒的应用。
背景技术:
疟疾与艾滋病以及结核病并列世界三大传染病,疟疾是一种由单细胞原生动物疟原虫引起的,并由按蚊传播的传染疾病,寄生人体的疟原虫分为4种:恶性疟原虫(p.falciparum)、三日疟原虫(p.malariea)、间日疟原虫(p.vivax)以及卵形疟原虫(p.ovale)。95%的疟疾死亡是由恶性疟原虫感染导致,其主要分布在撒哈拉沙漠以南的非洲区域。目前,用于疟疾研究的动物模型主要为鼠疟及猴疟模型。鼠疟原虫可分为夏氏疟原虫(p.chaubdi)、伯氏疟原虫(p.berghei)、约氏疟原虫(p.yoelii)及文氏疟原虫(p.vinckei)等。而猴疟原虫主要为诺氏疟原虫(p.knowlesi)以及石蟹猴疟原虫(p.cynomolgi)。
人疟原虫有人和按蚊两个宿主,会在人体内进行无性繁殖和按蚊体内进行有性生殖。在人体内经历肝期和红内期两个阶段,肝期进行分裂生殖形成裂殖子,红内期会进行分裂增殖,同时有部分形成配子体,配子体可以进行有性生殖。成熟的疟原虫子孢子位于按蚊的唾液腺,按蚊叮咬人体的同时将子孢子注入人体血液。通过血液循环,几分钟内,子孢子侵入肝脏细胞,并在肝脏细胞中进行分裂增殖,经过十到十二天的发育成熟后,裂殖体涨破肝细胞,释放裂殖子进入血液。一部分裂殖子继续感染肝细胞,一部分侵入红细胞,进入红内期,剩下的大部分被吞噬细胞吞噬。侵入红细胞的裂殖子继续发育,经历环状体、大滋养体、未成熟裂殖体和成熟裂殖体阶段,成熟的裂殖体溢出红细胞。这个阶段的裂殖体不会入侵肝脏,部分裂殖体能够继续侵染红细胞,部分经过几次分裂增殖后不再分裂,继续发育形成雌或雄配子体。疟疾病人体内含有大量的疟原虫配子体,当按蚊叮咬时,成熟的雌雄配子体进入蚊胃,开始有性生殖。雌雄配子体进一步发育成为雌雄配子,雌雄配子融合形成合子,进一步发育成动合子,动合子入侵按蚊的胃壁,形成卵囊,随后进行无性生殖的孢子增殖阶段。孢子增殖形成大量游离于卵囊子孢子,子孢子移动到按蚊唾液腺中,进入下一循环。
根据世界卫生组织2016年12月公布的最新估算数据,2015年有2.12亿起疟疾病例,42.9万人死亡。在2015年的统计数据中发现,全世界约有一半的人口面临疟疾的威胁,疟疾主要发生在撒哈拉以及南非,另外在东南亚、拉丁美洲以及中东地区也有不同程度的威胁。在2015年的疟疾统计中发现全球依然有91个国家以及地区有持续性的疟疾流行,撒哈拉以南非洲地区疟疾病例占全球疟疾病例总数的90%,并占了疟疾死亡总数的92%。同时在这些疟疾的高传播地区,5岁以下的儿童很容易感染疟疾而得病,严重的甚至会导致死亡。超过70%的疟疾死亡病例都是发生在5岁以下的儿童中,每两分钟就有一名儿童死于疟疾,所以疟疾是5岁以下儿童的头号杀手。除了5岁以下儿童,婴儿,孕妇以及艾滋病人等低免疫力人群都是疟疾的高风险人群。
因此一种高效的疟疾疫苗对于保护人类,消除疟疾有很重大的意义。可是目前因为疟原虫的生活史复杂,抗原的成分多变,疫苗研究的实验模型不完善等原因,疫苗研发的进展不大。目前疟疾疫苗主要分为:1、红前期疫苗,如rts,诱导针对环子孢子蛋白的抗体,具有比较好的临床保护效果,但是保护力较低,只有25-50%。而其它红前期的亚单位蛋白疫苗、dna疫苗都没有明显的保护效果;2、红内期疫苗,是利用裂殖子表面抗原、侵入红细胞相关抗原以及感染的红细胞表面抗原开发的疫苗,目前针对msp1以及ama1开发的红内期亚单位疫苗都没有明显的保护效果;3、传播阻断疫苗,利用配子体或合子体表面抗原阻止配子的结合或合子的发育从而阻断疟疾传播的疫苗,但是目前的传播阻断疫苗引起的抗体水平不高所以不具有实用价值;4、多阶段多抗原疫苗,一种复合的抗原,如sp66,包含红内期抗原msp1肽以及环子孢子蛋白csp中间复制区,目前的临床实验显示没有保护效果;5、全虫疫苗,一种减毒的疟原虫活疫苗,包括放射减毒疫苗,基因减毒疫苗以及药物减毒疫苗。
放射减毒疫苗通过辐照感染疟原虫的按蚊,令子孢子dna突变,不能进入红内期以实现减毒。利用辐照减毒的恶性疟原虫以及间日疟原虫获得的子孢子疫苗有保护作用,但是保护力较低,另外因为辐照减毒并不可控,不能保证安全性,限制了辐照减毒疫苗的应用。
药物减毒疫苗利用野生型的疟原虫感染宿主,同时给宿主抗疟药杀死疟原虫从而获得免疫。早期的实验验证了通过感染了恶性疟原虫的按蚊叮咬志愿者后给以口服氯喹治疗控制红内期的感染可以诱导完全的保护作用,但是在接种疟原虫后如不按时服用抗疟药会引起原虫血症,引起不良反应,被按蚊叮咬后可能引发疟疾传播,具有较大风险,制约了减毒疫苗的应用。
基因减毒疫苗目前主要是通过敲除疟原虫肝后期或红前期必须基因,让疟原虫不能进入红内期。与药物减毒疫苗相比,基因减毒疫苗没有引发疟疾传播的风险也不会引发原虫血症,同时作为全虫活疫苗可以激发明显的保护效果,是一种优秀的疟疾疫苗策略。但是敲除疟原虫发育必须基因或者毒性基因可能会影响疟原虫生长或者表面抗原的表达。
泛素蛋白酶体系统(ubiquitin-proteasomesystem(ups))是细胞内非溶酶体途径的蛋白降解通路,其中泛素是一个由76个氨基酸残基组成的在真核细胞中普遍存在且序列高度保守的小分子球形蛋白质,其分子量约8.5kda,可以通过共价键与细胞中的受体蛋白结合。细胞可以通过ups途径将蛋白降解,对受组成型调节和环境刺激产生的蛋白表达水平进行控制。细胞的多种生理过程,包括细胞凋亡、细胞增生及分化调节内质网蛋白质的质控蛋白转运、炎症反应抗原提呈和dna修复以及细胞应激反应等等都与ups有关,另外,ups可以降解异常蛋白,如未折叠蛋白,受损蛋白,变异及错误转录蛋白,所以ups对于维持细胞正常功能发挥着重要作用。
ddd(dhfrdegradationdomain)调控系统是一种利用泛素蛋白酶系统对目的蛋白进行调控的调控系统,它利用大肠杆菌的二氢叶酸还原酶(ecdhfr)与目标蛋白融合,通过控制稳定剂添加与否对目的蛋白进行调控。ecdhfr可以被dhfr抑制剂甲氧苄氨嘧啶(tmp)所稳定。当没有添加tmp时,ecdhfr及其融合的蛋白被泛素标记,被蛋白酶体识别并降解。当添加tmp时,tmp与ecdhfr结合并且稳定ecdhfr,使与ecdhfr融合的蛋白保持稳定不被泛素化降解,目的蛋白可以正常表达。tmp与ecdhfr结合从而稳定蛋白不被降解的状态是可逆的,tmp添加可以稳定ecdhfr,tmp撤药会导致ecdhfr及其融合蛋白的降解,另外通过控制tmp的量可以控制目的蛋白的表达水平,所以通过tmp控制目的蛋白是否表达以及控制目的蛋白的表达量非常方便。另外,因为ddd调控系统是通过泛素化降解控制目的蛋白是否表达,所以对分泌表达的蛋白并不能起到调控作用。
因此有必要开发一种条件性调控疟原虫必须基因表达的技术,先表达必须基因使疟原虫存活,在获得免疫保护后让疟原虫必须基因不表达,实现减毒。要求调控系统在不添加调控药物时不表达必须基因,添加调控药物后必须基因表达,疟原虫才存活,可以避免存活的疟原虫引起的疟疾传播。
技术实现要素:
针对现有技术的不足及实际的需求,本发明提供一种减毒系统及其应用,通过采用调控系统来调控ef1g基因的表达或降解,从而控制疟原虫的生长,实现疟原虫的减毒。
为达此目的,本发明采用以下技术方案:
一方面,本发明提供一种ef1g基因用于疟原虫减毒的用途。
本发明中,发明人发现ef1g(pbanka_1352000elongationfactor1-gamma)是伯氏疟原虫上的一个必须基因,所以通过使用调控元件来调控其表达控制疟原虫的生存实现疟原虫减毒。
根据本发明,所述ef1g基因的名称为elongationfactor1-gamma,基因识别号为pbanka_1352000,所述ef1g基因的核苷酸序列如seqidno.1所示,具体序列如下:
atggatttaaaacttcttggcccaaaaaatgatatcagatgtttgaaggtgcaaacagttgcttctttttgtaatataaaactaaatatcccaacatttgaaatcggtattgatgataataaagatgaatttataaaagaatcgccaatgaaaagacttccagttttaataacaccccaaggaagcttatttgaaagcaatgctataggaaaatatttatgcagtataagaagtgaacataatttattgggaaatggaatttttgaagaagggcaagtaaatatgtgggtagatttttgtacatttgaattagaaattccagtatgctgttatattagtaataagttgaatgaaaaatcgttaaaacatattcaagatacatttagttgtttaaataaacacttactattaaatcagtatatggtaggtaacaacataactattgttgatatttttatgtctgtaattataaatttttgtataaaatcgggaaaaatgactgaagcctttttaaaacaatatggaaacttatacagattatatacaactataataaatcagaaacaatttaaatatgttatgggttcaggatcagctgtaaataataaaaaaacacctactcaacccaaacagccaaataataaggaaaaaaaaaaaccaaaagaagatgcagatgatgatattaatctatttagtgatgatggacttaatgaaaaaaaaacaaaaaagacaaaccctttagatttattacctccatcaaaattttctttagataactggaaatataaatttagtaatgaaaaggatttattaaaaaatgcaatgcccacattttgggaaacttatgatagtaatggattttcattatattatatgaaatatgataaattagaagatgaatgccaaatatcttttgttgcttgtaatatggctagtgggtttttacaaaggttagaaaacaatttctcaaaatactcatttgcagttatatctgttttaggggaaaataaaaattatgatattgaaggtgtttggctatttagaggtactgaaattccttttgaaatgaaagaccatccatcttttgaatatcacatttttaaaaaattagatattaataacagtaatgataaaaaacttgttgaagattattggtgttcaaaagaaattatttctaatagacctgtttgtgatagaaaggtttggaaatga.
根据本发明,所述疟原虫为伯氏疟原虫、恶性疟原虫、间日疟原虫、三日疟原虫、卵形疟原虫或诺氏疟原虫中的任意一种或至少两种的组合,优选为伯氏疟原虫。
第二方面,本发明提供一种重组载体,所述重组质粒包括ef1g基因。
本发明构建的是一个实现敲入的载体,通过构建cas9敲入载体从而将调控元件和报告基因一同敲入宿主细胞基因组特定基因上。
根据本发明,所述载体为质粒载体、噬菌体载体或病毒载体中的任意一种或至少两种的组合,优选为质粒载体。
根据本发明,所述重组载体还包括调控元件,所述调控元件置于ef1g基因上游。
本发明中,通过所述重组载体可以将调控元件敲入疟原虫基因组中,通过敲入基因组中ef1g基因上游,能够控制基因组中的ef1g基因的表达,让该基因的转录或者该基因表达的对应的蛋白受到调控系统的控制。
根据本发明,所述调控元件为二氢叶酸还原酶调控元件(ddd)、四环素操纵子调控元件或fkbp12调控元件中的任意一种或至少两种的组合,优选为二氢叶酸还原酶调控元件。
本发明中,发明人发现利用ddd组件调控必须基因,在蛋白表达水平控制疟原虫必须基因的表达,从而控制疟原虫存活,ddd调控元件相比于其他调控元件本底低,调控表达幅度大,调控方便。
根据本发明,所述二氢叶酸还原酶调控元件的核苷酸序列如seqidno.2所示,具体序列如下:
atgatcagtctgattgcggcgttagcggtagattatgttatcggcatggaaaacgccatgccgtggaacctgcctgccgatctcgcctggtttaaacgcaacaccttaaataaacccgtgattatgggccgccatacctgggaatcaatcggtcgtccgttgccaggacgcaaaaatattatcctcagcagtcaaccgggtacggacgatcgcgtaacgtgggtgaagtcggtggatgaagccatcgcggcgtgtggtgacgtaccagaaatcatggtgattggcggcggtcgcgttattgaacagttcttgccaaaagcgcaaaaactgtatctgacgcatatcgacgcagaagtggaaggcgacacccatttcccggattacgagccggatgactgggaatcggtattcagcgaattccacgatgctgatgcgcagaactctcacagctattgctttgagattctggagcggcgg.
根据本发明,所述重组载体还包括报告基因,所述报告基因置于调控元件与ef1g基因之间。
本发明中,通过插入报告基因,从而进行观察调控元件对ef1g基因的调控效果。
根据本发明,所述报告基因选自但不限于报告蛋白gfpm3,其他报告基因也是可行的,在此不做过多列举,本领域技术人员可以根据需要来选择适用的报告基因。
根据本发明,所述报告蛋白gfpm3的核苷酸序列如seqidno.3所示,具体序列如下:
atgagtaaaggagaagaacttttcactggagttgtcccaattcttgttgaattagatggtgatgttaatgggcacaaattttctgtcagtggagagggtgaaggtgatgcaacatacggaaaacttacccttaaatttatttgcactactggaaaactacctgttccatggccaacacttgtcactactttcggttatggtgttcaatgctttgcgagatacccagatcatatgaaacagcatgactttttcaagagtgccatgcccgaaggttatgtacaggaaagaactatatttttcaaagatgacgggaactacaagacacgtgctgaagtcaagtttgaaggtgatacccttgttaatagaatcgagttaaaaggtattgattttaaagaagatggaaacattcttggacacaaattggaatacaactataactcacacaatgtatacatcatggcagacaaacaaaagaatggaatcaaagttaacttcaaaattagacacaacattgaagatggaagcgttcaactagcagaccattatcaacaaaatactccaattggcgatggccctgtccttttaccagacaaccattacctgtccacacaatctgccctttcgaaagatcccaacgaaaagagagaccacatggtccttcttgagtttgtaacagctgctgggattacacatggcatggatgaactatacaaa.
第三方面,本发明提供一种减毒系统,其通过第二方面所述的重组载体将调控元件插入疟原虫基因组中ef1g基因上游。
第四方面,本发明提供一种宿主细胞,通过第二方面所述的重组载体将调控元件插入疟原虫基因组中ef1g基因上游。
根据本发明,所述宿主细胞为疟原虫,优选为伯氏疟原虫、恶性疟原虫、间日疟原虫、三日疟原虫、卵形疟原虫或诺氏疟原虫中的任意一种或至少两种的组合,进一步优选为伯氏疟原虫。
第五方面,本发明提供一种疫苗,包括第三方面所述的减毒系统和/或第四方面所述的宿主细胞。
第六方面,本发明提供一种疟原虫减毒的方法,包括如下步骤:
将第三方面所述的减毒系统、第四方面所述的宿主细胞或第五方面所述的疫苗感染动物,控制tmp(甲氧苄氨嘧啶)添加实现减毒。
本发明中,使用的调控药物tmp可以控制疟原虫的生长,而且tmp可以直接用于人体,可以穿透血脑以及胎盘屏障。
第七方面,本发明提供一种如第三方面所述的减毒系统、第四方面所述的宿主细胞或第五方面所述的疫苗用于制备缓解疟原虫感染副作用的药物。
与现有技术相比,本发明具有如下有益效果:
(1)本发明首次发现了一个疟原虫的必须基因ef1g,通过使用调控元件对其进行调控,控制疟原虫ef1g蛋白的表达或降解,从而控制疟原虫的生长,实现疟原虫的减毒;
(2)本发明作为一种新型可行的疟原虫减毒策略,通过采用ddd调控元件对其进行调控,调控效果好,精准可控,且ddd调控系统本底低,调控方便,再配合tmp来控制疟原虫的生长,能够直接用于人体,从而实现疟原虫在人体感染后的减毒。
附图说明
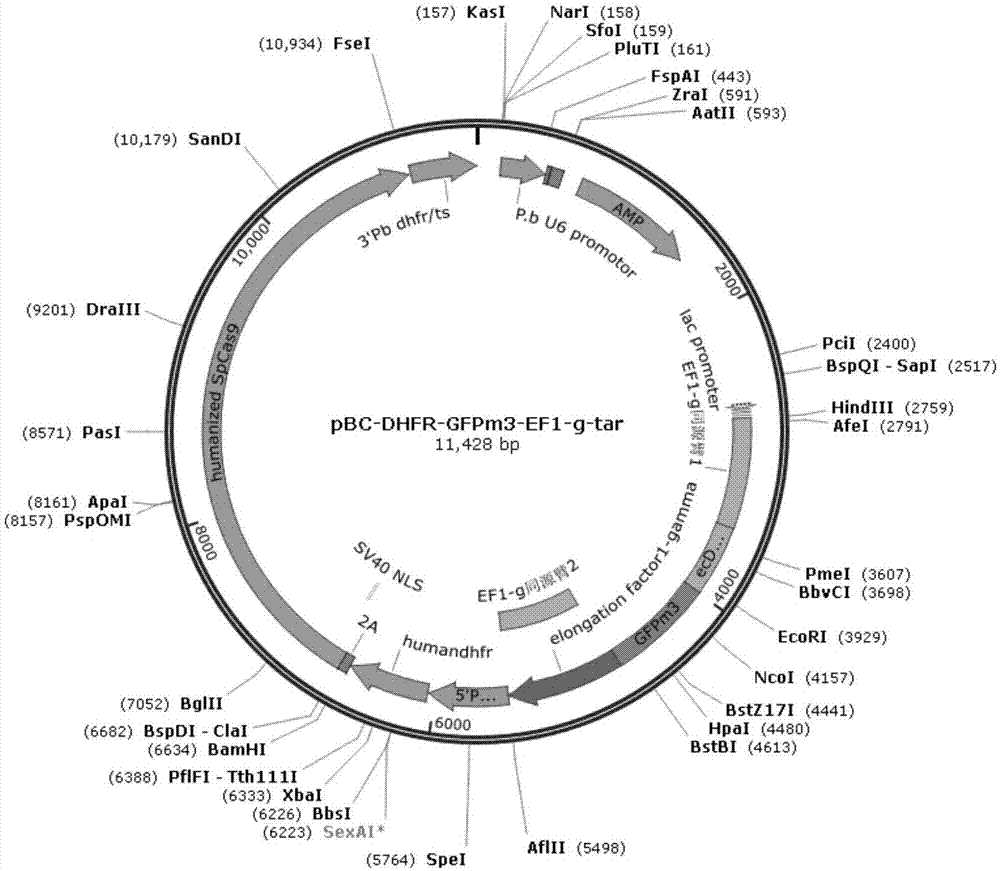
图1为pbc-dhfr-gfpm3-ef1g-tar载体示意图;
图2为荧光显微镜观察荧光结果,其中,bf为亮场,gfp为绿色荧光蛋白,hoechst为标记细胞核的染料;
图3为撤药tmp后疟原虫感染率变化曲线;
图4为第二轮ddd-ef1g虫株给药tmp后撤药检测感染率结果;
图5为tmp撤药实验各组疟原虫感染率以及生存率变化曲线;
图6为荧光显微镜检测g1组及野生型p.ba虫株荧光结果,其中,bf为亮场,fl荧光灯下结果;
图7为荧光显微镜检测tmp撤药后g1组荧光结果,其中,bf为亮场,fl荧光灯下结果,d为tmp撤药后天数;
图8(a)为tmp撤药实验各组疟原虫感染率;图8(b)为tmp撤药实验各组疟原虫生存率变化曲线;
图9为攻毒实验疟原虫接种以及给药流程示意图;
图10为ddd-ef1g(实验组)接种小鼠的感染率变化曲线;
图11为p.banka(对照组)接种小鼠的感染率变化曲线;
图12为疟原虫攻毒后小鼠存活曲线。
具体实施方式
为更进一步阐述本发明所采取的技术手段及其效果,以下结合附图并通过具体实施方式来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。
实施例1构建在伯氏疟原虫p.banka中使用ddd调控ef1g基因的虫株
本实施例通过构建cas9敲入载体pbc-dhfr-gfpm3-ef1g-tar,载体示意图如图1所示,该载体带有amp抗性,包含一个串联表达cas9蛋白以及疟原虫乙胺嘧啶抗性基因hdhfr,使用pbeef1aa启动子,cas9基因与hdhfr基因通过2a肽连接,使用3'pbdhfr/ts作为终止子。除此之外,该载体还包含一个融合表达框,该表达框使用pbeef1aa启动子包含ef1g同源臂1、调控元件dhfr、报告蛋白gfp以及ef1g下游同源臂的序列串联,使用3'pbdhfr/ts作为终止子,该载体还包含一个p.bu6启动子用于表达sgrna。
ef1g基因同源臂如seqidno.4-5所示,sgrna引物如seqidno.6-7所示,具体序列如下表1所示:
表1
质粒提取线性化后转染伯氏疟原虫p.banka,电转后混合给药tmp/乙胺嘧啶,对电转后的疟原虫感染小鼠给药方式如下:
乙胺嘧啶溶液:将乙胺嘧啶粉末溶于dmso,配置为终浓度7mg/ml的母液(震荡混匀),4℃保存;工作液是使用蒸馏水稀释100倍,调节ph为3.5-5.0范围,每七天更换一次;
tmp/乙胺嘧啶混合给药:先将100mgtmp溶于2mldmso再加入1ml乙胺嘧啶母液后用蒸馏水定容至100ml,调节ph至3.5-5.0范围,每三天更换一次;
通过将质粒电转伯氏疟原虫并接种balb/c(8w,雌性)小鼠,成功获得了p.banka/pbc-dhfr-gfpm3-ef1g-tar虫株(简称ddd-ef1g虫株),电转后虫株使用荧光显微镜观察,结果如图2所示,对虫株进行撤药实验(混合给药tmp/乙胺嘧啶,感染率超过10%后不给tmp,只给药乙胺嘧啶),观察虫株的感染率变化,结果如图3所示,对转接的第二代虫株进行tmp撤药实验(混合给药tmp/乙胺嘧啶,镜检发现疟原虫后不给tmp,只给药乙胺嘧啶),结果如图4所示。
从图2看出由ef1g启动子启动的gfp有明显荧光,位置与hoechst标记的疟原虫细胞核位置一致,判断gfp正确表达;从图3中可以看出,疟原虫在撤药后120h感染率从32.6%降到0.09%,在撤药后的144h后感染率为0;从图4中可以看出,在撤药后24h感染率略微上升,是残留tmp所致;在撤药tmp后疟原虫感染率降为0;
两次实验结果发现只有在给药tmp疟原虫才能够存活,此结果证明了ddd调控系统可以通过给药tmp与否控制疟原虫必须基因的表达从而控制疟原虫的存活,实现对疟原虫毒性的调节。
实施例2验证在伯氏疟原虫p.banka中使用ddd调控ef1g基因的效果
两只balb/c(8w,雌性)小鼠接种p.bnaka/pbc-dhfr-gfpm3-ef1g-tar虫株,一只小鼠接种使用crispr-cas9系统敲除非必须基因nt1的伯氏疟原虫作为对照,先进行tmp/乙胺嘧啶混合给药,待疟原虫感染率超过1%后进行撤药tmp实验。撤药后对小鼠进行采血涂片计算感染率,结果如图5所示。
从图5可以看出,对照nt1组小鼠在撤药后7天死亡,而ddd-ef1g组全部小鼠感染率下降为0;对照nt1虫株,在撤药tmp后(一开始tmp/乙胺嘧啶混合给药,撤药后为乙胺嘧啶给药)感染率持续上升,5天后死亡,而2只ddd-ef1g组小鼠在撤药后5天感染率下降为0,小鼠存活。
可见,在撤药tmp后,ddd-ef1g虫株接种感染的小鼠的疟原虫出现死亡,使用ddd系统可以调控ef1g基因表达,控制疟原虫生存,可实现疟原虫减毒。
实施例3在伯氏疟原虫p.banka中使用ddd调控ef1g基因的效果
本实施例将一株本公司构建的ddd-gfp虫株(ddd系统调控gfp表达,不调控必须基因)接种balb/c(8w,雌性)小鼠用于验证tmp撤药后是否有tmp残留,另外ddd-ef1g虫株接种6只balb/c(8w,雌性)小鼠,小鼠给药方式如表2所示:
表2小鼠分组给药表
待疟原虫感染率超过1%后对g1、g3组进行撤药,在撤药前,观察ddd-ef1g虫株的gfp荧光,结果如图6所示,在tmp撤药后,观察g1荧光,结果如图7所示,各组小鼠的感染率以及生存率结果如图8(a)-图8(b)所示。
从图6中可以看出在撤药前tmp给药可以激发g1组虫株的荧光,证明tmp起作用;从图7看出g1组的ddd-gfp虫株的荧光在撤药3天是增加的,在撤药后第5、7天没检出gfp荧光,认为是撤药3天tmp在小鼠体内仍有残留,在撤药5天tmp消耗完毕。
从图8(a)-图8(b)可以看出,除了g3组,g1、g2组小鼠全部死亡,g3组两只小鼠一只感染率降为0,一只感染率维持在50-60%,但小鼠没有死亡;g2组小鼠全部死亡,证明了持续给药tmp不会导致ddd-ef1g虫株的死亡,tmp的撤药是影响ddd-ef1g虫株死亡的关键因素;g1组小鼠死亡证明了ddd调控非必需基因的虫株在tmp给药后撤药不会死亡,证明只有ddd调控必须基因的虫株才受到tmp给药调控的影响。
综上所述,本实施例证明ddd-ef1g虫株的生长受到tmp的调控影响,ddd调控疟原虫ef1g基因表达是实现疟原虫外部调控存活以及疟原虫减毒的有效手段。
实施例4验证ddd调控的减毒疫苗的预防疟原虫感染效果
利用实施例1构建的p.bnaka/pbc-dhfr-gfpm3-ef1g-tar虫株(实验组)以及野生型p.banka虫株(对照组)接种balb/c(雌性,8w)小鼠进行实验。小鼠给药tmp(1mgtmp/ml水浓度,饮水给药)3天后接种疟原虫(实验组接种8只小鼠,对照组接种6只小鼠),再给药tmp/乙胺嘧啶(1mgtmp及0.07mg乙胺嘧啶/ml水,ph3.5-5,饮水给药),疟原虫感染率超过1%后撤tmp(0.07mg乙胺嘧啶/ml水,ph3.5-5,饮水给药),实验组疟原虫感染率降低直至为0,间隔一个月后接种1×105p.banka疟原虫进行攻毒实验,对实验组以及对照组的小鼠按照图9的流程进行给药以及接种,实验和对照小鼠的感染率变化曲线如图10-12所示。
从图10-12可以看出,实验组在撤药tmp后全部小鼠的疟原虫死亡,感染率降为0,将实验组的8只小鼠以及对照组的小鼠接种1×105p.banka,计数疟原虫感染率;实验组的小鼠在接种1×105p.banka未观察到疟原虫生长,小鼠全部存活(图10,12),而对照组的小鼠在接种22天后全部死于高感染率(图11,12)全部都有疟原虫生长;证明使用ddd调控系统控制必须基因的疟原虫疫苗具有明显的预防保护作用,可以有效地防止接种的小鼠被疟疾感染,具有作为疟原虫疫苗的价值。
综上所述,本发明作为一种新型可行的疟原虫减毒策略,通过采用ddd调控元件对其进行调控,调控效果好,精准可控,且ddd调控系统本底低,调控方便,再配合tmp来控制疟原虫的生长,能够直接用于人体,从而实现疟原虫在人体感染后的减毒。
申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!