细胞培养装置及细胞培养方法与流程
公开技术涉及一种细胞培养装置及细胞培养方法。
背景技术:
作为通过膜分离处理从培养液分离特定成分的技术,已知有以下技术。
例如,专利文献1中记载有采样装置,其具备:生物反应器;采样管路,使生物反应器内的培养液循环;交叉流方式的过滤装置,设置在采样管路的中途,分离培养液中的污染微生物;回收管路,连接过滤装置的透过侧室与生物反应器;及过滤膜单元,设置在回收管路的中途,捕集污染微生物。
专利文献2中记载有过滤装置,其具备:原液罐,收纳液体培养基;交叉流方式的第1过滤机构,分离液体培养基中的混杂物;及死端方式的第2过滤机构,进一步过滤通过第1过滤机构过滤的液体培养基。该过滤装置还具备:储存罐,储存通过第1过滤机构过滤的液体培养基;压力调整机构,调整储存罐内的压力;及泵,将储存于储存罐的液体培养基供给到第2过滤机构。
专利文献3中记载有半连续培养装置,其具备:培养槽,收纳培养液并在培养液中培养菌;自旋过滤器,配设在培养槽内,从培养液分离菌体;及作为第1过滤机构的超滤膜装置,从培养液回收菌所产生的产物。自旋过滤器连接于向超滤膜装置供给培养液的培养液导管,培养液导管经由配设在中途的微滤膜装置连接于超滤膜装置。超滤膜装置具备使其滤液在培养槽中循环的滤液导管,滤液导管经由微滤膜装置连接于培养槽。
现有技术文献
专利文献
专利文献1:日本特开2010-029109号公报
专利文献2:日本特开2011-211961号公报
专利文献3:日本特开2015-053892号公报
技术实现要素:
发明要解决的技术课题
作为利用了细胞所分泌的抗体的生物医药品的制造中所使用的细胞的培养方式,有灌流培养。灌流培养为连续过滤及排出包含细胞的培养液,另一方面连续向培养槽供给包含营养成分的新鲜的培养基的培养方式。
灌流培养中,通过更多地排出细胞的残骸、细胞的破碎物、DNA(deoxyribonucleic acid:脱氧核糖核酸)、HCP(Host Cell Protein:宿主细胞蛋白)、抗体、废物等细胞培养中不必要的成分,来促进细胞的增殖,提高抗体的生产率。然而,随着不必要成分的排出量的增加,培养基的使用量增加,抗体的生产成本变高。
公开技术是鉴于上述点而完成的,其目的在于能够抑制培养基的使用量并且提高抗体的生产率。
用于解决技术课题的手段
公开技术所涉及的细胞培养装置的一方式包括:培养容器,收纳包含细胞的细胞悬浮液;第1过滤部,具有第1过滤膜,所述第1过滤膜对从培养容器抽出的细胞悬浮液实施膜分离处理;第1循环流路,将被第1过滤膜阻止的成分回送到培养容器;第2过滤部,具有第2过滤膜,所述第2过滤膜对细胞悬浮液中透过第1过滤膜的成分实施膜分离处理;第2循环流路,将透过第2过滤膜的成分回送到培养容器;及回收流路,回收被第2过滤膜阻止的成分。公开技术所涉及的细胞培养装置中,第1过滤膜的平均孔径为20μm以下,将第1过滤膜的平均孔径设为A,将第2过滤膜的平均孔径设为B时,满足0<B/A≤0.5。
公开技术所涉及的细胞培养装置的又一方式包括:培养容器,收纳包含细胞的细胞悬浮液;第1过滤部,具有第1过滤膜,所述第1过滤膜对从培养容器抽出的细胞悬浮液实施膜分离处理;第1循环流路,将被第1过滤膜阻止的成分回送到培养容器;第2过滤部,具有第2过滤膜,所述第2过滤膜对细胞悬浮液中透过第1过滤膜的成分实施膜分离处理;第2循环流路,将透过第2过滤膜的成分回送到培养容器;及回收流路,回收被第2过滤膜阻止的成分,第1过滤膜的平均孔径为20μm以下,第2过滤膜为超滤膜。
通过第2过滤膜进行的膜分离处理的方式可以是死端方式。此时,回收流路可以设置在第1过滤部与第2过滤部之间。
通过第2过滤膜进行的膜分离处理的方式可以是切向流方式。此时,回收流路可以连接于第2过滤部的、使被第2过滤膜阻止的成分向第2过滤部的外部流出的流出口。
公开技术所涉及的细胞培养装置可以进一步包括送液部,所述送液部产生从第2过滤部的透过侧朝向供给侧的液流。
第2过滤膜的平均孔径优选大于0μm且1μm以下。
第1过滤膜可以具有形成在第1面的入侧的开口及形成在与第1面相反的一侧的第2面且与入侧的开口连通的出侧的开口,入侧的开口和出侧的开口可以配置于在与膜面平行的方向上错开的位置。
第1过滤膜可以具有形成在第1面的入侧的开口及形成在与第1面相反的一侧的第2面且与入侧的开口连通的出侧的开口,连接入侧的开口与出侧的开口的路径可以为非直线状。
第1过滤膜可以包含对纤维状部件进行斜纹荷兰编织而形成的网格来构成。此时,网格可以由金属构成。
第1过滤膜可以是微滤膜。
第2过滤膜可以是微滤膜。
并且,第2过滤膜可以是超滤膜。此时,第2过滤膜的截留分子量优选大于0kDa且100kDa以下,进一步优选为30kDa以上且70kDa以下。
公开技术所涉及的细胞培养方法的一方式包括:第1膜分离工序,使用第1过滤膜对从收纳包含细胞的细胞悬浮液的培养容器抽出的细胞悬浮液实施膜分离处理,将被第1过滤膜阻止的成分回送到培养容器;第2膜分离工序,使用第2过滤膜对透过第1过滤膜的成分实施膜分离处理,将透过第2过滤膜的成分回送到培养容器;及回收工序,经由回收流路而回收被第2过滤膜阻止的成分。以第1过滤膜的平均孔径为20μm以下,将第1过滤膜的平均孔径设为A,将第2过滤膜的平均孔径设为B时,满足0<B/A≤0.5的方式,构成第1过滤膜及第2过滤膜。
公开技术所涉及的细胞培养方法的又一方式包括:第1膜分离工序,使用第1过滤膜对从收纳包含细胞的细胞悬浮液的培养容器抽出的细胞悬浮液实施膜分离处理,将被第1过滤膜阻止的成分回送到培养容器;第2膜分离工序,使用第2过滤膜对透过第1过滤膜的成分实施膜分离处理,将透过第2过滤膜的成分回送到培养容器;及回收工序,经由回收流路而回收被第2过滤膜阻止的成分,第1过滤膜的平均孔径为20μm以下,第2过滤膜为超滤膜。
优选以将在回收工序中回收的成分的每日分量与收纳在培养容器的细胞悬浮液的分量之比即灌流比设为X,将在第1膜分离工序中透过第1过滤膜的成分的每日分量与收纳在培养容器的细胞悬浮液的分量之比即循环比设为Y时,满足1.5≤Y/X的方式,确定灌流比及循环比。
优选灌流比为0.1以上且2以下,优选循环比为0.2以上且10以下。
优选将收纳在培养容器的细胞悬浮液中所包含的细胞的浓度设为2×107cells/ml以上,且将收纳在培养容器内的细胞悬浮液中所包含的粒径为2μm以上且4μm以下的微粒的浓度设为40×107个/ml以下。
在第1膜分离工序中的膜分离处理中,优选将细胞的透过率设为20%以下且将粒径为2μm以上且4μm以下的微粒的透过率设为30%以上。
优先将透过第2过滤膜的成分中所包含的粒径为2μm以上且4μm以下的微粒的浓度设为1×107个/ml以下。
在细胞为表达抗体的细胞的情况下,优选将收纳在培养容器的细胞悬浮液中所包含的细胞的浓度设为2×107个/ml以上,将收纳在培养容器的细胞悬浮液中所包含的抗体的浓度设为4g/l以下。
在细胞为表达抗体的细胞的情况下,在第1膜分离工序中的膜分离处理中,优选将抗体的透过率设为30%以上。
在细胞为表达抗体的细胞的情况下,优选将透过第2过滤膜的成分中所包含的抗体的浓度设为1g/l以下。
在细胞为表达抗体的细胞的情况下,优选将被第2过滤膜阻止的成分中所包含的抗体的浓度设为0.5g/l以上。
通过第1过滤膜进行的膜分离处理的方式可以是切向流方式。
通过第2过滤膜进行的膜分离处理的方式可以是切向流方式。
通过第2过滤膜进行的膜分离处理的方式可以是死端方式。
在通过第2过滤膜进行的膜分离处理的方式为死端方式的情况下,公开技术所涉及的细胞培养方法可以进一步包括反洗工序,通过从第2过滤膜的膜面的透过侧朝向供给侧的液流将被第2过滤膜阻止的成分送到回收流路。
在通过第2过滤膜进行的膜分离处理的方式为切向流方式的情况下,回收工序中,可以将被第2过滤膜阻止的成分连续送到回收流路。
细胞可以是CHO细胞。
发明效果
根据公开技术,能够抑制培养基的使用量并且提高抗体的生产率。
附图说明
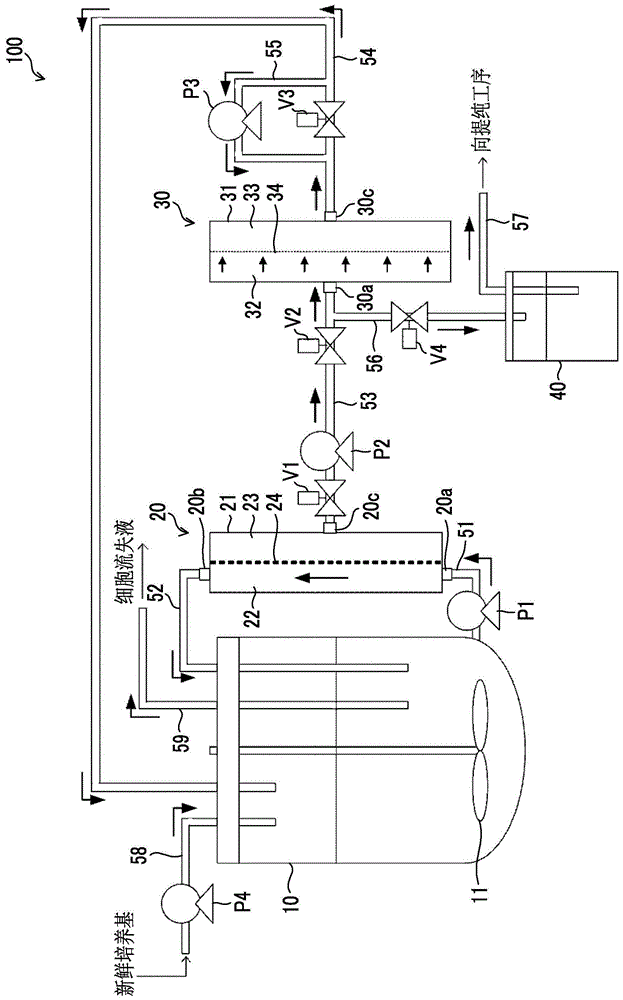
图1是表示公开技术的第1实施方式所涉及的细胞培养装置的结构的图。
图2是表示作为公开技术的实施方式所涉及的第1过滤膜而使用的网格过滤器的结构的一例的剖视图。
图3A是表示能够作为公开技术的实施方式所涉及的第1过滤膜而使用的斜纹荷兰编织网格的结构的立体图。
图3B是放大表示斜纹荷兰编织网格的开口的立体图。
图3C是表示透过斜纹荷兰编织网格的流体的流动的图。
图4是表示公开技术的第2实施方式所涉及的细胞培养装置的结构的图。
图5是表示公开技术的第3实施方式所涉及的细胞培养装置的结构的图。
图6A是表示使用公开技术的实施方式所涉及的细胞培养装置而进行了细胞的培养时的条件的图表。
图6B是表示使用公开技术的实施方式所涉及的细胞培养装置而进行细胞的培养并对多个项目进行了评价的结果的图表。
图7是表示截留分子量与超滤膜的平均孔径的关系的曲线图。
具体实施方式
以下,一边参考附图一边对公开技术的实施方式的一例进行说明。另外,各附图中对相同或等效的构成要件及部分标注相同的参考符号。
[第1实施方式]
图1是表示公开技术的第1实施方式所涉及的细胞培养装置100的结构的图。细胞培养装置100例如能够适当地使用于在动物细胞中用于表达抗体的细胞培养。
作为用于抗体的表达的细胞,并无特别限定,但可举出动物细胞、植物细胞、酵母等真核细胞、枯草芽孢杆菌等原核细胞及大肠杆菌等。优选CHO细胞、BHK-21细胞及SP2/0-Ag14细胞等动物细胞,更优选CHO细胞。
动物细胞中,作为表达的抗体,并无特别限定,但例如可举出抗IL-6受体抗体、抗IL-6抗体、抗磷脂酰肌醇蛋白聚糖-3抗体、抗CD3抗体、抗CD20抗体、抗GPIIb/IIIa抗体、抗TNF抗体、抗CD25抗体、抗EGFR抗体、抗Her2/neu抗体、抗RSV抗体、抗CD33抗体、抗CD52抗体、抗IgE抗体、抗CD11a抗体、抗VEGF抗体及抗VLA4抗体等。作为抗体,不仅包含源自人、老鼠、大鼠、仓鼠、兔子及猴子等动物的单克隆抗体,还包含嵌合抗体、人源化抗体及bispecific(双特异性)抗体等人为改变的抗体。
所得到的抗体或其片段能够提纯至均匀。关于抗体或其片段的分离及提纯,使用通常的多肽中所使用的分离及提纯方法即可。例如,若适当选择并组合亲和层析等层析柱、过滤、超滤、盐析、透析、SDS聚丙烯酰胺凝胶电泳及等电点电泳等,则能够分离及提纯抗体,但并不限定于这些。通过吸光度的测定或酶联免疫吸附测定(Enzyme-linked immunosorbent assay;ELISA)等能够进行所得到的抗体的浓度测定。
细胞培养装置100包括:培养容器10,收纳包含细胞的细胞悬浮液;第1过滤部20,具有第1过滤膜24,所述第1过滤膜24对从培养容器10抽出的细胞悬浮液实施膜分离处理;及作为第1循环流路的流路52,将被第1过滤膜24阻止的成分回送到培养容器10。细胞培养装置100还具有:第2过滤部30,具有第2过滤膜34,所述第2过滤膜34对细胞悬浮液中透过第1过滤膜24的成分实施膜分离处理,作为第2循环流路的流路54,将透过第2过滤膜34的成分回送到培养容器10;及回收流路56、57,回收被第2过滤膜34阻止的成分。
培养容器10为收纳包含用于抗体的表达的细胞及培养基的细胞悬浮液的容器。培养容器10的内部中,设有具有搅拌叶片11的搅拌装置。通过旋转搅拌叶片11,搅拌与细胞一起收纳在培养容器10内部的培养基,从而保持培养基的均质性。
流路51的一端连接于培养容器10的底部,另一端连接于第1过滤部20的流入口20a。流路51的中途设有抽出收纳在培养容器10的细胞悬浮液而送到第1过滤部20的泵P1。
第1过滤部20具备:容器21;及第1过滤膜24,将容器21内的空间分隔为供给侧22及透过侧23,对从培养容器10抽出的细胞悬浮液实施膜分离处理。并且,第1过滤部20在供给侧22具有细胞悬浮液流入的流入口20a及细胞悬浮液流出的流出口20b。从培养容器10抽出的细胞悬浮液从流入口20a流入容器21的内部而从流出口20b向容器21的外部流出的期间通过第1过滤膜24。第1过滤部20进行基于使成为膜分离处理的对象的液体沿第1过滤膜24的膜面(与膜面平行的方向上)流动并且将透过成分送到透过侧的切向流(交叉流)方式的膜分离处理。通过第1过滤膜24进行的膜分离处理的方式即切向流方式可以形成从培养容器抽出的细胞悬浮液沿第1过滤膜24的膜面平行地向一方向循环的流动,也可以形成细胞悬浮液沿第1过滤膜24的膜面平行地交替往复的流动。当形成循环的流动时,例如能够适当地使用SPECTRUM LABORATORIES,INC.的KrosFlo灌流培养路径装置(KML-100、KPS-200、KPS-600)。并且当形成交替往复的流动时,能够适当地使用REPLIGEN公司的ATF系统。
包含在细胞悬浮液的尺寸较大的成分不透过第1过滤膜24,从流出口20b向容器21的外部流出,并经由流路52被回送到培养容器10的内部。即,从培养容器10抽出的细胞悬浮液中,被第1过滤膜24阻止的成分经由流路52被回送到培养容器10的内部。另外,流路52为公开技术中的第1循环流路的一例。另一方面,包含在细胞悬浮液的尺寸较小的成分透过第1过滤膜24,从设置在透过侧23的排出口20c向容器21的外部排出。在第1过滤部20的透过侧23连接有设有泵P2的流路53,被排出到透过侧23的成分经由流路53被送到第2过滤部30。
本实施方式所涉及的细胞培养装置100中,以分离细胞和细胞培养中不必要的成分的目的使用第1过滤膜24。作为细胞培养中不必要的成分,可举出细胞的残骸、细胞的破碎物、DNA、HCP、抗体、废物等。即,第1过滤膜24具有适合使细胞的残骸、细胞的破碎物、DNA、HCP、抗体、废物等细胞培养中不必要的成分透过,另一方面阻止细胞的透过的分离性能。另外,在培养容器10内培养的细胞的尺寸假设大于20μm。并且,细胞的残骸及细胞的破碎物的尺寸假设为1μm以上且10μm以下。并且,DNA、HCP及抗体的尺寸假设为几十nm左右。
第1过滤膜24的平均孔径优选为超过0且20μm以下,更优选0.05μm以上且10μm以下,进一步优选0.1μm以上且9μm以下,最优选2μm以上且8μm以下。通过将第1过滤膜24的平均孔径设为20μm以下,能够降低细胞透过第1过滤膜24的风险,能够抑制培养容器10内的细胞数量的减少。另外,关于第1过滤膜24的平均孔径,在使用网格的情况下,能够用95%分离粒径进行测定,在使用微滤膜或超滤膜的情况下,能够用压汞法进行测定。另外,超滤膜(有时也称为UF膜(Ultrafiltration Membrane))是指平均孔径小于微滤膜(有时也称为MF膜(Microfiltration Membrane)),且平均孔径为0.001~0.01μm,其分离性能由截留分子量定义的过滤膜。
孔径小的超滤膜中,有时用压汞法难以测定平均孔径。此时,超滤膜的平均孔径能够根据截留分子量来进行推算。具体而言,如http://chemeng.in.coocan.jp/memb/m_mb4.html中所记载,使具有已知的分子量的多种标准物质透过成为对象的超滤膜,将阻止率成为90%时的标准物质的分子量设为该超滤膜的截留分子量。能够根据标准物质的分子量来推算分子直径,因此超滤膜的平均孔径能够根据截留分子量来进行推算。具体而言,如表1所记载,根据截留分子量来推算平均孔径。在截留分子量与标准物质的分子量不一致的情况下,绘制截留分子量与平均孔径,通过线性插值等来进行内插,由此能够推算平均孔径。作为一例,在图7中示出绘制表1的截留分子量与平均孔径而进行内插时的例。能够将如此得到的推算值用作超滤膜的平均孔径。
[表1]
作为第1过滤膜24,能够使用通过将纤维状部件编织成网状而构成的网格过滤器。作为第1过滤膜,使用网格过滤器,从而与使用中空纤维膜的情况相比,能够促进包含细胞的残骸及细胞的破碎物的细胞培养中不必要的成分向透过侧的排出。由此,能够从培养容器10内有效地去除细胞培养中不必要的成分,能够提高培养容器10内的细胞的增殖性。
并且,作为第1过滤膜24,能够使用微滤膜及超滤膜等中空纤维膜。作为第1过滤膜24使用中空纤维膜,从而与使用网格过滤器的情况相比,能够降低细胞向透过侧透过的风险。并且,能够降低如下风险,即,产生由细胞进入第1过滤膜24而引起的堵塞。根据这些,能够降低细胞的损失。
图2是表示能够用作第1过滤膜24的网格过滤器的结构的一例的剖视图。另外,能够用作第1过滤膜24的过滤器并不限定于图2所示的过滤器。图2中,例示有使用第1过滤膜24来分离细胞C和碎片D的情况。另外,碎片D为细胞的残骸、细胞的破碎物、DNA(脱氧核糖核酸)、HCP(宿主细胞衍生蛋白)、抗体、废物等细胞培养中不必要的成分。
第1过滤膜24具有形成在供给侧的第1面FI1的入侧的开口OP1及形成在透过侧的第2面FI2且与开口OP1连通的出侧的开口OP2。开口OP1及开口OP2配置于在与第1过滤膜24的膜面平行的方向上相互错开的位置。换言之,连接开口OP1与开口OP2的路径为非直线状,是屈曲或弯曲的。本实施方式中,开口OP1和开口OP2不具有彼此重叠的部分。即,第1过滤膜24不具有直线贯穿第1面FI1与第2面FI2之间的透视孔。另外,开口OP1和开口OP2可以部分重叠。第1过滤膜24例如通过编织由金属或塑料等构成的纤维状部件而形成。
通过使用具有上述结构的第1过滤膜24,沿第1过滤膜24的膜面在第1过滤部20的供给侧流动的细胞C能够从供给侧的开口OP1侵入第1过滤膜24的内部。然而,第1过滤膜24的透过侧的开口OP2配置于从供给侧的开口OP1错开的位置,或者连接开口OP1与开口OP2的路径为非直线状,因此侵入第1过滤膜24的内部的细胞C与碎片D相比无法轻易向透过侧流出。
另一方面,碎片D比细胞C的尺寸充分小,因此能够轻松地向第1过滤膜24的透过侧流出。并且,碎片D还能够穿过侵入到第1过滤膜24的开口OP1的细胞C的侧面而向透过侧流出。
例如,在使用通过平纹编织纤维状部件而形成的简单的网格状过滤膜而进行膜分离处理的情况下,细胞通过变形轻松地穿过过滤膜的网眼而向透过侧流出。为了防止细胞向透过侧的流出,若缩小过滤膜的网眼的尺寸,则产生堵塞,并且,通过过滤膜的网眼而细胞被分割,从而向透过侧流出。如此,在膜分离处理中,使用了平纹编织网格等简单结构的过滤膜时,即使适当选择过滤膜的网眼的尺寸,也可能难以适当地进行细胞与碎片的分离。
相对于此,根据图2所示的结构的过滤膜,透过侧的开口OP2配置于从供给侧的开口OP1错开的位置,或者连接开口OP1与开口OP2的路径为非直线状,因此抑制侵入到第1过滤膜24内部的细胞C向透过侧的流出,能够适当地分离细胞C与碎片D。并且,细胞C难以侵入至第1过滤膜24的厚度方向上的深部,因此能够抑制过滤膜的闭塞(堵塞),并且,在膜分离处理中能够缩小细胞所受的损伤。
作为第1过滤膜24,能够适当地使用例如图3A所示的斜纹荷兰编织纤维状部件而形成的斜纹荷兰编织网格200。斜纹荷兰编织网格200具有以如下方式编织而成的结构,即,相邻的纬线201彼此紧密接触,并且纬线201例如越过n根具有一定间隔而通过的经线202的同时与经线202缠结。另外,n为2以上的自然数(n≥2)。斜纹荷兰编织网格200没有网眼的透视孔,通过形成在纬线201与经线202的交叉部的间隙而形成开口。用于斜纹荷兰编织网格200的纤维状部件例如由不锈钢等金属或聚酯等树脂构成,优选不锈钢等金属。
图3B是放大表示斜纹荷兰编织网格200的开口OP的立体图。斜纹荷兰编织网格200的开口OP由通过2根纬线201与1根经线202的编织产生的间隙形成。另外,关于斜纹荷兰编织网格200的开口OP的平均孔径,作为进行基于标准粒子的过滤试验且成为阻止率95%的粒径(即,通过粒子透过试验得到的95%分离粒径)而计算。
并且当过滤膜为微滤膜或超滤膜时,能够通过压汞法来测定平均孔径。例如,能够使用SHIMADZU CORPORATION制的Autopore IV9520,通过在高压下将汞压入过滤器而进行测定。在难以进行基于压汞法的平均孔径的测定时,超滤膜的平均孔径如前所述,能够根据截留分子量来求出。
图3C是表示斜纹荷兰编织网格200的截面结构的图。图3C中,用箭头表示透过斜纹荷兰编织网格200的流体的流动。斜纹荷兰编织网格200不具有在厚度方向上直线贯穿的透视孔,因此透过斜纹荷兰编织网格200的流体一边改变流动方向一边朝向透过侧流动。因此,流体中所包含的直径较大的粒子容易残留在供给侧,而并不向透过侧流出。即,通过将斜纹荷兰编织网格200用作第1过滤膜24,与图2所示的典型结构的情况相同,在细胞悬浮液的膜分离处理中,能够抑制细胞向透过侧的流出。
如图1所示,第1过滤部20的透过侧经由流路53而连接于第2过滤部30的供给侧32。在流路53的中途设有阀V1、V2及泵P2。关于阀V1、V2,将透过第1过滤膜24的透过液从第1过滤部20送到第2过滤部30时,控制成打开状态,除此以外的情况下,控制成关闭状态。
第2过滤部30具备:容器31;及第2过滤膜34,将容器31内的空间分隔为供给侧32及透过侧33,对透过第1过滤膜24的透过液实施膜分离处理。并且,第2过滤部30在供给侧32具有细胞悬浮液流入的流入口30a。透过第1过滤膜24的透过液从流入口30a流入容器31的内部。本实施方式中,第2过滤部30进行基于过滤供给侧32的液体的大致所有量的死端方式的膜分离处理。
透过第1过滤膜24的透过液中所包含的尺寸较大的成分残留在第2过滤膜34的膜面或第2过滤部30的供给侧32,而并不透过第2过滤膜34。另一方面,透过第1过滤膜24的透过液中所包含的尺寸较小的成分透过第2过滤膜34而透过至透过侧33。第2过滤部30的透过侧33中设有排出口30c,在排出口30c中连接有流路54。透过第2过滤膜34的成分从排出口30c向容器31的外部排出,并经由流路54被回送到培养容器10。另外,流路54为公开技术中的第2循环流路的一例,一端连接于第2过滤部30的透过侧33,另一端连接于培养容器10。
本实施方式所涉及的细胞培养装置100中,以分离透过第1过滤膜24的透过液中所包含的包含抗体的培养中不必要的成分与培养基的目的使用第2过滤膜34。即,第2过滤膜34具有适合阻止包含抗体的细胞培养中不必要的成分的透过的分离性能。
第2过滤膜34的平均孔径优选为1μm以下,更优选为0.1μm以下,进一步优选为0.05μm以下,最优选为0.01μm以下。通过将第2过滤膜34的平均孔径设为1μm以下,能够降低包含抗体的细胞培养中不必要的成分经由流路54回送到培养容器10的风险。另外,关于第2过滤膜34的平均孔径,在使用网格的情况下,能够用95%分离粒径进行测定,在使用微滤膜或超滤膜的情况下,能够用压汞法进行测定。
并且,将第1过滤膜24的平均孔径设为A,将第2过滤膜34的平均孔径设为B时,两者的平均孔径比(B/A)优选满足下述式(1)。
0<B/A≤0.5 (1)
另外,第1过滤膜24与第2过滤膜34的平均孔径比(B/A)更优选0.0001以上且0.3以下,进一步优选0.001以上且0.2以下,最优选0.001以上且0.1以下。通过将第1过滤膜24与第2过滤膜34的孔径比(B/A)设为0.5以下,能够降低细胞培养中不必要的成分回送到培养容器10的风险。
作为第2过滤膜34,能够使用中空纤维微滤膜。作为第2过滤膜34使用中空纤维微滤膜,从而与使用中空纤维超滤膜的情况相比,能够降低产生堵塞的风险。
并且,作为第2过滤膜34,在本公开的一方式中,使用中空纤维超滤膜。作为第2过滤膜34使用中空纤维超滤膜,从而与使用中空纤维微滤膜的情况相比,能够有效地捕集包含抗体的细胞培养中不必要的成分。
并且,作为第2过滤膜34使用中空纤维超滤膜时,中空纤维超滤膜的截留分子量优选100kDa以下,更优选1kDa以上且90kDa以下,进一步优选10kDa以上且80kDa以下,尤其优选30kDa以上且70kDa以下,最优选60kDa以上且70kDa以下。通过将用作第2过滤膜34的中空纤维超滤膜的截留分子量设为100kDa以下,能够更加有效地捕集包含抗体的细胞培养中不必要的成分。并且,从细胞出现细胞因子等生长因子,但生长因子尽可能回送到培养槽内时对细胞增殖性带来良好影响。生长因子的分子量为1000~30000左右,因此优选将第2过滤膜34的截留分子量的下限如上述范围所示设定为生长因子的分子量以上的截留分子量。
另外,关于中空纤维超滤膜的截留分子量,根据使具有已知分子量的标准物质透过,且相当于阻止率90%的分子量来进行计算。
流路54的中途上,在第2过滤部30的透过侧33的附近设有阀V3。关于阀V3,将透过第2过滤膜34的成分送到培养容器10时,控制成打开状态,除此以外的情况下,控制成关闭状态。
本实施方式所涉及的细胞培养装置100具有回收机构,所述回收机构回收被第2过滤膜34阻止的包含抗体的细胞培养中不必要的成分。上述回收机构包括反洗流路55、泵P3、回收流路56、57及回收罐40而构成。另外,泵P3为公开技术中的送液部的一例。
反洗流路55形成绕过阀V3的入侧及出侧的旁通流路。泵P3设置在反洗流路55的中途,通过产生与通常的膜分离处理时产生的液流反方向的、从第2过滤部30的透过侧33朝向供给侧32的液流,来进行第2过滤膜34的反洗处理。在进行反洗处理的期间,阀V3控制成关闭状态,用于反洗的液体在反洗流路55上流动,供给到第2过滤膜34。通过对第2过滤膜34进行反洗处理,残留在第2过滤膜34的膜面及第2过滤部30的供给侧32的包含抗体的培养中不必要的成分从第2过滤部30的流入口30a排出。
回收流路56在第2过滤部30的流入口30a的附近连接于连接第1过滤部20的透过侧23与第2过滤部30的供给侧32的流路53。在进行反洗处理的期间,阀V1、V2及V3控制成关闭状态,阀V4控制成打开状态。由此,通过反洗处理从第2过滤部30的流入口30a排出的包含抗体的培养中不必要的成分经由回收流路56收纳于回收罐40。收纳在回收罐40的包含抗体的培养中不必要的成分经由回收流路57被送到作为下一工序的抗体的提纯工序。
细胞培养装置100具有:培养基供给流路58,用于将新鲜的培养基供给到培养容器10;及泵P4,设置在培养基供给流路58的中途。并且,细胞培养装置100中,为了防止培养容器10内的细胞浓度变得过高,在培养期间内适当的时间进行抽取培养容器10内的细胞的一部分(例如10%左右)的细胞流失处理。细胞流失处理中,培养容器10内的细胞经由流路59向培养容器10的外部排出。并且,细胞培养装置100具有控制泵P1~P4、阀V1~V4的未图示的控制部。
以下,对细胞培养装置100的动作进行说明。
细胞培养装置100中,在第1过滤部20及第2过滤部30中进行膜分离处理时,泵P1及P2被设为驱动状态,泵P3被设为停止状态。并且,阀V1、V2及V3控制成打开状态,阀V4控制成关闭状态。
通过驱动泵P1,收纳在培养容器10内的细胞悬浮液被送到第1过滤部20的供给侧22。从培养容器10抽出的细胞悬浮液通过第1过滤膜24被实施基于切向流方式的膜分离处理。被第1过滤膜24阻止的细胞经由流路52而回送到培养容器10内。另一方面,包含抗体的培养中不必要的成分透过第1过滤膜24。
透过第1过滤膜24的透过液经由流路53被送到第2过滤部30的供给侧32。透过第1过滤膜24的透过液通过第2过滤膜34被实施基于死端方式的膜分离处理。被第2过滤膜34阻止的包含抗体的细胞培养中不必要的成分残留在第2过滤膜34的膜面或第2过滤部30的供给侧32。另一方面,透过第2过滤膜34的去除了抗体等细胞培养中不必要的成分的纯净的培养基经由流路54而回送到培养容器10。
另一方面,细胞培养装置100中,当进行反洗处理时,泵P3被设为驱动状态,泵P1及P2被设为停止状态。并且,阀V4控制成打开状态,阀V1、V2及V3控制成关闭状态。
通过驱动泵P3,从而产生与通常的膜分离处理时产生的液流反方向的从第2过滤部30的透过侧朝向供给侧的液流,由此,进行第2过滤膜34的反洗处理。通过对第2过滤膜34进行反洗处理,残留在第2过滤膜34的膜面及第2过滤部30的供给侧32的包含抗体的细胞培养中不必要的成分从第2过滤部30的流入口30a排出。通过反洗处理而从第2过滤部30排出的包含抗体的细胞培养中不必要的成分经由回收流路56收纳于回收罐40。收纳在回收罐40的包含抗体的培养中不必要的成分经由回收流路57被送到作为下一工序的抗体的提纯工序。在培养期间,泵P3间歇地设为驱动状态,并间歇地实施反洗处理。因此,间歇地进行包含抗体的细胞培养中不必要的成分向回收流路56的送液。本实施方式所涉及的细胞培养装置100中,在培养期间,交替地反复实施膜分离处理及反洗处理。
在进行膜分离处理及反洗处理的期间,连续或在规定时间驱动泵P2,与经由回收流路56被送到回收罐40的培养基的分量大致相同的分量的新鲜的培养基经由培养基供给流路58被供给到培养容器10。由此,培养容器10内的培养基的分量在培养期间保持为大致恒定。
本实施方式所涉及的细胞培养装置100如上所述进行动作,从而实现基于包含以下工序的细胞培养方法的细胞培养。第1膜分离工序,使用第1过滤膜24对从收纳包含细胞的细胞悬浮液的培养容器10抽出的细胞悬浮液实施膜分离处理,并将被第1过滤膜24阻止的成分回送到培养容器10。第2膜分离工序,使用第2过滤膜34对透过第1过滤膜24的成分实施膜分离处理,并将透过第2过滤膜34的成分回送到培养容器10。回收工序,经由回收流路56而回收被第2过滤膜34阻止的成分。
在此,将细胞培养装置100中的灌流比设为X,将循环比设为Y时,优选灌流比X与循环比Y之比Y/X在由下述式(2)表示的范围。
1.5≤Y/X (2)
灌流比X为经由回收流路56而回收的成分(培养基)的每日分量p与收纳在培养容器10的细胞悬浮液的分量q之比p/q(X=p/q)。另外,经由回收流路56而回收的成分的每日分量p与经由培养基供给流路58而供给的培养基的每日分量一致。
循环比Y为透过第1过滤膜24的成分(培养基)的每日分量r与收纳在培养容器10的细胞悬浮液的分量q之比r/q(Y=r/q)。即,灌流比X与循环比Y之比Y/X相当于透过第1过滤膜24的成分的每日分量r与经由回收流路56而回收的成分的每日分量p之比r/p(Y/X=r/p)。
灌流比X与循环比Y之比Y/X如式(2)所示,优选为1.5以上,更优选为2以上且20以下,进一步优选为2.5以上且15以下,最优选为3以上且10以下。透过将灌流比X与循环比Y之比Y/X设为1.5以上,能够充分地去除包含抗体的细胞培养中不必要的成分。
并且,灌流比X优选为0.1以上且2以下,更优选为0.2以上且1.5以下,进一步优选为0.3以上且1以下。通过将灌流比设为0.1以上,能够抑制第2过滤膜34中产生堵塞的风险。并且,通过将灌流比设为2以下,能够抑制培养基的使用量,且能够实现低成本下的培养。
并且,循环比Y优选为0.2以上且10以下,更优选为0.5以上且8以下,进一步优选为1以上且6以下。通过将循环比设为0.2以上,能够充分地去除包含抗体的培养中不必要的成分。并且,通过将循环比设为10以下,能够抑制第1过滤膜24及第2过滤膜34中产生堵塞的风险。
并且,优选将收纳在培养容器10的细胞悬浮液中所包含的细胞的浓度设为2×107cells/ml以上,更优选设为5×107cells/ml以上且20×107cells/ml以下,进一步优选设为8×107cells/ml以上且15×107cells/ml以下。通过将收纳在培养容器10的细胞悬浮液中所包含的细胞的浓度设为2×107cells/ml以上,能够回收充分量的抗体。
并且,优选将收纳在培养容器10内的细胞悬浮液中所包含的粒径为2μm以上且4μm以下的微粒的浓度设为40×107个/ml以下,更优选设为20×107个/ml以下,进一步优选设为10×107个/ml以下,最优选设为0.1×107个/ml以上且5×107个/ml以下。通过将收纳在培养容器10内的细胞悬浮液中所包含的粒径为2μm以上且4μm以下的微粒的浓度设为40×107个/ml以下,能够提高细胞的增殖性。
并且,通过第1过滤膜24进行的膜分离处理中,优选将细胞的透过率设为20%以下,更优选设为10%以下,进一步优选设为5%以下,最优选设为2%以下。通过第1过滤膜24进行的膜分离处理中,通过将细胞的透过率设为20%以下,能够抑制培养容器10内的细胞数量的减少。
并且,通过第1过滤膜24进行的膜分离处理中,优选将粒径为2μm以上且4μm以下的微粒的透过率设为30%以上,更优选设为50%以上,进一步优选设为70%以上。通过第1过滤膜24进行的膜分离处理中,通过将粒径为2μm以上且4μm以下的微粒的透过率设为30%以上,能够促进培养容器10内的细胞培养中不必要的成分的去除。
并且,优选将透过第2过滤膜34的成分中所包含的粒径为2μm以上且4μm以下的微粒的浓度设为1×107个/ml以下,更优选设为0.1×107个/ml以下,进一步优选设为0.01×107个/ml以下。通过将透过第2过滤膜34的成分中所包含的粒径为2μm以上且4μm以下的微粒的浓度设为1×107个/ml以下,能够抑制回送到培养容器10的细胞培养中不必要的成分的分量。
并且,优选将收纳在培养容器10的细胞悬浮液中包含的抗体的浓度设为4g/l以下,更优选设为3g/l以下,进一步优选设为2g/l以下,尤其优选设为1g/l以下。通过将收纳在培养容器10的细胞悬浮液中所包含的抗体的浓度设为4g/l以下,能够抑制细胞的凝聚,且能够提高细胞的增殖性。
并且,通过第1过滤膜24进行的膜分离处理中,优选将抗体的透过率设为30%以上,更优选设为50%以上,进一步优选设为70%以上。通过第1过滤膜24进行的膜分离处理中,通过将抗体的透过率设为30%以上,能够抑制收纳在培养容器10内的细胞悬浮液中的抗体浓度,且能够提高细胞的增殖性。
并且,优选将透过第2过滤膜34的成分中所包含的抗体的浓度设为1g/l以下,更优选设为0.5g/l以下,进一步优选设为0.1g/l以下。通过将透过第2过滤膜34的成分中所包含的抗体的浓度设为1g/l以下,能够抑制回送到培养容器10的抗体的量。
并且,优选将被第2过滤膜阻止的成分中所包含的抗体的浓度设为0.5g/l以上,更优选设为1g/l,进一步优选设为2g/l。通过将被第2过滤膜阻止的成分中所包含的抗体的浓度设为0.5g/l以上,能够回收充分量的抗体。
如上所述,根据本实施方式所涉及的细胞培养装置100,对从培养容器10抽出的细胞悬浮液实施使用了第1过滤膜24的膜分离处理,被第1过滤膜24阻止的成分被回送到培养容器10。由此,能够从收纳在培养容器10的细胞悬浮液中去除细胞的残骸、细胞的破碎物、DNA、HCP、抗体、废物等细胞培养中不必要的成分。若在包含细胞的残骸或细胞的破碎物的培养基中培养细胞,则细胞厌氧而细胞增殖性下降。另一方面,若在包含DNA、HCP、抗体、废物的培养基中培养细胞,则细胞彼此粘接,产生细胞的凝聚体,从而细胞的增殖性下降。并且,若DNA、HCP、抗体、废物积蓄在培养容器10内,则培养容器10内被污染,长期培养变得困难。根据本实施方式所涉及的细胞培养装置100,通过使用了第1过滤膜24的膜分离处理,能够从收纳在培养容器10的细胞悬浮液中去除细胞的残骸、细胞的破碎物、DNA、HCP、抗体、废物等细胞培养中不必要的成分,因此能够提高在培养容器10内培养的细胞的增殖性。并且,通过提高细胞的增殖性,能够提高抗体的生产率。
并且,作为通过第1过滤膜24进行的膜分离处理的方式,采用切向流方式,从而与采用死端方式的情况相比,能够减轻对细胞的损伤。另外,作为通过第1过滤膜24进行的膜分离处理的方式,也能够采用死端方式。
并且,根据本实施方式所涉及的细胞培养装置100,对透过第1过滤膜24的透过液实施使用了第2过滤膜34的膜分离处理,透过第2过滤膜34的透过液被回送到培养容器10。由此,从透过第1过滤膜24的透过液中去除细胞的残骸、细胞的破碎物、DNA、HCP、抗体、废物等细胞培养中不必要的成分,且去除了细胞培养中不必要的成分的纯净的培养基被回送到培养容器10。如此,通过将向第2过滤膜34的透过侧33排出的纯净的培养基回送到培养容器10,能够抑制培养基的使用量。另一方面,能够在第2过滤膜34中捕集从细胞分泌的抗体。
并且,根据本实施方式所涉及的细胞培养装置100,被第2过滤膜34阻止的成分经由回收流路56而被回收。由此,能够回收被第2过滤膜34阻止的抗体。
如上所述,根据本实施方式所涉及的细胞培养装置100,能够抑制培养基的使用量并且提高抗体的生产率。一方式中,以将第1过滤膜24的平均孔径设为20μm以下,且将第1过滤膜24的平均孔径设为A,将第2过滤膜34的平均孔径设为B时,满足0<B/A≤0.5的方式,选定各过滤膜的平均孔径,从而促进上述效果。另一方式中,将第1过滤膜24的平均孔径设为20μm以下,且将第2过滤膜34设为超滤膜,从而促进上述效果。
如上所述,本实施方式所涉及的细胞培养装置100具有回收被第2过滤膜34阻止的成分的回收流路56,因此能够回收被第2过滤膜34阻止的抗体。而且,通过考虑第1过滤膜24的平均孔径A、或者第2过滤膜34的平均孔径B相对于平均孔径A的比(B/A)或第2过滤膜34的种类,能够降低如下可能性:培养中所需的细胞向系统外排出,或者细胞的残骸、细胞的破碎物、DNA、HCP、抗体、废物等细胞培养中不必要的成分并未充分地向系统外排出,或者无法有效地回收抗体。例如,通过第1过滤膜24的平均孔径A为20μm以下,能够抑制细胞从第1过滤膜24透过,从而细胞从回收流路57向系统外排出。而且,通过以满足0<B/A≤0.5的方式选定各过滤膜的平均孔径,或者将第2过滤膜34设为超滤膜,能够降低如下可能性:用第2过滤膜34无法充分阻止透过第1过滤膜24的培养中不必要的成分。即,不仅设置回收被第2过滤膜34阻止的成分的回收流路56,还将第1过滤膜24的平均孔径设为20μm以下,将第1过滤膜24的平均孔径A与第2过滤膜34的平均孔径B之比B/A设为0<B/A≤0.5,或者将第1过滤膜24的平均孔径设为20μm以下,将第2过滤膜34设为超滤膜变得很重要。
通常,使用过滤膜连续过滤包含有大小各异的成分的液体如培养液,并且连续回收被过滤膜阻止的成分是非常困难的。如本实施方式所涉及的细胞培养装置100,通过反洗来回收被第2过滤膜34阻止的成分,也会设想到在第2过滤膜34中形成凝胶层,或者进一步引起堵塞,从而在几天内无法进行过滤。在后面叙述的第2及第3实施方式中,通过切向流方式进行通过第2过滤膜34进行的膜分离处理,但在该情况下,也可能引起相同的情况。如本实施方式所涉及的细胞培养装置100,通过将第1过滤膜24的平均孔径设为20μm以下,将第1过滤膜24的平均孔径A与第2过滤膜34的平均孔径B之比B/A设为0<B/A≤0.5,或者将第1过滤膜24的平均孔径设为20μm以下,将第2过滤膜34设为超滤膜,能够抑制凝胶层的形成或堵塞,并且能够进行长期间的过滤及培养。
并且,根据本实施方式所涉及的细胞培养装置100,能够提高收纳在回收罐40并送到提纯工序中的抗体的浓度,因此能够缩减抗体的提纯工序中的处理成本。并且,细胞流失处理中从培养容器10抽出的培养基、或者结束细胞培养之后残留在培养容器10的培养基中,能够降低抗体的浓度,因此能够减少伴随废弃这些培养基的抗体的废弃损失。
而且,根据本实施方式所涉及的细胞培养装置100,能够缩短培养容器10内的抗体的停滞时间,因此能够抑制由培养容器内的抗体的凝聚或分解引起的抗体质量的恶化。通过将循环比与灌流比之比即Y/X例如设为10,与不设置第2过滤膜的情况相比,能够将培养槽内的抗体的停滞时间缩减为大约1/10。
除了公开技术以外,作为减少培养槽内的抗体的停滞时间的策略,通过进行离心分离而不设置第一过滤膜,或者进行超离心分离装置而不设置第二过滤膜,或者进行吸附抗体的亲和层析,也能够定期性地进行抗体的洗提及回收,但是均难以连续处理,从而公开技术优异。
[第2实施方式]
图4是表示公开技术的第2实施方式所涉及的细胞培养装置100A的结构的图。关于细胞培养装置100A,第2过滤部30中的膜分离处理的方式为切向流方式的点及被第2过滤膜34阻止的成分的回收方式与上述的第1实施方式所涉及的细胞培养装置100不同。
本实施方式所涉及的细胞培养装置100中,一端连接于第1过滤膜24的透过侧23的流路53A的另一端连接于罐41。
关于流路53B,一端连接于罐41,另一端连接于第2过滤部30的流入口30a。在流路53B的中途,设有抽出收纳在罐41的液体而送到第2过滤部30的泵P5。
第2过滤部30在供给侧32具有流入口30a及流出口30b。从罐41抽出的液体在从流入口30a流入容器31的内部并从流出口30b向容器31的外部流出的期间,通过第2过滤膜34。第2过滤部30通过第2过滤膜34对成为膜分离处理的对象的液体进行基于切向流方式的膜分离处理。
关于回收流路56,一端连接于第2过滤部30的流出口30b,另一端连接于罐41。从罐41抽出的液体中,被第2过滤膜34阻止的成分经由回收流路57被送到作为下一工序的抗体的提纯工序。第2过滤部30在透过侧33具有排出口30c。在排出口30c中连接有流路54。
以下,对细胞培养装置100A的动作进行说明。
细胞培养装置100A中,当在第1过滤部20及第2过滤部30中进行膜分离处理时,泵P1、P2、P4、P5及P6被设为驱动状态。
通过驱动泵P1,收纳在培养容器10内的细胞悬浮液被送到第1过滤部20的供给侧22。从培养容器10抽出的细胞悬浮液通过沿第1过滤膜24的膜面流动而被实施膜分离处理。被第1过滤膜24阻止的细胞经由流路52被回送到培养容器10内。另一方面,包含抗体的细胞培养中不必要的成分透过第1过滤膜24。
透过第1过滤膜24的透过液经由流路53A被送到罐41。收纳在罐41的透过第1过滤膜24的透过液通过泵P5被抽出,并送到第2过滤部30的供给侧32。透过第1过滤部20的透过液通过沿第2过滤膜34的膜面流动而被实施膜分离处理。被第2过滤膜34阻止的包含抗体的细胞培养中不必要的成分经由回收流路56被送到罐41。通过连续进行第2过滤部30中的膜分离处理,罐41内的抗体的浓度可提高至所期望的浓度。包含经浓缩的抗体的培养基经由回收流路57被送到作为下一工序的抗体的提纯工序。相对于上述的第1实施方式所涉及的细胞培养装置100中,被第2过滤膜34阻止的成分间歇地被送到回收流路56,本实施方式所涉及的细胞培养装置100A中,被第2过滤膜34阻止的成分连续被送到回收流路56。另一方面,透过第2过滤膜34的去除了抗体等细胞培养中不必要的成分的纯净的培养基从排出口30c向第2过滤部30的外部排出,并经由流路54被回送到培养容器10。
通过驱动泵P4,培养基经由培养基供给流路58被供给到培养容器10,并在培养容器10内的培养基的分量在培养期间保持为大致恒定。
根据本实施方式所涉及的细胞培养装置100A,第2过滤部30中的膜分离处理的方式为切向流方式,因此回收被第2过滤部30阻止的成分时,不需要反洗处理。
本实施方式所涉及的细胞培养装置100A中,第2过滤部30中的膜分离处理的方式为切向流方式,因此与进行基于死端方式的膜分离处理的情况相比,能够缩小施加于抗体的压力,能够抑制抗体的质量劣化。并且,将第2过滤部30中的膜分离处理的方式设为切向流方式,从而与进行基于死端方式的膜分离处理的情况相比,能够降低在第2过滤膜34中产生堵塞的风险。
并且,根据本实施方式所涉及的细胞培养装置100A,通过连续实施第2过滤部30中的膜分离处理,能够将罐41内的抗体的浓度提高至所期望的浓度,能够将包含经浓缩的抗体的培养基经由回收流路57而送到提纯工序中。由此,能够减轻提纯工序中的处理负担。
[第3实施方式]
图5是表示公开技术的第3实施方式所涉及的细胞培养装置100B的结构的图。关于细胞培养装置100B,第2过滤部30中的膜分离处理的方式为切向流方式的点及被第2过滤膜34阻止的成分的回收方式与上述的第1实施方式所涉及的细胞培养装置100不同。
本实施方式所涉及的细胞培养装置100B中,一端连接于第1过滤膜24的透过侧23的流路53的另一端连接于第2过滤部30的流入口30a。
第2过滤部30在供给侧32具有流入口30a及流出口30b。透过第1过滤膜24的透过液在从流入口30a流入容器31的内部而从流出口30b向容器31的外部流出的期间,通过第2过滤膜34。第2过滤部30通过第2过滤膜34对成为膜分离处理的对象的液体进行基于切向流方式的膜分离处理。在第2过滤部30的流出口30b中连接有回收流路56。第2过滤部30在透过侧33具有排出口30c。在排出口30c中连接有流路54。
以下,对细胞培养装置100B的动作进行说明。
细胞培养装置100B中,当在第1过滤部20及第2过滤部30中进行膜分离处理时,泵P1、P2、P4及P6被设为驱动状态。
通过驱动泵P1,收纳在培养容器10内的细胞悬浮液被送到第1过滤部20的供给侧22。从培养容器10抽出的细胞悬浮液通过沿第1过滤膜24的膜面流动而被实施膜分离处理。被第1过滤膜24阻止的细胞经由流路52被回送到培养容器10内。另一方面,包含抗体的培养中不必要的成分透过第1过滤膜24。
透过第1过滤膜24的透过液通过泵P2被抽出,并送到第2过滤部30的供给侧32。透过第1过滤部20的透过液通过沿第2过滤膜34的膜面流动而被实施膜分离处理。被第2过滤膜34阻止的包含抗体的细胞培养中不必要的成分经由回收流路56被送到作为下一工序的抗体的提纯工序中。相对于上述的第1实施方式所涉及的细胞培养装置100中,被第2过滤膜34阻止的成分间歇地被送到回收流路56,本实施方式所涉及的细胞培养装置100B中,被第2过滤膜34阻止的成分连续被送到回收流路56。另一方面,透过第2过滤膜34的去除了抗体等细胞培养中不必要的成分的纯净的培养基从排出口30c向第2过滤部30的外部排出,并经由流路54被回送到培养容器10。
通过驱动泵P4,与经由回收流路56被送到提纯工序中的包含抗体的培养基的分量大致相同分量的新鲜的培养基经由培养基供给流路58被供给到培养容器10。由此,培养容器10内的培养基的分量在培养期间保持为大致恒定。
根据本实施方式所涉及的细胞培养装置100B,第2过滤部30中的膜分离处理的方式为切向流方式,因此回收被第2过滤部30阻止的成分时,不需要反洗处理。
并且,根据本实施方式所涉及的细胞培养装置100B,与进行基于死端方式的膜分离处理的情况相比,能够缩小施加于抗体的压力,能够抑制抗体的质量劣化。并且,与进行基于死端方式的膜分离处理的情况相比,能够降低在第2过滤膜34中产生堵塞的风险。
并且,根据本实施方式所涉及的细胞培养装置100B,仅通过1次第2过滤部30的处理液被送到下一工序中,因此与将多次通过第2过滤部30的处理液送到下一工序中的情况相比,能够减轻第2过滤部30中的处理负担。由此,能够抑制在第2过滤膜34中产生堵塞的风险。
[实施例及比较例]
在图6A及图6B中示出使用上述的公开技术的实施方式所涉及的细胞培养装置来进行细胞的培养,并对下述中说明的多个项目进行了评价的结果。各实施例及各比较例中的、培养细胞的种类、第1过滤膜24及第2过滤膜34的规格、膜分离方式、灌流比、循环比、培养容器10中的细胞浓度、培养容器10中的微粒浓度、培养容器10中的抗体浓度如图6A所示。关于实施例1~20及比较例1、2,由图1的实施方式表示,关于实施例21,通过由图5所示的实施方式进行了实施。关于比较例3、4,通过从图1的实施方式去除了第二过滤部的实施方式进行了实施。将评价项目设为细胞增殖性、培养基使用量、培养容器内凝聚物、培养容器内微粒浓度、培养容器内抗体浓度、第1级过滤堵塞、第2级过滤堵塞、抗体回收率、主峰比例(抗体质量)及综合了这些的综合判定。
另外,关于第1过滤膜24及第2过滤膜34的平均孔径,在使用网格的情况下,用95%分离粒径进行了测定,在使用微滤膜(MF膜)或超滤膜(UF膜)的情况下,用压汞法进行了测定。
为了控制培养容器10内的细胞浓度,实施了细胞流失处理。细胞流失比由每天抽出的细胞流失液量与收纳于培养容器10的细胞悬浮液的分量之比(每天抽出的细胞流失液量/收纳于培养容器10的细胞悬浮液的分量)进行定义。实施例1~21及比较例1~4中,细胞流失比以0.1实施了培养。
细胞直径及细胞的浓度使用BECKMAN COULTER公司的Vi-CELL来进行了测定。微粒的浓度使用BECKMAN COULTER公司的Multisizer4来进行了测定。
细胞直径的测定中,将从培养容器10进行了采样的细胞悬浮液中所包含的细胞设为测定对象。培养容器10中的细胞的浓度及抗体的浓度的测定中,将从培养容器进行了采样的细胞悬浮液设为测定对象。
关于第1过滤膜24中的细胞的透过率,将透过第1过滤膜24之前的培养基中的细胞的浓度d1与透过第1过滤膜24之后的培养基中的细胞的浓度d2之比d2/d1作为了百分比(%)。
关于第1过滤膜24中的微粒的透过率,将透过第1过滤膜24之前的培养基中的微粒的浓度d3与透过第1过滤膜24之后的培养基中的细胞的浓度d4之比d4/d3作为了百分比(%)。
关于第1过滤膜24中的抗体的透过率,将透过第1过滤膜24之前的培养基中的抗体的浓度d5与透过第1过滤膜24之后的培养基中的抗体的浓度d6之比d6/d5作为了百分比(%)。
透过第1过滤膜24之前的培养基从培养容器进行了采样。透过第1过滤膜24之后的培养基从连接在第1过滤部20的透过侧的流路53进行了采样。
透过第2过滤膜34的透过液中的微粒浓度的测定中,将从连接在第2过滤部30的透过侧的流路54进行了采样的培养基设为测定对象。
回收液中所包含的抗体的浓度的测定中,将从回收流路56进行了采样的回收液设为测定对象。
具有抗体的培养容器10内的抗体的停滞时间越短,抗体质量变得越良好的倾向。作为抗体质量,通过尺寸排阻层析,以如下顺序对抗体的分解及凝聚状态进行了评价。
(1)向通过分离处理所得到的透过液或上清液7ml加入Ab Capcher Extra(ProteNova Co.,Ltd)100μl并静放了30分钟。
(2)对所得到的液体进行离心分离,上清液报废,并回收了经沉淀的凝胶。
(3)向设置在2ml的微管的微生物旋转柱6(BIO-RAD公司)内放入所得到的凝胶,并向柱加入洗提缓冲液(0.1M Glycine-HCl(pH2.8))400μl,并进行了离心分离。
(4)在通过柱并积存在管内的液体内添加中和缓冲液(1.0M Tris-HCl、pH 9.0)30μl,并进行了中和。
(5)将所得到的中和液使用Amicon Ultra 30kDa(Merck Group),缓冲交换成磷酸缓冲生理盐水80%与超纯水20%的混合液,以抗体浓度成为5mg/L的方式进行了制备。
(6)对上述制备液使用TOSOH CORPORATION制的TSKgel G3000SW柱并通过尺寸排阻层析(SEC)而测定了抗体的尺寸分布,并计算了主峰的比例。表示主峰的比例越大,透过液或上清液中所包含的抗体的质量越高。
抗体回收率由下述式进行定义。
每天从透过液回收的抗体量÷(每天从透过液回收的抗体量+每天通过细胞流失而报废的抗体量)×100
关于细胞增殖性的判定标准如下。
A:培养容器中的细胞浓度为8×107[cells/ml]以上。
B:培养容器中的细胞浓度为5×107[cells/ml]以上且小于8×107[cells/ml]。
C:培养容器中的细胞浓度为2×107[cells/ml]以上且小于5×107[cells/ml]。
D:培养容器中的细胞浓度小于2×107[cells/ml]。
关于培养基使用量的判定标准如下。
A:灌流比为1以下。
B:灌流比大于1且为1.5以下。
C:灌流比大于1.5且为2以下。
D:灌流比超过2。
关于培养容器内凝聚物的判定标准如下。
A:可继续的培养期间为30日以上。
B:可继续的培养期间为25日以上且29日以下。
C:可继续的培养期间为20日以上且24日以下。
D:可继续的培养期间为19日以下。
关于培养容器内微粒浓度的判定标准如下。
A:培养容器内的微粒浓度为5×107[个/ml]以下。
B:培养容器内的微粒浓度大于5×107[个/ml]且为10×107[个/ml]以下。
C:培养容器内的微粒浓度大于10×107[个/ml]且为40×107[个/ml]以下。
D:培养容器内的微粒浓度超过40×107[个/ml]。
关于培养容器内抗体浓度的判定标准如下。
A:培养容器内的抗体浓度为1[g/l]以下。
B:培养容器内的抗体浓度大于1[g/l]且为2[g/l]以下。
C:培养容器内的抗体浓度大于2[g/l]且为4[g/l]以下。
D:培养容器内的抗体浓度超过4[g/l]。
关于第1级过滤堵塞的判定标准如下。
A:能够继续使用第1过滤膜的期间为30日以上。
B:能够继续使用第1过滤膜的期间为25日以上且29日以下。
C:能够继续使用第1过滤膜的期间为20日以上且24日以下。
D:能够继续使用第1过滤膜的期间为19日以下。
关于第2级过滤堵塞的判定标准如下。
A:能够继续使用第2过滤膜的期间为30日以上。
B:能够继续使用第2过滤膜的期间为25日以上且29日以下。
C:能够继续使用第2过滤膜的期间为20日以上且24日以下。
D:能够继续使用第2过滤膜的期间为19日以下。
关于抗体回收率的判定标准如下。
A:抗体回收率为90%以上。
B:抗体回收率为80%以上且小于90%。
C:抗体回收率为60%以上且小于80%。
D:抗体回收率小于60%。
有关通过尺寸排阻层析而得到的主峰的比例的评价判定标准如下。
A:主峰的比例为99%以上。
B:主峰的比例为97%以上。
C:主峰的比例为95%以上。
D:主峰的比例小于95%。
综合判定的判定标准如下。
A:没有一个D,A为7个以上,且关于第1级过滤堵塞的判定为A。
B:没有一个D,A为1个以上,且不满足综合判定A的标准。
C:没有一个D,A为0个。
D:D为1个以上。
如图6所示,关于比较例1~4,将第1过滤膜24的平均孔径设为A,将第2过滤膜34的平均孔径设为B时的平均孔径比(B/A)不满足上述式(1)的点与实施例1~实施例21不同。因上述差异而比较例1~4中的综合判定全部成为D,相对于此,实施例1~实施例21中的综合判定成为A、B及C中的任一个。即,实施例1~实施例21中,能够抑制培养基的使用量并且提高抗体的生产率。
与具体且单独记载各个文献、专利申请及技术标准通过参考被引用的情况相同程度地,本说明书中所记载的所有文献、专利申请及技术标准通过参考被引用于本说明书中。
符号说明
10 培养容器
11 搅拌叶片
20 第1过滤部
20a 流入口
20b 流出口
20c 排出口
21 容器
22 供给侧
23 透过侧
24 第1过滤膜
30 第2过滤部
30a 流入口
30b 流出口
30c 排出口
31 容器
32 供给侧
33 透过侧
34 第2过滤膜
40 回收罐
41 罐
51、52、53、53A、53B、54 流路
55 反洗流路
56、57 回收流路
58 培养基供给流路
59 流路
100、100A、100B 细胞培养装置
200 斜纹荷兰编织网格
201 纬线
202 经线
C 细胞
D 碎片
FI1 第1面
FI2 第2面
OP、OP1、OP2 开口
P1~P6 泵
V1~V4 阀
- 还没有人留言评论。精彩留言会获得点赞!