鉴别动物源性成分的多重荧光PCR方法及试剂盒与流程
本发明属于分子生物学鉴定领域,具体涉及一种利用多重pcr及高分辨熔解曲线分析鉴定生乳、乳制品等中的山羊、绵羊、牛、水牛等不同动物源性成分的方法及试剂盒。
背景技术:
随着生活水平的不断提高,对生乳及乳制品的需求逐渐由数量向质量转变,人们更加倾向于营养更丰富的乳制品,如营养价值更高的羊奶和水牛奶。然而,随着消费需求的不断增加,为避免企业使用相对廉价的原料冒充这些营养价值更高的乳制品进行销售,世界各国都建立了食品标签制度,要求食品必须要标明原料成分,以打击掺假造假情况。生乳及乳制品等产品中动物源性成分的检测是一种重要的识别掺假的手段,建立快速、准确的动物源性成分检测方法具有重要意义。
随着分子生物学的发展,目前对于生乳及乳制品等产品的掺假检测主要基于蛋白质的检测和核酸的检测两个方面。目前运用的多重pcr方法在检测核酸时,一部分是基于探针技术开发的,检测成本高(foodcontrol,2007,18:1149);一部分是基于电泳的方法产生的,检测数量受限,操作繁琐费时,而且电泳是在pcr扩增完成后开管操作,导致气溶胶的污染,产生假阳性(journalofagriculturalandfoodchemistry,2012,60:10480)。
以dna为基础的实时荧光pcr具有特异、灵敏、简便、快速和闭管操作等优点,在乳制品掺假检测方面得到了快速发展。其中,熔解曲线技术是采用染料实时监测pcr扩增,当染料与双链dna结合时,发出荧光;随着温度的升高,dna双链逐渐解开,染料从dna链上释放出来时,信号急剧下降,把50%dna分子发生变性的温度称为熔解温度(tm)。如果不同的扩增产物长度不同、gc比值不同,进行熔解曲线分析时就会有其独特的熔解曲线,并且熔解曲线位置和tm值都是不同的,目的是检测非特异性扩增。而高分辨熔解曲线(highresolutionmelting,hrm)分析是在普通熔解曲线的基础上发展起来的,其利用dna饱和荧光染料、高精度的检测仪器以及相关分析软件,能够监测到的熔解温度差异小于0.5℃,并且其对于pcr扩增产物的区分检测已精确至单个碱基差异水平,同时,高分辨熔解曲线技术采用的饱和染料,其发光效率不容易被抑制,能够以更高的浓度应用于pcr扩增体系中,由于在熔解过程中这些染料重新与核酸链的非熔解区域结合的游离染料相对更少,荧光信号保真度更高,因此能够提供更大的熔解敏感度和更高的熔解谱分辨率,生成更为清晰的熔解曲线(foodchemistry,2014,158:245)。hrm分析由于具有操作简单、成本低廉、高通量、灵敏度强、特异性高和实现真正闭管操作等优点,目前已逐渐应用于食品掺假以及产地溯源检测。
乳制品等经过加工制造获得的产品,其制造原料中的dna会受到加工过程的影响而降解成许多小片段,这对扩增引物的设计提出了很高的要求,引物扩增的目标序列太长,容易导致无法获得扩增产物,引物扩增的目标序列太短,则由于扩增产物的熔解温度接近引物二聚体的形成温度,影响hrm分析实验结果。目前尚未见到利用多重pcr结合hrm分析对乳制品等中的不同动物源性成分进行鉴别的报道。
技术实现要素:
本发明的目的在于提供一种鉴别动物源性成分的多重荧光pcr方法及试剂盒,通过一次pcr反应,快速、经济、可靠的完成对生乳、乳制品等中山羊、绵羊、牛、水牛等动物源性成分的检测。
为达到上述目的,本发明采用了以下技术方案:
一种鉴别动物源性成分的多重荧光pcr方法,包括以下步骤:
1)根据样品中的不同动物源性成分的可能掺入情况,确定需要鉴别的各动物源性成分所对应的动物种类,根据确定的动物种类,设计用于扩增对应动物种类的基因组中某段特异性序列的扩增引物;
2)对步骤1)设计的针对不同动物种类的扩增引物进行多重pcr扩增及扩增产物熔解的特异性检验;
3)以提取自所述样品中的dna为模板,利用经过检验确定的针对不同动物种类的特异性扩增引物进行多重pcr扩增,对扩增得到的产物进行高分辨熔解并获取高分辨熔解曲线,将该高分辨熔解曲线与以各动物种类基因组dna为模板并采用所述特异性扩增引物扩增得到的对应产物的高分辨熔解曲线进行比对,根据比对匹配的熔解峰位置确定所述样品中动物源性成分的构成情况。
优选的,所述步骤1)中,扩增引物扩增的目的片段在200bp以下,扩增的目的片段位于对应动物种类基因组的特异性保守区域,不同动物种类对应的扩增产物在长度和/或gc比值上存在区别。
优选的,所述步骤3)中,经过检验确定的特异性扩增引物选自针对山羊的引物对p1、针对绵羊的引物对p2、针对牛的引物对p3、针对水牛的引物对p4中的两对以上引物;其中,引物对p1的序列为:
上游引物:5'-gcgggcagggcggcgggggcggggcccaccaaaattcaacacaataccacat-3'
下游引物:5'-gcgggcgccgccctgcccgcagcgttatctttgtaataggttttgt-3'
引物对p2的序列为:
上游引物:5'-cgtagatgtagtatgacttttcct-3'
下游引物:5'-gtgaagttagttaggagagtaattata-3'
引物对p3的序列为:
上游引物:5'-gttaacagctaaacaccctagct-3'
下游引物:5'-aggtttgactcctctttttaccaa-3'
引物对p4的序列为:
上游引物:5'-ccaaaatttaacacaatcccgcaa-3'
下游引物:5'-cattggtcgtggttgaattcca-3'。
优选的,所述多重pcr扩增的反应体系包括dna模板、引物对p1、p2、p3和p4、pcr反应试剂(例如,2×qiagenmultiplexpcrmastermix)、双蒸水以及荧光染料,p1:p2:p3:p4的引物摩尔比为4:9:5:8。
优选的,所述多重pcr扩增的反应程序为:94℃预变性15min;94℃变性15s,55℃退火20s,72℃延伸30s,35个循环;72℃延伸5min。
优选的,所述高分辨熔解的程序为:将多重pcr扩增的产物在闭管条件下从65℃开始以0.05℃/s速率逐渐升温至95℃,同时连续检测荧光强度。
优选的,所述样品采集自乳制品或生乳。
一种鉴别动物源性成分的多重荧光pcr试剂盒,包括上述针对不同动物种类的特异性扩增引物(例如,p1、p2、p3、p4四对引物)、pcr反应试剂、荧光染料、双蒸水以及对照品(经多重pcr扩增后)对应的高分辨熔解曲线,所述对照品选自不同动物种类(例如,山羊、绵羊、牛和水牛)各自的基因组dna或对应各动物种类的基因组dna的组合(例如,1:1:1:1)。
优选的,所述试剂盒还包括不同动物种类(例如,山羊、绵羊、牛和水牛)的基因组dna。
本发明的有益效果体现在:
本发明利用多重pcr扩增,以提取自样品的dna为模板,在一次pcr反应中同时扩增不同动物源性成分的特异性dna片段,结合高分辨熔解曲线对扩增的片段进行鉴定,实现了对样品中不同动物源性成分的鉴别,本发明不需要针对每种动物源性成分单独进行检测、鉴别,提高了检测效率,降低了检测成本,适用于大规模样品的检测。
进一步的,本发明选取较短的目的片段进行扩增,消除了乳制品等在加工过程中dna发生降解对乳制品等中动物源性成分特异性dna序列扩增效率的不利影响,实现了扩增产物的熔解峰完全分离,相互之间没有重叠,减少了交叉干扰。
进一步的,本发明提供的扩增引物序列提高了检测的特异性和灵敏性,也在很大程度防止了假阴性的产生,实现了有效鉴定乳制品等中山羊、绵羊、牛和水牛等不同动物源性成分掺杂的情况。
进一步的,在多重pcr反应中,多对引物之间存在相互竞争和抑制作用,容易造成不同靶序列扩增效率不一致,因此,本发明对多重pcr反应的引物用量比例进行优化,从而减少多对引物之间的相互干扰,使其达到最佳分离结果。
附图说明
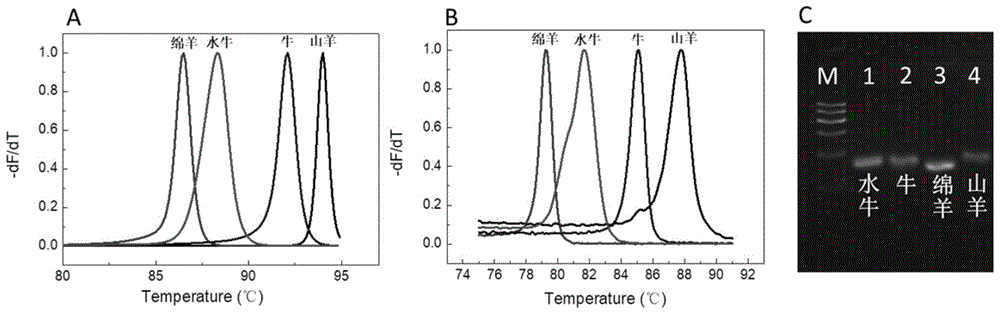
图1为山羊、绵羊、牛、水牛基因组dna的鉴别图,其中:a.理论拟合的熔解峰图;b.实验得到的熔解峰图;c.电泳验证图。
图2为不同熔解速率区分山羊、绵羊、牛、水牛基因组dna的效果图,其中:a.升温速率0.05℃/s;b.升温速率0.5℃/s。
图3为四重荧光pcr方法的灵敏度与特异性验证结果图,其中:a.灵敏度验证结果;b.特异性验证结果。
图4为八种市售乳制品样品动物源性成分检测结果图,其中:a.熔解峰图(1-8代表含有不同动物源性成分的乳制品样品多重pcr扩增产物的熔解峰图,9代表山羊、绵羊、牛、水牛四个物种的基因组dna同时存在时多重pcr扩增产物的熔解峰图);b.聚丙烯酰胺凝胶电泳验证结果图。
具体实施方式
下面结合附图和实施例对本发明做进一步说明。
(一)实验材料来源
鲜牛乳样品采自西安市未央区草滩奶牛场;鲜羊乳采自西安市未央区市场;鲜水牛乳和绵羊乳购自淘宝网,生乳于-20℃保存备用,样品中基因组dna提取采用磁珠分离法基因组dna提取试剂盒。非目标基因组dna(鸭、狗、兔、牦牛、鸡)均购于四川华汉三创生物科技有限公司。不同乳制品(液态乳、全脂奶粉、脱脂奶粉及配方奶粉产品等)分别购自西安市以及网上超市。获取时间均为2018年6月。
(二)乳制品中山羊、绵羊、牛和水牛动物源性成分四重荧光pcr检测方法的建立
多重pcr扩增的关键在于扩增引物的设计,染料法实时荧光pcr能用于多重检测是因为如果不同的扩增产物长度不同,其gc比值不同,进行熔解曲线分析时就会有其独特的熔解曲线,即熔解曲线性质、位置、tm值可能会有不同。因此引物设计时不仅针对山羊、绵羊、牛和水牛的核酸保守区域设计特异性扩增引物,并且确保无非特异性扩增和引物二聚体的生成,还考虑各种乳制品在加工过程中,其中所含的dna会遭到不同程度的破坏或者发生降解,扩增的目的基因片段(例如,参考ncbi中搜索到的线粒体dna)在200bp以下。但是,在满足以上条件之后,若扩增产物相互之间的tm值仍难以有效区分开(例如,山羊),则使扩增产物在长度和gc比值上要有一定的区别,为此,可以采取一些调控方法,改变扩增产物的gc比值(例如,在引物中增加额外的片段),保证进行熔解曲线分析时不同的扩增靶序列能产生具有不同tm值的熔解曲线。
根据以上实验发现,分别设计了针对山羊、绵羊、牛和水牛的四对物种特异性引物,采用u-melt软件对引物扩增的靶序列的熔解温度以及不同物种之间tm的差异进行拟合,拟合结果如图1a,结果显示物种特异性引物扩增的靶序列能够达到同时检测山羊、绵羊、牛和水牛线粒体dna的目的,可以节省时间与成本。引物设计达到预期目标后,以提取自山羊、绵羊、牛和水牛的生乳中的基因组(简称乳基因组)dna为混合模板,用四对物种特异性引物在实时荧光pcr仪上进行多重pcr扩增实验。
10μl扩增反应体系:将2×qiagenmultiplexpcrmastermix5μl,20×evagreen0.5μl,10μm引物对p1的上、下游引物(针对山羊的特异性引物)各0.2μl,10μm引物对p2的上、下游引物(针对绵羊的特异性引物)各0.45μl,10μm引物对p3的上、下游引物(针对牛的特异性引物)各0.25μl,10μm引物对p4的上、下游引物(针对水牛的特异性引物)各0.4μl,1.0μl(20ng/μl)的基因组dna提取液,加入反应管内,最后用ddh2o补足体系至10μl,闭管。其中,引物用量是从1:1:1:1开始进行优化,目的是为了让熔解曲线的峰高趋于等高,从而消除引物对之间的竞争优势,从而更清楚的区分四个物种。优化后,引物摩尔比为p1:p2:p3:p4=4:9:5:8。
四对物种特异性引物的序列为(引物设计完成时间为2018年8月):
引物对p1(山羊,参考序列gu295658):
上游引物:
5'-gcgggcagggcggcgggggcggggcccaccaaaattcaacacaataccacat-3'
下游引物:
5'-gcgggcgccgccctgcccgcagcgttatctttgtaataggttttgt-3'
引物对p2(绵羊,参考序列af010406):
上游引物:5'-cgtagatgtagtatgacttttcct-3'
下游引物:5'-gtgaagttagttaggagagtaattata-3'
引物对p3(牛,参考序列af492351):
上游引物:5'-gttaacagctaaacaccctagct-3'
下游引物:5'-aggtttgactcctctttttaccaa-3'
引物对p4(水牛,参考序列nc-006295):
上游引物:5'-ccaaaatttaacacaatcccgcaa-3'
下游引物:5'-cattggtcgtggttgaattcca-3'
扩增反应程序为:94℃预变性15min;94℃变性15s,55℃退火20s,72℃延伸30s,35个循环;72℃再延伸5min,在退火阶段采集荧光,用于获得扩增曲线。
熔解曲线制作:完成上述程序后,在闭管条件下,从65℃开始以0.05℃/s速率升温至95℃,在此升温过程中连续检测荧光强度,根据熔解曲线,山羊、绵羊、牛和水牛乳基因组扩增产物的熔解温度分别为86.7℃、77.7℃、83.7℃和80.2℃,熔解曲线分析结果如图1b所示。通过对比预测与实际熔解曲线(图1a和图1b),可以发现预测结果与实际结果的区分不同动物源性成分的效果相符合,尽管对于同一物种,实际的熔解温度低于预测的熔解温度(可能是由于盐离子浓度造成,熔解温度会随着盐离子浓度的增大而增大),但检测结果是可以判断样品中是否含有山羊、绵羊、牛和水牛的成分的。
另外,采用高分辨熔解曲线分析,相对于普通熔解曲线对温度的控制更加精确,可以采集更多的数据点。如图2a所示,在以0.05℃/s的速率对扩增产物进行高分辨熔解后,山羊、绵羊、牛和水牛四个物种的乳基因组对应扩增产物可以产生彼此分离的熔解峰,当采用普通的熔解速率(0.5℃/s)熔解时,如图2b所示,由于绵羊和水牛的乳基因组对应扩增产物的熔解温度差值较小,所以熔解峰重叠,难以区分。因此,使用高分辨熔解曲线分析可以区分熔解温度差异较小的不同物种的dna扩增产物。
(三)检测的特异性与灵敏度实验
以提取的山羊、绵羊、牛和水牛的乳基因组dna为混合模板,对混合模板用1×tris-edta10倍梯度稀释,每个稀释度各取1.0μl模板dna,按照(一)中建立的方法进行检测(同时加入4对引物,即进行四重荧光pcr),结果显示,四重荧光pcr的dna浓度与cq有良好的线性关系,浓度越高cq值越低,且最低可检测的模板浓度达到0.02ng/μl,结果参见图3a。
以鸭、狗、兔、牦牛、鸡的基因组dna分别作为待测样品模板,山羊、绵羊、牛、水牛的乳基因组dna分别作为模板阳性对照,双蒸水作为模板阴性对照(ntc)。按照(二)中建立的方法分别进行检测(同时加入4对引物),阳性对照模板均产生了明显的扩增曲线,待测样品和阴性对照的模板在30个循环内无明显的扩增曲线产生,表明所建立的检测方法具有较高的种属特异性,检测结果参见图3b,图1c验证了扩增靶序列的正确性,其中,山羊、绵羊、牛和水牛乳基因组dna扩增后所获目的条带大小分别为:168bp、157bp、161bp和175bp。
(四)市售乳制品样本检测实例
对市场上在售的乳制品进行检测时,首先提取待检测乳制品样品中的dna,以提取到的样品中的dna为模板,按照(二)中建立的方法进行四重荧光pcr,根据pcr扩增产物熔解峰的个数以及位置鉴别乳制品样品中的不同动物源性成分。图4a是八种市售乳制品经检测获得的熔解峰图,结果表明,山羊乳制品(图中编号3、5、7)中存在不同程度的掺入其他乳类的情况。经过聚丙烯酰胺凝胶验证(图4b),87.5%的检测结果与熔解曲线分析的结果相符合,由图4b还可以看出,由于四个物种扩增目的序列之间的碱基数相差很少,导致它们在凝胶电泳图中的条带非常相近,很难区分,而在熔解峰图中,可以很清楚地辨别各动物源性成分对应的熔解峰,进一步表明本发明的方法对于不同动物源性成分的鉴别具有较高的可靠性。
(五)同时检测山羊、绵羊、牛和水牛乳成分的四重荧光pcr试剂盒及使用方法
5.1试剂盒组成
该试剂盒内有:2×qiagenmultiplexpcrmastermix、四对物种特异性引物(p1、p2、p3、p4)、20×evagreen及双蒸水;还含有山羊、绵羊、牛和水牛的基因组dna。
5.2试剂盒使用方法
将2×qiagenmultiplexpcrmastermix5μl、20×evagreen0.5μl以及10μm/l引物对p1的上、下游引物各0.2μl,10μm/l引物对p2的上、下游引物各0.45μl,10μm/l引物对p3的上、下游引物各0.25μl和10μm/l引物对p4的上、下游引物各0.4μl以及双蒸水混合,得到四重荧光pcr扩增反应液。使用时根据实验样品需要加入模板dna即可,最终反应体系为10μl。根据建立的pcr实验条件,通过四重pcr扩增,结合对扩增产物的高分辨熔解曲线分析,可以对乳制品样品中是否含有山羊、绵羊、牛、水牛的乳成分进行判断。
总之,本发明具有操作简单、检测周期短、特异性强、检测结果可靠,节约成本和检测时间等优点,较常规的pcr可以避免开管造成的污染问题,实现同时对样品中的不同动物源性成分的检测。结合一定的样品dna分离技术,本发明可以广泛应用于生乳、乳制品及其他食品原料、产品中动物源性成分的鉴别。
<110>陕西科技大学
<120>鉴别动物源性成分的多重荧光pcr方法及试剂盒
<160>8
<210>1
<211>52
<212>dna
<213>人工合成
<400>1
gcgggcagggcggcgggggcggggcccaccaaaattcaacacaataccacat52
<210>2
<211>46
<212>dna
<213>人工合成
<400>2
gcgggcgccgccctgcccgcagcgttatctttgtaataggttttgt46
<210>3
<211>24
<212>dna
<213>人工合成
<400>3
cgtagatgtagtatgacttttcct24
<210>4
<211>27
<212>dna
<213>人工合成
<400>4
gtgaagttagttaggagagtaattata27
<210>5
<211>23
<212>dna
<213>人工合成
<400>5
gttaacagctaaacaccctagct23
<210>6
<211>24
<212>dna
<213>人工合成
<400>6
aggtttgactcctctttttaccaa24
<210>7
<211>24
<212>dna
<213>人工合成
<400>7
ccaaaatttaacacaatcccgcaa24
<210>8
<211>22
<212>dna
<213>人工合成
<400>8
cattggtcgtggttgaattcca22
- 还没有人留言评论。精彩留言会获得点赞!