具有BRD4蛋白抑制作用的菲啶酮类化合物及制备方法和应用与流程
本发明涉及药物化学领域,具体涉及菲啶酮类衍生物、它们的制备方法、含有这些化合物的药用组合物以及它们的药物用途,特别是作为BRD4蛋白抑制剂的用途。
背景技术:
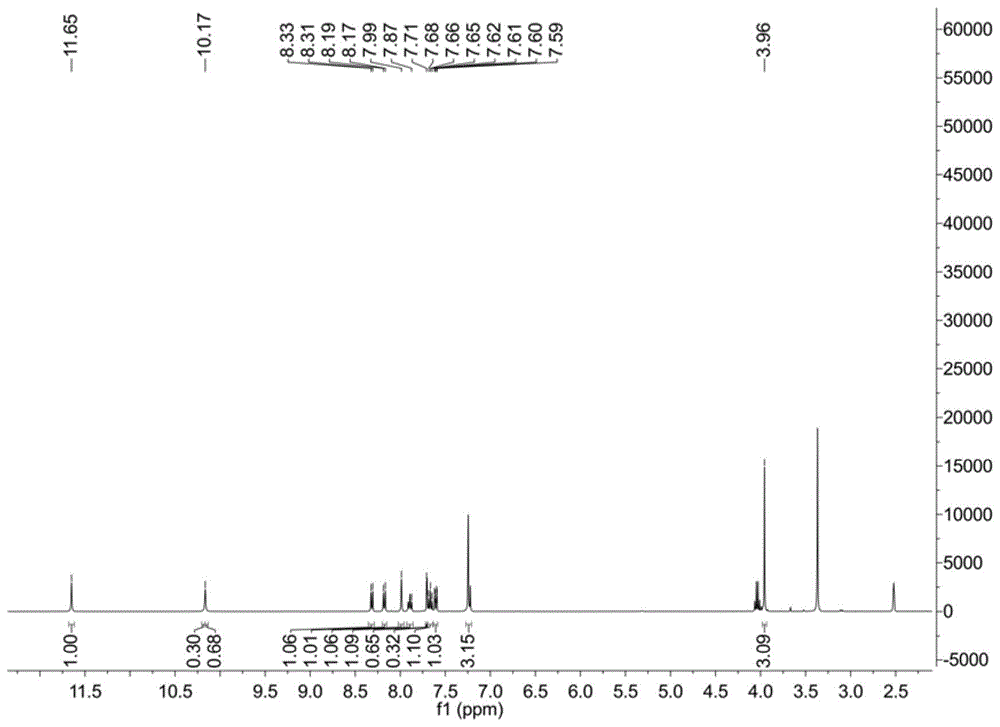
:近年来,肿瘤成为全球范围内导致人类死亡的主要原因之一。肿瘤普遍具有总体治愈率低且复发率高等特点,因此预防、治疗以及抑制肿瘤复发具有重要的科研价值,实现肿瘤的预防和治愈具有相当的紧迫性和挑战性。表观遗传调控的异常是导致肿瘤发生的重要因素之一。最新研究发现,BRD4蛋白介导的表观遗传异常与癌基因的过表达密切相关,并与癌细胞的生长增殖关系密切。BRD4是BromodomainandextraC-terminaldomain(BET)蛋白家族的一员,由于在抗肿瘤方面的潜在价值,引起了各大制药公司和科研机构的极大关注。BET蛋白也称为表观遗传识别蛋白,可以识别细胞组蛋白中的表观遗传学信息变化,并传递激发细胞分裂等的信号。以白血病为例,血细胞内BET蛋白的基因突变会干扰这种信号传输,导致病变细胞不受控制地分裂,从而损害人体的组织器官。BRD3/BRD4的Bromodomain编码区与NUT(睾丸中的核蛋白)基因染色质易位形成BRD-NUT融合型原癌基因是中线癌的发病机理所在,也是目前BRD4蛋白参与肿瘤发病过程的直接证据。同时研究也发现,在造血系统性癌症包括AML(白血病),Burkitt淋巴瘤,多发性骨髓瘤以及B细胞急性淋巴性白血病的模型中,通过干扰BRD4在MYC位点上的结合而直接将MYC沉默。由于已知各种MYC的异构体是细胞增殖和存活的重要调节因子,而且MYC是在许多癌症中过量表达的一个可能的癌基因,因此Bromodomain拮抗性也首次为针对MYC驱动的肿瘤生成提供了一个作用机会。这些研究结果说明BRD4与多种肿瘤存在密切联系,尤其在一些至今难以治愈或者尚无有效治疗手段的肿瘤中具有重要作用,其与肿瘤关系的研究为肿瘤治疗提供了新的策略。通过作用于BRD4蛋白Bromodomain结构域的小分子化合物,干扰Bromodomain结构域与乙酰化赖氨酸的特异性结合,影响肿瘤细胞内的转录调节和其它细胞过程,可以实现对肿瘤的靶向治疗。因此,BRD4蛋白是一个非常有前景的表观遗传新靶点,而作用于BRD4蛋白Bromodomain结构域的小分子抑制剂在肿瘤研究中也有着广阔的应用前景,而且有可能从中开发出新型抗肿瘤药物。已报道的BRD4蛋白的选择性抑制剂JQ1和IBET151,其晶体复合物表明此类小分子抑制剂正是结合在Bromodomain结构域的乙酰化赖氨酸识别口袋中,从而阻断了Bromodomain结构域介导的乙酰化调控,这些抑制剂在几种癌症中的治疗作用已经得到了证实。目前,BRD4蛋白的小分子抑制剂结构类型少且选择性还不够突出,限制了人们对含Bromodomain结构域蛋白的生物功能及其在抗肿瘤潜力方面开展深入的研究。此外,现有BRD4蛋白抑制剂作用效果尚待提高、机制有待进一步阐明,因此,寻找高效、高选择性的新型小分子BRD4蛋白抑制剂是表观遗传抗肿瘤研究的一个热点。技术实现要素:本发明的目的在于提供了一种具有BRD4蛋白抑制作用的菲啶酮类化合物及制备方法和应用,一种含有菲啶酮母核的菲啶酮类化合物,该菲啶酮类化合物具有良好的BRD4蛋白抑制活性和良好的抗肿瘤活性,可应用于制备BRD4蛋白抑制剂中,还可以进一步应用于制备抗癌药物中,具有极广阔的应用前景。一种具有BRD4蛋白抑制作用的菲啶酮类化合物,为式(I)所示结构的化合物及其药学上可接受的盐;式(I)中,R选自C1~C6烷基、C3~C6环烷基、噻吩基、2,3-二氢苯并呋喃基、未被取代或被取代基取代的苯基和萘基;所述取代基为卤素、氰基、羟基、氨基、巯基、C1~C6烷基、C1~C6烷氧基、C1~C6烷氨基或C1~C6卤代烷氧基。“C1~C6烷基”指具有1-6个碳原子的直链或支链饱和烃基;“C3~C6环烷基”指具有3-6个碳原子的环状饱和烃基;“卤素”或“卤”指卤原子,包括氟、氯、溴、碘和砹;C1~C6烷氧基中烷氧基为-O-烷基(即-O-C1~C6烷基,,C1~C6烷基定义同上);C1~C6烷氨基中“烷氨基”为-NH-烷基(即-NH-C1~C6烷基,C1~C6烷基定义同上);“卤代烷氧基”指氢原子被卤原子取代的烷氧基。本发明通过研究BRD4蛋白的晶体结构模型,设计并合成了一系列含有菲啶酮母核的全新结构的化合物,且通过药理试验结果表明得到的化合物具有良好的BRD4蛋白抑制活性和良好的抗肿瘤活性,具有极广阔的应用前景。优选的,R基为正丙基、正丁基、苯基、环戊基、环己基、2-噻吩基、2-甲氧基苯基、4-氯苯基、2-氯苯基、4-甲氧基苯基、4-叔丁基苯基、3-氰基苯基、2,4-二氯苯基、5-氯-2-甲氧基苯基、2-萘基或2,3-二氢苯并呋喃-5-基。R基的具体结构式见下表1所示:表1上述优选化合物编号1~15的具体化合物名称为:N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(1);N-(6-氧代-5,6-二氢菲啶-2-基)环己磺酰胺(2);N-(6-氧代-5,6-二氢菲啶-2-基)环戊磺酰胺(3);N-(6-氧代-5,6-二氢菲啶-2-基)丙磺酰胺(4);N-(6-氧代-5,6-二氢菲啶-2-基)丁磺酰胺(5);4-氯-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(6);4-甲氧基-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(7);4-叔丁基-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(8);3-氰基-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(9);2-氯-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(10);2-甲氧基-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(11);2-甲氧基-5-氯-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(12);N-(6-氧代-5,6-二氢菲啶-2-基)噻吩-2-磺酰胺(13);N-(6-氧代-5,6-二氢菲啶-2-基)萘-2-磺酰胺(14);N-(6-氧代-5,6-二氢菲啶-2-基)-2,3-二氢苯并呋喃-5-磺酰胺(15)。上述优选化合物的BRD4蛋白抑制能力更强,更适合用于制备BRD4蛋白抑制剂。所述化合物药学上可接受的盐包括:式(I)化合物与酸形成的酸式盐以及与无机碱形成的碱式盐。所述的酸为盐酸、氢溴酸、硫酸、磷酸、甲磺酸、苯磺酸、对甲苯磺酸、萘磺酸、柠檬酸、酒石酸、乳酸、丙酮酸、乙酸、马来酸、琥珀酸、富马酸、水杨酸、苯基乙酸或杏仁酸;所述的无机碱为含有碱性金属阳离子、碱土金属阳离子或铵阳离子盐。本发明还提供一种上述的式(I)结构的菲啶酮类化合物的制备方法,包括如下步骤:其中,R与式(I)所述的定义一致;步骤a为混酸硝化,步骤b为硝基还原,步骤c为磺酰胺化反应。一种具有BRD4蛋白抑制作用的菲啶酮类化合物的制备方法,包括以下步骤:1)以式A结构所示的化合物为原料,在HNO3/H2SO4的混酸条件下进行硝化反应,得到式B结构所示的硝基化合物;2)式B结构所示的硝基化合物,经过硝基还原反应后得到式C结构所示的中间体;3)式C结构所示的中间体与式D结构所示的磺酰氯化合物经过磺酰胺化反应后得到式(I)所示结构的菲啶酮类化合物。其中,式D中的R与式(I)中的R具有相同含义。具体方法为:以式(A)所示的化合物为原料,在HNO3/H2SO4的混酸条件下进行硝化,硝基还原后得到中间体(C),最后将中间体(C)进行磺酰胺化反应得到目标产物。步骤1)中,所述的硝化反应的条件为:在-5~5℃进行1~5h,进一步优选,在-2~3℃进行1.5~2.5h,最优选的,在0℃进行2h。步骤2)中,所述的硝基还原反应的条件为:加入铁粉和NH4Cl以及乙醇和水,在70℃~90℃反应1~3小时,进一步优选,在75℃~85℃反应1.5~2.5小时,最优选的,在80℃反应2小时。步骤3)中,所述的磺酰胺化反应的条件为:在二氯甲烷溶剂中,以吡啶作为催化剂,15℃~35℃反应1~5小时,进一步优选,20℃~30℃反应1~3小时,最优选的,25℃反应2小时。本发明化合物的制备根据取代基的不同和取代基位置的不同选用相应的原料即可。本发明还公开了一种药物组合物,其含有上述化合物和药学上可接受的辅料,具体包括:治疗有效量的式(I)化合物或药学上可接受的盐以及药学上可接受的载体或赋形剂。本发明对化合物的BRD4蛋白结合能力进行评价,发现本发明提供的化合物能在不同程度抑制BRD4蛋白,可用于制备BRD4蛋白抑制剂。本发明提供的化合物可用于制备预防或/和治疗与BRD4有关疾病的药物,所述化合物还可用于制备治疗Bromodomain依赖性疾病的药物。通过作用于BRD4蛋白Bromodomain结构域的小分子化合物,干扰Bromodomain结构域与乙酰化赖氨酸的特异性结合,影响肿瘤细胞内的转录调节和其它细胞过程,可以实现对肿瘤的靶向治疗。所述疾病包括:黑色素瘤、乳头状甲状腺肿瘤、胆管癌、结肠癌、卵巢癌、中线癌、非小细胞肺癌、恶性淋巴肿瘤、肝癌、肾癌、肺癌、胰腺癌、膀胱癌、前列腺癌、乳腺癌、胰腺癌、甲状腺癌、皮肤癌、结肠直肠癌、胰腺癌、卵巢癌、乳腺癌、睾丸癌、骨癌、脑癌、食管癌、胃肠道癌、软组织瘤、血癌、淋巴癌。BRD4蛋白体外活性测试表明,本发明所提供的化合物具有显著的BRD4蛋白结合能力,由于BRD4在肿瘤细胞生长增殖中具有关键性作用且有体外蛋白抑制活性实验支持,本发明所提供的化合物可以用于预防或治疗与BRD4抑制剂有关的疾病的药物中,尤其是肿瘤的药物中。同现有技术相比,本发明的有益效果体现在:本发明提供了一种含有菲啶酮母核的化合物,该化合物能在不同程度抑制BRD4蛋白,可用于制备BRD4蛋白抑制剂,用于预防和治疗与BRD4蛋白抑制剂有关的疾病,良好的抗肿瘤活性,所述疾病种类极多,因此其应用范围极广。此外,本发明制备方法的原材料来源广、操作简单、条件温和、成本低,十分适于工业化大规模生产。附图说明图1为本发明中化合物12的核磁图谱;图2为本发明中化合物12的碳谱;图3为本发明中化合物12的高分辨质谱。具体实施方式1HNMR、13CNMR用BRUKERACF-400型核磁共振仪、高分辨质谱(HRMS)用WatersSynaptG2型质谱仪测定。化合物熔点(mp)用BUCHIM-565型熔点仪测定。下面结合具体的实施例对本发明作进一步发明,但限制本发明的保护范围。实施例1(1)合成2-硝基-菲啶-6(5H)-酮(B):在250mL三颈瓶中加入HNO31.3g和H2SO410mL,置于冰盐浴条件下搅拌,维持温度0℃,通过恒压滴液漏斗滴加溶有菲啶-6(5H)-酮1.85g的H2SO42mL,然后维持温度0℃反应约2h,TLC检测反应完全,将反应液倒入300mL冰水混合物中,边加边搅拌,冰融化后有固体析出,抽滤,滤饼真空干燥,得黄色固体,为2-硝基-菲啶-6(5H)-酮(B),产率64.8%。(2)2-氨基-菲啶-6(5H)-酮(C):在100mL的茄形瓶中加入铁粉1.7g和NH4Cl0.8g,再加入乙醇(30mL)、水(10mL),将2-硝基-菲啶-6(5H)-酮(B)0.9g加入上述体系中,80℃反应2小时,抽滤,加圧蒸馏除去溶剂,柱层析分离得2-氨基-菲啶-6(5H)-酮(C)(1.04g,86.7%),白色固体。mp286.0-287.4℃.1HNMR(400MHz,DMSO-D6)δ11.33(s,1H),8.30(d,J=9.1Hz,1H),8.22(d,J=8.1Hz,1H),7.82(t,J=6.9Hz,1H),7.59(t,J=8.0Hz,1H),7.48(d,J=2.3Hz,1H),7.11(d,J=8.6Hz,1H),6.82(dd,J=8.6,2.3Hz,1H),5.01(s,2H).HRMSm/z:calcd.forC13H11N2O[M+H]+211.0871,found211.0874(3)N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(1)的合成:将2-氨基-菲啶-6(5H)-酮(C)(80mg,0.5mmol)和苯磺酰氯(0.5mmol,式D结构,R为苯基)溶于二氯甲烷中(5mL),再滴加吡啶3滴,室温25℃反应2小时后,将反应也加入到水中,乙酸乙酯萃取,柱层析分离得N-(2-氧代-2H-苯并吡喃-6-基)苯磺酰胺(1),其产率为89.3%。最后目标产物的表征数据如下:mp281.5-282.3℃.1HNMR(400MHz,DMSO-D6)δ:11.66(s,1H),10.29(s,1H),8.32(d,J=7.7Hz,1H),8.17(d,J=8.1Hz,1H),7.98(s,1H),7.89(d,J=4.1Hz,0H),7.88(s,1H),7.79(d,J=7.2Hz,2H),7.65(d,J=7.5Hz,1H),7.63–7.51(m,3H),7.29–7.20(m,2H);13CNMR(101MHz,DMSO-D6)δ160.8,139.7,134.2,133.9,133.4,132.5,129.7,128.8,128.1,127.2,126.3,124.1,122.5,118.2,117.4,116.0;HRMSm/z:calcd.forC19H15N2O3S[M+H]+351.0803,found351.0808。实施例2N-(6-氧代-5,6-二氢菲啶-2-基)环己磺酰胺(2)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为环己基,得到的产率79.2%。最后目标产物的表征数据如下:mp230.2-230.9℃.1HNMR(500MHz,DMSO-D6)δ11.75(s,1H),9.82(s,1H),8.35(d,J=7.7Hz,1H),8.27(d,J=8.1Hz,1H),8.16(s,1H),7.91(t,J=7.3Hz,1H),7.68(t,J=7.4Hz,1H),7.42(d,J=8.7Hz,1H),7.37(d,J=8.7Hz,1H),3.02(t,J=10.1Hz,1H),2.08(d,J=12.0Hz,2H),1.76(s,2H),1.64–1.53(m,2H),1.44(d,J=10.2Hz,2H),1.21(d,J=12.3Hz,2H).13CNMR(126MHz,DMSO-D6)δ161.0,134.1,133.8,133.6,133.3,128.7,128.1,126.4,123.3,122.7,118.36,117.5,114.7,59.4,58.8,27.8,26.5,25.8,25.5,25.2,24.8.HRMSm/z:calcdforC19H21N2O3S[M+H]+357.1273,found357.1264。实施例3N-(6-氧代-5,6-二氢菲啶-2-基)环戊磺酰胺(3)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为环戊基,得到的产率65.3%。最后目标产物的表征数据如下:mp226.3-226.9℃.1HNMR(400MHz,DMSO-D6)δ11.71(s,1H),9.76(s,1H),8.34(d,J=7.9Hz,1H),8.29(d,J=8.1Hz,1H),8.12(d,J=1.9Hz,1H),7.91(t,J=7.6Hz,1H),7.68(t,J=7.5Hz,1H),7.37(dd,J=12.9,5.4Hz,2H),1.96–1.85(m,4H),1.71–1.61(m,2H),1.58–1.48(m,2H),1.28–1.15(m,3H).13CNMR(101MHz,DMSO-D6)δ160.9,134.0,133.9,133.5,133.4,128.8,128.1,126.2,124.0,122.7,118.4,117.5,115.4,60.1,27.9,25.9.HRMSm/z:calcd.forC18H19N2O3S[M+H]+343.1116,found343.1112。实施例4N-(6-氧代-5,6-二氢菲啶-2-基)丙磺酰胺(4)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为正丙基,产率为80.4%。最后目标产物的表征数据如下:mp214.6-214.9℃.1HNMR(500MHz,DMSO-D6)δ11.74(s,1H),9.88(s,1H),8.35(d,J=7.4Hz,1H),8.29(d,J=8.0Hz,1H),8.18(s,1H),7.89(s,1H),7.68(t,J=7.4Hz,1H),7.42(d,J=10.4Hz,2H),3.14–3.05(m,2H),1.74(dd,J=15.0,7.5Hz,2H),0.96(t,J=7.4Hz,3H).13CNMR(126MHz,DMSO-D6)δ161.0,134.1,134.0,133.4,133.34,128.7,128.1,126.3,123.8,122.7,118.4,117.5,115.4,52.7,17.2,13.1.HRMSm/z:calcd.forC16H17N2O3S[M+H]+317.0960,found317.0956。实施例5N-(6-氧代-5,6-二氢菲啶-2-基)丁磺酰胺(5)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为正丁基,产率为93.1%。最后目标产物的表征数据如下:mp213.7-214.6℃.1HNMR(500MHz,DMSO-D6)δ11.74(s,1H),9.83(s,1H),8.35(d,J=32.3Hz,2H),8.17(s,1H),7.93(s,1H),7.71(s,1H),7.41(s,2H),3.13(d,J=1.1Hz,2H),1.73(d,J=1.2Hz,2H),1.39(d,J=5.7Hz,2H),0.86(s,3H).13CNMR(126MHz,DMSO-D6)δ161.0,134.1,134.1,133.5,133.3,128.8,128.7,128.2,126.38,123.8,123.8,122.7,118.4,117.6,115.4,115.3,50.7,25.6,21.2,14.0.HRMSm/z:calcd.forC17H19N2O3S[M+H]+331.1116,found331.1107。实施例64-氯-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(6)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为4-氯苯基,产率为86.2%。最后目标产物的表征数据如下:mp268.4-268.9℃.1HNMR(500MHz,DMSO-D6)δ:11.71(s,1H),10.39(s,1H),8.34(d,J=7.9Hz,1H),8.21(d,J=8.2Hz,1H),8.03(s,0H),8.01(d,J=2.1Hz,1H),7.93–7.84(m,1H),7.81–7.73(m,2H),7.71–7.65(m,1H),7.66–7.60(m,2H),7.28(d,J=8.7Hz,1H),7.21(dd,J=8.7,2.2Hz,1H).13CNMR(126MHz,DMSO-D6)δ:160.9,138.2–138.1,134.5,133.9,133.5,132.1,129.9,129.2,128.8,128.1,126.3,124.4,122.5,118.3,117.5,116.4.HRMSm/z:calcd.forC19H14ClN2O3S[M+H]+385.0414,found385.0398。实施例74-甲氧基-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(7)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为4-甲氧基苯基,产率为91.0%。最后目标产物的表征数据如下:mp285.8-286.7℃.1HNMR(500MHz,DMSO-D6)δ:11.64(s,1H),10.14(s,1H),8.30(d,J=8.7Hz,1H),8.15(d,J=8.1Hz,1H),7.97(d,J=1.8Hz,1H),7.85(t,J=7.6Hz,1H),7.70(d,J=8.9Hz,2H),7.63(t,J=7.5Hz,1H),7.21(dt,J=8.7,5.4Hz,2H),7.02(d,J=8.9Hz,2H),3.74(s,3H).13CNMR(126MHz,DMSO-D6)δ:162.9,160.9,134.0,133.5,132.8,131.4,129.5,128.7,128.1,126.3,123.9,122.5,118.1,117.4,115.6,114.8,56.0.HRMSm/z:calcd.forC20H17N2O4S[M+H]+381.0909,found381.0892。实施例84-叔丁基-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(8)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为4-叔丁基苯基,产率为81.8%。最后目标产物的表征数据如下:mp267.4-267.7℃.1HNMR(500MHz,DMSO-D6)δ11.67(s,1H),10.28(s,1H),8.33(s,1H),8.11(s,1H),7.96(s,1H),7.86(s,1H),7.70(d,J=42.4Hz,3H),7.56(s,2H),7.28(s,2H),1.22(s,9H).13CNMR(126MHz,DMSO-D6)δ161.0,156.4,137.2,134.1,134.0,133.5,132.7,128.8,128.2,128.2,127.2,126.6,126.3,124.0,124.0,122.4,122.4,118.2,117.3,117.4,115.7,115.6,35.6,31.9.HRMSm/z:calcd.forC23H23N2O3S[M+H]+407.1429,found407.1426。实施例93-氰基-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(9)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为3-氰基苯基,产率为79.2%。最后目标产物的表征数据如下:mp290.6-291.3℃.1HNMR(500MHz,DMSO-D6)δ11.78(d,J=34.8Hz,1H),10.54(d,J=34.4Hz,1H),8.45(s,1H),8.42–8.30(m,2H),8.27(t,J=8.6Hz,1H),8.20–8.11(m,2H),8.09(d,J=7.5Hz,1H),8.01(d,J=6.1Hz,1H),7.92(dd,J=19.4,11.5Hz,1H),7.86–7.76(m,1H),7.77–7.66(m,1H),7.44–7.22(m,2H).13CNMR(126MHz,DMSO-D6)δ161.0,161.0,141.1,141.0,137.1,137.0,134.7,134.7,133.6,133.5,131.8,131.7,131.3,131.3,130.8,130.8,128.9,128.8,128.2,128.1,126.4,126.3,124.7,124.6,122.7,122.6,118.4,118.4,117.9,117.9,117.6,117.6,117.0,116.9,113.0,113.0.HRMSm/z:calcd.forC20H14N3O3S[M+H]+376.0756,found376.0756。实施例102-氯-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(10)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为2-氯苯基,产率为79.8%。最后目标产物的表征数据如下:mp275.4-275.8℃.1HNMR(500MHz,DMSO-D6)δ11.72(s,1H),10.72(s,1H),8.32(d,J=7.9Hz,1H),8.16(d,J=8.1Hz,1H),8.10(dd,J=7.9,1.4Hz,1H),8.04(d,J=1.9Hz,1H),7.90(dd,J=11.2,4.1Hz,1H),7.70–7.64(m,2H),7.63–7.58(m,1H),7.51(dd,J=11.8,4.5Hz,1H),7.29(dd,J=9.4,7.3Hz,2H).13CNMR(126MHz,DMSO-D6)δ160.8,136.9,135.1,134.0,133.8,133.51,132.3,132.1,131.9,131.3,128.8,128.2,126.31,123.3,122.4,118.2,117.5,114.9.HRMSm/z:calcd.forC19H14ClN2O3S[M+H]+385.0414,found385.0406。实施例112-甲氧基-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(11)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为2-甲氧基苯基,产率为81.3%。最后目标产物的表征数据如下:mp298.4-299.3℃.1HNMR(400MHz,DMSO-D6)δ:11.61(s,1H),9.98(s,1H),8.34–8.27(m,1H),8.15(d,J=8.1Hz,1H),7.98(d,J=1.5Hz,1H),7.92–7.85(m,1H),7.77(dd,J=7.8,1.6Hz,1H),7.65(t,J=7.5Hz,1H),7.56–7.50(m,1H),7.22(dd,J=9.8,5.3Hz,2H),7.17(d,J=8.3Hz,1H),7.00(t,J=7.6Hz,1H),3.95(s,3H);13CNMR(101MHz,DMSO-D6)δ:160.9,156.8,135.6,133.9,133.5,132.8,130.8,128.7,128.2,126.6,126.3,123.5,122.3,120.6,118.0,117.2,115.0,113.2,56.6.HRMSm/z:calcd.forC20H17N2O4S[M+H]+381.0909,found381.0905。实施例122-甲氧基-5-氯-N-(6-氧代-5,6-二氢菲啶-2-基)苯磺酰胺(12)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为5-氯-2-甲氧基苯基,产率为72.6%。最后目标产物的表征数据如下:mp298.4-298.8℃.1HNMR(400MHz,DMSO-D6)δ:11.65(s,1H),10.17(s,0H),10.17(s,1H),8.32(d,J=7.9Hz,1H),8.18(d,J=8.2Hz,1H),7.99(s,1H),7.87(s,1H),7.71(s,1H),7.70(s,0H),7.66(t,J=7.5Hz,1H),7.61(dd,J=8.9,2.6Hz,1H),7.23(d,J=9.6Hz,3H),3.96(s,3H);13CNMR(101MHz,DMSO-D6)δ:160.9,155.8,135.1,134.2,133.9,133.6,132.2,129.8,128.8,128.2,126.3,124.2123.8,122.3,118.1,117.4,115.5,57.1.HRMSm/z:calcd.forC20H16N2O4S[M+H]+415.0519,found415.0522。本发明中化合物12的核磁图谱如图1所示;本发明中化合物12的碳谱如图2所示;本发明中化合物12的高分辨质谱如图3所示。实施例13N-(6-氧代-5,6-二氢菲啶-2-基)噻吩-2-磺酰胺(13)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为2-噻吩基,产率为75.5%。最后目标产物的表征数据如下:mp296.8-297.1℃.1HNMR(500MHz,DMSO-D6)δ:11.81–11.69(m,1H),10.51(dd,J=21.1,9.9Hz,1H),8.34(d,J=7.4Hz,1H),8.20(d,J=7.7Hz,1H),8.13–8.01(m,1H),7.90(d,J=6.8Hz,2H),7.76–7.65(m,1H),7.60(d,J=17.4Hz,1H),7.31(dt,J=21.7,10.7Hz,2H),7.21–7.07(m,1H).13CNMR(126MHz,DMSO-D6)δ:161.0,140.2,134.5,134.3,133.6,133.5,133.0,132.3,128.1,126.3,124.4,122.5,117.4,116.3.HRMSm/z:calcd.forC17H13N2O3S2[M+H]+357.0368,found357.0366。实施例14N-(6-氧代-5,6-二氢菲啶-2-基)萘-2-磺酰胺(14)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为2-萘基,产率为85.9%。最后目标产物的表征数据如下:mp291.4-292.3℃.1HNMR(500MHz,DMSO-D6)δ11.68(s,1H),10.55(s,1H),8.51(s,1H),8.31(d,J=7.3Hz,1H),8.19(d,J=7.6Hz,1H),8.12(t,J=8.5Hz,2H),8.08(s,1H),8.00(d,J=7.5Hz,1H),7.87(t,J=8.4Hz,2H),7.66(d,J=7.8Hz,2H),7.64–7.60(m,1H),7.26(d,J=6.5Hz,2H).13CNMR(126MHz,DMSO-D6)δ160.9,136.9,134.7,134.2,133.9,133.4,132.5,132.0,129.9,129.7,129.5,128.7,128.6,128.3,128.1,126.3,124.0,122.7,122.5,118.2,117.4,115.9.HRMSm/z:calcd.forC23H17N2O3S[M+H]+401.0960,found401.0968。实施例15N-(6-氧代-5,6-二氢菲啶-2-基)-2,3-二氢苯并呋喃-5-磺酰胺(15)的合成:具体制备方法参照实施例1,步骤(3)中式D结构中R为2,3-二氢苯并呋喃-5-基,产率为91.9%。最后目标产物的表征数据如下:mp280.4-280.9℃.1HNMR(500MHz,DMSO-D6)δ11.65(s,1H),10.15(s,1H),8.31(d,J=7.1Hz,1H),8.17(d,J=6.8Hz,1H),7.99(s,1H),7.87(s,1H),7.65(s,2H),7.55(d,J=7.9Hz,1H),7.35–7.17(m,2H),6.84(d,J=6.7Hz,1H),4.67–4.46(m,2H),3.18(d,J=7.2Hz,2H).13CNMR(126MHz,DMSO-D6)δ163.7,160.9,134.0,133.5,132.9,131.5,129.2,128.7,128.2,126.3,124.6,123.8,122.4,118.2,117.3,115.5,109.8,72.6,28.2.HRMSm/z:calcd.forC21H17N2O4S[M+H]+393.0909,found393.0899。应用例(一)BRD4蛋白结合能力测试AlphaScreen法:1)材料:BRD4蛋白;HTRFKinEASE(Cisbio,France);MgCl2、MnCl2、DTT;384低体积白板(Corning,USA);枪头(Axygen,USA);DMSO(Sigma,USA)2)方法:每孔加入5μL的蛋白反应缓冲液和肽底物,化合物10μL,孵育30分钟,混合物进一步室温孵育2小时,加入5μL的终止溶液终止反应,使用EnVision多标记阅读器检测荧光信号比,得到的数据使用GraphpadPrism5进行分析。按照上述方法测试实施例得到的化合物(1)~(15)对BRD4蛋白的半抑制浓度的实验结果如下表2所示。表2编号活性(BRD4)IC50(μM)编号活性(BRD4)IC50(μM)11.6491.7925.92101.2536.17110.4846.71120.2455.54136.7460.79147.2371.321513.1281.13(二)抗肿瘤活性测试MTT法:用含10%胎小牛血清得培养液配成单个细胞悬液,以每孔1000-10000个细胞接种到96孔板,每孔体积200uL,加相应浓度的药物,培养3-5天,每孔加MTT溶液(5mg/ml用PBS配制,pH=7.4)20uL。继续孵育4h,终止培养,小心吸弃孔内培养上清液,对于悬浮细胞需要离心后再吸弃孔内培养上清液。每孔加150uLDMSO,振荡10min,使结晶物充分融解。选择490nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。并根据细胞抑制率计算出化合物(13)对不同肿瘤细胞株的半抑制浓度(IC50值),具体结果如下表3所示。表3肿瘤类型细胞株IC50(μM)肺癌A5490.75肝癌HepG24.83胰腺癌PANC-16.70胃癌SGC-79015.35上述结果表明,本发明所提供菲啶酮类化合物具有良好的BRD4抑制效果,且对多种肿瘤均有良好的抑制作用。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1