一种分离、纯化和固定化组氨酸标签蛋白及牛血红蛋白的新型磁珠的制备方法和应用与流程
本发明涉及生物功能材料技术领域,具体涉及一种可用于分离、纯化和固定化组氨酸标签蛋白、牛血红蛋白的新型磁珠及其制备方法和应用。
背景技术:
蛋白质是一类重要的生物大分子,它是一切生命活动的主要承担者和物质基础。对蛋白质的结构功能进行研究并最终实现应用的前提和基础为蛋白质的高效分离纯化。常规的蛋白质分离提取技术通常依赖于蛋白质在溶解性、疏水性、分子大小、表面所带电荷以及特异生物学亲和性上的差异,由此发展出了盐析法、等电点沉淀法、有机溶剂沉淀法等粗分离方法。此类方法虽然操作简便、处理量大,但通常分辨率过低,无法有效的分离出目标蛋白。其他蛋白质精细分离技术还有凝胶层析、亲和层析、离子交换层析等,这些方法普遍存在价格昂贵、处理量少、对设备要求较高、难以大规模应用等问题。因此建立一种高选择性、可大规模应用的蛋白质分离技术是当前迫切且极具发展前景的一项任务。
基于金属螯合层析技术和功能化修饰磁珠发展起来的金属螯合磁珠是提取分离蛋白质的优良方法,这类磁珠表面修饰的功能化基团通过配位作用与金属离子牢固结合在一起,而重组蛋白表面所带的标签蛋白与金属离子之间的配位作用便于高选择性的提取到目标蛋白。这种方法成本相对较低、操作相对简单,在重组蛋白质的纯化中具有明显的优势。目前已有不少金属螯合磁珠被公开报道,也有不少商业化金属螯合磁珠产品,本发明采用新思路用新途径制备了一系列新型磁珠。与以往制备方法相比,本发明方法具有成本低、合成路线简单、效率高等显著优势。
技术实现要素:
本发明的目的之一在于提供一种可用于分离、纯化和固定化组氨酸标签蛋白及牛血红蛋白的新型磁珠的制备方法,该方法具体如下:
(a)保护气氛下将复合铁盐溶于水中,接着加入氨水,调节溶液ph至碱性并升温进行陈化反应,固液分离得到纳米四氧化三铁磁核,将磁核分散在除氧去离子水中,得到磁核溶液;
(b)以a组分和b组分为原料,制备配体溶液;
(c)将步骤(a)制得的磁核溶液与步骤(b)制得的配体溶液混合,调节混合溶液的ph至酸性并升温反应,最后固液分离得到磁珠;
其中a组分为γ-氨丙基三乙氧基硅烷(kh550)或n-β-(氨乙基)-γ-氨丙基三甲氧基硅烷(kh900),b组分为氯乙酸钠;或者a组分为γ-缩水甘油醚氧丙基三甲氧基硅烷(kh560),b组分为亚氨基二乙酸;或者a组分为γ-氨丙基三乙氧基硅烷(kh550),b组分为亚氨基二乙酸、环氧氯丙烷的混合物。
进一步的,步骤(a)所述复合铁盐为水溶性三价铁盐和水溶性二价铁盐的混合物,两者的质量比为1:1.0-1.4。所述水溶性三价铁盐选自fe(nh4)2·(so4)2或其水合物,所述水溶性二价铁盐选自fecl3或其水合物。
进一步的,步骤(a)具体过程如下:首先将去离子水煮沸后密封自然冷却,以便尽可能除去其中的氧;接着在氮气保护下向去离子水中加入复合铁盐使其充分溶解,所得混合物加热至50-70℃后以200-300r/min的速率搅拌20-40min,然后加入适量氨水调节溶液的ph至10-12,所得混合物继续加热至80-90℃,保温陈化0.5-2h,磁吸附分离后用乙醇和除氧去离子水洗涤所得固体至中性,再加入到除氧去离子水中得到磁核溶液。
进一步的,步骤(b)中配体溶液的制备方法具体如下:
①冰浴条件下向去离子水中滴加kh550,再加入氯乙酸钠,升温并调节溶液的ph至碱性,反应一段时间后得到配体溶液a;
或者②冰浴条件下向去离子水中滴加kh900,再加入氯乙酸钠,升温并调节溶液ph至碱性,反应一段时间后得到配体溶液b;
或者③冰浴条件下将亚氨基二乙酸溶解在去离子水中,调节溶液ph至碱性后滴加kh560,所得混合液转移至水浴中升温反应一段时间后再次转移至冰浴中,再次滴加kh560并水浴升温反应,最终得到配体溶液c;
或者④将亚氨基二乙酸溶于去离子水中并用氢氧化钠调节溶液ph至碱性,接着加入环氧氯丙烷并水浴升温反应,所得混合物转移至冰浴中并滴加kh550,最后加入氢氧化钠调节溶液ph至碱性并升温反应,得到配体溶液d。
进一步的,步骤(b)中混合溶液升温至40-90℃,ph调节至8-12(所使用的ph调节剂为naoh水溶液或碳酸钠水溶液),总的反应时间为4-8h。
进一步的,步骤(b)中制备配体溶液a所需kh550、氯乙酸钠的摩尔比为1:2-4,制备配体溶液b所需kh900、氯乙酸钠的摩尔比为1:2-4,制备配体溶液c所需kh560、亚氨基二乙酸的用量比为3ml:3.5-4.5g,制备配体溶液d所需kh550、亚氨基二乙酸、环氧氯丙烷的用量比为1.0-2.0ml:2.0g:1.0-2.0ml。
进一步的,步骤(c)中磁核溶液的浓度为5-15g/l,其与配体溶液混合时的体积比为1:1.1-1.4。
进一步的,步骤(c)中磁核溶液加入到配体溶液后先超声10-30min,接着用盐酸溶液调节体系ph至3-6,然后升温至80-100℃搅拌反应1-3h,最后磁吸附分离并用乙醇、去离子水反复洗涤所得固体。
进一步的,所述纳米四氧化三铁磁核的粒径为(50-500)nm。
本发明的另一目的在提供一种按照上述方法制备得到的磁珠。
本发明的第三重目的在于制得的磁珠在分离、纯化和固定化组氨酸标签蛋白及牛血红蛋白方面的应用。
本发明在现有金属螯合磁珠的制备基础上进行了改进,进一步提高了制备和提取效率,改进后的方法以超顺磁性的纳米四氧化三铁为内核,在其表面直接修饰上硅烷偶联剂作为连接剂,在修饰过程中硅烷偶联剂会少量水解并因此包裹于磁核表面,使得磁核中金属离子产生的非特异性吸附降低,同时也起到保护磁核的作用,提高了磁核的抗性和耐酸碱性,保护了微粒的磁响应性有利于磁珠的重复使用。此外本发明采用四种配体进行修饰,延长了金属离子与磁核的距离,从而削弱了大部分的其他吸附作用,使得金属离子与目标蛋白间的配位效应几乎成为唯一的作用力,提高了磁珠对标签蛋白和牛血红蛋白的吸附特异性,进而提升了目标蛋白的提取效率。配体中某些组成可与金属离子(cu2+、ni2+、zn2+、co2+)螯合,而这些金属离子与组氨酸标签蛋白等有很强的结合力,使得本发明的金属螯合磁性微珠具有较高的选择性分离蛋白的能力。
与现有技术相比,本发明的有益效果体现在以下几个方面:对现有金属螯合磁珠的制备方法进行了改良。传统金属螯合磁珠大多逐步向外合成,磁核外依次包裹二氧化硅、硅烷偶联剂、亚氨基二乙酸、环氧氯丙烷等物质,而本发明提供的新型磁珠同时制备纳米四氧化三铁磁核和配体,再直接将配体连接到磁核上,省去了传统制备方式中修饰二氧化硅层的步骤,简化了步骤节约了时间降低了制备成本。另外,用液液反应取代了传统的固液反应,大大提高了磁珠的制备和提取效率。
附图说明
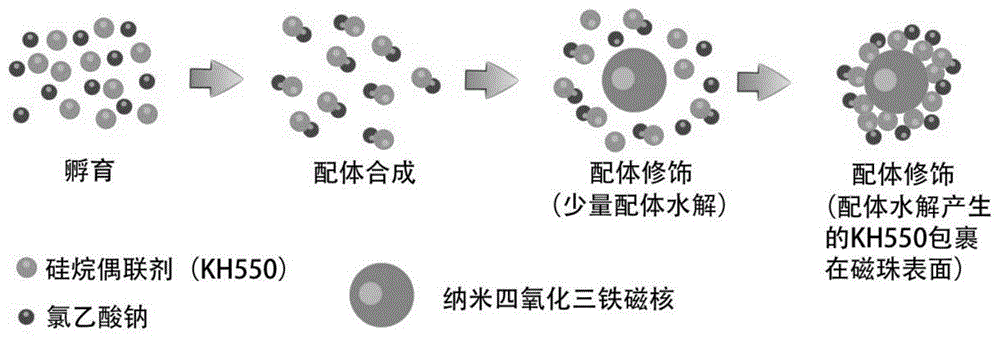
图1为本发明磁珠制备工艺流程图。
图2为本发明实施例1制得的ida磁珠、实施例5制备的镍-ida磁珠分离纯化分散蛋白b的电泳图,以及两种磁珠经盐酸处理后分离纯化分散蛋白b的电泳图。
图3为本发明实施例13制备的镍-ida磁珠分离纯化牛血红蛋白的电泳图。
具体实施方式
为使本领域普通技术人员充分理解本发明的技术方案和有益效果,以下结合具体实施例和附图1-3进行进一步说明。
实施例1
1)纳米四氧化三铁磁核的制备:将去离子水用微波炉煮沸并维持10min,得到除氧去离子水,密封冷却至室温备用。将1.90gfe(nh4)2·(so4)2·6h2o、2.33gfecl3·6h2o置于三口烧瓶中,再加入50ml除氧去离子水使其充分溶解。在氮气保护、200-300r/min搅拌速率、60℃水浴条件下将混合物加热30min,接着加入45ml氨水调节溶液ph至11,加热使混合液升温至80℃,在此温度下陈化1h后磁吸附分离,所得固体用除氧去离子水洗涤至中性,再次进行磁吸附,得到纳米四氧化三铁磁核。分析结果表明,该磁核的平均粒径为111.5nm。
将纳米四氧化三铁磁核加入到100ml除氧去离子水中,配制成浓度为10g/l的纳米四氧化三铁磁核溶液,室温保存。
2)配体的制备:在冰浴条件下向15ml去离子水中滴加0.842mlkh550(3.6mm,1eq),搅拌1h使其均匀混合,再加入氯乙酸钠水溶液(将1.26g氯乙酸钠(10.8mm,3eq)溶于10ml去离子水制得)并升温至80℃,用5mnaoh水溶液或碳酸钠水溶液调节混合物的ph至8-12,搅拌反应6h后得到配体溶液。
3)配体的修饰:用浓盐酸调节配体溶液的ph至酸性,再加入制得的纳米四氧化三铁磁核溶液并超声分散10min,加热使混合物升温至95℃,在此温度下搅拌反应2h使配体修饰反应充分进行。待反应结束后进行磁吸附分离,所得固体用乙醇洗涤2遍用去离子水洗涤6遍,接着再次进行磁吸附除去水分,最终得到新型磁珠。
实施例2
1)纳米四氧化三铁磁核的制备:将去离子水用微波炉煮沸并维持10min,得到除氧去离子水,密封冷却至室温备用。将1.90gfe(nh4)2·(so4)2·6h2o、2.33gfecl3·6h2o置于三口烧瓶中,再加入50ml除氧去离子水使其充分溶解。在氮气保护、200-300r/min搅拌速率、60℃水浴条件下将混合物加热30min,接着加入45ml氨水调节溶液ph至11,加热使混合液升温至80℃,在此温度下陈化1h后磁吸附分离,所得固体用除氧去离子水洗涤至中性,再次进行磁吸附,得到纳米四氧化三铁磁核。分析结果表明,该磁核的平均粒径为111.8nm。
将纳米四氧化三铁磁核加入到100ml除氧去离子水中,配制成浓度为10g/l的纳米四氧化三铁磁核溶液,室温保存。
2)配体的制备:在冰浴条件下向15ml去离子水中滴加0.822mlkh900(3.6mm,1eq),搅拌1h使其均匀混合,再加入氯乙酸钠水溶液(将1.26g氯乙酸钠(10.8mm,3eq)溶于10ml去离子水制得)并升温至80℃,用5mnaoh水溶液或碳酸钠水溶液调节混合物的ph至8-12,搅拌反应6h后得到配体溶液。
3)配体的修饰:用浓盐酸调节配体溶液的ph至酸性,再加入制得的纳米四氧化三铁磁核溶液并超声分散10min,加热使混合物升温至95℃,在此温度下搅拌反应2h使配体修饰反应充分进行。待反应结束后进行磁吸附分离,所得固体用乙醇洗涤2遍用去离子水洗涤6遍,接着再次进行磁吸附除去水分,最终得到新型磁珠。
实施例3
1)纳米四氧化三铁磁核的制备:将去离子水用微波炉煮沸并维持10min,得到除氧去离子水,密封冷却至室温备用。将1.90gfe(nh4)2·(so4)2·6h2o、2.33gfecl3·6h2o置于三口烧瓶中,再加入50ml除氧去离子水使其充分溶解。在氮气保护、200-300r/min搅拌速率、60℃水浴条件下将混合物加热30min,接着加入45ml氨水调节溶液ph至11,加热使混合液升温至80℃,在此温度下陈化1h后磁吸附分离,所得固体用除氧去离子水洗涤至中性,再次进行磁吸附,得到纳米四氧化三铁磁核。分析结果表明,该磁核的平均粒径为111.8nm。
将纳米四氧化三铁磁核溶液加入到100ml除氧去离子水中,配制成浓度为10g/l的纳米四氧化三铁磁核溶液,室温保存。
2)配体的制备:向50ml去离子水中加入4.20g亚氨基二乙酸,用10m的氢氧化钠水溶液调整混合液的ph至10-12,将混合液置于冰浴中在0℃下搅拌1h。接着将1.4mlkh560缓慢滴加到溶液中并搅拌0.5h,然后转移至65℃水浴中加热反应6h,再次冰浴冷却到0℃。重复上述步骤,将1.6mlkh560缓慢滴加到溶液中并搅拌0.5h,所得混合液在65℃水浴中加热反应6h得到配体溶液。
3)配体的修饰:用浓盐酸调节配体溶液的ph至酸性,再加入制得的纳米四氧化三铁磁核溶液并超声分散10min,加热使混合物升温至95℃,在此温度下搅拌反应2h使配体修饰反应充分进行。待反应结束后进行磁吸附分离,所得固体用乙醇洗涤2遍用去离子水洗涤6遍,接着再次进行磁吸附除去水分,最终得到新型磁珠。
实施例4
1)纳米四氧化三铁磁核的制备:将去离子水用微波炉煮沸并维持10min,得到除氧去离子水,密封冷却至室温备用。将1.90gfe(nh4)2·(so4)2·6h2o、2.33gfecl3·6h2o置于三口烧瓶中,再加入50ml除氧去离子水使其充分溶解。在氮气保护、200-300r/min搅拌速率、60℃水浴条件下将混合物加热30min,接着加入45ml氨水调节溶液ph至11,加热使混合液升温至80℃,在此温度下陈化1h后磁吸附分离,所得固体用除氧去离子水洗涤至中性,再次进行磁吸附,得到纳米四氧化三铁磁核。分析结果表明,该磁核的平均粒径为111.8nm。
将纳米四氧化三铁磁核加入到100ml除氧去离子水中,配制成浓度为10g/l的纳米四氧化三铁磁核溶液,室温保存。
2)配体的制备:向氢氧化钠水溶液(将1.2g氢氧化钠(0.03m,2eq)溶于10ml去离子水中制得)中加入亚氨基二乙酸溶液(将2.0g亚氨基二乙酸(0.015m,1eq)溶于10ml去离子水中制得),将所得混合液加热至40℃并在搅拌的情况下加入1.2ml环氧氯丙烷,反应4h后将混合物冰浴5min,期间滴加1.76ml的kh550(0.0075m,0.5eq),滴加完成后继续冰浴搅拌1h,最后加入0.6g氢氧化钠(0.015m,1eq)并升温至80℃反应4h,得到配体溶液。
3)配体的修饰:用浓盐酸调节配体溶液的ph至酸性,再加入制得的纳米四氧化三铁磁核溶液并超声分散10min,加热使混合物升温至95℃,在此温度下搅拌反应2h使配体修饰反应充分进行。待反应结束后进行磁吸附分离,所得固体用乙醇洗涤2遍用去离子水洗涤6遍,接着再次进行磁吸附除去水分,最终得到新型磁珠。
实施例5
将实施例1中制得的新型磁珠用于提取组氨酸标签蛋白的过程具体如下:
1)取5mg实施例1制得的新型磁珠,加入到4ml的离心管中,磁吸附后加入1ml浓度为1mol/l的硫酸镍溶液混合均匀,在37℃、220rpm的条件下孵育30-60min,得到混合液;
2)对混合液进行磁吸附后加入3ml去离子水,摇晃混匀后继续磁吸附,除去上清液再次加入3ml去离子水。如此重复洗涤三次以便除去多余的硫酸镍,得到螯合有镍离子的新型磁珠;
3)准备0.5-2ml含有组氨酸标签蛋白的细胞破碎液,与上述螯合有镍离子的新型磁珠混合,将混合物转移至摇床上于220rpm、37℃条件下孵育20min,磁吸附除去上清液后再加入1ml浓度为10mm的咪唑溶液,所得混合物再次置于摇床上于220rpm、37℃条件下重复洗涤三次,最后用250mm咪唑溶液重复洗涤五次,收集洗涤所得溶液的上清液,即为纯化后的组氨酸标签蛋白溶液。
实施例6
本实施例与实施例5基本相同,不同之处在于:新型磁珠来源更换为实施例2,磁珠用量不变。
实施例7
本实施例与实施例5基本相同,不同之处在于:新型磁珠来源更换为实施例3,磁珠用量不变。
实施例8
本实施例与实施例5基本相同,不同之处在于:新型磁珠来源更换为实施例4,磁珠用量不变。
实施例9
将实施例1中制得的新型磁珠用于提取牛血液中牛血红蛋白的过程具体如下:
1)牛血的预处理:向新鲜牛血中加入质量分数为5%的柠檬酸三钠并搅拌均匀。取50ml处理后的牛血,在4℃、2500r/min的条件下用150mlpbs溶液分三次各离心洗涤15min,再加入等体积的去离子水、1/4体积的无水乙醇搅拌30min,在此过程中血红细胞吸水胀裂。最后离心收集上清液,得到含有牛血红蛋白的溶液。
2)将5mg实施例1制得的新型磁珠,加入到4ml离心管中,磁吸附后加入1ml浓度为1mol/l的硫酸镍溶液并混合均匀,所得混合物在37℃、220rpm条件下孵育30-60min,得到混合液;
3)对混合液进行磁吸附后加入3ml去离子水,摇晃混匀后继续磁吸附除去上清液,再次加入3ml去离子水重复上述步骤洗涤三次,以便除去多余的硫酸镍,最终得到螯合有镍离子的新型磁珠;
4)将0.5-2ml含有牛血红蛋白的溶液与螯合有镍离子的新型磁珠混合均匀,接着将混合物置于摇床上于220rpm、4℃条件下孵育20min,磁吸附除去上清后再加入1ml浓度为10mm的咪唑溶液,再次置于摇床上于220rpm、4℃条件下重复洗涤三次,最后用250mm咪唑溶液重复洗涤五次,收集洗涤所得溶液的上清液,即为纯化后的牛血红蛋白溶液。
实施例10
本实施例与实施例9基本相同,不同之处在于:新型磁珠来源更换为实施例2,磁珠用量不变。
实施例11
本实施例与实施例9基本相同,不同之处在于:新型磁珠来源更换为实施例3,磁珠用量不变。
实施例12
本实施例与实施例5基本相同,不同之处在于:新型磁珠来源更换为实施例4,磁珠用量不变。
实施例13
利用实施例1制得的新型磁珠牛血清白蛋白和牛血红蛋白混合液中提取牛血红蛋白的过程具体如下:
1)将5mg实施例1制备的新型磁珠,加入至4ml离心管中,磁吸附后加入1ml浓度为1mol/l的硫酸镍溶液并混合均匀,在37℃、220rpm条件下孵育30-60min,得到混合液;
2)混合液磁吸附后与3ml去离子水混匀,继续磁吸附后除去上清液,再次加入3ml去离子水重复洗涤三次,以便除去多余的硫酸镍,最终得到螯合有镍离子的新型磁珠;
3)将0.5-2ml牛血清白蛋白-牛血红蛋白混合液与上述螯合有镍离子的新型磁珠混合均匀,所得混合物置于摇床上于220rpm、4℃条件下孵育20min,磁吸附除去上清液;再加入1ml浓度为0mm(即不含咪唑,下同)的咪唑溶液,再次置于摇床上于220rpm、4℃条件下重复洗涤三次,最后用500mm咪唑溶液重复洗涤五次,收集洗涤所得溶液的上清液,即为纯化后的牛血红蛋白溶液。
实施例14
本实施例与实施例13基本相同,不同之处在于:新型磁珠来源更换为实施例2,磁珠用量不变。
实施例15
本实施例与实施例13基本相同,不同之处在于:新型磁珠来源更换为实施例3,磁珠用量不变。
实施例16
本实施例与实施例13基本相同,不同之处在于:新型磁珠来源更换为实施例4,磁珠用量不变。
为证明实施例1-4制得的新型磁珠螯合镍离子后对组氨酸标签蛋白的选择性,进行了下述实验:取两份(5mg/份)实施例1中制得的新型磁珠,一份不作任何处理(简称ida磁珠),另一份螯合镍离子(即实施例5中间产物--螯合有镍离子的新型磁珠,简称镍-ida磁珠)。将两份磁珠样品分别加入到0.5ml带组氨酸标签的分散蛋白b的细胞破碎液中,得到混合液试样。将混合液试样置于室温下孵育20min后收集上清液,接着用1ml浓度为10mm的咪唑溶液洗涤三次,每次5分钟,洗涤完成后收集上清并合并。再用0.5ml浓度为250mm的咪唑溶液洗脱10分钟,同样收集上清。最后用蛋白质电泳(sds-page)对收集到的溶液进行检测,结果如图2中编号1-8的条带所示。
本发明制得的新型磁珠在四氧化三铁磁性内核表面包覆有少量硅烷偶联剂,因此会有少量未被硅烷偶联剂包覆的四氧化三铁附着在磁珠表面,其对分散蛋白b同样具有吸附作用。为消除这一干扰,进一步验证了实施例1-4制备的新型磁珠在螯合镍离子后对组氨酸标签蛋白的选择性,具体过程如下:
取两份(5mg/份)实施例1制备的新型磁珠,一份用盐酸处理消除表面四氧化三铁的干扰(简称ida磁珠(hcl)),另一份螯合镍离子(即实施例5制备得到螯合有镍离子的新型磁珠后再用盐酸处理,简称镍-ida磁珠(hcl))分别将两种磁珠加入到0.5ml带组氨酸标签的分散蛋白b的细胞破碎液中,得到混合液试样。将混合液试样置于室温下孵育20min后收集上清液,接着用1ml浓度为10mm的咪唑溶液洗涤三次,每次5分钟,洗涤完成后收集上清并合并。再用0.5ml浓度为250mm的咪唑溶液洗脱10分钟,同样收集上清。最后用蛋白质电泳(sds-page)对收集到的溶液进行检测,结果如图2中编号9-14的条带所示。
图2中编号1-8的条带从左到右依次为:marker、dspb原液、ida磁珠上清液、ida磁珠洗涤液、ida磁珠洗脱液、镍-ida磁珠上清液、镍-ida磁珠洗涤液、镍-ida磁珠洗脱液。由图可知镍-ida磁珠在洗脱液中出现了单一的条带(即分散蛋白b),而ida磁珠在洗脱液中并未出现分散蛋白b的条带。这说明镍-ida磁珠能从细菌破碎液中纯化得到带组氨酸标签的分散蛋白b,且选择性较强。
图2中编号9-14的条带从左到右依次为:ida磁珠(hcl)上清液、ida磁珠(hcl)洗涤液、ida磁珠(hcl)洗脱液、镍-ida磁珠(hcl)上清液、镍-ida磁珠(hcl)洗涤液、镍-ida磁珠(hcl)洗脱液。由图可知:镍-ida磁珠(hcl)在洗脱液中出现了单一的条带(即分散蛋白b),而ida磁珠(hcl)在洗脱液中并未出现分散蛋白b的条带。这说明镍-ida磁珠(hcl)能从细菌破碎液中纯化得到带组氨酸标签的分散蛋白b,且选择性较强。对比镍-ida磁珠(hcl)洗脱液和镍-ida磁珠洗脱液可知,两者分散蛋白b的条带无明显差异,这说明表面四氧化三铁对本发明所制备的新型磁珠的纯化效率干扰很小,进一步说明该新型磁珠螯合镍离子后对组氨酸标签蛋白展现出良好的选择性。
为验证实施例1-4提供的新型磁珠螯合镍离子后对牛血红蛋白的选择性,以实施例13为例对实验过程中收集到的牛血清白蛋白原液、牛血红蛋白原液、牛血清白蛋白-牛血红蛋白混合液、镍-ida磁珠上清液、0mm咪唑洗涤液、500mm咪唑洗脱液、洗脱后的镍-ida磁珠进行了sds-page检测,检测结果如图3所示。
图3中的条带从左到右依次为:marker、牛血清白蛋白原液、牛血红蛋白原液、牛血清白蛋白-牛血红蛋白混合液、镍-ida磁珠上清液、0mm咪唑洗涤液、500mm咪唑洗脱液、载体。由图可知,镍-ida磁珠在洗脱液中出现了单一的条带(即牛血红蛋白),而并未出现牛血清白蛋白对应的条带。这说明镍-ida磁珠能从牛血清白蛋白-牛血红蛋白混合液中分离纯化出牛血红蛋白,且选择性较强。此外在载体上存在有大量的牛血红蛋白,通过增加洗脱次数即可将其洗脱下来,这说明本发明制备的新型磁珠对牛血红蛋白的提取和纯化效率较高。
- 还没有人留言评论。精彩留言会获得点赞!