醇脱氢酶突变体及其在环状萜烯酮合成中的应用
本发明属于生物工程技术领域,具体涉及一种催化性能明显提高的醇脱氢酶突变体、其编码核酸,含有该核酸序列的重组表达载体和重组表达转化体,以及利用该醇脱氢酶突变体或重组表达转化体催化羟基化合物脱氢反应,特别是催化羟基位于3-和6-位的环状萜烯醇的脱氢反应,以制备环状萜烯酮的应用。
背景技术:
l-(-)-薄荷醇也叫左旋薄荷脑,常温下为液体,水溶性较差,具有清凉的风味和一定香气,常被用在酒类、调味品、口腔保健品、化妆品等产品加工中(phytochemistry,2013,96:15-25)。在自然界中,(-)-薄荷醇存在于薄荷植物叶片的油腺分泌细胞中,可通过萃取、常压蒸馏等手段得到(proc.natl.acad.sci.u.s.a,1999,97:2934-2939)。近几年来薄荷醇消耗量逐年大幅度上升,至2018年(-)-薄荷醇年消耗量达到约4万吨(anhui.chem.ind.,2018),其中约70%的(-)-薄荷醇是从植物薄荷蒸馏所得,受天气、土地和人力等因素影响极大。约有30%的(-)-薄荷醇是通过化学合成。目前为止,我国(-)-薄荷醇的市场很大,但国内薄荷醇的大面积种植产地较少,因此食品等行业内使用的天然(-)-薄荷醇大部分从印度和巴西进口。迄今为止国内尚无产量高、技术好的薄荷醇化学法合成企业。
现在的(-)-薄荷醇的化学合成企业以日本takasago和德国的symrise两家独大。日本takasago企业通过不对称合成的方法大规模合成(-)-薄荷醇(chem.biodivers,2014,11:1688-1699);而德国symrise企业则通过对映体拆分来制备(-)-薄荷醇(us20100249467a1,2010)。但这两者皆有缺陷,前者催化剂昂贵且污染严重,后者拆分困难,损失较多。除去日本takasago和德国symrise两家企业,剩下都是规模较小的化学合成法(cn107056587b,2017)。
由于植物萃取法和化学合成法所得的(-)-薄荷醇仍无法满足市场需求,所以(-)-薄荷醇的生物合成法便引起了越来越多学者的注意。但目前生物法合成(-)-薄荷醇仍处于初级阶段,其中大部分都是通过动力学拆分外消旋的薄荷醇等衍生物来制备(-)-薄荷醇(tetrahedronasymmetry.,2003,14:3313-3319)。目前效果较为显著的是通过在双水相体系中固定枯草芽孢的酯酶对乙酸薄荷酯进行拆分,其底物上载量可提高至3m,同时保证了>40%转化率和97%e.e.值,使得l-薄荷醇的大量生产成为可能(adv.synth.catal.,2010,351:405-414)。但这类方法并不是从甘油、(-)-柠檬烯等便宜的化合物合成,且与(-)-薄荷醇的植物提取法面临相同的难题(researchonchemicalintermediates,2018,44:6847-6860)。因此在微生物中模拟植物中的(-)-薄荷醇的从头合成途径更有可能实现(-)-薄荷醇的高效生物合成(journalofbiologicalchemistry,1992,267:7582-7587)。
目前在微生物中从头构建(-)-薄荷醇的途径虽尚未实现,但已取得优异的进展。nigels.scrutton所在课题组将薄荷醇途径中的后两步偶联起来,将烯还原酶(ntdbr)和(-)-薄荷酮还原酶(mmr)同时构建到大肠杆菌中,成功的从(+)-胡薄荷酮通过一锅煮的酶法合成了(-)-薄荷醇,打通(-)-薄荷醇生物合成途径的后两步(acssynth.biol.,2015,4:1112-1123),这让体外构建薄荷醇的途径有了希望。随后在2018年,该课题组通过细菌来源的异构酶(ksi)替代了异胡薄荷酮异构酶(ipgi)又实现了从(+)-顺式-异胡薄荷酮合成(-)-薄荷醇(25.5mg/l)。再加上2014年,andreasschmid课题组成功的在大肠杆菌中从头合成了2.7g/l的(-)-柠檬烯(biotechnol.j.,2014,9:1000-1012),因此目前微生物的(-)-薄荷醇途径的瓶颈在于柠檬烯-3-羟化酶(l3h)和异薄荷烯醇脱氢酶(ipdh)。
异薄荷烯醇脱氢酶(ipdh)隶属于sdr超家族。该类酶可以催化异薄荷烯醇氧化成相应的酮。该酶最初是在薄荷属植物中被发现的(archivesofbiochemistry&biophysics,1985,238:49-60),其既能够催化异薄荷烯醇(isopiperitenol)氧化,也能催化香芹醇(carveol)氧化,因此该酶也被称为异薄荷烯醇/香芹醇脱氢酶(plantphysiology,2004,136:4215-4227)。2005年,胡椒薄荷中的该酶成功地在大肠杆菌中异源表达并表征,但其活力极低,kcat/km仅0.027s-1·mm-1。除此之外,该酶也被发现存在于其他植物(biol.pharm.bull.,2014,37:847-852)、微生物(journalofbiologicalchemistry,1999,274:26292-26304)、真菌(fungalbiology,2017,121:137-144)之中。但这些异薄荷烯醇脱氢酶大部分都并未对底物异薄荷烯醇进行表征,且目前该酶的晶体结构尚未被解析。
已知ipdh除了在(-)-薄荷醇微生物合成途径中有重要作用之外,也为未来合成异薄荷烯酮提供了新的方法。异薄荷烯酮可以作为警告螨虫远离的“报警素”(agriculturalandbiologicalchemistry,1987,51:3441-3442),是生物界重要的物质,虽然目前它的其他应用不明,但其更多的应用会随着异薄荷烯酮合成方法的改善而被发现。迄今为止,异薄荷烯酮的制备研究进展尚浅,目前仅有化学合成法存在,比如通过钌、吡咯的络合物将(-)-柠檬烯氧化成(-)-异薄荷烯酮(thejournaloforganicchemistry,1999,64:7365-7374)。唯一达到克级别的制备是nigels.scrutton所在课题组所用的方法(j.nat.prod.,2018,81:1546-1552),但其产率仅35%。总之,目前酶法合成异薄荷烯酮的方法暂未出现。
综上所述,在(-)-薄荷醇微生物合成途径以及异薄荷烯酮的制备中,ipdh都占据着重要地位,但已知的异薄荷烯醇脱氢酶mpipdh存在着催化活性低,以膜蛋白形式存在,时空得率低等问题。因此,需要催化性能更好的酶催化剂来满足微生物中高效薄荷醇合成途径的需求,以及酶法合成异薄荷烯酮的需求。
技术实现要素:
本发明所要解决的技术问题是,针对现有技术中异薄荷烯醇脱氢酶的不足,提供一种催化性能明显改善的醇脱氢酶突变体。
本发明的技术方案之一,获得催化性能明显改善的醇脱氢酶突变体。
首先在ncbi的细菌库以已报道的mpipdh(plantphysiology,2005,137:863-872,ncbinumber:q5c919.1)为探针进行蛋白blast,得到与mpipdh有一定同源性的序列。其次将这些同源性序列通过序列比对后,筛选出有关键motif的序列,关键motif如sdr催化三联体(ser-tyr-lys)、nad(p)+-结合motif(-(t)gxxxgxg-),sdr保守motif(nnag)以及nad+-依赖性的结合残基asp;删除两两之间同源性过高的序列,使各个序列之间两两同源性小于85%,从而得到此醇脱氢酶的酶库。通过对候选酶进行活性检测,筛选获得来源于pseudomonasaeruginosa的还原酶paipdh,其氨基酸序列如序列表seqidno.2所示。
本发明中,以该酶基因作为母本,采用丙氨酸扫描、晶体结构指导、定点饱和突变、迭代组合突变等策略对其进行定向进化改造,结合紫外分光光度计法活性检测复筛,鉴别获得活性和热稳定性显著改善的醇脱氢酶突变体。
本发明所述的醇脱氢酶突变体,是将如seqidno.2所示氨基酸序列的95位谷氨酸、97位谷氨酸、154位甲硫氨酸、189位缬氨酸、191位天冬氨酸、194位甲硫氨酸、195位苯丙氨酸、199位酪氨酸、208位的苯丙氨酸中的1个或多个氨基酸残基替换为其他氨基酸残基的衍生蛋白质;同时,所述衍生蛋白质具有高于seqidno.2所示氨基酸序列组成的蛋白质的催化性能和稳定性。
与野生型醇脱氢酶相比,本发明提供的醇脱氢酶突变体具备更高的催化活性和稳定性效果。
将其它氨基酸残基替换成不影响醇脱氢酶突变体催化性能的其他氨基酸残基的衍生蛋白质也属于本发明权利要求保护的范围。
本发明提供多种较佳的醇脱氢酶突变体,其是由下述任一氨基酸序列组成的蛋白质:
(1)将如seqidno.2所示氨基酸序列的第95位谷氨酸替换为缬氨酸(e95v);
(2)将如seqidno.2所示氨基酸序列的第95位谷氨酸替换为苯丙氨酸(e95f);
(3)将如seqidno.1所示氨基酸序列的第97位谷氨酸替换为甲硫氨酸(e97m);
(4)将如seqidno.2所示氨基酸序列的第154位甲硫氨酸替换为组氨酸(m154h);
(5)将如seqidno.2所示氨基酸序列的第189位缬氨酸替换为色氨酸(v189w);
(6)将如seqidno.2所示氨基酸序列的第189位缬氨酸替换为异亮氨酸(v189i);
(7)将如seqidno.2所示氨基酸序列的第191位天冬氨酸替换为缬氨酸(d191v);
(8)将如seqidno.2所示氨基酸序列的第194位甲硫氨酸替换为赖氨酸(m194k);
(9)将如seqidno.2所示氨基酸序列的第194位甲硫氨酸替换为天冬酰胺(m194n);
(10)将如seqidno.2所示氨基酸序列的第195位苯丙氨酸替换为色氨酸(f195w);
(11)将如seqidno.2所示氨基酸序列的第195位苯丙氨酸替换为甲硫氨酸(f195m);
(12)将如seqidno.2所示氨基酸序列的第199位酪氨酸替换为缬氨酸(y199v);
(13)将如seqidno.2所示氨基酸序列的第199位酪氨酸替换为组氨酸(y199h);
(14)将如seqidno.2所示氨基酸序列的第95位谷氨酸替换为缬氨酸(e95v),第208位苯丙氨酸替换为组氨酸(f208h);
(15)将如seqidno.2所示氨基酸序列的第97位谷氨酸替换为甲硫氨酸(e97m),第154位甲硫氨酸替换为组氨酸(m154h);
(16)将如seqidno.2所示氨基酸序列的第194位甲硫氨酸替换为赖氨酸(m194k),第199位酪氨酸替换成色氨酸(y199w);
(17)将如seqidno.2所示氨基酸序列的第194位甲硫氨酸替换为赖氨酸(m194k),第199位酪氨酸替换成组氨酸(y199h),第208位苯丙氨酸替换为组氨酸(f208h);
(18)将如seqidno.2所示氨基酸序列的第95位谷氨酸替换成苯丙氨酸(e95f),第189位缬氨酸替换为色氨酸(v189w),第195位苯丙氨酸替换为色氨酸(f195w),第199位酪氨酸替换成缬氨酸(y199v)。
本发明提供的醇脱氢酶突变体适合作为异薄荷烯醇脱氢酶突变体。
本发明的技术方案之二,提供了编码所述醇脱氢酶突变体的核酸,以及含有所述醇脱氢酶突变体基因核酸序列的重组表达载体。
所述核酸编码表达如技术方案一所述的进化改造获得的醇脱氢酶突变体,其来源包括:通过基因工程技术对技术方案一所述的系列醇脱氢酶突变体的基因序列进行克隆;或者通过人工全序列合成的方法得到编码如技术方案一所述醇脱氢酶突变体的核酸分子。
所述的重组表达载体可通过本领域常规方法,将本发明所述的醇脱氢酶突变体基因的编码核酸序列连接于各种市售空载载体上构建而成。所述的市售空载载体可以是本领域常规的各种质粒载体,只要所述重组表达载体可以在相应的表达宿主中正常复制,并表达相应的醇脱氢酶即可。
针对不同的表达宿主,优选的质粒载体是不同的。本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。对于大肠杆菌宿主,所述质粒载体优选的为pet-28a(+)质粒。可通过下述方法制得本发明所述的大肠杆菌重组表达载体:将通过pcr扩增所得的醇脱氢酶突变体基因片段用限制性内切酶ecori和hindiii双酶切,同时将空载质粒pet-28a(+)同样用限制性内切酶ecori和hindiii双酶切,回收上述酶切后的醇脱氢酶突变体的dna片段以及空载质粒,利用t4dna连接酶连接,构建获得用于大肠杆菌表达的含有所述醇脱氢酶突变体编码核酸的重组表达载体。
本发明的技术方案之三,提供了一种包含本发明所述醇脱氢酶突变体基因或其重组表达载体的重组表达转化体。可通过将已经构建好的重组表达载体转化至宿主细胞来制备重组表达转化体。
所述宿主细胞为本领域的各种常规宿主细胞,只要所述的重组表达载体能够稳定地自行复制并能通过诱导剂诱导后有效表达目标蛋白质即可。本发明首选大肠杆菌作为宿主细胞,更优选大肠杆菌e.colibl21(de3)用于高效表达本发明所述的醇脱氢酶突变体。
本发明的技术方案之四,提供一种重组醇脱氢酶突变体催化剂,所述的重组醇脱氢酶突变体催化剂是以下形式中的任意一种:
(1)培养本发明所述的重组表达转化体,分离含有所醇脱氢酶突变体的转化体细胞;
(2)培养本发明所述的重组表达转化体,分离含有所述醇脱氢酶突变体的粗酶液;
(3)将所述醇脱氢酶突变体的粗酶液冷冻干燥得到的粗酶粉。
其中所述重组表达转化体的培养方法和条件可以为本领域常规的方法和条件。在本发明的一个实施方式中,提供如下步骤:培养本发明的重组表达转化体,获得重组醇脱氢酶。对于重组大肠杆菌,优选培养基为lb培养基:蛋白胨10g/l,酵母膏5g/l,nacl10g/l,ph6.5-7.0。优选的培养方法为:将如上所述构建的重组大肠杆菌,接种至含有卡那霉素的lb培养基中,37℃、180rpm振荡培养过夜。按1-2%(v/v)的接种量接入装有100ml的lb培养基(含卡那霉素)的500ml三角烧瓶中,置于37℃、180rpm摇床振荡培养,当培养液的od600达到0.6-0.8时,加入终浓度为0.1-0.5mmol/l的异丙基-β-d-硫代半乳糖苷(iptg)作为诱导剂,16℃诱导16-24h后,将培养液离心,收集沉淀,然后用生理盐水洗涤两次,获得重组表达转化体细胞。将收获的重组细胞进行冷冻干燥,即可获得含有所述醇脱氢酶突变体的冻干细胞。将收获的重组细胞悬浮于5-10倍体积(v/w)的缓冲液中,超声破碎,离心收集上清液,即可获得所述重组醇脱氢酶突变体的粗酶液。收集的粗酶液放置在-80℃下冷冻,然后使用真空冷冻干燥机低温干燥,即可得到冻干酶粉。将所获得的冻干酶粉保存在4℃冰箱内,可以方便地使用。
本发明中所述醇脱氢酶突变体的活力测定方法:将含1mmol/l(-)-trans-异薄荷烯醇和10mmol/lnad+的1ml反应体系(50mmol/l甘氨酸-氢氧化钠缓冲液,ph10.0)预热至40℃,然后加入适量的醇脱氢酶突变体,40℃保温反应,在分光光度计上检测340nm处nadh的吸光度变化,记录1分钟内吸光度的变化值。
用下式计算得到酶活力:
酶活力(u)=ew×v×103/(6220×l)式中,ew为1分钟内340nm处吸光度的变化;v为反应液的体积,单位为ml;6220为nadh的摩尔消光系数,单位为l/(mol·cm);l为光程距离,单位为cm。1个酶活力单位(u)定义为上述条件下每分钟催化还原1μmolnad+所需的酶量。
本发明的技术方案之五,提供了所述醇脱氢酶突变体或重组醇脱氢酶突变体催化剂在催化化羟基化合物脱氢反应中的应用。
即本发明提供了利用醇脱氢酶突变体或重组醇脱氢酶突变体催化剂催化羟基化合物脱氢反应,制备相应的酮的方法。
其中所述羟基化合物可选自以下化合物中的任一种:
在所述应用中,羟基化合物的浓度可为1~5mmol/l,所述的醇脱氢酶突变体或重组醇脱氢酶突变体催化剂中醇脱氢酶突变体的用量可选用为1~50u/mmol羟基化合物。
在本发明的一个实施方式中,提供所述醇脱氢酶突变体或重组醇脱氢酶突变体催化剂在催化羟基位于3-和6-位的环状萜烯醇的脱氢反应,以制备环状萜烯酮的应用。
在本发明的一个实施方式中,所述环状萜烯酮包括(-)-异薄荷烯酮、(-)-香芹酮。
在本发明的一个实施方式中,提供所述醇脱氢酶突变体或重组醇脱氢酶突变体催化剂在催化(-)-trans-异薄荷烯醇脱氢反应,以制备(-)-异薄荷烯酮的应用。
在本发明的一个实施方式中,反应液中nadh或nad+的用量为0.1~0.5mmol/l。反应过程中可利用o2作为辅底物,通过nadh脱氢酶催化的反应实现反应体系中nad+的辅酶循环,反应体系的磷酸盐缓冲液为本领域常规磷酸盐缓冲液,如磷酸钾缓冲液,其浓度较佳为50mmol/l。所述的脱氢反应是在振荡或搅拌条件下进行。所述的脱氢反应的温度为20~40℃,优选25℃。所述的脱氢反应的时间以底物完全转化或反应自行终止的时间为准,优选反应时间小于24h。
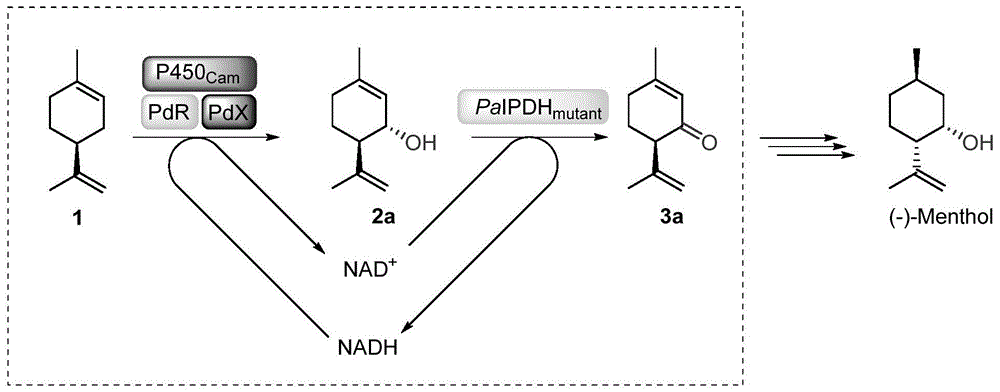
在在催化(-)-trans-异薄荷烯醇脱氢反应,以制备(-)-异薄荷烯酮的应用的过程中,由于底物(-)-trans-异薄荷烯醇的商业不可购买性,直接从(-)-trans-异薄荷烯醇制备(-)-异薄荷烯酮是不可取的。因此通过引入一个羟化步骤来间接合成(-)-异薄荷烯酮。具体为:通过p450camy96f/y247l(chem.commun.,2001,635-636)与其不可或缺的电子传递部分pdx、pdr共表达在氨苄霉素抗性的pet21a上,便宜且廉价的(-)-柠檬烯可以大部分被羟化成(-)-trans-异薄荷烯醇,而后通过卡那霉素抗性的pet28a-paipdh突变体所表达出的蛋白再将上一步羟化所产生的(-)-trans-异薄荷烯醇氧化成(-)-异薄荷烯酮。因为此级联酶法中的第一步骤p450cam部分会消耗nadh生成nad+,而第二步骤paipdh突变体会消耗nad+生成nadh,即可自身自循环辅酶。因此无需添加外辅助酶来循环辅酶。且通过整细胞反应,可以最大程度保留p450的活力且无需添加辅酶nad+/nadh。
其中,醇脱氢酶突变体与p450cam组合转化合成(-)-异薄荷烯酮(化合物3a)的反应过程示意图如图1所示。
其中共表达蛋白p450camy96f/y247l-pdx-pdr的dna序列如序列表seqidno.3所示。
氧化反应结束后,采用常规方法对反应液中的氧化产物环状萜烯酮进行分离提取。
对反应液中的氧化产物环状萜烯酮进行分离提取的方法优选的为,在反应液中加入乙酸乙酯进行萃取,萃取得到的有机相中加入无水硫酸钠进行过夜干燥,因产物的易挥发性,在20~25℃采用减压蒸馏的方法对萃取液进行浓缩除去溶剂,获得产物酮的粗产品。优选的,通过硅胶柱层析分离酮粗产品,采用200-300目的硅胶,洗脱液为石油醚:乙酸乙酯=50:1(或100:1),洗脱结束后,用gc检测纯度,然后对符合纯度要求的洗脱管进行收集合并,同样通过减压蒸馏的方法除去溶剂后纯化获得目标(-)-异薄荷烯酮纯品。
与现有技术相比,本发明的创新和改进效果在于:
本发明提供了一种催化性能更好的醇脱氢酶突变体,高效催化环己烷3位-/6位-醇的羟基脱氢反应,制备光学纯的酮化合物如:(-)-异薄荷烯酮、(-)-香芹酮。所述(-)-异薄荷烯酮、(-)-香芹酮均为环状萜烯酮化合物,这些环状萜烯酮化合物由于具有其独特的香味以及其抗菌抗癌作用在香料市场和医药市场上具有广泛的应用价值。所述的醇脱氢酶能够催化浓度高达8mm的疏水性(-)-trans-异薄荷烯醇底物转化,实现80%以上的转化率,产率达到128.6mgl-1,是目前酶法合成(-)-异薄荷烯酮的最高产率。相对于母本醇脱氢酶paipdh,本发明得到的醇脱氢酶突变体具有更高的催化活性,稳定性高等优势,因此更适合运用于微生物中高效(-)-薄荷醇合成途径的构建,具有远大的前景。
附图说明
图1为本发明醇脱氢酶突变体与p450cam组合转化合成(-)-异薄荷烯酮(化合物3a)的反应过程示意图。
具体实施方式
本发明内容中所述的各反应或检测条件,可根据本领域常识进行组合或更改,并可通过实验得到验证。下面将结合具体实施例,对本发明中的技术方案和技术效果进行清楚、完整地描述,但是本发明的保护范围并不限于这些实施例,凡是不背离本发明构思的改变或等同替代均包括在本发明的保护范围之内。
下列实施例中的材料来源为:
基因组pseudomonasaeruginosa,含有如序列表seqidno.1所示的核酸序列,为发明人所在实验室提取。
空质粒载体pet28a购自novagen公司。
e.colibl21(de3)感受态细胞、primestar(hs)、taqdna聚合酶、琼脂糖凝胶dna回收试剂盒均购自北京天根生化科技有限公司。
限制性内切酶ecori、hindiii均为newenglandbiolabs(neb)公司的市售产品。
实施例中的mm为mmol/l的简写。
除非另有说明,下列实施例中的具体实验按照本领域常规方法和条件进行,或遵照试剂盒的商品说明书。
实施例1.醇脱氢酶paipdh的构建
采用pcr技术对如序列表seqidno.2所示氨基酸序列的醇脱氢酶paipdh进行构建。
使用的引物为:
上游引物序列:ccggaattcatgagcaaacttctttccggccagg。
下游引物序列:cccaagctttcagatcgccgtcgc。
其中上游引物中gaattc序列为ecori的酶切位点,下游引物中aagctt序列为hindiii的酶切位点。
以基因组pseudomonasaeruginosa为模板,用2×taqdna聚合酶进行pcr。pcr体系(20μl):2×taqdna聚合酶10μl,上下游引物(10μm)各1μl,dmso1μl,基因组pseudomonasaeruginosa2μl,加灭菌蒸馏水补足至20μl。pcr反应程序:(1)94℃预变性10min;(2)94℃变性1min;(3)55℃退火30s;(4)72℃延伸1min;步骤(2)~(4)共进行30个循环;最后72℃延伸10min,4℃保存产物。pcr产物经琼脂糖凝胶电泳分析验证后切胶纯化回收,对回收后的目的基因dna片段与空载质粒pet28a分别用限制性内切酶ecori和hindiii在37℃双酶切6h。双酶切产物经琼脂糖凝胶电泳分析验证后切胶纯化回收,用t4dna连接酶将得到的线性化pet28a质粒与纯化后的目的基因dna片段置于16℃连接过夜。将连接产物转化到大肠杆菌e.colibl21(de3)感受态细胞中,并均匀涂布于含有50μg/ml卡那霉素的lb琼脂平板上,置于37℃培养箱中静置培养约12h。
将转化平板上的转化体用枪头挑入4mllb试管中,于37℃,220rpm摇床中培养过夜。经测序验证无误后加入50%的甘油保菌,从而得到pet28a-paipdh重组菌。
实施例2.半理性设计构建醇脱氢酶paipdh突变体
在实施例1的基础上,对paipdh与其辅酶nad+进行蛋白结晶得到了paipdh-nad+晶体复合物,将paipdh结构与底物分子进行分子对接,进而对底物口袋附近的氨基酸进行丙氨酸扫描。通过pymol、swiss-model、autodockvina等软件辅助,如序列表seqidno.2所示氨基酸序列的醇脱氢酶paipdh的空间立体结构中,在底物(-)-trans-isopiperitenol的结合位点周围的氨基酸残基包括:95位谷氨酸、97位谷氨酸、98位谷氨酰胺、154位甲硫氨酸、189位缬氨酸、191位天冬氨酸、192位苏氨酸、194位甲硫氨酸、195苯丙氨酸、199位酪氨酸、208位苯丙氨酸。从丙氨酸扫描中得到敏感位点后,通过定点饱和突变和组合突变,进一步提高酶的活性。采用定点突变技术,对这些位点的氨基酸残基进行定点突变。
使用的引物如表1所示:
表1引物表
以pet28a-paipdh为模板,使用primestar(hs)premix进行pcr扩增。pcr体系为:2×primestarhspremix10μl,上下游引物各1μl,pet28a-paipdh质粒40ng,dmso1μl,加灭菌蒸馏水补足至20μl。pcr反应程序:(1)95℃预变性3min;(2)98℃变性10s;(3)55℃退火15s;(4)72℃延伸6min20s;步骤(2)~(4)共进行18个循环;最后72℃延伸10min。反应结束后,再加1μl的限制性内切酶dpni、2μl2×cutsmart到20μl的pcr产物中,并在37℃条件下保温2h,使模板充分消化降解,将消化产物转化到大肠杆菌e.colibl21(de3)感受态细胞中,并均匀涂布于含有50μg/ml卡那霉素的lb琼脂平板上,置于37℃培养箱中静置培养约12h。将所得到的单克隆菌落挑取到4mllb培养基中进行培养,于37℃,220rpm摇床中培养过夜。经测序验证无误后,得到pet28a-paipdh突变体重组菌。
将paipdh突变体蛋白从pet28a-paipdh突变体重组菌的破碎上清中纯化出来后,以nad+为辅酶,在1ml的比色皿中对表达的蛋白进行活力的测定。将含1mmol/l(-)-trans-异薄荷烯醇和10mmol/lnad+的1ml反应体系(50mmol/l甘氨酸-氢氧化钠缓冲液,ph10.0)预热至40℃,然后加入适量的醇脱氢酶突变体,40℃保温反应,在分光光度计上检测340nm处nadh的吸光度变化,记录1分钟内吸光度的变化值,计算酶活力。
通过定点突变测活,发现将醇脱氢酶paipdh的第95位谷氨酸替换为苯丙氨酸(e95f)、第189位缬氨酸替换为色氨酸(v189w)、第195位苯丙氨酸替换为色氨酸(f195w)、第199位酪氨酸替换为缬氨酸(y199v)、获得的系列醇脱氢酶突变体对(-)-trans-异薄荷烯醇的活性提高。在此基础上,对一些位点进行饱和突变,并对突变点进行组合,得到了对(-)-trans-异薄荷烯醇活性显著提高的突变体,这些突变体的序列以及这些突变体对(-)-trans-异薄荷烯醇的活性列于表2中。
表2醇脱氢酶突变体序列和相应的活性改进列表
所述醇脱氢酶paipdh突变体氨基酸具有如下序列中的一种:
(1)将如seqidno.2所示氨基酸序列的第95位谷氨酸替换为缬氨酸(e95v);
(2)将如seqidno.2所示氨基酸序列的第95位谷氨酸替换为苯丙氨酸(e95f);
(3)将如seqidno.1所示氨基酸序列的第97位谷氨酸替换为甲硫氨酸(e97m);
(4)将如seqidno.2所示氨基酸序列的第154位甲硫氨酸替换为组氨酸(m154h);
(5)将如seqidno.2所示氨基酸序列的第189位缬氨酸替换为色氨酸(v189w);
(6)将如seqidno.2所示氨基酸序列的第189位缬氨酸替换为异亮氨酸(v189i);
(7)将如seqidno.2所示氨基酸序列的第191位天冬氨酸替换为缬氨酸(d191v);
(8)将如seqidno.2所示氨基酸序列的第194位甲硫氨酸替换为赖氨酸(m194k);
(9)将如seqidno.2所示氨基酸序列的第194位甲硫氨酸替换为天冬酰胺(m194n);
(10)将如seqidno.2所示氨基酸序列的第195位苯丙氨酸替换为色氨酸(f195w);
(11)将如seqidno.2所示氨基酸序列的第195位苯丙氨酸替换为甲硫氨酸(f195m);
(12)将如seqidno.2所示氨基酸序列的第199位酪氨酸替换为缬氨酸(y199v);
(13)将如seqidno.2所示氨基酸序列的第199位酪氨酸替换为组氨酸(y199h);
(14)将如seqidno.2所示氨基酸序列的第95位谷氨酸替换为缬氨酸(e95v),第208位苯丙氨酸替换为组氨酸(f208h);
(15)将如seqidno.2所示氨基酸序列的第97位谷氨酸替换为甲硫氨酸(e97m),第154位甲硫氨酸替换为组氨酸(m154h);
(16)将如seqidno.2所示氨基酸序列的第194位甲硫氨酸替换为赖氨酸(m194k),第199位酪氨酸替换成色氨酸(y199w);
(17)将如seqidno.2所示氨基酸序列的第194位甲硫氨酸替换为赖氨酸(m194k),第199位酪氨酸替换成组氨酸(y199h),第208位苯丙氨酸替换为组氨酸(f208h);
(18)将如seqidno.2所示氨基酸序列的第95位谷氨酸替换成苯丙氨酸(e95f),第189位缬氨酸替换为色氨酸(v189w),第195位苯丙氨酸替换为色氨酸(f195w),第199位酪氨酸替换成缬氨酸(y199v)。
实施例3.重组酶paipdh突变体e95f/v189w/f195w/y199v的表达与纯化
将实施例2中所得的表达菌株e.coli/pet28a-paipdhe95f/v189w/f195w/y199v接种于含有50μg/ml卡那霉素的lb液体培养基(胰蛋白胨:10g/l,酵母提取物:5g/l,nacl:10g/l)中,于37℃,220rpm震荡培养24h,按1%的接种量接种至100ml含有50μg/ml卡那霉素的tb液体培养基(胰蛋白胨:12g/l,酵母提取物:24g/l,甘油:4ml/l,kh2po4:2.31g/l,k2hpo412.54g/l)中,置于37℃,220rpm摇床中培养,当培养液的光密度od600达到0.6-0.8时,加入0.2mm的iptg进行诱导,在16℃持续培养、诱导20-24h。培养结束后,将培养液于4℃、8000×g离心后去除上清,用0.9%生理盐水清洗菌体,洗涤两遍。再以纯化缓冲液a(0.59g/lnah2po4·2h2o,5.8g/lna2hpo4·12h2o,500mmnacl,5mm咪唑,375μl/lβ-巯基乙醇,ph7.4)重悬菌体,细胞与缓冲液的比例为1:20(g/ml)。重悬结束后超声破碎细胞(260w,工作4s,间歇6s)。将破碎液于4℃、8000×g离心后去除沉淀,得到含蛋白的上清液。将含目标蛋白的上清液倒入到提前用纯化缓冲液a平衡的镍柱上。以纯化缓冲液b(0.59g/lnah2po4·2h2o,5.8g/lna2hpo4·12h2o,500mmnacl,500mm咪唑,375μl/lβ-巯基乙醇,ph7.4-7.6)与纯化缓冲液a预混为咪唑浓度为0~250mm梯度洗脱。以垂直电泳仪进行sds-page,分离胶浓度为12.5%,检测收集的洗脱蛋白,结果表明通过上述方法获得的突变体纯度超过90%,分子量大小为30kda左右。收集合适的洗脱液,利用10kda超滤膜于4℃超滤浓缩,并利用纯化缓冲液c(0.59g/lnah2po4·2h2o,5.8g/lna2hpo4·12h2o,200mmnacl,2mmdtt)脱咪唑,最后利用10kda超滤膜于4℃超滤浓缩至1ml的蛋白液,加入20%的甘油后置于-80℃备用。
实施例4重组羟基脱氢酶paipdh及突变体e95f/v189w/f195w/y199v催化底物的脱氢反应活力
酶活力测定在1ml比色皿中进行,在740μl甘氨酸-naoh缓冲液(50mm,ph10.0)中加入10μl100mm的系列底物(其结构如表3所示),200μl50mm的nad+,50μl稀释的纯酶。40℃下在分光光度计上检测340nm处nadh的吸光度变化,记录1分钟内吸光度的变化值,计算酶活力。
表3paipdh催化系列底物的活力
实施例5重组羟基脱氢酶paipdhe95f/v189w/f195w/y199v催化合成(-)-异薄荷烯酮
将pet21a-p450camy96f/y247l-pdx-pdr以及pet28a-paipdh突变体pet28a-paipdhe95f/v189w/f195w/y199v这两种不同抗性的质粒导入到大肠杆菌bl21(de)中,而后涂板到双抗的平板上,37℃培养12h。将所得到的单克隆菌落挑取到含100μg/ml氨苄霉素和50μg/ml卡那霉素的4mllb培养基中进行培养,于37℃,220rpm摇床中培养过夜。以1%的接种量从试管中吸取菌液接到含100μg/ml氨苄霉素和50μg/ml卡那霉素的摇瓶lb培养基中,在37℃培养到od600为0.8后,加入0.2mmiptg,0.1mmfecl3和0.2mm5-氨基酮戊酸诱导,然后在16℃,180rpm继续培养24h。培养结束后,将培养液于4℃、8000×g离心后去除上清,用0.9%生理盐水清洗菌体,洗涤两次。将收获的菌体沉淀用50mmkpb(ph7.6)重悬,细胞含量为20g/l,将1l细胞悬浮液加入到5l三口烧瓶中,然后加入158.9mg(-)-柠檬烯(终浓度8mm),25℃,200rpm反应18小时,(-)-异薄荷烯酮产物浓度为128.6mgl-1,。反应结束后,用等体积的乙酸乙酯萃取产物、无水硫酸钠干燥8小时,20℃减压旋转蒸发去除溶剂得到黄色粗产物。将9批反应得到的所有粗产物合并后通过硅胶柱层析纯化得到产物(-)-异薄荷烯酮,流动相为石油醚/乙酸乙酯,比例为100:1。分离得微黄色液体529.5mg,分离产率为41%,纯度大于92%。
以上实施例4-实施例5是以突变体e95f/v189w/f195w/y199v(即将如seqidno.2所示氨基酸序列的第95位谷氨酸替换成苯丙氨酸,第189位缬氨酸替换为色氨酸,第195位苯丙氨酸替换为色氨酸,第199位酪氨酸替换成缬氨酸)为例来说明其催化底物的脱氢反应活力、催化合成(-)-异薄荷烯酮等方面的具体应用。需要说明的是:如表2所示,突变体e95f/v189w/f195w/y199v只是本发明多种醇脱氢酶突变体中的其中一种,由表2可知,其他种类的醇脱氢酶突变体同样比seqidno.2所示氨基酸序列组成的蛋白质的比活力提高很多,所以,本领域技术人员知晓,其他种类的醇脱氢酶突变体同样可以催化底物的脱氢反应活力、催化合成(-)-异薄荷烯酮,并具有优于seqidno.2所示氨基酸序列组成的蛋白质的技术效果。本发明实施例中只是以突变体e95f/v189w/f195w/y199v为例来说明而已。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
序列表
<110>华东理工大学、苏州百福安酶技术有限公司
<120>醇脱氢酶突变体及其在环状萜烯酮合成中的应用
<160>3
<170>siposequencelisting1.0
<210>1
<211>762
<212>dna
<213>pseudomonasaeruginosa
<400>1
atgagcaaacttctttccggccaggtcgcgctggtcactggcggtgcggcgggcatcggc60
cgcgctaccgcgcaggccttcgccgccgccggggtcaaggtggtggtcgccgacctggac120
agcgccggcggcgagggcacggtcgaagcgatccgccaggcaggtggcgaagccgtcttc180
attcgctgcgacgtcacccgcgacgccgaggtcaaggcgctggtagagggttgcgcggcg240
gcctacggccgtctcgactacgccttcaacaacgccggtatcgagatcgagcagggcaag300
ctggccgacggcaacgaagccgagttcgacgccatcatggctgtcaacgtgaagggcgtc360
tggttgtgcatgaagcaccagatcccgctgatgctggcccagggcggtggcgcgatcgtc420
aacaccgcctcggtcgccgggctcggcgcggcgccgaagatgagcatctacgctgcttcc480
aagcacgcggtgatcggcctgaccaaatcggcggcgatcgagtacgcgaagaagggcatc540
cgcgtcaacgccgtgtgtccggcggtgatcgacaccgacatgttccgccgcgcctacgag600
gccgatccgcgcaaggccgagttcgccgccgcgatgcatccgctgggtcgggtcgggcgg660
gtcgaagaaatcgccgccgcggtgctctatctgtgcagcgacaacgcaggcttcaccacc720
ggtatcgccttgccggtggacggcggggcgacggcgatctga762
<210>2
<211>253
<212>prt
<213>pseudomonasaeruginosa
<400>2
metserlysleuleuserglyglnvalalaleuvalthrglyglyala
151015
alaglyileglyargalathralaglnalaphealaalaalaglyval
202530
lysvalvalvalalaaspleuaspseralaglyglygluglythrval
354045
glualaileargglnalaglyglyglualavalpheileargcysasp
505560
valthrargaspalagluvallysalaleuvalgluglycysalaala
65707580
alatyrglyargleuasptyralapheasnasnalaglyilegluile
859095
gluglnglylysleualaaspglyasnglualaglupheaspalaile
100105110
metalavalasnvallysglyvaltrpleucysmetlyshisglnile
115120125
proleumetleualaglnglyglyglyalailevalasnthralaser
130135140
valalaglyleuglyalaalaprolysmetseriletyralaalaser
145150155160
lyshisalavalileglyleuthrlysseralaalaileglutyrala
165170175
lyslysglyileargvalasnalavalcysproalavalileaspthr
180185190
aspmetpheargargalatyrglualaaspproarglysalagluphe
195200205
alaalaalamethisproleuglyargvalglyargvalglugluile
210215220
alaalaalavalleutyrleucysseraspasnalaglyphethrthr
225230235240
glyilealaleuprovalaspglyglyalathralaile
245250
<210>3
<211>2879
<212>dna
<213>人工序列(artificialsequence)
<400>3
atgacgactgaaaccatacaaagcaacgccaatcttgcccctctgccaccccatgtgcca60
gagcacctggtattcgacttcgacatgtacaatccgtcgaatctgtctgccggcgtgcag120
gaggcctgggcagttctgcaagaatcaaacgtaccggatctggtgtggactcgctgcaac180
ggcggacactggatcgccactcgcggccaactgatccgtgaggcctatgaagattaccgc240
cacttttccagcgagtgcccgttcatccctcgtgaagccggcgaagcctttgacttcatt300
cccacctcgatggatccgcccgagcagcgccagtttcgtgcgctggccaaccaagtggtt360
ggcatgccggtggtggataagctggagaaccggatccaggagctggcctgctcgctgatc420
gagagcctgcgcccgcaaggacagtgcaacttcaccgaggactacgccgaacccttcccg480
atacgcatcttcatgctgctcgcaggtctaccggaagaagatatcccgcacttgaaatac540
ctaacggatcagatgacccgtccggatggcagcatgaccttcgcagaggccaaggaggcg600
ctctacgactatctgataccgatcatcgagcaacgcaggcagaagccgggaaccgacgct660
atcagcatcgttgccaacggccaggtcaatgggcgaccgatcaccagtgacgaagccaag720
aggatgtgtggcctgttactgctgggcggcctggatacggtggtcaatttcctcagcttc780
agcatggagttcctggccaaaagcccggagcatcgccaggagctgatcgagcgtcccgag840
cgtattccagccgcttgcgaggaactactccggcgcttctcgctggttgccgatggccgc900
atcctcacctccgattacgagtttcatggcgtgcaactgaagaaaggtgaccagatcctg960
ctaccgcagatgctgtctggcctggatgagcgcgaaaacgcctgcccgatgcacgtcgac1020
ttcagtcgccaaaaggtttcacacaccacctttggccacggcagccatctgtgccttggc1080
cagcacctggcccgccgggaaatcatcgtcaccctcaaggaatggctgaccaggattcct1140
gacttctccattgccccgggtgcccagattcagcacaagagcggcatcgtcagcggcgtg1200
caggcactccctctggtctgggatccggcgactaccaaagcggtatgagaattcaaggag1260
atataccatgtctaaagtagtgtatgtgtcacatgatggaacgcgtcgcgaactggatgt1320
ggcggatggcgtcagcctgatgcaggctgcagtctccaatggtatctacgatattgtcgg1380
tgattgtggcggcagcgccagctgtgccacctgccatgtctatgtgaacgaagcgttcac1440
ggacaaggtgcccgccgccaacgagcgggaaatcggcatgctggagtgcgtcacggccga1500
actgaagccgaacagcaggctctgctgccagatcatcatgacgcccgagctggatggcat1560
cgtggtcgatgttcccgataggcaatggtaagagctcaaggagatataccatgaacgcaa1620
acgacaacgtggtcatcgtcggtaccggactggctggcgttgaggtcgccttcggcctgc1680
gcgccagcggctgggaaggcaatatccggttggtgggggatgcgacggtaattccccatc1740
acctaccaccgctatccaaagcttacttggccggcaaagccacagcggaaagcctgtacc1800
tgagaaccccagatgcctatgcagcgcagaacatccaactactcggaggcacacaggtaa1860
cggctatcaaccgcgaccgacagcaagtaatcctatcggatggccgggcactggattacg1920
accggctggtattggctaccggagggcgtccaagacccctaccggtggccagtggcgcag1980
ttggaaaggcgaacaactttcgatacctgcgcacactcgaggacgccgagtgcattcgcc2040
ggcagctgattgcggataaccgtctggtggtgattggtggcggctacattggccttgaag2100
tggctgccaccgccatcaaggcgaacatgcacgtcaccctgcttgatacggcagcccggg2160
ttctggagcgggttaccgccccgccggtatcggccttttacgagcacctacaccgcgaag2220
ccggcgttgacatacgaaccggcacgcaggtgtgcgggttcgagatgtcgaccgaccaac2280
agaaggttactgccgtcctctgcgaggacggcacaaggctgccagcggatctggtaatcg2340
ccgggattggcctgataccaaactgcgagttggccagtgcggccggcctgcaggttgata2400
acggcatcgtgatcaacgaacacatgcagacctctgatcccttgatcatggccgtcggcg2460
actgtgcccgatttcacagtcagctctatgaccgctgggtgcgtatcgaatcggtgccca2520
atgccttggagcaggcacgaaagatcgccgccatcctctgtggcaaggtgccacgcgatg2580
aggcggcgccctggttctggtccgatcagtatgagatcggattgaagatggtcggactgt2640
ccgaagggtacgaccggatcattgtccgcggctctttggcgcaacccgacttcagcgttt2700
tctacctgcagggagaccgggtattggcggtcgatacagtgaaccgtccagtggagttca2760
accagtcaaaacaaataatcacggatcgtttgccggttgaaccaaacctactcggtgacg2820
aaagcgtgccgttaaaggaaatcatcgccgccgccaaagctgaactgagtagtgcctga2879
- 还没有人留言评论。精彩留言会获得点赞!