含有三苯胺乙烯侧链的香豆素类绿光染料的制作方法
本发明涉及用于平面显示的新型有机色转换膜材料,具体涉及一类含有三苯胺乙烯侧链的香豆素类绿光染料,通过溶液旋涂制成薄膜,可应用于平面显示。
背景技术:
随着显示行业技术的不断突破和市场需求的日益增加,平板显示器以其体积小、重量轻、耗电省、辐射小、电磁兼容性好等一系列优点迅速崛起,成为21世纪显示技术的主流。平板显示器的成彩方式在其生产过程中起着非常重要的作用,它的好坏直接决定了平板显示器的显色效果,生产成本以及使用寿命。
目前平板显示器实现彩色显示的主流技术是印刷红、绿、蓝三基色荧光材料制备器件,然而,由于三基色荧光材料的寿命和衰减度差异较大,很容易造成彩色显示器的偏色,而且三原色器件的制作工艺比较复杂,成本较高。为了解决这些问题,人们开提出了一种色彩转换的新思路即“蓝源成彩”。“蓝源成彩”技术采用具有单一高亮度的蓝色荧光体作为背光源,背光源发出的蓝光经过色彩转换膜后转变成红光和绿光,从而实现RGB全彩显示。这一技术不仅可以大大简化电致发光平面显示器的生产工艺,提高显示器的色彩稳定性及均匀性,而且还能显著降低显示器的生产成本。用于色彩转换膜的材料可分为无机和有机两大类。经研究发现,相对于无机荧光粉,有机转换材料不仅具有更高的色彩转换效率,颜色也更饱和,从而可以实现更宽的色域,而且原料廉价易得,更容易进行分子的剪裁和修饰以获得更好的显示效果。
20世纪90年代,Leising团队采用香豆素类染料Coumarin 102为绿光材料,Lumogen F300为红光染料分散在PMMA中制备了绿色、红色光转换膜,获得了大于10%的红光转换效率(参考文献:Adv.Mater.,1997,9(1),33-36)。近年来国内研究团队也对有机光转换膜的制备进行了报道(参考文献:Optoelectronics Letters,2010,6(4),245-248,CN105267059A,CN103647003A),得到了色域广,光转化率高的有机光转换膜。然而这些传统的染料分子对加工工艺十分敏感,采用不同温度加工或曝光后其发光颜色会产生很大变化(参考文献:Abstract,2354,218th ECS Meeting),因此开发对环境稳定的光转换材料十分必要。
有机荧光色彩转换膜一般是将具有不同颜色的有机荧光染料通过紫外固化或热固化等方式均匀地分散在高分子固体薄膜中,再以高亮度的蓝色背光源激发有机荧光色彩转换膜中的染料分子以实现颜色的转变,转换得到的红光、绿光与背景的蓝光形成光的三种基色,最终可以实现电致发光元件的全彩色显示。
技术实现要素:
针对上述光转换膜材料,本发明提供一种具有三苯胺乙烯侧链的香豆素类绿光染料分子,将其分散在甲基丙烯酸甲酯(PMMA)等高分子树脂中固化制备了光转换膜。该材料发光强,对制备工艺不敏感,在较大参杂浓度和温度范围内其发射光谱都很稳定。
含有三苯胺乙烯侧链的香豆素类绿光染料,其分子结构如式(I)所述,
其中,R1、R2和R3独立地表示为氢、取代或者未取代的C1-C8烷基、C1-C8烷氧基或卤素。
优选:其中,R1、R2和R3独立地表示为氢、取代或者未取代的C1-C4烷基或烷氧基。
优选:其中R1和R2独立地表示为氢、C1-C4的烷氧基,R3独立地表示为取代或者未取代的C1-C4烷基。
优选:R1、R2相同。
优选:其中,R1和R2优选表示为氢、甲氧基,R3独立地表示为甲基。
式(I)所述的化合物优选为具有下列结构的化合物:
上述的绿光染料的制备方法,采用式A与式B通过Heck偶联反应制备得到:
所述式A的制备方法为采用下式中C溴代而得到,反应式如下:
所述式B的制备方法为在弱碱性条件下采用下式D与乙烯基氟硼酸钾反应制得,所述催化剂为四三苯基膦钯,反应式如下:
光转换膜,由上述绿光染料与固化的高分子树脂组成。
所述固化的高分子树脂是丙烯酸酯、环氧树脂或聚氨酯。
所述光转换膜总厚度为1-100μm。
上述绿光染料在光转换膜中的应用。
所述应用为将上述绿光染料与固化的高分子树脂溶于甲苯后,再旋涂成膜,烘干后固化制备有机光转换膜,固定在背光源上,应用于平面显示中,以实现全彩显示。
所述光转换膜的固化制备方法可以是热固化或紫外光固化。
所述背光源为蓝光光源,固化的高分子树脂为甲基丙烯酸甲酯(PMMA)高分子树脂。
所述蓝光光源是液晶面板、OLED或者无机LED光源。
具有式(1)所示的分子具有高的荧光量子产率,在绿光光转换膜材料方面具有很好的应用潜力。该材料发光强,对制备工艺不敏感,在较大参杂浓度和温度范围内其发射光谱都很稳定。
附图说明
图1本发明所述绿光染料GT1的合成路线示意图
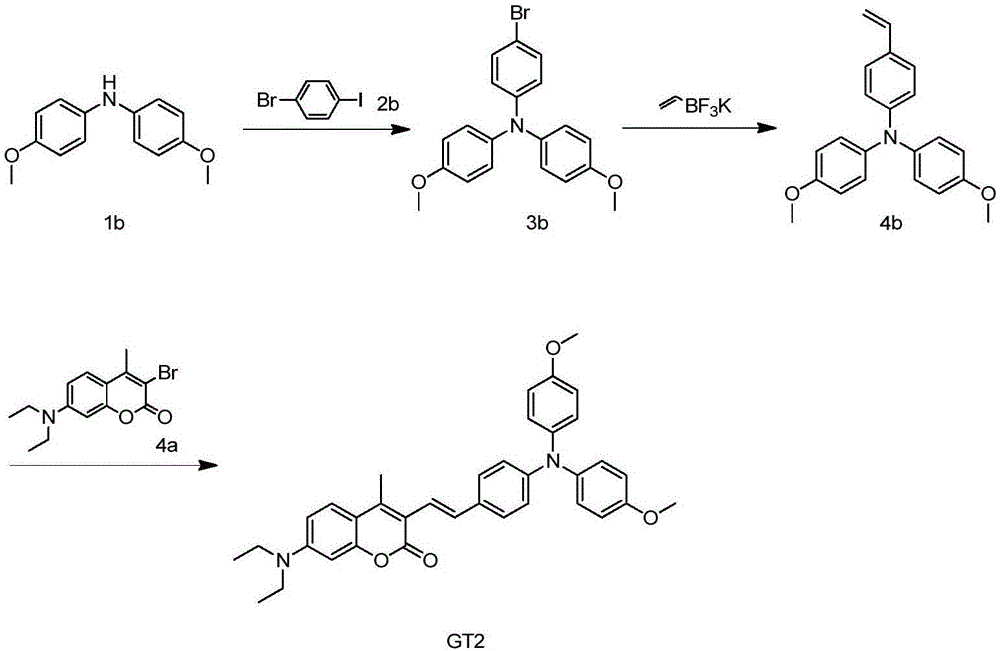
图2本发明所述绿光染料GT2的合成路线示意图;
图3本发明所述绿光染料GT1在甲苯、二氯甲烷以及PMMA薄膜和固态时的紫外-可见吸收光谱;
图4本发明所述绿光染料GT1在甲苯、二氯甲烷以及PMMA薄膜和固态时的荧光发射光谱,
图5本发明所述绿光染料GT2在甲苯、二氯甲烷以及PMMA薄膜和固态时的紫外-可见吸收光谱;
图6本发明所述绿光染料GT2在甲苯、二氯甲烷以及PMMA薄膜和固态时的荧光发射光谱。
图7经典绿光染料C545T以不同比例参杂在PMMA中制成光转换膜薄膜的荧光发射光谱。
图8以本发明中的绿光染料GT2制备的光转换膜的荧光发射光谱。
具体实施方式
为了更详细叙述本发明,特举以下例子,但是不限于此。
染料分子均通过Heck偶联反应制备:
实施例1绿光染料GT1的合成:
其合成路线见图1所示。
(1)化合物2a的合成
合成步骤:向250mL反应烧瓶中加入化合物1a(6.48g,20mmol)(市售),乙烯基氟硼酸钾(3.22g,24mmol),四三苯基膦钯(8.3g,5%),K2CO3(6.48g,60mmol),甲苯(70mL)和水(14mL)。氮气排空3次,加热升温至80℃,保持此温度,反应8小时,TLC检测化合物1a反应完全。
反应后处理:停止加热,降温至20℃,将反应液倒入水中,EA(100mL*3)萃取分液,合并有机层,用无水硫酸钠干燥后减压蒸干。粗品柱层析得到白色的化合物2a(4g,产率73.7%)。1H NMR(400MHz,CHLOROFORM-d)ppm 5.15(d,J=10.88Hz,1H)5.63(d,J=17.61Hz,1H)6.66(dd,J=17.48,10.88Hz,1H)6.92-7.05(m,4H)7.09(d,J=8.19Hz,4H)7.19-7.38(m,6H)。
(2)化合物4a的合成
合成步骤:向250mL反应烧瓶中加入化合物3a(7g,30mmol)(市售),NBS(5.9g,39mmol)和氯仿(50mL)。室温反应2小时,TLC检测化合物3a反应完全。
反应后处理:停止反应,将反应液倒入水中,二氯甲烷(100mL*2)萃取分液,合并有机层,用无水硫酸钠干燥后减压蒸干。粗品柱层析得到浅黄色的化合物4a(5g,产率53.7%)。1H NMR(400MHz,CHLOROFORM-d)ppm 1.21(t,J=7.09Hz,6H)2.45-2.62(m,3H)3.32-3.50(m,4H)6.49(d,J=2.57Hz,1H)6.60(dd,J=9.05,2.57Hz,1H)7.43(d,J=9.05Hz,1H)。
(3)GT1的合成
合成步骤:向250mL反应烧瓶中加入化合物4a(0.31g,1mmol),化合物2a(0.352g,1.3mmol)Pd2(dba)3(15mg,5%),三叔丁基膦(30mg,10%),三乙胺(0.6mL)和DMF(5mL)。氮气排空3次,加热升温至100℃,保持此温度,反应12小时,TLC检测化合物4a反应完全。
反应后处理:停止加热,降温至20℃,将反应液倒入水中,乙酸乙酯(50mL*2)萃取分液,合并有机层,用无水硫酸钠干燥后减压蒸干。粗品柱层析得到浅黄色的化合物GT1(0.15g,产率30%)。
1H NMR(400MHz,CHLOROFORM-d)ppm 1.22(t,J=7.03Hz,7H)2.50(s,3H)3.42(q,J=7.05Hz,4H)6.51(s,1H)6.61(d,J=9.17Hz,1H)6.97-7.07(m,6H)7.11(d,J=7.95Hz,4H)7.23(br.s.,2H)7.27(s,1H)7.40(d,J=8.31Hz,2H)7.47(d,J=8.93Hz,1H)7.56(d,J=16.14Hz,1H)。
实施例2绿光染料GT2的合成:
其合成路线见图2所示。
(1)化合物3b的合成
合成步骤:向250mL反应烧瓶中加入化合物1b(4.58g,20mmol)(市售),化合物2b(市售)(8.5g,30mmol),Pd2(dba)3(920mg,5%),三叔丁基膦(400mg,10%),叔丁醇钠(4.58g,40mmol)和甲苯(100mL)。氮气排空3次,加热升温至110℃,保持此温度,反应12小时,TLC检测化合物1b反应完全。
反应后处理:停止加热,降温至20℃,将反应液倒入水中,乙酸乙酯(10mL*2)萃取分液,合并有机层,用无水硫酸钠干燥后减压蒸干。粗品经柱层析得到浅黄色的化合物3b(4.3g,产率56.4%)。1H NMR(400MHz,CHLOROFORM-d)ppm 3.79(s,6H)6.67-6.88(m,6H)7.02(d,J=8.93Hz,4H)7.23(d,J=8.80Hz,2H)。
(2)化合物4b的合成
合成步骤:向250mL反应烧瓶中加入化合物3b(4g,10.4mmol),乙烯基氟硼酸钾(1.67g,12.5mmol),四三苯基膦钯(580mg,5%),K2CO3(3.24g,30mmol),甲苯(100mL)和水(20mL)。氮气排空3次,加热升温至80℃,保持此温度,反应8小时,TLC检测化合物3b反应完全。反应后处理:停止加热,降温至20℃,将反应液倒入水中,EA(100mL*3)萃取分液,合并有机层,用无水硫酸钠干燥后减压蒸干。粗品柱层析得到白色的化合物4b(2.8g,产率81.2%)。1H NMR(400MHz,CHLOROFORM-d)ppm 3.79(s,6H)5.09(d,J=10.88Hz,1H)5.58(d,J=17.61Hz,1H)6.51-6.70(m,1H)6.73-6.84(m,5H)6.87(d,J=8.56Hz,1H)6.95-7.09(m,4H)7.14-7.25(m,2H)。
(3)GT2的合成
合成步骤:向250mL反应烧瓶中加入化合物4b(1g,3.2mmol)(市售),化合物4a(1.42g,4.2mmol)Pd2(dba)3(50mg,5%),三叔丁基膦(200mg,10%),三乙胺(5mL)和DMF(10mL)。氮气排空3次,加热升温至100℃,保持此温度,反应12小时,TLC检测化合物4a反应完全。反应后处理:停止加热,降温至20℃,将反应液倒入水中,乙酸乙酯(50mL*2)萃取分液,合并有机层,用无水硫酸钠干燥后减压蒸干。粗品柱层析得到浅黄色的化合物GT2(0.55g,产率30.7%)。
1H NMR(400MHz,CHLOROFORM-d)ppm 1.21(t,J=7.03Hz,6H)2.49(s,3H)3.42(q,J=7.01Hz,4H)3.80(s,6H)6.50(d,J=2.45Hz,1H)6.61(dd,J=8.93,2.32Hz,1H)6.83(d,J=8.93Hz,4H)6.90(d,J=8.56Hz,2H)7.00(d,J=16.26Hz,1H)7.06(d,J=8.93Hz,4H)7.34(d,J=8.68Hz,2H)7.46(d,J=9.05Hz,1H)7.49-7.57(m,1H)。
实施例3绿光染料GT1和GT2的光物理性质测试:
绿光染料GT1和GT2在溶液中的光物理性质测试是将相应的染料溶于甲苯或二氯甲烷,溶液的浓度为1×10-5mol/L,基于染料的CCF薄膜是将染料和相应比例的PMMA溶于甲苯,经旋涂然后烘干制备,染料薄膜的光物理性质是将染料溶于THF后旋涂制备薄膜后测得。以GT1和GT2制备的CCF膜对背景蓝光(λmax≈450nm)有很好的吸收,见图3、图5,发射出的光为绿光,见图4、图6。GT1和GT2具有很强的发光(量子产率EQE接近70%),对制备工艺不敏感,在较大参杂浓度和温度范围内其发射光谱都很稳定。图7是经典绿光染料C545T以不同比例参杂在PMMA中制成光转换膜薄膜的荧光发射光谱,可以看到参杂比例的微小变化都会导致其发光光谱产生很大改变,其发光稳定性很差,图8是以本发明中的绿光染料GT2制备的光转换膜的荧光发射光,可以看到将其以不同浓度分散在PMMA中,它的光谱十分稳定。
- 还没有人留言评论。精彩留言会获得点赞!