一种具有可见光催化活性的BiOCl及其制备方法与流程
本发明涉及一种具有可见光催化活性的纳米材料,特别是一种具有可见光催化活性的BiOCl及其制备方法。
背景技术:
光催化技术以其可利用太阳能、清洁高效等优势在环境净化、燃料电池等领域得到了广泛的关注与研究,具有广阔的应用前景。光催化剂的选择是影响光催化技术应用的重要因素,几十年来广受关注与应用的纳米TiO2虽然具有高效、无毒、稳定性好、成本低等优点,但是常用的锐钛矿型TiO2的禁带宽度较宽(3.2 eV),只能吸收太阳光中3%~5%的紫外光,限制了其实际应用。为了使其具备可见光活性,金属沉积(Lv et al., Appl. Catal. B, 2016, 194, 150–156)、离子掺杂(Leyland et al., Sci. Rep.,2016, 6, 24770)、复合窄禁带半导体(Liu et al., ChemSusChem, 2016, 9, 1118–1124)等方法被用来改性TiO2,但是也存在制备过程复杂等问题。
BiOCl是近十年来发现的一种较为新型的光催化剂,具有由双Cl-离子层和[Bi2O2]2+层交替排列构成的层状结构,该独特的开放式层状结构有利于光生电子-空穴的分离,表现出比TiO2更高的催化降解污染物能力(Zhang et al., Appl. Catal. B, 2006, 68, 125–129)。但是,纯BiOCl也存在两个问题:一是禁带宽度较宽,根据制备方法等不同而波动在3.2-3.4 eV之间,即只具有紫外光活性,对太阳能的利用也较低;二是量子效率仍有待提高。
为了提高BiOCl的可见光催化活性及量子效率,研究者采取了各种方法,如构建表面氧空位(Sarwan et al., Mat. Sci. Semicon. Proc., 2014, 25, 89–97)、复合半导体(Li et al., Appl. Catal. B, 2014, 150, 574–584)、暴露高活性{001}晶面(Peng et al., CrystEngComm, 2015, 17, 3845–3851)等。而同时利用一步法合成同时具有表面氧空位和{001}晶面暴露的BiOCl尚未见报道。
燃烧合成是一种快速合成方法,原料一般为硝酸盐及尿素、氨基乙酸、柠檬酸等含氮有机物,利用硝酸盐和燃料之间的氧化还原反应所放出的热量直接促进硝酸盐的分解及氧化物之间的反应,得到所需的材料(ZL201410322255.X),且该方法无需复杂设备,耗时短,易于工业化生产。在燃烧合成中,煅烧气氛中的氧和材料表面的氧原子应有一个化学平衡态,即煅烧处于缺氧的还原气氛时,材料表面的氧原子即逸出,形成表面氧空位(Li et al., Nanoscale, 2015, 7, 17590–17610)。因此如能燃烧法一步构建具有表面氧空位的BiOCl材料,则不仅可以利用氧空位的低导带位置降低BiOCl的禁带宽度,氧空位还可以吸附光生电子和污染物、提高反应效率,而且也可以拓宽燃烧合成的应用。
技术实现要素:
本发明的目的是提供一种具有可见光催化活性的BiOCl及其制备方法。
本发明的目的是这样实现的。一种具有可见光催化活性的BiOCl,同时具有表面氧空位及{001}活性晶面高度暴露。
优选的,本发明的具有可见光催化活性的BiOCl的禁带宽度为2.72 eV、{001}与{101}晶面的强度比为2.07。
燃烧合成是一种快速合成方法,原料一般为硝酸盐及尿素、氨基乙酸、柠檬酸等含氮有机物,利用硝酸盐和燃料之间的氧化还原反应所放出的热量直接促进硝酸盐的分解及氧化物之间的反应,得到所需的材料(ZL201410322255.X),且该方法无需复杂设备,耗时短,易于工业化生产。在燃烧合成中,煅烧气氛中的氧和材料表面的氧原子应有一个化学平衡态,即煅烧处于缺氧的还原气氛时,材料表面的氧原子即逸出,形成表面氧空位(Li et al., Nanoscale, 2015, 7, 17590–17610)。因此如能燃烧法一步构建具有表面氧空位的BiOCl材料,则不仅可以利用氧空位的低导带位置降低BiOCl的禁带宽度,氧空位还可以吸附光生电子和污染物、提高反应效率,而且也可以拓宽燃烧合成的应用。
本发明的一种具有可见光催化活性的BiOCl的制备方法,包括以下步骤:
(1)将硝酸铋和盐酸二乙胺按照摩尔比为1:(1.0~1.6)的比例混合,加热至熔化,得到离子液体;
(2)将步骤(1)所得的离子液体继续加热至燃烧完全;
(3)收集步骤(2)燃烧完全后产生的固体,冷却、研磨,得到由BiOCl和Al2O3组成的异质结。
优选的,步骤(1)中加热温度为100~300 ℃。
优选的,步骤(2)中的加热升温速率为5~50 ℃/min。
本发明制备BiOCl纳米粉体采用离子溶液自燃烧法,即将硝酸铋与盐酸二乙胺((C2H5)2NH·HCl)混合并加热形成离子液体,以硝酸铋和盐酸二乙胺摩尔比1:1为例,该离子液体形成方程式如下式所示:
Bi(NO3)3+(C2H5)2NH·HCl=[(C2H5)2NH·H]++[Bi(NO3)3Cl]- (1)
本发明中,(C2H5)2NH·HCl不仅起着为离子液体提供Cl离子和本身起到阳离子的作用,还可以起到燃料的作用。燃烧反应如式(2)所示:
Bi(NO3)3+(C2H5)2NH·HCl+3O2=BiOCl+4CO2+6H2O+2N2 (2)
由式(2)可见,该反应为耗氧反应,当空气中的氧不能提供足够的氧时,则形成还原煅烧气氛,材料表面的氧原子会逸出,从而形成表面氧空位。
本发明取得的有益效果在于:①克服了其他燃烧法中需要加入水形成溶液的缺陷,如水的加入会降低热效率而且随温度升高而蒸发,造成体系不稳定;②表面氧空位可以原位生成,方法简便;③盐酸二乙胺还可以诱导{001}晶面的暴露,进一步加速了光生电子沿{001}晶面的传递,提高了量子效率和光催化活性;④合成过程简单,几分钟之内即可形成,适合于工业化批量生产。
附图说明
图1为实施例1~例4所制备的BiOCl的X射线衍射(XRD)图谱。
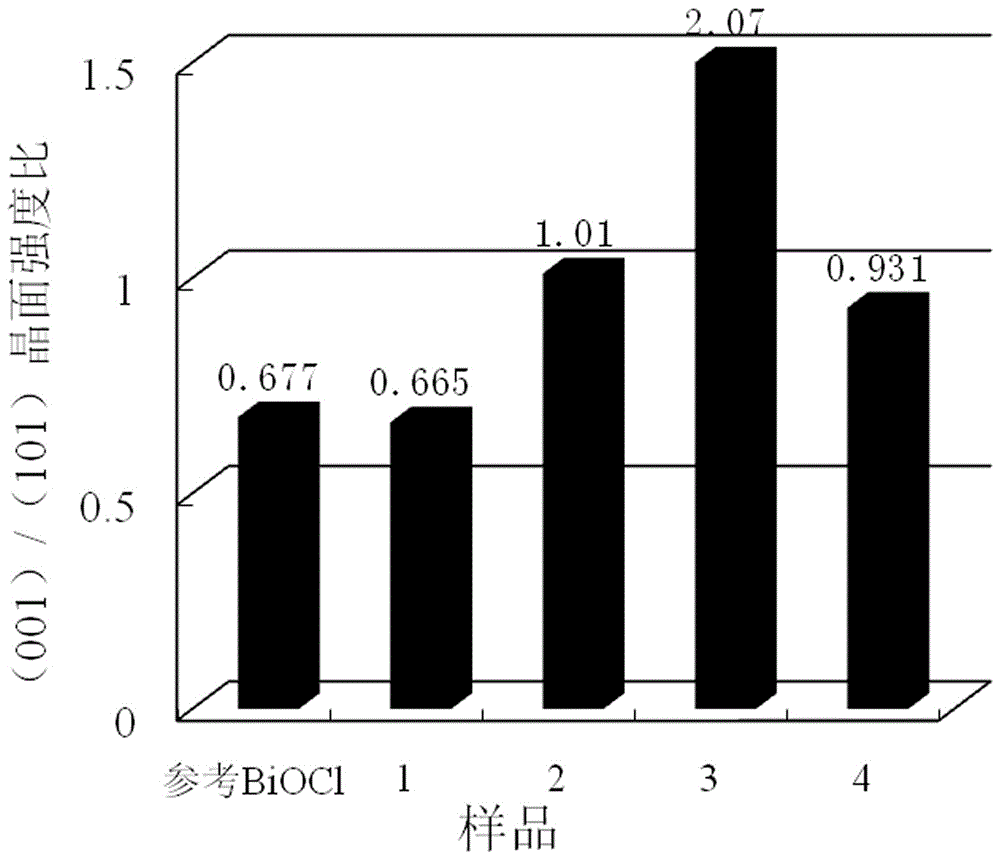
图2为参考BiOCl(由JCPDS NO. 01-082-0485卡片数据所得)及实施例1~例4的{001}/{101}晶面强度比例。
图3a为实施例1~例4所制备的BiOCl的紫外-可见漫反射(UV-Vis DRS)图谱,图3b为实施例1和例3所制备的BiOCl的禁带宽度图谱。
图4为实施例1和实施例3所制备的BiOCl的扫描电子显微镜(SEM)图谱。
图5为实施例1和实施例3所制备的BiOCl的高倍透射电镜(HRTEM)图谱。
图6实施例1和实施例3所制备的BiOCl的电子顺磁共振(ESR)图谱。
图7为实施例1~例4所制备的BiOCl的光催化降解次甲基蓝的时间曲线图。
具体实施方式
以下实施例用于说明本发明。
实施例1 按照下述步骤制备BiOCl
①将0.0050 mol硝酸铋与0.0050 mol盐酸二乙胺混合,加热至熔化,形成离子液体;
②在管式炉中以5 ℃/min升温速率加热步骤①中所述的离子液体,至离子液体燃烧,燃烧产生大量的烟雾,并放出大量的热量;
③收集步骤②燃烧完全后产生的固体,冷却并研磨,得到白色粉体,命名为样品1。
对样品1进行XRD测试,如图1所示,该图谱与BiOCl标准卡片(JCPDS NO. 01-082-0485)完全一致,表明形成的是BiOCl粉体,其(001)与(101)晶面峰强度比值列于图2,由图2可见,该比值0.665与标准卡片中的数值0.677基本一致,表明这个加入量的燃料对形成的晶面没有太大的影响。
对样品1进行UV-Vis DRS测试,如图3a所示,基本上只在紫外光区有吸收,与传统BiOCl表现基本一致。利用α(hν)=a(hν-Eg)2公式计算其禁带宽度约为3.15 eV,如图3b所示。对样品1进行SEM、HRTEM和ESR测试,结果分别如图4至图6所示。
对所制备的样品1进行光催化活性试验:在100 mL的10 mg/L次甲基蓝溶液中加入0.1 g本实施例制备的样品1,以350 W 氙灯为可见光源,以400 nm滤光片滤掉λ<400 nm的光,次甲基蓝的浓度利用紫外-可见漫反射光谱进行吸收率测试,其降解率以C/C0表示,C表示降解后浓度,C0为样品的初始浓度10 mg/L。结果表明:吸附10min后达到平衡,照射10min后次甲基蓝的降解率为59.1%,如图7所示。而无催化剂时次甲基蓝的降解率为5.8%,表明该条件下次甲基蓝的自降解较低。
实施例2 按照下述步骤制备BiOCl
①将0.0050 mol硝酸铋与0.0060 mol盐酸二乙胺混合,加热至熔化,形成离子液体;
②在管式炉中以20 ℃/min升温速率加热上述离子液体,直至离子液体燃烧,燃烧产生大量的烟雾和热量;
③收集步骤②燃烧完全后产生的固体,冷却、研磨,得到浅黄色粉体,命名为样品2。
对样品2进行XRD测试,如图1所示。与样品1相比,其(001)晶面峰明显增强,计算(001)/(101)强度比值为1.01,如图2所示,表明增加燃料盐酸二乙胺的量可以诱导晶体沿{001}晶面生长。
对样品2进行UV-Vis DRS测试,如图3a所示,与样品1相比,其吸收光谱表现为明显的红移,已经扩展到可见光区,归因于氧空位的存在。
按照实施例1的方法进行可见光催化活性试验,结果表明:照射10 min后次甲基蓝的降解率为79.1%。
实施例3 按照下述步骤制备BiOCl
①将0.0050 mol硝酸铋与0.0070 mol盐酸二乙胺混合,加热至熔化,形成离子液体;
②再在电阻炉以30 ℃/min升温速率加热直至离子液体燃烧,燃烧产生大量的烟雾和热量;
③收集燃烧完全后产生的固体,冷却、研磨,得到粉体命名为样品3。其XRD图如图1所示,计算(001)/(101)强度比值为2.07,如图2所示;SEM图谱如图4b所示,与样品1的图4a相比,{001}晶面的比例明显变大,与图1和图2的结果相一致,表明盐酸二乙胺是很好的晶面控制形成剂。样品3的UV-Vis DRS图谱见图3a,可见该样品在可见光区也有了明显的吸收,利用α(hν)=a(hν-Eg)2公式计算其禁带宽度约为2.72 eV,如图3b所示。由样品3的HRTEM图谱(图5b)可见,与样品1的图5a相比,图5b的边缘有明显的非晶格区域,该区域为氧原子逸出后造成的空位缺陷;同时图6的ESR图谱也明显看出样品3的g=1.9996应归因于氧空位缺陷,而样品1则没有表现出信号。由此可以推测,样品3的可见光吸收能力来自于表面氧空位。
按照实施例1的方法进行可见光催化活性试验,结果表明:照射10 min后次甲基蓝的降解率为98.9%,如图7所示,已基本完全降解,表现出优异的光催化能力。
实施例4 按照下述步骤制备BiOCl
①将0.0050 mol硝酸铋与0.0080 mol盐酸二乙胺混合,加热至熔化,形成离子液体;
②再在管式炉以50 ℃/min升温速率加热直至离子液体燃烧,燃烧产生大量的烟雾和热量;
③收集燃烧后产生的固体,冷却、研磨,命名为样品4。其XRD和峰强度比值分别参见图1和图2。由图可见,(001)和(101)晶面比例反而降低了,这可能是由于过多的燃料反而导致溶液无法完全燃烧、燃料没有充分发挥作用造成的。UV-Vis DRS测试表明仍然在可见光区有吸收,即有氧空位的存在。按照实施例1的方法进行可见光催化活性试验,结果表明:照射10 min后苯酚的降解率为88.5%,如图7所示。
- 还没有人留言评论。精彩留言会获得点赞!