基于石墨烯场效应管的核酸检测微流控芯片及制备方法与流程
本发明属于核酸检测装置技术领域,具体涉及一种基于石墨烯场效应管的核酸检测微流控芯片及制备方法。
背景技术:
基因检测在医疗诊断、临床分析、个性化给药、病原探测和疾病预防等方面具有重要意义,尤其是在遗传疾病和癌症的早期诊断等方面具有非常广泛的应用。目前对dna分子的杂交过程进行检测的常规测序方法有鸟枪法、sanger测序法、dna阵列技术、和454测序法等。这些基因检测方法有效地丰富了基因检测的手段,但是也存在检测过程复杂繁琐,时间长,灵敏度不高,并且样品来源稀少宝贵使得检测成本高昂,耗时费力等缺点。因此,开发出一种灵敏度高、简洁快速、价格低廉、节省样品的基因检测手段成为一个急需解决的问题。这些年来,很多种方法开始应用在这个方面,包括荧光检测法、单晶硅悬臂梁、电化学方法和场效应晶体管等检测方法被用于进行dna杂化分析,序列检测和寡核苷酸的多态分析等方面。场效应晶体管具有价格低廉、面积小、免标记、易于集成等优点,而且利用场效应晶体管做基因检测灵敏度高、传感速度快、操作简单,更重要的是其加工工艺和微机电工艺兼容,容易进行大规模的生产和制备。
然而现有技术研究中的晶体管传感技术大多是在敞开的环境下进行的,容易受到外界环境的干扰和影响,稳定性和实用性差。目前基于场效应品体管的传感器大部分也是在开放的环境中进行实验的,外界环境使得晶体管dna检测性能下降,灵敏度降低,实验重复性不好。另外,检测过程复杂,不易操作,容易引入人为误差,这些因素都降低了检测的灵敏度,并且实验稳定性和重复性不好。
技术实现要素:
为了解决上述问题,本发明提供的一种基于石墨烯场效应管的核酸检测微流控芯片及制备方法,检测过程简单,易操作,解决了现有技术中检测灵敏度低,并且实验稳定性和重复性不好,容易引入人为误差的问题。
本发明目的是提供一种基于石墨烯场效应管的核酸检测微流控芯片,包括基底和微流通道片,所述基底上设置有源极、漏极、第一电极和第二电极,所述源极与所述第一电极电连接,所述漏极与所述第二电极电连接,所述第一电极和第二电极之间通过石墨烯层连接,所述石墨烯层的上表面修饰有纳米金颗粒,所述微流通道片覆盖在所述石墨烯层上方,所述微流通道片上设置有微流通道、进液口、出液口和电极插口,并且所述进液口、出液口和电极插口均与所述微流通道连通,所述电极插口内插接有金属电极丝,所述微流通道位于所述第一电极和第二电极之间,第一电极和第二电极的连线与所述微流通道相对垂直,所述微流通道还与所述石墨烯层连通。
优选的,所述的基于石墨烯场效应管的核酸检测微流控芯片,所述第一电极和第二电极的结构相同,均由粘附层以及覆盖于粘附层上方的导电层制成,并且所述粘附层位于所述基底上。
优选的,所述的基于石墨烯场效应管的核酸检测微流控芯片,所述粘附层为铬层,所述导电层为金层;或者所述粘附层为钛层,所述导电层为铂层。
优选的,所述的基于石墨烯场效应管的核酸检测微流控芯片,所述第一电极和第二电极之间的距离为0.2mm~0.6mm。
优选的,所述的基于石墨烯场效应管的核酸检测微流控芯片,所述基底是硅片或者玻璃载玻片。
优选的,所述的基于石墨烯场效应管的核酸检测微流控芯片,所述进液口、出液口和电极插口均为圆柱形,且进液口、出液口和电极插口的直径均为0.8mm。
优选的,所述的基于石墨烯场效应管的核酸检测微流控芯片,所述微流通道的宽度为0.1mm~0.4mm,高度0.01mm~0.1mm,长度为0.5cm~3cm。
优选的,所述的基于石墨烯场效应管的核酸检测微流控芯片,所述金属电极丝是圆柱形的ag/agcl电极丝,且直径为0.3mm~0.6mm。
本发明还提供了一种的基于石墨烯场效应管的核酸检测微流控芯片的制备方法,包括以下步骤:
s1,制备电极载玻片
使用光刻胶作为牺牲层,在基底上分别光刻出第一电极图形,采用磁控溅射的方法先在基底上镀一层粘附层,然后在粘附层上镀一层导电层,最后用丙酮溶解掉光刻胶以及光刻胶表面的杂质,得到第一电极;第二电极的制备方法与第一电极的制备方法相同,只是在基底的位置不同,最终得到电极载玻片;
s2,制备石墨烯电极载玻片
以铜箔作为基底,利用化学气相沉积方法在铜箔表面生长出石墨烯,得到石墨烯/铜;
在石墨烯/铜上表面涂一层聚甲基丙烯酸甲脂后,80℃加热0.5h~1h,待其自然冷却,放入质量分数2%的氯化铁溶液中将铜箔腐蚀掉,得到聚甲基丙烯酸甲脂/石墨烯,然后用水浸泡清洗,接着用所述电极载玻片将聚甲基丙烯酸甲脂/石墨烯从水中捞起,晾干后,将所述电极载玻片连同聚甲基丙烯酸甲脂/石墨烯浸泡于丙酮中将聚甲基丙烯酸甲脂溶解,晾干,得到石墨烯电极载玻片,石墨烯电极载玻片中第一电极和第二电极之间通过石墨烯层连接;
s3,纳米金颗粒修饰载玻片
将所述石墨烯电极载玻片浸入5mmol/l60℃的氯金酸溶液中,60℃避光反应45min后,使石墨烯层的上表面修饰有纳米金颗粒,取出并清洗处理,得到纳米金颗粒修饰载玻片;
s4,微流通道片的制备
以硅片或者玻璃载玻片作为微流通道片基底,利用软光刻的方法在微流通道片基底上光刻出微流通道片的阳模形,在阳模形上倾倒聚二甲基硅氧烷液体,固化后得到pdms阴模,所述pdms阴模即为所述微流通道片,所述微流通道片包括微流通道、进液口、出液口和电极插口,并且所述进液口、出液口和电极插口均与所述微流通道连通,将金属电极丝插入电极插口,作场效应晶体管的栅极;
s5,利用等离子体键合仪分别对所述微流通道片的下表面和所述纳米金颗粒修饰载玻片上表面进行处理,然后将处理后的微流通道片覆盖在处理后的纳米金颗粒修饰载玻片上,75℃条件下烘干≥3h,得到基于石墨烯场效应管的核酸检测微流控芯片。
与现有技术相比,本发明提供的一种基于石墨烯场效应管的核酸检测微流控芯片及制备方法,具有以下有益效果:
(1)本发明的芯片体积小、重量轻、易于携带,有效地减少了基因样品的消耗量,同时生化反应在芯片内部,样品体积小,液体表面积体积比大,扩散速度快,使检测速度大幅度提高。
(2)采用电学方法进行dna分子的检测,避免了荧光染色等复杂的操作步骤,检测过程简洁快速,便于推广。
(3)在芯片内部进行检测,避免了外界环境的干扰,解决了现有技术中容易引入人为误差,造成的检测灵敏度低,并且实验稳定性和重复性不好的问题,能够有效地提高检测的灵敏度。
(4)整个芯片制备过程采用工业中已经成熟的微机电加工工艺,可以进行大规模批量化的生产,生产成本低、效率高,有利于产业化和市场化。据此,本发明可广泛应用于生命科学、遗传科学、和人类基因疾病的预防、诊断和治疗等领域。
附图说明
图1是本发明微流控芯片的结构示意图;
图2是本发明微流控芯片的剖视图;
图3是本发明微流控芯片中微流通道片的结构示意图;
图4是制备电极载玻片的工艺流程图;
图5是本发明实施例1微流控芯片检测样品的流程图;
图6是本发明实施例1微流控芯片石墨烯层的拉曼表征图谱;
图7是本发明实施例1微流控芯片石墨烯层表面纳米金颗粒的sem表征图;
图8是不同浓度cdna检测结果;
图9是晶体管的最小电流值随cdna浓度的变化。
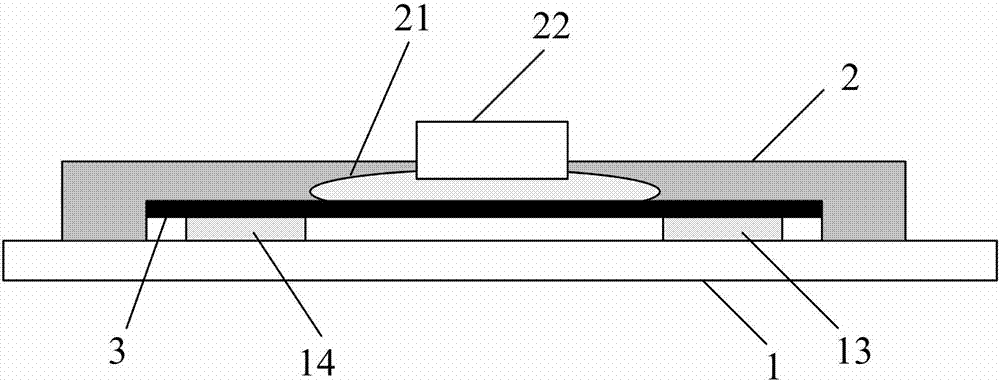
附图标记说明:1.基底,11.源极,12.漏极,13.第一电极,14.第二电极,2.微流通道片,21.微流通道,22.进液口,23.出液口,24.电极插口,241.金属电极丝,3.石墨烯层。
具体实施方式
下面结合具体附图和实施例对本发明进行详细说明,但不应理解为本发明的限制。下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中涉及到数据范围的,在该数据范围内包括两个端点的任何数值均可实现,由于效果和步骤相同,故不赘述。
实施例1
一种基于石墨烯场效应管的核酸检测微流控芯片,具体如图1-3所示,包括基底1和微流通道片2,所述基底1上设置有源极11、漏极12、第一电极13和第二电极14,并且所述源极11与所述第一电极13通过导线电连接,所述漏极12与所述第二电极14通过导线电连接,所述第一电极13和第二电极14之间连接有石墨烯层3,石墨烯层3的厚度为1nm~3nm,并且所述第一电极13和第二电极14对称的分布在所述石墨烯层3中部两端的位置、位于石墨烯层3和基底1之间,所述石墨烯层3的上表面修饰有纳米金颗粒,所述微流通道片2覆盖在所述石墨烯层3上方,所述微流通道片2上横向设置有微流通道21,微流通道片2上分别纵向设置有进液口22、出液口23和电极插口24,所述进液口22、出液口23和电极插口24均为圆柱形,且进液口22、出液口23和电极插口24的直径均为0.8mm,并且所述进液口22、出液口23和电极插口24均与所述微流通道21连通,所述电极插口24内插接有金属电极丝241,所述微流通道21位于所述第一电极13和第二电极14之间,第一电极13和第二电极14的连线与所述微流通道21相对垂直,所述微流通道21还与所述石墨烯层3连通。
其中,所述第一电极13、第二电极14、源极11和漏极12的结构相同,均由粘附层以及覆盖于粘附层上方的导电层制成,并且所述粘附层位于所述基底1上,其中粘附层的厚度为10-20nm,导电层的厚度为60-70nm。所述粘附层为铬层,所述导电层为金层,组成au/cr电极;或者所述粘附层为钛层,所述导电层为铂层,组成pt/ti电极。所述第一电极13和第二电极14之间的距离为0.2mm~0.6mm,石墨烯层3的长度为0.3mm~0.6mm,且石墨烯层3的长度大于第一电极13和第二电极14之间的距离,能够将第一电极13和第二电极14连接起来。石墨烯层3上表面修饰有纳米金颗粒,纳米金颗粒的直径为50nm~200nm,用来捕获dna分子探针。
其中,所述金属电极丝241是圆柱形,且直径为0.3mm~0.6mm,可以从电极插入口插入。金属电极丝241采用现有技术的ag/agcl电极丝。
需要说明的是,所述基底1是现有技术的硅片或者玻璃载玻片。
需要说明的是,微流通道21是进行dna分子进行化学反应和核酸检测的场所,为了减少样品用量,所述微流通道21的宽度为0.1mm~0.4mm,高度0.01mm~0.1mm,长度为0.5cm~3cm。微流通道21从第一电极13和第二电极14之间穿过,且宽度小于第一电极13和第二电极14之间的距离,当样品从微流通道21中流动时,石墨烯层3上表面的纳米金颗粒会通过au-s巯基共价键将探针分子捕获,然后当探针分子的互补链cdna分子流过时,cdna分子探针会和cdna杂化,形成dna分子双链,引起石墨烯电学特性的变化,从而对cdna分子进行检测。
本发明还提供了一种基于石墨烯场效应管的核酸检测微流控芯片的制备方法,包括以下步骤:
s1,制备电极载玻片
利用lift-off工艺在基底表面制备第一电极13和第二电极14,工艺流程如图4所示,具体包括:使用光刻胶作为牺牲层,在基底1上光刻出第一电极13图形,采用磁控溅射的方法先在基底1上镀一层粘附层,然后在粘附层上镀一层导电层,最后用丙酮溶解掉光刻胶以及光刻胶表面的杂质金属电极,而没有光刻胶的区域粘附层和导电层保留下来,留作第一电极13;第二电极14、源极11和漏极12的制备方法与第一电极13的制备方法相同,也是采用磁控溅射的方法先在基底1上镀一层粘附层,然后在粘附层上镀一层导电层,最后用丙酮溶解掉光刻胶以及光刻胶表面的杂质金属电极,而没有光刻胶的区域粘附层和导电层保留下来,留作第二电极14、源极11或者漏极12,只是第一电极13、第二电极14、源极11和漏极12在基底1的位置不同,最终得到电极载玻片;需要说明的是,所述丙酮为市售丙酮,使用不用加水。
s2,制备石墨烯电极载玻片
以铜箔作为基底,利用化学气相沉积方法在铜箔表面生长出石墨烯层3,石墨烯层3的厚度为1nm~3nm,得到石墨烯/铜;
在石墨烯/铜上表面(含有石墨烯的一面)旋涂一层聚甲基丙烯酸甲脂(pmma)后,在80℃的烘台上加热0.5h~1h,待其自然冷却,将样品放入质量分数2%的氯化铁溶液中将铜箔腐蚀掉,得到聚甲基丙烯酸甲脂/石墨烯(pmma/graphene),然后用水浸泡清洗,接着用所述电极载玻片将聚甲基丙烯酸甲脂/石墨烯从水中捞起,并使聚甲基丙烯酸甲脂/石墨烯位于中第一电极13和第二电极14之间,将第一电极13和第二电极14连接起来,晾干后,将聚甲基丙烯酸甲脂/石墨烯浸泡于丙酮中将聚甲基丙烯酸甲脂溶解,晾干,至此,铜箔上面的石墨烯转移到电极载玻片表面,得到石墨烯电极载玻片,石墨烯电极载玻片中第一电极13和第二电极14之间通过石墨烯层3连接起来;
s3,纳米金颗粒修饰载玻片
将所述石墨烯电极载玻片浸入5mmol/l60℃的氯金酸溶液中,用锡纸将反应体系盖住以避免光的影响,60℃避光持续反应45min后,使石墨烯层3的上表面修饰有纳米金颗粒,取出并清水清洗处理,晾干,得到纳米金颗粒修饰载玻片;
需要说明的是,s2和s3进行时,一直维持甲基丙烯酸甲脂/石墨烯或者石墨烯层3位于中第一电极13和第二电极14上方,将第一电极13和第二电极14连接起来,保证各部件之间的位置不变。
s4,微流通道片2的制备
以硅片或者玻璃载玻片作为微流通道片基底,利用软光刻的方法在微流通道片基底上光刻出微流通道片2的阳模形,在阳模形上倾倒聚二甲基硅氧烷(pdms)液体,固化后得到pdms阴模,所述pdms阴模即为所述微流通道片2,所述微流通道片2上横向设置有微流通道21,微流通道片2上分别纵向设置有进液口22、出液口23和电极插口24,并且所述进液口22、出液口23和电极插口24均与所述微流通道21连通,将金属电极丝241插入电极插口24,金属电极丝241作场效应晶体管的栅极;
s5,将微流通道片基底上的微流通道片2撕下,利用等离子体键合仪gpc-102a分别在所述微流通道片2的下表面(与进液口22、出液口23和电极插口相对的一面)和所述纳米金颗粒修饰载玻片上表面(覆有石墨烯层3的一面)进行处理,使微流通道片2的下表面和纳米金颗粒修饰载玻片上表面附着有一层等离子体,然后将处理后的微流通道片2覆盖在处理后的的纳米金颗粒修饰载玻片上,并且微流通道片2位于石墨烯层3上方,75℃条件下烘干3h~72h,使纳米金颗粒修饰载玻片与微流通道片2的边缘通过氧等离子体牢固键合在一起,得到基于石墨烯场效应管的核酸检测微流控芯片。
需要说明的是,所述纳米金颗粒修饰载玻片上表面进行处理时,先用硅片将纳米金颗粒修饰载玻片的上石墨烯层3盖住,在利用等离子体键合仪在所述纳米金颗粒修饰载玻片上表面进行处理,以免等离子体影响石墨烯层3的功能。
我们采用基底1上设置有源极11、漏极12、第一电极13和第二电极14,所述第一电极13和第二电极14之间连接有石墨烯层3,所述微流通道片2上设置有微流通道21、进液口22、出液口23和电极插口24,将金属电极丝241插入电极插口24、作场效应晶体管的栅极,从而组成基于石墨烯场效应管的微流控芯片。石墨烯层3、源极11、漏极12、金属电极丝241制作的栅极、微流通道21组成石墨烯场效应管。实施例1制成的基于石墨烯场效应管的微流控芯片进行dna的杂化检测,微流控芯片的具体尺寸为:微流控芯片主要由一片微流通道片(长30mm×宽10mm×厚3mm)和一片纳米金颗粒修饰载玻片(长45mm×宽25mm×厚2mm)构成,如图5所示。微流通道宽400μm,高50μm。纳米金颗粒修饰载玻片表面上的两条第一电极13和第二电极14均是pt/ti电极薄膜,pt/ti电极薄膜宽400μm,两个pt/ti电极薄膜之间距离是0.6mm。两个pt/ti电极薄膜之间的石墨烯层尺寸是长0.8mm×宽0.4mm,石墨烯层的拉曼表征如图6所示,石墨烯层表面纳米金颗粒的sem表征图如图7所示。
(1)将5μmol带有巯基的dna分子探针从微流控芯片的微流通道片上的进液口注射入芯片,静置1h以上,dna分子探针通过被动扩散的方式运动到石墨稀层表面,石墨烯层表面的纳米金颗粒能够和探针上的琉基形成非常强烈的共价键,从而装载探针。
(2)用标准的pbs溶液从微流通道片上的进液口注入微流通道中,以200μl/h的速度冲洗5分钟,以冲掉微流通道中未被纳米金捕获的dna探针,消除其对后续实验的影响。
(3)为了证明本芯片只对探针分子的互补链dna分子有传感特性,而对其他非互补的dna分子没有传感特性,需要做一组对照实验,就是将高浓度的非互补链dna,即1μmol/l的ncdna(ncdna表示与探针分子的不互补cdna链)冲入微流通道中,等待1h,测试石墨烯场效应管的性能。检测结果如图8所示,从中可以看出本芯片对高浓度的ncdna分子片段基本没有响应。
(4)分别将不同浓度的cdna(1μm、100nm、10nm、1nm、100pm、10pm、1pm、100fm、10fm、)注入微流控芯片的微流通道中,进行杂交和检测。具体操作过程是:每通入一次特定浓度的cdna之后,在室温下静置1h进行杂交,等cdna和dna探针杂交过程基本完成之后,用磷酸盐缓冲溶液冲洗微流通道冲出cdna,5min后进行测试,然后在微流通道中注入下一个浓度的cdna溶液,进行下一轮的检测。
需要说明的是,石墨烯的电学特性测试可以通过采用半导体参数分析仪agilent4156c测量石墨烯晶体管的转移特性曲线,测试方法是:将半导体参数分析仪中晶体管漏极测量端和源极的测量端分别对应连接到微流控芯片的源极和漏极上,将晶体管的栅极测量端连接微流通道片的栅极(ag/agcl电极丝)上即可进行测试,将参数仪调至测量fet的ids-vg特性。然后根据半导体参数分析仪agilent4156c现实的数据进行分析。
检测结果如图8所示,从中可以看到,cdna和dna分子探针杂化引起石墨烯晶体管电流的下降,随着cdna浓度的不断升高,电流下降的越大。图9统计了晶体管的最小电流值随cdna浓度的变化,可以看出本微流控芯片芯片可以检测到10fm的cdna,相对于其他方法,灵敏度有明显提高。并且整个检测过程是在微流通道中进行,有效地降低了基因样品的消耗量,避免了外界环境的干扰,器件的稳定性和实用性较好。故而可以利用本装置对核酸进行传感检测,在癌症以及遗传病的预防、诊断、和临床治疗等方面具有良好的应用前景。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!