一种电化学发光夹心生物传感器及制备与应用的制作方法
本发明涉及分析化学与电化学发光传感器分析领域,具体涉及一种基于金纳米-石墨烯复合材料和适配体的检测凝血酶的电化学发光生物传感器以及制备方法与应用。
背景技术:
凝血酶主要是指凝血级联效应蛋白酶。它主要进行循环纤维蛋白原转化为纤维白体,然后聚合成纤维蛋白,即血栓纤维素。人类的凝血酶主要用于在出现外伤时帮助凝血。检测在血液中的凝血酶含量的必要性不仅是为了那些遭受凝血功能异常疾病的病人,也是为了检验治疗药物在外科手术和血栓疾病的处理的效果。因此,灵敏的、准确的凝血酶检测方法在疾病预防中是关键和有用的。
适配体是一些天然的单链DNA或者RNA。他们折叠成二级和三级结构,使凝血酶能够以非常高效和特异性地结合一些目标分子(小分子、核酸、蛋白质或者整个细胞)。适配体通常通过系统的演化指数富集配体(SELEX)。与传统的识别元素——抗体相比,适配体有许多独特的特点例如最小的免疫原性、合成方便、容易化学修饰、结构稳定有柔性。这些特点使适配体成为了发展适配体为基础的分析方法的一种理想的候选者。这些方法包括电化学发光法(ECL),电化学法,荧光法以及比色法。到目前为止,有两种凝血酶适配体已经得到了广泛的应用,一种是TBA1能够结合凝血酶的纤维蛋白原位点,结合常数Kd在100 nM左右。另一种是TBA2更好的结合凝血酶(Kd=0.5 nM)。
与其他方法相比,电化学发光法结合了电化学和化学发光法的优点,例如低的背景信号,容易控制和低的检测限。结合电化学发光的有点和适配体的特异性的特点,适配体电化学发光传感器已经变成了一种重要的有前景的检测方法。由于Ru(bpy)32+/TprA体系出色的稳定性和很高的发光效率,Ru(bpy)32+/TprA体系得到了很好的研究。尤其在基于提高Ru(bpy)32+/TprA体系发光性能方面做了深入的研究。纳米材料比如碳纳米管、石墨烯、金纳米以及纳米复合材料用来放大电化学发光信号的应用已经在电化学发光传感器中的得到了广泛的应用。最近石墨烯已经以石墨烯为基础的纳米复合材料在构建电子元件中得到了广泛的重视,像在激光发射、太阳能电池。这些电子元件大多都需要一些轻薄以及电子传导效率高的材料。石墨烯是一种单原子层厚的石墨材料,而且石墨烯-金属复合材料拥有出色的物理化学性质比如大的比表面积、可控的电子性质。这些性质让石墨烯-金属复合材料在构建电化学发光传感器中已经成为了有前景的电极材料。
技术实现要素:
本发明的目的在于提供一种电化学发光夹心生物传感器及其制备与应用以解决目前对凝血酶的检测设备和处理过程复杂、价格昂贵、灵敏度不高等问题。
一种电化学发光夹心生物传感器的制备方法,主要包括以下步骤:
(S1)采用恒电位法制备金纳米-石墨烯修饰的玻碳电极;
(S2)采用柠檬酸还原氯金酸法制备AuNPs;
(S3)用Ru(bpy)2(dcbpy)NHS标记TBA2并溶解于PBS溶液中,得到Ru-TBA2信标;
(S4)将步骤(S3)所得Ru-TBA2信标用TCEP(磷酸三氯乙酯)和pH为5.2的醋酸盐缓冲溶液预处理1 h以断开巯基之间形成的双硫键;
(S5)将步骤(S2)所得AuNPs加入用NaOH处理过的玻璃瓶中,再加入步骤(S4)所得Ru-TBA2,在室温遮光下培育16 h后加入pH为8.2 的Tris-醋酸盐缓冲溶液和NaCl,继续在温室遮光下培育24 h;离心除去多余的Ru-TBA2;把得到的Ru-TBA2-AuNPs溶解到PBS缓冲溶液中;
(S6)将所述步骤(S1)所得到金纳米-石墨烯修饰的玻碳电极浸入含有巯基修饰的TBA1溶液中培育2~8 h,然后在含有凝血酶溶液中培育20 min;最后在步骤(S5)所得Ru-TBA2-AuNPs中培育20 min。
金纳米-石墨烯复合材料,既有石墨烯具有的良好性质,独特的结构使其具有优异的电学、热学、力学以及化学性质,而且在金纳米的相互作用下,这些性质有明显的增强。而且金纳米能够提供巯基修饰DNA分子修饰的位点。在本发明中,电极表面的金纳米和巯基修饰的适配体TBA1通过Au-S化学键结合可以有效的固定适配体TBA1。另一方面金纳米-石墨烯复合材料可以大大增大电极的电子传导效率,这样就可以增大电化学发光信号的响应。
Ru(bpy)32+是一种稳定的、发光效率非常高的发光试剂,由于其分子量和分子空间体积较酶等标记小很多,且不影响核酸的特异性和杂交活性,使得Ru(bpy)32+在分子水平上对核酸进行标记而成为可能。再加上Ru(bpy)32+可在电化学发光反应中进行再生循环反应,使得一个标记物在每一个检测周期中会产生相当数量的光子,因而分析灵敏度很高。在本发明的方法中利用Ru(bpy)32+标记TBA2不仅不会影响适配体TBA2与凝血酶的结合,而且还还能增强检测反应的灵敏度。在本发明中,在溶液中,利用金纳米颗粒连接修饰有Ru(bpy)32+的TBA2,由于一个金纳米颗粒可以连接很多数量的TBA2分子从而形成一种放射状的电化学发光信号源(Ru-TBA2-AuNPs),那当体系中出现少量的凝血酶时,就会引入大量的发光试剂,这样进一步对电化学发光信号的响应进行了放大。
通过本发明制备的电化学发光生物传感器,由于Ru(bpy)32+标记在适配体TBA2上,进而TBA2与金纳米形成Ru-TBA2-AuNPs的信号大分子。适配体TBA1通过Au-S化学键连接在修饰有金纳米-石墨烯的电极表面。当体系中出现凝血霉时,凝血酶就会和TBA1和TBA2结合,从而把Ru-TBA2-AuNPs引入到电极表面,通过电化学发光信号的增强来实现对凝血酶的定量检测。
生物分子需要一定的电解质环境,氯化钠主要提供电解质环境。
进一步的,所述巯基修饰的TBA1序列为5’-SH-(CH2)6-TTTTTGGTTGGTGTGGTTGG-3’;所述Ru-TBA2信标的序列为5’-SH-(CH2)6-TTTTTTTTTTTTTTTAGTCCGTAGGGCAGGTGGGGGG TGACTT-(CH2)6-NH2-3’。
进一步的,所述柠檬酸还原氯金酸法制备AuNPs主要包括:取氯金酸溶液于容器中加热至沸腾,然后快速加入柠檬酸钠;继续加热并不停的搅拌直到溶液的颜色由黄色变成红色,再不停的搅拌溶液冷却到室温,储存在4 °C下备用。
进一步的,所述恒电位法制备金纳米-石墨烯修饰的玻碳电极主要包括: 采用氧化石墨烯和氯金酸,在电位为-1.1 V下恒电位沉积到玻碳电极600~1000 s。使用玻碳电极前先将玻碳电极用α-A12O3抛光粉抛光;洗涤,分别在去离子水和乙醇中超声10 min。
进一步的,所述Ru(bpy)2(dcbpy)NHS的合成主要包括以下步骤:
(S11)将Ru(bpy)2Cl2、碳酸氢钠和2,2’-联吡啶-4,4’-二羧酸混合均匀,加入乙醇-水溶液中加热回流后冷却过滤制备Ru(bpy)2(dcbpy)(PF6)2;
(S12)再将N,N′-二环己基碳二亚胺和N-羟基琥珀酰亚胺搅拌混合后加入DMF溶液使其充分溶解后加入Ru(bpy)2(dcbpy)(PF6)2中合成Ru(bpy)2(dcbpy)NHS。
进一步的,步骤(S5)制备所得Ru-TBA2-AuNPs的浓度为2~8 μM;步骤(S2)制备得到的AuNPs粒径为6-10 nm。Ru-TBA2-AuNPs如果浓度太低,在电极表面引入的电化学发光信号源太少,影响电化学发光信号的响应,如过太多,会增加传感器表面的空间位阻,也不利于信号源的引入。
进一步的,所述PBS缓冲溶液的PH值为7.4。
一种上述制备方法得到的电化学发光夹心生物传感器。
一种上述电化学发光夹心生物传感器的应用,主要用于凝血酶的检测。由于凝血酶能够特异性的结合适配体TBA1和TBA2,所以在凝血霉出现的情况下,发光试剂Ru-TBA2-AuNPs就会被引入到电极表面,从而引起电化学发光信号的增强,根据电化学发光信号的增强程度实现对凝血酶的定量检测。电化学发光生物传感器对凝血酶的检测限为6.3 pM。
进一步的,所述凝血酶的检测主要包括以下步骤:
(S21)将所述电化学发光夹心生物传感器浸入到待测凝血酶溶液中20~40 min,然后用磷酸盐缓冲溶液冲洗电极;
(S22)将所述电化学发光夹心生物传感器浸入到1~10µM的Ru-TBA2-AuNPs中20~40 min,然后用磷酸盐缓冲溶液冲洗电极;
(S23)将所述电化学发光生物传感器作为工作电极在三电极系统中,以0.05~0.1 M三正丙胺溶液作为检测溶液进行电化学及电化学发光检测。
与现有技术相比,本发明的检测凝血酶的电化学发光生物传感器具有如下优点:1)具有良好的稳定性、重现性、对凝血酶具有很高的特异性,不易受到检测样品中其他物质的干扰;2)利用金纳米-石墨烯复合材料对电子传导效率的提高,促进电化学发光引号的响应,以及大信号源Ru-TBA2-AuNPs的引入对电化学发光信号的放大,从而极大地增大了本发明传感器的灵敏度;3)操作简单方便,能够快速准确检测样品中凝血酶的含量。本发明的电化学发光生物传感器在检测血液中的凝血酶含量体现了良好的性能,因此对凝血类药物的研发有一定的帮助。
附图说明
图1为发明的电化学发光生物传感器用于检测凝血酶的实验原理图;
图2为发明的玻碳电极在不同阶段在5 mM铁氰化钾/亚铁氰化钾中的循环伏安图;
图3为发明的玻碳电极在不同阶段的电化学阻抗;
图4为发明的生物传感器在凝血酶中发光强度与Au-TBA2-AuNPs培育时间的关系曲;
图5为发明的生物传感器的发光强度与在不同浓度凝血酶0.01nM(a)、 0.05nM(b)、 0.1 nM(c)中培育时间的关系曲线;
图6为金纳米-石墨烯的形貌图;
图7为发明的生物传感器检测不同浓度的凝血酶的电化学发光信号响应,电化学发光强度与凝血酶浓度的标准曲线图;
图8发明的生物传感器检测凝血酶的电化学发光信号半个月前后的变化;
图9为本发明的生物传感器抗干扰性图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
实施例1
一种检测凝血酶的电化学发光生物传感器的制备方法,如图1所示,主要包括以下步骤:
(1)玻碳电极预处理:玻碳电极经0.05μm的α-A12O3抛光粉抛光后,用去离子水冲洗干净,并分别在去离子水和乙醇中超声10 min。采用三电极系统检测,工作电极为玻碳电极,对电极为铂丝电极,参比电极为Ag/AgCl电极,在0.5 M硫酸中,设置电压为-0.2~1.6 V,对玻碳电极进行循环伏安扫描,检测完毕后,用去离子水冲洗电极,吹干电极表面,备用。
(2)金纳米-石墨烯修饰玻碳电极的制备:在浓度为0.6 mg mL-1的氧化石墨烯和25 mM的氯金酸,在电位为-1.1 V下恒电位沉积600 s。其中氧化石墨是根据改进的Hummers理论由鳞片石墨制备。制备得到的金纳米-石墨烯的形貌图如图6所示,从图6中可以看出有许多金纳米颗粒分布在石墨烯表面,而且金纳米颗粒大小均匀,说明得到的复合材料结构均匀。
(3)发光信标Ru-TBA2-AuNPs溶液的制备:
1)金纳米颗粒和合成(AuNPs)
AuNPs是通过用柠檬酸还原氯金酸的方法得到的。具体如下,取50 mL 1~5 mM 的氯金酸溶液于锥形瓶中加热沸腾,然后5 mL 30~40 mM 的柠檬酸钠快速的加入到溶液中。溶液继续加热沸腾并不停的搅拌,溶液的颜色由黄色变成红色。不停的搅拌溶液冷却到室温,这样就得到了AuNPs胶体溶液,储存在4 °C下备用。
2)Ru-TBA2的合成
① Ru(bpy)2(dcbpy)(PF6)2的合成:称取0.16 g即0.328 mM的 Ru(bpy)2Cl2、0.16 g碳酸氢钠和0.12 g即0.492 mM 的2,2’-联吡啶-4,4’-二羧酸均匀混合,加入10 mL体积比为4:1的乙醇-水溶液后加热回流4h;回流反应完成后,冰浴冷却7h,冷却过程中,采用1 M盐酸溶液调节反应液pH至4.4以促进反应产生橘红色的结晶沉淀析出;将充分结晶后的反应液进行过滤,得到的结晶用甲醇再次溶解后进行过滤以除去不溶杂质,得到透亮的橘红色滤液;将14 mL的六氟磷酸钠(NaPF6)(2 g)溶液加入到橘红色滤液中,冰浴冷却7h,保证产物能够完全沉淀析出;采用微孔膜过滤所得的沉淀物,并对其进行真空干燥,最终得到的红色粉末状固体即为Ru(bpy)2(dcbpy)(PF6)2。
②Ru(bpy)2(dcbpy)NHS的合成:将0.46 g即2.22 mM的 N,N′-二环己基碳二亚胺(DCC)和0.238 g即2.08 mM N-羟基琥珀酰亚胺(NHS)搅拌混合,在冰浴条件下加入3 mL DMF溶液使其充分溶解;将溶解液搅拌加入到1 ml含有0.38 g Ru(bpy)2(dcbpy)(PF6)2的DMF溶液中,继续常温条件下搅拌5h以最终制备得到具有活性羧基官能团Ru(bpy)2(dcbpy)NHS DMF溶液;取少量产物溶液加入到0.10 M的PBS溶液中进行紫外光谱表征,根据其在279 nm和453 nm处出现特征峰及前期实验工作,换算估计浓度为6.02 × 10-4 M。
③单链B-DNA钌配合物标记: Ru(bpy)2(dcbpy)NHS可以被直接用来标记3’端胺基化的TBA2(其适配体TBA2: 5’-SH-(CH2)6-TTTTTTTTTTTTTTTAGTCCGTAGGGCAGGTGGGGGG TGACTT-(CH2)6-NH2-3‘)。首先,取200μL溶解Ru(bpy)2(dcbpy)NHS的PBS溶液,加入至含有200μL TBA2溶液(1OD)的5 mL的离心管中,恒温25℃条件下避光低速震荡12h;震荡完成后,将100 μL 3 M的醋酸钠溶液和2mL冰无水乙醇加入至反应体系终止反应,在-20℃条件下静置12h;静置完成后,反应混合物在12000 r/min转速下低温离心30 min,小心去除上清液,再用70%的冰无水乙醇漂洗沉淀物2次,每次漂洗完后离心10 min,最终洗去未被DNA结合的Ru(bpy)2(dcbpy)NHS;冷冻干燥后的反应沉淀物即为三联吡啶钌标记后的电化学发光信标Ru-TBA2。
3)Ru-TBA2-AuNPs的合成
Ru-TBA2-AuNPs的合成,9 µL 1 mM的Ru-TBA2用1.5 µL 10 mM的TCEP和1 µL 500 mM pH=5.2的醋酸盐缓冲溶液预处理1 h以断开巯基之间形成的双硫键。然后3 mL的AuNPs加入到用NaOH处理过的玻璃瓶中,然后把上述Ru-TBA2加入到玻璃瓶中,在室温遮光下培育16 h。30 µL 500 mM的pH=8.2 Tris-醋酸盐缓冲溶液和300 µL 1 M的NaCl缓慢地加入到体系中,混合液在温室遮光下继续培育24 h。在室温下16000 r/min离心25 min除去多余的Ru-TBA2。最后取4.035 μg Ru-TBA2-AuNPs溶解到200 μL 0.1 M pH=7.4 的PBS缓冲溶液中配制成2μM的Ru-TBA2-AunNPS溶液,储存在4 °C 下备用。
(4)生物传感器的构建
①把修饰有金纳米-石墨烯复合材料的玻碳电极浸入到20 μL的含有巯基修饰的TBA1溶液2 h。
②然后把电极在含有凝血酶溶液中培育20 min。
③在把上述电极浸泡在含有20 μL 2μM的Ru-TBA2-AuNPs中培育20 min。
本实施例为了研究本发明的修饰玻碳电极生物传感器检测凝血的电极反应性质、机理和电极过程动力学参数。预处理后的玻碳电极在进行修饰前,采用三电极系统循环伏安法进行测试。
检测方法主要包括以下步骤:
(1)即将工作电极为预处理后的玻碳电极,对电极为铂丝电极,参比电极为Ag/AgCl电极的三电极系统,在0.5 M 硫酸中,对玻碳电极进行循环伏安扫描,其中设置电压为-0.2~1.6 V,检测完毕后,用去离子水冲洗玻碳电极,吹干玻碳电极表面,备用。
(2)将所述电极在凝血酶和Ru-TBA2-AuNPs中浸泡20 min,然后分别用磷酸盐缓冲溶液冲洗电极。
(3)将制备完成的修饰电极放入0.05 M三正丙胺溶液中进行循环伏安扫描,其中其中电压范围是0.2~1.25 V,扫描速率是100 mV•s-1,光电倍增管高压设置为-800 V
实施例2
一种检测凝血酶的电化学发光生物传感器的制备方法,包括以下步骤:
(1)玻碳电极预处理:玻碳电极经0.05μm的α-A12O3抛光粉抛光后,用去离子水冲洗干净,并分别在去离子水和乙醇中超声10 min。采用三电极系统检测,工作电极为玻碳电极,对电极为铂丝电极,参比电极为Ag/AgCl电极,在0.5 M硫酸中,设置电压为-0.2~1.6 V,对玻碳电极进行循环伏安扫描,检测完毕后,用去离子水冲洗电极,吹干电极表面,备用。
(2)金纳米-石墨烯修饰玻碳电极的制备:在浓度为0.8 mg mL-1的氧化石墨烯和55 mM的氯金酸,在电位为-1.1 V下恒电位沉积1000 s。其中氧化石墨是根据改进的Hummers理论由鳞片石墨制备。制备得到的金纳米-石墨烯的形貌图如图6所示,从图6中可以看出有许多金纳米颗粒分布在石墨烯表面,而且金纳米颗粒大小均匀,说明得到的复合材料结构均匀。
(3)发光信标Ru-TBA2-AuNPs溶液的制备:Ru-TBA2-AuNPs的制备过程同实施例1,取16.14 µg的Ru-TBA2-AuNPs冲洗溶解于200 µL的PBS溶液中,配制成浓度为8 µM的Ru-TBA2-AuNPs溶液。并于4℃条件下保存备用。
(4)生物传感器的构建
①把修饰有金纳米-石墨烯复合材料的玻碳电极浸入到20 μL的含有巯基修饰的TBA1溶液8 h。
②然后把电极在含有凝血酶溶液中培育40 min。
③在把上述电极浸泡在含有20 μL 8μM的Ru-TBA2-AuNPs中培育40 min。
本实施例为了研究本发明的修饰玻碳电极生物传感器检测凝血的电极反应性质、机理和电极过程动力学参数。预处理后的玻碳电极在进行修饰前,采用三电极系统循环伏安法进行测试。
检测方法主要包括以下步骤:
(1)即将工作电极为预处理后的玻碳电极,对电极为铂丝电极,参比电极为Ag/AgCl电极的三电极系统,在0.5 M 硫酸中,对玻碳电极进行循环伏安扫描,其中设置电压为-0.2~1.6 V,检测完毕后,用去离子水冲洗玻碳电极,吹干玻碳电极表面,备用。
(2)将所述电极在凝血酶和Ru-TBA2-AuNPs中浸泡40 min,然后分别用磷酸盐缓冲溶液冲洗电极。
(3)将制备完成的修饰电极放入0.1M三正丙胺溶液中进行循环伏安扫描,其中其中电压范围是0.2~1.25 V,扫描速率是100 mV•s-1,光电倍增管高压设置为-800 V。
实施例3
1、循环伏安测试对比
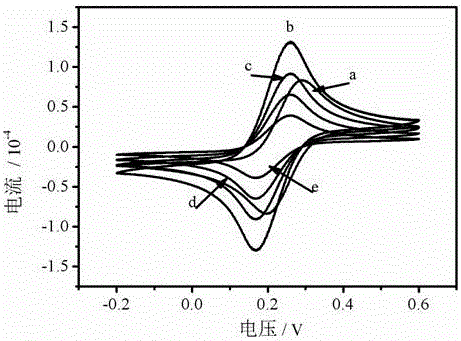
将5个按照实施例1或2处理得到的玻碳电极分别做以下处理a为裸电极、b修饰有金纳米-石墨烯复合材料的电极、c修饰有TBA1、d引入凝血酶、e引入TBA2-Ru –AuNPs。再把a、b、c、d、e在5 mM铁氰化钾/亚铁氰化钾中的循环伏安测试,测试结果如图2所示,只有当金纳米-石墨烯复合材料修饰电极后,电流有明显的增加,说明本发明的复合材料具有很好的导电性能。
2、电化学阻抗测试对比
将5个按照实施例1或2处理得到玻碳电极分别做以下处理a为裸电极、b修饰有金纳米-石墨烯复合材料的电极、c修饰有TBA1、d引入凝血酶、e引入TBA2-Ru –AuNPs。再把a、b、c、d、e进行阻抗测试,测试结果如图3所示阻抗谱图,从图中可以看出当金纳米-石墨烯修饰电极后阻抗有明显的减小进一步说明复合材料有很好的导电性能。
3、Au-TBA2-AuNPs中培育时间的的研究
将按照实施例1或2得到的金纳米-石墨烯修饰的玻碳电极浸入含有巯基修饰的TBA1溶液中培育2~8 h,然后在含有凝血酶溶液中培育20 min。最后在按照本实施例1或2得到的Ru-TBA2-AuNPs中培育不同的时间,如图4所示,a、b和c分别为浓度为0.01nM、 0.05nM和0.1 nM的浓度的凝血酶在Ru-TBA2-AuNPS中培育不同时间的电化学发光信号的变化,从图中可以看出随着时间的增加电化学发光信号不断增加,在20 min达到稳定,说明在Ru-TBA2-AuNPS中最佳培育时间为20 min。
4、凝血酶中培育时间的的研究
将按照实施例1或2得到的金纳米-石墨烯修饰的玻碳电极浸入含有巯基修饰的TBA1溶液中培育2~8 h,然后在含有凝血酶溶液中培育不同时间。最后在按照本实施例1或2得到的Ru-TBA2-AuNPs中培育20min,如图5所示, a、b和c分别为浓度为0.01nM、 0.05nM和0.1 nM的凝血酶在不同培育时间中电化学发光信号变化曲线,从图5中可以看出随着时间的增加电化学发光信号不断增加,在30 min时达到稳定,说明在凝血酶中最佳培育时间为30 min。
5、凝血酶中浓度对电化学发光信号响应的影响
将a-g的浓度分别为0.01 nM、0.05 nM、 0.1 nM、0.5 nM、1 nM、5 nM和10 nM的凝血酶按照实施例1或者实施例2的方法进行检测,如图7所示,对不同浓度的凝血酶的电化学响应强度和凝血酶浓度的对数呈线性关系,而且线性关系很好。
6、传感器稳定性测试
如图8所示,a为半个月前的电化学发光信号,b为半个月的发光信号,从图中可以看出半个月前后信号变化不大,说明传感器很稳定。
7、选择性的测试
为了探究传感器对其他物质的抗干扰性,对其他常见的物质牛血清蛋白、溶菌酶、人血清蛋白、免疫球蛋白、胰岛素、胰蛋白酶、组氨酸进行平行干扰实验。从图9中可以看出,传感器对凝血酶有强烈的信号响应,对其他干扰物质几乎没有信号响应。实验结果表明本实施例制备的传感器具有良好的抗干扰性能,具有良好的凝血酶识别特异性。
以上所述仅为本发明的优选实施例而已, 并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明, 对于本领域的技术人员来说, 其依然可以对前述各实施例所记载的技术方案进行修改, 或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内, 所作的任何修改、 等同替换、 改进等,均应包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 汕头大学
<120> 一种电化学发光夹心生物传感器及制备与应用
<130> 2016
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 24
<212> DNA
<213> 人工序列
<400> 1
shchtttttg gttggtgtgg ttgg 24
<210> 2
<211> 51
<212> DNA
<213> 人工序列
<220>
<221> misc_feature
<222> (50)..(50)
<223> n is a, c, g, or t
<400> 2
shchtttttt ttttttttta gtccgtaggg caggtggggg gtgacttchn h 51
- 还没有人留言评论。精彩留言会获得点赞!