同型半胱氨酸的测定试剂及其制备方法与流程
本发明涉及一种同型半胱氨酸的测定试剂及其制备方法,属于借助于测定材料的化学或物理性质来测试或分析材料
技术领域:
。
背景技术:
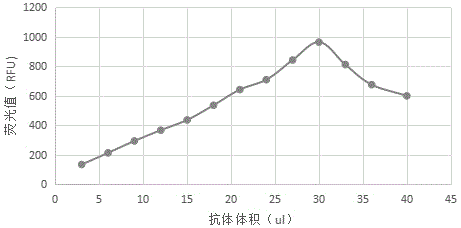
:同型半胱氨酸(高半胱氨酸,Hcy)是含硫氨基酸,在细胞内蛋氨酸脱甲基生成。同型半胱氨酸经甲基化生成蛋氨酸,此过程需活性维生素B12及四氢叶酸作为辅助因子参与。同型半胱氨酸也可经转硫通路生成半胱氨酸,此过程需胱硫酶合成酶参与,磷酸吡哆醛(活性维生素B6)为其辅助因子。当同型半胱氨酸代谢受阻,同型半胱氨酸就在细胞内积聚,并进入血液循环。还原型同型半胱氨酸在血中仅占1%,大部分以氧化型存在,其中80-90%与蛋白结合,5-10%与同型半胱氨酸自身结合(HCY-SS-HCY),另外5-10%与半胱氨酸等结合形成混合型同型半胱氨酸二硫化物(CY-SS-HCY)。通常测定血中总同型半胱氨酸含量(tHCY),临床证明:同型半胱氨酸对预测心脑血管病、恶性肿瘤、老年性痴呆等多种疾病的发病危险具有重要意义,具体如下:(1)同型半胱氨酸与冠状动脉疾病在动脉粥样硬化、冠心病等心脑血管病症中,其血清同型半胱氨酸的水平显著升高,浓度越高危险性越大。所以轻微到中度同型半胱氨酸血症是动脉粥样硬化所致心血管疾病最广泛、最强的独立的致病因素。对慢性肾病病人,排泄HCY功能降低,血中tHCY增加,引起动脉粥样硬化,心血管疾病死亡率增加。(2)同型半胱氨酸与血栓形成同型半胱氨酸通过产生超氧化物及过氧化物损伤血管内皮细胞,改变凝血因子功能,增加血栓形成倾向。同型半胱氨酸可使小动脉血管易于栓塞及促进血管平滑肌细胞增殖参与粥样硬化形成。同型半胱氨酸活化形式(Homocysteinthiolactone)可促使血小板聚集,并可与载脂蛋白B形成致密的复合物易于被血管壁巨噬细胞吞噬,引起血管壁脂肪堆积。同型半胱氨酸能增强其它心血管疾病危险因素如胆固醇、高血压及吸烟对心血管的损害。(3)同型半胱氨酸与肾功能衰竭进行血液透析的肾病患者,其血中同型半胱氨酸水平可达到正常人的2~4倍,且发生血管栓塞性症状的几率显著增加。(4)同型半胱氨酸与妊娠同型半胱氨酸与与妊娠高血压综合症相关,妊娠中期同型半胱氨酸水平可作为早期妊娠高血压综合症的指标;在体外研究发现,高浓度的同型半胱氨酸具有胚泡毒性,从而导致畸胎发病率增加;高浓度同型半胱氨酸还可引起绒毛膜绒毛细胞血管病因而导致复发性早期流产。(5)遗传和营养因素所致高同型半胱氨酸血症同型半胱氨酸在体内的分解代谢,受两方面因素影响最大。一是与先天遗传有关的某些生物酶的缺乏,另一个就是体内叶酸、维生素B6、维生素B12等营养元素的缺乏。这两种缺乏都会影响同型半胱氨酸转化为其他物质,导致高同型半胱氨酸血症。目前国内测定同型半胱氨酸的方法主要有:(1)质谱法,该方法操作复杂,价格昂贵,不易开展。(2)胶乳增强免疫比浊法,该方法灵敏度较低,易产生带现象。(3)酶循环法,该方法虽然准确性高,但有干扰物的影响。例如:胆红素加入浓度在4.0mg/dl、8.0mg/dl、12.0mg/dl、16.0mg/dl、和20.0mg/dl时,产生的干扰偏差分别为-0.85%、0.51%、0.17%、-1.24%和-1.41%;血红蛋白加入浓度在3.3g/L、6.7g/L、10.0g/L、11.7g/L和13.3g/L时,产生的干扰偏差分别为4.49%、5.09%、6.55%、4.71%和6.71%;而荧光法中,胆红素、血红蛋白对该试剂盒的测定结果无明显干扰基于此,做出本申请。技术实现要素:针对现有同型半胱氨酸在测试过程中存在的上述缺陷,本发明首先提供一种快速灵敏、准确性好、特异性高、稳定性好、液体双试剂操作简便,采用国内外先进的荧光法,适用于临床全自动或半自动生化分析(手工加样品、试剂)的同型半胱氨酸测定试剂。为实现上述目的,本申请采取的技术方案如下:一种同型半胱氨酸的测定试剂,由R1a试剂、R1b试剂、R2试剂和标准样构成,所述的R1a试剂是由TritonX-100溶解于添加有缓冲液、二硫苏糖醇(DTT)的纯化水中所形成的溶液;所述的R1b试剂是由基因重组蛋氨酸裂解酶溶解于添加有缓冲液、山梨醇、蔗糖、海藻糖、4-氨基-N,N-二甲基苯胺盐酸盐的纯化水中所形成的溶液;所述的R2试剂是添加有盐酸、三氯化铁的纯化水中所形成的溶液;所述的标准样是由同型半胱氨酸、牛血清蛋白、缓冲液和叠氮钠溶解于纯化水中形成的溶液。进一步的,作为优选:所述的R1a试剂中,缓冲液为三羟甲基氨基甲烷(Tris),更优选的,所述的三羟甲基氨基甲烷(Tris)的浓度为100mmol/L,二硫苏糖醇(DTT)的浓度为0.5mmol/L,TritonX-100的浓度为0.2%。所述的R1b试剂中,山梨醇的浓度3%,蔗糖的浓度为2%,海藻糖的浓度为2%,4-氨基-N,N-二甲基苯胺盐酸盐浓度为20mmol/L,基因重组蛋氨酸裂解酶浓度为0.75KU/L。所述的R2试剂中,盐酸浓度为10%,三氯化铁浓度为15mmol/L。所述的标准样中,缓冲液为磷酸盐缓冲液,更优选的,所述的磷酸盐缓冲液的浓度为50mmol/L,牛血清蛋白浓度为0.5%,叠氮钠浓度为0.1%。同时,本申请还提供了一种具有上述特征同型半胱氨酸测定试剂的制备方法,包括如下步骤:(1)R1a试剂配制:向纯化水中加入缓冲液,搅拌至完全溶解;加入二硫苏糖醇(DTT)搅拌至溶解,加入TritonX-100,搅拌至溶解,继续搅拌后定容;(2)R1b试剂配制:向纯化水中加入缓冲液,搅拌至完全溶解;加入山梨醇搅拌至溶解,加入蔗糖,搅拌至溶解;加入海藻糖,搅拌至溶解;加入4-氨基-N,N-二甲基苯胺盐酸盐,搅拌至溶解;加入基因重组蛋氨酸裂解酶搅拌至完全溶解,继续搅拌后定容;(3)R2试剂配制:向纯化水中加入盐酸,搅拌至完全溶解;加入三氯化铁,搅拌至溶解,继续搅拌后定容;(4)同型半胱氨酸标准样配制:向纯化水中加入同型半胱氨酸,搅拌至完全溶解;加入缓冲液搅拌至溶解,加入牛血清蛋白搅拌至溶解;加入叠氮钠搅拌至完全溶解;继续搅拌后定容;(5)对上述制备的R1a试剂、R1b试剂和R2试剂及同型半胱氨酸标准样进行灵敏度、线性范围、精密度和准确度进行测定。进一步的,作为优选:所述的搅拌速度为450转/分。搅拌速度过高会导致剪切力过大,影响所配制溶体的表面张力和粘合力,搅拌速度过低则影响其混配效果,控制在450转/分时,在确保搅拌剪切适中的同时,也促进了其内所添加物质的融合。步骤(1)中,所述的纯化水为400ml,定容体积为500ml。定容前后体积变化在20%左右,可以很好的保证其内所添加其他物质良好的融合性,确保所配置的R1a试剂浓度、溶液稳定性最佳。步骤(2)中,所述的纯化水为2ml,定容体积为3ml。定容前后体积变化在20%左右,可以很好的保证其内所添加其他物质良好的融合性,确保所配置的R1b试剂浓度、溶液稳定性最佳。步骤(3)中,所述的纯化水为80ml,定容体积为100ml。定容前后体积变化在20%左右,可以很好的保证其内所添加其他物质良好的融合性,确保所配置的R2试剂浓度、溶液稳定性最佳。步骤(4)中,所述的纯化水为80ml,定容体积为100ml。定容前后体积变化在20%左右,可以很好的保证其内所添加其他物质良好的融合性,确保所配置的标准样浓度、溶液稳定性最佳。本发明的工作原理如下:本试剂盒使用酶转换法定量测定血清中同型半胱氨酸的总浓度。首先以还原剂将氧化态的同型半胱氨酸还原,再以基因重组酶将同型半胱氨酸分解。基因重组酶分解所形成的产物与显色剂反应后之产物可于660nm波长激发下发射出710nm波长荧光,测定其反应前后荧光度的差,即可计算出样本中同型半胱氨酸的含量。(1)灵敏度评价试验根据GB/T26124-2011《临床化学体外诊断试剂(盒)》中对“分析灵敏度”检测的要求,以试剂盒在规定参数下对分析灵敏度评价用样本进行检测产生的吸光度改变,换算为n单位的吸光度的差值(ΔA)作为分析灵敏度。分析灵敏度评价试验对分析灵敏度评价用样本重复测定20次。评估结果:分析灵敏度43.5μmol/L,荧光值≥700RFU。(2)线性范围评价试验根据GB/T26124-2011《临床化学体外诊断试剂(盒)》和《体外诊断试剂分析性能评估指导原则——线性范围(征求意见稿)》中的建议,对试剂线性范围进行验证时,在待验证线性范围内选择5个浓度水平,每个浓度水平重复测定3次。(3)精密度评价试验精密度评价包括重复性和批间差,且至少评估二个浓度水平样本的精密度,其中有一个浓度在医学决定水平左右。因此,重复性评价采用在重复性条件下,用二个浓度水平的控制物质(其中一个浓度接近医学决定水平)测试,每个浓度重复测试10次;批间差评价采用二个浓度水平的控制物质(其中一个浓度接近医学决定水平)分别测试3个不同批号的试剂盒,每个批号测试3次。(4)准确度评价试验用不少于40个在检测浓度范围内的不同浓度的人源样品,以指定的分析系统作为比对方法,每份样品按待测试剂操作方法及比对方法分别检测。用线性回归方法计算两组结果的相关系数(r)及每个浓度点的相对偏差。评估结果:三批试剂的重复性≤10%;批间差≤15%;相对偏差≤15%,试剂线性可达80μmol/L,分析灵敏度43.5μmol/L,荧光值≥700RFU。本发明利用荧光法测定同型半胱氨酸的方法,其优点是快速灵敏,准确性好,特异性高,稳定性好,操作简便,可适用于临床全自动或半自动生化分析仪配套使用。附图说明图1为本申请中抗原-荧光值曲线图;图2为本申请中抗体-荧光值曲线图;图3为本申请中测定试剂的准确度柱状图。具体实施方式实施例1本实施例所用主要试剂:R1a试剂:T三羟甲基氨基甲烷(Tris):100mmol/L;二硫苏糖醇(DTT):0.5mmol/L;TritonX-100:0.2%。R1b试剂:山梨醇:3%;蔗糖:2%;海藻糖:2%;4-氨基-N,N-二甲基苯胺盐酸盐:20mmol/L;基因重组蛋氨酸裂解酶:0.75KU/L。R2试剂:盐酸:10%;三氯化铁:15mmol/L。标准样:磷酸盐缓冲液:50mmol/L;牛血清蛋白:0.5%;叠氮钠:0.1%。1)R1a试剂的配制①将400ml纯化水加入到适当容器中。②开启电动搅拌器,搅拌速度均为450转/分。③称取0.5000gTris加入上述纯化水中,搅拌至完全溶解。④量取2.5ml二硫苏糖醇加入上述溶液中,搅拌至完全溶解。⑤量取1.0mlTritonX-100加入上述溶液中,搅拌至完全溶解。⑥搅拌十分钟以上。⑦定容至500ml。2)R1b试剂的配制①将2ml纯化水加入到适当容器中。②开启电动搅拌器,搅拌速度均为450转/分。③称取0.0010gTris加入上述纯化水中,搅拌至完全溶解。④量取0.09ml山梨醇加入上述溶液中,搅拌至完全溶解。⑤称取0.009g蔗糖加入上述溶液中,搅拌至完全溶解。⑥称取0.006g海藻糖加入上述溶液中,搅拌至完全溶解。⑦量取0.02ml4-氨基-N,N-二甲基苯胺盐酸盐加入上述溶液中,搅拌至完全溶解。⑧量取0.3ml基因重组蛋氨酸裂解酶加入上述溶液中,搅拌至完全溶解。⑨搅拌十分钟以上。⑩定容至3ml。3)R2试剂的配制①将80ml纯化水加入到适当容器中。②开启电动搅拌器,搅拌速度均为450转/分。③量取10ml盐酸加入上述纯化水中,搅拌至完全溶解。④称取1.500g三氯化铁加入上述纯化水中,搅拌至完全溶解。⑤搅拌十分钟以上。⑥定容至100ml。4)标准品的配制①将80ml纯化水加入到适当容器中。②开启电动搅拌器,搅拌速度均为450转/分。③量取0.5ml同型半胱氨酸加入上述纯化水中,搅拌至完全溶解。④量取5.46ml磷酸氢二钾加入上述纯化水中,搅拌至完全溶解。⑤量取4.53ml磷酸二氢钾加入上述溶液中,搅拌至完全溶解。⑥量取0.1ml牛血清蛋白加入上述溶液中,搅拌至完全溶解。⑦称取0.0200g叠氮钠加入上述溶液中,搅拌至完全溶解。⑧搅拌十分钟以上。⑨定容至100ml。4)试剂检验①仪器配置:仪器使用OP-162微量荧光检测仪。测定参数严格按照产品说明书在仪器中设定,基本测定参数如下:a.方法:终点法,反应方向:向上;激发光:660nm,发射光:710nm;温度37℃,反应时间:10min。b.比色杯光径:1cm;工作液(在R1b管中加入200μl的R1a混匀):200μl,R2试剂:30μl,同型半胱氨酸标准样:20μl。c.第一反应点:在工作液加入后恒温温育5min。d.第二反应点:在R2加入后恒温温育5min。②试剂外观检查:目测检查。③装量检查:用通用量具测量。④试剂空白测定:用蒸馏水或去离子水作为空白样品测试试剂盒,在660nm波长激发下发射出710nm波长荧光,测定其反应前后荧光度的差,差值即为工作试剂的空白吸光度。⑤线性范围测定:取接近线性范围上限的高值样本用生理盐水倍比稀释配制成不同浓度梯度的样本系列。以H值与稀释比例计算出预期值。稀释方法参照表1所示(根据高值的大小可相应调整稀释梯度)。表1样本稀释表实施例12345生理盐水(ml)00.50.50.50.5高值标本H(ml)10.50.50.50.5稀释比例原倍1/21/41/81/16实施例1样本的浓度为已知定值CH,实施例2-5样本浓度按公式:样本浓度=CH×稀释比例,计算作为预期值,将稀释好的样本系列充分混匀,在校正后的测定系统上按从低值到高值顺序平行测定2次,均值作为对应实施例样本实测值(如2次测定结果有明显偏差应剔除重测)。统计学分析:以预期值为横坐标,样本实测值为纵坐标作图及直线回归分析,确定线性区间计算出直线方程y=a+bx及相关系数,当相关系数r≥0.990时为线性良好。数据分析处理采用MicrosoftExcel软件。相关公式如下:b=nΣXiYi-ΣXi·ΣYinΣXi2-(ΣXi)2...(1)]]>|a|=|ΣYi-bΣXi|n...(2)]]>r-nΣXiYi-ΣXiΣYi[n·ΣXi-(ΣXi)][nΣYi-(ΣYi)]...(3)]]>式中,C:浓度;V:容积;b:回归线的斜率;∣a∣:回归线截距的绝对值;r:相关系数;Xi:各管预期值;Yi:各管测定值;i:1、2、3.……、n;n:测定样本数。⑥精密度测定:a.重复性测定:用临床标本或质控血清测试试剂盒,重复测试10次,计算测量值的平均值和标准差(s)。按如下公式计算变异系数(CV)。与变异系数CV(%):X‾=ΣX1/n...(4)]]>CV=Σ(X‾-Xi)(X‾)2(n-1)...(5)]]>式中:——待测血清样本的均值;Xi——测定血清样本的测定结果;n——测定次数;CV——变异系数。b.批间差测定取三个批号送检试剂,每个批号取3瓶,分别测定1份临床样本或质控血清,可选用罗氏质控品,分别计算9份试剂测定均值和每个批号3份试剂的测定均值并用MicrosoftExcel软件统计三个批号试剂测定的变异系数。相关公式如下:式中:——中的最大值;——中的最小值;——总均值。⑦准确性测定:相关系数r≥0.990。相对偏差≤15%;⑧分析灵敏度:用已知浓度或活性的样品测试试剂盒,记录在试剂盒规定参数下产生的吸光度改变,换算为n单位的吸光度差值(ΔA)。根据表1计算得到的预期值、实测值、变异系数CV、批间极差、相对偏差B以及吸光度差值ΔA汇总入表2。表2测试结果汇总表表3分析灵敏度对照表(1-20为平行实验序号)1234567891077676876081679276082481678477611121314151617181920776824792808784848776792816752表4批内重复性对照表表5批间精密度对照表评估结果及表2-5结果表明:本申请试剂的重复性变异系数CV≤10%;批间差≤15%;相对偏差≤15%,试剂线性可达80μmol/L,分析灵敏度43.5μmol/L,荧光值≥700RFU。本申请利用荧光法测定同型半胱氨酸的方法,测试过程快速灵敏,准确性好,特异性高,稳定性好,操作简便,可适用于临床全自动或半自动生化分析仪配套使用。以上内容是结合本发明创造的优选实施方式对所提供技术方案所作的进一步详细说明,不能认定本发明创造具体实施只局限于上述这些说明,对于本发明创造所属
技术领域:
的普通技术人员来说,在不脱离本发明创造构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明创造的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-939的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-933的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-939的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-933的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-939的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法-933的制作方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法
- 同型半胱氨酸诊断/测定试剂(盒)及同型半胱氨酸浓度测定方法