检测炎症性肌病NXP2自身抗体的非放射标记免疫沉淀方法与应用与流程
本申请属于生物技术领域,具体地说,涉及检测炎症性肌病NXP2自身抗体的非放射标记免疫沉淀方法与应用。
背景技术:
特发性炎症性肌病(idiopathic inflammatory myopathies,IIM)是一组以侵害骨骼肌为主的系统性自身免疫性疾病,自身免疫的异常是IIM的发生、发展的关键。根据最近的诊断分类标准,IIM可分为多发性肌炎(polymyositis,PM)、皮肌炎(dermatomyositis,DM)、免疫介导的坏死性肌炎(immune-mediated necrotizing myopathy,IMNM)、非特异性肌炎(nonspecific myositis,NSM)和包涵体肌炎(inclusion body myositis,sIBM)。IIM临床特点表现为四肢近端肌无力、特征性皮疹、系统性损害以及血清中存在多种自身抗体,这些自身抗体与临床表型密切相关(Mei Zong&Ingrid E.Lundberg.Pathogenesis,classification and treatment of inflammatory myopathies.Nature Review sRheumatology,2011,7,297-306.)。
IIM患者的自身抗体主要分为肌炎特异性自身抗体(myositis specific autoantibodies,MSAs)和肌炎相关性自身抗体(myositis associated autoantibodies,MAAs)。传统的MSAs包括抗氨基酰tRNA合成酶(aminoacyl-tRNA synthetase,ARS)抗体、抗Mi-2抗体和抗信号识别颗粒(signal recognition particle,SRP)抗体,近些年也发现多种新的MSAs,如抗黑色素瘤分化相关基因(melanoma differentiation associated gene 5,NXP2)抗体、抗核基质蛋白2(nuclear matrix protein 2,NXP2)抗体、抗转录中介因子1(transcriptional intermediary factor 1,TIF1)抗体等,MSAs一般仅见于IIM患者,对于疾病的临床-血清学分类有重要的指导意义(Sarah L Tansley,Zoe E,Betteridge,Neil J,McHugh.The diagnostic utility of autoantibodies in adult and juvenile myositis.Current Opinion in Rheumatology,2013,25(6):772-777.)。
NXP-2蛋白(又名MORC3)定位于细胞核的PML(早幼粒细胞性白血病)核体,在RNA代谢及维持细胞核结构方面起到了重要的作用,还能募集和激活p53通路,调节多种细胞因子的转录(Kimura Y,Sakai F,Nakano O,Kisaki O,Sugimoto H,Sawamura T,Sadano H,Osumi T.The newly identified human nuclear protein NXP-2possesses three distinct domains,the nuclear matrix-binding,RNA-binding,and coiled-coil domains.J Biol Chem.2002;277:20611–20617)。Oddis等发现18%儿童皮肌炎(juvenile dermatomyositis,JDM)患者的血清中存在一种针对分子质量为140KD蛋白质的自身抗体,称为MJ(myositis iuvenile)/P140抗体(Oddis CV,Fertig N,Goel A,Espada G,Confalone Gregorian M,Maldonado Cocco JA,et al.Clinical and serological characterization of the anti-MJ antibody in childhood myositis.Arthritis Rheum.1997;40:S139.)。随后Targoff IN等通过免疫沉淀法确认了该抗体的靶抗原是NXP-2(Targoff IN,Trieu EP,Levy-Neto M,Fertig N,Oddis CV.Sera with autoantibodies to the MJ antigen react with NXP2.Arthritis Rheum.2007;56:S787)。Gunawardena等回顾英国及爱尔兰JDM的研究中发现,23%的JDM患者该抗体阳性,抗体阳性的患者更容易发生钙质沉着(Gunawardena H1,Wedderburn LR,Chinoy H,Betteridge ZE,North J,Ollier WE,Cooper RG,Oddis CV,Ramanan AV,Davidson JE,McHugh NJ;Juvenile Dermatomyositis Research Group,UK and Ireland.Autoantibodies to a 140-kd protein in juvenile dermatomyositis are associated with calcinosis.Arthritis Rheum.2009Jun;60(6):1807-14.)。Cefibelli等研究了58例意大利成年PM/DM患者,发现30%的DM和8%的PM患者血清中抗NXP-2抗体阳性。抗NXP-2抗体阳性的患者发病年龄较轻,向阳疹及皮下钙质沉着较明显,而少有内脏损伤和肿瘤的发生,对治疗反应更好(Angela Ceribelli,Micaela Fredi,Mara Taraborelli,Ilaria Cavazzana,Franco Franceschini,Marzia Quinzanini,Angela Tincani,Steven.J.Ross,Jason YF Chan,Brad A Pauley,Edward KL Chan,Minoru Satoh.Anti-MJ/NXP-2autoantibody specificity in a cohort of adult Italian patients with polymyositis/dermatomyositis.Arthritis Res Ther.2012;14(2):R97.)。Ichimura等研究了507例成年日本IIM患者,发现该抗体的阳性率在PM和DM患者中的阳性率均为1.6%。所有抗体阳性的患者均有明显的肌无力,血清肌酸激酶显著升高,但与DM的皮疹无明显相关性。另外37.5%的抗体阳性DM患者合并肿瘤(Ichimura Y,Matsushita T,Hamaguchi Y,Kaji K,Hasegawa M,Tanino Y,Inokoshi Y,Kawai K,Kanekura T,Habuchi M,Igarashi A,Sogame R,Hashimoto T,Koga T,Nishino A,Ishiguro N,Sugimoto N,Aoki R,Ando N,Abe T,Kanda T,Kuwana M,Takehara K,Fujimoto M.Anti-NXP2autoantibodies in adult patients with idiopathic inflammatory myopathies:possible association with malignancy.Ann Rheum Dis.2012May;71(5):710-3.)。卢昕等检测我国IIM患者NXP-2抗体水平,发现抗体阳性率为5.1%,阳性患者发病年龄较低,而皮下钙质沉积的发生率较高(卢昕,袁凯,杨阚波,彭清林,王艳,张学智,王国春.抗核基质蛋白2抗体在特发性炎性肌病中的分布及临床意义.中华风湿病学杂志,2014,18(4))。不同人群抗体阳性率及与临床相关性的差异可能与不同种族、地域、检测方法以及样本量大小有关,因此抗NXP2自身抗体在特发性炎症性肌病患者中的检测具有重要的临床意义。
检测自身免疫性疾病自身抗体的主要方法有酶联免疫吸附法(ELISA)、放射标记的免疫沉淀方法、免疫印迹法,但是目前国内还没有商业化的检测NXP2抗体的ELISA试剂盒以及免疫印迹膜条,大部分实验室对于NXP2抗体的检测包括:(1)购买纯化的NXP2蛋白包被酶标反应板,加入待测血清后孵育,使用酶标的抗人免疫球蛋白抗体可以检测出与抗原结合的抗体,随后用合适的酶底物进行显色;(2)购买纯化的NXP2蛋白与待测血清进行免疫沉淀,采用western Blot检测沉淀后的产物;(3)采用S35标记Hela细胞,然后用待测血清进行免疫沉淀,SDS-PAGE电泳分离沉淀物、放射自显影,这是检测MSA的金标准。以上方法各有优缺点,酶联免疫吸附法为自身抗体的检测提供了敏感性高且较迅速的方法,但是目前尚无商业化的检测NXP2抗体的ELISA试剂盒,这种方法需要高度纯化的抗原,而且抗原包被的条件需要最优化,容易出现假阳性的结果,需要批量操作,对于发病率不是那么高的炎症性肌病,导致成本的增加;作为金标准的放射标记免疫沉淀法有很高的特异性和敏感性,而且这种方法沉淀的是以天然构象存在的抗原以及与靶抗原相互作用的蛋白分子,但是放射同位素只能用于装备良好的实验室,并要求严格控制,不适合推广使用。
技术实现要素:
本发明的目的在于提供检测炎症性肌病NXP2自身抗体的非放射标记免疫沉淀方法与应用,解决目前国内还没有商业化检测NXP2抗体的ELISA试剂盒以及免疫印迹膜条的缺陷,以及自行包被NXP2抗原的ELISA试剂盒的高成本、高假阳性率和放射标记免疫沉淀法的安全性等问题。
本发明的目的通过以下技术方案来实现:
检测炎症性肌病NXP2自身抗体的非放射标记免疫沉淀方法,包括以下步骤:
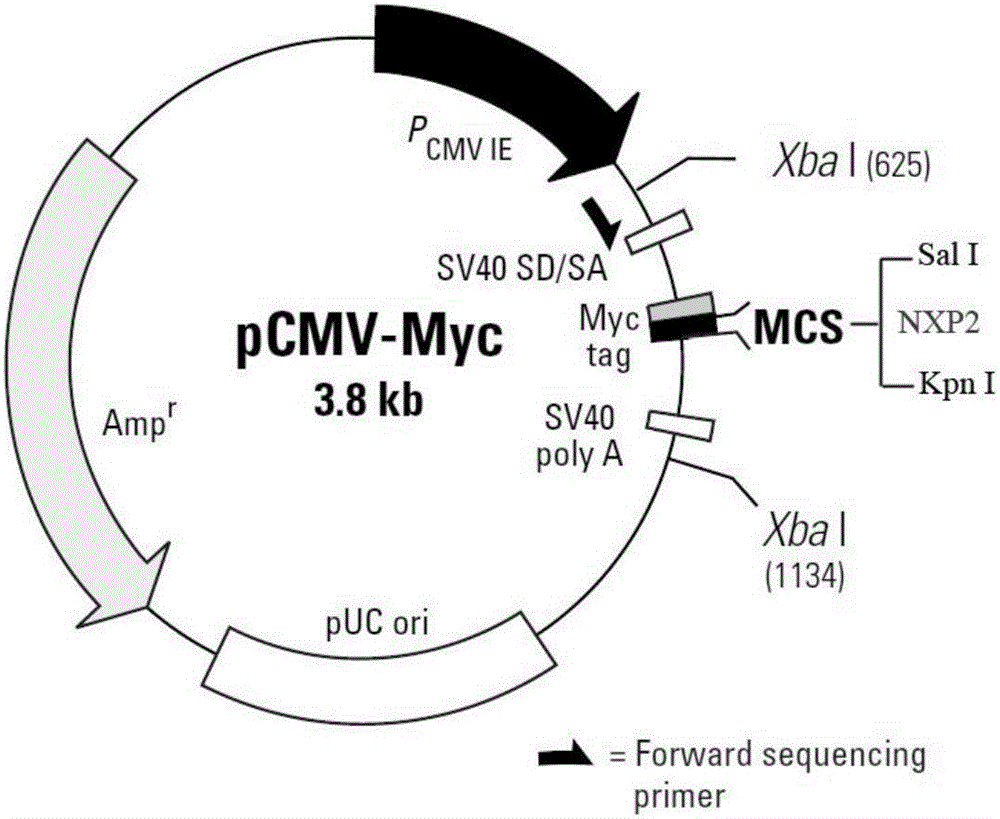
1)利用引物对NXP2-F/NXP-R2和引物对NXP2-F2/NXP2-R从pCMV-myc-NXP2全长质粒中分别PCR扩增人NXP2的N端(Genbank:NM_015358.2,80-1576bp)或C端(Genbank:NM_015358.2,1274-2896bp);
2)用胶回收试剂盒(Omega,D2500-01)回收纯化NXP2的N端或C端,然后克隆至pCMV-myc载体,构建含NXP2N端或NXP2C端并且带有Myc标签的pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒,通过酶切鉴定确定所述pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒的插入子;
3)测序证实所述pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒中的NXP2N端或NXP2C端序列和读码框的准确性;
4)将所述pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒瞬时转染人胚肾(HEK)293细胞48小时,通过Western Blot法使用c-myc抗体或NXP2抗体检测所述pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒的NXP2N端或NXP2C端在HEK293细胞中的过表达;
5)用Protein G magnetic beads分别与20ul NXP2抗体阳性的炎症性肌病患者血清或健康对照血清进行结合,继而与过表达的NXP2N端或NXP2C端的细胞裂解液孵育进行抗原吸附,洗脱后进行SDS-PAGE凝胶电泳,用c-myc抗体进行检测。
检测炎症性肌病NXP2自身抗体的非放射标记免疫沉淀方法的应用,用于检特发性炎症性肌病患者的抗NXP2自身抗体。
附图说明
此处所说明的附图用来提供对本申请的进一步理解,构成本申请的一部分,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
图1是本发明pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒的酶切鉴定结果图;
图2是本发明含NXP2的N端或C端并且带有Myc标签的pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒图谱;
图3是本发明测序证实pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒中NXP2的N端(a)或C端(b)序列和读码框的准确性对照图;
图4是本发明Western Blot法检测pCMV-myc-NXP2或pCMV-myc-NXP2C质粒在HEK293细胞的过表达;其中,(a)为c-myc抗体检测pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒在HEK293细胞的过表达;(b)为NXP2抗体检测pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒在HEK293细胞的过表达;
图5是本发明采用NXP2抗体阳性的炎症性肌病患者血清和健康对照血清与过表达NXP2N端或NXP2C端的HEK293细胞裂解液进行免疫沉淀,western Blot检测沉淀的NXP2蛋白,从而证实炎症性肌病患者血清中NXP2抗体能够识别HEK293细胞中的含Myc标签的NXP2N端或C端;
图6是本发明采用非放射标记免疫沉淀方法筛选炎症性肌病患者血清中的NXP2抗体;其中(a)和(b)为分别选自不同炎症性肌病患者血清检测的NXP2抗体,HC为健康对照,IM为炎症性肌病。
具体实施方式
以下将配合附图及实施例来详细说明本申请的实施方式,借此对本申请如何应用技术手段来解决技术问题并达成技术功效的实现过程能充分理解并据以实施。
实施例1炎症性肌病NXP2自身抗体的非放射标记免疫沉淀检测方法
炎症性肌病NXP2自身抗体的非放射标记免疫沉淀检测方法,包括以下步骤:
(1)设计引物对NXP2-F(5’-CGGTCGACCGCGGCGCAGCCACC-3’)和NXP2-R2(5’-GCGGTACCTTAGCTTGGAGTTGAAAGAGC-3’)、引物对NXP2-F2(5’-CGGTCGACCGAAGATATACAGAAGCGTCC-3’)和NXP2-R(5’-GCGGTACCTTAAGTACTACTGATTTCACTCATT-3’),然后从pCMV-myc-NXP2全长质粒中分别扩增人NXP2的N端(Genbank:NM_015358.2,80-1576bp)或C端(Genbank:NM_015358.2,1274-2896bp)。
(2)用胶回收试剂盒(Omega,D2500-01)回收纯化PCR片段,用SalⅠ和KpnⅠ限制性内切酶分别进行双酶切,与SalⅠ和KpnⅠ已双酶切的pCMV-myc载体连接过夜,转化JM109细菌感受态,在含50ug/ml氨苄青霉素的平板上筛选阳性克隆,小量提取阳性克隆的质粒DNA,用SalⅠ和KpnⅠ酶切pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒DNA,结果显示两种质粒各含1.5kb或1.6kb的插入子(如附图1所示)。
(3)将该两种质粒DNA进行测序,证实NXP2N端或C端序列和读码框的准确性(如附图3所示),结果提示含NXP2N端(1-500aa)或NXP2C端(400-939aa)并且带有Myc标签的质粒pCMV-myc-NXP2N或pCMV-myc-NXP2C构建成功(如附图2所示)。
(4)将4ug pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒或pCMV-myc瞬时转染HEK293细胞48小时,SDS裂解液裂解HEK293细胞,进行SDS-PAGE凝胶电泳和转膜,一张膜采用c-myc抗体进行孵育,发现转染pCMV-myc-NXP2N质粒的HEK293细胞中有约为60Kd的特异性条带,转染pCMV-myc-NXP2C质粒的HEK293细胞中有两条约为70Kd和100Kd的特异性条带,而转染pCMV-myc质粒的HEK293细胞中没有特异性条带(如附图4(a)所示);同时,另一张膜采用NXP2抗体进行孵育,发现NXP2C端能被NXP2抗体识别而NXP2N端不能被NXP2抗体识别(如附图4(b)所示),以上结果提示pCMV-myc-NXP2N或pCMV-myc-NXP2C质粒能在HEK293细胞中过表达,表达的蛋白质约为60Kd的带有Myc标签的NXP2N端或70Kd和100Kd的带有Myc标签的NXP2C端。
(5)取50ul Protein G Magnetic Bead悬液与20ul NXP2抗体阳性的炎症性肌病患者血清或健康对照血清室温持续混匀1h以捕获抗体;反应后用500μL PBS(含0.1%20)洗涤磁珠3-5次,加入200ug过表达NXP2N端或NXP2C端的HEK293细胞裂解液,并用RIPA(含1%蛋白酶抑制剂)裂解液补足体积至500ul,2-8℃持续混匀过夜进行抗原吸附。重复上述清洗磁珠步骤3-5次,向其中加入40μL1×SDS-PAGE Loading Buffer混合均匀,70-90℃加热10min;立即收集上清液至新的EP管。然后将上述样品于10%SDS-PAGE电泳后转移至PVDF膜上,加入C-myc抗体杂交,ECL化学发光,证实炎症性肌病患者血清的NXP2抗体能够特异性地将HEK293细胞中过表达的带Myc标签的NXP2N端或NXP2C端沉淀下来(如附图5所示)。
实施例2检测50例炎症性肌病患者血清的NXP2抗体的阳性率
(1)接种30%HEK293细胞于75cm2的细胞培养皿,37℃培养小于24小时;
(2)将20ug pCMV-myc-NXP2C质粒转染HEK293细胞48小时;
(3)采用1ml含蛋白酶抑制剂的RIPA裂解液裂解HEK293细胞,蛋白进行定量;
(4)采用c-myc抗体证实HEK293细胞中过表达的NXP2C端。
取20ul炎性肌病患者待测血清、阳性血清、阴性血清分别与过表达NXP2C端的细胞裂解液进行免疫沉淀,进行SDS-PAGE凝胶电泳,然后用c-myc抗体进行检测,确定NXP2抗体在炎症性肌病患者中的阳性率约为12.8%(如附图6所示,(a)和(b)为分别选自不同炎症性肌病患者血清检测的NXP2抗体)。
上述说明示出并描述了发明的若干优选实施例,但如前所述,应当理解发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离发明的精神和范围,则都应在发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!