一种香附药材中天然α‑葡萄糖苷酶抑制剂的快速筛选方法与流程
本发明属于中药化合物筛选技术领域,尤其涉及一种香附药材中天然
背景技术:
目前,天然aghi的主流筛选方法有系统分离法、活性追踪法和高通量筛选法等,然而这些主流筛选方法均存在着一个重大缺陷,均需要进行复杂的、费时费力的分离工作,才能从天然混合物中分离出单体活性成分。由此可见,制约天然aghi筛选效率的主要因素是繁琐的分离纯化步骤,即使是高通量筛选,也仅仅是加快了活性测试的过程,但它仍需要大量的、经过系统分离后的单体化合物作为化合物库,方能进行快速筛选。为了突破这个瓶颈,一些着眼于简化化合物分离、纯化环节的快速筛选新方法迅速发展起来,其中基于固定化酶亲和吸附原理的快速筛选方法最受人们关注。
技术实现要素:
针对上述问题,本发明的目的在于提供一种香附药材中天然
本发明的上述目的通过以下技术方案予以实现:香附药材中天然
步骤1、固定化酶的合成:将氨基硅胶与戊二醛反应,得到醛基硅胶,即为空白基质;所得的醛基硅胶再与
步骤2、固定化酶的亲和吸附与解吸:将固定化酶与香附提取液共孵育一段时间后,离心分离出固定化酶,再将固定化酶上特异性亲和吸附的化合物洗脱下来,所述的特异性亲和吸附的化合物为aghi候选分子;重新取香附提取液,并将空白基质与香附提取液共孵育一段时间后,离心分离出空白基质,再将空白基质上特异性亲和吸附的化合物洗脱下来,所述的特异性亲和吸附的化合物为假阳性分子。
步骤3、香附aghi的结构确定:将aghi候选分子和假阳性分子分别进行uhplc-ms分析,测定二者的指纹图谱,随后将aghi候选分子的指纹图谱和假阳性分子的指纹图谱进行扣减(“aghi候选分子的指纹图谱”的信号减去“假阳性分子的指纹图谱”的信号),即可得到除去假阳性结果的香附aghi指纹图谱;再通过hr-ms技术即可确定香附aghi的结构。
步骤4、香附aghi的活性验证:将上述筛选出的香附aghi,采用常规的酶活测定法检测其agh抑制活性,进一步证明亲和筛选结果的可靠性。
与现有技术相比,本发明的筛选方法具有如下优势和特点。
本发明是在我们的前期研究成果的基础上进一步深入研究,前期研究发现,中药香附提取物具有很强的agh抑制活性,很有希望从中发现天然aghi活性单体,因此我们将香附提取物作为待筛选化合物库,采用固定化agh酶亲和筛选方法进行天然aghi的快速发现。本发明的方法是先将固定化agh酶与待筛选化合物库共孵育,利用酶和抑制剂间的特异性亲和作用力,形成“酶-抑制剂”复合体,随后将这种复合体从孵育体系中分离出来,再从复合体上解吸出抑制剂,并进一步鉴定出抑制剂结构。该方法的优点在于无需复杂耗时的分离工作,可在较短时间内(数小时)筛选出天然产物混合物中的活性抑制剂单体。
本发明的筛选方法相对于传统的天然aghi筛选方法而言,本技术具有快速(筛选周期由数天至数周缩短至数小时),高效经济(无需消耗大量药材、试剂、人力和场地),实用可靠(可消除假阳性,另包含活性验证环节)等突出特点;相对于目前已建立的一些aghi亲和筛选方法而言,本方法的特点在于:首次将基于固定化酶亲和技术的天然
附图说明
图1固定化酶的制备过程原理示意图。
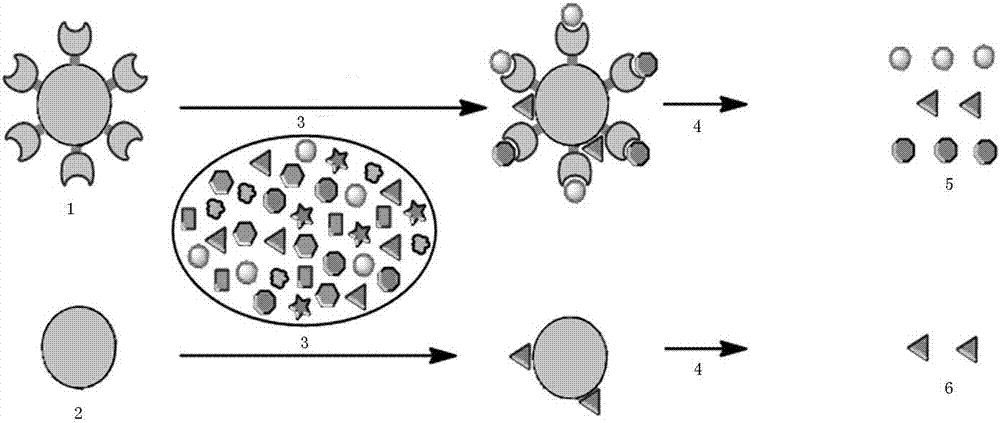
图2固定化酶的亲和吸附与解吸过程原理示意图;其中1为固定化酶,2为空白基质,3为香附提取物,4为亲和解析,5为aghi候选分子,6为假阳性分子。
图3香附aghi的结构确定过程的原理示意图;其中1为aghi候选分子,2为非特异性吸附的假阳性分子,3为注入uhplc-ms进行指纹图谱分析,4为aghi候选分子的指纹图谱,5为假阳性分子的指纹图谱,6为图谱扣减,7为扣除假阳性结果后得到的香附aghi的指纹图谱。
图4香附药材提取液的uhplc-ms指纹图谱。
图5aghi候选分子(实线)及假阳性分子(虚线)的uhplc-ms指纹图谱。
图6扣减后所得香附aghi的uhplc-ms指纹图谱。
图7峰1的hr-ms图谱及分子结构。
图8峰2的hr-ms图谱及分子结构。
图9峰3的hr-ms图谱及分子结构。
图10峰4的hr-ms图谱及分子结构。
具体实施方式
下面结合具体实施例对本发明做进一步的说明。
实施例1。
一、固定化酶的合成。
将0.2g氨丙基硅胶(10
将0.1g醛基硅胶加入到2.5ml浓度为5.25mg/ml的agh缓冲液中(缓冲液为:50mmna2hpo4溶液,ph7.0),室温振荡反应1h,再于4℃冰箱中反应24h;反应结束后,用缓冲液(50mmna2hpo4缓冲液,ph7.0)、含0.2mkcl的缓冲液、h2o依次洗涤,除去未反应的酶,最后在缓冲液中保存,得agh键和硅胶,即固定化酶。
固定化酶的制备过程原理,如图1所示。
二、香附药材提取液的制备。
取香附药材粉末0.2g,过80目筛;用20ml80%甲醇水溶液在室温下超声提取30min;提取液过滤,冻干,再用10ml亲和缓冲液(亲和缓冲液为:67mmkh2po4(含5%甲醇),ph6.8)复溶,然后0.45
三、固定化酶的亲和吸附与解吸。
将400
将上述过程中的固定化酶替换为空白基质,即可得到只在基质上有非特异性吸附的假阳性分子溶液。
固定化酶的亲和吸附与解吸过程原理,如图2所示。
四、香附aghi的结构确定。
香附aghi的结构确定过程的原理,如图3所示。
将所得的aghi候选分子溶液和假阳性分子溶液,分别在氮吹仪上浓缩至10
三种香附aghi对照品的制备方法可参见文献(中国专利:cn104910172a)。
五、香附aghi的活性验证。
对三种香附aghi(scirpusinsb、cyperusphenola、mesocyperusphenola)和阳性对照(阿卡波糖)进行常规的agh抑制活性实验,以证明筛选结果的可靠性。
采用对硝基酚-
三种香附aghi的分离纯化:纯化方法参见文献(中国专利:cn104910172a)。
样品的配制:将0.48ml磷酸缓冲液(67mm,ph6.8),0.02ml谷胱甘肽(3mm),0.05mlpnpg(10mm)和0.02ml待测样品溶液(三种香附aghi(scirpusinsb、cyperusphenola、mesocyperusphenola)和阿卡波糖)混合均匀后,于37℃孵育10min,然后加入0.02mlα-葡萄糖苷酶(0.3u/ml),混合均匀后,于37℃孵育20min,所有的试剂均用磷酸缓冲液(67mm,ph6.8)配制;用2.4ml碳酸钠水溶液(100mm)终止酶解反应,随即于410nm波长下检测吸光度(as)。
对照样品的配制方法与上述样品的配制方法基本相同,仅将待测样品溶液替换为等量的磷酸缓冲液(67mm,ph6.8)。
空白样品和空白对照的配制方法也分别与上述样品和对照样品的配制方法基本相同,仅分别将样品和对照样品中的
样品抑制活性(%)计算公式为:抑制率(%)=100%×[(as-asb)/(ac-acb)]。
其中,as、asb、ac及acb分别代表样品、空白样品、对照样品和空白对照组的吸光度;所有数据重复测定三次;4个样品在不同浓度点的具体抑制率,见表1;三种香附aghi及阳性对照(阿卡波糖)的agh抑制活性,见表2。
表1三种香附aghi及阳性对照的agh抑制率。
表2三种香附aghi及阳性对照的agh抑制活性。
由表2结果可知,本发明所筛选得到的三种香附aghi(scirpusinsb、cyperusphenola、mesocyperusphenola)均为agh的强效抑制剂,进一步证明和验证了本筛选方法的可靠性。
- 还没有人留言评论。精彩留言会获得点赞!