用于接触活化系统相关的疾病的蛋白生物标记的制作方法
本申请根据35u.s.c.§119(e)要求于2017年6月12日提交的美国临时申请no.62/518,492和于2016年9月16日提交的美国临时申请no.62/395,712的权益。这些参考申请的每篇的全部内容通过引用并入本文。
背景技术:
血浆接触活化系统是涉及一组血浆蛋白酶的促炎症反应的且促凝血的系统。其通过暴露于外源物质或带负电的表面时被因子xiia或在内皮细胞表面上被脯氨酰羧肽酶活化(sainzi.m.等,thromb.haemost.(2007)98,77-83)。不适当的或未经调节的接触系统活化涉及多种疾病,包括遗传性血管性水肿(hae)。
hae是造成肿胀阵发性发作的疾病,其可影响身体的多个部分,比如面部、四肢、生殖器、胃肠道和上气道。因为hae症状通常与变态反应或肠绞痛的症状类似,所以通常难以确诊hae患者,直到他们显示严重的或威胁生命的症状。早期诊断将使得更好地管理与急性hae发作相关的紧急情况,并且也将有助于管理hae患者来预防或减少急性hae发作,例如,允许hae患者避免暴露于可能触发hae发作的刺激。
因此,非常感兴趣的是鉴定用于hae的生物标记,并且开发可靠的诊断和预后方法,用于鉴定患有某些类型的hae或处在遭受急性hae发作的风险中的受试者。这种生物标记也将有益于关于发病机理的研究,这可促进开发用于该疾病的有效的新疗法。
技术实现要素:
本公开基于鉴定与从健康个体相比,在从患有与接触活化系统相关的疾病的受试者获得的生物样品中区别存在的蛋白质,或在从这种疾病的不同阶段(例如,发作对静息)的受试者获得的生物样品中区别存在的蛋白质。
因此,本公开的一个方面提供了分析样品的方法,所述方法包括(i)提供从患有与接触活化系统相关的疾病、疑似患有与接触活化系统相关的疾病或处在与接触活化系统相关的疾病的风险中的受试者,比如人受试者获得的生物样品(例如,血清样品或血浆样品);和(ii)测量包括选自表1中的至少一种蛋白质的生物标记组的水平,其中如果生物标记组由一种蛋白质组成,则所述蛋白质不是c4、血浆前激肽释放酶、凝血酶、组织型纤溶酶原激活剂(tpa)和热休克蛋白90。在一些实施方式中,与接触活化系统相关的疾病是遗传性血管性水肿(hae),比如1型hae或ii型hae。
在一些实施方式中,生物标记组由选自表1中的2-10种蛋白质组成。在一些实施方式中,至少一种蛋白质是线粒体蛋白,其可为atp合酶亚单位o(atpo)、亲环蛋白f或线粒体热休克蛋白60(hsp60)。在一些实施方式中,至少一种蛋白质是14-3-3ζ/δ或14-3-3β/α。在一些实施方式中,至少一种蛋白质是蛋白激酶,其可为蛋白激酶yes、蛋白激酶lyn或丝裂原活化蛋白激酶14(mapk14)。在一些实施方式中,至少一种蛋白质是糖原合酶激酶3α/β。在一些实施方式中,至少一种蛋白质是atp依赖性rna解旋酶ddx19b(deadbox19b)。在一些实施方式中,至少一种蛋白质为真核翻译起始因子5a-1(eif-5a-1)。
在一些实施方式中,提供生物样品包括将生物样品收集至包括一种或多种蛋白酶抑制剂的真空采血管中。在一些实施方式中,使用酶联免疫吸附试验(elisa)、免疫印迹试验或侧流测定(lateralflowassay)进行测量生物标记组的水平。
在一些实施方式中,方法进一步包括如果受试者的生物标记组的水平偏离对照受试者的相同生物标记组的水平,则将受试者鉴定为患有与接触系统相关的疾病。在一些实施方式中,方法进一步包括如果受试者被鉴定为患有疾病,则向受试者施用有效量的用于治疗该疾病的治疗剂,比如血浆激肽释放酶(pkal)抑制剂、缓激肽2受体抑制剂和/或c1酯酶抑制剂。在一些实施方式中,pkal抑制剂是抗pkal抗体(例如,lanadelumab)或抑制性肽(例如,艾卡拉肽(ecallantide))。在一些实施例中,缓激肽2受体抑制剂是抑制性肽(例如,艾替班特(icatibant))。在一些实施例中,c1酯酶抑制剂是人血浆衍生的c1酯酶抑制剂。
在一些实施方式中,受试者是正在治疗该疾病的人患者,并且其中方法进一步包括基于生物标记组的水平评估治疗的功效,受试者的生物标记组的水平与对照受试者的生物标记组的水平的偏离表示治疗功效。在一些实施方式中,方法进一步包括基于生物标记组的水平,鉴定用于受试者的适当的治疗。在一些实施方式中,方法进一步包括基于生物标记组的水平,将受试者鉴定为用于疾病治疗的候选者。
本公开提供了能够鉴定具有与接触活化系统相关的疾病(例如,hae)的患者的生物标记。测量生物标记组的水平也可用于这种疾病的评估和治疗。
在另一方面中,提供了用于分析患有与接触系统相关的疾病、疑似患有与接触系统相关的疾病或处在与接触系统相关的疾病的风险中的受试者的样品的试剂盒,该试剂盒包括对于选自表1中的第一蛋白生物标记特异性的第一结合剂;和对于选自表1中的第二蛋白生物标记特异性的第二结合剂;其中第一蛋白生物标记和第二蛋白生物标记不同。在一些实例中,第一和/或第二结合剂是对于蛋白标记特异性的抗体。在一些实施方式中,试剂盒可进一步包括结合第一结合剂的第一检测试剂和结合第二结合剂的第二检测试剂。在一些实施方式中,第一结合剂和第二结合剂固定在支撑元件上。
下面描述中阐释了本公开的一个或多个实施方式的细节。本公开的其他特征或优势从下述附图和数个实施方式的详细描述中、并且也从所附的权利要求中将是显而易见的。
附图说明
下述附图形成本说明书的一部分并且被包括以进一步表明本公开的某些方面,这些方面可通过参考这些附图中的一个或多个结合本文呈现的具体实施方式的详细描述而被更好地理解。
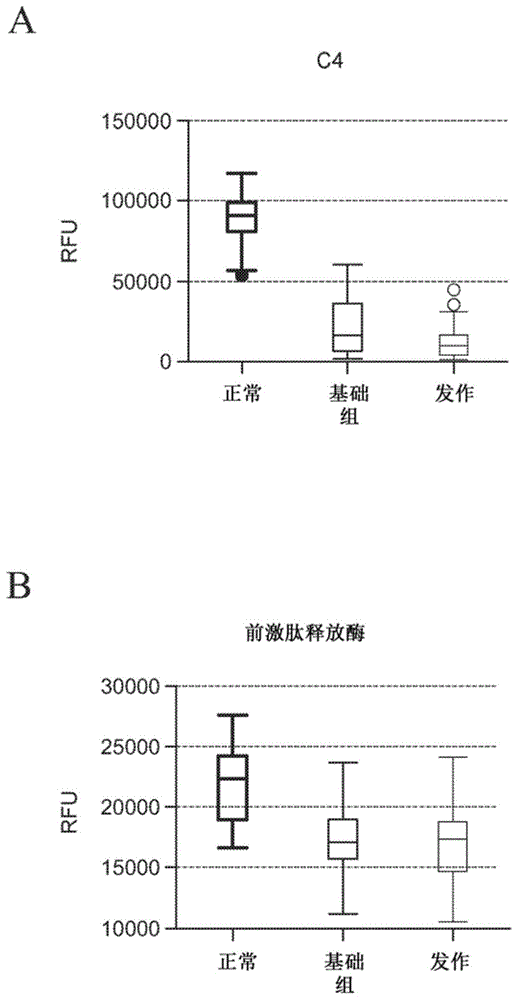
图1呈现了显示在来自患有hae(i型/ii型)的患者在基础水平(“基础”,n=33)和hae发作期间(“发作”,n=33)和健康个体(“正常”,n=22)的血浆样品中检测的蛋白质水平的箱线图。a:补体蛋白4(c4)水平。b:从健康个体(n=22)、基础hae(i/ii)(n=33)和发作hae(i/ii)(n=33)血浆获得的血浆样品中的前激肽释放酶水平。rfu是相对荧光单位。
图2呈现了显示在用fxiia活化之后,来自患有hae(i型/ii型)在基础水平(“hae基础”,n=9)的患者、来自hae发作期间的hae患者(“hae发作”,n=10)和来自健康个体(“hv”,n+28)的血浆样品中血浆激肽释放酶生成速率的图。
图3呈现了显示在来自患有hae(i型/ii型)在基础水平(“haeb”,n=18)和hae发作期间(“haea”,n=19)的患者和健康个体(“正常”,n=22)的血浆样品中检测的c1-酯酶抑制剂(c1-inh)蛋白水平的箱线图。a:显示了来自每个个体的血浆样品中检测的c1-inh,包括由箭头指示的异常值。b:显示了来自每个个体的血浆样品中检测的c1-inh,忽略了异常值。rfu是相对荧光单位。来自健康的患者的血浆样品中的平均c1-inh是6522rfu±1852(标准偏差,sd)。来自在基础水平的患有hae的患者的血浆样品中的平均c1-inh是1231rfu±673(sd),并且来自在发作期间的患有hae的患者的血浆样品中的平均c1-inh是1082rfu±530(sd)。
图4呈现了显示在来自患有hae(i型/ii型)的患者在基础水平(“haeb”)和hae发作期间(“haea”)和健康个体(“正常”)的血浆样品中检测的参与线粒体功能的数种蛋白质的水平的箱线图。a:atp合酶亚单位o水平。b:亲环蛋白f水平。c:线粒体热休克蛋白60(hsp60)。rfu是相对荧光单位。
图5呈现了显示在来自患有hae(i型/ii型)的患者在基础水平(“haeb”,n=33)和hae发作期间(“haea”,n=33)和健康个体(“正常”,n=22)的血浆样品中检测的蛋白质水平4-3-3蛋白质ζ/δ的箱线图。rfu是相对荧光单位。
图6呈现了显示来自患有hae(i型/ii型)的患者在基础水平(“haeb”,n=33)和hae发作期间(“haea”,n=33)和健康个体(“正常”,n=22)的血浆样品中的il-1f6蛋白水平的箱线图。rfu是相对荧光单位。
图7呈现了显示来自患有hae(i型/ii型)的患者在基础水平(“hae基础”)、来自hae患者在hae发作期间(“hae发作”)和健康个体(“hv”)的血浆样品中的蛋白激酶水平的图。a:酪氨酸-蛋白激酶(yes)。b:酪氨酸-蛋白激酶lyn(lyn)。c:丝裂原活化蛋白激酶14(mapk14)。rfu是相对荧光单位。
图8呈现了显示来自患有hae(i型/ii型)的患者在基础水平(“hae基础”)、hae患者在hae发作期间(“hae发作”)和健康个体(“hv”)的血浆样品中的糖原合酶激酶3α/β(gsk-3α/β)蛋白水平的图。rfu是相对荧光单位。
图9呈现了显示来自患有hae(i型/ii型)的患者在基础水平(“hae基础”)、hae患者在hae发作期间(“hae发作”)和健康个体(“hv”)的血浆样品中的atp依赖性rna解旋酶ddx19b(deadbox蛋白19b)蛋白水平的图。rfu是相对荧光单位。
图10呈现了显示来自患有hae(i型/ii型)的患者在基础水平(“hae基础”)、hae患者在hae发作期间(“hae发作”)和健康个体(“hv”)的血浆样品中的真核翻译起始因子5a1(elf-5a-1)蛋白水平的图。rfu是相对荧光单位。
具体实施方式
接触活化系统通过释放促炎症肽缓激肽启动固有的凝血途径且促进炎症。因子xii(fxii),也称为哈格曼因子,是在固有的凝血途径以及激肽释放酶-激肽系统的活化中起作用的丝氨酸蛋白酶。fxii通过带负电的表面(例如,多阴离子表面、玻璃、多磷酸盐、鞣花酸)活化,以产生活化形式的fxiia。活化的fxiia能够切割前激肽释放酶,产生活化的pkal。随后,活化的pkal能够将fxii切割成fxiia,产生其中fxiia产生甚至更多pkal的正反馈回路,pkal进一步将另外的fxii活化成fxiia。活化的pkal也能够切割高分子量激肽原(hmwk)以释放缓激肽。在与接触系统活化相关的疾病比如hae中,增加的缓激肽的水平可诱导血管舒张和炎症,其导致水肿性hae发作。期望鉴定新型的生物标记,其可用于例如鉴定由接触活化系统介导的疾病、鉴定患有这种疾病或处在患有这种疾病的风险中的受试者。
本公开至少部分地基于经由蛋白质组学分析鉴定与健康个体相比,在从患有与接触活化系统相关的疾病(例如,基础(basal)或发作)的受试者获得的生物样品中区别存在的蛋白质。出人意料地观察到,与健康个体相比,属于特定细胞途径或过程的蛋白质(例如,参与线粒体功能的蛋白质)和属于蛋白质家族的蛋白质(例如,7成员蛋白质家族)在来自患有疾病的受试者的样品中具有类似的趋势(例如,升高或降低的水平)。
因此,本文提供了通过检测蛋白生物标记组的存在或测量蛋白生物标记组的水平,分析来自患有与接触活化系统相关的疾病(例如,hae)、疑似患有与接触活化系统相关的疾病(例如,hae)或处在与接触活化系统相关的疾病(例如,hae)的风险中的受试者的生物样品的方法。这种方法可用于例如鉴定处在与接触活化系统相关的疾病(例如,hae)的风险中的患者、选择用于治疗的候选者、监测疾病进展或疾病状态、评估针对疾病的治疗功效、确定治疗过程、评估受试者是否处在疾病发作的风险中、鉴定疾病或障碍(disorder)是否与接触活化系统相关,和/或用于研究目的,包括例如研究疾病的机理和/或涉及疾病的生物途径/过程,可以依赖其用于开发新的疗法。
接触活化系统蛋白生物标记
本文所述的方法和试剂盒至少部分地基于鉴定这样的蛋白质:其被发现与来自健康受试者的样品相比,在来自患有hae的受试者的样品中区别存在、和/或在来自处于这种疾病的不同阶段(例如,基础对发作)的受试者的样品中区别存在。如本文所使用,术语“蛋白生物标记”或“蛋白生物标记组”指在来自不同的受试者组,例如患有与接触系统相关的疾病的受试者对健康受试者(例如,没有疾病的受试者)、或患有疾病并且在静息阶段的受试者对疾病发作中的受试者的样品中,以不同水平存在的一种蛋白质或蛋白质组。这种生物标记/生物标记组可用于诊断/预后应用和非临床应用(例如,用于研究目的)。
在一些实施方式中,与来自健康受试者的样品中的相同蛋白生物标记的水平相比,来自患有与接触活化系统相关的疾病(例如,hae)的受试者的样品中的蛋白生物标记可以以升高的水平存在。在一些实施方式中,与来自健康受试者的样品中的生物标记的水平相比,来自患有与接触活化系统相关的疾病(例如,hae)的受试者的样品中的蛋白生物标记可以以降低的水平存在。在其他的情况中,与疾病静息期间的受试者相比,从如本文所描述的疾病的发作下的受试者获得的样品中的蛋白生物标记可以以升高的水平存在。可替选地,与疾病静息期间的受试者相比,从如本文所描述的疾病的发作下的受试者获得的样品中的蛋白生物标记可以以降低的水平存在。
在一些实施方式中,包含一种或多种生物标记的蛋白生物标记组可在本文所述的方法中分析。当蛋白生物标记组包含多于一种的生物标记时,与健康受试者相比,在患有疾病的受试者中,所有的生物标记可以以升高的水平或降低的水平存在。可替选地,蛋白生物标记组可包含与健康受试者相比,在患有疾病的受试者中升高的至少一种生物标记和与健康受试者相比,在患有疾病的受试者中降低的至少一种生物标记。
类似地,蛋白生物标记组用于区分在疾病发作下的受试者与疾病静息下的受试者,生物标记组可包含与第二疾病阶段(例如,静息)相比,在第一疾病阶段(例如,发作)中都升高的或都降低的多种生物标记。可替选地,生物标记组可包含与第二疾病阶段相比,在第一疾病阶段中升高的至少一种生物标记,和与第二疾病阶段相比在第一疾病阶段中降低的至少一种生物标记。
下面表1提供了可通过本文所述的方法评估的标记,以对于与接触活化系统相关的疾病,评估受试者或来自受试者的生物样品。
在一些实施方式中,在本文所述的任何方法中测量和分析的生物标记组包括至少一种(例如,1、2、3、4、5、6、7、8、9、10或更多种)选自表1中的蛋白质。当生物标记组包括单个蛋白质时,该蛋白质可以不是补体蛋白4(c4)、c1抑制剂、前激肽释放酶、热休克蛋白90、组织型纤溶酶原激活剂或凝血酶。在一些实例中,待在本文所述的方法中测量和分析的蛋白生物标记组不包括补体蛋白4(c4)、c1抑制剂、前激肽释放酶、热休克蛋白90、组织型纤溶酶原激活剂和凝血酶中任何一种的组合。
如实施例1中描述,出人意料地发现参与线粒体功能的数种蛋白质与健康受试者相比,在来自患有hae的受试者的样品中区别存在。在一些实施方式中,生物标记组包括表1中列举的一种或多种线粒体蛋白。在一些实施方式中,线粒体蛋白生物标记组包括atp合酶亚单位o(atpo)、线粒体热休克蛋白60(hsp60)、亲环蛋白f(也称为亲环蛋白d或肽基-脯氨酰基顺-反异构酶f;ec:5.2.1.8),或其组合。
也如实施例1中描述,与健康受试者相比,也发现属于相关蛋白质家族的数种蛋白质在来自患有hae的受试者的样品中区别存在。在一些实施方式中,生物标记是14-3-3ζ/δ或14-3-3β/α。在一些实施方式中,生物标记是蛋白激酶,比如酪氨酸蛋白激酶yes、酪氨酸蛋白激酶lyn或丝裂原活化蛋白激酶14(mapk14),或其组合。在一些实施方式中,生物标记是糖原合酶激酶3α/β(gsk-3α/β)。在一些实施方式中,生物标记是atp依赖性rna解旋酶ddx19b(deadbox蛋白ddx19b)。在一些实施方式中,生物标记是真核翻译起始因子5a-1(eif-5a-1)。这些蛋白生物标记的任何组合也在本公开的范围内。
表1:接触系统活化生物标记
蛋白生物标记的使用
本公开的一个方面涉及通过测量样品中如本文所描述的生物标记组的水平,来分析从患有与接触活化系统相关的疾病、疑似患有与接触活化系统相关的疾病或处在与接触活化系统相关的疾病的风险中的受试者(例如,人患者)获得的样品的方法。从这种试验方法获得的结果将用于诊断和/或预后目的、以及用于其他非临床目的,比如研究目的。
(i)生物样品的分析
本文所述的方法涉及提供从受试者获得的生物样品。如本文所使用,“生物样品”指包括来自受试者的组织,例如,血液、血浆或蛋白质的组分。样品包括取自受试者的初始未处理的样品以及随后处理的样品、例如部分纯化的或保存的形式。示例性样品包括血液、血浆、泪液或粘液。在一些实施方式中,样品是体液样品,比如血清或血浆样品。在一些实施方式中,多种(例如,至少2、3、4、5或更多种)生物样品可在一段时间内或以具体时间间隔从受试者收集,例如以评估疾病进展或评估治疗的功效。
可使用本领域已知的任何方式从受试者获得生物样品。在一些实施方式中,通过将样品(例如,血液样品)收集至真空收集管(例如,真空采血管)中从受试者获得样品。在一些实施方式中,真空收集管包含一种或多种蛋白酶抑制剂,例如,以减少或防止样品收集期间,接触系统的离体活化。这种蛋白酶抑制剂可以包含在液体制剂中。在一些实施方式中,蛋白酶抑制剂包括至少一种丝氨酸蛋白酶抑制剂和至少一种半胱氨酸蛋白酶抑制剂。这种真空收集管是本领域已知的。参见,例如pct申请号us2016/046681。任选地,真空采血管可进一步包括一种或多种抗凝血剂。
术语“患者”、“受试者”或“个体”可替换使用并且指需要如本文所描述的分析的受试者。在一些实施方式中,受试者是人或非人哺乳动物。在一些实施方式中,受试者疑似或处在与接触活化系统相关的疾病或障碍(例如hae)的风险中。这种受试者可呈现出与该疾病相关的一种或多种症状。可替选地或另外,这种受试者可携带疾病的一种或多种风险因素,例如,与疾病相关的遗传因素(例如,ci-inh中的遗传缺陷)。
可替选地,需要本文所述的分析的受试者可为疾病的患者。这种受试者可能目前处在疾病发作中,或可能过去遭受过该疾病(例如,目前在疾病静息期间)。在一些实施例中,受试者是可能正在进行疾病治疗的人患者,例如,涉及c1酯酶抑制剂(c1-inh)、血浆激肽释放酶抑制剂或缓激肽抑制剂的治疗。在其他情况下,这种人患者可能没有进行这种治疗。
与接触活化系统相关的疾病的实例包括但不限于激肽释放酶介导的障碍,例如,缓激肽介导的障碍,比如遗传性血管性水肿(hae);非组胺依赖性特发性血管性水肿;风湿性关节炎;克罗恩病(crohn’sdisease);狼疮;阿尔茨海默氏疾病;脓毒性休克;烧伤;脑缺血性/再灌注损伤;脑水肿;糖尿病视网膜病变;糖尿病型肾病;黄斑性水肿;血管炎;动脉或静脉血栓形成;与心室辅助装置或支架相关的血栓形成;肝素诱导的血小板减少伴血栓形成;血栓栓塞病;和冠心病伴不稳定心绞痛;水肿;眼病;痛风;肠道肠疾病;口腔黏膜炎;神经性疼痛;炎症性疼痛;椎管狭窄-退行性脊椎病;术后肠梗阻;主动脉瘤;骨关节炎;遗传性血管性水肿;肺栓塞;中风;头部创伤或瘤周脑水肿;脓毒;急性中脑动脉(mca)缺血性事件(中风);再狭窄(例如,血管成形术之后);系统性红斑狼疮肾炎;自身免疫性疾病;炎症性疾病;心血管疾病;神经疾病;与蛋白质错折叠相关的疾病;与血管生成形相关的疾病;高血压肾病和糖尿病型肾病;过敏和呼吸疾病(例如,过敏、哮喘、慢性阻塞性肺部疾病、急性呼吸窘迫综合症、囊性纤维化、持续性鼻炎),以及组织损伤(例如,烧伤或化学损伤)。
在一些实施方式中,与接触活化系统相关的疾病或病况是遗传性血管性水肿(hae)。遗传性血管性水肿(hae)也称为“昆克(quincke)水肿”、c1酯酶抑制剂缺陷、c1抑制剂缺陷和遗传性血管神经性水肿(hane)。hae的特征在于严重肿胀(血管性水肿)的复发性发作,其可影响例如四肢、面部、生殖器、胃肠道和气道。hae的症状包括,例如手臂、腿、嘴唇、眼睛、舌头和/或喉咙的肿胀;可涉及喉咙肿胀和突然嘶哑的气道阻塞;没有明显原因的腹部绞痛的重复性发作;和/或肠道的肿胀,其可是严重的并且可导致腹部绞痛、呕吐、脱水、腹泻、疼痛和/或休克。约三分之一的患有hae的个体在发作期间出现称为边缘性红斑的不发痒皮疹。
气道的肿胀可以是威胁生命的并且造成一些患者的死亡。估计死亡率为15-33%。hae每年导致约15,000-30,000次急诊科就诊。
创伤或紧张(stress),例如,牙科手术、疾病(例如病毒性疾病,比如感冒和流感)、月经和外科手术,可以触发血管性水肿的发作。为了防止hae的急性发作,患者可尝试避免先前已经引起发作的特定刺激。但是,在许多情况下,在没有已知触发的情况下出现发作。典型地,hae症状首先在儿童时期出现并且在青春期恶化。未治疗的个体平均每1至2周发作一次,并且大部分发作持续约3天至4天(ghr.nlm.nih.gov/condition/hereditary-angioedema)。发作的频率和持续时间在患有遗传性血管性水肿的人当中、甚至在相同家族的人当中变化非常大。
存在三类hae,称为i型、ii型和iii型。据估计,每50,000人中有1人患有hae,i型占约85%的病例,ii型占约15%的病例,并且iii型非常罕见。iii型是最近描述的形式并且最初认为仅仅出现在女人中,但是已经鉴定了具有患病男性的家族。
hae以常染色显性模式遗传,使得患病的人可从一个患病的父母中遗传该突变。基因中也可出现新突变,并且hea也可出现在他们的家族中没有该障碍历史的人中。据估计,20-25%的病例源自新的自发突变。
serping1基因中的突变造成i型和ii型遗传性血管性水肿。serping1基因为制造对于控制炎症是重要的c1抑制剂蛋白质提供了指导。c1抑制剂阻碍了促进炎症的某些蛋白质的活性。造成i型遗传性血管性水肿的突变导致血液中降低的c1抑制剂的水平。相反,造成ii型的突变导致产生功能异常的c1抑制剂。在没有适宜水平的功能性c1抑制剂的情况下,产生过量的缓激肽。通过增加流体通过血管壁渗透进入身体组织,缓激肽促进炎症。流体在身体组织中的过量积聚造成患有i型和ii型遗传性血管性水肿的个体中可见的肿胀的发作。
f12基因的突变与iii型遗传性血管性水肿的一些病例相关。f12基因为制造凝血因子xii提供了指导。除了在血液凝结(凝血)中起到关键的作用,因子xii也是炎症的重要的刺激物并且参与缓激肽的产生。f12基因的某些突变导致产生具有增加活性的因子xii。结果,产生了更多的缓激肽且血管壁变得更加渗漏,其导致肿胀的发作。iii型遗传性血管性水肿的其他病例的病因仍是未知的。一个或多个迄今未鉴定的基因的突变可能造成这些病例中的障碍。
hae可与由变态反应或其他医学病况引起的其他形式的血管性水肿类似地出现,但是其病因和治疗明显不同。当hae被误诊为过敏时,最常见地是用对于hae通常无效的抗组胺剂、类固醇类和/或肾上腺素治疗,尽管肾上腺素可用于威胁生命的反应。误诊也已经导致对于患有腹部肿胀的患者不必要的探查性的外科手术,并且在一些hae患者中,腹部疼痛已经被错误地诊断为身心性的。
用于hae的c1抑制剂疗法以及其他疗法描述在kaplan,a.p.,jallergyclinimmunol,2010,126(5):918-925中。
提供hae发作的紧急治疗,以尽可能快速地停止水肿的进展。静脉内施用的来自供体血液的c1抑制剂浓缩物是一种紧急治疗;但是,该治疗在许多国家中不可用。在c1抑制剂浓缩物不可用的紧急情况下,新鲜冷冻的血浆(ffp)可用作替代物,因为其也包含c1抑制剂。
自从1979年,欧洲已经开始使用源自人血液的纯化的c1抑制剂。现在美国有数种c1抑制剂治疗可用并且现在加拿大有两种c1抑制剂产品可用。巴氏消毒的berinertp(cslbehring)于2009年被f.d.a.批准用于急性发作。纳米过滤的
急性hae发作的治疗也可包括用于疼痛缓解的药物和/或iv流体。
其他治疗方式可刺激c1抑制剂的合成,或减少c1抑制剂消耗。雄激素药物,比如达那唑,可通过刺激c1抑制剂的产生而降低发作的频率和严重程度。
幽门螺旋杆菌(helicobacterpylori)可触发腹部发作。治疗幽门螺旋杆菌的抗生素将减少腹部发作。
较新的治疗攻击接触级联反应。艾卡拉肽
hae的诊断可依赖于例如,家族史和/或血液检测。与i型、ii型和iii型hae相关的实验室发现描述在例如kaplan,a.p.,jallergyclinimmunol,2010,126(5):918-925中。i型hae中,c1抑制剂的水平如c4的水平一样降低,而c1q水平是正常的。在ii型hae中,c1抑制剂的水平是正常的或增加的;但是,c1抑制剂功能不正常。c4水平降低并且c1q水平是正常的。在iii型中,c1抑制剂、c4和c1q的水平可都是正常的。本公开至少部分地基于与健康个体相比,在来自hae患者的样品中具有不同水平的另外蛋白质(表1)的鉴定。测量这些蛋白质的生物标记组的水平可用于鉴定受试者是否患有疾病,比如hae。在一些实施方式中,该方法可用于确定患者是否已经患有或正患有hae发作。
可例如使用问卷,例如由患者、临床医生或家族成员完成的问卷评估hae的症状。这种问卷是本领域已知的并且包括例如视觉模拟量表。参见,例如mcmillan,c.v.等patient.2012;5(2):113-26。
可通过测量生物样品中如本文所描述的生物标记组的水平而进行分析本文所述的生物样品。本文公开的生物标记的水平(例如含量)或生物标记的水平的改变,可使用本文所述的试验和/或本领域已知的试验评估。本文所述的一种或多种生物标记可使用常规方法分析。在一些实施方式中,通过直接检测生物样品中的蛋白质,评估或测量生物标记的水平。可替选地或另外地,可例如通过检测蛋白质的活性的水平(例如酶试验)间接评估或测量生物样品中的蛋白质的水平。
在一些实施方式中,使用免疫试验测量生物标记。免疫试验的例子包括但不限于免疫印迹试验(蛋白质印迹)、酶联免疫吸附试验(elisa)(例如,夹心elisa)、放射免疫试验、基于电化学发光的检测试验、磁性免疫试验、侧流试验和相关的技术。用于检测本文提供的生物标记的另外适当的免疫试验对于本领域技术人员将是显而易见的。但是,对于本领域技术人员将是显而易见的是本公开不限于免疫试验,并且不基于抗体或抗原结合抗体片段的检测试验,比如质谱,也用于检测和/或量化如本文提供的接触系统生物标记。依赖于显色底物的试验也可用于检测和/或量化如本文提供的接触系统生物标记。
用于检测和/或量化接触系统生物标记、比如本文提供的那些的检测试验的类型将取决于其中使用试验的具体情况(例如临床或研究应用)、待检测的生物标记的种类和数量、以及待平行进行的患者样品的种类和数量等等。
elisa是本领域已知的(参见,例如crowther,johnr(2009).“theelisaguidebook.”第二版,humanapressandlequinr(2005).“enzymeimmunoassay(eia)/enzyme-linkedimmunosorbentassay(elisa)”.clin.chem.51(12):2415-8)并且本文描述了示例性elisa。用于进行elisa的试剂盒也是本领域已知的和商业上可得的(参见,例如来自lifetechnologies和bdbiosciences的elisa试剂盒)。
在一些实施方式中,免疫试验用于测量蛋白生物标记的水平。本文所述的免疫试验可为夹心elisa的形式,其中特异性结合生物标记组的蛋白质的第一结合剂固定在支撑元件上。然后,在使得结合剂和样品中的蛋白质之间形成复合物的条件下,可以将支撑元件与如本文所描述的生物样品孵育适当的时间段。然后,可以使用结合蛋白、结合剂-蛋白质复合物或结合剂的检测试剂,检测这种复合物。检测试剂可缀合至标签,所述标签可直接或间接释放信号。信号的强度表示样品中蛋白质的水平。在一些实施方式中,检测试剂被检测并且其水平表示样品中蛋白质的水平。
在本文所述的方法和试剂盒中,可以使用特异性结合期望的蛋白质的任何结合剂以测量生物样品中蛋白质的水平。在一些实施方式中,结合剂是特异性结合期望的蛋白质的抗体。在一些实施方式中,结合剂是特异性结合期望的蛋白质的适配体抗体。在一些实施方式中,样品可同时或顺序接触结合不同蛋白质的多于一种的结合剂(例如多重分析,例如somascantm试验(somalogic))。生物样品在适当的条件下接触结合剂。一般而言,术语“接触”指将结合剂暴露于生物样品或试剂足够在结合剂和样品中蛋白质(如果存在的话)之间形成复合物的适当的时间段。在一些实施方式中,接触通过毛细管作用进行,其中生物样品或试剂横跨支撑膜的表面移动。
在一些实施方式中,免疫试验可在低通量平台上进行,包括以单个免疫试验的形式。例如,低通量平台可用于测量生物样品(例如,生物组织、组织提取物)中蛋白质的存在和含量以用于诊断方法、监测疾病和/或治疗进展、和/或预测疾病或障碍是否可从具体的治疗获益。
在一些实施方式中,将结合剂固定至支撑元件可以是必要的。用于固定结合剂的方法将取决于比如结合剂的性质和支撑元件的材料的因素并且可能需要特定的缓冲液。这种方法对于本领域普通技术人员将是显而易见的。例如,如本文所描述的生物样品中的生物标记组可使用也是本文所述的任何试剂盒和/或检测装置测量。
如本文所使用,术语“测量(measuring)”或“测量(menasurement)”或可替选地“检测(detecting)”或“检测(detection)”意思是评估样品中物质的存在、缺乏、数量或含量(其可为有效量),包括导出这种物质的定性或定量浓度水平,或以其他方式评估受试者的值或分类。
试验,例如蛋白质印迹试验,可进一步涉及使用定量的成像系统,例如licor成像技术,其是商业上可得的(参见,例如来自li-corbiosciences的
在本文所述的任何方法中,生物标记组的蛋白质的水平可与对照样品或参考样品中的蛋白质的水平进行比较。
涉及也在本文中所述的任何蛋白生物标记组的本文所述的方法和试剂盒可用于评估与接触活化系统相关的疾病,比如本文所述的那些。
(ii)诊断和/或预后应用
在来自受试者的样品中检测到的表1中呈现的蛋白质的水平可用作可靠的生物标记,用于诊断与接触活化系统相关的疾病(例如hae)、监测这种疾病的进展、评估对于该疾病的治疗的功效、鉴定适于具体治疗的患者、和/或预测受试者的疾病发作。
因此,基于从受试者获得的生物样品中生物标记组的水平,本文描述了用于与接触活化系统相关的疾病的诊断和预后方法。在一些实施方式中,如使用本文所述的任何方法测量的生物标记的水平,可以被依赖用于评估从其获得生物样品的受试者(例如人患者)是否患有与接触活化系统相关的疾病或处在与接触活化系统相关的疾病的风险中,所述疾病比如与血浆激肽释放酶相关的疾病,例如hae,或自身免疫性疾病,比如ra、uc和克罗恩病。
在一些实施方式中,可以将生物标记的水平与参考样品或对照样品比较,以确定指示样品中蛋白质含量的值。在一些实施方式中,通过比较样品中蛋白质的水平与样品中另一蛋白质(例如,内部对照或内标)的水平,获得生物标记的值。这种生物标记值可为相对于内部对照或内标的归一化值。可将生物标记的值与参考值比较,以确定受试者是否患有与接触活化系统相关的疾病或处在与接触活化系统相关的疾病的风险中。参考值可表示没有靶疾病的受试者(例如,人受试者)中相应的生物标记的水平。在一些实施方式中,如果生物标记的水平或值高于参考水平或值,则受试者可鉴定为患有与接触活化系统相关的疾病或处在与接触活化系统相关的疾病的风险中。在一些实施方式中,如果生物标记的水平或值低于参考水平或值,则受试者可鉴定为患有与接触活化系统相关的疾病或处在与接触活化系统相关的疾病的风险中。
在一些实施方式中,生物标记的水平可与该蛋白质预定的阈值相比较,偏离该预定的阈值可指示受试者患有与接触系统相关的疾病。预定的阈值可表示将患有靶疾病的患者中的生物标记的水平与没有靶疾病的患者中的生物标记的水平区分开的生物标记的值。
在一些实施方式中,生物标记组包括大于一种的蛋白质,对于其中至少一种,升高的水平指示受试者患有疾病或处在患有疾病的风险中,并且对于至少一种蛋白质,降低的水平指示受试者患有疾病或处在患有疾病的风险中。在一些实施方式中,生物标记组包括大于一种的蛋白质,对于其中任一种,升高的水平指示受试者患有疾病或处在患有疾病的风险中。在一些实施方式中,生物标记组包括大于一种的蛋白质,对于其中任一种,降低的水平指示受试者患有疾病或处在患有疾病的风险中。
在一些实施方式中,对照样品或参考样品是从健康个体获得的生物样品。在一些实施方式中,对照样品或参考样品包含已知含量的待评估的蛋白质。在一些实施方式中,对照样品或参考样品是从对照受试者获得的生物样品。
如本文所使用,对照受试者可为健康个体,即在测量蛋白质的水平时明显没有靶疾病(例如,与接触系统相关的疾病)或没有该疾病的历史的个体。对照受试者也可表示健康受试者的群体,其优选地具有与通过本文所述的方法分析的受试者匹配的特征(例如,年龄、性别、种族群体)。
对照水平可为预定的水平或阈值。这种预定的水平可表示未患有靶疾病或未处在靶疾病的风险中的受试者的群体中的蛋白质的水平(例如,健康受试者的群体中的平均水平)。它也可表示患有靶疾病的受试者的群体中蛋白质的水平。
预定的水平可采用各种形式。例如,其可为单个截止值,比如中值或平均值。在一些实施方式中,这种预定的水平可基于比较组确立,比如其中一个限定的组已知患有靶疾病和另一限定的组已知未患有靶疾病。可替选地,预定的水平可为一个范围,例如,表示对照群体中蛋白质的水平的范围。
如本文所描述的对照水平可通过常规技术确定。在一些实施例中,可通过对也如本文所述的对照样品进行常规方法(例如,用于获得如本文所描述的测试样品中蛋白质的水平的相同试验)获得对照水平。在其他实例中,可从对照群体的成员获得蛋白质的水平,并且可通过例如计算程序分析结果,以获得表示对照群体中的蛋白质的水平的对照水平(预定的水平)。
通过比较从候选受试者获得的样品中生物标记的水平与如本文所描述的参考值,可确定候选受试者是否患有与接触系统相关的疾病(例如,hae)或处在与接触系统相关的疾病的风险中。例如,如果候选受试者的样品中生物标记的水平偏离参考值(例如,与参考值相比增加),则候选受试者可能被鉴定为患有疾病或处在疾病风险中。当参考值表示患有靶疾病的受试者的群体中的生物标记的水平的值范围时,则候选者的样品中的生物标记的值落在所述范围内指示候选受试者患有靶疾病或处在靶疾病的风险中。
如本文所使用,“升高的水平”或“高于参考值的水平”意思是生物标记的水平高于参考值,比如对照样品中生物标记水平的预定的阈值。本文详细地描述了对照水平。升高的生物标记的水平包括比参考值高例如1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、300%、400%、500%或更多的生物标记的水平。在一些实施方式中,测试样品中的生物标记的水平比参考样品中的生物标记的水平高至少1.1、1.2、1.3、1.4、15、1.6、1.7、1.8、1.9、2、2.5、3、3.5、4、4.5、5、5、6、7、8、9、10、50、100、150、200、300、400、500、1000、10000倍或更高。
如本文所使用,“降低的水平”或“低于参考值的水平”意思是生物标记的水平低于参考值,比如对照样品中生物标记的预定的阈值。本文详细地描述了对照水平。降低的生物标记的水平包括比参考值低例如1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%、150%、200%、300%、400%、500%或更多的生物标记的水平。在一些实施方式中,测试样品中的生物标记的水平比参考样品中生物标记的水平低至少1.1、1.2、1.3、1.4、15、1.6、1.7、1.8、1.9、2、2.5、3、3.5、4、4.5、5、5、6、7、8、9、10、50、100、150、200、300、400、500、1000、10000倍或更低。
在一些实施方式中,候选受试者是人患者,其具有与接触活化系统相关的疾病的症状,比如pkal介导的障碍,例如hae或自身免疫性疾病,比如ra、uc和克罗恩病。例如,受试者患有水肿、肿胀,其中所述肿胀完全或主要是外周的;荨麻疹;在没有明显感染迹象的情况下的泛红、疼痛和肿胀;非组胺介导的水肿、复发性的肿胀发作或其组合。在其他实施方式中,在收集样品时受试者没有pkal介导的障碍的症状、没有pkal介导的障碍的症状的历史、或没有pkal介导的障碍(比如hae)的历史。在其他实施方式中,受试者耐受抗组胺疗法、皮质激素疗法或它们二者。
在本文所述的方法中鉴定的受试者可为经受适当的治疗,比如如本文所描述的用pkal抑制剂的治疗的受试者。
考虑生物标记的水平和这种疾病之间的相关性,本文所述的试验方法和试剂盒也可用于评估与接触系统相关的疾病比如本文所述的那些的疾病的治疗功效。例如,可从在治疗之前和之后或治疗过程期间进行治疗的受试者收集多个生物样品(例如,血液或血浆样品)。可通过如本文所描述的任何试验方法测量生物标记的水平并且相应地可确定生物标记的值(例如,含量)。例如,如果升高的生物标记的水平指示受试者患有靶疾病并且生物标记的水平在治疗之后或治疗过程期间降低(稍后收集的样品中生物标记的水平与较早收集的样品中的生物标记的水平相比),则其指示治疗是有效的。作为另一实例,如果降低的生物标记的水平指示受试者患有靶疾病并且在治疗之后或治疗过程期间生物标记的水平增加(稍后收集的样品中生物标记的水平与较早收集的样品中的生物标记的水平相比),则其指示治疗是有效的。在一些实例中,治疗涉及有效量的治疗剂,比如血浆激肽释放酶抑制剂、缓激肽b2受体拮抗剂或c1酯酶抑制剂(c1-inh)。治疗剂的实例包括但不限于lanadelumab、艾卡拉肽、艾替班特和人血浆衍生的c1-inh。
如果受试者被鉴定为对治疗无应答,则将治疗剂的更高剂量和/或更高的给药频率施用至经鉴定的受试者。在一些实施方式中,在鉴定为对治疗响应或不需要进一步治疗的受试者中,保持、降低或停止治疗剂的剂量或给药频率。可替选地,不同的治疗可应用于被发现对第一治疗不响应的受试者。
在其他实施方式中,也可依靠生物标记或生物标记组的值,以鉴定障碍与接触系统相关或障碍可通过例如pkal抑制剂治疗。为了实施该方法,从患有靶疾病的受试者收集的样品(例如,血液样品或血浆样品)中的生物标记的水平可通过适当的方法测量,例如,本文所述的那些,比如蛋白质印迹或elisa试验。如果生物标记的水平偏离参考值(例如,升高的或降低的),则其指示pkal抑制剂可有效治疗该疾病。如果该疾病被鉴定为易受pkal抑制剂的影响(可由pkal抑制剂治疗),则方法可进一步包括向患有该疾病的受试者施用有效量的pkal抑制剂,比如抗pkal抗体或抑制性肽(例如,lanadelumab、艾卡拉肽);缓激肽2受体抑制剂(例如,艾替班特);和/或c1-inh(例如人血浆衍生的c1-inh)。
评估与接触系统相关的疾病严重程度或该疾病状态的方法也在本公开的范围内。例如,如本文所描述,hae可处于静息状态(基础状态),在静息状态期间受试者不经历疾病的症状。hae发作通常为复发性的发作,其中受试者可能经历例如手、脚、面部、胃肠道、生殖器和喉头(喉咙)的可持续两天至五天的疼痛和肿胀。在一些实施方式中,一种或多种生物标记的水平表征受试者是否将经历、正在经历或将很快经历hae发作。在一些实施方式中,方法涉及比较从患有hae的受试者获得的样品中的生物标记的水平与来自相同受试者的样品,例如从基础状态下相同受试者获得的样品中或从hae发作期间相同受试者获得的样品的生物标记的水平。
(iii)非临床应用
此外,本文所述的任何生物标记组的水平可用于研究目的。尽管已经鉴定了许多与接触活化系统相关的疾病,但是其他疾病由类似的机理介导或涉及类似的组分是可能的。在一些实施方式中,本文所述的方法可用于将疾病鉴定为与接触活化系统相关或与接触活化系统的组分相关。在一些实施方式中,本文所述的方法可用于研究疾病的机理(例如,发现参与疾病发展的新的生物途径或过程)或疾病的进展。
在一些实施方式中,可依赖如本文所描述的生物标记组的水平来开发用于与接触活化系统相关的疾病的新疗法。例如,可测量从已经施用新疗法(例如,临床测试)的受试者获得的样品中的生物标记组的水平。在一些实施方式中,生物标记组的水平可指示新疗法的功效或在新疗法之前、期间或之后受试者的疾病的进展。
用于测量蛋白生物标记组的试剂盒和检测装置
本公开也提供了用于测量如本文所描述的生物标记组的水平的试剂盒和检测装置。这种试剂盒或检测装置可包括特异性结合比如表1中列举的那些的蛋白生物标记的结合剂。例如,这种试剂盒或检测装置可包括对于选自表1中的两种不同的蛋白生物标记特异性的至少两种结合剂。在一些情况下,试剂盒或检测装置包括对于本文所述的蛋白生物标记组的所有成员特异性的结合剂。
在一些实施方式中,一种或多种结合剂是特异性结合生物标记组的蛋白质的抗体。在一些实施方式中,一种或多种结合剂是特异性结合生物标记组的蛋白质的适配体,比如肽适配体或寡核苷酸适配体。
在一些实施方式中,试剂盒进一步包括检测试剂(例如,与结合剂结合的抗体),用于检测结合剂与生物标记组的蛋白质的结合。检测试剂可缀合至标签。在一些实施方式中,检测试剂是特异性结合至少一种结合剂的抗体。在一些实施方式中,结合剂包括可被检测试剂鉴定和直接或间接结合检测试剂的标志(tag)。
在一些实施方式中,支撑元件是膜,比如硝化纤维素膜、聚偏二氟乙烯(pvdf)膜或乙酸纤维素膜。在一些实例中,免疫试验可为蛋白质印迹试验形式或侧流试验形式。
在一些实施方式中,支撑元件是多孔板,比如elisa板。在一些实施方式中,本文所述的免疫试验可在高通量平台上进行。在一些实施方式中,多孔板,例如24孔板、48孔板、96孔板、384孔板或更多孔的孔板可用于高通量免疫试验。个体免疫试验可在每个孔中平行进行。所以,一般期望使用读板仪以平行测量多个孔,从而增加试验通量。在一些实施方式中,能够使多孔(例如,4、16、24、48、96、384或更多个孔)平行成像的读板仪可用于该平台。例如,可使用商业上可获得的读板仪(例如,可获得自perkinelmer,waltham,ma的板::视野系统)。该读板仪能够基于动力学荧光分析。该板::视野系统具有高的收集效率光学并且具有用于平行分析96个孔的专用光学设计。另外适当的平行读板仪包括但不限于safire(tecan,sanjose,ca)、
在试剂盒或检测装置中,一种或多种结合剂可固定在支撑元件,例如膜、珠子、载玻片或多孔板上。用于免疫试验的适当的支撑元件的选择将取决于各种因素,比如样品的数量和检测从缀合至第二试剂的标签释放的信号的方法。
试剂盒可还包括如本文所描述的一种或多种缓冲液,但不限于包被缓冲液、封闭缓冲液、冲洗缓冲液和/或停止缓冲液。
在一些实施方式中,试剂盒可包括根据本文所述的任何方法使用的说明书。包括的说明书可包括如何使用试剂盒中包含的组分以用于测量从受试者比如人患者收集的生物样品中的生物标记组的蛋白质的水平的说明。
与试剂盒使用相关的说明书一般包括关于用于进行本文所述的试验方法的各个组分的用量和适宜的条件的信息。试剂盒中的组分可为单位剂量、散装(例如,多剂量包装),或亚单位剂量。本公开的试剂盒中提供的说明书通常为标签或包装插入物(例如,试剂盒中包括的纸页)上的书面说明书,但是机器可读的说明书(例如,磁盘或光盘存储器上携带的说明书)也是可接受的。
标签或包装插入物指示试剂盒用于评估生物标记组的蛋白质的水平。可提供用于实施本文所述的任何方法的说明书。
本公开的试剂盒在合适的包装中。合适的包装包括但不限于小瓶(vial)、细口瓶(bottle)、广口瓶(jar)、柔性包装(例如,密封的聚酯薄膜(mylar)或塑料袋)等。也考虑与特定设备,比如吸入器、鼻施用设备(例如,雾化器)或注入设备(比如微型泵)组合使用的包装。试剂盒可具有无菌进入孔(例如容器可为静脉内溶液袋或小瓶,其具有可被皮下注射针刺破的塞子)。容器也可具有无菌进入孔(例如容器可为静脉内溶液袋或小瓶,其具有可被皮下注射针刺破的塞子)。
试剂盒可任选地提供另外的组分,比如解释信息,如对照样品和/或标准样品或参考样品。通常,试剂盒包括容器和在容器上或与容器相关联的标签或包装插入物。在一些实施方式中,本公开提供了包括上述试剂盒的内容物的制造制品。
治疗与接触活化系统相关的疾病
如使用本文所述的方法鉴定的处在与接触活化系统相关的疾病的风险中或遭受与接触活化系统相关的疾病的受试者可用任何适当的治疗剂治疗。在一些实施方式中,提供的方法包括基于描述的方法例如测量生物标记组的水平的输出,选择用于受试者的治疗。
在一些实施方式中,方法包括基于试验、例如,生物标记检测的输出,选择或施用治疗剂或者选择且施用所述治疗剂,例如激肽释放酶抑制剂、缓激肽b2受体抑制剂和/或c1酯酶抑制剂,用于施用至受试者。
在一些实施方式中,向受试者施用治疗剂一次或多次。在一些实施方式中,向受试者施用血浆激肽释放酶抑制剂。在一些实施方式中,激肽释放酶抑制剂是肽、小分子抑制剂、激肽释放酶抗体、或其片段。在一些实施方式中,向受试者施用缓激肽b2受体的拮抗剂。在一些实施方式中,向受试者施用c1-inh。
治疗剂,例如激肽释放酶抑制剂、缓激肽b2受体抑制剂和/或c1-inh,可与另一疗法一起施用,该另一疗法作为用于治疗涉及接触活化系统的疾病或病况的组合疗法的一部分。组合疗法,例如用激肽释放酶抑制剂、缓激肽b2受体拮抗剂或c1-inh替代试剂中的一种或多种的组合疗法,例如用激肽释放酶抑制剂、缓激肽b2受体拮抗剂或c1-inh替代试剂中的一种或多种和另一疗法的组合疗法可以以多种不同的配置提供。第一试剂可在施用其他疗法之前或之后施用。在一些情况下,第一试剂和另一疗法(例如,治疗剂)同时施用,或在很短的时间内施用(例如,注射之间的短时间间隔,比如相同治疗段期间)。第一试剂和其他疗法也可以以更大的时间间隔施用。
治疗剂
血浆激肽释放酶结合剂(例如,结合蛋白,例如多肽,例如抑制多肽,例如抗体,例如抑制抗体,或其他结合剂,例如小分子)是用于各种疾病和病况例如涉及血浆激肽释放酶活性的疾病和病况的有用的治疗剂。例如,在一些实施方式中,涉及血浆激肽释放酶活性的疾病或病况是遗传性血管性水肿(hae)。在一些实施方式中,向处在与接触活化系统相关的疾病的风险中或遭受与接触活化系统相关的疾病的受试者施用血浆激肽释放酶结合剂、比如血浆激肽释放酶抑制剂。
激肽释放酶,组织和/或血浆激肽释放酶的许多有用的蛋白质抑制剂包括kunitz结构域。如本文所使用,“kunitz结构域”是具有至少51个氨基酸并且包含至少两个、和优选地三个二硫键的多肽结构域。结构域折叠使得第一和第六半胱氨酸、第二和第四半胱氨酸、以及第三和第五半胱氨酸形成二硫键(例如,在具有58个氨基酸的kunitz结构域中,根据下面提供的bpti同源物的序列的编号,半胱氨酸可出现在对应于氨基酸5、14、30、38、51和55的位置处,并且二硫键可在位置5和55、位置14和38以及位置30和51的半胱氨酸之间形成),或者,如果存在两个二硫键,则它们可在其半胱氨酸相应的子集之间形成。根据下面提供的bpti序列的编号,各个半胱氨酸之间的间隔可为对应于下述位置之间间隔的7、5、4、3、2、1或0个氨基酸内:5至55、14至38、以及30至51。bpti序列可用作参考,以指出任何一般kunitz结构域中的特定位置。比较感兴趣的kunitz结构域与bpti的比较可通过鉴定其中对齐的半胱氨酸的数量最大化的最佳拟合比对进行。
bpti的kunitz结构域的3d结构(在高分辨率下)是已知的。一个x-射线结构以“6pti”保存在brookhaven蛋白质数据库中。一些bpti同源物的3d结构(eigenbrot等,proteinengineering(1990)3(7):591-598;hynes等,biochemistry(1990)29:10018-10022)是已知的。至少81种kunitz结构域序列是已知的。已知的人同源物包括也称为组织因子途径抑制剂(tfpi)的laci的三个kunitz结构域(wun等,j.biol.chem.(1988)263(13):6001-6004;girard等,nature(1989)338:518-20;novotny等,j.biol.chem.(1989)264(31):18832-18837)、间α胰蛋白酶抑制物app-i的两个kunitz结构域(kido等j.biol.chem.(1988)263(34):18104-18107)、来自胶原的kunitz结构域、tfpi-2的三个kunitz结构域(sprecher等,pnasusa(1994)91:3353-3357)、肝细胞生长因子激活剂抑制物1型的kunitz结构域、肝细胞生长因子激活剂抑制物2型的kunitz结构域、在美国专利公开号:2004-0152633中描述的kunitz结构域。laci是分子量为39kda的包含三个kunitz结构域的人血清磷糖蛋白(表2中的氨基酸序列)。
表2:示例性的天然kunitz结构域
上述kunitz结构域被称为laci-k1(残基50至107)、laci-k2(残基121至178)和laci-k3(213至270)。wun等(j.biol.chem.(1988)263(13):6001-6004)报道了laci的cdna序列。girard等(nature(1989)338:518-20)报道了其中改变了三个kunitz结构域的各自p1残基的突变研究。当因子viia(f.viia)与组织因子复合时,laci-k1抑制f.viia并且laci-k2抑制因子xa。
包含示例性kunitz结构域的蛋白质包括下述,括号中为swiss-prot登录号:
a4_human(p05067),a4_macfa(p53601),a4_macmu(p29216),
a4_mouse(p12023),a4_rat(p08592),a4_saisc(q95241),
ambp_plepl(p36992),app2_human(q06481),app2_rat(p15943),
axp1_antaf(p81547),axp2_antaf(p81548),bpt1_bovin(p00974),
bpt2_bovin(p04815),ca17_human(q02388),ca36_chick(p15989),
ca36_human(p12111),crpt_boomi(p81162),elac_maceu(o62845),
elac_trivu(q29143),eppi_human(o95925),eppi_mouse(q9da01),
htib_manse(p26227),ibp_carcr(p00993),ibpc_bovin(p00976),
ibpi_tactr(p16044),ibps_bovin(p00975),ics3_bommo(p07481),
imap_drofu(p11424),ip52_anesu(p10280),isc1_bommo(p10831),
isc2_bommo(p10832),ish1_stohe(p31713),ish2_stohe(p81129),
isik_helpo(p00994),isp2_galme(p81906),ivb1_bunfa(p25660),
ivb1_bunmu(p00987),ivb1_vipaa(p00991),ivb2_bunmu(p00989),
ivb2_dabru(p00990),ivb2_hemha(p00985),ivb2_najni(p00986),
ivb3_vipaa(po0992),ivbb_denpo(p00983),ivbc_najna(p19859),
ivbc_ophha(p82966),ivbe_denpo(p00984),ivbi_denan(p00980),
ivbi_denpo(p00979),ivbk_denan(p00982),ivbk_denpo(p00981),
ivbt_erima(p24541),ivbt_najna(p20229),mcpi_melcp(p82968),
sbpi_sarbu(p26228),spt3_human(p49223),tkd1_bovin(q28201),
tkd1_sheep(q29428),txca_denan(p81658),upti_pig(q29100),
ambp_bovin(p00978),ambp_human(p02760),ambp_merun(q62577),
ambp_mesau(q60559),ambp_mouse(q07456),ambp_pig(p04366),
ambp_pat(q64240),iatr_horse(p04365),iatr_sheep(p13371),
spt1_human(o43278),spt1_mouse(q9r097),spt2_human(o43291),
spt2_mouse(q9wu03),tfp2_human(p48307),tfp2_mouse(o35536),
tfpi_human(p10646),tfpi_macmu(q28864),tfpi_mouse(o54819),
tfpi_rabit(p19761),tfpi_rat(q02445),yn81_caeel(q03610)
各种方法可用于鉴定来自序列数据库的kunitz结构域。例如,kunitz结构域的已知的氨基酸序列、共有序列或基序(例如,prosite基序)可以使用例如blast针对genbank序列数据库(nationalcenterforbiotechnologyinformation(国家生物技术信息中心)、nationalinstitutesofhealth(国立卫生研究院)、bethesdamd)进行检索;针对hmm(hiddenmarkovmodels,隐马尔可夫模型)的pfam数据库(例如,使用对于pfam检索的默认参数)进行检索;针对smart数据库进行检索;或针对prodom数据库进行检索。例如,pfam版本9的pfam登录号pf00014提供了许多kunitz结构域和用于鉴定kunitz结构域的hmm。pfam数据库的描述可见于sonhammer等proteins(1997)28(3):405-420并且hmm的详细描述可见于例如gribskov等meth.enzymol.(1990)183:146-159;gribskov等proc.natl.acad.sci.usa(1987)84:4355-4358;krogh等j.mol.biol.(1994)235:1501-1531;和stultz等proteinsci.(1993)2:305-314。hmm的smart数据库(simplemodulararchitectureresearchtool(简单的分子架构研究工具),embl,heidelberg,de)描述于schultz等proc.natl.acad.sci.usa(1998)95:5857和schultz等nucl.acidsres(2000)28:231中。smart数据库包含通过用hmmer2检索程序的隐马尔科夫模型特征分析而鉴定的结构域(r.durbin等(1998)biologicalsequenceanalysis:probabilisticmodelsofproteinsandnucleicacids.cambridgeuniversitypress)。也注释和监测数据库。prodom蛋白质结构域数据库由同源的结构域的自动汇编组成(corpet等nucl.acidsres.(1999)27:263-267)。当前版本的prodom使用swiss-prot38和trembl蛋白质数据库的递归psi-blast搜索构建(altschul等nucleicacidsres.(1997)25:3389-3402;gouzy等computersandchemistry(1999)23:333-340.)。数据库自动为各自结构域生成共有序列。prosite将kunitz结构域列举为基序并且鉴定包括kunitz结构域的蛋白质。参见,例如falquet等nucleicacidsres.(2002)30:235-238。
kunitz结构域主要使用两个环区域(“结合环”)中的氨基酸与靶蛋白酶相互作用。第一环区域在大约对应bpti的氨基酸13-20的残基之间。第二环区域在大约对应bpti的氨基酸31-39的残基之间。kunitz结构域的示例性文库的第一和/或第二环区域中存在一个或多个氨基酸位置的不同。当筛选与激肽释放酶相互作用的kunitz结构域或当选择改善的亲和性突变体时,尤其有用的待改变的位置包括:相对于bpti序列的位置13、15、16、17、18、19、31、32、34和39。预期这些位置中的至少一些与靶蛋白酶紧密联系。改变其他位置,例如三维结构中靠近上述位置的位置也是有用的。
kunitz结构域的“框架区”被定义为这样的残基:其作为kunitz结构域的一部分,但是尤其不包括第一和第二结合环区中的残基,即大约对应于bpti的氨基酸13-20和bpti的氨基酸31-39的残基。相反地,不在结合环中的残基可耐受更宽范围的氨基酸置换(例如,保守置换和/或非保守置换)。
在一个实施方式中,这些kunitz结构域为包括人脂蛋白相关凝血抑制剂(laci)蛋白的kunitz结构域1的成环结构的变体形式。laci包含三个内部、明确限定的为典范kunitz结构域的肽环结构(girard,t.等,nature(1989)338:518-520)。已经筛选、分离了本文所述的laci的kunitz结构域1的变体并且以增强的亲和性和特异性结合激肽释放酶(参见,例如美国专利号5,795,865和6,057,287)。这些方法也可应用于其他kunitz结构域框架,以获得与激肽释放酶(例如血浆激肽释放酶)相互作用的其他kunitz结构域。激肽释放酶功能有用的调节剂通常结合和/或抑制激肽释放酶,如使用激肽释放酶结合和抑制试验所确定的。
在一些方面中,血浆激肽释放酶抑制剂结合活化形式的血浆激肽释放酶。在一些实施方式中,血浆激肽释放酶抑制剂结合和抑制血浆激肽释放酶,例如,人血浆激肽释放酶和/或鼠激肽释放酶。示例性多肽血浆激肽释放酶试剂公开在美国专利号5,795,865、美国专利号5,994,125、美国专利号6,057,287、美国专利号6,333,402、美国专利号7,628,983,和美国专利号8,283,321、美国专利号7,064,107、美国专利号7,276,480、美国专利号7,851,442、美国专利号8,124,586、美国专利号7,811,991和美国公开号20110086801中,其各自的全部内容通过引用并入本文。在一些实施方式中,血浆激肽释放酶抑制剂是抑制性多肽或肽。在一些实施方式中,抑制性肽是艾卡拉肽(也称为dx-88或
glualamethisserphecysalaphelysalaaspaspglyprocysargalaalahisproargtrpphepheasnilephethrargglncysgluglupheiletyrglyglycysgluglyasnglnasnargphegluserleugluglucyslyslysmetcysthrargasp(seqidno:3)。
血浆激肽释放酶抑制剂可为全长抗体(例如,igg(例如,igg1、igg2、igg3、igg4)、igm、iga(例如,iga1、iga2)、igd和ige)或可仅仅包括抗原结合片段(例如,fab、f(ab′)2或scfv片段)。结合蛋白可包括两个重链免疫球蛋白和两个轻链免疫球蛋白,或可为单链抗体。血浆激肽释放酶抑制剂可为重组蛋白,比如人源化的、cdr移植的、嵌合的、去免疫化的或体外产生的抗体,并且和可任选地包括源自人生殖细胞系免疫球蛋白序列的恒定区。在一个实施方式中,血浆激肽释放酶抑制剂是单克隆抗体。
示例性血浆激肽释放酶结合蛋白公开于美国公开号20120201756中,其全部内容通过引用并入本文。在一些实施方式中,激肽释放酶结合蛋白是具有选自由下述组成的组中的抗体的轻链和/或重链的抗体(例如,人抗体):m162-a04、m160-g12、m142-h08、x63-g06、x101-a01(也称为dx-2922)、x81-b01、x67-d03、x67-g04、x81-b01、x67-d03、x67-g04、x115-b07、x115-d05、x115-e09、x115-h06、x115-a03、x115-d01、x115-f02、x124-g01(也本文称为dx-2930或lanadelumab)、x115-g04、m29-d09、m145-d11、m06-d09和m35-g04。在一些实施方式中,血浆激肽释放酶结合蛋白与下述抗体竞争或结合相同表位:m162-a04、m160-g12、m142-h08、x63-g06、x101-a01(也本文称为dx-2922)、x81-b01、x67-d03、x67-g04、x81-b01、x67-d03、x67-g04、x115-b07、x115-d05、x115-e09、x115-h06、x115-a03、x115-d01、x115-f02、x124-g01、x115-g04、m29-d09、m145-d11、m06-d09和m35-g04。在一些实施方式中,血浆激肽释放酶结合蛋白是lanadelumab。参见美国公开号20110200611和美国公开号20120201756,其通过引用并入本文。
血浆激肽释放酶抑制抗体的实例是lanadelumab。下面提供了lanadelumab的重链可变区和轻链可变区的氨基酸序列,其中以黑体和下划线标出cdr区。
lanadelumab的重链可变区序列(seqidno:4)
evqllesggglvqpggslrlscaasgftfshyimmwvrqapgkglewvsgiyssggitvyadsvkgrftisrdnskntlylqmnslraedtavyycayrrigvprrdefdiwgqgtmvtvss
lanadelumab的轻链可变区序列(seqidno:5)
diqmtqspstlsasvgdrvtitcrasqsisswlawyqqkpgkapklliykastlesgvpsrfsgsgsgteftltisslqpddfatyycqqyntywtfgqgtkvei
在一些实施方式中,血浆激肽释放酶抑制剂与本文所述的血浆激肽释放酶抑制剂可具有约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的序列同一性。在一些实施方式中,血浆激肽释放酶抑制剂与本文所述的血浆激肽释放酶抑制剂在hc框架区和/或lc框架区(例如,hc和/或lcfr1、2、3和/或4)中可具有约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的序列同一性。在一些实施方式中,血浆激肽释放酶抑制剂与本文所述的血浆激肽释放酶抑制剂在hccdr和/或lccdr(例如,hc和/或lccdr1、2和/或3)中可具有约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的序列同一性。在一些实施方式中,血浆激肽释放酶抑制剂与本文所述的血浆激肽释放酶抑制剂在恒定区(例如,ch1、ch2、ch3和/或cl1)中可具有约85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的序列同一性。
在一些方面中,小分子结合和抑制活化形式的血浆激肽释放酶。
缓激肽b2受体抑制剂
在一些实施方式中,向受试者施用缓激肽b2受体抑制剂(例如,拮抗剂)。示例性的缓激肽b2受体拮抗剂包括艾替班特
c1-inh替代试剂
在一些实施方式中,向受试者施用c1酯酶抑制剂(c1-inh),比如c1-inh替代试剂。示例性c1-inh替代试剂是公众可得到的并且包括例如人血浆衍生的c1-inh,例如
不用进一步阐释,相信本领域技术人员可基于上述描述最大限度地使用本公开。因此,下述具体的实施方式仅仅视为是说明性的,并且决不以任何方式限制本发明的剩余部分。通过引用并入本文引用的所有出版物为了本文提到的目的或主题。
实施例
实施例1:鉴定与健康个体相比在来自hae患者的样品中区别存在的蛋白质
从健康个体(n=22,称为“正常”样品)和患有hae(i型/ii型)的疾病静息期间(n=33,称为“基础”)和发作期间(n=33,称为“发作”)的患者收集血浆样品。遵循严格的血液收集方案,其中通过使用蝴蝶针、塑料导管和塑料收集管静脉穿刺收集血液。丢弃为血清管的第一采血管。包含蛋白酶抑制剂混合物和抗凝剂的第二采血管(p100管)用于蛋白质组学分析。在p100管中收集的血液在收集的1小时内被处理为血浆,分成数个等分试样,并且在<-70℃冷冻。
使用能够检测1,310种不同人蛋白质的相对丰度的多重试验(somascantm试验;somalogic;boulder,co)分析血浆样品。对于三种不同的样品类型(健康个体、处于静息状态的患有hae的患者和具有hae发作的患者),该试验比较1,310种蛋白质各自的信号水平。
使用kruskal-wallis方差分析,对数据进行统计分析。这是检验可具有相同或不同样本尺寸的大于两个组的分布的非参数方法。如果假设是除了中值的任何区别之外,比例分布(scaleddistribution)对于所有组都相同,则零假设是所有组的中值相同,并且备选假设是一个组的群体中值与至少一个其他组的群体中值不同。如果统计不显示显著性,则没有证据表明样本之间的随机占优。但是,如果中值存在显著性,则至少一个样本比另一样本随机占优。
用假阳性率(q值)<0.01和t检验(p值<0.05,合并方差的平均值)区分与健康个体相比的hae患者(基础或发作)之间的蛋白质水平列在表1中。根据来自接受者工作曲线(roc)分析的c-统计值,将蛋白质分级,其中接近1.0的c-统计值对于hae(i/ii)的阳性检测具有最高特异性和灵敏性。i型hae患者鉴定为具有总c1抑制剂蛋白质(c1-inh)的正常含量的至少50%(通常小于30%)(david-lorton,m.j.drugsdermatol.(2015)14:151-157)。ii型hae患者具有serping1基因中的突变,其导致失调的c1-inh蛋白并且鉴定为具有功能c1-inh的正常含量的至少50%。在该研究中,hae患者未确定为他们是否患有i型或ii型hae。
如表1中显示,发现152种蛋白质在从hae患者(发作或基础)获得的血浆样品和从健康个体获得的血浆样品之间具有统计学上差异的水平(p<0.05),其表示可被评估以区分患有hae的个体与没有该疾病的个体的生物标记。蛋白质组学分析鉴定了与来自健康个体的样品相比,来自hae患者的血浆样品中的水平中>2倍(p<0.050)高的58种蛋白质和来自hae患者的血浆样品中>2倍(p<0.05)低的12种蛋白质。10种蛋白质被鉴定具有>0.93的c-统计值。这些蛋白质,例如,具有高c-统计值(例如,>0.9)的那些无论单独或组合使用,可用作用于hae和其他与接触系统相关的疾病的可靠的生物标记。
相比来自健康个体的血浆,来自hae患者的血浆样品包含显著更低含量的补体蛋白4(“c4”)(图1,图块a)。低c4水平用于临床hae(i/ii)的诊断(davis-lorton,m.j.drugsdermatol.(2015)14:151-157)。另外,相对于来自健康个体的样品,在来自hae患者的样品中观察到了前激肽释放酶的含量的稍微降低(图1,图块b)。先前也已显示相对于正常水平,hae患者中前激肽释放酶的含量降低。使用本文所述的方法,观察到的hae患者相对于健康个体的c4和pkal丰度的改变指示所述方法能够检测与疾病发生相关的蛋白质水平的变化。
也评估了来自hae患者和健康个体的血浆样品的血浆激肽释放酶产生。简言之,柠檬酸化的血浆样品用fxiia活化,随后用玉米胰蛋白酶抑制剂进行fxiia猝灭。在来自hae患者的样品中血浆激肽释放酶的速率相对于正常水平稍微降低(图2)。
在该研究中,患有hae的33名受试者中的15名用c1-inh,
蛋白质组学数据也提供了有关hae的病理学的新观点。例如,鉴定为在来自hae患者的血浆样品中升高的蛋白质亚组与线粒体功能相关(图4,图块a-c)。atp合酶亚单位o(atpo)是必要的线粒体膜蛋白(也称为f1f0atp合酶或复合物v),其在横跨线粒体膜的质子梯度存在的情况下,从adp产生atp,所述质子梯度通过呼吸链的电子运输复合物而生成。类似地,亲环蛋白f(也称为亲环蛋白d或肽基-脯氨酰基顺-反异构酶f,线粒体,ec:5.2.1.8)也是线粒体膜蛋白。发现60kd线粒体热休克蛋白(hsp60)的水平在来自hae患者的血浆样品中也升高。
在蛋白质组学分析中鉴定的可用作hae的生物标记的另外蛋白质是14-3-3ζ/δ(14-3-3ζ)蛋白。如图5中显示,与健康个体相比,14-3-3ζ/δ蛋白的水平在来自hae患者的血浆中升高。14-3-3ζ/δ蛋白是7成员蛋白质家族中的一种,在该家族中其他成员也被发现在来自hae患者的血浆中升高,包括14-3-3β/α(表1)。14-3-3蛋白在植物和哺乳动物中普遍表达并且高度保守,并且参与代谢、转录、细胞凋亡、蛋白质运输和细胞周期调节的信号转导途径的调节(aghazadeh等drugdiscov.today(2015))。这些蛋白质变化的血浆或血清水平已经与疾病比如风湿性关节炎(maksymowych等clin.exp.rheumatol.(2014)32:s35-s39)、大血管血管炎,包括takayasu动脉炎和巨细胞性动脉炎(chakravarti等arthritisrheumatol.(2015)67:1913-1921)、癌症(matta等experopin.ther.targets(2012)16:515-523)、帕金森病(slone等neurobiol.dis.(2015)79:1-13)和阿尔茨海默氏病(steinacker等semin.celldev.biol.(2011)22:696-704)的发生相关。本文描述的结果首次鉴定了与来自健康志愿者的血浆相比,来自hae患者的血浆中的14-3-3ζ/δ蛋白的水平升高。
鉴定为与健康个体相比,在来自患有hae的患者的血浆中偏离的另外的蛋白质包括il-1f6(也称为白细胞介素-36α);蛋白激酶:酪氨酸蛋白激酶yes、酪氨酸蛋白激酶lyn和丝裂原活化蛋白激酶14(mapk14);糖原合酶激酶3α/β(gsk3α/β);atp依赖性rna解旋酶ddx19b(deadbox蛋白19b);和真核翻译起始因子5a1(elf-5a-1)(表1)。如图6中显示,il-1f6的水平在来自hae患者的血浆样品中显著更低;而如图7-10中显示,酪氨酸蛋白激酶yes、酪氨酸蛋白激酶lyn、mapk14、gsk3α/β、deadbox蛋白19b和elf-5a-1各自在来自hae患者的血浆样品中显著升高。
蛋白质组学分析鉴定了在患有hae的患者和健康个体中以不同的水平存在的超过150种蛋白质。本文鉴定的任何蛋白质可用作用于与接触活化系统相关的疾病的生物标记(单独或组合(生物标记组)),例如在用于下述的方法中:鉴定处在与接触活化系统相关的疾病(例如,hae)的风险中的患者、选择用于治疗的候选者、监测疾病进展或疾病状态、评估针对疾病的治疗功效、确定治疗过程、鉴定疾病或障碍是否与接触活化系统相关,和/或用于研究目的,包括例如研究疾病的机理,其可被依赖用于开发新的疗法。
其他实施方式
本说明书中公开的所有特征可以以任何组合而结合。本说明书中公开的各个特征可被用于相同、等同或类似的目的的可替选特征所替换。因此,除非另外明确指出,否则公开的各个特征仅仅是通用系列的等同或类似特征的例子。
从上述描述中,本领域技术人员可容易确认本公开的实质性特征,并且在不背离其精神和范围的情况下,可对本公开进行各种改变和修饰,以使其适应各种用途和条件。因此,其他实施方式也在权利要求的范围内。
等同方式和范围
本领域技术人员仅仅使用常规实验,将认识到或能够确认本文所述的公开的具体实施方式的许多等同方式。本公开的范围不旨在限于上述描述,而是如所附的权利要求中阐释。
在权利要求中,比如“一个(a)”、“一个(an)”和“所述(the)”的冠词可意指一个或多于一个,除非相反指出或从上下文中显而易见。如果一个、多于一个或所有的群体成员出现在产品或过程中、用于产品或过程或以其他方式与给定的产品或过程相关,则认为满足了在群体的一个或多个成员之间包括“或”的权利要求或说明,除非相反指出或从上下文中显而易见。本公开包括其中群体中的一个具体成员出现在给定的产品或过程、用于给定的产品或过程或以其他方式与给定的产品或过程相关的实施方式。本公开包括其中多于一个或所有的群体成员出现在给定的产品或过程、用于给定的产品或过程或以其他方式与给定的产品或过程相关的实施方式。
此外,本公开包括其中来自一个或多个列举的权利要求的一个或多个限定、要素、条款和描述性术语并入另一权利要求的所有变型、组合和排列。例如,引用另一权利要求的任何权利要求可被修改成包括在引用相同基础权利要求的任何其他权利要求中出现的一个或多个限定。在要素以列表、例如以马库什群体形式出现的情况下,也公开了要素的各个子群体,并且任何要素可从群体中去除。应理解,一般而言,在本公开或本公开的方面被认为包括特定的要素和/或特征的情况下,本公开或本公开的方面的某些实施方式由这种要素和/或特征组成,或基本上由这种要素和/或特征组成。为了简化的目的,本文未用这些词语具体阐释那些实施方式。也应注意。术语“包括”和“包含”旨在是开放式的并且允许包括另外的要素或步骤。在给出范围的情况下,也包括端点。此外,除非另外说明或者根据上下文以及本领域技术人员的理解显而易见,否则表达为范围的值在本公开的不同实施方式中可将叙述的范围内的任何具体值或子范围假设为该范围下限的十分之一单位,除非上下文另外明确说明。
本申请引用了各种发行的专利、公开的专利申请、杂志文章和其他出版物,其所有通过引用并入本文。如果在任何并入的参考文献和本说明书之间存在冲突,以本说明书为准。另外,落在现有技术范围内的本公开的任何具体实施方式可明确地从任何一个或多个权利要求中排除。因为这种实施方式对本领域普通技术人员而言是视为已知的,它们可被排除,即使本文未明确阐释排除。出于任何原因,无论是否与现有技术的存在有关,本公开的任何具体实施方式可从任何权利要求中排除。
仅仅使用常规实验,本领域技术人员将认识到或能够确认本文所述的具体实施方式的许多等同方式。本文所述的该实施方式的范围不旨在限于上述描述,而是如所附的权利要求中阐释。本领域技术人员将认识到,在不背离如下述权利要求限定的本公开的精神和范围的情况下,可对本说明书进行各种改变和修饰。
序列表
<110>dyaxcorp.
<120>用于与接触活化系统相关的疾病的蛋白生物标记
<130>d0617.70115wo00
<140>未指定
<141>2017-09-15
<150>us62/395,712
<151>2016-09-16
<150>us62/518,492
<151>2017-06-12
<160>5
<170>patentin版本3.5
<210>1
<211>304
<212>prt
<213>智人(homosapiens)
<400>1
metiletyrthrmetlyslysvalhisalaleutrpalaservalcys
151015
leuleuleuasnleualaproalaproleuasnalaaspsergluglu
202530
aspglugluhisthrileilethraspthrgluleuproproleulys
354045
leumethisserphecysalaphelysalaaspaspglyprocyslys
505560
alailemetlysargphephepheasnilephethrargglncysglu
65707580
glupheiletyrglyglycysgluglyasnglnasnargphegluser
859095
leugluglucyslyslysmetcysthrargaspasnalaasnargile
100105110
ilelysthrthrleuglnglnglulysproaspphecyspheleuglu
115120125
gluaspproglyilecysargglytyrilethrargtyrphetyrasn
130135140
asnglnthrlysglncysgluargphelystyrglyglycysleugly
145150155160
asnmetasnasnphegluthrleugluglucyslysasnilecysglu
165170175
aspglyproasnglypheglnvalaspasntyrglythrglnleuasn
180185190
alavalasnasnserleuthrproglnserthrlysvalproserleu
195200205
phegluphehisglyprosertrpcysleuthrproalaasparggly
210215220
leucysargalaasngluasnargphetyrtyrasnservalilegly
225230235240
lyscysargprophelystyrserglycysglyglyasngluasnasn
245250255
phethrserlysglnglucysleuargalacyslyslysglypheile
260265270
glnargileserlysglyglyleuilelysthrlysarglysarglys
275280285
lysglnargvallysilealatyrglugluilephevallysasnmet
290295300
<210>2
<211>58
<212>prt
<213>智人(homosapiens)
<400>2
argproaspphecysleugluproprotyrthrglyprocyslysala
151015
argileileargtyrphetyrasnalalysalaglyleucysglnthr
202530
phevaltyrglyglycysargalalysargasnasnphelysserala
354045
gluaspcysmetargthrcysglyglyala
5055
<210>3
<211>60
<212>prt
<213>人工序列
<220>
<223>合成多肽
<400>3
glualamethisserphecysalaphelysalaaspaspglyprocys
151015
argalaalahisproargtrpphepheasnilephethrargglncys
202530
gluglupheiletyrglyglycysgluglyasnglnasnargpheglu
354045
serleugluglucyslyslysmetcysthrargasp
505560
<210>4
<211>122
<212>prt
<213>人工序列
<220>
<223>合成多肽
<400>4
gluvalglnleuleugluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphethrpheserhistyr
202530
ilemetmettrpvalargglnalaproglylysglyleuglutrpval
354045
serglyiletyrserserglyglyilethrvaltyralaaspserval
505560
lysglyargphethrileserargaspasnserlysasnthrleutyr
65707580
leuglnmetasnserleuargalagluaspthralavaltyrtyrcys
859095
alatyrargargileglyvalproargargaspglupheaspiletrp
100105110
glyglnglythrmetvalthrvalserser
115120
<210>5
<211>105
<212>prt
<213>人工序列
<220>
<223>合成多肽
<400>5
aspileglnmetthrglnserproserthrleuseralaservalgly
151015
aspargvalthrilethrcysargalaserglnserilesersertrp
202530
leualatrptyrglnglnlysproglylysalaprolysleuleuile
354045
tyrlysalaserthrleugluserglyvalproserargphesergly
505560
serglyserglythrgluphethrleuthrileserserleuglnpro
65707580
aspaspphealathrtyrtyrcysglnglntyrasnthrtyrtrpthr
859095
pheglyglnglythrlysvalgluile
100105
- 还没有人留言评论。精彩留言会获得点赞!