长寿动物模型和延长寿命与抑制肿瘤发生的方法与流程
本申请案主张2014年9月1日提申的美国临时案第62/044,411号的所有权利,其内文整体并入本申请案中。
本揭示内容关于增加寿命和健康年限及抑制肿瘤形成和转移的方法,以及具有长寿和肿瘤形成的非人类动物模型,以及鉴别能够增加寿命或健康年限,或是抑制肿瘤形成、转移的活性药剂的方法。
背景技术:
长寿基因具有延长寿命的潜力及加强生活质量的可能性,其重要性使之成为当前研究的主流。然而,目前仅确认了极少数的长寿基因,且对于这些基因如何预防老化和延长寿命的机制所知仍不甚清楚。此外,目前也在迫切寻找可降低细胞增殖性疾病风险的基因,及与老化相关的基因。
因此,本领域亟需找出其功能与延长生命和/或减少细胞增殖性疾病相关的基因。这些基因和其产物可用来筛选抗老化和/或抗癌剂,亦可作为多种抗老化和抗癌疗法的关键标的。此外,可基于对这些基因的了解来开发疾病动物模型,并进一步利用这些动物模型来探讨疾病致病机制以及验证治疗药剂疗效。最终,这些工具和治疗药剂将有助于减缓老年族群的认知或运动缺损,并能够降低老年族群或一般族群中癌症的发生率或转移率,进而提升老年人的自理能力并促进健康。
技术实现要素:
本发明的第一方面提供了一种非人类转基因动物,其包含一或多个修饰的红血球kruppel样因子(modifiederythroidkruppel-likefactor,eklf)的等位基因(genealleles),其可编码产生出,相较于野生型eklf多肽而言,包含一或多个氨基酸修饰(aminoacidmodification)的eklf多肽。具体而言,野生型eklf多肽是来自于和所述非人类转基因动物同一属或同一种的动物。在特定实施方式中,所述非人类转基因动物是基因敲入(knock-in)动物,且动物体内的一或多个内源性eklf等位基因(geneallele)被一或多个修饰的eklf基因所取代。在特定实施方式中,所述一或多个修饰的eklf基因的表达受到内源性eklf启动子的调控。在一实施方式中,所述非人类转基因动物是基因敲入动物,其eklf基因的两个位点(allele)相较于野生型皆经过修饰或改变,故可编码产生此处所述的修饰eklf多肽,例如,一修饰的eklf多肽,特征是其类小泛素化位置经过突变后不会进行类小泛素化作用。在特定实施方式中,所述动物是一啮齿动物动物,譬如,小鼠或大鼠。
在本发明第一方面的特定实施方式中,所述一或多个氨基酸修饰指在野生型eklf多肽中其类小泛素化或磷酸化的作用氨基酸位置进行修饰。在一实施方式中,所述一或多个氨基酸修饰指在野生型小鼠的eklf全长多肽中第74位置的氨基酸进行修饰。在除了小鼠以外的其他动物的实施方式中,所述一或多个氨基酸修饰指在小鼠eklf多肽中受到类小泛素化作用的氨基酸残基上所进行的修饰,此残基位置在不同物种间有可能座落在不同位点。举例来说,人类eklf多肽中与小鼠eklf多肽第74位(即,类小泛素化位置)相对应的氨基酸残基位置是在第54位。在特定实施方式中,此氨基酸残基是赖氨酸(lys)。在特定实施方式中,针对对应于第74位氨基酸所做的修饰或修饰是以精氨酸(arg)取代赖氨酸(lys)(即,k74r)。在特定实施方式中,所述一或多个氨基酸修饰系指针对对应于野生型小鼠eklf多肽第68位的氨基酸所做的修饰。在一实施方式中,本发明包含一纯合子(homozygous)敲入小鼠,其eklf等位基因皆发生k74r氨基酸置换。在除了小鼠以外的其他动物的实施方式中,所述一或多个氨基酸修饰指在小鼠eklf多肽中受到磷酸化作用的氨基酸残基上所进行的修饰,此残基位置在不同物种间有可能座落在不同位点。
在本发明第一、二、三或四方面的特定实施方式中,该修饰的eklf多肽其类小泛素化或磷酸化程度低于野生型eklf多肽。在特定实施方式中,所述修饰的eklf多肽的细胞质至细胞核移位作用(translocation)也低于野生型eklf多肽的移位作用,和/或其转录活化子活性(transactivatoractivity)或抑制子活性(repressoractivity)也与野生型eklf多肽不同。在相关的实施方式中,与野生型动物相比,非人类转基因动物中其修饰的eklf多肽的表达与增加寿命或健康年限相关;非人类转基因动物中其修饰的eklf多肽表达与减少肿瘤发生、生长或肿瘤转移相关。
在第二方面中,本发明包含一基因敲入载体,其包含一可编码出全长或部分修饰的eklf多肽的多核苷酸序列,相较于野生型eklf多肽,所述修饰的eklf多肽包含一或多个氨基酸修饰。
在本发明第三方面中,本发明包含的细胞、组织或器官源自此处所述非人类转基因动物。
在本发明第四方面中,本发明提供一种方法,其能治疗或预防一有需要个体的细胞增殖性疾病,或抑制或减少所述个体肿瘤发生或转移的机率;所述方法包含对该个体施用一有效量的多肽或编码产生所述多肽的核酸,其中所述多肽是一修饰的eklf多肽,其包含一或多个氨基酸修饰,而使得修饰的eklf多肽的类小泛素化程度低于一野生型eklf多肽;和/或第一活性药剂,其能改变内源性或野生型eklf多肽的一或多种活性。在特定的实施方式中,所述修饰的eklf多肽是修饰的人类eklf多肽;且在特定实施方式中,所述第一活性药剂可改变一野生型人类eklf多肽的一或多种活性。在部分实施方式中,所述细胞增殖性疾病是肿瘤或转移性肿瘤;譬如,但不限于:肝癌、大肠癌、乳癌、前列腺癌、肝细胞癌、黑色素瘤、肺癌、神经胶母细胞瘤、脑瘤、造血系统恶性肿瘤、胆道癌、视网膜母细胞瘤、肾细胞癌、头颈癌、子宫颈癌、胰脏癌、食道癌或鳞状细胞癌。
在第四方面的特定实施方式中,当施用所述多肽或核酸时,修饰的eklf多肽自细胞质至细胞核的移位作用(translocation)小于野生型eklf多肽的移位作用。在特定实施方式中,修饰的eklf多肽的转录活化子活性或抑制子活性与野生型eklf多肽不同。在一实施方式中,所述核酸是一表达载体。在一实施方式中,所述表达载体是一病毒载体。在特定实施方式中,所述病毒载体是来自于疱疹病毒、反转录病毒、牛痘病毒、减毒牛痘病毒、金丝雀痘病毒、腺病毒或腺相关病毒。
在本发明第四方面的特定实施方式中,所述一或多个修饰的氨基酸包含对应于野生型eklf多肽(例如,野生型人类eklf多肽)上类小泛素化或磷酸化位置之一的氨基酸修饰。在特定的实施方式中,所述一或多个修饰的氨基酸包含一对应于全长野生型人类eklf多肽上第54个氨基酸的修饰。在一实施方式中,对于第54个氨基酸进行修饰是指以譬如精氨酸来取代赖氨酸(k54r)。在特定实施方式中,所述一或多个修饰的氨基酸包含针对(如,人类eklf多肽中)已被磷酸化的氨基酸进行修饰,例如,但不限于,针对对应于全长野生型小鼠eklf多肽上第68位的磷酸化氨基酸残基进行修饰。
在本发明第四方面的特定实施方式中,当施用第一活性药剂时,其可降低内源性eklf多肽从细胞质至细胞核的移位作用。在特定实施方式中,所述第一活性药剂可修饰内源性eklf多肽的转录活化子活性或抑制子活性。在部分实施方式中,所述第一活性药剂可结合至内源性eklf多肽。在可任选的实施方式中,所述第一活性药剂是有机小分子或多肽,且所述多肽可以是抗体或其功能性片段。在特定实施方式中,第一活性药剂与内源性eklf多肽结合后,能抑制内源性eklf多肽从细胞质至细胞核的移位作用。
在第四方面的特定实施方式中,当施用所述多肽或核酸、或者是施用第一活性药剂时,所述方法还需要施用能够抑制内源性eklf多肽表达的第二活性药剂。在特定实施方式中,第二活性药剂是核酸分子,且可以是一负链rna、sirna、shrna或mirna,所述核酸分子能结合至可编码产生内源性eklf多肽的mrna或其互补序列。在一实施方式中,所述eklfcdna或mrna序列是genbank登录号:bc033580.1所示的人类序列。
依据本发明第四方面的特定实施方式,本发明更包含对该个体施用有效量的抗增殖剂,其中所述抗增殖剂适用于治疗细胞增殖性疾病。在特定实施方式中,所述抗增殖剂是一烷化剂、拓扑异构酶抑制剂、抗代谢物或细胞毒性抗生素。在特定实施方式中,所述烷化剂是顺铂(cisplatin)、卡铂锭(carboplatin)、益乐铂(oxaliplatin)、甲基二(氯乙基)胺(mechlorethamine)、环磷酰胺(cyclophosphamide)、氮芥苯丙氨酸(melphalan)、氮芥苯丁酸(chlorambucil)、依弗酰胺(ifosfamide)、二甲磺酸丁酯(busulfan)、n-亚硝-正-甲脲(n-nitroso-n-methylurea,mnu)、双氯乙基亚硝脲(carmustine)、环己亚硝(lomustine)、司莫司汀(semustine)、福莫司汀(fotemustine)、链佐霉素(streptozotocin)、达卡巴仁(dacarbazine)、米托唑胺(mitozolomide)、替莫唑胺(temozolomide)、沙奥特帕(thiotepa)、丝裂霉素(mytomycin)或地亚农(diaziquone)。在特定实施方式中,拓扑异构酶抑制剂是喜树碱(camptothecin)、依瑞诺丁(irinotecan)、托普迪肯(topotecan)、依妥普赛(etoposide)、艾霉素(doxorubicin)、坦尼坡赛(teniposide)、诺波霉素(novobiocin)、美巴龙(merbarone)或阿柔比星(aclarubicin)。在特定实施方式中,所述抗代谢物是氟嘧啶(fluoropymidine)、脱氧核酸类似物(deoxynucleosideanalogue)、硫嘌呤(thiopurine)、甲氨蝶呤(methotrexate)或培美曲塞(pemetrexed)。在特定实施方式中,细胞毒性抗生素是放线菌素(actinomycin)、博莱霉素(bleomycin)、普卡霉素(plicamycin)、丝裂霉素(mitomycin)、艾霉素(doxorubicin)、柔红霉素(daunorubicin)、表阿霉素(epirubicin)、伊达比星(idarubicin)、泛艾霉素(piraubicin)、阿柔比星(alcarubicin)或米托蒽醌(mitoxantrone)。
在本发明第五个方面中,本发明包含一种可延长一个体的寿命或健康年限的方法,包含对所述个体施用有效剂量的以下成分:一种多肽或一种可编码产生该多肽的核酸,其中所述多肽是修饰的eklf多肽,其包含一或多个修饰的氨基酸,使得此一修饰的eklf多肽的类小泛素化程度低于野生型eklf多肽;和/或第一活性药剂,其可改变内源性eklf多肽的一或多种活性。在某些实施方式中,此一修饰的eklf多肽是修饰的人类eklf多肽,且在特定实施方式中,第一活性药剂可改变野生型人类eklf多肽的一或多种活性。
在本发明第五个方面的特定实施方式中,当施用所述多肽或所述核酸时,修饰的eklf多肽的细胞质至细胞核移位作用(translocation)低于野生型eklf多肽的移位作用。在特定的实施方式中,修饰的eklf多肽其具有修饰的转录活化子活性或修饰抑制子活性与野生型eklf多肽的转录活化子活性或抑制子活性不同。依据一实施方式,该核酸是一表达载体。在一实施方式中,所述表达载体是一病毒载体。在一特定实施方式中,所述病毒载体是来自于疱疹病毒、反转录病毒、牛痘病毒、减毒牛痘病毒、金丝雀痘病毒、腺病毒或腺相关病毒。
在本发明第五方面的特定实施方式中,一或多个的氨基酸修饰包含野生型eklf多肽上类小泛素化或磷酸化位置上经修饰的氨基酸。举例而言,所述野生型eklf多肽可以是野生型人类eklf多肽。在特定的实施方式中,所述一或多个的氨基酸修饰包含一对应于全长野生型人类eklf多肽第54个氨基酸的修饰的氨基酸。在一实施方式中,所述对应于第54个氨基酸的修饰的氨基酸是指在原来赖氨酸的位置进行取代置换,例如,以精氨酸置换赖氨酸(k54r)。在特定实施方式中,所述一或多个的氨基酸修饰包含一磷酸化氨基酸,譬如,人类eklf多肽上修饰的磷酸化氨基酸,所述人类eklf多肽上的氨基酸相当于全长野生型小鼠eklf多肽上第68个氨基酸位置的磷酸化氨基酸。
在本发明第五方面的特定实施方式中,当施用第一活性药剂时,其可降低或抑制内源性eklf多肽从细胞质至细胞核的移位作用。在特定实施方式中,所述第一活性药剂修饰内源性eklf多肽其转录活化子活性或抑制子活性。在某些实施方式中,所述第一活性药剂可与所述内源性eklf多肽结合。在可任选的实施方式中,所述第一活性药剂是一有机小分子或一多肽。在一非必要的实施方式中,所述多肽可以是抗体或功能性片段。在特定实施方式中,第一活性药剂与内源性eklf多肽结合后可抑制内源性eklf多肽从细胞质至细胞核的移位作用。
在第五方面的特定实施方式中,当施用所述多肽或核酸、或者是施用所述第一活性药剂时,所述方法还需要施用能够抑制内源性eklf多肽表达的第二活性药剂。在特定实施方式中,第二活性药剂是核酸分子,且可以是一负链rna、sirna、shrna或mirna,所述核酸分子能与可编码产生内源性eklf多肽的mrna或其互补序列结合。
在本发明第五方面的特定实施方式中,所述方法能达到减少个体头发花白、提升其运动协调能力或肌力、减轻肌肉无力、降低骨质疏松症、增加骨体积、提升骨密度、增加索前软骨数量、缩减索前软骨间隙或减少平衡力的丧失的效果。
在第四或第五方面的特定实施方式中,所述个体可以是哺乳动物,其可以是一人类。
在第六方面中,本发明包含一种鉴别活性药剂的方法,所述活性药剂能延长个体寿命、提升生命年限或健康年限,和/或抑制或减少个体的肿瘤形成或肿瘤发生或转移的机率。本方法包含:将eklf多肽或能表达eklf多肽的细胞中加入一候选药剂;以及测量在eklf多肽上的转译后修饰量,或测量eklf多肽的活性量,其中若该转译后修饰量或活性量与一对照量不同,则该候选药剂是可延长个体寿命或生命年限和/或抑制或减少个体的肿瘤形成或肿瘤转移的活性药剂。在特定实施方式中,所述eklf多肽是野生型人类eklf多肽、其变异物或片段。在特定实施方式中,本方法是测量转译后修饰量,且若侦测到的量低于对照量,则候选药剂是活性药剂。在某些实施方式中,测量转译后修饰的方式是测定类小泛素化或磷酸化的量。在特定实施方式中,类小泛素化发生在对应于人类eklf多肽第54位的氨基酸残基上。在特定实施方式中,所述活性量是测定eklf多肽从细胞质至细胞核的移位作用,且若测量量低于对照量,则候选药剂是活性药剂。依据一特定实施方式,所述测量活性是转录活化子活性,若测量量改变(例如,低于对照量)则该候选药剂是活性药剂。在特定实施方式中,所述测量量是抑制子活性,若测量量改变(例如,高于对照量)则该候选药剂是活性药剂。在多种实施方式中,所述对照量是默认值或与eklf多肽(譬如,野生型人类eklf多肽或其片段)相关的量,或是未接触该候选药剂的细胞相关活化子或抑制子的量。在某些实施方式中,所述eklf多肽是内源性eklf多肽或外源性eklf多肽。在某些实施方式中,所述外源性eklf多肽是野生型eklf多肽。在特定实施方式中,所述细胞包含能表达eklf多肽的外源性核酸。
在第七个方面中,本发明包含一种用以鉴别活性药剂的方法,所述活性药剂能增加个体的预期寿命、延长生命年限、提升健康年限、和/或抑制肿瘤形成或肿瘤发生;所述方法包含:对此处所述的非人类转基因动物(例如,本发明第一方面的非人类动物)施用一候选药剂;以及,比较施用候选药剂的非人类转基因动物与控制组动物(即,未施用候选药剂的动物)的生命年限,其中若经施用候选药剂的非人类转基因动物的生命年限比控制组动物长,则所述候选药剂是能增加个体预期寿命、延长生命年限、和/或抑制肿瘤形成的活性药剂。
在第八个方面中,本发明包含一种用以鉴别活性药剂的方法,所述活性药剂能增加个体预期寿命、和/或抑制肿瘤形成或肿瘤转移;所述方法包含:将能够表达一修饰的eklf等位基因的细胞与一候选药剂接触,其中该修饰的eklf等位基因可编码产生一修饰的eklf多肽,相较于野生型eklf多肽,此一修饰的eklf多肽包含一或多个修饰的氨基酸;以及测量该修饰的eklf多肽的表达量;其中若该修饰的eklf多肽表达量高于未与候选药剂接触的控制组细胞中该修饰的eklf多肽表达量,则该候选药剂是能延长个体寿命和/或抑制肿瘤形成的活性药剂。在本发明第八方面的特定实施方式中,所述一或多个修饰的氨基酸包含对于野生型eklf多肽(例如,野生型人类eklf多肽)上经类小泛素化或磷酸化的氨基酸位置进行修饰。在特定的实施方式中,所述一或多个的氨基酸修饰是指对应于野生型人类eklf多肽第54位的修饰氨基酸。在一实施方式中,对所述第54个氨基酸进行修饰是指以精氨酸来取代赖氨酸(k54r)。在特定实施方式中,所述一或多个修饰的氨基酸包含譬如,人类eklf多肽中修饰的磷酸化氨基酸,例如但不限于,对应于野生型小鼠eklf多肽第68位的修饰的磷酸化氨基酸。
附图说明
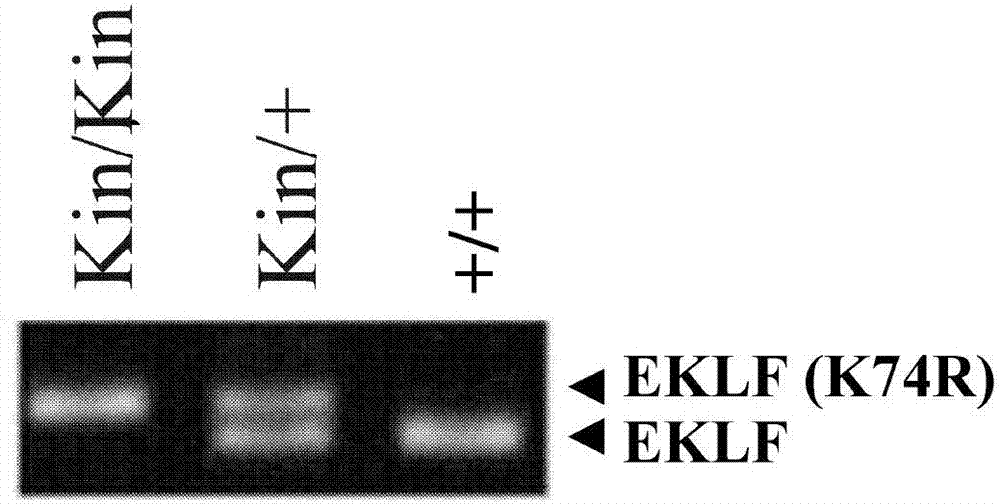
图1a-d显示利用同源重组技术产生eklfk74r小鼠的示意图。图1a上方绘示eklf基因的基因座和目标基因座。图1a下方显示重组等位基因在cre-调控重组之前(i)与之后(ii)的情形。以loxp-pgk-gb2-neo-loxpeklfk74r反转录病毒载体以及两侧各带有loxp位(黑色方块)的新霉素(neomycin)卡匣(neo,白色方块)来取代eklf基因的外显子2的蛋白编码区域。图中的阴影区域代表内源性eklf基因座被删除的部分,以及在利用cre重组酶移除新霉素匣之前(i)和之后(ii),标的载体被插入至eklf基因座中的部位。nfix为nfix基因座。fbwx9为fbwx9基因座。e1、e2和e3分别为eklf基因的外显子1、外显子2和外显子3;内含子1以及内含子2分别为eklf基因的第一与第二个内含子。neo为新霉素匣。pgk为真核启动子pgk;gb2为gb2原核启动子。删除是指由eklf内含子1删除50个核苷酸;5fa、5ra、gteklfd5’、gteklf3’、gteklfpgk5’、kin5’以及kin3’分别是基因分型用的pcr引物。左箭头和右箭头分别指出了基因分型引物的座落位置。k74r是指造成k74r置换的dna修饰。polya是指polya位置。loxp是指loxp位置。图1b显示野生型(+/+)小鼠、杂合子型eklfk74r小鼠(kin/+)以及纯合子型eklfk74r小鼠(kin/kin)的基因分型结果。图1c是野生型(wt)以及纯合子型k74r小鼠(kin)在胚胎第13.5天(e13.5)的胚胎照片。图1d显示野生型与eklfk74r小鼠的eklfmrna的相对表达量。
图2a和2b显示eklfk74r置换影响eklf多肽的转录活性。图2a显示野生型(wt)以及eklfk74r(kin)小鼠在胚胎第14天(e14)胎肝中col1a1mrna的相对表达量。图2b显示野生型(wt)以及eklfk74r(kin)小鼠在胚胎第14天(e14)胎肝中mpv171mrna的相对表达量。数据来自3个独立试验。**p<0.01,***p<0.001。
图3a和3b显示eklfk74r(kin)和野生型同窝小鼠(wt)间寿命的比较结果。图3a显示wt以及kin小鼠的存活曲线。图3b的照片显示kin小鼠脱色延迟(delayedde-pigmentation)的现象。
图4a-d显示野生型(wt)以及eklfk74r(kin)小鼠代谢的分析结果。图4a为野生型(wt)和eklfk74r(kin)三月龄小鼠的照片。图4b显示eklfk74r(kin)和wt小鼠于3、6、12、18和24月龄的体重。在野生型(wt)和eklfk74r(kin)小鼠3个月和24个月大时,测量其标准昼间代谢参数(canonicaldiurnalmetabolicparameters),包括其食物摄取(图4c)和水摄取(图4d)分析。所述数据以平均值±sem表示。以双尾学生氏t检定评估统计上的显著性。
图5a-d显示野生型(wt)和eklfk74r(kin)小鼠全身能量消耗的比较结果。测量3月龄和24月龄高龄小鼠的标准昼间代谢参数,包含vo2(图5a)、vco2(图5b)、热生成(图5c)以及呼吸交换率(respiratoryexchangeratio,rer)(图5d)。数据以平均值±sem表示。以双尾学生氏t检定评估统计上的显著性。
图6a-c显示野生型(wt;以圆圈表示)和eklfk74r小鼠(kin;以方块表示)饭前血糖的测量浓度(图6a)、胰岛素浓度(图6b)和葡萄糖耐受性试验(图6c)。数据以平均值±sem表示(每组n=3-9)。以双尾学生氏t检定评估统计上的显著性。
图7a和7b显示野生型(wt)和eklfk74r(kin)小鼠3月龄和24月龄的生理特征的比较结果。图7a是握力试验的结果。图7b是旋转杆试验结果。数据以平均值±sem表示(每组n=20)。p值表示在双向的重复测量anova中,基因型效应的显著性。数据以平均值±sem表示。以双尾学生氏t检定评估统计上的显著性。
图8显示评估公鼠骨质疏松症的结果。利用高分辨率微米级计算机断层扫瞄仪(high-resolutionmicro-computedtomography(mct))显影来分析3月龄(上方)和24月龄(下方)的野生型(wt)和eklfk74r(kin)小鼠的索前软骨(n=3-6)。
图9a和9b显示野生型(wt)以及eklfk74r(tg)小鼠24月龄的micropet影像。图9a为micropet影像,其是对小鼠施用100居礼(ci)的18f-fdg并于注射后扫描0.5小时所得。白色箭头指出野生型小鼠的肝脏、胰脏和脾脏中的肿瘤,但eklfk74r小鼠(kin)这些部位则没有肿瘤。图9b的表格为小鼠身体切片检验的结果,结果显示三分之二的wt小鼠形成肿瘤,但3只kin小鼠皆没有肿瘤形成。
图10a和10b显示eklfk74r小鼠抗癌生成的能力。图10a为注射b16f10黑色素瘤细胞后14天,野生型(wt)以及eklfk74r(kin)小鼠肺部的照片。三只经注射的wt小鼠的肺部皆发展形成了肿瘤(左图),3只kin小鼠的肺部无肿瘤形成(右图),其中比例尺为5公厘。图10b以柱形图呈现肿瘤的比较结果。
具体实施方式
除非另有指明,本发明利用所属技术领域常规分子生物和重组dna技术。所述常规技术揭示于以下文献:sambrook,etal.,molecularcloning:alaboratorymanual(3rdedition,2000);dnacloning:apracticalapproach,vol.i&ii(d.glover,ed.);oligonucleotidesynthesis(n.gait,ed.,1984);oligonucleotidesynthesis:methodsandapplications(p.herdewijn,ed.,2004);nucleicacidhybridization(b.hames&s.higgins,eds.,1985);nucleicacidhybridization:modernapplications(buzdinandlukyanov,eds.,2009);transcriptionandtranslation(b.hames&s.higgins,eds.,1984);animalcellculture(r.freshney,ed.,1986);freshney,r.i.(2005)cultureofanimalcells,amanualofbasictechnique,5thed.hobokennj,johnwiley&sons;b.perbal,apracticalguidetomolecularcloning(3rdedition2010);farrell,r.,rnamethodologies:alaboratoryguideforisolationandcharacterization(3rdedition2005).poly(ethyleneglycol),chemistryandbiologicalapplications,acs,washington,1997;veronese,f.,andj.m.harris,eds.,peptideandproteinpegylation,advanceddrugdeliveryreviews,54(4)453-609(2002);zalipsky,s.,etal.,“useoffunctionalizedpoly(ethyleneglycols)formodificationofpolypeptides”inpolyethyleneglycolchemistry:biotechnicalandbiomedicalapplications。
除非本说明书另有定义,此处所用的科学与技术词汇的含义与本发明所属技术领域中具有通常知识者所理解与惯用的意义相同。
“提升预期寿命(enhancinglongevity)”、“延长预期寿命(increasinglongevity)”、“延长生命(life-extension)”等词汇于本说明书中皆可互换使用,其是指延缓动物正常老化过程和/或延长其生命周期;所述动物如患有威胁生命的疾病(如,癌症或肿瘤)的动物。在较佳实施方式中,延长预期寿命是因为成熟生命阶段的延长所致,而不是因为未成熟生命周期的延长,且是因为以本发明所述方法处置后所造成的结果。
“提升健康年限(enhancinghealthspan)”是指延缓与老化相关的体质衰退、疾病或病症的发生或减缓其严重性。提升健康年限亦指降低或减少一般与老化相关的(如,在特定年龄)体质衰退、疾病或病症的发生或程度。
在此所述“等位基因(allele)”一词系指一细胞内或族群中的一特定基因形式,所述特定形式和同一个基因的其他形式的不同处在于:该基因的序列中的至少一个(且通常超过一个)变异位置的序列不同。不同等位基因之间,在这些变异位置上序列的差异,称为变异(variance)、多形性(polymorphism)或突变(mutation)。当一个体的一基因有两个相同的等位基因,则称此个体就该基因或等位基因而言为纯合子(homozygous)。当一个体的一基因有两个不同的等位基因,则称此个体就该基因而言为杂合子的(heterozygous)。特定基因上的多个等位基因彼此可能有单一个核苷酸或数个核苷酸的差异,且可包含核苷酸的置换、删除和插入。一基因上的一等位基因也可以是包含突变的基因形式。
所述“表达(expression)”一词系指当符合一定条件时,基因的转录作用会产生mrna,且通常会因而产生所编码的蛋白质。所述表达可由细胞在天然状态(即,未经人工技术介入)下完成或进行,或是利用人工技术(即,利用人工技术介入,如,藉由使用受到化学剂调控的启动子)完成或进行所述表达。也可利用由特定位重组酶(site-specificrecombinase)所引发的重组事件,来起始所述表达,例如,藉由cre-媒介重组技术。可藉由测量由该基因转录所得的mrna、或者是测量由该基因编码产生的蛋白量,来测量所述表达量。
所述“核酸”一词是指多核苷酸,譬如脱氧核糖核酸(dna),且在适当情况下亦可为核糖核酸(rna)。所述核酸包含但不限于,单股和双股多核苷酸。举例而言,多核苷酸包含dna、单股dna、cdna和mrna。所述核酸亦包含由核苷酸类似物制得的dna或rna的类似物,且也可以是单股(正股或负链)和双股核苷酸。所述核酸一词更包含修饰的的多核苷酸,其包含修饰的dna和修饰的rna,譬如,包含一或多个非天然状态的核苷酸或核苷的dna和rna。所述“核酸”和“核苷酸”在本说明书可交互使用,是指脱氧核糖核苷核酸或核糖核苷酸和其聚合物,且其可以是单股或双股形式。所述“核酸”一词涵盖包含已知核苷酸类似物或核酸骨架残基或键结经过修饰的修饰的核酸,所述修饰可以合成、天然存在和非天然存在的核酸,且/或其具有和对照核酸类似的结合特性,和/或代谢方式。举例而言,所述类似物包含但不限于,硫代磷酸盐(phosphorothioates)、氨基磷酸酯盐(phosphoramidates)、甲基磷酸盐(methylphosphonates)、手性-甲基磷酸盐(chiral-methylphosphonates)、2-o-甲基核糖核苷酸(2-o-methylribonucleotides)、多肽-核酸(peptide-nucleicacid,pna)。除非另有指明,一特定核酸序列包含保留性修饰变异(即,同义密码置换)以及互补序列,以及明确指出的序列。具体而言,同义密码置换可以藉由一或多个选定的(或全部)密码的第三个位置,以混合的碱基和/或脱氧基残基完成(batzeretal.,nucleicacidres.19:5081(1991);ohtsukaetal.,j.biol.chem.260:2605-2608(1985);rossolinietal.,mol.cell.probes8:91-98(1994)。
所述“分离(isolated)”的核酸分子通常是指与该核酸天然来源相关的核酸分子。分离的核酸分子和存在于天然界中的核酸的形式不同。因此,分离的核酸分子不同于存在于天然细胞中的核酸分子。
所述“载体”是指能够运送与其连接的另一核酸的核酸分子。所述“表达载体”是指此载体包含一启动子,其与一核酸分子以可操作的方式连接,而使得该经可操作连接的核酸能够被表达。在此所述的载体或表达载体包含质粒或噬菌体,其能合成该载体携带的各别重组基因所编码的目标蛋白质。载体或表达载体亦包含能够将核酸导入至一细胞(如,哺乳动物细胞)的病毒载体。某些载体能够自主复制和/或表达与其所连接的核酸。
在本揭示内容中,当放置所述核酸使其与另一核酸序列有功能性连接关系时,称两者为“可操作地连接(operablylink)”。举例而言,当一启动子能够启动编码序列的转录时,称该启动子与所述序列为可操作地连接;或当将一核糖结合位放置于能够协助转译发生的位置时,称该核糖结合位与编码序列为可操作地连接。一般来说,“可操作地连接”是指连接的dna序列是连续的且在阅读相(readingphase)中。然而,增强子就不一定要是连续的。可在既有的限制位进行接合以完成所述连接,若没有此类限制位时,可利用常规技术中的合成寡核苷酸转接子(adaptor)或连接符(linker)完成。
所述“转染(transfection)”一词系指核酸的导入作用,譬如,一表达载体藉由核酸媒介基因转移技术至一受体细胞。“转化(transformation)”系指细胞内噬外源性dna或rna导致细胞基因型改变的结果,且所述转化细胞表达一预期的异源蛋白。
在此“转基因(transgene)”是被引入转基因动物或细胞的一核酸序列,对于此一转基因动物或细胞,所述核酸序列的全部或一部可以是异源性的;或者是所述核酸序列是同源性的,但其经设计可被导入或已导入至该动物的基因组中而使得被导入的细胞的基因体改变。可将一转基因可操作地连接至欲使所选核酸有最佳表达所必须的一或多个转录调控序列以及任一其他核酸(如,内含子)。因此,“转基因”可作为形容词使用,以描述动物或构筑体携带转基因的特性。举例而言,“转基因动物”是一非人类动物,较佳是非人类哺乳动物;更佳是一啮齿动物,其中所述动物的一或多个细胞含有经由人为介入所导入的异源核酸,例如利用习知的转基因技术,包括基因敲入(geneknock-in)技术。可利用经设计的遗传操控手段,譬如透过微注射或重组病毒感染,将所述核酸直接或间接地导入一细胞的前体中,以将核酸导入至此细胞中。转基因动物包含但不限于基因敲入动物。
所述“基因敲入(knock-in)(kin)”系指将一转基因定向敲入至一宿主细胞的基因组中,造成转基因表达。基因敲入的转基因体所含的转基因可以是经敲入的杂合子。在特定的实施方式中,“基因敲入”使得一内源性基因(或其部分)被一外源性基因(或其部分)所置换,例如,使得成对的等位基因的一个或两个等位基因发生定向突变(targetedmutaiton)。“基因敲入”亦包含使所述动物和能够促进转基因的表达的物质接触(譬如,引入可促进定向插入位置的重组的酶(如cre-lox系统中的cre)或利用其他方法),以使得该转基因表达。
“纯合子(homozygous)”状态是指在同源染色体上相应的等位基因座上存有相同等位基因的遗传状态。相反地,“杂合子(heterozygous)”状态则是指在同源染色体上相应的等位基因座上存有不同等位基因的遗传状态。
所述“哺乳动物(mammal)”是指哺乳纲的所有成员,包含人类、灵长类、家畜与农畜(例如,兔、猪、绵羊和牛);以及哺乳动物动物园或竞赛用动物、宠物,以及啮齿动物(如,小鼠和兔)。所述“非人类哺乳动物”指除了人以外的所有哺乳纲成员。
所述“治疗(treatment)”一词是指达到所欲的药学和/或生理学效果;例如,延缓或抑制癌症的发生、生长或转移或缓减相关症状。上述效果可以是预防性的(prophylactic),而指能够部分或完全地防止或抑制疾病或其病征的发生;和/或可以是治疗性的(therapeutic),而能够完全或部分治愈疾病和/或可肇因于该疾病的副作用。所述“治疗(treatment)”包含对哺乳类动物(特别是人类)的疾病进行预防性(preventive)、治疗性(curative)或缓和性(palliative)的处置;且所述治疗包含:(1)针对易于罹患一疾病但尚未确诊的个体进行预防性(如,预防用药)、治疗性或缓和性的处置,以避免该疾病或或相关症状(如,癌症)的发生;(2)抑制一疾病(例如,延迟该疾病的进程);或(3)缓解一疾病(如,减轻与所述疾病相关的症状)。
所述“施用(administered)”一词及其各种时态与词性是指一传递方式,包含但不限于,以静脉内、肌肉内、腹膜内、动脉内、颅内或皮下等途径来施用本发明的药剂(例如,化合物或组合物)。
在此处,“有效量(effectiveamount)”一词系指在必要的剂量和期间等条件下,针对所治疗的疾病或症状(如,老化)足以招致所欲的反应或效果的用量。以治疗癌症为例,一药剂(如,化合物、多肽、编码治疗用多肽的聚核酸)能够减少、抑制、预防、延缓、遏止或延迟与癌症相关的任一症状时,就视为有效。一药剂的有效量不必然能够治愈一疾病或症状,但能延缓、阻碍或预防疾病或症状的发生,或缓减疾病或相关的病征与症状。可将所述治疗有效量以适当的形式分成一、二或更多剂,并在指定期间内施用一次、二次或更多次。
所述“个体(subject)”是指可接受此处提出的方法来治疗的动物(包含人类)。除非另有指明,“个体”一般包含雄性与雌性。因此,所述“个体”包含可因此处提出的治疗方法而受益的任何哺乳类动物。
“细胞增殖性疾病”、“肿瘤”和“癌症”等词,在此可交互使用,此类疾病的特征为失调或失控的自发性细胞生长(包含恶性和非恶性生长)、细胞分化能力丧失以及具有侵袭局部组织和转移的能力。所述疾病的例子包含,但不限于:恶性肿瘤(carcinoma)、淋巴瘤(lymphoma)、胚细胞瘤(blastoma)、肉瘤(sarcoma)和白血病(leukemia)或淋巴样恶性肿瘤(lymphoidmalignancies)。所述疾病特定的实例包含,但不限于:肝癌(livercancer)、大肠癌(coloncancer)、乳癌(breastcancer)、前列腺癌(prostatecancer)、肝细胞癌(hepatocellularcarcinoma)、黑色素瘤(melanoma)、肺癌(lungcancer)、神经胶母细胞瘤(glioblastoma)、脑肿瘤(braintumor)、造血系统恶性肿瘤(hematopoeiticmalignancies)、视网膜母细胞瘤(retinoblastoma)、肾细胞癌(renalcellcarcinoma)、头颈癌(headandneckcancer)、子宫颈癌(cervicalcancer)、胰脏癌(pancreaticcancer)、食道癌(esophagealcancer)以及鳞状细胞癌(squamacellcarcinoma)。
在不与上下文冲突的前提下,本说明书所用的单数名词涵盖该名词的复数型。
所述量值的“降低(decreased)或减少(reduced)”通常是指在统计上具显著差异的量,且可包含,例如,相较于控制组,降低或减少5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含以上数值之间的所有正整数与数值范围)。本说明书亦记载了其他比较以及“统计上具显著差异”的量的例示。“降低”在此可以是抑制(inhibit)、减少(reduce)、、限制(curb)、减弱(abate)、衰减(diminish)、减轻(lessen)或下降(lower)。
所述量值的“增加(increased)或增强(enhanced)”通常是指在统计上具显著差异的量,且可包含,例如,相较于控制组,增加5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。增加或增强的量可包含,相较于控制组,能够增加或增强2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、300倍、400倍、500倍、1,000倍、10,000倍或以上(包含以上数值之间的所有正整数与数值范围)。本说明书亦记载了其他比较以及“统计上具显著差异”的量的例示。增加在此亦指刺激(agonize)、增强(enhance)、提升(inflate)、提高(escalate)、扩张(expand)、强化(augment)、增大(enlarge)或上升(raise)。
在此所述“多肽(polypeptide)”和“蛋白质(protein)”能交互使用,都是指氨基酸聚合物,及其氨基酸变异物和合成类似物。因此,这些词汇亦适用于带有一或多个合成的、非天然存在的氨基酸(如一天然存在的氨基酸的化学类似物)的氨基酸聚合物,也适用于天然存在的氨基酸聚合物。在此所述的“多肽”不限于具有特定长度的产物,故,胜肽、寡胜肽和蛋白质皆属于此处定义的多肽,且在本说明书中可交互使用这些名词,除非另有指明。此处所述的多肽也可具有表达后修饰或修饰(post-expressionmodification),例如,糖化(glycosylations)、乙酰化(acetylations)、磷酸化(phosphorylations)、及与其相似的修饰或还有其他已知的修饰,且涵盖天然发生和非天然发生的修饰。所述多肽可以是完整的蛋白质或其次序列、片段、变异物或衍生物。
在此处,利用“相似(similar)”一词来描述可以被测量和/或定量的特性、特征、作用或活性时,是指未出现可侦测到的差异和/或不具统计上的显著差异。
所述“野生型(wild-type)”是指一基因或基因产物所具备的特性,和从天然存在的来源中分离出来的该基因或基因产物的特性相同。一野生型基因或基因产物(如,多肽)是一族群中出现频率最高的,且因可将其定义为该基因的“正常型(normal)”或“野生型”形式。
一“控制组动物”是和实验组动物(例如,能表达修饰的eklf多肽的转基因动物)非常相似的动物,但不具有实验组的特征(如,表达出修饰的eklf多肽)。于一实验或比较性实验中,所属技术领域中具有通常知识者,可基于某些考虑来选择适当的控制组动物,上述考虑包括但不限于:实验或比较性实验的本质、转基因动物的物种和年纪,以及实验可行性。除非另有指明,所述控制组动物的eklf基因未经修饰,且不会表达修饰的的eklf多肽。在某些实例中,所述控制组动物与转基因动物的性别相同,且为同窝动物。
所述“老年(aged)动物”是指一成体动物显现出至少一与正常老化过程相关的表达型。一动物被视为“老年”的实际年龄会随着动物的品种和/或品系而不同,也和所探讨的表达型有关,且本领域技术人员可轻易地决定此一年龄。
“同源性(homology)”是指相同氨基酸或保留性置换氨基酸的百分比。可利用序列比较程序(例如,gap(deverauxetal.,1984,nucleicacidsresearch12,387-395))来测定同源性。以所述程序进行测定时,将和此处所述的序列和相似序列或长度实质上不同的序列进行比较时,可在对比序列中引入间隙,其中所述间隙可以利用gap中的比较算法来决定。
“统计上的显著(statisticallysignificant)”是指结果不太可能是偶然发生的。可利用任何本领域中已知的方法来计算统计显著性。本领域常用p值来表示显著差异性,此一数值代表当虚无假设为真时,所观察到的事件发生的频率或机率。若所得到的p值小于显著水平,则拒绝虚无假设。在简单的实例中,显著水平定义为p值小于或等于0.05。所述“显著”一词包含统计上的显著。
“序列相似度”或举例来说“序列有50%的相似度”是指在一比对范围(windowofcomparison)内,逐个比较核苷酸或逐个比较氨基酸后,序列相同的程度。因此,可以藉由比较在比对范围中,经优化比对排列的两个序列,来决定在两个序列中具有相同核酸碱基(如,a、t、c、g、i)或相同氨基酸残基(如,ala、pro、ser、thr、gly、val、leu、ile、phe、tyr、trp、lys、arg、his、asp、glu、asn、gln、cys与met)的位置的数目,以得到相符位置的数目,而后再将相符位置数目除以比对范围中所有位置的总数(即,窗口大小)并乘以100,以计算出序列相似度百分比。
用以描述二或多个多肽间序列关系的名词,包含“参考序列(referencesequence)”、“比对范围(comparisonwindow)”、”序列相似度(sequenceidentity)”、“序列相似度百分比(percentageofsequenceidentity)”和“实质相似度(substantialidentity)”。“参考序列”的长度为至少12个单体,一般为15至18个单体,且通常为至少25个单体,该单体可以是核苷酸或氨基酸残基。因为对二个多肽而言,两者可分别包含(1)两个多肽序列间彼此相似的一段序列(即,完整多肽序列的一部分而已),以及(2)两个序列间彼此不同的一段序列;所以在比较二(或多个)多肽的序列时,通常会比较在一“比对范围”中,二个多肽的序列,以鉴别和比较局部区域的序列相似度。一“比对范围”是指一种概念性的片段(conceptualsegment),其长度为至少6个连续位置,通常为约50至100个,更佳为100至150个,在将两个序列优化比对排列之后,可将一序列的此一区段和参考序列中相同数目的连续位置进行比较。为达到两个序列的优化比对排列,比对范围相较于参考序列(不含加入或删除)可带有约20%或以内的加入或删除(即,间隙)。在比对排列一比对范围时,可利用由计算机实作的算法(geneticscomputergroup公司(575sciencedrivemadison,wi,usa)发行的wisconsingeneticssoftwarepackagerelease7.0中的gap、bestfit、fasta和tfasta程序)或藉由检视使用所选的多种方法其中任一种产生的最佳比对排列(即,在比对窗口内可得到最高同源百分比者),以得到序列的最佳比对排列。亦可参考如altschuletal.,1997,nucl.acidsres.25:3389一文所揭示的blast系列程序。对序列分析的详尽讨论结果请参见ausubeletal.所著currentprotocolsinmolecularbiology(johnwiley&sonsinc,1994-1998,chapter15)一文的19.3段落。
可利用以下方法来计算序列之间的序列相似度或序列一致性(在本说明书中这些名词可交互使用)。于测定二氨基酸序列或二核酸序列的相似度百分比时,可排列这些序列以实现优化的比对结果(例如,可在第一和第二氨基酸或核酸序列其中之一或二序列中引入间隙,以实现优化比对排列,或可基于比对之目的,忽略非同源序列)。在特定实施方式中,参考序列中用于比对排列的部分的长度至少为参考序列的30%,较佳为至少40%,更佳为至少50%、60%,以及甚至更佳为至少70%、80%、90%、100%。之后,比对位在相应氨基酸位置或核苷酸的位置上的氨基酸残基或核苷酸。当第一序列中一位置上的氨基酸残基或核苷酸和第二序列相应位置的氨基酸残基或核苷酸相同时,则在所述位置上的分子是相同的。
二序列间的相似度百分比是这些序列所共有的相同位置的数目的函数,且需考虑为了使二序列达到最佳比对排列所引入的间隙数量及每一间隙的长度。
可利用数学算法来进行序列的比较以及决定二序列间的相似度百分比。在一较佳的实施方式中,利用needleman和wunsch算法(1970,j.mol.biol.48:444-453)来决定二氨基酸序列的相似度百分比,gcg软件包中的gap程序即使用此一算法,此算法利用blossum62矩阵或pam250矩阵,且间隙权重(gapweight)为16、14、12、10、8、6或4,长度权重(lengthweight)为1、2、3、4、5或6。在其他较佳的实施方式中,利用gcg软件包中的gap程序来决定二核苷酸序列的相似度百分比,其使用nwsgapdna.cmp矩阵,且间隙权重为40、50、60、70或80,长度权重为1、2、3、4、5或6。一较佳的参数(除非另有指明,此处使用此一参数)为blossum62评分矩阵,间隙罚分为12、间隙延长罚分为4,和框架飘移间隙罚分为5。亦可利用e.meyers与w.miller提出的算法(1989,cabios,4:11-17)来计算二氨基酸或核苷酸序列的相似度百分比,align程序(2.0版)即使用此一算法,并使用了pam120权重残基表、间隙长度罚分为12且间隙罚分为4。
在公开数据库中进行检索时,可将此处所述的核酸和蛋白质序列作为“查询序列(querysequence)”,以鉴别出例如其他家族成员或相关序列。可利用nblast和xblast程序(2.0版)(altschul,etal.,(1990,j.mol.biol,215:403-10))来进行上述检索。利用nblast程序来进行blast核苷酸检索时,所用的参数设定为:分数=100、字长=12,以得到与本发明所述核酸分子同源的核苷酸序列。利用xblast程序来进行blast蛋白质检索时,所用的参数设定为:分数=50、字长=3,以得到与本发明所述蛋白质分子同源的氨基酸序列。基于比较的目的,欲得到含有间隙的比对排列时,可利用altschul等人发表的gappedblast进行比对(1997,nucleicacidsres,25:3389-3402)。当使用blast以及gappedblast程序时,可利用各程序(如,xblast以及nblast)的预设参数进行比对分析。
所述“抗体(antibody)”应以最广意义来解释,且具体来说涵盖了单克隆抗体、多克隆抗体、由至少两种完整抗体所形成的多特异性抗体(即,双特异性抗体)以及抗体片段,只要其能够展现所需的抗原结合活性。“抗体片段”包含完整抗体的一部分,较佳为包含其抗原结合区或变异区。抗体片段的实例包含fab、fab'、f(ab')2、scfv和fv片段;微型双功能抗体(diabodies);纳米抗体(nanobodies);线性抗体(linearantibodies);单链抗体分子;以及由一或多个抗体片段所形成的多特异性抗体。
转基因动物
本揭示内容部分是基于所开发出的基因敲入动物(譬如,基因敲入小鼠);此一基因敲入动物可作为长寿、抗老化、抗肿瘤发生,和/或抗肿瘤转移的动物模型,其中所述动物的内源性红血球kruppel样因子(eklf)基因的一或两个等位基因经过修饰,以编码产生一修饰的eklf多肽,其包含在此所述的任一具体实施方式。在转基因动物体内表达此一修饰的eklf多肽,能增加动物寿命和/或健康年限,和/或抑制肿瘤形成和/或癌细胞转移。因此,导入此一修饰的eklf等位基因,可作为增加个体寿命或健康年限的手段,或治疗细胞增殖性疾病(譬如,抑制肿瘤形成或肿瘤转移)的手段,以及用以筛选能够作为抗老化和抗肿瘤药剂的候选药剂的手段。
在特定的实施方式中,本案开发的非人类转基因动物模型是一种有价值的的研究工具,适用于研究老化、长寿以及细胞增殖性疾病(如,癌症)的进程和治疗。此一动物模型的优点在于,其代谢模式和正常动物并无二致。特别是,本发明提出的非人类转基因动物模型对于研究老化、长寿,以及筛选可作为抗老化剂和治疗或预防癌症(包含癌转移)的药剂的候选药剂等研究极具实用性。
本发明特定实施方式是关于一种转基因动物,其包含可编码产生修饰的eklf多肽的核酸(如,dna)序列。“修饰的eklf多肽”包含一eklf变异物或其片段;相较于野生型eklf蛋白,所述修饰的eklf多肽具有至少一修饰的氨基酸;所述eklf片段具有至少100、200、300或350个氨基酸;且所述变异物或其片段相对于野生型eklf蛋白的序列相似度为至少80%、85%、90%、95%、96%、97%、98%或99%。
在特定实施方中,转基因动物包含可编码产生此一修饰的eklf多肽的核酸序列,也可包含可编码产生野生型eklf的核酸序列。在特定实施方式中,转基因动物包含可编码产生修饰的eklf多肽的核酸序列(如,dna),且不包含可编码产生野生型eklf的核酸序列。在多种实施方式中,所述动物可表达出此一修饰的eklf多肽,以及内源性eklf多肽;而在某些实施方式中,所述动物仅能表达出此一修饰的eklf多肽。
在某些实施方式中,编码产生此一修饰的eklf的核酸序列系受到内源性eklf基因启动子所调控。某些实施方式是关于能够表达此一修饰的eklf蛋白的非人类转基因动物,其中所述转基因动物包含可编码产生此一修饰的eklf蛋白的核酸序列,其中该eklf蛋白是由内源性eklf启动子所调控。某些实施方式是关于能够表达此一修饰的eklf蛋白的非人类转基因动物,其中所述转基因动物包含可编码产生此一修饰的eklf蛋白的核酸序列,以及外源启动子其可编码产生此一修饰的eklf蛋白的核酸序列系可操作式地连接至所述外源启动子,或受其控制。在部分实施方式中,外源性启动子是选自:能够以组成型(constitutive)形式导引转基因表达的启动子、能够以具组织特异性的形式导引表达的启动子、诱导型启动子(如,tet-on诱导型启动子),以及可基于发展进程或时间的而导引表达的启动子。某些实施方式是关于能够表达此一修饰的eklf蛋白的非人类转基因动物,其中该转基因动物包含可编码产生此一修饰的eklf蛋白的核酸序列,其中该eklf蛋白是由内源性eklf启动子所调控的。“启动子”是指能够起始特定基因转录的dna区域。“内源性启动子”是指天然状态下即可在细胞或个体中导引目标基因表达的启动子(即,原生启动子)。对基因敲入小鼠来说,修饰的基因系接受该基因的内源性小鼠启动子的导引而表达。
本发明特定的实施方式是关于一种非人类eklf基因敲入动物。在此所述的“基因敲入动物”是指利用基因工程方式将dna序列(如,cdna序列)插入至生物染色体的特定位置上所产生的转基因动物。插入序列两侧带有来自非关键位置的dna相连,而同源重组使得转基因可被标定到所述的特定的非关键整合位置(non-criticalintegrationsite)。所述“基因敲入”应涵盖第一代动物和其继代,这些动物在至少一等位基因中含有该转基因。在某些实施方式中,所述插入序列包含标定到eklf基因座的dna或其片段,其中所述插入序列编码修饰的eklf多肽或其区域或部分。在某些实施方式中,所述插入序列系被插入至eklf基因座中编码蛋白质的区域。在特定的实施方式中,所述插入序列可编码产生一修饰的eklf多肽。
“eklf基因敲入”是指在非人类转基因动物中,编码产生修饰的eklf多肽或其部分或区域的核酸,被基因敲入至eklf基因座上,譬如,用其取代该动物中用以编码相对应的野生型eklh多肽的核酸或其部分。在某些实施方式中,所述基因敲入动物是杂合子,其包含一份内源性eklf基因和一份修饰的、敲入的eklf基因。在特定实施方式中,所述转基因动物是一eklf基因敲入小鼠。在特定实施方式中,所述基因敲入动物是纯合子,其包含二份修饰的、敲入的eklf基因。
在特定实施方式中,非人类动物遗传物质的修饰是发生在内源性eklf基因座上,以修饰的eklf基因序列(或其部分)来取代内源性基因序列(或其部分),进而形成一修饰的eklf基因座,其中该修饰的eklf基因序列包含至少一可编码产生该修饰蛋白的外显子。在某些实施方式中,所述取代包含一修饰的基因片段,其包含至少两个可编码产生eklf蛋白质的外显子。在部分实施方式中,所述取代包含一修饰的基因体片段,其包含至少三个可编码产生该修饰的eklf蛋白质的外显子。在特定实施方式中,所述非人类动物遗传物质的修饰是以eklf基因的修饰的外显子2(或其部分)来取代eklf基因的内源性外显子2。在特定实施方式中,以一修饰的eklf基因序列来取代内源性eklf基因序列中编码产生eklf蛋白类小泛素化位置或磷酸化位置的区域。
在一特定实施方式中,非人类转基因动物包含一修饰的eklf基因座,其可编码产生一修饰的eklf多肽;相较于内源性野生型eklf,所述修饰的eklf多肽包含一或多个修饰的氨基酸,所述修饰包括本说明书所提到的各种修饰作用。在特定实施方式中,所述修饰的eklf多肽可抑制其的类小泛素化程度。生物体通常能够将遗传物质被修饰的部分传给后代,例如,藉由生殖繁衍的方式传给后代。在某些实施方式中,所述非人类转基因动物为,已带有可编码产生修饰的eklf多肽的修饰的eklf基因座的亲代,所产生的子代。在某些实施方式中,子代的修饰的eklf基因座为纯合子。在特定实施方式中,子代的修饰的eklf基因座为杂合子。
在特定实施方式中,相较于野生型内源性eklf片段,非人类转基因动物包含一修饰的eklf基因座,其可编码产生包含有一或多个修饰的氨基酸的eklf多肽,且更包含在一或多个其他基因座上的修饰的氨基酸。在某些实施方式中,所述转基因动物包含一、二、三、四、五、六、七、八、九、十、或更多个其他额外的、修饰的基因座。在某些实施方式,额外的修饰基因座可以一基因剔除、基因敲入或插入一外源性基因。
特定的实施方式是关于非人类的eklf基因敲入动物与包含至少一额外、修饰的基因座的转基因动物交配后所产生的子代。特定实施方式是关于能够表达此一修饰的eklf多肽的子代,上述修饰的eklf多肽是由一eklf基因敲入动物和转基因动物(包含至少一额外非eklf修饰)交配后所得到。转基因动物为已知的技术,且可包含:其可诱导表达外源多肽的转基因动物、可诱导基因剔除的动物模型(如,cre-loxp)、可诱导基因敲入的动物(如,crisper/cas)。在特定实施方式中,eklf基因敲入动物可与转基因动物交配,譬如,基因敲入动物和/或基因剔除动物彼此交配。在某些实施方式中,eklf基因敲入动物可与特定动物疾病模式的转基因动物交配,例如,癌症或长寿态样的动物(如,s6k1基因剔除动物模型)。
在某些实施方式中,所述非人类的转基因动物是选自于小鼠、大鼠、兔、猪、牛(乳牛、公牛、野牛)、鹿、绵羊、山羊、鸡、猫、狗、貂、灵长类(如,狨猴或恒河猴)。在特定实施方式中,所述非人类动物是一哺乳动物,譬如非人类哺乳动物。在特定实施方式中,所述非人类动物是小哺乳动物,譬如,鼠总科(thesuperfamilyofmuroidea)。在某些实施方式中,所述转基因动物是啮齿动物。在某些实施方式中,所述啮齿动物是选自于小鼠、大鼠和仓鼠。在某些实施方式中,所述啮齿动物是选自鼠总科。在一实施方式中,所述转基因动物是选自于以下各科:丽仓鼠科(calomyscidae,如,鼠样仓鼠(mouse-likehamsters))、仓鼠科(cricetidae,如,仓鼠(hamster)、新世界大鼠和小鼠(newworldratsandmice)、田鼠(voles))、鼠科(muridae,如,真小鼠和大鼠(truemiceandrats)、沙鼠(gerbils)、刺毛鼠(spinymice)、鬃鼠(crestedrats))、马岛鼠科(nesomyidae,如,攀鼠(climbingmice)、岩鼠(rockmice)、白尾鼠(with-tailedrats)、马达加斯加大鼠和小鼠(malagasyratsandmice))、刺山鼠科(platacanthomyidae,如,刺山鼠(spinydormice)),以及鼹形鼠科(spalacidae,如,鼹鼠(molerates)、竹鼠(bamboorats)、鼢鼠(zokors))。在某些实施方式中,所述转基因啮齿动物是选自真小鼠或大鼠(鼠科)、沙鼠、刺毛鼠和鬃鼠。在一实施方式中,所述转基因小鼠是鼠科成员。在一实施方式中,所述动物是啮齿动物。在一特定的实施方式中,所述啮齿动物是选自于小鼠和大鼠。在一实施方式中,所述非人类动物是一小鼠。在一特定实施方式中,所述非人类转基因动物是一eklf基因敲入小鼠。
在一特定的实施方式中,所述非人类动物是一啮齿动物,且是一c57bl小鼠。所述c57bl小鼠选自于c57bl/a、c57bl/an、c57bl/grfa、c57bl/kalwn、c57bl/6、c57bl/6j、c57bl/6byj、c57bl/6nj、c57bl/10、c57bl/10scsn、c57bl/10cr和c57bl/ola品系。在其他实施方式中,所述小鼠是129品系小鼠,其系选自于129p1、129p2、129p3、129x1、129s1(如,129s1/sv、129s1/svim)、129s2、129s4、129s5、129s9/svevh、129s6(129/svevtac)、129s7、129s8、129t1和129t2(参见,festingetal.(1999)revisednomenclatureforstrain129mice,mammaliangenome10:836,亦可参见auerbachetal.(2000)establishmentandchimeraanalysisof129/svev-andc57bl/6-derivedmouseembryonicstemcelllines)。在某些实施方式中,所述转基因小鼠是所述129品系交配所产生或c57bl/6品系小鼠交配所产生。在其他特定实施方式中,所述小鼠是前述129品系或bl/6品系交配所产生。在某些实施方式中,所述交配的129品系是129s6(129/svevtac)。在其他实施方式中,所述小鼠是balb品系(如,balb/c)。在其他实施方式,所述小鼠是balb和其他前述的品系交配所产生。在又一实施方式中,所述小鼠是一杂交系(hybridline)小鼠(如,50%balb/c-50%12954/sv;或50%c57bl/6-50%129;如,f1h4细胞,参见“auerbachetal.(2000)”一文。
在特定实施方式中,所述非人类动物是一大鼠。在其他实施方式中,大鼠是选自于wistar大鼠、lea品系、spraguedawley品系、fischer品系、f344、f6和darkagouti。在某些实施方式中,所述大鼠品系是经由二或多种如下所述品系的大鼠交配所产生:wistar大鼠、lea、spraguedawley、fischerstrain、f344、f6和darkagouti。
虽然在此亦提出了包含所述修饰的转基因细胞,在许多方面和实施方式中,所述非人类转基因动物在生殖细胞中包含修饰的内源性eklf基因座。
在不同的实施方式中,所述非人类动物是哺乳动物。在特定实施方式中,所述哺乳动物为啮齿动物。在特定实施方式中,所述啮齿动物包含在一或二内源性啮齿动物eklf基因座上的eklf遗传物质进行修饰。本发明揭示制造啮齿动物(如,小鼠)的方法,所述方法包含在单一或二内源性eklf基因座上,以修饰的eklf基因或其片段来取代内源性eklf基因或其片段(如,包含一或多个外显子的片段)。在特定实施方式是关于包含修饰的eklf基因的细胞、组织和小鼠,以及由内源性非人类eklf基因座来表达人类eklf的细胞、组织和小鼠。亦提出了可在内源性啮齿动物启动子的调控下表达修饰的eklf蛋白的啮齿动物。
在特定实施方式中,揭示产生可表达修饰的eklf多肽的基因敲入动物的方法,其包含但不限于可表达修饰的eklf多肽,而不是野生型eklf多肽的纯合子。可利用已知的技术产生基因敲入动物,如小鼠,请参见以下文献:doyleetal.2012transgenicres.21(2):327–349;以及roebroeketal.chapter10in:hofkermh,deursenjv,editors.transgenicmouse:methodsandprotocols.humanapress;totowa,nj:2003.pp.xiiipp.3741pp.3187–3200。
在一策略中,利用二阶段法来得到基因敲入小鼠,此方法利用多功能胚胎干细胞(pluripotentembryonicstem(es)cells)作为载体,并利用此载体将实验性基因操作转换成可在小鼠体内以门德尔式遗传的性状。在特定策略中,利用具有标的dna的构筑体(targetingconstruct)来转染源自小鼠的胚胎干细胞,所述具有标的dna的构筑体和内源性基因或染色体序列具有同源区域,以利进行同源重组。所述具有标的dna的构筑体不仅包含与基因同源的特定区域,亦包含经过独特基因工程处理的突变或序列变异,使得在将其转染至es细胞内之后,可利用一对一的置换方式,以来自于具有标的dna的构筑体的序列来取代内源性基因(或其部分),使得这些细胞的基因体中的等位基因带有此一新的序列变异物。将含有适当改变基因的es细胞株转移至3.5天囊胚细胞的囊胚腔中。接着,将胚胎转移至代理孕母体内,经过妊娠而得到衍生自es细胞的种源创始小鼠(foundermice),此一小鼠遗传了上述新的变异序列(即,基因敲入突变),并在选定的基因座上产生一具有功能的等位基因(gain-of-functionallele)。所属技术领域中具有通常的知识者,可依照其通常知识选定特定的策略,以产生基因敲入动物,譬如,利用cre-loxp系统和crisper/cas9技术。
对于无法轻易取得适用于对遗传物质进行修饰的es细胞的非人类转基因动物,可利用其他方法来制造含有修饰的遗传物质的非人类动物。所述方法包含,例如但不限于,对一非es细胞基因体(如,纤维母细胞或经诱导的多能细胞)进行修饰和使用核转移技术,将修饰的的基因体转移到合适的细胞(如,卵母细胞),并在适当条件下以非人类动物孕育上述修饰的的细胞(如,修饰的卵母细胞),以形成一胚胎。
部分实施方式中,本发明提供利用cre-loxp系统来产生转基因动物的方法,所述转基因动物会表达出此一修饰的eklf多肽。已知可利用cre-loxp系统在受到控制的情况下,藉由在分离的细胞或转基因动物中,诱发基因体重组,以对选定基因的表达进行修饰或诱导染色体重组。此系统利用pi噬菌体酶,即,cre重组酶,其可辨识称为loxp的一段较短(34bp)且不对称的共有序列(consensussequence)。当一dna分子上有两个相同方向的此种序列时,所述酶会催化这两个部位间的重组并切除中间的dna片段。当两个loxp序列位于不同的dna分子上时,例如两条染色体上,则cre会导引分子间的重组。重组的结果取决于loxp部位的方位,对于位在相同的染色体臂上的二个lox部位,反向的loxp部位会导致插入的情形,而一正向重复的loxp部位会造成删除的情形。除了在此所述的cre-loxp重组系统外,亦可利用其他由部位导引的重组系统(site-directedrecombinationsystem)来产生如本揭示内容实验例中所例示的非人类转基因动物模型。
所述转基因动物经过筛选与评估,可选择出带有所欲研究的表达型的动物。进行初步筛选时,可利用例如southern印迹法或pcr技术来分析动物组织,以确认是否发生转基因的插入。亦可利用已知的技术来评估在转基因动物组织中,转基因的mrna表达量,上述技术包括但不限于:以northern印迹法分析来自动物的组织样本、原位交配分析和反转录-pcr(rt-pcr)。可利用免疫细胞化学法,以对转基因具有专一性的抗体来评估取自适当组织的样本。用于评估所述转基因的其他可替代或额外的技术包含,但不限于,适当的生物化学分析(譬如酶和/或免疫学分析)、针对特定标记或酶活性进行组织染色、流式细胞仪分析及其他类似技术。亦可利用血液分析来侦测转基因产物是否存在于血液中。
在特定的实施方式中,本发明方法与产生转基因动物的方法有关,其中所述转基因动物是利用多能细胞或全能(totipotent)细胞(如,es细胞)所产生。在特定的实施方式中,利用核注射步骤来产生非人类动物,此方法是利用原核注射来导入带有所述修饰的eklf基因或其部分(可任选的是上游和/或下游内源性非人类调控序列)的核酸构筑体。在某些实施方式中,该核酸构筑体包含一基因体片段,其包含至少一可编码产生修饰的eklf蛋白的外显子。在特定实施方式中,所述片段包含可编码产生修饰的eklf的外显子2的多个部分。
在某些实施方式中,本发明提供了产生转基因动物的方法,所述动物可表达出一修饰的eklf多肽,所述方法包含以下步骤:a)取得一载体,其包含可编码产生一修饰的eklf多肽或其部分的多核苷酸;b)将所述载体注射到非人类动物的胚胎干(es)细胞中;c)将包含所述载体的es细胞转移至囊胚胚胎;d)将所述囊胚胚胎转移至一代理孕母体内,使其孕育所述胚胎,因而得到一种源动物,其包含可编码产生此一修饰的eklf多肽的多核苷酸,以得到所述转基因动物。在某些实施方式中,所述转基因动物是一基因敲入动物,其中所述载体是一标的载体,其包含与所述动物的内源性dna同源的多核苷酸,这些多核苷酸位于所述可编码产生该修饰的eklf的多核苷酸的3’和5’端的两侧。在特定实施方式中,将包含与动物的内源性dna同源的多核苷酸的载体注射到至es细胞中,会透过同源重组作用使得多核苷酸插入至es细胞的基因体中。在特定实施方式中,所述同源dna是与eklf基因座同源的dna序列。在特定实施方式中,所述具标的dna载体更包含一选择匣(selectioncassette),用以在将载体注射至es细胞后,利用该选择匣来辨识含所述载体的es细胞。在特定实施方式中,所述选择匣是pgk-gb2-neo匣。在特定实施方式中,所述选择匣两侧为loxp部位,且所述产生转基因动物的方法,更包含以下步骤:e)使一成体种源动物与生殖细胞可表达cre的一转基因动物交配,以得到交配后的子代动物,所得到的子代动物能够表达出此一修饰的eklf多肽,且其基因体上没有该选择匣。
在特定实施方式中,本发明揭示产生可表达此一修饰的eklf多肽的基因敲入小鼠的方法,所述方法包含以下步骤:a)得到一载体,此载体包含可编码产生此一修饰的eklf多肽(或其部分)的一多核苷酸,且所述多核苷酸的于5’和3’端的两侧分别设有与内源性小鼠eklf基因同源的多核苷酸;b)将所述载体注射到非人类动物的小鼠es细胞中,其中藉由同源重组技术将所述可编码产生此一修饰的eklf的多核苷酸,插入es细胞基因体的eklf基因座上;c)将包含所述载体的es细胞转移到3.5天龄的小鼠囊胚胚胎中;以及d)将囊胚胚胎转移至代孕小鼠体内以完成妊娠周期,进而产生包含可编码产生此一修饰的eklf多肽或其部分的核苷酸的种源动物,进而产生基因敲入小鼠。在特定实施方式中,所述载体更包含一选择匣。在某些实施方式中,所述选择匣是一pgk-gb2-neo匣。在某些实施方式中,所述载体包含一选择匣,其两侧设有loxp部位,且所述方法更包含以下步骤:e)使一成体种源动物与生殖细胞可表达cre的转小鼠交配,以得到交配后的子代小鼠,进而得到基因体中不包含选择匣的eklf基因敲入小鼠。在某些实施方式中,所述载体包含的多核苷酸可编码产生一种在第74个氨基酸位置上的赖氨酸被精氨酸所取代(k74r)的eklf。
本揭示内容的种源动物可以彼此交配(bred)、近亲交配(inbred)、远亲交配(outbred)、跨品系交配(crossbred)以产生特定动物族群,包括但不限于,纯合子动物。所述育种策略包含,但不限于,将带有多个插入位的种源动物进行远亲交配,以建立个别的品系;将个别品系进行近亲交配,以产生转动物(如,基因敲入动物),在这些动物体内,由于每一转基因的加成表达(additiveexpression),其转基因的表达量较高;使杂合子转基因小鼠交配,以得到在指定插入位上为纯合子的小鼠,此技术不仅能够提升表达量,且可以免除利用dna分析法来筛选动物的必要;使个别的纯合子品系杂交,以产生复合型杂合子或纯合子品系;使动物交配以形成不同的近亲遗传背景,以便检视修饰等位基因对于转基因表达的影响以及对表达的影响。
在特定的实施方式中,本发明揭示一种转基因动物的细胞(如,衍生自或取自该动物),在所述细胞的一或二eklf基因座上,包含可编码产生一修饰的eklf多肽的dna。在某些实施方式中,所述细胞的一eklf基因座上包含可编码产生一修饰的eklf多肽的dna。在某些具体实施方式中,所述细胞在二eklf基因座皆包含可编码产生一修饰的eklf多肽的dna。在某些实施方式中,所述细胞是从转基因动物分离所得。在特定实施方式中,所述细胞可表达此一修饰的eklf多肽。在特定实施方式中,所述细胞不会表达此一修饰的eklf多肽。在特定实施方式中,所述细胞含一外胚层细胞系(ectodermallineage)。在某些实施方式中,所述细胞是选自于产毛细胞(trichocyte)、角质细胞(keratinocyte)、促性腺细胞(gonadotrope)、促肾上腺皮质素细胞(corticotrope)、促甲状腺素细胞(thyrotrope)、生长激素细胞(somatotrope)、激乳细胞(lactotroph)、神经元(neuron)、神经胶细胞(glia)、许旺氏细胞(schwanncell)、卫星胶细胞(satelliteglialcell)、嗜铬细胞(chromaffincell)、滤泡旁细胞(parafollicularcell)、球囊细胞(glomuscell)、黑色素细胞(melanocyte)、痣细胞(nevuscell)、莫克尔氏细胞(merkelcell)、生齿细胞(odontoblast)、垩质原细胞(cementoblast)、角膜基质细胞(cornealkeratocyte)、间胶细胞(oligodendrocyte)、星形细胞(astrocyte)、室管膜细胞(ependymocyte)和松果腺细胞(pinealocyte)。在特定实施方式中,所述细胞含一内胚层细胞系(endodermallineage)。在某些实施方式中,所述细胞是选自于第一型肺细胞(type1pneumocyte)、第二型肺细胞(type2pneumocyte)、棒细胞(clubcell)、杯状细胞(gobletcell)、胃主细胞(gastricchiefcell)、胃壁细胞(parietalcell)、小凹细胞(foveolarcell)、肠内分泌细胞(enteroendocrinecell)、g细胞、delta细胞、肠嗜铬细胞样细胞(enterochromaffin-likecell)、胃抑素s细胞(gastricinhibitorypolypeptidescell)、delta细胞、胆囊收缩素(cholecystokinin)、goblet细胞、帕内特细胞(panethcell)、肠细胞(enterocyte)、微皱细胞(microfoldcell)、肝细胞(hepatocyte)、肝星状细胞(hepaticstellatecell)、库弗式细胞(kupffercell)、胆囊细胞(cholecystocyte)、泡心细胞(centroacinarcell)、胰星状细胞(pancreaticstellatecell)、alpha细胞、beta细胞、delta细胞、f细胞、pp细胞、epsilon细胞、滤泡细胞(follicularcell)、副甲状腺主细胞(parathyroidchiefcell)、嗜酸性细胞(oxyphilcell)和泌尿上皮细胞(urothelialcell)。在某些实施方式,所述细胞含一中胚层细胞系(mesodermallineage)。在某些实施方式中、所述细胞是选自于一成骨细胞(osteoblast)、骨细胞(osteocyte)、软骨母细胞(chondroblast)、软骨细胞(chondrocyte)、脂母细胞(lipoblast)、脂肪细胞(adipocyte)、肌母细胞(myoblast)、肌细胞(myocyte)、肌星细胞(myosatellitecell)、腱细胞(tendoncell)、心肌细胞(cardiacmusclecell)、纤维母细胞(fibroblast)、纤维细胞(fibrocyte)、卡加尔氏间质细胞(interstitialcellofcajal)、血管母细胞(angioblast)、内皮细胞(endothelialcell)、肾间质细胞(mesangialcell)、肾小球内间质细胞(intraglomerularmesangialcell)、肾小球外间质细胞(extraglomerularmesangialcell)、肾小球旁细胞(juxtaglomerularcell)、致密斑细胞(maculadensacel)l、间质细胞(stromalcel)、间隙细胞(interstitialcell)、特洛细胞(telocytes)、单层上皮细胞(simpleepithelialcell)、足细胞(podocyte)、肾小管刷状缘细胞(kidneyproximaltubulebrushbordercell)、赛特利细胞(sertolicell)、雷氏细胞(leydigcell)、颗粒性细胞(granulosacell)、插入细胞(pegcell)、生殖细胞(germcell)、精子(spermatozoon)、卵子(ovum)、类淋巴细胞(lymphoid)、淋巴母细胞(lymphoblast)、淋巴细胞(lymphocyte)、骨髓细胞(myeloid)、内皮祖细胞(endothelialprogenitorcell)、内皮聚落形成细胞(endothelialcolonyformingcell)、内皮干细胞(endothelialstemcell)、血管母细胞(angioblast)、血管母细胞(mesoangioblast)、外膜细胞(pericyte)和壁细胞(muralcell)。在某些实施方式中,所述细胞是干细胞。在特定实施方式中,所述细胞是全能干细胞(totipotentstemcell)、多能干细胞(pluripotentstemcell)、专能干细胞(multipotentstemcell)、寡能干细胞(oliopotentstemcell)或单能干细胞(unipotentstemcell)。
在特定实施方式中,本发明揭示一种转基因动物的组织(如,衍生自或取自该动物),所述组织包含一修饰的eklf基因座,其可编码产生一修饰的eklf多肽。在某些实施方式中,所述组织是从转基因动物分离所得。在特定实施方式中,所述组织包含一个修饰的eklf基因座,其可编码产生一修饰的eklf多肽,且其中所述组织表达修饰的eklf多肽。在特定实施方式中,所述组织包含一个修饰的eklf基因座,其可编码产生一修饰的多肽,但此组织不表达修饰的eklf多肽。在某些实施方式中,所述组织是结缔组织(connectivetissue)、神经组织(nervoustissue)、上皮组织(epithelialtissue)或肌肉组织(muscletissue)。
在特定的实施方式中,本发明揭示一种转基因动物的器官(如,衍生自或取自该动物),所述转基因动物包含一修饰的eklf基因座,其可编码产生一修饰的eklf多肽。在某些实施方式中,所述器官是从转基因动物分离所得。在特定实施方式中,所述器官包含一修饰的eklf基因座,其可编码产生一修饰的eklf多肽,且所述器官表达修饰的eklf多肽。在特定实施方式中,所述组织包含一修饰的eklf基因座,其可编码产生一修饰的eklf多肽,但所述器官不表达修饰的eklf多肽。在某些实施方式中,所述器官是来自以下系统的器官:皮肤系统、骨骼系统、肌肉系统、淋巴系统、呼吸系统、消化系统、神经系统、内分泌系统、心血管系统、泌尿系统或生殖系统。在某些实施方式中,所述器官是皮肤、毛发、趾甲、骨头、关节、骨骼肌、红骨髓、胸腺、淋巴管、胸导管、脾、淋巴结、鼻腔、咽、喉、气管、支气管、肺、口腔、食道、肝、胃、小肠、大肠、直肠、肛门、脑、脊髓、神经、松果体、脑垂体、甲状腺、胸腺、肾上腺、胰脏、卵巢、睾丸、心脏、血管、肾脏、输尿管、膀胱、尿道、前列腺腺、阴茎、睾丸、阴囊、输精管、乳腺、卵巢、子宫、阴道或输卵管。
“分离的(isolate)”是指从动物移出的细胞、组织或器官。在某些实施方式中,所述细胞、组织、器官为活体,举例来说,此类细胞、组织、器官适用于培养。在某些实施方式中,所述细胞、组织或器官非为活体(如,经过固定),此类细胞、组织或器官适用于分析。
在特定的实施方式中,本发明揭示一种构筑体,其能用以产生能表达修饰的eklf多肽的转基因动物(如,基因敲入标的载体)。在特定实施方式中,所述构筑体包含一核酸(如,dna或cdna),其含有修饰的序列而可编码产生一修饰的eklf基因的至少一部分转录区域。在某些实施方式中,所述构筑体包含一核酸序列,其含有一或多个修饰的eklf外显子。在特定实施方式中,所述构筑体包含一选择标记,如pgk-gb2-neo模版,其可编码产生一抗新霉素/卡那霉素(neomycin/kanamycin)基因。在某些实施方式中,所述构筑体包含选择标记,其两侧设有loxp。在特定实施方式中,本发明揭示用以产生基因敲入小鼠的构筑体,,其包含一标的载体,所述标的载体包含修饰的小鼠eklf外显子2(或其部分)和选择标记(如,pgk-gb2-neo筛选匣),所述选择标记设于二个loxp部位之间。在一实施方式中,基因敲入标的构筑体包含:(i)第一eklf基因序列的至少一部份;以及(ii)含有一修饰的第二eklf基因序列的至少一部份。在一实施方式中,基因敲入标的构筑体包含:(i)第一eklf基因序列的至少一部份;(ii)polya序列;(iii)选择标记(如,抗新霉素)基因序列;(iv)一启动子序列,如,第一型磷甘油酸激酶(phosphoglyceratekinase1,pkg);以及(v)含有一修饰的第二eklf基因序列的至少一部分。在一实施方式中,一含基因敲入标的的构筑体包含:(i)第一eklf基因序列的至少一部份;(ii)loxp部位;(iii)polya序列;(iv)选择标记(如,抗新霉素)基因序列;(v)启动子(如,pgk)序列;(vi)loxp部位;以及(vii)含有一修饰的第二eklf基因序列的至少一部份。在不同的实施方式中,第一eklf基因序列包含eklf外显子1与内含子1的至少一部分,且第二eklf基因序列包含eklf外显子2、内含子2与外显子3的至少一部份,其中外显子2包含一修饰,所述修饰包含一修饰的的密码子,其可编码产生一不存在于内源性eklf蛋白的一氨基酸残基,如,在eklf蛋白中类小泛素化位置或磷酸化位置上的一修饰。在特定实施方式中,第一eklf序列的所述部分以及第二eklf序列的所述部分两者需有足够的长度,以使其能够和内源性eklf基因座进行同源重组;举例而言,所述长度为至少20个核苷酸、至少50个核苷酸或至少100个核苷酸。在特定实施方式中,所述eklf蛋白是小鼠eklf蛋白,且在特定实施方式,所述修饰的密码子可编码产生位于第74个氨基酸位置上的修饰氨基酸。在一特定实施方式中,所述eklf蛋白是人类eklf蛋白,且在特定实施方式中,所述修饰的密码子可编码产生位于第54个氨基酸位置上的修饰氨基酸。在特定实施方式中,所述修饰的小鼠外显子2可编码产生一小鼠eklf多肽的一个区域,此区域包含一修饰的氨基酸,所述修饰可以防止eklf多肽发生类小泛素化或磷酸化。在特定实施方式中,修饰的小鼠外显子2可编码产生一一小鼠eklf多肽区域,其包含在第74个氨基酸位置上的氨基酸置换,将此位置的赖氨酸取代成譬如,精氨酸。在特定实施方式中,所述修饰可以是本揭示内容任一实施方式所示的修饰。
在特定实施方式中,转基因动物表达一修饰的eklf多肽,其中所述修饰的eklf多肽是对与此动物同一物种的动物的野生型eklf进行修饰后所得。在特定实施方式中,转基因动物可表达一修饰的eklf多肽,其中所述修饰的eklf多肽系对与此动物不同物种的动物的野生型eklf进行修饰后所得。在某些实施方式中,此修饰的eklf多肽是对小鼠eklf多肽(登录号:np_034765.2;seqidno:1)进行修饰后所得。在某些实施方式中,此修饰的eklf多肽是对鼠eklf多肽(登录号:np_001100634.1;seqidno:2)进行修饰后所得。在某些实施方式中,此修饰的eklf多肽是对人类eklf多肽(登录号:np_006554.1;seqidno:3)进行修饰后所得。在某些实施方式中,此修饰的eklf多肽是对黑猩猩eklf多肽(登录号:xp_524128;seqidno:4)进行修饰后所得。在某些实施方式中,此修饰的eklf多肽是对恒河猴eklf多肽(登录号:np_001181384xp_001109612;seqidno:5)进行修饰后所得。在某些实施方式中,此修饰的eklf多肽是对狗eklf多肽(登录号:xp_542040;seqidno:6)进行修饰后所得。在某些实施方式中,此修饰的eklf多肽是对牛eklf多肽(登录号:np_001073828xp_001251865;seqidno:7)进行修饰后所得。在特定实施方式中,包含在此处所述载体中的修饰的eklf基因座或其部分,是对人类eklf基因序列(登录号:ensmusg00000105610;seqidno:9)进行修饰后所得,或是对小鼠eklf基因序列(登录号:ensmusg00000054191;seqidno:10)或相关基因进行修饰后所得。此处提出的载体可带有上述序列的一部分。
在某些实施方式中,非人类转基因动物可表达此一修饰的eklf多肽,相较于野生型eklf,所述修饰的eklf多肽包含至少一修饰的氨基酸。在一特定实施方式中,相较于野生型eklf多肽,转基因动物表达的多肽系包含一或多个修饰的氨基酸。在某些实施方式中,相较于野生型eklf多肽,修饰的eklf多肽包含一、二、三、四、五、六、七、八、九、十、十一、十二、十三、十四、十五、十六、十七、十八、十九、二十、大于二十、大于二十五、大于三十、大于三十五、大于四十、大于四十五、大于五十个修饰的氨基酸。在某些实施方式中,所述修饰的氨基酸可以是透过取代、增加、删除特定氨基酸或上述组合,来达成修饰。
在某些实施方式中,非人类转基因动物表达出一修饰的eklf多肽,此序列和野生型eklf的序列相似度小于100%。在特定实施方式中,转基因动物所表达的多肽和内源性野生型eklf的序列相似度大于80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%,但小于100%。
由特定实施方式可知,eklf多肽的功能是由其和不同辅助因子间的互动,以及转译后修饰等因素进行严密的调控。eklf与多种转录活化因子相关,例如p300、cbp以及具有内在组蛋白乙酰转移酶(intrinsichistoneacetyltransferase,hat)活性的p/caf,且eklf本身也会被p300和cbp在两个位置上进行乙酰化,而活化其转录作用。eklf的稳定性受到其泛素化状态所调控(quadrini,k.j.,andj.j.bieker.2006.febslett.580:2285-2293)。将第41个位置上的苏氨酸(threonine)磷酸化对于将转录活性优化具有关键性影响(ouyang,l.,x.chen,andj.j.bieker.1998.j.biol.chem.273:23019-23025.)。再者,将第74个位置上的赖氨酸类小泛素化则可调控eklf的转录抑制子活性(siateckaetal.2007molcellbiol.:27(24):8547–8560),以及调控eklf进入细胞核的运送(shyuetal.2014.developmentalcell28,409–422)。
在特定实施方式中,所述转基因动物可表达出此一修饰的eklf多肽;相较于野生型eklf多肽,所述修饰的eklf多肽的转译后修饰会受到改变,譬如,丧失转译后修饰。在特定实施方式中,转基因动物所表达的修饰的eklf多肽包含至少一修饰的氨基酸,其是对该至少一氨基酸进行置换,以防止eklf多肽在转译后修饰位置上发生转译后修饰。在某些实施方式中,转译后修饰是指蛋白质合成过程之中或之后,对多肽的修饰作用。转译后修饰包含,但不限于,磷酸化、乙酰化、甲基化、糖基化、脂化、豆蔻酰化(myristoylation)、棕榈酰化(palmitoylation)、法尼基化(farnesylation)、香叶基香叶基化(geranylgeranylation)、甲酰化(formylation)、酰胺化(amidation)、糖基磷脂酰肌醇化(glypiation)、脂酰化(lipoylation)、酰化(acylation)、丁酰化(butyrylation)、丙二酰化(malonylation)、羟化(hydroxylation)、亚硝酰化(s-nitrosylation)、琥珀酰化(succinylation)、类小泛素化、泛素化(ubiquitination)和nedd化(neddylation)。在特定实施方式中,所述转基因动物所表达的修饰的eklf多肽,其能够防止或抑制磷酸化。在特定实施方式中,所述转基因动物所表达的修饰的eklf多肽包含一修饰的氨基酸,其能够防止或抑制类小泛素化。在特定实施方式中,所述转基因动物是eklf基因敲入小鼠,其所表达的修饰的eklf多肽的转译后修饰作用与野生型eklf多肽不同。
“磷酸化”一词是指将一个磷酸基(phosphate(po43-)group)添加到多肽上的一个氨基酸残基的作用。可逆式的蛋白质磷酸化是最重要也最为本领域熟知的一种转译后修饰,通常作用于丝氨酸,苏氨酸或酪氨酸残基上。磷酸化对多种细胞程序的调控非常重要,譬如,细胞周期、生长、凋亡及讯息传导途径。在特定实施方式中,转基因动物所表达的修饰的eklf多肽包含一修饰的氨基酸,其能够防止修饰的eklf多肽的磷酸化。在某些实施方式中,此修饰的eklf多肽所包含的修饰的氨基酸能够防止对所述修饰的氨基酸残基的磷酸化。
“类小泛素化”是指多肽与类小泛素修饰(smallubiquitin-relatedmodifier,简称sumo)蛋白间的共价键结。sumo蛋白是由多种小蛋白组成的家族,这些小蛋白可以共价键结至细胞内其他蛋白且可与其分离,以改变所述其他蛋白的功能。类小泛素化是一种转译后修饰,其和多种细胞机制有关,例如,核-质运输(nuclear-cytosolictransport)、转录调控(transcriptionalregulation)、凋亡、蛋白稳定性、压力反应以及细胞周期的进程。在一些特定实施方式中,转基因动物所表达的修饰的eklf多肽包含一修饰的氨基酸,其能够防止修饰的eklf上发生类小泛素化作用。在某些实施方式中,修饰的eklf多肽所含的修饰的氨基酸可防止在被修饰的氨基酸残基上发生类小泛素化。
由特定实施方式可以得知eklf多肽的会透过在单一位置上的类小泛素化来进行转译后修饰,且e3连接酶pias1在此过程中扮演重要的角色。由特定实施方式可以得知,eklf多肽被类小泛素化的位置在小鼠eklf多肽是第74个位置上的赖氨酸,而在人类eklf多肽则是第54个位置上的赖氨酸,或是在一对应的类小泛素化位置。由特定实施方式可以得知人类eklf多肽第54个位置的赖氨酸经类小泛素化。在特定实施方式中,对应于小鼠eklf多肽第74个位置的赖氨酸的类小泛素化位置是人类eklf多肽上第54个位置的赖氨酸。由某些实施方式可以得知,对小鼠eklf多肽第74个位置上的赖氨酸、对人类eklf多肽第54个位置上的赖氨酸或对一相应的类小泛素化部位进行修饰,可以防止eklf多肽的类小泛素化。在特定实施方式中,所述转基因动物所表达的修饰的eklf多肽包含对第74个位置上的赖氨酸或一相应的类小泛素化部位进行修饰,以防止修饰的eklf多肽的类小泛素化。在特定实施方式,所述修饰是置换。在特定实施方式中,所述修饰是在小鼠eklf多肽第74个氨基酸位置,以精氨酸置换赖氨酸。
由特定实施方式可以得知由pkc所进行的磷酸化会发生在小鼠第68个氨基酸位置的丝氨酸或相对应的磷酸化位置,所述磷酸化会启动eklf多肽的类小泛素化。由特定实施方式可以得知,能够防止eklf在第68个位置上丝氨酸的磷酸化的修饰可以防止或降低eklf多肽上第74个位置上赖氨酸的发生类小泛素化的可能。在特定实施方式中,转基因动物所表达的修饰的eklf多肽包含一修饰的氨基酸,其能够防止第68个位置上丝氨酸的磷酸化,以及减低或防止修饰的eklf多肽的类小泛素化。在特定实施方式中,所述转基因动物表达的修饰的eklf多肽包含对第68个位置的修饰的氨基酸,其能够防止第68个位置上发生磷酸化,以及减少或防止修饰的eklf多肽的类小泛素化。在特定实施方式中,所述修饰是一置换。在特定实施方式中,所述修饰是在第68个氨基酸位置上,以丙氨酸取代丝氨酸。
在一实施方式中,所述人类eklf多肽包含一或多个磷酸化位置。在特定实施方式中,人类eklf多肽上的一个磷酸化位置被磷酸化时,会促发人类eklf多肽的类小泛素化。由特定实施方式可以得知,可以防止人类eklf多肽磷酸化的修饰的氨基酸能够防止降低eklf在第54个位置的赖氨酸发生类小泛素化的可能性。在特定实施方式中,修饰的人类eklf的磷酸化位置上包含一修饰的氨基酸,其能够防止磷酸化,以及减低或防止修饰的人类eklf多肽的类小泛素化。
在某些实施方式中,所述非人类转基因动物所表达的修饰的eklf多肽包含至少一修饰的氨基酸,其中所述至少一修饰的氨基酸能防止或减少eklf多肽的类小泛素化。在某些实施方式中,非人类转基因动物所表达的修饰的eklf多肽包含至少一修饰的氨基酸,其中所述至少一修饰的氨基酸能防止eklf多肽的类小泛素化。在某些实施方式中,相较于野生型eklf多肽,所述至少一修饰的氨基酸能减少修饰的eklf多肽被类小泛素化的量。在某些实施方式中,相较于野生型eklf多肽,所述至少一修饰的氨基酸使得修饰的eklf多肽被类小泛素化的量减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。在某些实施方式中,至少一修饰的氨基酸可降低修饰的eklf多肽被类小泛素化的机率。在某些实施方式中,相较于野生型eklf多肽,所述至少一修饰的氨基酸使得修饰的eklf多肽被类小泛素化的机率减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。
在某些实施方式中,所述非人类转基因动物所表达的修饰的eklf多肽包含至少一修饰的氨基酸,其中所述至少一修饰的氨基酸能防止或减少eklf多肽的磷酸化。在某些实施方式中,所述非人类转基因动物所表达的修饰的eklf多肽包含至少一修饰的氨基酸,其中所述至少一修饰的氨基酸能防止eklf多肽的磷酸化。在某些实施方式中,相较于野生型eklf多肽,所述至少一修饰的氨基酸可降低修饰的eklf多肽被磷酸化的量。在某些实施方式中,相较于野生型eklf多肽,所述至少一修饰的氨基酸使得修饰的eklf多肽的磷酸化量减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。在某些实施方式中,相较于野生型eklf多肽,所述至少一修饰的氨基酸能减少修饰的eklf多肽被类小泛素化的量。在某些实施方式中,相较于野生型eklf多肽,所述至少一修饰的氨基酸使得修饰的eklf多肽被类小泛素化的量减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。在某些实施方式中,至少一修饰的氨基酸可降低修饰的eklf多肽将被类小泛素化的机率。在某些实施方式中,相较于野生型eklf多肽,所述至少一修饰的氨基酸使得修饰的eklf多肽被类小泛素化的机率减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。
在某些实施方式中,非人类转基因动物所表达的修饰的eklf多肽包含一修饰的氨基酸,其中所述修饰的氨基酸能防止修饰的eklf多肽的丝氨酸68或相应的磷酸化位置被磷酸化。在某些实施方式中,所述非人类转基因动物所表达的修饰的eklf多肽包含对一丝氨酸68或相应的磷酸化位置进行修饰,其中所述修饰可防止eklf多肽的类小泛素化。在特定实施方式,所述修饰是在第68个氨基酸位置或相应的磷酸化位置,以丙氨酸取代丝氨酸。在某些实施方式中,能够防止丝氨酸68或相应的磷酸化位置被磷酸化的修饰可以减少修饰的eklf多肽上类小泛素化的量。在某些实施方式中,相较于野生型eklf多肽,能防止丝氨酸68或相应磷酸化位置被磷酸化的至少一修饰的氨基酸可使得修饰的eklf多肽被类小泛素化的量减少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。在某些实施方式中,能防止第68个氨基酸位置或者相应或不同磷酸化位置被磷酸化的上述修饰可以使得修饰的eklf多肽被类小泛素化的机率减少约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。
由某些具体实施方式可知,相较于野生型eklf多肽,由转基因动物所表达的修饰的eklf多肽,随着表达此修饰的eklf多肽的细胞类型或组织类型的不同,其特性或活性可能会改变,例如,细胞内的位置(subcellularlocalization,又称亚细胞定位)或转录活化子活性。因此,在所述转基因动物的一种特定细胞类型或组织类型中,修饰的eklf多肽的特性可能类似或不同于在均等的细胞或组织中表达的野生型eklf多肽的特性。因而,于某些实施方式中,转基因动物包含一细胞类型或组织类型,而修饰的eklf多肽在该处的特性或活性和野生型eklf多肽不同,且该动物也包含一细胞类型或组织类型,而修饰的eklf多肽在该处的上述特性或活性和野生型eklf多肽类似。在特定实施方式中,在转基因动物体内会表达eklf的所有细胞和组织类型中,修饰的eklf多肽的特性或活性和野生型eklf多肽不同。
由某些实施方式可知,相较于内源性eklf多肽(即,野生型eklf多肽),eklf多肽经修饰后并不会改变其表达。由某些实施方式可知,在转基因动物的指定细胞或组织中,编码产生一修饰的eklf多肽的mrna量与一控制组动物(同窝出生、同性别)在相当的细胞或组织中,编码产生一野生型eklf多肽的mrna量相当。由特定实施方式可知,在转基因动物的特定细胞或组织中,编码产生一修饰的eklf多肽的mrna量与相同物种的非转基因动物中相当的细胞或组织类型中编码产生一野生型eklf多肽的mrna量相当。
在某些实施方式中,转基因动物表达一修饰的eklf多肽,相较于内源性、野生型eklf多肽,所述修饰作用改变了此一修饰的eklf多肽的稳定性。在某些实施方式中,对eklf多肽进行修饰使得修饰的eklf的半衰期(half-life)较内源性、野生型eklf多肽增加约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、200%;或增加约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或大于100倍以上(包含其间的所有正整数和数值范围)。在某些实施方式中,对eklf多肽进行修饰使得此一修饰的eklf的半衰期比野生型eklf多肽减少约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。
在某些实施方式中,所述转基因动物可表达一修饰的eklf多肽,其中修饰作用使得此一修饰的eklf多肽在细胞内的位置和内源性、野生型eklf多肽不同。在某些实施方式中,对eklf多肽进行修饰使得该修饰的eklf多肽的细胞质定位(cytosoliclocalization)比野生型eklf多肽增加约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、200%或约2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100倍或大于100倍(包含其间的所有正整数和数值范围)。在某些实施方式中,对eklf多肽进行修饰使得此一修饰的eklf的细胞核定位(nuclearlocalization)比野生型eklf多肽减少约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。在特定实施方式中,在红血球系的祖细胞(progenitor)和前驱(precursor)细胞中,此一修饰的eklf多肽的细胞内位置会改变。在某些实施方式中,在细胞从原-红母细胞(pro-erythroblast,pro-e)转变成嗜碱性红母细胞(basophilicerythroblast,baso-e)的过程中,当细胞经历红血球系细胞成熟(erythroidmaturation)时,亚细胞定位会改变。在特定实施方式中,在dmso-诱导鼠红血球性白血病(murineerythroleukemia,mel)细胞分化的过程之中或之后,亚细胞定位会改变。
在某些实施方式中,所述转基因动物可表达一修饰的eklf多肽,其中该修饰的eklf多肽的转录活化活性(即,提升一或多目标基因的转录作用)比内源性、野生型eklf多肽高。在某些实施方式中,比起至少一基因受到野生型eklf的提升作用,所述修饰的eklf多肽使得该基因的转录增加约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、200%,或约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或大于100倍(包含其间的所有正整数和数值范围)。在某些实施方式中,所述修饰的eklf多肽能促进一、二、三、四、五、六、七、八、九、十、大于十、大于十五、大于二十、大于二十五、大于三十、大于四十、大于五十、大于六十、大于七十、大于八十、大于九十、大于一百、大于二百、大于三百、大于四百、大于五百或大于一千个基因的转录,而这些基因无法藉由野生型eklf多肽来促进其转录。
在某些实施方式中,所述转基因动物可表达此一修饰的eklf多肽,其中该修饰的eklf多肽的转录抑制活性(即,抑制一或多目标基因的转录作用)比野生型、内源性eklf多肽高。在某些实施方式中,比起至少一基因转录活性因野生型eklf而提升,此一修饰的eklf多肽却可抑制该基因的转录约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、200%或约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍或大于100倍(包含其间的所有正整数和数值范围)。某些实施方式中,所述修饰的eklf多肽可抑制一、二、三、四、五、六、七、八、九、十、大于十、大于十五、大于二十、大于二十五、大于三十、大于四十、大于五十、大于六十、大于七十、大于八十、大于九十、大于一百、大于二百、大于三百、大于四百、大于五百或大于一千个基因的转录,而这些基因无法藉由野生型eklf多肽来抑制其转录。
在某些实施方式中,所述转基因动物可表达一修饰的eklf多肽。其中该修饰的eklf多肽的转录活化活性(即,提升一或多目标基因的转录作用)比野生型、内源性eklf多肽来得低。在某些实施方式中,比起至少一基因转录活性因野生型eklf而提升,修饰的eklf多肽使得该至少一基因的转录降低约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%(包含其间的所有正整数和数值范围)。在某些实施方式中,转录活性会受到此修饰的eklf多肽而提升的基因数目,比起转录活性受到野生型eklf多肽提升者少了一、二、三、四、五、六、七、八、九、十、大于十、大于十五、大于二十、大于二十五、大于三十、大于四十、大于五十、大于六十、大于七十、大于八十、大于九十、大于一百、大于二百、大于三百、大于四百、大于五百或大于一千个基因转录。
在某些实施方式中,所述转基因动物可表达一修饰的eklf多肽,其中所述修饰的eklf多肽的转录抑制活性(即,抑制一或多目标基因的转录作用)比野生型eklf多肽来得低。在某些实施方式中,比起至少一基因的转录抑制活性受到野生型eklf的抑制,此修饰的eklf多肽使得该基因的转录抑制活性降低约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%(包含其间的所有正整数和数值范围)。某些实施方式中,转录抑制活性会受到修饰的eklf多肽抑制的基因数目,比起转录抑制活性受到野生型eklf多肽抑制者少了一、二、三、四、五、六、七、八、九、十、大于十、大于十五、大于二十、大于二十五、大于三十、大于四十、大于五十、大于六十、大于七十、大于八十、大于九十、大于一百、大于二百、大于三百、大于四百、大于五百或大于一千个基因转录。
在某些实施方式中,本发明揭示一种可以表达修饰的eklf多肽的转基因动物,相较于表达野生型eklf多肽的控制组动物而言,本发明转基因动物的寿命与健康年限较长和/或有抗癌特性。在特定实施方式中,本发明提供一种模型动物,其中藉由表达一修饰的eklf多肽来达到延长寿命与健康年限和/或提升癌症抗性,此一机制异于既有长寿与抗癌动物模型。此一模型动物的开发是基于发现到表达此一修饰的eklf的动物模型的表达型和以往所述的长寿模型动物的表达型不同;所述既有的长寿模型例如卡路里受限的动物、施用二甲双胍的动物、igf1受体剔除动物、转基因pten动物、杂合子myc基因剔除动物、施用雷帕霉素的动物、s6k1基因剔除动物、fat10基因剔除动物、sirt1突变动物和转基因cisd2动物。由特定实施方式可以看出,修饰的eklf多肽的表达能延长寿命以及健康年限而不会改变一或多个以下特性:代谢(metabolism)、生育力(fertility)、自噬衡平(autophagyhomeostasis)、基因稳定性(genomicstability)或粒线体功能(mitochondrialfunction)。
在某些实施方式中,相较于表达野生型eklf多肽的控制组动物而言,表达修饰的eklf多肽的转基因动物的寿命较长。在特定实施方式中,寿命延长是指转基因动物的平均寿命比控制组动物的平均寿命长。在特定实施方式中,寿命延长是指相较于控制组动物,转基因动物可存活的最高年龄更长。在某些实施方式中,寿命延长是指最高寿命增加,所述最高寿命是指寿命最长的前10%的族群的平均寿命。在特定实施方式中,表达修饰的eklf多肽的转基因动物比表达野生型eklf多肽的控制组动物的寿命增加约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、35%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%(包含其间的所有正整数和数值范围)。
在某些实施方式中,表达修饰的eklf多肽的转基因动物比表达野生型eklf多肽的控制组动物有较长的健康年限。所述健康年限是指生物体的处于理想健康状况的时间长度,如未罹患年龄相关疾病。在特定实施方式中,相较于表达野生型eklf多肽的控制组动物,表达修饰的eklf多肽的转基因动物的健康年限增加为约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、35%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%(包含其间的所有正整数和数值范围)或大于100%。可针对和提升健康相关的一或多个物理特征,来测量健康年限的增加,包含但不限于本说明书所述的方法。
在特定实施方式中,在表达修饰的eklf多肽的转基因动物体内,发生老化相关症状的时间较晚和/或发展进程较慢。在特定实施方式中,相较于年龄相当的控制组动物,老化转基因动物在至少一种与老化相关症状的程度较轻微,所述症状如:头发花白、肌肉无力(muscleweakness)、运动协调性(motorcoordination)、骨质疏松(osteoporosis)、平衡力丧失(lossofbalance)、癌症发生(cancerincidence)、化学压力的易感性(susceptibilitytochemicalstress)、感染的易感性(susceptibilitytoinfection)或发炎的易感性(susceptibilitytoinflammation)。在特定实施方式中,与年龄相当的控制组动物相比,表达修饰的eklf多肽的转基因动物较晚历经老化相关征状的发生。在特定实施方式中,与年龄相当的控制组动物相比,表达修饰的eklf多肽的转基因动物与老化相关征状的进程较为缓慢。
在特定实施方式中,表达修饰的eklf多肽的转基因动物在譬如肌力和运动协调等方面的老化相关改变的发生时间较晚和/或发展进程较慢。由特定实施方式可知,正常老化过程会伴随着渐进式的肌肉无力和丧失运动协调性。在特定实施方式中,表达修饰的eklf多肽的年轻的转基因动物与表达野生型eklf多肽的年轻控制组动物相比,二者皆展现相似的肌力和运动协调性;而表达修饰的eklf多肽的老化的转基因动物与表达野生型eklf多肽的年轻控制组动物相比,表达修饰的eklf多肽的老化的转基因动物展现较佳的肌力和运动协调性。在特定实施方式中,表达修饰的eklf多肽的转基因动物在有生之年随着年岁渐增,仍能保有约50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、大于80%、大于85%、大于90%、大于95%、大于99%的肌力及运动协调性。所属技术领域中具有通常知识者已知,适用于测量评估肌力和运动协调性的方法,包含但不限于旋转试验和握力试验。
在特定实施方式中,与年龄相当的控制组动物相比,表达修饰的eklf的老化转基因动物的肌力提升了约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、200%或约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍(包含所有的数值范围及其之间的正整数)或大于100倍。在特定实施方式中,与年龄相当的控制组动物相比,表达修饰的eklf的老化转基因动物的运动协调性提升了约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、200%或约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍(包含所有的数值范围及其之间的正整数)或大于10倍。
由特定实施方式可知,骨质疏松可能发展成一般老化的征状,且正常老化会伴随骨体积和索前软骨的数量减少以及索前软骨间隙变大。在特定实施方式中,表达修饰的eklf的转基因动物终其一生不会出现骨质疏松的现象。在某些实施方式中,表达出修饰的eklf的转基因动物在其有生之年不会发生骨体积和/或索前软骨数量减少的状况。在某些实施方式中,表达修饰的eklf的转基因动物一生中,索前软骨间隙都不会变大。在特定实施方式中,与年龄相当的表达野生型eklf的控制组动物相比,在表达修饰的eklf的转基因动物的一生中,骨质疏松的发生较为缓慢。在某些实施方式中,相较于年龄相当的控制组动物,表达修饰的eklf的转基因动物一生中,骨体积和/或索前软骨数量的减少过程较为缓慢。在某些实施方式中,表达修饰的eklf的转基因动物在其一生中,索前软骨的间隙变大的过程较为缓慢。
在特定实施方式中,与年龄相当的控制组动物相比,表达修饰的eklf的老化转基因动物的骨体积增加约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、200%或约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍(包含所有的数值范围及其之间的正整数)或大于10倍。在特定实施方式中,与年龄相当的控制组动物相比,表达修饰的eklf的老化转基因动物的索前软骨数量增加约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、200%或约2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍(包含所有的数值范围及其之间的正整数)或大于10倍。在特定实施方式中,与年龄相当的控制组动物相比,表达修饰的eklf的老化转基因动物的索前软骨的间隙减小约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%(包含所有的数值范围及其之间的正整数)。
在特定实施方式中,与表达野生型eklf控制组动物相比,表达修饰的eklf多肽的转基因动物发展出细胞增殖性疾病(即,癌症)的机率较低。在某些实施方式中,与控制组动物相比,表达修饰的eklf多肽的转基因动物在一生中得到癌症的机率降低了约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或约100%(包含所有的数值范围及其之间的正整数)。在特定实施方式中,相较于控制组动物,转基因动物较不易发展出细胞增殖性疾病,所述细胞增殖性疾病是选自肝癌、大肠癌、乳癌、前列腺癌、肝细胞癌、黑色素瘤、肺癌、神经胶母细胞瘤、脑肿瘤、造血系统恶性肿瘤、视网膜母细胞瘤、肾细胞癌、头颈癌、子宫颈癌、胰脏癌、食道癌或鳞状细胞癌。在某些实施方式中,相较于控制组动物,表达经修饰eklf的转基因动物终其一生发展黑色素瘤的机率较低。
由特定实施方式可知,在转基因动物体内表达修饰的eklf多肽可抑制肿瘤或癌症的生长,或抑制肿瘤、癌细胞或癌前期细胞(precancerouscell)转移的能力。由某些实施方式可知,在转基因动物体内表达修饰的eklf多肽可抑制肿瘤、癌细胞或癌前期细胞转移的能力,但不会改变肿瘤生长的速率。在由特定实施方式得知,相较于经静脉注射癌前期细胞或癌细胞(如,b16f10黑色素瘤细胞)的控制组动物而言,对表达修饰的eklf多肽的转基因动物静脉注射癌前期细胞或癌细胞,会显著减少所述转基因动物体内癌细胞转移与肿瘤形成。在特定实施方式中,相较于控制组动物中的癌细胞或癌前期细胞,表达修饰的eklf多肽的转基因动物体内的癌细胞或癌前期细胞形成肿瘤的可能性也随之降低。在特定实施方式中,相较于控制组动物中的癌细胞或癌前期细胞,表达修饰的eklf多肽的转基因动物体内的癌细胞或癌前期细胞转移转移率也降低。在某些实施方式中,所述癌细胞或癌前期细胞并不包含对eklf基因座进行修饰且不会表达此一修饰的eklf。
在某些实施方式中,与控制组动物中相对应的细胞相比,表达修饰的eklf多肽的转基因动物中的癌前期细胞或癌细胞的生长或转移减少了约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或约100%(包含所有的数值范围及其之间的正整数)。在某些实施方式中,癌前期细胞或癌细胞是以静脉注射方式注射到转基因动物体内。在某些实施方式中,所述细胞是b16f10黑色素瘤细胞。
在某些实施方式中,与控制组动物相对应的细胞相比,表达修饰的eklf多肽的转基因动物的癌前期细胞或癌细胞形成肿瘤的数量降低约5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或约100%(包含所有的数值范围及其之间的正整数)。在某些实施方式中,癌前期细胞或癌细胞是以静脉注射方式注射至转基因动物体内。在某些实施方式中,所述细胞是b16f10黑色素瘤细胞。
本揭示特定的实施方式是关于表达修饰的eklf多肽的eklf基因敲入小鼠,其中修饰的eklf多肽包含至少一修饰的氨基酸,其可防止修饰的eklf多肽的类小泛素化,且其中eklf基因敲入小鼠能延长寿命、健康年限,和/或癌抗性以及癌症转移。特定实施方式是关于表达修饰的eklf多肽的eklf基因敲入小鼠,其中修饰的eklf多肽包含在其第74个氨基酸位置上以精氨酸置换赖氨酸,其中eklf基因敲入小鼠的寿命较长、健康年限较长和/或对肿瘤发生与癌症转移有抗性。
鉴别能延长寿命和/或减少肿瘤形成或肿瘤转移的药剂的方法
本发明包含鉴别活性药剂的方法,所述药剂能延长个体的寿命或健康年限、降低肿瘤形成和/或降低肿瘤转移,其中所述个体可以是哺乳动物(如,人类)。本发明的方法是基于意外地发现eklf修饰在哺乳动物中体内有上述效果。在此所述“肿瘤形成”是指肿瘤的起始或发生,即,肿瘤的出现(occurrenceofatumor)。在此所述的组合物和方法亦可用以达成或在较长时期内维持与保持年轻或延长寿命相关的特定表现型或特征,上述特征涵盖在此所述或呈现的任何特征,如,经处理的个体相较于未经处理的同年龄个体能表现以下任一表现型或特征:头发花白减少、运动协调提升、肌力提升、肌肉无力减轻、运动协调提升、骨质疏松症状减少、骨体积增加、骨密度提升、索前软骨的数量增加、索前软骨的间隙缩减、平衡力的丧失减低。再者,以下所述的方法能用以鉴别活性药剂,其能够使处理后的个体展现上述的表现型或特征。
在一特定实施方式中,本发明提供一种鉴别活性药剂的方法,所述活性药剂能延长个体寿命或健康年限,和/或抑制肿瘤形成或肿瘤转移。所述方法包含鉴别足以改变eklf多肽(如,人类eklf蛋白)之一或多个转译后修饰的药剂。在一特定实施方式中,所述的转译后修饰是类小泛素化或磷酸化。可逆的转译后修饰(包含类小泛素化以及磷酸化)对于特定蛋白质(含eklf)的核移入(nucleicimport)扮演着重要的角色。已知鼠eklf类小泛素化是位于第75个位置的赖氨酸(lys74),此位置位于共通且带负电的氨基酸-依赖类小泛素化模体(consensusnegativelychargedaminoacid-dependentsumoylationmotif)内。人类eklf中相应的类小泛素化位置是位于第54个位置的赖氨酸(lys54)。不限于特定的理论,此处认为类小泛素化有可能或无法减少eklf的核移位作用。此外,此处认为类小泛素化可改变eklf于一或多个eklf标的基因的转录活性(如,活化子或抑制子活性)。
类小泛素修饰物(smallubiquitin-relatedmodifier,简称sumo)是哺乳动物蛋白的修饰物(sarge,k.andparke-sarge,o-k.,methodsinmol.biol.2009;590:265-277(2010))。根据该文内容,蛋白质类小泛素化不会促使蛋白质降解,却反而会调控标的蛋白的功能特性,如,亚细胞定位,蛋白合作关系(proteinpartnering)和转录因子转活化等。sumo蛋白会共价结合至蛋白质的赖氨酸残基,其通常位于共通模体ψkxe内,其中ψ是疏水性氨基酸且x是任一残基。sumo共价结合至其他蛋白涉及了一系列活体内的酶步骤。第一,sumo蛋白于靠近c端处发生蛋白水解,以产生成熟蛋白,此一步骤是藉由sumo蛋白酶(ulp’s)所完成。这些蛋白酶皆有双功能,其可从受质蛋白质上藉由切断接合处的类多肽键结,以切下sumo基团。在一atp相关性的反应中,经成熟处理的sumo蛋白透过硫酯键共价键结合到异二聚体sumoe1活化酶的sae2(uba2)亚单元上。sumo模体由e1转移至ubc9(即sumoe2酶),接着ubc9结合至标的蛋白中的ψkxe共通序列,并在sumo多肽c端的甘氨酸的羧基和所述序列上赖氨酸的ε-氨基之间形成类多肽键结。已知sumoe3蛋白可藉由与ubc9(e2酶)以及受质两者的互动来提升sumo结合的效果,因此,sumoe3蛋白可作为一桥接因子。脊椎动物细胞包含三种sumo同种同源物。sumo-2和sumo-3的序列非常相似,其与sumo-1的相似度为约50%,且sumo-1的特性是三种脊椎动物sumo蛋白中最为人所熟知的。
eklf上的蛋白激酶ctheta(pkcθ)-媒介的第68个位置的丝氨酸(ser68)磷酸化位置与第74个位置的赖氨酸(lys74)位置相近,且已有推论认为在lys74上与ser68磷酸化相关的类小泛素化有利于eklf的核移入,且eklf的ser68磷酸化不仅使得eklf可由foe分离出来,且亦可能影响eklf的类小泛素化,其在红血球成熟过程中对于eklf的核移入扮演着重要的调控角色(yangetal.(2006)emboj.25,5083-5093)。在不限于任何特定的理论上,本揭示内容认为能够抑制ser68磷酸化或lys74类小泛素化的活性药剂,可能或无法抑制eklf进入细胞核内的移位,因此,影响eklf在转录层级活化或抑制标的基因的能力。此外,此处认为能够抑制ser68磷酸化或lys74类小泛素化的活性药剂,可改变eklf在一或多个eklf标的基因的转录活性,例如,活化子或抑制子活性。
在一实施方式,本揭示内容提供一种鉴别活性药剂的方法。所述方法包含:将eklf多肽(如,人类eklf蛋白)与一候选药剂接触;以及测量呈现于eklf多肽上的转译后修饰量,其中若eklf多肽上的转译后修饰量显著不同于(如,少于)默认值或显著不同于(如,少于)未与候选药剂接触的控制组中的量,则认为所述候选药剂是活性药剂。在特定实施方式中,所述方法更包含测量存在于未与候选药剂接触的eklf多肽上的转译后修饰量。在一特定实施方式中,所述默认值是零或默认值表示少于10%、20%或50%的转译后修饰量或eklf多肽带有转译后修饰。
在不同的实施方式中,在进行分析以侦测转译后修饰量之前和/或同时,将eklf多肽与所述候选药剂接触,所述分析可以是活体外磷酸化或类小泛素化分析。在特定实施方式中,所述分析包含将eklf多肽与可对eklf多肽进行转译后修饰的一或多种酶接触,且在接触时同时存有例如,用以连接至eklf多肽上的化学基团(如磷酸基或sumo蛋白),上述所处需持续疑足够的时间且是在允许转译后修饰进行的条件下;且之后,测定含有转译后修饰的eklf的量或测定存在于eklf多肽上的转译后修饰的量。可将所述eklf多肽和各种的候选药剂量接触,以便譬如测量该候选药剂的ic50。
在特定实施方式中,所述转译后修饰是类小泛素化,且在进行活体外类小泛素化分析之前或同时,以eklf多肽接触所述候选药剂。所述分析为本领域所知熟知的分析,且亦有可供进行此类分析的套组,如,enzo类小泛素化套组(farmingdale,ny,usa)。在特定实施方式中,在sumo-1、sumo-2和/或sumo-3存在下,使eklf多肽与候选药剂于足以进行类小泛素化的条件与时间下接触;接着,利用sumo专一抗体透过例如sds-page或western印迹(westernblotting)来侦测类小泛素化的eklf蛋白。
在特定实施方式中,所述转译后修饰是类小泛素化,在存有放射性标志(如,35s-met)的条件下进行eklf多肽的活体外转译;接着,在将所述eklf多肽和sumoe1和e2酶以及sumo-1于足以使其进行类小泛素化的条件与时间下培养之前或同时,让eklf多肽与候选药剂接触,接着以sds-page和自动放射显影术测定使否存在经类小泛素化的eklf多肽。
在特定实施方式中,所述转译后修饰是磷酸化修饰,在存有放射性标志(如,35s-met)的条件下进行eklf的活体外进行转译后修饰;接着,在将所述eklf多肽和pkcθ以及磷酸基于足以使其进行磷酸化的条件与时间下培养之前或同时,让eklf多肽与候选药剂接触,接着以自动放射显影术或ib进行分析。在可任选的实施方式中,可利用sds-page分离磷酸化蛋白并以质谱仪分析。相关方法请参见“shyu,y-c.etal.,(2014)developmentalcell28:409-422”一文。
在另一种实施方式中,本揭示内容提供一种鉴别活性药剂的方法,包含:将含有eklf多肽的细胞与一候选药剂接触;以及测量该eklf多肽上的转译后修饰量,其中若eklf多肽上的转译后修饰量显著不同于(如,少于)默认值或显著不同于(如,少于)未与候选药剂接触的控制组中的量,则认为所述候选药剂是活性药剂。在一特定实施方式中,所述方法更包含测量存在于未与候选药剂接触的eklf多肽上的转译后修饰量。
在不同的实施方式中,所述细胞包含eklf多肽,其包含一外源性导入的eklf多肽(如,人类eklf蛋白)。在特定实施方式中,所述细胞包含一可表达外源eklf蛋白的表达载体。所述表达载体能稳定地整合至细胞的基因体中或暂时存在于细胞中。在特定实施方式中,利用显微注射或利用脂质传递载体将eklf蛋白导入细胞中。在特定实施方式中,所述分析包含将eklf多肽的细胞和一促进或刺激eklf多肽转译后修饰的药剂(如pma、epo、pkctheta活化子或sumo多肽)在足以进行转译后修饰的时间和条件下接触;接着,测定含有转译后修饰的eklf的量或测定存在于eklf多肽上的转译后修饰的量。可将所述包含eklf多肽的细胞和不同量的候选药剂接触,以测定例如候选药剂的ic50。
在特定实施方式中,所述转译后修饰是类小泛素化,在足使eklf多肽发生类小泛素化的条件与时间下,使所述多肽或细胞与活性药剂接触;接着,分析类小泛素化程度。可利用已知技术进行分析,例如,活体内类小泛素化分析。举例而言,之后可使所述细胞裂解并利用免疫沉淀分析(immunoprecipitation,ip)来侦测类小泛素化蛋白,其中所述免疫沉淀分析可利用结合到eklf上的初级抗体,物种匹配的非专一性igg(species-matchednon-specificigg)以及抗sumo-1、抗sumo-2或抗sumo-3抗体(invitrogen)。本发明亦可利用其他方法,包含但不限于活体内ip-western印迹、ip-ms、dna转染、dna转染-ip-western印迹。例示的方法请参见“sarge,k.andparke-sarge,o-k.,methodsinmol.biol.2009;590:265-277(2010)”一文。
在特定实施方式中,所述转译后修饰是磷酸化,在足使eklf多肽发生磷酸化的条件与时间下,使多肽或细胞与活性药剂接触;接着,可利用本领域多种已知分析法的任一种来侦测磷酸化eklf蛋白,所述方法譬如,活体外磷酸化。举例而言,可使所述细胞裂解,并以免疫沉淀法来侦测磷酸化的eklf蛋白,其中所述免疫沉淀法是利用可专一性地结合到磷酸化eklf(ser68经磷酸化)的初级抗体,以及利用一可侦测的二级抗体进行侦测。其他适用的例示性方法包括活体内ip-western印迹、ip-ms、dna转染、dna转染-ip-western印迹和western印迹。
在不同的实施方式中,本发明包含测量eklf多肽上转译后修饰的量,所述转译后修饰是类小泛素化或磷酸化。在特定实施方式中,所述修饰是指鼠eklf上lys74或人类eklf上lys54的类小泛素化或鼠eklfser68的磷酸化。在特定实施方式中,所述修饰是经由p-pkcθ(s676)磷酸化。可利用已知的方法测定多肽是否有类小泛素化或磷酸化或修饰的的量。举例而言,例示性的方法可参见“yangetal.(2006)emboj.25,5083-5093;shyuetal.(2006)cellres.16,347-355;siateckaetal.(2007)molcellbiol.27(24):8547-60;andshyu,etal.(2014)developmentalcell,28,409-422”等文。
在特定实施方式中,本发明包含测量eklf多肽上转译后修饰的量,若相较于未接触候选药剂eklf多肽上的量,接触候选药剂后的eklf多肽上呈现的转译后修饰量少于90%、80%、70%、60%、50%、40%、30%、20%、10%或为0%,则认为该候选药剂为活性药剂。在特定实施方式中,若呈现于eklf多肽的转译后修饰量小于或等于预设阈值,则认定该候选药剂为活性药剂,其中所述预设阈值可利用已知抑制磷酸化或类小泛素化的药剂测定而得。在一特定实施方式中,所述预设阈值是零。
在特定实施方式中,本发明揭示一种鉴别一活性药剂的方法,所述活性药剂能延长个体的预期寿命、生命年限或健康年限和/或抑制肿瘤形成或肿瘤转移;所述方法包含鉴别能改变eklf多肽(如,人类eklf蛋白)的一或多种活性的药剂。在特定实施方式中,所述活性是核移位活性、转录活性或转录抑制活性。数据显示,在红血球系祖细胞和前驱细胞中,eklf主要位于细胞质内,且在红血球成熟的过程中,eklf会从细胞质移位至细胞核中(yangetal.(2006)emboj.25,5083-5093)。在不受特定理论的限制下,据信eklf的核移入作用对于成体球蛋白基因转录的活化作用是必要的。eklf交互因子(即,foeofeklf,foe)可与eklf交互作用并将其隔离在细胞质中,并因此决定了eklf在红血球祖细胞中的功能性限制,这又进一步可调控在红血球系细胞由cfu-e/pro-e转变至baso-e的过程中,eklf对于一系列红血球基因的活化作用或抑制作用。
在另一实施方式中,本揭示内容提供一种鉴别活性药剂的方法;所述方法包含:将一含有eklf多肽的细胞(如,人类eklf蛋白)与一候选药剂接触;以及测量eklf多肽的活性量,其中若eklf多肽的活性量显著不同于(如,大于或小于)默认值,或显著不同于(如,大于或小于)未与候选药剂接触的控制组,则认为该候选药剂为活性药剂。在特定实施方式中,所述方法是利用一eklf多肽而非利用含有eklf多肽的细胞,例如,当所述活性是转录活化子活性或抑制子活性时。
用以测定多肽的核定位作用的方法为本领域所熟知的方法。举例而言,所述方法可参照以下文献所揭示的内容“yangetal.(2006)emboj.25,5083-5093”,以利用譬如免疫荧光法来测定eklf多肽的亚细胞(如,细胞质或细胞核)定位。因此,在一方法中,在足以进行核定位的条件与时间下,将含eklf多肽的细胞与候选药剂接触,接着以免疫荧光法利用eklf专一性抗体来测定eklf多肽的亚细胞定位。在特定实施方式中,所述分析是利用巨核细胞(megakaryocyt)/红血球系祖细胞、或成熟红血球来进行。在特定实施方式中,上述分析所利用的细胞是在cfu-e/pro-e转变至baso-e的过程之前、之中或之后处于分化阶段的细胞。在特定实施方式中,所述细胞为经分类的cfu-e/proe、baso-e、polych-e或orthoch-e细胞。相关的方法请参见“y-c.etal.,(2014)developmentalcell28:409-422”一文。
可利用习知方法测定eklf多肽的转录活性(如,转录活化作用或抑制作用),所述方法包含用以测定eklf与标的多核苷酸序列的结合的分析,或反转录活化子活性或抑制子活性,上述分析例如,利用带状移位(band-shift)分析来测量eklf与标的启动子或增强子序列的结合、利用eklf多肽和报导构筑体(reporterconstructs)进行活体外转录分析、以及使用定量聚合酶反应(polymerasechainreaction,pcr)来测定譬如在细胞中受到eklf活化或抑制的基因的mrna表达量。受到eklf调控的基因包含,但不限于:eklf正调控的基因,如,alpha球蛋白、beta球蛋白、epb4.9、tspo2和fn3k;以及eklf负调控的基因,如,hecw1、nrip3和jak3。其他已知受eklf调控的基因,可参照以“biekeretal.1995,mol.cell.biol.15:852-860;chenandbieker,2004,mol.cell.biol.24:10416-10424;chenandbieker,2001,mol.cell.biol.21:3118-3125;millerandbieker,1993,mol.cell.biol.13:2776-2786.”等文所揭示的内容。在特定的实施方式中,测定col1a和/或mpv171基因的mrna。在本揭示内容的实施例中,在寿命较长且肿瘤发生和转移率较低的突变小鼠中,上述基因的mrna的量皆降低。在特定实施方式中,将含eklf多肽的细胞与候选药剂接触,并测定任一所述基因的表达量,如,藉由rt-pcr,以决定该些基因的表达量相较于譬如对照量或未接触候选药剂的细胞是否改变。
在特定实施方式中,于足以使eklf结合至一多肽的条件与时间下,将eklf多肽与含有eklf结合位的经标记多核苷酸进行培养,并在上述培养之前或同时,使eklf多肽与候选药剂。利用带状移位分析来决定结合至所述多核苷酸的eklf量。
在特定实施方式中,于足以使报导基因转录的条件与时间下,利用与一启动子或增强子可操作地连接的报导基因进行活体外转录分析,并在上述分析之前或之后,将eklf多肽(如,人类eklf蛋白)与一候选药剂接触。可利用定量pcr或藉由侦测测定报导蛋白(譬如,利用荧光报导蛋白的荧光量,或利用可结合至报导蛋白的抗体)来决定经转录的报导基因mrna或蛋白。
在特定实施方式中,将含eklf多肽(如,人类eklf蛋白)的细胞与候选药剂接触,并经过足以让eklf活化或抑制任一标的基因的时间,接着藉由测量标的基因mrna或所编码产生的蛋白量(例如,利用定量pcr或利用一专一性结合标的基因的抗体进行免疫分析),以决定标的基因的表达量。
在特定实施方式中,所述方法包含测量eklf的核移位作用,相较于未与候选药剂接触的eklf多肽于细胞质中的量,若与候选药剂接触的eklf多肽于细胞质中的量低于90%、80%、70%、60%、50%、40%、30%、20%、10%或为0%,则认定该候选药剂为活性药剂。在特定实施方式中,若细胞质中的eklf多肽的量少于或等于预设阈值,则认定所述候选药剂是活性药剂,其中可基于在以下细胞的细胞质中所观察到的量,来决定所述预设阈值;上述细胞为巨核细胞/红血球祖细胞、成熟红血球细胞、在由cfu-e/pro-e转变为baso-e的过程之前、之中或之后处于不同分化阶段的细胞、或经分类的cfu-e/proe、baso-e、polych-e或orthoch-e细胞。在特定实施方式中,预设阈值是80%、50%或10%。在特定实施方式中,本发明包含测量eklf的核移位作用,相较于未与候选药剂接触的eklf多肽于细胞核中的量,若与候选药剂接触的eklf多肽于细胞核中的量高出90%、80%、70%、60%、50%、40%、30%、20%、10%,则认定所述候选药剂是活性药剂。在特定实施方式中,若在细胞核中eklf多肽的量小于或等于预设阈值,则认定所述候选药剂为活性药剂,所述预设阈值是基于在baso-e细胞核中所测定的量而决定。在特定实施方式中,预设阈值是80%、50%或10%。
在一特定实施方式中,本发明包含测量eklf的转录活化子活性,相较于在存有eklf多肽的条件下但未与候选药剂接触的标的基因的表达量,若在存有eklf的条件下与欲研究的候选药物接触的标的基因的表达量少于90%、80%、70%、60%、50%、40%、30%、20%、10%或为0%,则认定所述候选药剂为活性药剂。在特定实施方式中,本发明包含测量eklf的抑制子活性,相较于在存有eklf多肽的条件下但未与候选药剂接触的标的基因的表达量,若在存有eklf的条件下与欲研究的候选药物接触的标的基因的表达量增加了至少10%、20%、30%、40%、50%、60%、70%、100%、200%、500%或1000%,则认定所述候选药剂为活性药剂。
在其他实施方式中,本发明提供一种鉴别活性药剂的方法,其中所述活性药剂能延长个体寿命或健康年限和/或抑制肿瘤形成或肿瘤转移,所述方法包含:施用一候选药剂至一转基因动物(如,在此所述的基因敲入动物);以及比较转基因动物(如,基因敲入)在施用了候选药剂之后的寿命以及未施用候选药剂的控制组动物的寿命,其中若转基因动物的寿命比控制组动物来得长,则所述候选药剂是能够延长个体寿命或健康年限和/或抑制个体肿瘤形成或肿瘤转移的活性药剂。在特定实施方式中,相较于未经活性药剂处理的动物,经活性药剂处理的动物其寿命至少延长了5%、10%、20%、30%、40%、50%、60%、70%、80%、90%或100%。在特定实施方式中,所述转基因动物是一基因敲入非人类哺乳动物,其两个eklf等位基因皆经过修饰,以减少lys74的类小泛素化或ser68磷酸化修饰。在特定实施方式中,两个eklf等位基因皆包含在lys74或ser68位置上的一氨基酸置换。在特定实施方式中,所述氨基酸置换是k74r。
可利用任何方式以所欲方式和/或适当的给药途径将候选药剂施用至动物,以利检验所增加的长寿活性或所减少的肿瘤形成。举例而言,可利用注射(如,静脉注射、肌肉内注射、皮下注射)、经口灌注或其他合适的方式来施用所述候选药剂。
对动物施用候选药物时可能涉及给予不同剂量的候选药剂,且可能包含给予不同配方的该药剂或利用不同的给药途径。可藉由对动物(如,转基因动物)施用候选药剂,并评估其对于转基因动物的寿命的影响,以便评估候选药剂中止或减缓正常老化过程的能力。可藉由对野生型动物或未经引入会导致寿命延长的eklfk74r突变的动物施用候选药剂,以评估候选药剂防止老化的能力。
在另一实施方式中,本发明提供的方法可用以鉴别能够延长预期寿命、生命年限或健康年限或减少肿瘤形成或肿瘤转移的候选标的,所述方法包含:测量野生型动物(或野生型细胞)中受到eklf多肽所调控的一或多个基因的表达量;以及测量此处所述可表达修饰的eklf多肽的动物(或细胞)中受到eklf多肽调控的上述一或多个基因的表达量,其中在所述二种动物(或细胞)间,表达量有显著差异的基因可认定为候选治疗标的。在多个特定实施方式中,所述基因包含一或多个此处所述受到eklf调控的各种基因。在特定实施方式中,所测量的表达量是指由所述一或多个基因转录的mrna量或所述一或多个基因所编码产生的多肽量。可利用已知的先前技术来测定样本中mrna的量,例如,使用定量聚合酶链反应(qpcr)。再者,可利用已知先前技术测定样本中多肽的量,例如,elisa、免疫沉淀法或facs,这些方法通常可利用能够专一性结合至所编码产生的多肽的抗体。在特定实施方式中,可测定该动物的一或多种特定细胞类型中所述一或多个基因的表达量;上述细胞类型例如:骨髓细胞、红血球细胞、血液细胞、红血球细胞和/或巨核祖细胞、或多能祖细胞。可利用已知的步骤从动物中分离所述细胞;所述方法包括例如,facs法,其利用结合至这些细胞类型上所呈现的特定细胞表面标记的抗体。在特定实施方式中,所述转基因动物是一基因敲入非人类哺乳动物,其两个eklf等位基因皆经过修饰,以减少lys74的类小泛素化或ser68磷酸化修饰。在特定实施方式中,两个eklf等位基因皆包含在lys74或ser68位置上的一氨基酸置换。在特定实施方式中,所述氨基酸置换是k74r。
受到eklf所调控的基因的实施例包含,但不限于:eklf正调控的基因,如,alpha球蛋白、beta球蛋白、epb4.9、tspo2和fn3k;以及eklf负调控的基因,如,hecw1、nrip3和jak3。在特定实施方式中,相较于本发明修饰的eklf动物(或细胞),在野生型动物中(或细胞)表达量较高的基因(及其所编码产生的蛋白)可作为降低其表达或抑制其活性(如,在表达层次或在蛋白层次量)的药剂的作用标的。在特定实施方式中,相较于本发明修饰的eklf动物(或细胞),在野生型动物(或细胞)中表达量较低的基因(及其所编码产生的蛋白)可作为能促进其表达或提升其活性的药剂的作用标的,所述药剂如基因治疗载体。
在特定实施方式中,本揭示内容揭示一种基于基因表达量或其所编码产生的蛋白的量的差异来鉴别活性药剂的方法,所述方法更包含针对经鉴别在野生型动物或细胞中和在修饰的eklf动物或细胞中,表达量会有差异的基因或其所编码产生的蛋白,鉴别已知可调控所述基因或蛋白的表或活性的药剂。可利用多种方法来鉴别所述药剂,例如,参考科学期刊或数据库所揭示的关于特定化学物质如何影响特定基因表达的信息,或基于该差异化表达的蛋白已知的功能活性。
在一实施方式中,本发明提供的方法可用以鉴别能够延长个体预期寿命、生命年限或健康年限或减少肿瘤形成或肿瘤转移的活性药剂,所述方法包含:将可表达修饰的eklf等位基因的细胞与一候选药剂接触,其中相较于野生型eklf多肽,所述修饰的eklf等位基因编码产生一修饰的eklf多肽,且其包含一或多个修饰的氨基酸;以及测量修饰的eklf多肽的表达量,其中若修饰的eklf多肽的表达量高于未与候选药剂接触的控制组细胞的表达量,则所述候选药剂为能够增加个体的寿命和/或抑制肿瘤形成的活性药剂。
在特定实施方式中,在此所述任一用以鉴别活性药剂的方法,更包含一或多个其他步骤,如,确认或验证所述候选药剂对于哺乳动物能产生欲求效果。在一实施方式中,所述方法更包含对哺乳动物提供经鉴别的活性药剂,以及测定哺乳动物是否有一或多个与长寿、延长生命年限、延长健康年限相关的特征(相较于未经活性药剂处理的哺乳动物而言)。举例而言,所述特征是指经处理的哺乳动物比未经处理的同龄哺乳动物具下列特征:头发花白减少、运动协调性提升、肌力提升、骨质疏松症发生率降低、骨体积增加、骨密度增加、索前软骨的数量增加或索前软骨的间隙缩减。此外,可检验与老化相关的细胞性质变化,或者是检验组织或器官结构或功能上的变化。在一实施方式中,本方法更包含对哺乳动物提供一经本发明方法鉴别出的活性药剂,以及决定该哺乳动物相较于未经活性药剂处理的哺乳动物是否具有一或多个与降低肿瘤形成或肿瘤转移相关的特征。
在本发明任一筛选分析法的实施方式中,eklf多肽是一野生型eklf多肽或其片段,其能被磷酸化和/或类小泛素化。在一特定实施方式中,所述片段包含eklf多肽的连续氨基酸的至少10%、20%、30%、40%、50%、70%、80%或90%的片段。在特定实施方式中,一eklf多肽与野生型eklf多肽或其片段有至少80%、85%、90%、95%或98%的相似度。在特定实施方式中,野生型eklf多肽是哺乳动物eklf,如,小鼠、人类、大鼠或兔子eklf多肽,包含但不限于在此所述的任一种多肽。在特定实施方式中,eklf多肽是修饰的eklf多肽,其包含但不限于包含一修饰的氨基酸的eklf多肽,其中所述修饰可以是对在此所述的类小泛素化位置或磷酸化位置进行取代置换。在特定实施方式中,eklf多肽对于细胞而言,是内源性多肽;但在其他实施方式中,eklf多肽对于细胞而言,是外源性多肽,或已导入至细胞内。在特定实施方式中,所述细胞包含能表达eklf多肽的外源性核酸。在特定实施方式中,所述细胞是在此所述的转基因细胞或来自在此所述的转基因动物。
可利用譬如此处所建立的非人类转基因动物模型,来筛选具有可延长寿命或降低肿瘤形成活性的候选药剂,适用于所述筛选的候选药剂包含,但不限于,合成、存在于天然界或以重组方式产生的分子,包含小分子、胜肽、抗体及多肽。候选药剂可以从多种不同来源所取得,包含合成或天然化合物数据库。举例而言,可利用本领域已知的组合数据库中多种不同方式的任一种方式来获得候选药物,上述组合数据库包含生物数据库、空间可定位平行固相或液相数据库(spatiallyaddressableparallelsolidphaseorsolutionphaselibraries);经由运算(deconvolution)所得的合成数据库的方法(需解卷积(deconvolution))、一珠一化合物(one-beadonecompound)数据库,以及利用亲和性管柱筛选的合成数据库。生物数据库的方法包含多肽数据库(虽然亦有其他可应用至胜肽的方案)、非肽寡聚物或化合物的小分子数据库。
在一特定实施方式中,活性药剂(和候选药剂)是小分子有机化合物、肽、蛋白质、多核苷酸、非肽化合物、合成化合物、发酵产物或细胞萃取物。在特定实施方式中,小分子有机化合物的分子量为大于50至小于约20,000道尔顿(daltons)。在特定实施方式中,蛋白质是抗体或其片段,如,scfv、纳米抗体等。在特定实施方式中,活性药剂是可结合至eklf的一抗体或其片段,藉以防止eklf的ser68的磷酸化和/或lys74的类小泛素化。在特定实施方式中,所述抗体或其片段可结合至eklf上的一区域,此区域包含eklf第68-74个氨基酸残基的区域或与其重迭。
在特定实施方式中,多核苷酸可以是单链或双链dna或rna,且包含其经过修饰的的形式,包含带有修饰的核酸碱基和/或修饰的核酸间键结者,所述修饰可增加稳定性或有效性。在特定的实施方式中,多核苷酸可结合至eklf基因或mrna和/或抑制其表达或转译。在特定实施方式中,多核苷酸是rna干扰剂、sirna、shrna、多价sirna或mirna。可利用计算机仿真程序来设计可结合至eklf基因或mrna的多核苷酸,所述程序可鉴别一基因或mrna理想的标的位置(参见,如,halo-biornaitherapeutics,seattle,wa)。在特定实施方式中,多核苷酸药剂有一区域和eklf的dna或mrna的序列为同源区域或互补区域;所述区域为例如,至少6核苷酸、至少8核苷酸、至少12核苷酸、至少16核苷酸、至少24核苷酸或至少30核苷酸。在特定实施方式中,所述候选药剂可以是已知能减少或抑制磷酸化或类小泛素化的化合物。
在特定实施方式中,在此所述的分析是在包含多种候选药剂的数据库中鉴别活性药剂。在特定实施方式中,所述数据库包含多种小分子有机化合物、肽、蛋白或多核苷酸。已有多种已知且可商业取得的小分子有机化合物数据库,可依据本发明的实施方式运用这些数据库。
用以增强预期寿命、生命年限或健康年限以及降低肿瘤形成或肿瘤转移的方法
本发明进一步提供用以增加一个体预期寿命、生命年限或健康年限的方法,以及用以抑制有需要个体的肿瘤形成或肿瘤转移的方法。依据本实施例所揭示内容,本发明人意外地发现对哺乳动物eklf多肽的类小泛素化位置进行修饰,能增加哺乳动物的预期寿命和提升生命年限与健康年限,以及降低哺乳动物的肿瘤形成以及肿瘤转移。此外,利用带有黑色素瘤的小鼠进行试验,以探讨eklfk74r对于癌细胞所扮演的角色。出乎意料地,eklfk74r等位基因的表达能够防止癌性黑色素瘤细胞转移。因此,本揭示内容的进一步方面是提供能够治疗患有细胞增殖性疾病的个体的方法。在不限定于任何理论下,据信对类小泛素化位置进行修饰,能够抑制或破坏eklf多肽的类小泛素化,这会改变eklf多肽活性以达到延年益寿以及降低肿瘤形成和肿瘤转移的效果。
因此,本发明包含用以增加或增强一个体预期寿命、生命年限或健康年限的方法,以及用以抑制肿瘤形成或肿瘤转移的方法;所述方法包含提供本发明的修饰的eklf多肽给所述个体,和/或提供可改变个体内源性或野生型eklf多肽活性的第一活性药剂。在特定实施方式中,亦可对该个体提供一第二活性药剂,其中第二活性药剂可降低个体内源性、野生型eklf多肽的活性及表达。在特定实施方式中,所述个体是一哺乳动物,如,人类或非人类哺乳动物。第一活性药剂、第二活性药剂和/或修饰的eklf多肽皆可以一有效量提供予所述个体。可藉由对个体施用修饰的eklf多肽或可编码产生该修饰的eklf多肽的多核苷酸,将修饰的的eklf多肽提供予该个体。在特定实施方式中,所述修饰的eklf多肽是修饰的人类eklf多肽。在特定实施方式中,所述修饰的eklf多肽包含能够抑制其类小泛素化的一突变。在特定实施方式中,所述修饰的eklf多肽包含在lys54位置的修饰。在此提供的方法亦可用以达成或在较长时期内维持与保持年轻或延长寿命相关的特定表达型或特征,上述特征涵盖在此所述或呈现的任何特征,如,经处理的个体相较于未经处理的同年龄个体能表达以下任一表达型或特征:头发花白减少、运动协调性提升、肌力提升、骨质疏松症降低、骨体积增加、骨密度提升、索前软骨的数量增加或索前软骨间的间隙缩减。
在特定的实施方式中,所述个体是哺乳动物(如,人类)。在特定实施方式中,所述个体经诊断为罹患或可能罹患肿瘤或肿瘤转移。在特定实施方式中,所述个体经诊断为罹患或可能罹患与老化相关的疾病或症状。在特定实施方式中,个体的年龄为至少20岁、至少30岁、至少40岁、至少50岁、至少60岁、至少70岁、或至少80岁。
在一实施方式中,本发明包含治疗或防止一有需要个体中的细胞增殖性疾病(如,肿瘤形成或肿瘤转移)的方法,所述方法包含对该个体施用一有效量的多肽或可编码产生该多肽的核酸,其中所述多肽是修饰的eklf多肽,其包含一或多个修饰的氨基酸,使得其类小泛素化程度和/或核移位作用低于野生型eklf多肽的类小泛素化程度和/或核移位作用。在特定实施方式中,修饰的eklf多肽是修饰的人类eklf多肽。在特定实施方式中,修饰的eklf多肽的类小泛素化程度低于野生型eklf多肽的类小泛素化程度。在特定实施方式中,修饰的eklf多肽从细胞质至细胞核的移位作用低于野生型eklf多肽。在特定实施方式中,相较于野生型eklf多肽,修饰的eklf多肽具有修饰的转录活化子活性或修饰的抑制子活性。在不同的实施方式中,所述一或多个修饰的氨基酸包含在野生型eklf多肽上会被类小泛素化或磷酸化的氨基酸位置进行修饰;譬如在全长小鼠野生型eklf多肽上的第74个氨基酸进行修饰(例如,以精氨酸置换赖氨酸(k74r))、或全长人类野生型eklf多肽上的第54个氨基酸进行修饰(例如以精氨酸置换赖氨酸(k54r)),或者是全长野生型eklf多肽上的第68个氨基酸进行修饰。本发明的一方法包含对一个体施用一有效量的多肽或可编码产生该多肽的核酸,其中所述多肽是修饰的人类eklf,并且在eklf多肽片段上第54个位置的赖氨酸经过突变,非必要的是以精氨酸取代。在特定实施方式中,修饰的人类eklf在第54个位置上未经类小泛素化。
可利用多种不同方式将多肽施用至一个体,包含以“裸露的(naked)”多肽或和利于递送的药剂复合。在特定实施方式中,将所述多肽与可增强细胞吞噬作用的药剂一起递送。可以藉由不同的方式将核酸施用至一个体,包含“裸露的”dna或rna或与脂质复合或包覆于脂质颗粒内。在特定实施方式中,将一核酸(如,一多核苷酸)施用至所述个体时,该核酸是存在于一表达载体中。在特定的实施方式中,该核酸是存在于病毒载体中。所述病毒载体可以是复制能力缺陷或有复制能力的病毒载体。在各种不同的实施方式中,所述病毒载体是来自于疱疹病毒、反转录病毒、慢病毒(lentivirus)、牛痘病毒、减毒牛痘病毒、金丝雀痘病毒、腺病毒或腺相关病毒。该核酸可存在于一表达载体中,其中编码产生所述修饰的eklf多肽的核酸序列是可操作地连接至一启动子或增强子-启动子组合(enhancer-promotercombination)。适合的表达载体包含质体和病毒载体,如,疱疹病毒、反转录病毒、牛痘病毒、减毒牛痘病毒、金丝雀痘病毒、腺病毒以及腺相关病毒。在特定实施方式中,该核酸可操作地连接至启动子序列和任选地增强子连接。在特定实施方式中,启动子和/或增强子使得该核酸和其编码的多肽具有组织特异性的表达。在特定实施方式中,启动子和/或增强子是eklf基因启动子和/或增强子,且其使得核酸能够具有和内源性eklf相似或相同的表达模式。
可利用习知的聚合物、生物可降解微粒或微胶囊递送装置来递送上述的核酸或多核苷酸。另一种使宿主摄入核酸的方法是利用标准方法制备而成的脂质体。可将多核苷酸单独并入上述传递载体或与组织专一性抗体共同并入载体中。在可任选的实施方式中,可制备一分子接合物,其系由质粒或其他载体和聚-l-赖氨酸(poly-l-lysine)所组成,其中两者是藉由静电或共价力而结合。聚赖氨酸可结合至一配体(ligand),所述配体可结合至标的细胞上的受体(cristiano,etal.,1995,j.mol.med.73:479)。在可任选的实施方式中,可使用习知的组织专一性转录调控组件来实现组织专一性的标的作用。要达到活体内(invivo)表达的另一种方法是将“裸露的”dna(即,未与传递载体结合者)递送到肌肉内、皮内或皮下位置。
可利用已知方法合成或利用重组技术来制备所述多肽。举例而言,可以将可编码产生所述多肽(如,具k74r突变的修饰的eklf)的核酸转到表达载体中,其中该核酸是可操作地连接至能够在宿主细胞中表达所述多肽的适当调控序列。本领域技术人员可载体导入至宿主细胞中以表达所述多肽。可利用已知方法,硫酸铵沉淀法及分馏管柱层析法,从宿主细胞中纯化经表达的重组多肽。可根据此处所述的方法来测定利用上述方法制得的多肽的活性。
在特定的实施方式中,是将所述多肽或核酸施用至所述个体,且所述方法包含对该个体施用一第二活性药剂,其中该第二活性药剂可抑制内源性eklf多肽的表达。在特定实施方式中,该第二活性药剂是一核酸分子,可任选的是一负链rna、sirna、shrna或mirna,且其可结合至编码内源性eklf多肽的mrna或其互补序列。
在一实施方式中,本发明包含治疗或防止一有需要个体中一细胞增殖性疾病(如,肿瘤形成或肿瘤转移)的方法,所述方法包含对该个体施用有效量的活性药剂,所述活性药剂能抑制内源性eklf多肽的类小泛素化和/或降低内源性eklf多肽从细胞质至细胞核的移位作用。在一实施方式中,所述活性药剂可抑制类小泛素化。在一实施方式中,所述活性药剂可降低移位作用。
在一实施方式中,本发明包含治疗或防止一有需要个体中的细胞增殖性疾病(如,肿瘤形成或肿瘤转移)的方法,所述方法包含对该特体施用有效量的活性药剂,所述活性药剂能改变内源性eklf多肽的一或多种活性。在一实施方式中,所述活性药剂可抑制类小泛素化。在一实施方式,所述活性药剂能降低移位作用。在一特定实施方式中,所述活性药剂可修饰内源性eklf多肽的转录活化子活性或抑制子活性。
在一特定实施方式中,本发明方法所使用的活性药剂可结合至内源性eklf多肽。在特定实施方式中,活性药剂是有机小分子或多肽,非必要的是一抗体或其功能性片段。
本发明的方法可用以治疗或防止多种细胞增殖性疾病,包含但不限于肿瘤和肿瘤转移,包含但不限于此处所述者。在特定实施方式中,肿瘤或肿瘤转移是肝癌、大肠癌、乳癌、前列腺癌、肝细胞癌、黑色素瘤、肺癌、神经胶母细胞瘤、脑瘤、造血系统恶性肿瘤、视网膜母细胞瘤、肾细胞癌、头颈癌、子宫颈癌、胰脏癌、食道癌或鳞状细胞癌。
在特定实施方式中,治疗或防止细胞增殖性疾病的方法更包含对一个体施用有效量的抗增殖剂,以治疗细胞增殖性疾病。在特定实施方式中,抗增殖剂是一烷化剂、拓扑异构酶抑制剂、抗代谢物或细胞毒性抗生素。在某些实施方式中,烷化剂是顺铂、卡铂定、益乐铂、甲基二(氯乙基)胺、环磷酰胺、氮芥苯丙氨酸、氮芥苯丁酸、依弗酰胺、二甲磺酸丁酯、n-亚硝-正-甲脲、双氯乙基亚硝脲、环己亚硝、司莫司汀、福莫司汀、链佐霉素、达卡巴仁、米托唑胺、替莫唑胺、沙奥特帕、丝裂霉素或地亚农。在某些实施方式中,拓扑异构酶抑制剂是喜树碱、依瑞诺丁、托普迪肯、依妥普赛、艾霉素、坦尼坡赛、诺波霉素、美巴龙和阿柔比星。在某些实施方式,抗代谢物是氟嘧啶、脱氧核酸类似物、硫嘌呤、甲氨蝶呤或培美曲塞。在某些实施方式中,细胞毒性抗生素是放线菌素、博莱霉素、普卡霉素、丝裂霉素、艾霉素、柔红霉素、表阿霉素、伊达比星、泛艾霉素、阿柔比星或米托蒽醌。
在其他实施方式中,本发明包含延长一个体寿命或健康年限的方法,该方法包含对该个体施用一有效量的多肽或编码产生该多肽的核酸,其中该多肽为修饰的eklf多肽,其包含一或多个修饰的氨基酸,以使得其类小泛素化和/或核移位作用程度低于野生型eklf多肽的类小泛素化和/或核移位作用程度。在特定实施方式中,修饰的eklf多肽的类小泛素化程度低于野生型eklf多肽。在特定实施方式中,修饰的eklf多肽核从细胞质到细胞核的移位作用低于一野生型eklf多肽。在特定实施方式中,修饰的eklf多肽的转录活化子活性或抑制子活性与野生型eklf多肽不同。在特定实施方式中,该核酸是存在于一表达载体中。在特定的实施方式中,该核酸是存在于病毒载体中。在多种不同的实施方式中,病毒载体是来自于疱疹病毒、反转录病毒、牛痘病毒、减毒牛痘病毒、金丝雀痘病毒、腺病毒或腺相关病毒。在不同的实施方式中,所述一或多个修饰的氨基酸包含在野生型eklf多肽上会被类小泛素化或磷酸化的氨基酸位置上进行修饰;譬如在全长野生型eklf多肽上的第74个氨基酸进行修饰(例如,以精氨酸置换赖氨酸(k74r))或者是全长野生型eklf多肽上的第68个氨基酸进行修饰。
在特定实施方式中,是将多肽或核酸施用至所述个体,所述方法更包含对该个体施用一第二活性药剂,其中第二活性药剂可抑制内源性eklf多肽的表达。在特定实施方式中,该第二活性药剂是一核酸分子,可任选的是一负链rna、sirna、shrna或mirna,其可结合至可编码产生内源性eklf多肽的mrna或其互补序列。
在一实施方式中,本发明包含延长个体寿命或健康年限的方法,包含对该个体施用一有效量活性药剂,所述活性药剂可抑制内源性eklf多肽的类小泛素化和/或降低内源性eklf多肽从细胞质至细胞核的移位作用。在一实施方式中,所述活性药剂可抑制类小泛素化。在一实施方式中,所述活性药剂可降低移位作用。
在一实施方式中,本发明包含延长个体寿命或健康年限的方法,包含对该个体施用一有效量的活性药剂,所述活性药剂可改变内源性eklf多肽的一或多种活性。在一实施方式中,所述活性药剂可抑制类小泛素化。在一实施方式中,所述活性药剂能降低移位作用。在一特定实施方式中,所述活性药剂可修饰内源性eklf多肽的转录活化子活性或抑制子活性。
本发明更包含药学组合物,其包含一编码产生一修饰的eklf的多核苷酸、一修饰的eklf多肽、一候选药剂或一活性药剂,和一或多个药学上可接受赋形剂、稀释剂或载体。可利用包含以上任一种的药学组合物来进行本发明所提出的方法。本发明的实施方式包含多种组合物,其包含修饰的eklf多肽、可编码产生此一修饰的eklf多肽的多核苷酸或活性药剂,上述成分可调配于药学上可接受或生理上可接受的溶液中,以供单独施用或和一或多个其他治疗模式并用于一细胞、个体或动物。可以理解的是,若有需要,亦可将本发明的组合物和其他药剂(如,其他蛋白质或多肽或各种具药学活性的药剂)共同施用。可包含在本组合物中的其他成分基本上没有限制,只要所述额外的药剂不会对于要达到的调控或其他效果有负面影响即可。
在本发明的药学组合物中,药学上可接受赋形剂和载体溶液的配方以及将此处所述的特定组合物用于各种治疗方案时是用的给药方式与治疗方案都是所属技术领域中具有通常知识者所熟知的,所述治疗方案包括,例如,口服、肠胃外、静脉内、经鼻和肌肉内等施用途径和配方。
在特定的状况下,想要将此处所述的药学组合物以以下途径施用:肠胃外、皮下、静脉内、肌内、动脉内、鞘内、脑实质内、脑池内、脑室内、尿道内、胸骨内、头颅内、滑膜内或腹膜内施用,譬如,请参见以下专利文献u.s.pat.no.5,543,158、u.s.pat.no.5,641,515和u.s.pat.no.5,399,363(在此所列示的每一文献皆并入本发明的内容)。适用于肠胃外施用的装置包含针注射器(含微针)、无针注射器和灌注技术。
活性化合物的溶液中含有游离碱基形式的活性化合物或其药学上可接受盐类,可在水中将其和表面活性剂(如,羟丙基纤维素)适当地混合以制备所述溶液。亦可将其制备为分散液,如在甘油、液态聚乙二醇和其混合物中以及在油类中制备。在一般的储存和使用条件下,所述制备物包含一防腐剂以防止微生物生长。
适用于注射的药学形式包含无菌水溶液或分散剂和可用以实时制备无菌注射溶液或分散液的无菌粉末,(u.s.pat.no.5,466,468,在此所列示的每一文献皆并入本发明内容)。在任何条件下,药学形式应为无菌的且应为具备可供注射的流体性质。所述药物配方在制备和储存的条件下必须是稳定的,且应经过防腐处理而能够抵抗微生物(如,细菌和真菌)的污染。所述载体可以是溶剂或分散剂,其含有例如水、乙醇、多元醇(如,甘油、二醇和液态聚乙二醇即与其相似者)、上述物质的适当混合物和/或植物油。本发明的药物配方应保持适当的流动性,例如,利用一披覆层(如,卵磷脂)、当为分散液或使用表面活性剂时藉由维持所需颗粒大小。可以使用各种不同的抗细菌剂和抗霉菌剂以利对抗微生物的污染作用,例如,羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞及与其相似等。在许多情形中,本发明的药物配方较佳可包含包含等渗剂,例如,糖或氯化钠。可藉由在组合物中使用能够延缓吸收的药剂(例如,单硬脂酸铝和明胶),以使得注射用组合物有延缓吸收的效果。
肠胃外施用的配方为液体溶液,举例而言,视实际使用状况,所述溶液应经过适当的缓冲处理,且液体稀释剂应先可利用适当的盐或葡萄糖制成等渗液。这些特定的水溶液特别适用于静脉内、肌肉内、皮下和腹膜内施用。在这方面,基于此处所揭示的内,本领域技术人员可轻易想见使用的无菌溶液介质。举例而言,可将一剂量溶解于1毫升的等渗透压nacl溶液,然后将其加入至1000毫升的皮下溶液中或注射于建议的灌注部位(参见remington’spharmaceuticalsciences,15thedition,pp.1035-1038and1570-1580)。基于接受治疗的个体状况的不同,施用的剂量会随着改变。在任何情况下,负责施用的人员可针对该个体来决定适当的剂量。再者,施用于人类的配方应该是无菌、无热源且安全和纯度标准需符合fda生物标准规范要求。
可将适当量的活性化合物混入适当的溶剂以及其他所需的上述成分,接着进行过滤除菌,以制得无菌注射液。一般而言,分散液的制备方式是将各种无菌的活性成分混入无菌载体中,上述无菌载体其含有基本的分散介质以及其他所需的上述成分。在制备应用于无菌溶液使用的无菌粉末时,较佳的方法是利用真空干燥和冷冻干燥的方式制备,以产生活性成分的粉末加上先前经过除菌过滤的溶液中的任何额外的所欲成分。
可将在此所述的组合物调配成中性或盐类形式。药学上可接受盐类,包含酸加成盐(和蛋白质的游离氨基共同形成),其可以是和无机酸(如,盐酸或磷酸)或有机酸(如醋酸、草酸、酒石酸、杏仁酸等)共同形成。亦可由游离羧基和无机碱或有机碱形成的盐类,所述无机碱如,钠、钾、铵、钙或氢氧化铁,所述有机碱可以是异丙胺、三甲胺、组氨酸、普鲁卡因等。在调配完成后,以和剂型配方兼容的方式并以治疗有效量来施用这些溶液。可精义地以多种剂型(如,注射溶液或药物释放胶囊等)来施用这些配方。
在此所述“载体(carrier)”一词,包含任何以及所有的溶剂、分散介质、载体、披覆层、稀释剂、抗菌剂和抗真菌剂、等渗剂和延迟吸收剂、缓冲液、载体溶液、悬浮液和胶体等。所述适用于药学活性物质的介质和药剂可以是为已知介质和药剂。此介质与药剂在药学活性物质中的运用为本领域所熟知的。除非惯用的介质或药剂和活性成分不相容,本发明涵盖所述介质或药剂于此处提出的治疗组合物中的运用。此外,本发明组合物亦可涵盖其他辅助活性成分。
所述“药学上可接受载体”是指当施用于人体时,不会导致过敏反应或类似反应的分子实体与组合物。含有作为活性成分的蛋白的液体组合物的制备是为本领域众所周知的。一般而言,可将此种组合物制备为注射剂,其可以是液体溶液或悬浮液;也可以制备成固体形式,所述固体形式适合于在注射之前加入溶液或悬浮液中以制备注射剂。也可以乳化该制剂。在一特定实施方式中,可以藉由脂质体、纳米胶囊、微粒、微球体、脂质粒、载体等进行传递。在特定的实施方式中,本发明的组合物可以包覆于脂质颗粒、脂质体、载体、纳米胶囊或纳米微粒中,以供递送。再者,可利用习知与惯用的技术来进行上述配方与此种递送载体的应用。
在特定实施方式中,可将在此所提供的药剂接合到药学上可接受的固体基底上,包含生物兼容性和生物可降解基底,如聚合物和基质。举例而言,所述固态基底包含但不限于,聚酯(polyesters)、水凝胶(hydrogels)(例如,聚(2-羟乙基-甲基丙烯酸酯)(poly(2-hydroxyethyl-methacrylate))或聚(乙烯醇)(poly(vinylalcohol))、聚乳酸(polylactides)(美国专利第3,773,919号)、l-麸氨酸和γ乙基-l-麸氨酸的共聚物(copolymersofl-glutamicacidandγ-ethyl-l-glutamate)、非可降解的乙烯-乙酸乙烯酯(non-degradableethylene-vinylacetate)、可降解的乳酸-乙醇酸共聚物(degradablelacticacid-glycolicacidcopolymers)如聚(乳酸-共-乙醇酸)(poly(lactic-co-glycolicacid),plga)以及luprondepottm(由乳酸-乙醇酸共聚物和醋酸利普安(leuprolideacetate)组成的可注射微粒)、聚-d-(-)-3-羟基丁酸(poly-d-(-)-3-hydroxybutyricacid)、胶原蛋白(collagen)、金属(metal)、羟基磷灰石(hydroxyapatite)、生物玻璃(bioglass)、铝酸盐(aluminate)、生物陶瓷材料(bioceramicmaterials)和纯化蛋白。
可利用已知的方法进行调制,例如参照“remington:thescienceandpracticeofpharmacy,mackpublishingcompany,easton,pa.,19thedition(1995)”一文所述。可依据本发明所提供的方法,以任何治疗上有效的给药方式来施用在此揭示的组合物和药剂。藉由选择给药剂量及频率,以便得到该药剂的有效量,且在此一有效量下不会产生有害的影响。本发明化合物的有效量会随着施用的途径、受治疗的温血动物的类型、所讨论的特定温血动物的生理特性而有不同。在决定所述有效量时应考虑的因素以及其间的关系为医学领域具有通常知识者所熟知。可量身打造有效量以及施用方法,以达到最佳的治疗效果,但这需要考虑多种因素,例如,体重、饮食、目前使用的其他药物以及医学领域具有通常知识者所想到的其他因素。
本发明其他方面的实施方式提供了一种试剂盒,其包含一或多个容器,容器内填充有一或多种药学组合物,其含有如此处所述的本发明的多肽、多核苷酸、活性药剂等。所述试剂盒可以包含说使用说明书,以说明如何使用此组合物(如,延长预期寿命、生命年限或健康年限,或者是抑制或降低肿瘤形成或肿瘤转移)。
在此所述的试剂盒可以包含一或多种额外的治疗药剂或适用于或想用于所治疗的用途或用于所欲诊断应用的其他成分。若有需要,可将额外的治疗药剂填充于第二容器中。所述额外的治疗药剂的实施例包含,但不限于抗肿瘤药。
所述试剂盒亦可包含一或多个注射器或要实现一所欲递送模式所必须或可用的其他组件(如,支架、可植入药物储库等)。
实施例
材料与方法
实验动物
成体c57bl小鼠(18至25克)购自台湾实验动物中心,并依据中央研究院(中国台湾)实验动物委员会核准的流程,饲育在动物设施中。
eklf(k74r)基因敲入小鼠的产生
产生基因敲入小鼠的方式如下:利用标准的基因标定方法,使用cre-loxp重组系统、标定bacclonerp24-319p23(invitrogen)和反向选择bac修饰试剂盒(genebrides),藉由es细胞内的同源重组作用,将eklf类小泛素化位突变(k74r)引入至小鼠eklf(klf1)基因的第二外显子上。以取自c57b/6j小鼠es细胞的基因体dna作为模板,利用pcr扩增含有eklf外显子2区域的片段,并用来建构标的载体。在转至模板标的载体之前,利用标准突变技术将外显子2编码的密码子74突变成精氨酸(k74r)。此外,将新霉素匣建构至标的载体中,其中pgk-gb2-neo模板可编码新霉素/卡那霉素抗性基因,此模板结合了可在e.coli中表达卡那霉素抗性的原核启动子(gb2)以及可在哺乳动物细胞中表达新霉素抗性的真核启动子(pgk)。此外,修饰的野生型dna两侧设有loxp部位,以利移除野生型dna(图1a)。将loxp-pgk-loxp匣插入eklf基因的内含子1的位置。接着以电穿孔的方式使标的构筑体进入c57b/6jes细胞,并利用新霉素抗性的特性进行筛选。以5’和3’western印迹来鉴别适当的经标的es转殖株。在移除neo匣并确认编码eklfk74r的基因体区域的结构后,将es转殖株注射至囊胚中以产生嵌合小鼠。为了得到含基因敲入等位基因的杂合子小鼠,将生殖系传递(germlinetransmission)f1品系与全身表达cre重组酶的eiia-cre小鼠交配。将带有单点突变的一个等位基因的eklf杂合子小鼠相互交配,以得到纯合子eklf(k74r)基因敲入小鼠。
eklfk74r基因敲入标的载体序列如表e1所示。所示的序列以5’至3’的方向表示,且核苷酸的位置从5’往3’的方向编码,并以5’端第一个核苷酸为1。以各区域的核苷酸区域(即,该区域涵盖的核苷酸位置的范围)来表示标的载体的各区域,如,eklf基因的外显子和内含子、loxp部位、polya部位、neo和pgk启动子。
表e1标的载体多核苷酸序列
taqman基因表达分析
利用trizol试剂(invitrogen)来制备rna,并以oligo-5dt引物与superscriptiii反转录酶(rt)(invitrogen)依据标准步骤进行将rna反转录。使用appliedbiosystems7500实时pcr系统(appliedbiosystems)设备,于预设的循环条件(50℃,2分钟;95℃,10分钟;95℃,15秒;和60℃,1分钟;40个循环)下以经验证的taqman分析来进行定量pcr(qpcr)。将cdna样本连续稀释以得出标准曲线,接着以β-肌蛋白(actb:mm00607939_s1;appliedbiosystems)或gapdh(mm说明书摘要15_g1;appliedbiosystems)标准化,以测定相对的eklf(mm04208330_g1andmm00516096_m1;appliedbiosystems)表达量。
寿命测量
利用标准步骤来测量寿命。在于无特定病原(specific-pathogen-free,spf)的动物中心内,追踪eklf(k74r)基因敲入小鼠的寿命。
肿瘤形成抗性分析
为了研究eklf(k74r)基因敲入小鼠的抗癌效果,利用先前公开文献(chaetal.,2003;stackpole,1981)所示的肺群落分析法(lungcolonizationassay)进行研究。以静脉注射方式将鼠转移性黑色素瘤细胞(即,b16-f10)(106细胞/0.2ml)分别注射至eklf(k74r)kin小鼠和野生型小鼠的尾静脉中(3只小鼠/组),以检视这些细胞形成肿瘤以及转移的潜力。由于b16f10细胞是来自于c57bl/6小鼠,且其与c57bl/6小鼠(野生型和eklf(k74r)基因敲入小鼠)在免疫上兼容,故本试验选择b16f10细胞进行试验。经二周后,以二氧化碳使小鼠窒息并牺牲,摘除小鼠肺部进行检验。利用影像分析软件(imageinc.;chaetal.,2003)来测量肺部表面的转移结节。在注射后14天测量每只小鼠的肿瘤数目。
微数组分析
取出wt以及eklfk74r基因敲入小鼠的e14.5小鼠的胎肝或3月龄小鼠骨髓,重复吸放磷酸盐缓冲液(pbs)(10mmphosphate,0.15mnacl[ph7.4])以使组织均质化。以trizol试剂(invitrogen)分离总rna,并利用mousegenomeassay430a2.0(affymetrix,inc.)测定基因体范围的基因表达图谱分析(genome-scalegeneexpressionprofiling)。应用标准mas5.0方法标准化基因表达数据。基因表达值经对数转换,以供后续比较分析。利用r3.0.2语言(rdevelopmentcoreteam,2013,www.r-project.org)进行统计分析。
eklf标的基因qpcr
利用市售trizol试剂(invitrogen)萃取总rna,并利用superscriptiii(invitrogen)依照制造商提供的步骤进行反转录。利用实时pcr或半定量rt-pcr和适当的引物(购自missionbiotech,中国台湾)测定小鼠cola1、mpv17l以及肌蛋白的mrna量。利用appliedbiosystems7500实时pcr系统(appliedbiosystems,fostercity,ca,usa)进行qpcr分析,分析条件如下:1循环:50℃持续2分钟;1循环:95℃持续10分钟;以及35循环:95℃持续15秒和60℃持续1分钟。利用仪器所附软件(7500systemsdssoftwarevers.1.3.1)来计算循环阈值(thresholdcycle)(ct)。以肌蛋白作为内部控制组,并以肌蛋白将cola1或mpv17lmrna的表达量标准化以得到相对量。数据以柱状图显示,其中每一直条代表由三次重复所得到的数据的平均值±sem。半定量rt-pcr分别由以下pcr反应培养条件所组成:94℃持续5分钟;接着,22个循环,条件如下:94℃持续30秒、55℃持续40秒和72℃持续30秒(肌蛋白);28个循环,条件如下:94℃持续30秒、52℃持续30秒和72℃持续27秒(cola1);以及24个循环,条件如下:94℃持续30秒、52℃持续40秒、72℃持续20秒(mpv17l)。数据以柱状图显示,其中每一直条代表由两次重复所得到的数据的平均值±sem。
食品/水摄取测量
利用对连续影像纪录进行全自动计算机摄影分析,以监控自发性笼内活动。
代谢测量
利用全方位实验动物监控系统(clams,oxymaxopencircuitcalorimeter,columbusinstruments)测量动物的氧气消耗量、二氧化碳产生量、食物和水摄取量。
胰岛素以及葡萄糖测量
采集小鼠血液样本。经由离心后,收取血浆利用elisa(mediagnost,germany)并依照制造商建议来定量胰岛素和葡萄糖。亦将血浆用于定量葡萄糖。
握力试验
以muromachi公司的mk-380cm/r设备进行握力测试,记录实验结果。
旋转杆试验
以ugobasilerota-rod47600设备进行旋转试验。在试验阶段中,将螺旋杆以每分钟2转的转速持续加速至每分钟80转。
骨摄影
于动物安乐死后,立刻利用scancomedicalmicro-ct40设备评估动物全身骨头密度。
肿瘤摄影
于小鼠施用100ci的18f-fdg后0.5小时,以micropetr4扫瞄小鼠以得到micropet影像。
实施例1产生eklfk74r小鼠
依据上文“材料与方法”所述的步骤制备带有eklfk74r突变等位基因的转基因小鼠。图1a简要地绘示了用以产生eklfk74r小鼠的标的载体构筑体。以pcr分析取自小鼠尾巴的基因体dna,并确认纯合子和杂合子小鼠皆带有eklfk74r突变等位基因(参见图1b)。以常规方法培育eklfk74r基因敲入小鼠,且其子代性状符合门德尔遗传率,这代表修饰的eklf基因的作用方式和野生型eklf等位基因类似,且不会造成胚胎死亡。胚胎中的mrna定量分析显示eklfk74r小鼠和野生型同窝小鼠的总eklfmrna量相近(第1d图)。
eklf蛋白是一种转录因子,其具有启动子和抑制子活性。转录体(transcriptome)会因为k74r突变而改变。如骨髓或e14.5胎肝的微数组杂交分析所示,至少有40个基因分别被负向调控和正向调控。如图2所示,pcr确认了某些上述基因表达的。相较于野生型小鼠,在成体eklfk74r基因敲入小鼠的骨髓中,col1a1的mrna量明显较低(如图2a所示)。相较于野生型小鼠,eklfk74r基因敲入小鼠的e14.5胎肝中,mpv171的mrna量明显较低(图2b)。
实施例2eklfk74r突变造成寿命增加
相较于同窝的野生型小鼠,eklfk74r转基因小鼠的寿命较长。具体而言,eklfk74r小鼠(n=45)寿命的中位数比野生型小鼠(n=33)多了3个月(图3a)。寿命实验结果摘要于表e2。
表e2eklfk74r小鼠寿命
表e2的结果证实,相较于野生型小鼠,eklfk74r公鼠最高寿命(一群组中最长寿的10%小鼠的平均寿命)增加5.8个月。eklfk74r小鼠寿命最大值为约40个月,比文献所揭示的其他长寿小鼠(如,cisd2)的寿命更长(wuetal.,humanmoleculargenetics(2012)21,3965-3968)。再者,相较于17月龄的野生型小鼠,32月龄的eklfk74r小鼠灰白色的毛发较少(图3b)。由实验结果发现eklfk74r小鼠除了长寿之外,身体健康且能正常生长。
已知对多种物种(包含酵母菌、鱼、啮齿动物和狗)进行饮食限制或卡路里限制能够减缓生物老化的过程,进而达到增加寿命以及健康年限的效果。亦有研究指出直接改变代谢作用能延长寿命。对正常饮食小鼠进行小规模表达型分析,初步数据如图4和图5所示。如图所示,野生型和eklfk74r小鼠在3月龄至24月龄间的体重变化相似(图4b)。事实上,在48小时自发性食物摄取实验中,无论是将体重变化以体重进行标准化或将体重变化表示为绝对值,野生型小鼠和eklfk74r小鼠的结果都很相近,且水分摄取试验亦有类似的结果(图4c和图4d)。
正常饮食的小鼠的代谢表达型并没有显著改变,所述代谢表达型如,氧消耗量(vo2,图5a)、二氧化碳产量(vco2,图5b)、热产量(图5c)和呼吸交换率(respiratoryexchangeratio,rer)(图5d)。这些数据显示,在eklfk74r小鼠和野生型小鼠中,都采用类似的方式使用脂质和碳水化合物作为能量来源。
由于限制饮食或卡路里通常和葡萄糖耐受性的改变相关,本实施例测量正常饮食小鼠血液中的空腹葡萄糖浓度和空腹胰岛素浓度,以及从血液循环中清除葡萄糖的能力。如图6所示,eklfk74r和野生型小鼠之间的空腹葡萄糖浓度(图6a)、空腹胰岛素浓度(图6b)或葡萄糖耐受度(图6c)并无显著差异。
进行试验以评估肌肉力量和运动协调性。3月龄的eklfk74r小鼠与3月龄野生型小鼠的握力相似,但24月龄的eklfk74r小鼠的握力明显高于同龄的野生型小鼠(图7a)。另一方面,在eklfk74r小鼠和野生型小鼠之间,无论是三月龄或12月龄的小鼠,从螺旋杆上掉落的延迟时间都很相似(图7b)。本试验中,每天进行三次试验,以测量从加速的螺旋杆上掉落的延迟时间。
骨质疏松是老化的重要特征之一。如图8所示,在野生型小鼠中,骨体积和索前软骨的数量都会随着年龄而减少,而其索前软骨的间隙则会增加(图8,左栏)。相反地,在高龄的eklfk74r小鼠体内,上述参数的结果和年轻的eklfk74r动物则不相上下,这代表eklfk74r小鼠不会随着年龄增长而造成骨质疏松(图8;右栏)。
在eklfk74r小鼠身上观察到的表现型和既有的长寿小鼠模型不同。表e3比较了eklfk74r小鼠和其他长寿啮齿动物的表现型。向上箭头表示相较于野生型小鼠有所提升、向下箭头表示降低,而等号则表示没有改变。在“老化”一栏中,是高龄野生型小鼠相对于年轻野生型小鼠的比较。此表是依据“hofmann,etal.(2015)cell160,477-488”一文表s7修改而得。
表e3长寿小鼠模型的表达型
实施例3eklfk74r突变导致抗癌性
藉由表达型的观察可知,相较于同窝野生型小鼠,eklfk74r小鼠的年龄相关癌症发生率较低,如,micro-pet影像分析(图9a)以及24月龄小鼠的解剖结果(图9b)所示。
够过藉由静脉注射将癌细胞植入至eklfk74r小鼠和同窝的野生型小鼠。b16f10黑色素瘤细胞(atcc#crl6475)来自和eklfk74r小鼠具有相同遗传背景的c57bl/6j小鼠。将b16f10细胞透过尾静脉注射(i.v.注射)至小鼠体内,以进行活体内转移分析(图10)。于注射b16f10细胞后两周检查肺部。结果显示eklfk74r小鼠的癌症转移率较低。初步研究显示,当将b16f10黑色素瘤细胞皮下注射至小鼠体内时,kin小鼠中的肿瘤生长会受到些微的抑制,但此一现象不具统计上显著性。
总体来说,以上数据显示eklfk74r小鼠的癌症转移率较低(图9),此一结果和肺肿瘤分析的结果十分吻合(图10)。这些数据和eklfk74r能够降低或抑制肿瘤发生以及减少或抑制癌细胞转移的结果一致。
在此所提供的具体说明与附图是作为本实施例的具体描述,然其并非用以限定本发明。在此阐述了实施例的功能,以及用以建构和操作所述实施例步骤顺序。然而,相同或均等功能和顺序可以由不同的实施例完成。可以合并在此所述的多种实施方式以产生其他实施方式。必要时可对多种实施方式的方面进行修饰,利用在此所述的多种专利、申请案和公开文献所揭示的概念衍生其他实施方式。
根据上述详细说明能够对所述实施方式进行修改。原则上,权利要求所使用的词汇不应受限于说明书具体实施方式和申请专利范围中所揭示的具体内容,于解读申请专利范围时应包括所有可能的实施例及其均等的权利范围。因此,本发明的保护范围当以附随权利要求所界定者为准,不受本揭示内容所限制。
所有本说明书所引用的美国专利、美国专利申请公开案、美国专利申请案、他国专利、他国专利申请公开案和非专利文献和/或申请表中所列文献,皆视为本说明书的一部份。
- 还没有人留言评论。精彩留言会获得点赞!