一种用大蒜花序轴进行脱毒快繁的方法及应用与流程
技术领域
本发明属于农业生物工程技术领域,涉及大蒜组织培养与快繁的方法,更具体的说是构建一种用大蒜花序轴进行脱毒快繁的新方法。
背景技术:
大蒜(Allium sativum L.)是百合科葱属一年生植物,大蒜栽培品种多不能形成种子,通常采用无性繁殖。这就使大蒜的生物多样性和遗传特性受到限制,造成严重的种性退化,严重影响大蒜的产量和品质。长期无性繁殖还导致大蒜病毒的不断积累,严重影响大蒜植株的生长及鳞茎的商品价值。当前,植物组织培养、人工诱变、基因工程以及大蒜多倍体育种等技术的应用,很大程度上提升了大蒜优良品种的选育工作。其中植物组织培养技术作为一种有效的脱毒快繁技术,已成大蒜育种研究热点。
在大蒜的植物组织培养研究中,大蒜的不同外植体如,茎尖、根尖、幼嫩的叶子、贮藏叶、叶原基 、未成熟的花序轴、鳞茎以及气生鳞茎等都已被应用于组织培养中用于诱导与再生。不定芽增殖途径是直接诱导外植体内潜伏的不定芽萌发,具有遗传性状稳定,突变率低,再生时间较短等优势。目前,大蒜不定芽增殖方式多选用茎尖和茎盘(等为外植体,其繁殖系数平均在3到7 之间。花序轴是大蒜的生殖器官,处在生长顶端,病毒含量较低,其自然脱毒效果可以达到77.6%;花苞基部花盘有很高的诱导不定芽的潜力,王秀芝等以大蒜花序轴为外植体,诱导不定芽,每个花序轴不定芽总数可以达到19.2个。可见大蒜花序轴可以作为大蒜脱毒快繁的重要外植体。
然而,许多研究者虽然获得了较多的不定芽,但脱毒种蒜高效培养成功的相关报道较为少见。因为高频率试管苗的诱导仅仅是脱毒种蒜生产的限速条件之一,如何保证这些试管苗生根、移栽成活进而获得脱毒种蒜是另一个重要条件。许多研究者采用离体培养技术从愈伤组织中获得了大量再生植株,但在诱导生根和移栽环节上损失大量植株,降低了繁殖效率,并且耗时耗力,在应用方面受到限制。有研究者通过优化大蒜再生植株的移植条件,提高其存活率,但植株驯化困难,效果不甚理想。熊正琴等将试管苗诱导形成试管鳞茎,其移栽成活率能明显提高。此外,试管鳞茎便于储存、方便运输、具有更强抗逆性以及无需驯化的优点,诱导成试管鳞茎的方式更加适用于大蒜组织培养。而且有研究表明,试管鳞茎与普通大蒜蒜瓣种植相似,经过其休眠期,便可以直接种植并正常生长。
本发明以宝坻大蒜“六瓣红”的花序轴作为外植体,通过优化激素种类及浓度配比,获得高效诱导不定芽培养基,结合诱导试管鳞茎、改进栽培途径,构建了从外植体到脱毒种蒜生产的完整方法,该体系为大蒜脱毒、快繁、保持优良遗传稳定性、提高鳞茎产量及品质等提供了重要的技术依据。
技术实现要素:
本发明的目的在于公开了一种用大蒜花序轴进行脱毒快繁的方法,它是按如下的步骤进行:
(1)花序轴诱导不定芽:选择宝坻大蒜“六瓣红”,大蒜进入生殖生长期时,其花茎:假茎=1-1.2时,采摘大蒜的花序轴并于4℃中保存两周。将经低温储存两周后的花序轴置于自来水下冲洗30 min,0.1% HgCl2 消毒20 min,蒸馏水冲洗3-4次,再用75%的酒精消毒10 min,蒸馏水冲洗3-4次。剥下外层苞叶及表面退化的花原基残留物和膜质苞片,并去除花茎部分,将花序轴接入不定芽诱导培养基中,每瓶接入2个花序轴。诱导不定芽的培养基为: MS+2.0 mg L-1 KT+0.1 mg L-1 NAA+ 30.0 g· L-1 蔗糖+7.5 g ·L-1 琼脂,pH=6.2。每个花序轴诱导的不定芽数可以达到11个;不定芽诱导试管鳞茎的诱导率均在90%以上,最高可达到98.78%,而每个花序轴诱导的试管鳞茎数最高可达到10.64个,其繁殖系数相对于鳞茎直接种植高了2倍多;
(2)不定芽诱导试管鳞茎:花序轴生长六周后,形成的不定芽高度达到3-5cm时,将其接入诱导培养基中诱导试管鳞茎,所述的诱导培养基指的是试管鳞茎诱导培养基:MS+120 g· L-1绵白糖+6.8 g· L-1琼脂,pH=7.5,其详细的方法是:当花序轴诱导的不定芽生长六周后,形成的不定芽高度达到3-5cm时,将其接入另试管鳞茎诱导培养基中诱导试管鳞茎;
(3)试管鳞茎的收获与储藏:不定芽在诱导试管鳞茎的培养基中诱导六周后,试管鳞茎成熟,将其取出并洗去培养基,在避光处晾干,晾干后,在4℃下保存3周后种植。
(4)再生植株和再生鳞茎的获得:试管鳞茎度过休眠期后,于10月底种植,覆膜。第二年5月份,揭开薄膜,并进行除草,浇水以及松土工作。在6月下旬,组培大蒜成熟并收获;
(5)组培大蒜病毒检测和染色体检测: 利用酶联免疫技术和根尖细胞染色体制片技术分别检测组培大蒜脱毒效果和染色体变异情况,组培大蒜达到部分脱毒效果,未观察到染色体异常现象。
本发明所述的NAA是 a-萘乙酸(1-naphthlcetic acid),简称NAA ; KT是激动素(Kinetin),简称KT;所述的MS基本培养基配方:
每1L基本培养基中含有:KNO3 1900mg,NH4NO3 1650mg, MgSO4∙7H2O 370 mg, KH2PO4 170 mg, CaCl2∙2H2O 440 mg, MnSO4∙4H2O 22.3 mg, ZnSO4∙7H2O 8.6 mg, H3BO3 6.2 mg, KI 0.83 mg, Na2MO3∙2H2O 0.25 mg, CuSO4∙5H2O 0.025 mg, CoCl2∙6H2O 0.025 mg, Na2-EDTA 37.7 mg, FeSO4∙7H2O 27.8 mg, 甘氨酸2.0 mg, 盐酸硫胺素0.4 mg, 盐酸吡哆素0.5 mg, 烟酸0.5 mg, 肌醇100 mg。
本发明进一步公开了用大蒜花序轴进行脱毒快繁方法在提高大蒜脱毒快繁效率方面的应用,实验结果显示:本发明的方法是有效的,能够缩短大蒜制种时间,增大繁殖系数,由于不经过脱分化和再分化过程,可以最大限度保证了优良大蒜品种的遗传稳定性。
本发明以大蒜花序轴为外植体,构建了从外植体选择、花序轴不定芽诱导、不定芽诱导试管鳞茎、试管鳞茎打破休眠、大田栽培种植、脱毒效果检测、遗传稳定性检测、直到脱毒种蒜获得的完整的方法。
下面本发明以典型的天津市宝坻大蒜快繁为代表,更加具体的说明实施方案:
1、花序轴诱导不定芽最佳培养基筛选:本发明所用的大蒜为宝坻大蒜“六瓣红”,材料来自于天津师范大学生物科技园中。选择于第一年10月底种植的宝坻大蒜“六瓣红”,大蒜进入生殖生长期时,其花茎:假茎=1-1.2时,采摘大蒜的花序轴并于4℃中保存两周。将经低温储存两周后的花序轴置于自来水下冲洗30 min,0.1% HgCl2 消毒20 min,蒸馏水冲洗3-4次,再用75%的酒精消毒10 min,蒸馏水冲洗3-4次。剥下外层苞叶及表面退化的花原基残留物和膜质苞片,并去除花茎部分,将花序轴接入筛选培养基中,每瓶接入2个花序轴。筛选培养基以MS为基本培养基,添加不同种类(KT,6-BA以及NAA)及浓度的激素,附加蔗糖30g·L-1,琼脂7.5g·L-1,pH=6.2,121 ℃ (1.03×105 Pa)灭菌20 min后使用。以下为花序轴诱导不定芽的筛选培养基:
表1 培养基激素配比
2、不定芽诱导试管鳞茎:花序轴生长六周后,形成的不定芽高度达到3-5cm时,将其接入另一种固体培养基中(MS+120 g· L-1绵白糖+6.8 g· L-1琼脂,pH=7.5)诱导试管鳞茎,观察并记录试管鳞茎生长状况。
3、试管鳞茎的收获与储藏:不定芽在诱导试管鳞茎的培养基中诱导六周后,试管鳞茎成熟,将其取出并洗去培养基,在避光处晾干,晾干后,在4℃下保存3周后种植。
4、再生植株和鳞茎的形态学观察:试管鳞茎度过休眠期后,于10月底种植,并覆膜。第二年5月份,揭开薄膜,并进行除草,浇水以及松土工作。在6月下旬,大蒜成熟并收获。测量鳞茎直径,将大蒜鳞茎按照大中小的标准分为三组,每一组测量十个数据,将得到的三十个数据进行平均,得到试管鳞茎的平均直径大小。
5、病毒检测:酶联免疫试剂OYDV、LYSV和GMV的DAS-ELISA检测试剂盒购自美国Agdia公司。所用检测抗体、酶标抗体、对硝基苯磷酸二钠(PNP)底物、阳性对照、GEB样品提取缓冲液、聚乙烯微孔板均购自Agdia公司,酶结合物为碱性磷酸酶(AP)标记的OYDV、LYSV、GMV3种病毒抗体,阴性对照为GEB提取缓冲液,具体检测方法参照Agdia公司说明书。用双抗体夹心酶联免疫吸附法检测大蒜的脱毒效果,方法参照试剂盒说明书,每个样品重复三次。
6、再生植株染色体检测:选取大蒜花序轴试管鳞茎再生植株根尖,用固定液固定24h后,用蒸馏水冲洗3-4次,放入70%的乙醇中进行保存。选取保存的根尖,用蒸馏水冲洗3-5次,加入1M HCl在60℃水浴中水解8 min,蒸馏水冲洗3-5次,将根尖分生组织区置于载玻片中央,滴加2-3滴卡宝品红溶液,染色8min,用滤纸吸去多余染液,在显微镜下观察根尖分生组织区染色体形态。
本发明公开的用大蒜花序轴进行脱毒快繁的方法与现有技术相比所具有的积极效果在于:
(1)该方法的核心是通过高频诱导试管鳞茎、试管鳞茎低温春化、设施栽培进而在实现脱毒种蒜生产。传统利用茎尖脱毒快繁,需要经过脱分化、再分化、诱导试管苗、试管苗生根、炼苗移栽等繁琐过程,历时两年才能获得脱毒种蒜。本实验室构建的方法,大大提高了大蒜脱毒快繁效率,节省培育时间,降低生产成本。
(2)大蒜花序轴处于大蒜植株生长顶端,其本身带毒量少,且通过花序轴直接诱导不定芽,没有经过脱分化和再分化过程,植株遗传稳定性得到保障。
(3)4℃下处理两周,打破花序轴休眠期,更加有利于不定芽诱导。
(4)本发明优化了各个环节,构建了从外植体到脱毒种蒜以及组培蒜脱毒效果和遗传稳定性检测的完整的方法,该方法在国内外尚未见相关报道。
附图说明
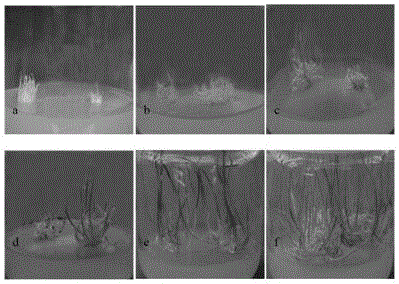
图1为大蒜花序轴不定芽诱导,其中a.花序轴刚接入培养基,b-f.花序轴生长约1周、2周、3周、4周和6周时的生长状况;
图2为大蒜花絮轴不定芽诱导试管鳞茎,其中a.不定芽接入诱导试管鳞茎培养基中,b-f. 不定芽诱导试管鳞茎1周、2周、3周、4周和6周的生长状况;
图3为形成的不定芽总数与形成的试管鳞茎数总数相关性分析;
图4为试管鳞茎的外观、大小与解剖图,其中a-b.从培养瓶中收获的成簇的试管鳞茎 c.收获的所有试管鳞茎,d.比较宝坻蒜瓣与试管鳞茎大小 e-f. 在解剖镜下观察试管鳞茎的生长点(箭头所指)(图中比例尺为1.9cm);
图5为大蒜试管鳞茎所得再生植株与鳞茎的形态,其中a.再生植株在地里的生长情况,b.收获鳞茎时再生植株的形态,c.独头鳞茎 d.分瓣鳞茎e.二次生长鳞茎(图中比例尺为1.9cm);
图6为大蒜花絮轴试管鳞茎再生植株根尖分生组织区的染色体检测。
具体实施方式
下面结合实施例说明本发明,这里所述实施例的方案,不限制本发明,本领域的专业人员按照本发明的精神可以对其进行改进和变化,所述的这些改进和变化都应视为在本发明的范围内,本发明的范围和实质由权利要求来限定。其中本发明所用到的NAA,KT, 蔗糖,10%安替福民、琼脂均有市售。
实施例1
(1)花序轴诱导不定芽:选择宝坻大蒜“六瓣红”,大蒜进入生殖生长期时,其花茎:假茎=1-1.2时,采摘大蒜的花序轴并于4℃中保存两周。将经低温储存两周后的花序轴置于自来水下冲洗30 min,0.1% HgCl2 消毒20 min,蒸馏水冲洗3次,再用75%的酒精消毒10 min,蒸馏水冲洗3次。剥下外层苞叶及表面退化的花原基残留物和膜质苞片,并去除花茎部分,将花序轴接入不定芽诱导培养基中,每瓶接入2个花序轴。诱导不定芽的培养基为: MS+2.0 mg L-1 KT+0.1 mg L-1 NAA+ 30.0 g· L-1 蔗糖+7.5 g ·L-1 琼脂,pH=6.2。每个花序轴诱导的不定芽数可以达到11个;不定芽诱导试管鳞茎的诱导率均在90%以上,最高可达到98.78%,而每个花序轴诱导的试管鳞茎数最高可达到10.64个,其繁殖系数相对于鳞茎直接种植高了2倍多;
(2)不定芽诱导试管鳞茎:花序轴生长六周后,形成的不定芽高度达到3-5cm时,将其接入诱导培养基中诱导试管鳞茎,所述的诱导培养基指的是试管鳞茎诱导培养基:MS+120 g· L-1绵白糖+6.8 g· L-1琼脂,pH=7.5,其详细的方法是:当花序轴诱导的不定芽生长六周后,形成的不定芽高度达到3-5cm时,将其接入另试管鳞茎诱导培养基中诱导试管鳞茎。
(3)试管鳞茎的收获与储藏:不定芽在诱导试管鳞茎的培养基中诱导六周后,试管鳞茎成熟,将其取出并洗去培养基,在避光处晾干,晾干后,在4℃下保存3周后种植。
(4)再生植株和再生鳞茎的获得:试管鳞茎度过休眠期后,于10月底种植,覆膜。第二年5月份,揭开薄膜,并进行除草,浇水以及松土工作。在6月下旬,组培大蒜成熟并收获;
(5)组培大蒜病毒检测和染色体检测: 利用酶联免疫技术和根尖细胞染色体制片技术分别检测组培大蒜脱毒效果和染色体变异情况,组培大蒜达到部分脱毒效果,未观察到染色体异常现象。
本发明所述的NAA是 a-萘乙酸(1-naphthlcetic acid),简称NAA ; KT是激动素(Kinetin),简称KT;所述的MS基本培养基配方:
每1L基本培养基中含有:KNO3 1900mg,NH4NO3 1650mg, MgSO4∙7H2O 370 mg, KH2PO4 170 mg, CaCl2∙2H2O 440 mg, MnSO4∙4H2O 22.3 mg, ZnSO4∙7H2O 8.6 mg, H3BO3 6.2 mg, KI 0.83 mg, Na2MO3∙2H2O 0.25 mg, CuSO4∙5H2O 0.025 mg, CoCl2∙6H2O 0.025 mg, Na2-EDTA 37.7 mg, FeSO4∙7H2O 27.8 mg, 甘氨酸2.0 mg, 盐酸硫胺素0.4 mg, 盐酸吡哆素0.5 mg, 烟酸0.5 mg, 肌醇100 mg。
实施例2
1、大蒜花序轴诱导不定芽诱导
由于不同激素种类(KT、6-BA及NAA)及浓度对不定芽再生效率有一定的影响,我们设计了12种筛选培养基,将低温保存两周后的大蒜花絮轴接入上述筛选培养基中,统计不定芽诱导率,确定最佳诱导培养条件,其结果如下表所示:
表2 不同激素配比对宝坻大蒜花序轴不定芽增殖的影响
从表2中可以看出,在培养基1到6中,培养基2的诱导率较高,每个花序轴诱导的不定芽数达到6.12个。在6- BA浓度相同时,不添加NAA的培养基诱导率较高,说明诱导不定芽时6-BA比NAA的影响大。培养基7到12中,11的诱导率较高,每个花序轴诱导的不定芽数达到11.00个,在KT浓度相同时,添加NAA的培养基诱导率较高,表明KT与NAA共同作用花序轴不定芽的诱导。而从表中结果发现,培养基7到12均比培养基1到6的诱导率高,说明KT比6-BA更适合大蒜花絮轴不定芽的诱导,因此,大蒜花絮轴诱导不定芽的最优培养基为:培养基11,即MS+2.0 mg L-1 KT+0.1 mg L-1 NAA+ 30.0 g· L-1 蔗糖+7.5 g ·L-1 琼脂,pH=6.2,其诱导率达到11个。
图1是在最佳诱导培养基上诱导不定芽各环节:刚接入培养基时未见明显膨大(图1-a)。经过一个星期左右,其表面出现凸起,花序轴明显膨大,切块表面增厚,形成半透明的丛生芽,大多数生长于中部和下部,并且密集生长(图1-b)。不定芽持续生长,大约两周后,半透明的不定芽变成嫩绿色,达到2厘米的长度(图1-c)。4周后,形成密集的不定芽丛(图1-e)。大约6周后,不定芽可以移植到诱导试管鳞茎培养基中(图1-f)。
2、大蒜花序轴不定芽诱导试管鳞茎
由于众多的不定芽丛生于同一个花絮轴基部,难以保证每一颗苗能够诱导出实生根进行移栽,本研究通过诱导试管鳞茎途径以提高繁殖效率。诱导试管鳞茎的培养基为:MS+ 120.0 g· L-1 绵白糖+6.8 g ·L-1 琼脂,pH=7.5 。从图2中可以看到,诱导大约1周后,不定芽根部开始膨大(图2-b);2周后,试管苗出现枯萎(图2-c);3周时,鳞茎外表皮逐渐变为紫色(图2-d);4周时,诱导形成的试管鳞茎大部分外表皮变为紫色,试管苗枯萎现象严重(图2-e);6周后,试管苗枯萎,试管鳞茎基本成熟(图2-f)。此时,将试管鳞茎从培养瓶中取出,洗去表面培养基,于阴凉处晾干。
从表3中可以看到,不定芽诱导试管鳞茎的诱导率均在90%以上,最高可达到98.78%,而每个花序轴诱导的试管鳞茎数最高可达到10.64个,其繁殖系数相对于鳞茎直接种植(繁殖系数为5)高了2倍多。从图3中可以看出,大蒜花序轴形成的不定芽总数与形成试管鳞茎总数呈显著正相关(p<0.05)。因此,在需要获得高诱导率的试管鳞茎时,诱导不定芽则需要在诱导率较高的培养基上生长。
表3大蒜花絮轴不定芽诱导试管鳞茎
注:小写字母在0.05水平上差异显著,大写字母在0.01水平上差异显著。
3 试管鳞茎的收获与贮藏
大蒜花序轴诱导形成试管鳞茎总计1260个。较大的试管鳞茎的直径为6.65mm,中等大小的直径为4.23mm,而相对较小的直径为1.68mm。从培养瓶中收获的试管鳞茎成簇状排列,每簇最多可达到25个(见图4-a-b)。晾干后的试管鳞茎外表皮呈紫色(见图4-c),与宝坻大蒜鳞茎外表皮一致。在解剖镜下观察,试管鳞茎都具有生长点(见图4-e-f),因此,在渡过休眠期后,移栽至地里,试管鳞茎均可以正常生长。
4 大蒜试管鳞茎所得再生植株与鳞茎的形态学统计分析
大蒜试管鳞茎的再生植株数量为539株,收获的鳞茎中,独头蒜有530株,分成两瓣的有8株,四瓣的1株。鳞茎的最大直径为22.14mm,最小直径为3.16mm,二次生长的1株。
5病毒检测
对通过试管鳞茎种植大田所得再生植株叶片分别用OYDV、LYSV和GMV试剂盒进行DAS-ELISA检测,用酶标仪读取405nm吸光度值,并与阴性对照、阳性对照吸光度值进行比较。结果表明,未脱毒宝坻大蒜病毒感染比较严重,且为复合型感染(见表4)。
从表4中可以看出,在未脱毒宝坻大蒜中均检测出感染上述三种病毒,但病毒对植株侵染程度不同,这是一种复合侵染的方式。未脱毒大蒜样品OYDV、LYSV和GMV检测结果分别为阴性对照的3.10、6.11和3.11倍,感染情况相当严重。这种可能是导致大蒜品质下降,繁殖系数降低的原因之一。经过花序轴脱毒快繁途径后再生植株样品OYDV、LYSV和GMV检测结果分别为阴性对照的2.9、4.3和1.2倍,达到一定脱毒效果。
表4再生植株叶片ELISA病毒检测结果
6细胞学观察
大蒜是真核细胞生物,染色体的正常形态和结构保证了基因遗传的稳定性,观察大蒜花序轴试管鳞茎再生植株根尖分生组织区的染色体形态和结构,细胞中有16条染色体,并且形态正常,未发现染色体异常现象,因此保证了大蒜种质的遗传稳定性。
本发明构建的大蒜脱毒快繁方法与常规方法的对比试验结果如下:
对比试验:
结论:与常规方法相比,本发明以大蒜花序轴为外植体,构建了从外植体选择、花序轴不定芽诱导、不定芽诱导试管鳞茎、试管鳞茎打破休眠、大田栽培种植、脱毒效果检测、遗传稳定性检测、直到脱毒种蒜获得的完整的方法,省去试管苗生根和移栽,解决了试管苗成活率低的问题。该体系为大蒜脱毒、快繁、保持优良遗传稳定性、提高鳞茎产量及品质等提供了重要的技术依据。
- 还没有人留言评论。精彩留言会获得点赞!