一种益生菌微胶囊的制备方法与流程
本发明涉及微生物技术领域。更具体地,涉及一种益生菌微胶囊的制备方法。
背景技术:
益生菌是一类对宿主有益的活性微生物,是定植于人体肠道、生殖系统内,能产生确切健康功效从而改善宿主微生态平衡、发挥有益作用的活性有益微生物的总称。近年来越来越多的研究证实益生菌能够抑制致病菌生长,消除致癌因子,维持肠道正常菌群,而且具有缓解乳糖不耐症,降低胆固醇,提高免疫力等重要生理功效。
双歧杆菌与乳杆菌是人体肠道内重要有益菌,常作为人体健康的重要标志,然而它们对外界环境较为敏感,极易受到氧、温度、ph值、水分等因素的影响。从益生菌产品加工、贮藏、运输到最终被食用等过程都会影响益生菌的生物活性和存活率。因此对一款益生菌产品而言最终定植于肠道中的活菌数往往低于能够发挥有效作用的理论值,如何保持益生菌的活性和高存活率成为此类产品的关键所在。
电子辐照(electronirradiation)是一种采用高能电子束来照射材料、以改善材料性能的技术。它是利用射线与物质间的作用,电离和激发产生的活化原子与活化分子,使之与物质发生一系列物理、化学等生物化学变化,导致物质的降解、聚合、交联、并发生改性。辐射加工技术已经形成一个新兴产业,辐照加工与常规加工方法相比,具有节能、无环境污染等特点,可进行常温加工。高能射线不仅可以处理被加工物表面,同时可深入其内部,且工艺控制简单。由于辐照技术对材料的形态,辐照温度没有苛刻的要求,且反应快、产品纯度高,易控制,可实行连续操作,因此被认为是一种经济效益高、节约能源、节省人力,无公害或少公害的新加工技术。
甲基纤维素(mc)是一种长链取代纤维素,其中约27%~32%的羟基以甲氧基的形式存在。不同级别的甲基纤维素具有不同的聚合度,其范围为50~1000;而其分子量(平均数)的范围在10000~220000da之间。
mc在无水乙醇、乙醚、丙酮中几乎不溶。水溶液在常温下相当稳定,具有优良的润湿性、分散性、粘接性、增稠性、乳化性、保水性,耐酸性和成膜性,所成膜具有优良的韧性、柔曲性和透明度。纤维素结构规整,具有致密的晶体结构,大量的羟基被封闭,使得反应试剂难以与纤维素反应,限制了纤维素的应用。通过采用电子辐照技术对其进行特殊的处理,将纤维素分子链中的结合键打开,引入新的官能团,就可以改变其固有的特性,增强其耐酸性、保水性、凝胶性、粘结性和成膜性。
低聚半乳糖是一种具有天然属性的功能性低聚糖,其分子结构一般是在半乳糖或葡萄糖分子上连接1-7个半乳糖基,它是人体肠道中双歧杆菌、嗜酸乳杆菌等有益菌极好的营养源和有效的增殖因子。低聚半乳糖还具有较强的耐酸性、耐热性,不会因为在加工过程中的高温杀菌及人体胃酸的分解而失去其本来应有的特性。
微胶囊技术是近几年发展起来的一种比较成熟、用途广泛的高新技术。由于其显著的包埋效果也开始被应用于益生菌制品的保护方面。当前市面上益生菌产品主要存在以下问题:一、未经包埋,直接加入保护剂,然后冻干成粉并包装,在胃里一经释放益生菌很容易受到胃酸、胆盐的破坏;二、包埋中大多采用普通单一壁材,很少使用复配壁材,存在菌种死亡率高,微胶囊耐酸性差等问题。
传统的单层包埋不仅产率低而且包埋效果差,不能对菌体起到很好的保护作用;三层及以上微胶囊包埋技术虽然提高了菌体的稳定性,但是工艺繁琐,耗时,在肠道内益生菌株无法快速定植、释放。
因此,需要提供一种采用电子辐照技术制备得到的新型壁材,在保证益生菌存活率基础上提高益生菌稳定性、耐酸性、肠溶性,增强益生菌肠道释放活力,充分发挥益生菌的有益功效的益生菌微胶囊的制备方法。
技术实现要素:
本发明的目的在于提供一种益生菌微胶囊的制备方法,该方法有效提高了益生菌的活性、稳定性。
为达到上述目的,本发明采用下述技术方案:
本发明提供了一种益生菌微胶囊的制备方法,包括如下步骤:
(1)益生菌株的培养与活化;
(2)离心收集菌体,在菌体中加入复合冷冻干燥保护剂;
(3)包埋:制备菌液,进行包埋,将菌液、包埋壁材溶液与海藻酸钠溶液混合,搅拌后,将菌液混合液滴到氯化钙溶液中,固化后,用无菌水洗涤并过滤;
(4)将步骤(3)得到的微胶囊进行冷冻干燥,即得。
优选地,步骤(1)中所述益生菌均来源于健康人体胃肠道、发酵乳品,包括但不限于具有益生作用的乳杆菌属或双歧杆菌属中的一种或多种菌株的混合物,在中国工业微生物菌种保藏管理中心均可以购得。
本发明益生菌株的培养与活化采用本领域常规技术即可。如:双歧杆菌属的培养与活化:将双歧杆菌菌种接种在ph为6.5-7.0的含琼脂斜面培养基上于37-41℃条件下厌氧培养18-24h,活化2-3次,然后按1%-5%接种量移入液体培养基中于37-41℃条件下扩大培养24-36h。乳杆菌属的培养与活化:将乳杆菌菌种接种在ph为5.5-6.2的含琼脂斜面培养基上于35-40℃条件下培养18-24h,活化2-3次,然后按1%-5%接种量移入液体培养基中于35-40℃扩大培养24-36h。
优选地,步骤(2)中,所述离心是以4000-6000rpm的转速离心6-10min;所述每克菌体加入1-2.5ml复合冷冻干燥保护剂;所述复合冷冻干燥保护剂为甘油0.15-0.25%,甘氨酸0.2-0.5%,乳糖1-2%,山梨醇0.5-1.5%,牛血清白蛋白1.5-2%,在115-121℃条件下灭菌15-20min,冷却后使用。
优选地,步骤(3)中,所述菌液中菌体密度为109cfu/ml以上;所述包埋壁材溶液的浓度为8-15mg/ml;所述海藻酸钠溶液中海藻酸钠的质量百分比为2.5-3.5%;菌液、包埋壁材溶液与海藻酸钠溶液的体积比为1∶(1-30)∶(1-10);所述搅拌为120-160r/min,搅拌25-30min;所述固化的时间为30-60min;
优选地,所述包埋壁材为甲基纤维素-低聚半乳糖接枝共聚物,是通过电子辐照技术制备得到的,具体包括以下步骤:
(1)将甲基纤维素(相对分子质量为40-60kda)按照质量比1:(2-8)加入低聚半乳糖预混后,溶于无菌水中,使其混合均匀,采用阿贝折光仪测定折光率,折光率最终控制在1.35-1.44之间,采用磁力搅拌器搅拌15-20min;
(2)将步骤(1)混合好的溶液,装入耐辐照的pe塑料袋中封存包装,利用4.5-18mev电子束,30-60ma束流,90-120kw额定功率的电子加速器辐照,辐照剂量为20-200kgy,辐照剂量率为5-500kgy/hr,辐照结束后进行超滤处理(分子截留量为80kda),去除未反应的甲基纤维素及低聚半乳糖,收集大于80kda的组分进行冷冻干燥,即得甲基纤维素-低聚半乳糖接枝共聚物。
在微胶囊包埋过程中,包埋壁材选用甲基纤维素-低聚半乳糖接枝共聚物,通过采用电子辐照技术对甲基纤维素进行接枝共聚改性,一方面拓宽了甲基纤维素本身的应用领域和范围,更多的应用于食品技术的开发;另一方面,通过电子辐照处理,可更加宽泛的调节甲基纤维素的界面性质,接枝多糖的无规线团结构有效改善了甲基纤维素的物理稳定性,降低了其对低ph及胃蛋白酶的敏感性,增加了它的凝胶性、成膜性、乳化性、耐酸性等功能性质;第三通过增加侧链的长度有利于增加内层壁材的交联密度,减小凝胶孔隙,提高微胶囊对胃酸的缓冲作用,外加其良好的成膜性,可增强益生菌微胶囊的保水能力,强化益生菌产品的持水性;第四,微胶囊进入肠道释放后,壁材可为益生菌提供益生元,达到一种快速增殖益生菌的作用,可更好的促进益生菌在肠道内活性和数量。
本发明制备的益生菌微胶囊,可以极大提高益生菌株在肠道内的定殖量和存活率,在37℃恒温箱中储存30d,菌株存活率仍保持在79%以上。
本发明的有益效果如下:
本发明通过采用以电子辐照技术制备的甲基纤维素-低聚半乳糖接枝共聚物作为包埋壁材,增强了益生菌制剂在储藏运输过程中的稳定性,有效降低了胃酸、胆盐等对益生菌体的破坏,极大提高了益生菌株在小肠内的数量和活性,利于肠道菌群的调节和改善,极大提高益生菌制品的质量,同时弥补了现有微胶囊技术的不足,操作灵活,适宜工业化生产,另一方面也进一步拓宽了甲基纤维素的应用范围,具有重要的经济意义。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细的说明。
图1示出益生菌微胶囊耐酸性试验结果图。
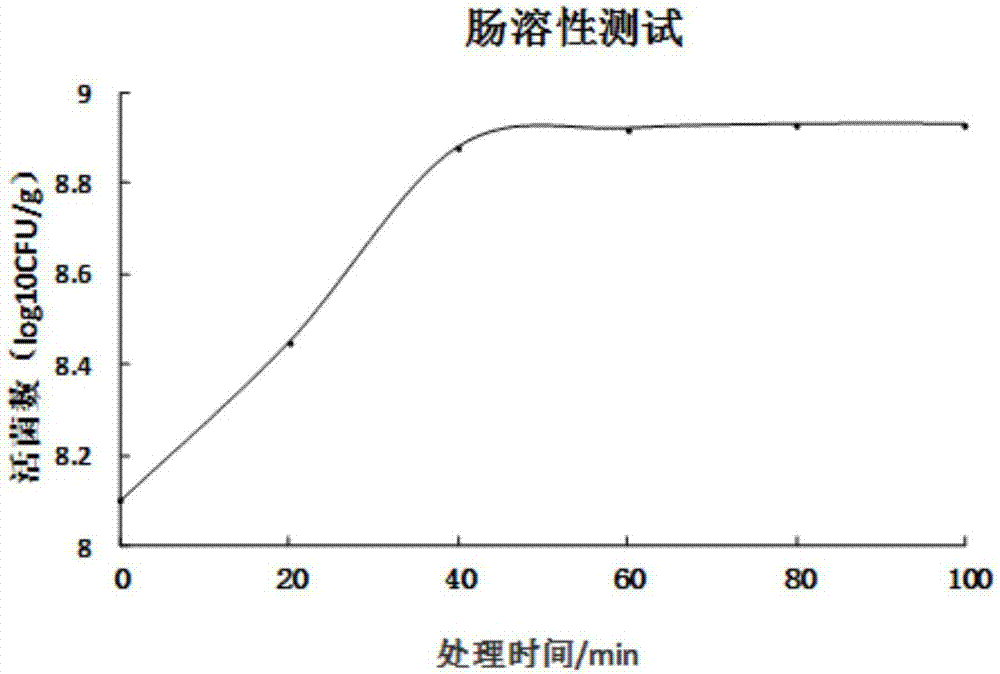
图2示出益生菌微胶囊肠溶性试验结果图。
图3示出益生菌微胶囊储藏稳定性测试结果图。
具体实施方式
为了更清楚地说明本发明,下面结合优选实施例和附图对本发明做进一步的说明。附图中相似的部件以相同的附图标记进行表示。本领域技术人员应当理解,下面所具体描述的内容是说明性的而非限制性的,不应以此限制本发明的保护范围。
实施例1乳双歧杆菌微胶囊的制备
一种乳双歧杆菌微胶囊制备工艺,菌种购买于中国工业微生物菌种保藏管理中心,包括如下具体步骤:
(1)复合冷冻干燥保护剂配制:甘油0.2%,甘氨酸0.5%,乳糖2%,山梨醇0.5%,牛血清白蛋白2%,用蒸馏水定容,使用前在115℃条件下灭菌20min,冷却后使用。
(2)包埋壁材的制备:将甲基纤维素(相对分子质量为40kda)按照质量比为1:2加入低聚半乳糖预混,然后溶于无菌水中,使其混合均匀,采用阿贝折光仪测定折光率,折光率最终控制在1.35。采用磁力搅拌器搅拌15min。将混合好的溶液装入耐辐照的pe塑料袋中封存包装。利用4.5mev电子束,束流30ma,额定功率为90kw的电子加速器辐照,辐照剂量为20kgy,辐照剂量率为5kgy/hr,辐照结束后将辐照后的样品进行超滤处理(分子截留量为80kda),去除未反应的甲基纤维素及低聚半乳糖,收集大于80kda的组分进行冷冻干燥,即得甲基纤维素-低聚半乳糖接枝共聚物。使用前取适量无菌水将其溶解并配制成浓度为8mg/ml的甲基纤维素-低聚半乳糖接枝共聚物溶液。
(3)乳双歧杆菌的培养与活化
将乳双歧杆菌接种在ph为6.8的含琼脂的斜面培养基上于37℃条件下厌氧培养24h,活化3次,然后按1%接种量分别移入液体培养基中于37℃条件下扩大培养24h。
(4)将培养后的菌液置于离心机中以6000rpm的转速离心6min,收集菌体,每克菌体中加入1.5ml已冷却且灭过菌的复合冷冻干燥保护剂。
(5)制备菌液,调整菌体密度为1010cfu/ml。将菌液、步骤(2)制备的甲基纤维素-低聚半乳糖接枝共聚物溶液与3.5%海藻酸钠溶液按照1∶5∶2比例混合均匀,于常温下,120r/min,搅拌25min,然后将菌液混合液滴到1%氯化钙溶液中,在常温下固化30min,最后用无菌水洗涤并过滤。
(6)将上述制备的微胶囊进行冷冻干燥,即得益生菌微胶囊制品。
实施例2嗜酸乳杆菌微胶囊的制备
一种嗜酸乳杆菌微胶囊制备工艺,菌种购买于中国工业微生物菌种保藏管理中心,包括如下具体步骤:
(1)复合冷冻干燥保护剂配制:甘油0.15%,甘氨酸0.2%,乳糖1%,山梨醇1%,牛血清白蛋白1.5%,用蒸馏水定容,使用前在121℃条件下灭菌15min,冷却后使用。
(2)包埋壁材的制备:将甲基纤维素(相对分子质量为50kda)按照质量比为1:8加入低聚半乳糖预混,然后溶于无菌水中,使其混合均匀,采用阿贝折光仪测定折光率,折光率最终控制在1.40左右。最后采用磁力搅拌器搅拌20min。将混合好的溶液装入耐辐照的pe塑料袋中封存包装。利用10mev电子束,束流30ma,额定功率为120kw的电子加速器辐照,辐照剂量为200kgy,辐照剂量率为50kgy/hr,辐照结束后将辐照后的样品进行超滤处理(分子截留量为80kda),去除未反应的甲基纤维素及低聚半乳糖,收集大于80kda的组分进行冷冻干燥,即得甲基纤维素-低聚半乳糖接枝共聚物。使用前取适量无菌水将其溶解并配制浓度为15mg/ml的甲基纤维素-低聚半乳糖接枝共聚物溶液。
(3)嗜酸乳杆菌的培养与活化:将嗜酸乳杆菌菌种接种在ph为5.5的含琼脂斜面培养基上于37℃条件下培养18h,活化3次,然后按1%接种量移入液体培养基中于37℃扩大培养30h。
(4)将培养后的菌液置于离心机中以4000rpm的转速离心10min,收集菌体。每克菌体中加入2ml已冷却且灭过菌的复合冷冻干燥保护剂。
(5)制备菌悬液,调整菌体密度为109cfu/ml。将菌液、步骤(2)制备甲基纤维素-低聚半乳糖接枝共聚物溶液与3.5%海藻酸钠溶液按照1∶15∶10比例混合均匀,于常温下,160r/min,搅拌30min,然后将菌液混合液滴到6%氯化钙溶液中,在常温下固化60min,最后用无菌水洗涤并过滤。
(6)将上述制备的微胶囊进行冷冻干燥,即得益生菌微胶囊制品。
实施例3长双歧杆菌微胶囊的制备
一种长双歧杆菌微胶囊制备工艺,菌种购买于中国工业微生物菌种保藏管理中心,包括如下具体步骤:
(1)复合冷冻干燥保护剂配制:甘油0.25%,甘氨酸0.3%,乳糖1%,山梨醇1.5%,牛血清白蛋白2%,用蒸馏水定容,使用前在118℃条件下灭菌18min,冷却后使用。
(2)包埋壁材的制备:将甲基纤维素(相对分子质量为60kda)按照质量比为1:6加入低聚半乳糖预混,然后溶于无菌水中,使其混合均匀,采用阿贝折光仪测定折光率,折光率最终控制在1.44左右。最后采用磁力搅拌器搅拌20min。将混合好的溶液装入耐辐照的pe塑料袋中封存包装。利用10mev电子束,束流45ma,额定功率为115kw的电子加速器辐照,辐照剂量为200kgy,辐照剂量率为500kgy/hr,辐照结束后将辐照后的样品进行超滤处理(分子截留量为80kda),去除未反应的甲基纤维素及低聚半乳糖,收集大于80kda的组分进行冷冻干燥,即得甲基纤维素-低聚半乳糖接枝共聚物。使用前取适量无菌水将其溶解并配制15mg/ml的溶液。
(3)长双歧杆菌的培养与活化
将长双歧杆菌接种在ph为6.8的含琼脂的斜面培养基上于37℃条件下厌氧培养18h,活化3次,然后按2%接种量移入液体培养基中于37℃条件下进行厌氧扩大培养,培养时间为36h。
(4)将培养后的菌液置于离心机中以4000rpm的转速离心10min,收集菌体。每克菌体中加入1ml已冷却灭过菌的复合冷冻干燥保护剂。
(5)制备菌液,调整菌体密度为1010cfu/ml。将菌液、步骤(2)制备甲基纤维素-低聚半乳糖接枝共聚物溶液与3.5%海藻酸钠溶液按照1∶30∶10比例混合均匀,于常温下,140r/min,搅拌45min,然后将菌液混合液滴到2%氯化钙溶液中,在常温下固化40min,最后用无菌水洗涤并过滤。
(6)将上述制备的微胶囊进行冷冻干燥,即得益生菌微胶囊制品。
对比例1一种乳双歧杆菌微胶囊的制备
以微胶囊常用壁材海藻酸钠代替甲基纤维素-低聚半乳糖接枝共聚物,参照实施例1的方法直接制备乳双歧杆菌微胶囊,其中菌液与3.5%海藻酸钠溶液的添加比例为1∶5。
试验例1益生菌微胶囊菌种耐酸性、包埋率、肠溶性及储藏稳定性的测定
对本发明方法制备得到的益生菌微胶囊进行了在模拟胃液和模拟肠液内溶解性能及储藏稳定性的进行测定。以实施例1制备的乳双歧杆菌微胶囊为例进行详细说明。
(1)模拟胃液配制:取2.0氯化钠和3.2g胃蛋白酶(标识应为每mg中含800~2500个活度单位),加7.0ml盐酸和水使溶解至1000ml,调节ph值至1.2,最后用0.22μm滤膜过滤除菌。
(2)模拟肠液配制:取磷酸二氢钾6.8g,加水250ml使溶解,加0.2mol/l氢氧化钠溶液77ml和500ml水,再加胰酶10g使溶解后,用0.2mol/l氢氧化钠溶液或0.2mol/l盐酸溶液调节ph值至6.8±0.1,再加水稀释定容至1000ml,用0.22μm滤膜过滤除菌。
(3)耐酸性测试:精确称取制备好的乳双歧杆菌微胶囊制剂0.5g,将其置于盛有49.5ml模拟胃液的锥形瓶内,在温度37℃,120rpm/min震荡培养2.5h,每隔30min吸取0.5ml样品溶液置于模拟肠液中,震荡培养2h,使菌体完全释放,并从中吸取0.5ml样液用pbs缓冲液作梯度稀释,测定活菌数,并计算菌体存活率。同时以未经包埋的乳双歧杆菌制剂作空白对照,方法同上。
菌体存活率=外界条件处理后测定的活菌数/包埋前活菌数×100%
耐酸性测试结果如图1所示,从图1可以看出:益生菌在模拟胃液中的活菌数下降幅度较小,几乎可以忽略,2.5h之后包埋样品存活率由90.28%下降到87.85%,而未包埋样品存活率则由92.75%下降到2.15%,这说明包埋后的微胶囊耐酸能力很强,能够有效保护益生菌体。
(4)包埋率测定
包埋率测定具体方法如下:精确称取0.5g制备好的乳双歧杆菌微胶囊制剂,加入到49.5ml预热的磷酸盐缓冲液中(37℃,0.1mol/lnah2po4,ph8.0),通过高速均质机使其破碎,然后震荡此破碎液约30min,使包埋壁材完全释放所包埋的乳双歧杆菌,最后从中吸取0.5ml样液用pbs缓冲液作梯度稀释,测定活菌数。
包埋率/%=微胶囊中的活菌总数/包埋前活菌数×100%
包埋率是评价微胶囊的重要指标,经测定本发明微胶囊包埋率达到95.8%。
(5)肠溶性测试:精确称取制备好的乳双歧杆菌微胶囊制剂0.5g,将其置于盛有49.5ml模拟肠液的锥形瓶内,在温度37℃,120rpm/min震荡培养2.5h,每隔20min,从中吸取0.5ml样液用pbs缓冲液作梯度稀释,测定活菌数。结果如图2所示,从图2中可以看出,在小肠内,微胶囊包埋益生菌体在40min左右基本完全溶解,这表明其具有较好的肠溶解能力。
(6)储藏稳定性测试:取制备好的乳双歧杆菌微胶囊分别置于4℃、37℃恒温箱中储存30d,每隔6d取样,测定菌种存活率。结果如图3所示,从图3中可以看出,益生菌微胶囊制剂在储存30d时,37℃条件下菌体存活率仍大于79%,这表明本发明的制备方案具有实际的应用价值。
同时本发明对对比例1制备的乳双歧杆菌微胶囊制剂,根据上述方法进行了耐酸性、包埋率、肠溶性及储藏稳定性测试,测试结果见表1。对照表1中的指标,发现应用甲基纤维素-低聚半乳糖接枝共聚物作为包埋壁材时,同常用壁材海藻酸钠相比,致密性及保水性方面更好,包埋率、耐酸性、肠溶性能、储藏稳定性等指标都得到了很大的改善,更有利于保障益生菌体在体内体外的活性和稳定性。
表1不同包埋壁材条件下性能比较
本发明进一步对实施例2和实施例3制备的嗜酸乳杆菌微胶囊制剂和长双歧杆菌微胶囊制剂,进行了耐酸性、包埋率、肠溶性及储藏稳定性的测定,经测定,结果与上述实施例1制备的乳双歧杆菌微胶囊关于菌种耐酸性、包埋率、肠溶性及储藏稳定性一致,表明本发明微胶囊制备方法具有实际应用价值。
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定,对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动,这里无法对所有的实施方式予以穷举,凡是属于本发明的技术方案所引伸出的显而易见的变化或变动仍处于本发明的保护范围之列。
- 还没有人留言评论。精彩留言会获得点赞!