红树莓汁乳酸菌混菌发酵饮料及其制备方法
本发明属于发酵饮料制备技术领域,具体涉及一种红树莓汁乳酸菌混菌发酵饮料及其制备方法。
背景技术:
随着人们日益增长的对美好生活的需求,人们对食品安全性、健康性要求越来越高。红树莓作为第三代水果,具有丰富的营养价值和药用价值。但是成熟后的红树莓因其独特的外形结构,非常不易于贮藏以及运输,致使红树莓的营养价值和利用率没有得到充分的发挥、利用和提升。我国红树莓的种植起步较晚,对于红树莓生产工艺的研究和开发更是比较落后,停留在加工过程简单、技术相对滞后的初级阶段。目前,我国对于红树莓饮料的研究和开发大部集中在复合型饮料,红树莓酸奶,亦或是酵母菌发酵的红树莓保健酒。如夏元春等将红树莓与芦荟进行结合制出复合保健型饮料。易美君等将红树莓与薏米结合制出复合饮料。张强等研究了红树莓果醋自然发酵工艺并分析了其香气成分。魏东东等用红树莓研制了红树莓酵素并对优势菌株进行了分离鉴定;李亮亮等进行了红树莓果酒的研制。红树莓汁饮料产品类型多为复合果蔬汁调配型饮料,而关于添加益生菌发酵红树莓制备饮料的相关工艺研究相对较少。
由于我国红树莓的种植起步较晚,对于红树莓生产工艺的研究和开发更是比较落后,停留在加工过程简单、技术相对滞后的初级阶段,并且红树莓汁在发酵过程中,乳酸菌生长情况会受到培养条件、发酵温度、发酵时间等因素等影响,进而影响饮料的品质,因此,采用红树莓汁为原料,添加益生菌对其进行发酵,优化其工艺条件,增加红树莓发酵饮料产品类型,对红树莓的深加工具有重要意义。
技术实现要素:
本发明的目的在于提供一种红树莓汁乳酸菌混菌发酵饮料及其制备方法。
本发明所用菌株为经过筛选得到的适合发酵红树莓的乳酸菌菌株,即植物乳杆菌(lactobacillusplantarum)rs13和鼠李糖乳杆菌(lactobacillusrhamnosus)lr-05,l.plantarumrs13菌株分离自树莓酵素中,分离筛选鉴定见文献(红树莓酵素发酵过程中优势菌株的分离鉴定;魏东东,常曼曼,阴芳冉,于宏伟,郭润芳,河北农业大学学报),l.rhamnosuslr-05分离自商品化益生菌粉,即鼠李糖乳杆菌hn001。
本发明公开了一种红树莓汁乳酸菌混菌发酵饮料,所述混菌发酵饮料是以红树莓汁为原料,添加碳源、氮源及酸度调节剂,经植物乳杆菌rs13和鼠李糖乳杆菌lr-05-281混菌发酵,添加甜味剂及稳定剂后制成。
所述植物乳杆菌rs13和鼠李糖乳杆菌lr-05的菌株添加量比为1:1,接菌量为红树莓汁的2%。
所述碳源为葡萄糖,所述氮源为磷酸氢二胺,所述酸度调节剂为柠檬酸和柠檬酸钠,所述甜味剂为菊糖,所述稳定剂为黄原胶、cmc-na及果胶。
本发明还公开了红树莓汁乳酸菌混菌发酵饮料的制备方法,按照如下步骤进行:
s1:将植物乳杆菌rs13和鼠李糖乳杆菌lr-05分别置于mrs肉汤培养基中,37℃静置培养,进行活化和复壮;
s2:将红树莓果实用榨汁机打浆,离心,再经过两层纱布过滤后,加入葡萄糖、磷酸氢二胺、酸度调节剂柠檬酸钠和柠檬酸,于65-68℃条件下灭菌30min后冷却保存备用;
s3:将植物乳杆菌rs13和鼠李糖乳杆菌lr-05接种到红树莓汁中,在34~38℃温度范围内发酵32-36小时得到红树莓发酵汁;
s4:红树莓发酵汁中加入菊糖,使菊糖的浓度控制在0.20-0.25%;
s5:红树莓发酵汁加入黄原胶、cmc-na及果胶,制得红树莓汁乳酸菌混菌发酵饮料。
所述步骤s2中葡萄糖的添加量为红树莓汁的6.23%;所述磷酸氢二胺的添加量为红树莓汁3%;所述酸度调节剂柠檬酸钠和柠檬酸的添加量为使调节初始ph值在4.5。
所述步骤s3中植物乳杆菌rs13和鼠李糖乳杆菌lr-05的接种量为2%,两种菌的比例为1:1;所述发酵温度为36℃,所述发酵时间为36h。
所述步骤s4中菊糖的浓度为0.20%。
所述步骤s5中黄原胶浓度为0.05%,cmc-na浓度为0.08%,果胶浓度为0.08%。
本发明还公开了红树莓汁乳酸菌混菌发酵饮料的储藏条件及最佳饮用时间,储藏条件为4℃状态下贮藏,最佳饮用时间为自生产日期起5周内。
有益效果:本发明的红树莓汁乳酸菌发酵饮料风味独特、口感酸甜、营养价值丰富且具有一定保健功能,确定了发酵饮料的最佳贮藏条件和贮藏时间不仅利用了其卓越的营养和药用价值,还解决了红树莓运输难、不易贮藏、利用率低的问题,同时为红树莓的深加工提供了科学依据,是红树莓深加工的技术延伸。
附图说明
图1为发酵菌种配比对ph的影响图;
图2为发酵菌种配比对活菌数的影响图;
图3为不同碳源对发酵红树莓汁ph值的影响图;
图4为不同碳源对发酵红树莓汁活菌数的影响图;
图5为葡萄糖浓度对红树莓汁发酵ph值的影响图;
图6为葡萄糖浓度对红树莓汁发酵活菌数的影响图;
图7为不同氮源对发酵红树莓汁ph值的影响图;
图8为不同氮源对发酵红树莓汁活菌数的影响图;
图9为磷酸氢二胺浓度对红树莓汁发酵ph的影响图;
图10为磷酸氢二胺浓度对红树莓汁发酵活菌数的影响图;
图11为初始ph值对红树莓汁发酵ph的影响图;
图12为初始ph值对红树莓汁发酵活菌数的影响图;
图13为乳酸菌接菌量对活菌数的影响图,图中a、b表示用spss20duncan氏新复极差法检验同一性能在0.01水平上的差异性,字母相同表示差异不显著,字母不同表示差异显著。
图14为发酵温度对活菌数及ph值的影响图;
图15为发酵时间对活菌数及ph值的影响图;
图16为菊糖添加量对发酵红树莓汁感官得分及糖酸比的影响图;
图17为稳定剂添加量对发酵红树莓汁离心率的影响图;
图18为稳定剂复合配比优化的等高线叠加图;
图19为低温贮藏对饮料活菌数及ph值的影响图。
具体实施方式
为了便于理解本发明,下面将对本发明进行更全面的描述。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
实施例1红树莓汁发酵菌种的配比选择
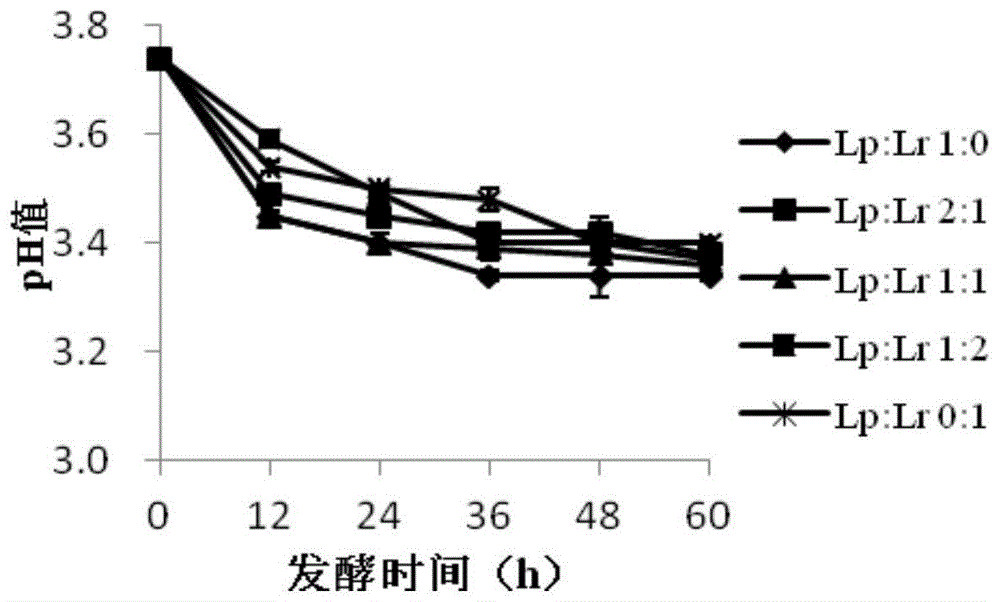
将红树莓果实用榨汁机打浆,离心,再经过两层纱布过滤后,得到红树莓汁,将红树莓汁进行巴氏灭菌(65-68℃,30min)处理后保存备用。将保存于实验室的植物乳杆菌(lactobacillusplantarum)rs13和鼠李糖乳杆菌(lactobacillusrhamnosus)lr-05的保藏培养物分别以一定比例置于mrs肉汤培养基中,37℃静置培养,进行活化和复壮。植物乳杆菌:鼠李糖乳酸菌按照1:0、1:1、1:2、2:1、0:1的发酵比例,以3%的接种量投入红树莓汁中,37℃发酵60h,每隔12h测定其ph值和活菌数,根据红树莓汁在发酵过程中测定指标的变化,确定发酵红树莓汁的最佳比例。
以不同配比的乳酸菌发酵剂对红树莓汁进行发酵,ph值和活菌数的变化结果如图1-2所示,5组红树莓发酵汁其ph值均呈现下降的趋势,在发酵0-36h时,ph值下降迅速,36h之后ph值的下降幅度变缓,维持在3.4左右;而乳酸菌活菌数发酵36h后明显下降,比较不同菌株配比的指标发现,lp:lr为1:1的ph值及活菌数分别为3.4、3.9×107cfu/ml,发酵效果优于其他两组。因此选择lp:lr为1:1作为最佳菌株配比进行发酵研究。
实施例2培养基质对发酵红树莓汁的影响
(1)碳源对红树莓汁发酵的影响
选择葡萄糖、蔗糖和乳糖3种糖作为补充碳源,分别以2%的添加量投入红树莓汁中,进行巴氏灭菌,待冷却后以3%的接菌量接入混合菌种(植物乳杆菌:鼠李糖乳酸菌1:1),37℃发酵60h,每隔12h测定其ph值和活菌数,根据不同碳源各测定指标的变化曲线,筛选出乳酸菌利用效果最好的糖类,作为唯一的补充碳源。
浓度的选择:配料时,设定碳源浓度分别为0、4、6、8和10%,相同条件下培养、测定,根据测定指标的曲线变化,综合选出最适合发酵红树莓汁的碳源浓度。并以空白组即为原汁为对照,ph值和活菌数的变化结果如图3-4所示,在24h时,4组ph值的下降值分别为0.14、0.35、0.34和0.28;乳酸菌发酵初始值均为3.9×107cfu/ml,在发酵24h时空白组活菌数为2.6×109cfu/ml,葡萄糖组的活菌数为6.5×1010cfu/ml,是空白组的24.9倍;乳糖组的活菌数为8.2×109cfu/ml,是空白组的3.1倍;蔗糖组的活菌数为1.3×109cfu/ml,是空白组的4.9倍,即相比于空白组,其它3组在发酵过程中的ph值指标及活菌数指标均优于空白组。综合比较得知葡萄糖被乳酸菌利用的效果优于乳糖和蔗糖,导致这种现象的原因是由于葡萄糖属于单糖,而蔗糖和乳糖属于二糖,因此在被乳酸菌利用时,葡萄糖被相对较为容易,因此选择葡萄糖作为唯一补充碳源,发酵效果较好。
不同浓度的葡萄糖进行发酵,ph值和活菌数的变化结果如图5-6所示,不同浓度葡萄糖的红树莓汁在发酵过程中ph值逐渐降低,而活菌数逐渐升高,36h达到最大值,分别为3.8×1010cfu/ml、1.8×1011cfu/ml、7.4×1011cfu/ml、5.5×1012cfu/ml和5.9×1011cfu/ml。5组处理中,添加量为8%的处理组活菌数最具优势水平,其在36h的活菌数是空白组活菌数最大值的142.6倍。结果说明,8%葡萄糖已能够满足乳酸菌成长需求,故综合考虑ph值和活菌数两测定指标,发酵基质中的葡萄糖浓度水平设定为6%、8%和10%。
(2)氮源对发酵红树莓汁的影响
选择蛋白胨、硫酸铵和磷酸氢二胺3种氮源,分别以2%的添加量投入红树莓汁中,进行巴氏灭菌,待冷却后以3%的接菌量接入混合菌种(植物乳杆菌:鼠李糖乳酸菌1:1),37℃发酵60h,每隔12h测定其ph值和活菌数,根据不同氮源各测定指标的变化曲线,筛选出乳酸菌利用效果最好的氮源,作为唯一的补充氮源。
浓度的选择:配料时,设定氮源浓度分别为0、1.0、1.5、2和2.5%,相同条件下培养、测定,根据测定指标的曲线变化,综合选出最适合发酵红树莓汁的氮源浓度。
空白组即为原汁作为对照组,ph值和活菌数的变化结果如图7-8所示,在发酵过程中,各组的ph值逐渐降低;而乳酸菌活菌数在24-36h达到最大,最大值分别为空白组2.6×109cfu/ml、蛋白胨组4.1×1011cfu/ml、硫酸铵组6.1×109cfu/ml和磷酸二氢铵组4.5×1012cfu/ml,蛋白胨组、硫酸铵组和磷酸氢二胺组活菌数分别是空白组154.9倍、2.3倍、1706.1倍。综合比较发现,加入磷酸氢二胺作为补充氮源,发酵迅速,产乳酸多,乳酸菌利用效果相较于其它两种氮源较好,分析认为由于磷酸氢二胺显弱碱性,结合了红树莓汁中的氢离子,对红树莓汁的ph值进行了上调,更接近乳酸菌生长的最适ph值,且在发酵后期活菌数依然处于优势水平,保证了果汁含有较高的活菌数,故选择磷酸氢二胺作为补充碳源,为乳酸菌发酵提供营养条件效果较好。
添加不同浓度的磷酸氢二胺进行发酵,ph值和活菌数的变化结果如图9-10所示,5组处理随着磷酸氢二胺添加量的增多,ph值下降速度加快,在发酵前24h内ph值下降幅度较大,ph值的的减小量分别为0.05、0.15、0.37、0.6和0.79;而空白组、添加磷酸氢二胺1%、添加磷酸氢二胺1.5%和添加磷酸氢二胺2.0%的红树莓汁在发酵24h时活菌数在发酵整个阶段达到最大值,分别为3.8×1010cfu/ml、6.9×1012cfu/ml、1.5×1013cfu/ml和3.6×1013cfu/ml,而添加磷酸氢二胺2.5%的红树莓汁在36h时达到整个发酵阶段最大值,活菌数为1.6×1014cfu/ml,综合考虑到ph值、活菌数、果汁品质以及生产成本,发酵基质中的磷酸氢二胺浓度水平设定为1%、2%和3%。
(3)初始ph值对红树莓汁发酵的影响
发酵基质的ph值影响着乳酸菌生长及乳酸的积累。红树莓原汁ph较低,影响乳酸菌生长,本试验对红树莓汁发酵基质初始ph值进行调节。试验选用柠檬酸和柠檬酸钠对对发酵基质的初始ph进行调节,设置4个处理组,分别为3.5、4.0、4.5和5.0,空白组为原汁,进行巴氏灭菌,待冷却后以接种量3%的混合菌种(lp:lr1:1),37℃发酵60h,每隔12h测定其ph值和活菌数,根据测定指标的曲线变化,综合选出最适合发酵红树莓汁的初始ph值。发酵过程中ph值和活菌数的变化结果如图11-12所示,发酵过程中,各处理组的ph逐渐降低,而活菌数在发酵36h达到最大,分别为2.4×109cfu/ml、1.9×109、4.4×1010cfu/ml,和1.5×1010cfu/ml。调节ph后的红树莓发酵汁的指标均优于空白组。红树莓汁初始ph值的不同,使得发酵过程中的活菌数发生较大差异,且发酵基质初始ph值从4.5继续升高到5.0后,乳酸菌活菌数反而降低,考虑到果汁红树莓果香、质量和成本,故将初始ph值设置在3.5-4.5。
(4)发酵基质响应面优化
根据原料配比单因素试验结果,利用软件design-exper8.0,采用box-benhnkendesign(bbd)中心组合设计法进行分析用以预测最佳原料配比条件。参数及范围如下:发酵时葡萄糖添加量a为-1-1(6%-10%)、磷酸氢二胺添加量b为-1-1(1%-3%)、果汁初始ph值c为-1-1(3,5-4,5)。此次试验将a、b、c设为三个因素,以活菌数和ph值为评分指标进行优化,试验共设计17组试验方案,其中包含12组析因试验点,5组中心试验点,用以减小试验误差,试验各因素水平见表1。
表1发酵基质box-benhnken中心组合设计表
根据预试验结果,利用design-exper8.0.6进行响应面设计,发酵基质响应面试验设计及结果如表2所示。
表2发酵基质响应面试验设计及结果
采用box-benhnkendesign(bbd)中心组合设计法利用design-expert8.0软件对17组试验数据进行分析,建立活菌数(x)对发酵时葡萄糖添加量(a)、磷酸氢二胺添加量(b)和果汁初始ph值(c)的回归模型,回归方程如下:x=17.63-0.22a-0.20b+1.62c-0.62ab-0.89ac+0.20bc-0.98a2-0.25b2-1.09c2
x为乳酸菌活菌数,a、b、c为发酵基质中各参数编码。而方程r2=0.902,adjr2=0.7657,说明此方程可应用于预测,且精确度较高。
由design-expert8.0.6软件进行分析并根据响应面结果得到红树莓汁发酵基质预测最优条件为:碳源浓度6.23%、氮源浓度3%、初始ph值4.5,预测乳酸菌活菌数对数值可达到18.6894,并且具有可行性。为了验证响应面得到的最佳条件是否具有效性,进行实际操作验证试验。将发酵基质参数设置为碳源浓度6.23%、氮源浓度3%、初始ph值4.5,进行3次重复试验,得到的发酵汁ph值为3.86,其乳酸菌活菌数对数值为18.242,与预测的结果相差2.4%,试验表明实际操作结果与预测值接近,证明响应面得到的红树莓汁发酵基质参数具有可行性,存在一定价值。
实施例3红树莓汁乳酸菌发酵条件优化
(1)接种量对红树莓汁发酵的影响
将优化发酵基质后的红树莓汁进行巴氏灭菌,待冷却后,接入分别为1、2、3、4和5%的混合菌种(lp:lr1:1),在37℃发酵36h,测定其ph值和活菌数,根据测定指标的曲线变化,综合选出最适合红树莓汁发酵的乳酸菌接种量。不同接菌量对红树莓发酵基质进行发酵,ph值和活菌数的变化结果见图13。如图13所示,随着接种量的增加,ph值迅速降低,表明产酸迅速加快;而活菌数最高的处理组为2%接菌量,达到3.14×1019cfu/ml,且与其它组相比,变化极显著(p<0.01),故综合考虑,接菌量选2%。
(2)发酵温度对红树莓汁发酵的影响
将优化发酵基质后的红树莓汁进行巴氏灭菌,待冷却后,根据以上试验得到的最佳接种量进行接菌(2%),并分别在30、32、34、36、38和40℃条件下发酵36h,测定其ph值和活菌数,根据测定指标的曲线变化,综合选出最适合红树莓汁发酵的温度。ph值和活菌数的变化结果如图14所示,乳酸菌活菌数随着发酵温度的升高呈先升后降的趋势,发酵温度在34-38℃范围内时,活菌数数量较高,在36℃时活菌数最大,达9.6×1019cfu/ml,与其它温度差异极显著(p<0.01),;而ph值随发酵温度的增加逐渐下降。综合考虑两个指标,发酵温度设为36℃。
(3)发酵时间对红树莓汁发酵的影响
将优化发酵基质后的红树莓汁进行巴氏灭菌,待冷却后,根据以上试验得到的最佳接种量进行接菌(2%)并在最佳发酵温度下进行培养(36℃),分别发酵24、28、32、36和40h,测定其ph值和活菌数,根据测定指标的曲线变化,综合选出最适合红树莓汁发酵的时间。发酵汁的ph值和活菌数的变化结果见图15。如图15所示,乳酸菌活菌数随着发酵时间的延长呈先升后降的趋势,发酵36h,活菌数最大,为3.0×1019cfu/ml,且与其它处理差异极显著(p<0.01),;而ph值始终呈下降的趋势。综合考虑,发酵时间设为36h。
(4)糖酸比调配
红树莓发酵汁不经调配口感微酸,影响发酵汁口感。菊糖作为甜味剂,恰好可以调节饮料的糖酸比,并且作为一种低聚果糖,在被摄入人体以后消化系统不会对其分解利用,不会提供热量,并且食用适量菊糖对人体具有一定保健功能。因此本试验以菊糖调节糖酸比,根据总酸度的测定方法测定红树莓发酵汁的酸度,并用阿贝折光仪测定可溶性固形物。以糖酸比和感官评分为测定指标,研究发酵红树莓汁的最佳糖酸比,使红树莓发酵汁更佳符合消费者口感。以不同添加量的菊糖调配红树莓发酵汁,糖酸比和感官得分的结果如图16所示,随着菊糖添加量的越来越高,其糖酸比呈逐渐升高的趋势,而感官得分则是先升高后降低。糖酸比为0.20-0.25%时,感官得分较高,均达到90分以上,说明此时风味较好,口感容易被接受,综合考虑菊糖添加量设为0.20%。
(5)稳定剂调配
发酵汁长期放置还会有分层现象,影响发酵汁整体品质。本试验对稳定剂调配进行研究,不仅防止发酵汁发生分层和沉淀,增加发酵汁稳定性,还可以提升其品质。而单一的稳定剂稳定效果欠佳且国家相关标准限值最大用量为0.3%,因此本试验对发酵汁进行稳定剂调配,在单一稳定剂稳定性的研究基础上,探究使用多种稳定剂复配的最佳效果。本试验首先考察单一稳定剂即果胶、黄原胶、cmc-na、卡拉胶和海藻酸钠添加量对饮料稳定性的影响,然后探究复合稳定剂的配比及稳定性情况。
首先,进行稳定剂单因素实验,选用果胶、黄原胶、cmc-na、卡拉胶和海藻酸钠5种稳定剂,添加量均分别设为0、0.05、0.10、0.15、0.20和0.25%进行单一稳定剂调配试验,以此研究稳定剂复合配比。以不同稳定剂调配红树莓发酵汁,离心率和粘稠度的结果见图17及表3。如图17所示,5种稳定剂均随着添加量的增加,红树莓汁的离心率下降速度先剧烈后逐渐缓慢,即下层沉淀物质越来越少。其中黄原胶稳定剂稳定性效果最好,离心率最低,说明红树莓汁中的沉淀物质最少,且当黄原胶其添加量大于0.04%,离心率变化缓慢,结合表2各稳定剂不同用量粘稠度的影响,当黄原胶添加量为0.04%时,离心率效果显著(p<0.01),且口感较好,流动性不粘滞,故综合考虑离心率急剧变化的范围及饮料的粘稠度,选择0.04%作为黄原胶的临界控制点。其次稳定效果较好的为果胶和cmc-na,其浓度大于0.08%,趋于变慢,结合表3各稳定剂不同用量粘稠度的影响,当果胶和cmc-na添加量为0.08%时,红树莓汁离心率效果显著(p<0.01),且口感较好,流动性不粘滞,故综合考虑离心率急剧变化的范围及饮料的粘稠度,选择0.08%作为果胶和cmc-na的临界控制点。而卡拉胶和海藻酸钠与其它稳定剂相比,在整个浓度考察范围内,离心率变化相当较为缓慢,且口感较为稀薄,粘度小,对饮料稳定性改善作用相对较小。因此,本试验中各稳定剂对饮料稳定性效果依次是黄原胶>果胶>cmc-na>卡拉胶>海藻酸钠,故选择黄原胶、果胶及cmc-na进行稳定剂复配试验。
表3各稳定剂不同用量粘稠度的影响
注:图中+表示粘稠度。
在单一稳定剂试验的基础上,利用软件design-exper8.0,采用box-benhnkendesign(bbd)中心组合设计法进行分析用以预测复合稳定剂的配比。参数及范围如下:黄原胶a为-1~1(0.02%~0.06%)、cmc-nab为-1~1(1、0.06%~0.10%)、果胶c为-1~1(0.06%~0.10%)。此次试验将a、b、c设为三个因素,以活菌数和ph值为评分指标进行优化,试验共设计17组试验方案,其中包含12组析因试验点,5组中心试验点,用以减小试验误差,试验各因素水平见表4。
表4复合稳定剂box-benhnken中心组合设计表
试验设计及结果如表5所示。采用box-benhnkendesign(bbd)中心组合设计法利用design-expert8.0软件对17组试验数据进行分析,分别建立离心率(y1)及感官得分(y2)对黄原胶(a)、果胶(b)和cmc-na(c)的回归模型,回归方程如下:
y1=+0.41-0.12a-0.98b-0.71c-0.040ab+0.038ac-0.030bc+0.042a2+0.084b2+0.062c2
y2=+87.00-0.12a-2.50b-2.88c-1.00ab-0.25ac-1.00bc-8.88a2-13.33b2-7.37c2
y1、y2分别为离心率和感官得分,a、b、c为各个稳定剂参数编码。而方程r1=0.9703,adjr1=0.9322,r2=0.9132,adjr2=0.8016,说明此方程可应用于预测,且精确度较高。
表5复合稳定剂响应面试验设计及结果
各三维响应面在所选范围内均存在极值,即每个响应面均有各自对响应值影响较高的优势范围,而复合稳定剂响应面中的3个因素中黄原胶(a)与果胶(c)对离心率响应值(y1)和感官得分响应值(y2)的影响作用较大,因此将响应面的等高线图进行叠加,从而缩小优势范围,图18即为稳定剂复合配比优化的等高线叠加图。将两个响应面的等高线图进行叠加,可以通过观察交集,直观的观察出两个指标同时满足优势水平的范围为:黄原胶浓度0.04%-0.05%,cmc-na浓度0.07%-0.08%,果胶浓度0.08%-0.09%,结合design-expert8.0.6软件box-benhnkendesign试验得出的结果,综合确定双响应值的最佳稳定剂复合配比为:黄原胶浓度为0.05%,cmc-na浓度为0.08%,果胶浓度为0.08%,离心率的理论预测值为0.37%,感官得分为86分。依据预测的优势稳定剂复合配比进行试验,设计3次重复试验以验证预测条件的可行性及有效性。结果显示,此条件下的离心率和感官得分的实际值分别为0.36%、87分,即实际试验值与模型预测结果接近,离心率与预测值相差2.7%,感官得分与预测值相比相差1.2%,误差较小。试验表明实际操作结果与预测值接近,证明响应面得到的稳定剂参数的复合配比具有可行性。
实施例4红树莓汁乳酸菌混菌发酵饮料贮藏稳定性研究
选择低温(4℃)贮藏方式,对活菌型红树莓汁乳酸菌混菌发酵饮料贮藏稳定性研究试验。在低温(4℃)条件下,每隔7d对红树莓汁饮料其ph值和活菌数两个测定指标进行测定,探究ph值和活菌数变化规律。通过研究活菌型红树莓汁乳酸菌混菌发酵饮料贮藏稳定性,对饮料在低温贮藏下的货架期进行预测,为红树莓汁乳酸菌混菌发酵饮料的贮藏提供科学的理论依据。饮料ph值和活菌数的变化结果如图19所示,红树莓汁乳酸菌混菌发酵饮料在低温条件下贮藏,红树莓汁乳酸菌混菌发酵饮料其ph值及活菌数的变化对相对缓慢,在低温条件贮藏5周,活菌数从2.6×1019cfu/ml降低至3.8×1011cfu/ml,ph值从3.85降至3.28;当贮6周后,活菌数降为1.9×1010cfu/ml,ph值降至3.14,虽然贮藏6周活菌数仍然满足国标要求,但此时饮料口感果酸,考虑到绝大多数消费者的口感需求以及果汁饮料的营养价值和品质,故将低温状态下贮藏的红树莓汁乳酸菌混菌发酵饮料保存时间定为5周内饮用,饮料品质最佳。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!