植入后可扩展的外科心脏瓣膜构造的制作方法
本申请根据美国法典35U.S.C.§119要求2012年12月31日提交的美国临时申请序列号US 61/748,022的优先权。本申请也涉及2008年9月19日提交的题为“Prosthetic Heart Valve Configured to Receive a Percutaneous Prosthetic Heart Valve Implantation(构造成接收经皮人工心脏瓣膜植入的人工心脏瓣膜)”的美国专利申请序列号US 12/234,559并涉及2008年9月19日提交的题为“Annuloplasty Ring Configured to Receive a Percutaneous Prosthetic Heart Valve Implantation(构造成接收经皮人工心脏瓣膜植入的瓣环成形术环)”的美国专利申请序列号US12/234,580,这些专利申请的全部公开内容通过引入明确地并入本文。
技术领域
本发明涉及一种用于心脏瓣膜置换的外科心脏瓣膜,并且更具体地涉及一种被构造成在其中接收可扩展的人工心脏瓣膜的外科心脏瓣膜。
背景技术:
心脏是具有四个泵送室的中空肌肉器官,该四个泵送室由主动脉瓣、二尖瓣(mitral)(或二叶瓣(bicuspid))、三尖瓣和肺动脉瓣四个心脏瓣膜分离。心脏瓣膜由被称为瓣环的致密纤维环,和附连到瓣环的小叶或尖瓣(cusp)组成。
心脏疾病是其中心脏瓣膜中的一个或多个无法正常工作的普遍状况。患病的心脏瓣膜可以分类为:狭窄的心脏瓣膜,其中瓣膜不充分打开以允许血液通过该瓣膜充分向前流动;和/或机能不全的心脏瓣膜,其中瓣膜不完全闭合,从而当瓣膜闭合时引起血液通过该瓣膜过多向后流动。瓣膜疾病可能正在严重地衰弱并且如果不治疗甚至致命。各种外科技术可以被用于置换或修复患病的瓣膜或受损的瓣膜。在传统的瓣膜置换操作中,受损的小叶通常被切除并且瓣环被塑造成接收置换人工瓣膜。
人工心脏瓣膜通常包括具有部署在其中的瓣膜组件的支撑结构(如环和/或支架)。支撑结构通常是刚性的,并且可以由包括金属、塑料、陶瓷等的各种生物相容性材料形成。两种主要类型的“常规”心脏瓣膜置换或假体是已知的。一种是机械型心脏瓣膜,其使用由基座结构支撑的球笼布置或枢转机械罩,以提供单向血流,诸如在Stobie等人的美国专利US6,143,025和Brendzel等人的美国专利US6,719,790中所示的单向血流,这两个美国专利的全部公开内容通过引入明确地并入本文。另一种是组织型或“人造生物”瓣膜,其具有由基座结构支撑并伸入流动流中的柔性小叶,所述流动流在功能上像天然的人类心脏瓣膜并模仿其天然挠曲动作,以靠着彼此接合并确保单向血流。
在组织型瓣膜中,整体异种移植瓣膜(例如,猪的瓣膜)或多个异种移植小叶(例如,牛心包膜)可以提供流体封闭表面。合成的小叶已经提出,并且因此术语“柔性小叶瓣膜”是指天然“组织型”瓣膜和人造“组织型”瓣膜。在典型的组织型瓣膜中,两个或更多个柔性小叶被安装在外周支撑结构内,外周支撑结构通常包括在流出方向上延伸到天然瓣环中的仿造的天然纤维连合(commissure)的柱(post)或连合。有时称为“线状结构(wireform)”或“支架(stent)”的金属或聚合的“支撑框架”具有多个(通常为三个)大半径尖瓣,该大半径尖瓣支撑柔性小叶(即整体异种移植瓣膜或三个分离的小叶)的尖瓣区域。每对相邻尖瓣的端部在某种程度上渐近地会聚,以形成在尖端终止的直立连合,其中每个连合在与弓形尖瓣相反的方向上延伸并具有相对小的半径。瓣膜的部件通常与一个或多个生物相容性织物(例如,涤纶)覆盖物组装,并且织物覆盖的缝合环被设置在外周支撑结构的流入端上。
柔性小叶瓣膜的结构的一个示例见于Huynh等人的美国专利US6,585,766(2003年7月1日发行),其中图1的分解图示出在小叶子组件52的任一侧上的织物覆盖的线状结构54和织物覆盖的支撑支架56。美国专利US6,585,766的内容通过引用以其全文并入本文。瓣膜和相关的组件/系统的其他示例见于1978年4月18日发行的美国专利US4,084,268;2006年11月21日发行的美国专利US7,137,184;2009年12月10日提交的美国专利US8,308,798;2010年6月23日提交的美国专利US8,348,998;和2011年6月23日提交的美国专利公开US2012/0065729;这些文献的全部内容通过引用以其全文并入本文。
有时在患者已经具有对相同瓣膜的早期瓣膜置换之后,对完整的瓣膜置换的需要可能产生。例如,被成功植入以置换天然瓣膜的人工心脏本身可能在最初植入后的许多年遭受损伤和/或磨损和破裂。将人工心脏瓣膜直接植入先前植入的人工心脏瓣膜内可能是不切实际的,部分原因是新的人工心脏瓣膜(包括支撑结构和瓣膜组件)将不得不驻留在先前植入的心脏瓣膜的瓣环内,并且传统的人工心脏瓣膜不可能被构造成以一种为新瓣膜提供稳固的安放位置同时也在新瓣膜内具有用于支撑穿过其中的适当血流的足够大的瓣环的方式容易地接收此类瓣膜在瓣膜内的植入。
已经注意到在旧瓣膜内植入新瓣膜的问题。特别地,下列文献公开了用于瓣中瓣(瓣膜在瓣膜中)的系统的各种解决方案:2008年9月19日提交的美国专利公开US2010/0076548;和2011年7月7日提交的美国专利公开US2011/0264207。
尽管瓣中瓣领域有某些进步,但仍需要可以适当地置换受损心脏瓣膜的人工心脏瓣膜,诸如被构造成经由手术植入置换天然瓣膜的人工瓣膜,但所述人工心脏瓣膜也能够使置换可扩展人工心脏瓣膜在更晚的时间部署在其中而无流量损失。本发明满足此需要。
技术实现要素:
本申请公开了许多人工心脏瓣膜,其中每个人工心脏瓣膜具有流入端和流出端。人工心脏瓣膜具有第一未扩展构造和第二扩展构造,并且包括支撑结构,所述支撑结构抵抗所述瓣膜压缩到比未扩展构造更小,并允许扩展到扩展构造。期望地,心脏瓣膜在当受到1至5大气压之间的压缩力时防止压缩,并且在受到1至12大气压的扩张力(尽管在1至8大气压之间的扩张力更有可能)时,从第一直径周向地扩展到第二直径。
在一个实施例中,支撑结构限定瓣口并且包括在流出方向上伸出的多个连合支撑件(commissural support)或柱。由支撑结构支撑的瓣膜部分包括多个小叶,其中相邻小叶在其边缘处固定到连合支撑件。当人工心脏瓣膜处于第一未扩展构造时,每个小叶被构造成与相邻小叶接合,以允许血液从流入端至流出端流过人工心脏瓣膜,但防止血液从流出端至流入端流过人工心脏瓣膜。
本申请公开一种具有流入端和流出端的人工心脏瓣膜,并且该瓣膜具有第一未扩展构造和第二扩展构造。该瓣膜包括围绕瓣口限定的内部支撑结构。该支撑结构具有在人工心脏瓣膜处于第一未扩展构造时的第一内直径和在人工心脏瓣膜处于第二扩展构造时的第二内直径,并且该支撑结构被构造成当处于第一未扩展构造时抵抗该支撑结构的向内压缩,并且当受到扩张力时允许其到第二内直径的径向扩展,但当受到扩张力时防止其到比第二内直径更大的直径的径向扩展。该支撑结构包括支撑环,所述支撑环包括当受到扩张力时将塑性扩展的至少一个扩展节段,并且所述瓣膜具有由支撑结构支撑的瓣膜部分,所述瓣膜部分在所述瓣膜处于第一未扩展构造时允许穿过所述瓣膜的单向血流。
扩展节段可以包括通过铰链状连接件进行端至端连接的一系列互连撑杆,所述一系列互连撑杆形成具有大致菱形格(cell)的Z字形手风琴状结构。在一种形式中,支撑环具有带有交替尖瓣和连合的波浪形状,并且其中支撑环包括位于连合之间的多个扩展节段。扩展节段可以是由金属撑杆形成的大致蛇形结构,其中所述撑杆紧密地压缩在一起,在处于所述未扩展构造的相邻撑杆之间具有最小距离,以防止所述结构到较小直径的向内压缩。支撑环也可以由经由铰链状褶皱(fold)连接的多个节段形成,所述多个节段包括扩展节段,其中相邻节段的端部最初在所述褶皱处重叠,从而使得支撑环具有最小直径,并且当支撑环扩展时,相邻节段的端部随着所述褶皱至少部分展开而被拉开,从而使得所述结构具有最大内直径。
本文公开的另一个实施例是一种具有第一未扩展构造和第二扩展构造的人工心脏瓣膜,所述人工心脏瓣膜包括限定周边的支撑结构。支撑结构具有在人工心脏瓣膜处于第一未扩展构造时的第一内直径和在人工心脏瓣膜处于第二扩展构造时的第二内直径,其中第二内直径大于第一内直径。当人工心脏瓣膜处于第一未扩展构造时,支撑结构刚性地抵抗向内压缩。支撑结构包括大致围绕支撑结构的周边穿过的第一支撑带。第一支撑带可以包括聚合材料。第二支撑带大致围绕支撑结构的周边穿过并且抵靠第一支撑带同心地布置。第二支撑带可以包括金属,并且第二支撑带具有围绕其周边的至少一个扩展点,所述至少一个扩展点被构造成当支撑结构受到比与正常心动周期相关联的力明显更大的扩张力时允许第二支撑带的扩展。第一支撑带和第二支撑带在围绕支撑结构的周边的至少一个点处固定在一起,并且所述瓣膜具有由支撑结构支撑的瓣膜部分,瓣膜部分在所述瓣膜处于第一未扩展构造时允许穿过所述瓣膜的单向血流。
第一支撑带期望地具有第一弱化部段,所述第一弱化部段被构造成当支撑结构受到扩张力时拉伸或在结构上失效。第二支撑带还可以具有在第一弱化部段的位置处的第二弱化部段,所述第二弱化部段被构造成当支撑结构受到扩张力时在结构上失效。在一个实施例中,第二内直径固定,从而使得当受到扩张力时支撑结构不会扩展超过第二内直径。
第二支撑带中的至少一个扩展点包括每个都带有对准的至少一个孔的重叠自由端以及保持自由端对齐但被构造成当支撑结构受到扩张力时断裂的穿过对准的孔的缝合线。优选地,第二支撑带具有带有交替尖瓣和连合的波浪形状,并且自由端在尖瓣之一处或在连合之一处重叠。自由端可以包括彼此接合以保持自由端对齐的交错接头,或者自由端以一个在另一个外侧的方式重叠,并且套管包围它们以保持自由端的对齐。在另一个实施例中,一个自由端包括驻留在另一个自由端中的狭槽中的销,其中所述销被构造成在所述狭槽内滑动。此外,支撑环可以包括具有互相重叠的自由端的三个节段。
在一个实施例中,支撑结构包括由内环和外环形成的支撑环,其中所述内环具有围绕支撑环外周的大致连续结构,并且所述外环具有由与内环的外面滑动接触的多个离散节段形成的分段结构。内环抵抗由于诸如来自球囊导管的向外力的向外扩展到比外环的节段更大的程度,并且当人工心脏瓣膜处于未扩展构造时,支撑环防止支撑结构的压缩。优选地,在外环中存在与连合支撑件的数量相同的离散节段,其中每个离散节段位于相邻连合支撑件之间。支撑环的内环可以由弹性材料形成,该弹性材料在受到扩张力时将拉伸。外环的离散节段可以由断裂或弱化部分分离。
在另外的构造中,支撑结构大致是环形的,并且包括具有围绕其周边延伸的多个弓形节段的支撑环。相邻弓形节段的端部重叠并且在连接处彼此固定,以形成当受到扩张力时将在结构上失效的弱化部分。所述连接可以是点焊焊接、声波焊接和/或粘合剂。此外,每个弓形节段具有相对的端部,其中每个连接可以包括一个弓形节段的端部中的销,该销驻留在相邻节段中的狭槽中,并且其中所述销被构造成在所述狭槽内滑动。所述销可以具有直径大于狭槽宽度的放大的远侧部分,从而防止所述销被拉出狭槽。期望地是,每个销具有大致圆形或大致细长的横截面。每个销可以非常紧密地驻留在狭槽内,使得该销不会在该狭槽内滑动,除非瓣膜受到扩张力。在一个版本中,每个销诸如经由粘合剂或点焊固定地保持在狭槽内的具体位置处,所述粘合剂或点焊被配置成当瓣膜受到扩张力时失效并允许所述销滑动。期望的是,存在至少三个重叠节段,并潜在地多达六个重叠节段。
另外的心脏瓣膜支撑结构包括支撑环,所述支撑环包括当受到扩张力时将塑性扩展的多个弱化部分。例如,支撑环可以包括一系列互连撑杆,所述一系列互连撑杆通过形成弱化部分的铰链状连接件进行端至端连接,以形成具有大致菱形格的Z字形手风琴状结构。在一个实施例中,支撑环包括位于连合支撑件之间的多个扩展节段。扩展节段可以包括由金属撑杆形成的大致蛇形结构。优选地,撑杆紧密地压缩在一起,在处于未扩展构造的相邻撑杆之间具有最小距离,以防止所述结构到较小直径的向内压缩。可替代地,支撑环由经由形成弱化部分的铰链状褶皱连接的多个节段形成,其中相邻节段的端部最初在所述褶皱处重叠,从而使得支撑环具有最小直径,并且当支撑环扩展时,相邻节段的端部随着所述褶皱至少部分展开而被拉开,从而使得所述结构具有最大内直径。
在另一个实施例中,人工心脏瓣膜包括限定周边的支撑结构,所述支撑结构在人工心脏瓣膜处于第一未扩展构造时具有第一内直径和在人工心脏瓣膜处于第二扩展构造时具有第二内直径。第二内直径大于第一内直径。当人工心脏瓣膜处于第一未扩展构造时,支撑结构抵抗向内压缩。支撑结构包括支撑带,所述支撑带具有重叠自由端和弱化部分,每个重叠自由端具有对准的至少一个孔,所述弱化部分包括保持自由端对齐但被构造成当支撑结构受到比与正常心动周期相关联的力更大的扩张力时在结构上失效的穿过对准孔的缝合线。瓣膜也包括由支撑结构支撑的瓣膜部分,瓣膜部分在瓣膜处于第一未扩展构造时允许穿过瓣膜的单向血流。支撑带可以包括金属,并且具有带有交替尖瓣和连合部分的波浪形状,并且自由端可以在尖瓣部分之一处或在连合部分之一处重叠。支撑结构也可以包括第二支撑部分,所述第二支撑部分包括大致围绕支撑结构的周边穿过并同心地布置在支撑带内的聚合材料。支撑带和第二支撑部分优选地在围绕支撑结构的周边的至少一点处固定在一起。第二支撑部分可以包括第二弱化部分,所述第二弱化部分被构造成当支撑结构受到扩张力时拉伸或在结构上失效。
本文所述的人工心脏瓣膜被构造成在其中接收人工心脏瓣膜,诸如导管部署的(经导管)人工心脏瓣膜。在一个实施例中,人工心脏瓣膜具有支撑结构,所述支撑结构在部署在患者的天然心脏瓣膜环中来置换天然心脏瓣膜(或置换另一人工心脏瓣膜)时大致抵抗径向压缩(并且可以大致抵抗径向扩展),但被构造成可径向扩展的且/或转变成大致扩展的和/或可扩展的构造,以便在其中接收人工心脏瓣膜,诸如经皮输送的人工心脏瓣膜。从抗扩展到已扩展/可扩展的转变可以通过使抗扩展的支撑结构受到诸如扩张力的向外的力来实现,所述扩张力可以由用于部署置换人工瓣膜的扩张球囊提供。
人工心脏瓣膜结构在扩张之前可以是大致刚性的,并且可以被构造成当受到向外力时变成大体非刚性和甚至大体弹性。弹性可以辅助将经皮引入的人工瓣膜保持在当前人工瓣膜结构内。该人工心脏瓣膜结构可以被构造成抵抗径向压缩,但当受到径向扩展力和潜在地受到甚至相对小的径向扩展力时允许径向扩展。
人工瓣膜可以最初使用各种外科技术(例如,传统的开胸、微创、经皮等)部署在患者的瓣膜环中,以校正心脏瓣膜功能。如果在人工瓣膜的部署之后心脏瓣膜功能还下降,则新的置换人工瓣膜可以部署在先前部署的人工瓣膜内,而不需要切除先前部署的人工瓣膜。置换人工瓣膜在先前部署的人工瓣膜内的部署可以在从先前部署的人工瓣膜的最初部署的更晚时间发生。因此,本文公开的人工瓣膜被构造成部署在患者体内且在更晚的时间,以接受并甚至改进置换人工瓣膜在相同瓣膜环内的部署。
根据本发明的实施例的用于修复患者心脏功能的方法可以包括:提供人工心脏瓣膜,所述人工心脏瓣膜被构造成在植入时具有大致刚性和/或抗扩展的支撑结构并且也被构造成在扩张时呈现已扩展/可扩展的构造;以及在心脏瓣膜环中植入人工心脏瓣膜。该方法也可以包括在先前部署的心脏瓣膜和心脏瓣膜环内部署可扩展的人工心脏瓣膜。在先前部署的人工瓣膜和心脏瓣膜环内部署可扩展的人工心脏瓣膜可以包括扩张先前部署的人工瓣膜,以使先前部署的人工瓣膜呈现大致已扩展/可扩展的形状。
扩张先前部署的人工心脏瓣膜可以包括使用扩张球囊,诸如当前用于天然心脏瓣膜的扩张的类型,所述扩张球囊可以在先前部署的人工心脏瓣膜内推进并扩展到期望的压力和/或直径。作为一般规则,用于天然瓣膜的扩张的扩张球囊由大致无弹性材料形成,以当充气时提供大致固定的(即预设的)外直径。一旦此类球囊充气到其全部的固定直径,这些球囊就不会明显地进一步扩展(在破裂之前),即使在其中添加附加的容积/压力。用于使此类球囊充气的典型压力是在1至12大气压之间且更优选地在1至8大气压之间,其中此类球囊的预设充气外直径约为18毫米至33毫米。扩张球囊可以扩展到足以使扩张球囊完全充气到其期望直径并扩张和扩展到先前部署的人工心脏瓣膜的期望压力(例如,1-12大气压)。
在一个实施例中,扩张球囊被构造有大于先前部署的人工心脏瓣膜的内直径诸如2-3mm或10-20%或更多的预设充气外直径。作为示例,如果本发明的先前部署的人工心脏瓣膜具有23mm的内直径,则具有24-27mm充气直径的扩张球囊可以在人工心脏瓣膜内充气,以使其扩展和/或变得有弹性。
在扩展的构造中,人工心脏瓣膜的小叶(其已接合,以在扩展之前控制血流)也可以不接合,或者根本不接合。因此,小叶(在扩展后)可以允许大量的血液在两个方向上流动。因此,小叶在扩展后控制血流中基本上是无效的。血流的控制将因此由部署在在先的(和现在扩张的)人工瓣膜的孔口内的新植入的人工瓣膜呈现。
本发明的实施例的(在扩展前和在扩展后)内直径/孔口的非限制性示例包括:15mm,其扩展到17mm或18mm;17mm,其扩展到19mm或20mm;19mm,其扩展到21mm或22mm;22mm,其扩展到24mm或25mm;25mm,其扩展到28mm;27mm,其扩展到30mm;30mm,其扩展到33mm。
根据本发明的各种实施例的人工心脏瓣膜可以被构造成在扩张之前是大致刚性的,但当受到足够的扩张压力时变成扩展的和/或弹性的。例如,人工心脏瓣膜可以被构造成承受可以在心脏跳动期间出现的自然发生的扩张压力,但当受到期望的压力(例如,来自扩张球囊或其他机械扩展器的压力),诸如1大气压、2大气压、3大气压、4大气压、5大气压或6大气压的压力时变成扩展的和/或弹性的,这取决于特定的应用。
与通过示例的方式说明本发明的原理的附图结合,本发明的其他特征和优点从下列具体实施方式中将变得明显。
附图说明
图1示出根据本发明的实施例的部署在心脏中的人工心脏瓣膜;
图2A-2C分别示出根据本发明实施例的人工心脏瓣膜的透视图、俯视图和侧视图;
图2D示出在人工心脏瓣膜已扩张之后图2A-2C的人工心脏瓣膜的俯视图;
图3A-3B示出根据本发明实施例的人工心脏瓣膜支撑结构的分别在扩张前和扩张后的俯视图;
图4A-4B示出根据本发明实施例的人工心脏瓣膜支撑结构的分别在未扩展构造和扩展构造的俯视图;
图5A-5B示出根据本发明实施例的分别在扩张前构造和扩张后构造的人工心脏瓣膜支撑结构的俯视图;
图6A-6D分别示出根据本发明实施例的人工心脏瓣膜支撑结构的(扩张前)俯视图、(扩张后)俯视图和特写侧视图;
图7A-7B分别示出根据本发明实施例的扩张前的人工心脏瓣膜的俯视图和侧视图;
图7C-7D分别示出在人工心脏瓣膜支撑结构已扩张之后图7A-7B的支撑结构的俯视图和侧视图;
图8A-8B示出根据本发明实施例的人工心脏瓣膜支撑结构分别在扩张前和扩张后的侧视图;
图9A-9B示出根据本发明实施例的人工心脏瓣膜支撑结构分别在扩张前和扩张后的俯视图;
图10A和图10B示出根据本发明实施例的人工心脏瓣膜支撑结构分别在扩张前和扩张后的俯视图;
图10C-10D示出根据本发明实施例的人工心脏瓣膜支撑结构分别在扩张前和扩张后的俯视(特写)视图;
图10E-10F示出根据本发明实施例的人工心脏瓣膜支撑结构分别在扩张前和扩张后的俯视(特写)视图;
图11A-11D是具有内结构带的现有技术的示例性人工心脏瓣膜的透视图和分解图;
图12A示出根据本发明实施例的人工心脏瓣膜支撑带的侧视图;
图12B和图12C分别示出其中缝合线将自由端固定在一起的图12A的人工心脏瓣膜支撑带的侧视图和透视(特写)视图;
图12D示出具有自由端固定在一起的替代构造的图12A的支撑带的放大侧视图;
图12E示出用于与图12A的支撑带一起使用的另一个人工心脏瓣膜支撑带的侧视图;
图12F示出由将图12A中的第一人工心脏瓣膜支撑带和图12E中的第二人工心脏瓣膜支撑带固定到复合结构中而形成的人工心脏瓣膜结构的侧视图;
图12G-12J示出图12A-12F中所示的第一和第二人工心脏瓣膜支撑带上的变化;
图12K-12N示出第一人工心脏瓣膜支撑带上的进一步变化;
图13A和图13B是具有带有彼此接合的接头/调整片(tab)的重叠自由端的适合于植入后扩展的另一个示例性人工心脏瓣膜支撑带的透视图,以及图13C和图13D是分别在收缩和扩展构造的重叠自由端的放大视图;
图14A和图14B是也具有由摩擦套管保持在一起的重叠自由端的适合于植入后扩展的另外的人工心脏瓣膜支撑带的透视图,以及图14C示出重叠自由端的扩展;
图15A示出根据本发明实施例的为人工心脏瓣膜部署而构造的可扩展的人工心脏瓣膜部署导管;
图15B示出根据本发明实施例的安置在患者的心脏瓣膜环中的先前部署的人工心脏瓣膜内的图15A的可扩展的人工心脏瓣膜部署导管;
图15C示出根据本发明实施例的扩张先前部署的人工心脏瓣膜并部署在其内的可扩展的人工心脏瓣膜的图15A的可扩展的人工心脏瓣膜部署导管;
图15D示出根据本发明实施例的正从患者体内抽出的图15A的可扩展的人工心脏瓣膜部署导管;
图16A示出根据本发明的实施例的构造用于先前部署的人工心脏瓣膜的扩张并且用于可扩展的人工心脏瓣膜的部署的可扩展的人工心脏瓣膜部署导管;
图16B示出根据本发明实施例的其中扩张球囊安置在心脏瓣膜环中的先前部署的人工心脏瓣膜内的图16A的可扩展的人工心脏瓣膜部署导管;
图16C示出根据本发明实施例的扩张先前部署的人工心脏瓣膜的图16A的可扩展的人工心脏瓣膜部署导管;以及
图16D示出根据本发明实施例的其中在先前部署的人工心脏瓣膜扩张之后扩张球囊放气的图16A的可扩展的人工心脏瓣膜部署导管。
具体实施方式
参考图1,根据本发明的人工心脏瓣膜10被示出在心脏12中。心脏12具有称为右心房14、右心室16、左心房18和左心室20的四个腔室。如从患者的前面看到的心脏12的大体解剖结构将出于背景目的进行描述。心脏12具有肌外壁22,其中心房间隔24划分右心房14和左心房18,肌心室间隔26划分右心室16和左心室20。在心脏12的底端是顶端28。
血液流过上腔静脉30和下腔静脉32进入心脏12的右心房14中。具有三个小叶36的三尖瓣34控制右心房14和右心室16之间的血流。当血液从右心室16泵送出穿过肺动脉瓣38到分支成通向肺(未示出)的动脉的肺动脉40时,三尖瓣34闭合。此后,三尖瓣34打开,用来自右心房14的血液重新填充右心室16。三尖瓣34的小叶36的下部分和自由边缘42经由三尖瓣腱索44连接到右心室16中的乳头肌46,以便控制三尖瓣34的运动。
在离开肺之后,新的含氧血液流过肺静脉48并进入心脏12的左心房18。正常心脏中的二尖瓣控制在左心房18和左心室20之间的血流。注意在当前附图中,天然二尖瓣已经用人工心脏瓣膜10置换,其因此是人工二尖瓣50。在血液从左心室20射入主动脉52中时的心室收缩期期间,人工二尖瓣50闭合。此后,人工二尖瓣50打开,以用来自左心房18的血液重新填充左心室20。来自左心室20的血液由从心脏壁22的肌组织和肌心室间隔26产生的功率泵送穿过主动脉瓣62到分支成通向身体的所有部分的动脉的主动脉52中。
在所示的特定实施例中,人工心脏瓣膜10被部署以置换天然二尖瓣,并且更具体地(例如,经由缝合线)邻近并围绕二尖瓣瓣膜环64固定。根据包括通过其植入人工心脏瓣膜10的方法的特定应用,特定的天然瓣膜(主动脉瓣、二尖瓣、三尖瓣等)和/或部分或全部其相关联的结构可以在人工心脏瓣膜10的植入之前或在人工心脏瓣膜10的植入期间完全地或部分地移除,或者天然瓣膜和/或部分或全部相关联的结构可以简单地留在原位,其中人工心脏瓣膜10安装在天然瓣膜之上。例如,天然二尖瓣通常具有两个小叶(前小叶和后小叶),这些小叶的下部分和自由边缘经由二尖瓣腱索连接到左心室20中的乳头肌60用于控制二尖瓣的运动。并非所有这些结构(即二尖瓣小叶、腱索)描绘在图1中,因为在特定的实施例中,天然二尖瓣和许多相关联的结构(腱束等)已在人工心脏瓣膜10的植入之前或在人工心脏瓣膜10的植入期间去除。然而,在许多人工瓣膜植入中,外科医生选择保留许多腱索等,甚至在切除天然瓣膜时也是如此。
虽然图1示出人工二尖瓣,但是注意本文所述的构造可以应用于人工瓣膜(并且因此应用于系统和方法),所述人工瓣膜被构造成置换包括主动脉瓣、二尖瓣、三尖瓣和肺动脉瓣的任何心脏瓣膜。
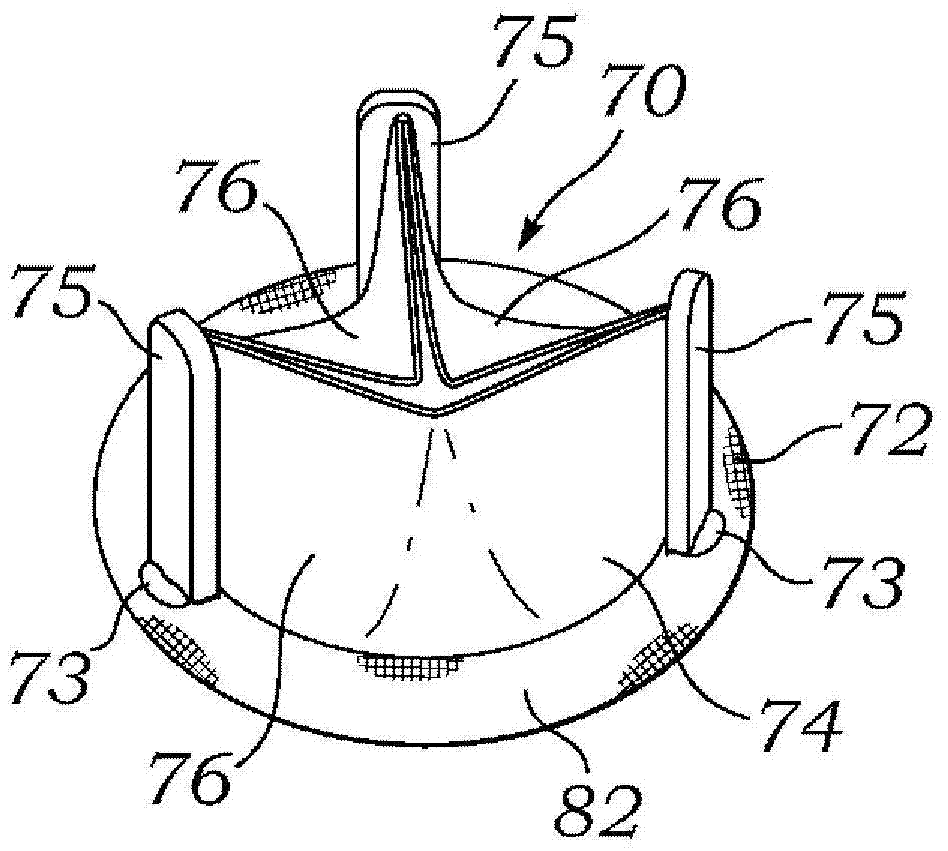
图2A-2C示出根据本发明实施例的人工心脏瓣膜70,其中人工心脏瓣膜70包括支撑框架72和瓣膜结构74。在所示的特定实施例中,瓣膜结构74包括三个心脏瓣膜小叶76。人工心脏瓣膜70具有瓣口80的内直径78a,其中血液可以在一个方向上流过瓣口80,但是瓣膜小叶76将阻止在相反方向上的血流。支撑框架72是大致刚性的和/或抗扩展的,以便保持瓣口80的特定形状(其在该实施例中是大致圆形的)和直径78a,并且也保持相应的瓣膜小叶76适当地对齐,以便瓣膜结构74适当地闭合和打开。特定的支撑框架72也包括帮助支撑瓣膜小叶76的自由边缘的连合支撑件或柱75。在优选的结构中,每个瓣膜小叶76沿到周围的支撑框架72的尖瓣边缘并向上沿相邻连合柱75附连。在图2A-2C中所示的特定实施例中,支撑框架72限定环绕瓣膜70的大致刚性和/或抗扩展的环82并限定大致圆形的瓣口80,但其他形状也在本发明的范围内,这取决于特定的应用(包括诸如要置换的特定天然瓣膜等组织)。特定的人工心脏瓣膜70包括可视标记73(诸如不透射线标记等),可视标记73在本实施例中是在支撑框架72上,并对应于环82并且也对应于连合柱75(因此对应于连合),这可以帮助随后部署的可扩展人工心脏瓣膜在人工心脏瓣膜70的瓣口80内的适当放置。
当图2A-2C的人工心脏瓣膜70受到扩张力(诸如来自扩张球囊的扩张力,其可以提供1至12大气压或更通常1和8大气压的压力)时,该人工心脏瓣膜将稍微扩展。支撑框架72将从图2A-2C的大致刚性和/或抗扩展构造过渡到图2D中所示的大致非刚性和扩展的构造。注意,大致刚性和/或抗扩展的环82现在被扩展,并且瓣口80已相应地扩大到较大内直径78b。较大内直径78b被构造成在其中接收可扩展的人工心脏瓣膜。整体结果是图2D的“扩张后”人工心脏瓣膜70具有大致较大内直径的环形开口78b。实际内直径将取决于特定应用,包括特定患者的心脏的各方面(例如,天然瓣膜和/或瓣环直径等)。作为示例,二尖瓣的扩张前内直径78a可以在22-30mm之间,或者主动脉瓣的扩张前内直径可以在18-28mm之间。扩张后内直径78b将较大,并且更具体地足够大到在其中容纳可扩展的人工瓣膜的外直径。
在其中可扩展的人工心脏瓣膜用于置换/修复先前部署的人工心脏瓣膜的一些手术过程中,期望的是,可扩展的人工心脏瓣膜具有的部署的(扩展的)内直径(和对应的可扩展的人工心脏瓣口面积)约等于或甚至大于先前部署的人工心脏瓣膜70的扩张前内直径78a(和对应的扩张前人工瓣口面积)。内直径/孔口面积之间的这种一致性或其改进在保持适当的血流中可以是有用的,以便可扩展的人工心脏瓣膜将提供与由先前部署的人工心脏瓣膜提供的血流相同或改进的血流。注意,术语“瓣口面积”是指当瓣膜部分处于完全打开构造(例如,瓣膜小叶处于其完全打开构造,以便有效的孔口面积处于其最大尺寸)时瓣口的面积。
例如,爱德华兹生命科学公司(Edwards Lifesciences)拥有SapienTM可扩展人工心脏瓣膜,其具有分别为23mm和26mm的外直径和对应的分别为约22mm和25mm的内直径。因此,(先前部署的)人工心脏瓣膜的扩张后内直径78b可以是(分别)大约23mm和26mm,以容纳此类可扩展的人工心脏瓣膜。其对应于大于扩张前内直径78a约10%-20%的扩张后内直径78b。因此,本发明的实施例包括扩张后内直径78b为扩张前内直径78a的约10%、15%或20%或者在5%-25%、10%-20%或13%-17%之间的人工心脏瓣膜。
注意本发明不限于扩张前内直径和扩张后内直径之间的上述差异。例如,可以存在其中可以要求更小和/或更大的扩张后内直径的应用。在一些情况下,可扩展的人工心脏瓣膜将具有仅稍微大于其内直径的外直径,以便要求先前部署的人工心脏瓣膜内直径的较少扩展来容纳可扩展的人工心脏瓣膜。在其他情况下,可扩展的人工心脏瓣膜可以具有比其内直径更大的外直径,从而使得先前部署的人工心脏瓣膜内直径的较大扩展是必要的以便容纳可扩展的人工心脏瓣膜。也可以存在其中期望部署具有比由(先前部署和扩张前)人工心脏瓣膜提供的内直径更小或更大的内直径的可扩展人工心脏瓣膜的应用。
注意,根据特定的应用,人工心脏瓣膜70可以在受到诸如来自球囊扩张导管或其他机械扩展器的扩张之后返回到其扩张前内直径78a。然而,所述扩张将“扩张后”人工心脏瓣膜70转化成大致扩张友好型构造,使得当可扩展的(例如,球囊可扩展、自扩展等)人工心脏瓣膜被部署在人工心脏瓣膜70的瓣口80内时,“扩张后”人工心脏瓣膜70将相对容易地被推到较大直径(诸如78b)中。
本申请公开了用于可以在植入后扩展的人工心脏瓣膜的许多不同支撑结构。应该理解,此类支撑结构的示意性表示不意在限定整个支撑结构,但为了清楚起见进行描述,以便更好地解释特定结构。事实上,人工心脏瓣膜的优选实施例包括安装在包括支撑柔性瓣膜小叶76的连合柱75的整体支撑结构内的可扩展支撑结构,如图2A-2D中所示。可替代地,包括所公开的可扩展支撑结构的人工心脏瓣膜可以是带有机械小叶的机械瓣膜。换句话讲,人工心脏瓣膜的整体结构不应该被认为限制在任何权利要求中,除非在该权利要求中明确指出。
图3A-3B示出人工心脏瓣膜支撑结构90的实施例。结构90包括限定内直径94的大致环形部分92。大致环形部分92包括诸如凹口96的一个或多个变薄部分,其在特定实施例中绕大致环形部分92的周边间隔,其中大致环形部分92的较厚和较强节段98在凹口96之间延伸。在所示的实施例中,存在由四个凹口96隔开的四个较强节段98,尽管节段的数量可以是更多或更少的。凹口96或其他变薄区域被构造成当受到诸如2、3、4、5或6大气压的从球囊导管预期的径向扩展力水平时失效。图3A示出处于其扩张前形式的结构90。图3B示出处于其扩张后形式的结构90,其中一个或多个凹口96已断裂,从而使得有在大致环形部分92的相邻节段98之间形成空间的一个或多个断开处100。内直径94在图3B中较大,以在其中容纳可扩展的瓣膜。
图4A-4B示出具有限定内直径114的大致环形部分112的人工心脏瓣膜支撑件110的另外的实施例。大致环形部分112是由类似和/或不同材料的两个环116、118形成的复合结构。环116中的第一环是大致连续的环结构,在特定实施例中第一环是限定内直径114的结构的内部分。环118中的第二环是在相邻节段122之间具有断开处120(和/或弱化部分)的分段结构。应当注意在所示的实施例中,有包括外环118的四个节段122,尽管可以采用更多或更少的节段。在替代实施例中,存在具有以120°间距围绕周边均匀分布的断开处120的三个外节段122。在另外的实施例中,断开处120与心脏瓣膜支撑件110的连合柱(诸如图2A-2D中所示的柱75)一致定位。大致环形部分112有力地抵抗压缩,这自然一起驱动第二部分118的相邻节段122,从而使得第一环形部分116和第二环形部分118两者抵抗此类压缩。复合结构对径向扩展具有更少的抵抗性,径向扩展由第一环形部分116抵抗,但完全不(或最低限度地)由第二环形部分118抵抗。例如,内环形部分116可以由弹性材料制成。因此,结构可以在受到诸如2、3、4、5或6大气压的从球囊导管预期的径向扩展力水平时径向地扩展。如图4B中所示,当结构径向地扩展时,相邻节段122之间的断开处120变得更大,从而增加结构的内直径114,以在其中容纳新的瓣膜。
图5A-5B示出分别处于扩张前构造和扩张后构造的人工心脏瓣膜支撑结构130的另外的实施例。结构130由具有经由连接件138固定的重叠端部134、136的多个节段132形成。例如,支撑结构130包括由大致布置在内圆上并跨越间隙间隔开的多个内节段132和大致布置在外圆上的多个外节段132制成的环,每个外节段横跨相邻内节段之间的间隙。在一个实施例中,有三个内节段和三个外节段。期望地,外节段132的中心位于由心脏瓣膜支撑结构130限定的瓣膜尖瓣内,诸如在连合柱之间。节段132可以由诸如金属(例如,不锈钢、钴-铬(例如,埃尔基洛伊耐蚀游丝合金)、镍-钛(例如,镍钛合金)等)或诸如聚酯的聚合物等各种材料形成。连接件138可以使用点焊焊接、声波焊接和/或粘合剂形成。连接件被构造成当受到诸如2、3、4、5或6大气压的从球囊导管预期的径向扩展力水平时失效。当连接件138失效时,节段132滑动地移开,从而减少或消除端部134、136的重叠区域并且从而增加内直径140的尺寸。
图6A-6D示出本发明的另外的实施例,其中心脏瓣膜支撑结构150具有防止支撑结构的压缩并也防止支撑结构的过度扩展和因此由支撑结构150支撑的人工心脏瓣膜的过度扩展的锁定特征。支撑结构150具有多个扩展部段,每个扩展部段包括连接相邻节段156的销152和狭槽154。更具体地,一个节段156的销152驻留在相邻节段156的狭槽154中,从而滑动地连接相邻节段156。销152可以具有直径大于狭槽宽度的扩大的远侧部分153,从而防止销152被从狭槽154拉出。销152可以具有如图6C中所示的大致圆形横截面,或如图6D中所示的大致细长横截面。诸如正方形或矩形的其他横截面也在本发明的范围内。注意到,销152和狭槽154可以被构造成使得销152非常紧密地驻留在狭槽154内,从而使得销152不会在狭槽154内滑动,除非受到很大的力,诸如当球囊导管的球囊在支撑件150内扩展到2、3、4、5、6、7或8大气压或者更大的压力时产生的力。销152可以诸如经由粘合剂或点焊固定地保持在狭槽内的特定位置处(例如,保持在狭槽154的近端158处),但是粘合剂和/或点焊被配置成当结构150受到很大的力时,诸如当球囊导管的球囊在支撑件150内扩展到2、3、4、5、6、7或8大气压或者更大的压力时产生的力时,失效并允许销152滑动。当结构150处于其非扩展(扩张前)状态时,如图6A中所示,销152在狭槽154的近端158处并且内直径162处于最小尺寸。当结构150径向扩展时(例如,当结构150正在支撑的人工瓣膜扩张时),如图6B中所示,销152朝向狭槽154的远端160向远侧滑动并且内直径162被扩大。因此,销152和狭槽154布置允许结构150径向地扩展,但提供对于将被允许的最大扩展的固定限制。图6A-6D分别示出根据本发明实施例的人工心脏瓣膜支撑结构的(扩张前)俯视图、(扩张后)俯视图和特写侧视图。
图7A-7D示出根据本发明的支撑结构170的另外的实施例,其中扩展部段由一系列互连撑杆172形成,该一系列互连撑杆172通过铰链状/合叶状连接件174进行端至端连接,以形成具有大致菱形格176的Z字形手风琴状结构。在(图7A和图7B中所示的)非扩展(扩张前)构造中,大致菱形格176处于最大高度178和最小宽度180,并且结构170限定最小尺寸内直径182。在(图7C和图7D中所示的)扩展(扩张后)构造中,互连撑杆172在铰链状连接件174处旋转,并且大致菱形格176已经因此横向拉伸并处于最小高度178和最大宽度180。扩展结构170限定最大尺寸内直径182。期望的是,支撑结构170是可塑性扩展的,以便最初抵抗植入后和当受到正常解剖扩张压力时的扩张。当将置换瓣膜植入在具有支撑结构170的人工瓣膜内时,向外球囊力或其他机械扩展器力通常在铰链状连接件174处引起互连撑杆172的塑性变形。球囊或机械扩展力可以与后来瓣膜的植入单独地完成,或者随后植入的瓣膜的扩展可以同时扩展支撑结构170。
图8A-8B示出根据本发明的支撑结构190的另外的实施例,其中扩展部段191在连合支撑件193之间延伸。扩展部段191由大致Z字形或正弦形结构192形成,该大致Z字形或正弦形结构192由固定在蛇形图案中的尖峰196处的一系列节段194形成。在图8A的非扩展(扩张前)构造中,Z字形节段194紧密地压缩在一起,在相邻尖峰196之间具有最小距离198(并且甚至可以使相邻节段194彼此边与边接触并且因此防止结构的向内压缩达到更小直径)。在此类构造中,支撑结构190将具有最小(未扩展)直径。在图8B的扩展(扩张后)构造中,正弦形/Z字形被拉动成较少压缩的构造,并且相邻尖峰196和节段194彼此间隔开,并且在相邻尖峰196之间具有最大距离198并且因此支撑结构190具有最大直径。
图9A-9B示出本发明的另外的实施例,其中支撑结构200包括经由铰链状褶皱204连接的节段202。在图9A的非扩展(扩张前)构造中,相邻节段202的端部206在折叠204处重叠,并且结构200具有最小直径208。当结构200如图9B中所示扩展(扩张后)时,相邻节段的端部206随着褶皱204至少部分展开而拉开,从而使得该结构具有最大内直径208。同样,支撑结构200的褶皱204可以由可塑性扩展的材料形成,从而使得一旦扩展,褶皱204就保持其形状。
在本发明的实施例中,如图7A-9B中所示的实施例中,结构的几何形状和材料可以被构造成使得某些载荷(例如,达1或2或甚至3大气压的压缩和/或扩展压力)将使所述材料保持在其弹性区域中,使得当受到相对小的压缩和/或扩展载荷时其可以稍微扩展和/或压缩,但一旦此类载荷去除,就将返回到其原始形状。所述结构的几何形状和材料可被构造成使得在达到某个载荷(诸如2、3、4、5或6大气压)之后,塑性变形与永久性径向扩展将发生。通过此类塑性变形,各元件可以“锁定”并因此防止结构的进一步径向扩张。
图10A-10D示出本发明的另外的实施例,其中支撑结构210包括弓形节段212,其在特定实施例中是围绕结构210的整个周边穿过的约360度的节段。弓形节段212的第一端214具有被构造成滑动地接收弓形节段214的第二端218的凹槽216。凹槽216具有远侧开口220和近端221,其中第二端218被构造成推进到凹槽216中并当结构210如图10A中所示处于其未扩展(扩张前)构造时靠着其近端221。因此,第二端218抵靠近端221的安置防止结构210向内压陷到比未扩展(扩张前)构造所期望的更小的内直径222。当结构210如图10B中所示径向扩展时,第二端218向远侧滑动地从凹槽216移出,直到第二端完全在凹槽216的外部,并且第一端214和第二端218之间存在空间,并且该结构具有比当处于图10A的未扩展构造时更大的内直径222。注意,虽然图10A-10B示出限定支撑结构210的整个周边的单个弓形节段212,但是多个弓形节段诸如每个节段约180度的2个节段或每个节段约120度的3个节段可以可替代地用于形成结构210的周边,其中相邻节段的相邻端部具有被构造成如图10A-10B(和/或下面的图10C-10F)中所示相互作用的凹槽和/或端部。
图10C和图10D示出图10A-10B的实施例的修改版本,其中凹槽216被构造成使得其径向向内部分223大致与弓形节段212的剩余部分周向对齐,而凹槽216的径向向外部分224从弓形节段212径向向外延伸。在该实施例中,结构的内表面225(例如,在内直径内)是相对平滑的,而由凹槽216组件产生的表面中断几乎完全在支撑结构200的外表面226上。此类组件为支撑结构210提供平滑的内表面,具有相应一致的内直径。
图10E和图10F示出图10A和图10B的实施例的另一个修改版本,其中凹槽216相对深,具有比图10A-10B中的凹槽更大的深度227,从而提供凹槽216和第二端218之间的较长重叠,该较长重叠可以提供结构的更多抗压缩性和其他增加的结构整体性。凹槽的深度227可以足以包含第二端218,甚至在第二端218在扩展期间向远侧从凹槽近端221移开之后。因此,第二端218总是保持在凹槽216内,甚至在支撑结构210到其较大内直径的扩展/扩张之后。如图10A中所示,在未扩展构造中,第二端218设置为与凹槽近端221相邻和/或抵靠凹槽近端221。当所述结构如图10F中所示径向地扩展时,第二端218相对于凹槽近端221向远侧移动,但仍然保持在凹槽216内。
注意存在上述实施例的许多变型,包括各种实施例的各种组合,所有这些变型都在本发明的范围内。一个实施例的节段可以与其他实施例的可扩展部分组合。另外,特定的支撑结构可以具有上述可扩展部分的任何组合。
图11A-11D是围绕流动轴线229取向的现有技术的示例性人工心脏瓣膜228的透视图和分解图。心脏瓣膜228包括由波浪形线状结构231以及结构支架232部分地支撑的多个(通常为三个)柔性小叶230。线状结构231可以由诸如类似埃尔基洛伊耐蚀游丝合金的钴-铬-镍合金的适当弹性的金属形成,而结构支架232可以是金属、塑料或两者的组合。如在图11B中看到,相邻小叶230的外部接头233在沿流动轴线229的流出方向上伸出的称为瓣膜连合处围绕结构支架232的一部分缠绕。软的密封或缝合环234限制人工心脏瓣膜228的流入端并且通常用于诸如采用缝合线将瓣膜固定到天然瓣环。线状结构231和结构支架232在附图中可见,但通常覆盖有聚酯织物,以利于组装并减少植入后的直接血液暴露。
图11C和图11D示出内部结构支架232的组装图和分解图。虽然图11A和图11B中所见的人工心脏瓣膜228的一般特性可以在许多不同的人工心脏瓣膜中使用,但是所示的结构支架232是在特定心脏瓣膜中使用的结构支架;即,由加利福尼亚州Irvine的爱德华兹生命科学公司(Edwards Lifesciences)制造的心包心脏瓣膜。例如,利用心包小叶230的PerimountTM系列心脏瓣膜特有与图11C和图11D中所示的支架很像的内部支架232。特别地,支架232包括两个同心带的组件,其中外带235环绕内带236。带235、236的径向尺寸与轴向尺寸相比是相对薄的,并且两者都具有围绕周边轴向地向上和向下成波浪形的一致的下边缘。外带235呈现在三个向下弯曲的凹部之间的三个截短的尖峰,而内带236具有大致相同的形状,但还在连合柱237处向上延伸。向下弯曲的凹部通常称为尖瓣(cusp)238,如在图11C中看到。
在示例性PerimountTM瓣膜中,外带235是金属的并且由弯曲成大致环形形状并在250处焊接的细长金属条形成。相比之下,内带236由诸如Delrin(聚甲醛树脂)的生物相容性聚合物形成,其可以模制成形,并且也可以形成为条且弯曲成环形并焊接(未示出)。外带235和内带236两者特有一系列通孔,这一系列通孔彼此对准,从而使得组件可以缝在一起,如图11C中示意性示出的。内带236的线状结构231和连合柱237向瓣膜的连合提供柔性,从而帮助减少小叶230的人造生物材料上的应力。然而,由缝合环234环绕的瓣膜228的流入端或基座包括结构支架232的相对刚性的环形部分。金属外带235和塑料内带236的组合为瓣膜提供尺寸相对稳定的周向基座,这有利于常规的使用。然而,为外科瓣膜提供良好稳定性的结构支架232的相同特性抵抗瓣膜的植入后扩展。因此,本申请考虑了对结构支架232的各种修改,以利于其扩展。
图12-14是用于能够使心脏瓣膜在实施后扩展的图11A中所示的现有技术人工外科心脏瓣膜228的置换结构带的许多不同实施例的透视图、组装图和分解图。
在第一实施例中,图12A-12F示出由内带或第一带242和外带或第二带244形成的用于人工心脏瓣膜的复合支撑支架240。参考图12A-12B,第一带242包括形成具有在连合点248处连接的3个弯曲节段246的大致环形支撑结构的单个一体材料片。弯曲节段246之一在其中间具有断开处250,其中孔252钻在断开处250的任一侧上的自由端254中。如图12B和图12C中所示,当组装时,自由端254经由诸如丝4-0缝合线的缝合线256接在一起,穿过孔252并固定在结258中。注意,结258可以在第一支撑结构的径向外部上形成,以帮助保持其平滑的内表面。图12D示出具有固定在一起的自由端254的替代构造的图12A的外支撑带242的放大侧视图。特别地,每个自由端254具有与另一个自由端中相同数量的孔对齐的一系列孔252,如图所示为三个孔。缝合线256或其他此类细丝的长度可以诸如在“图8”的构造中交错穿过孔252,并且然后在结258处打结。
缝合线/孔组合在第一带242上形成弱化点,其中在支撑部分的剩余部分在支撑部分受到扩张力时将失效之前,缝合线256将断裂。注意,其他技术和组件可以用于形成诸如点焊焊接的弱化部分、变薄部分和用于其他实施例的诸如本文公开的那些的其他方法。在图12A-12B中所示的特定实施例中,期望的是,第一带242由诸如不锈钢或钴-铬(Co-Cr)的金属形成。
图12E示出根据本发明的实施例的第二支撑带244。支撑带244包括诸如聚酯类的聚合物的单个一体材料片,从而形成具有在连合支撑件262处连接的3个弯曲节段260的大致环形支撑结构。弯曲节段260之一具有变薄节段264,以形成当受到足够的扩张力时将在结构的其余部分之前失效的弱化部分。注意,形成弱化部分的其他方法也在本发明的范围内,诸如使用点焊焊接、声波焊接、缝合线和/或变薄/弱化区域。
图12F示出通过将第一人工心脏瓣膜支撑带242和第二人工心脏瓣膜支撑带244固定到复合结构内而形成的复合人工心脏瓣膜支撑支架240。支撑部分242、244可以经由诸如焊接、粘合剂等的各种技术固定在一起。在所示的特定实施例中,支撑部分242、244经由缝合线272与支撑部分242、244的连合点248和连合支撑件262相邻地固定在一起。注意,在该特定实施例中,第一支撑带242同心地设置在第二支撑带244内,并且第二带244的弱化区域264在第一带242中的重叠端254之上与缝合线256相邻设置,使得当第二支撑带244和第一支撑带242由于扩张而断裂时,相应的断开处将处于围绕支撑支架240周边的相同位置处。
在替代实施例中,弱化区域264可以周向地从缝合线256和重叠端254移位,诸如在绕周边离开从几度到完全相反处(即180度)的任何地方的位置。第二支撑带244的弱化区域264可以周向地从缝合线256/重叠端254移位,但仍然设置在相同的一对连合柱262之间,其中缝合线256/重叠端254设置在该对连合柱262之间。注意,第一支撑带242和第二支撑带244中的一个或两者可以具有设计成当受到足够的径向压力时失效的多个弱化区域。例如,第一支撑带242可以具有以缝合线256和重叠端254的形式的单个弱化区域,其中第二支撑带244具有多个弱化区域264(诸如3个不同的弱化区域,其中一个弱化区域设置在每对连合柱262之间)。第一支撑部分和第二支撑部分的弱化区域的偏移可以提高扩张后的结构的结构完整性。
图12G-12J示出图12A-12F中所示的第一和第二人工心脏瓣膜支撑带的变化,其中第一带265的外部包括前述波浪形尖瓣266和截短的连合267,并且由具有与连合之一相邻而不是在尖瓣处的两个自由端268a、268b的单个元件形成。当与内带或第二带269对准时,缝合线270可以用于诸如通过使用对齐孔将对准的连合区域固定在一起,以形成复合支架271,如在图12J中看到的。在组装到人工心脏瓣膜,诸如图5A的瓣膜130之后,支架271最初为瓣膜提供良好的周向支撑并抵抗来自天然心脏循环力的压缩或扩展。在将来的某一天,如果瓣膜需要置换,则球囊或其他机械扩展器可以被推进到瓣环并插入限定在瓣膜内的孔口中。在具有自由端268a、268b的瓣膜连合处的缝合线270将最终由于球囊的向外扩展力而断裂,从而允许瓣膜扩展。优选地,内带269由对球囊力拥有相对小的抵抗性的聚合物制成,并且最终会拉伸并甚至断裂。为了促进此过程,诸如在图12I中看到的一个或多个小凹口272可以被提供在内带269的连合的底边缘处。将断裂点定位在连合之一处具有允许瓣膜扩展而不太多地改变连合柱的周向间距的附加好处。也就是,例如,在具有间隔120°的三个柱(和三个小叶)的瓣膜中,外带265的下尖瓣266将稍微滑开,内带269的尖瓣部分也将如此,但直立的柱将基本上保持在相同位置中。扩展幅度没有大到扭曲结构的程度,并且因此主瓣膜的直立柱将保持相隔120°,以便不干扰次要瓣膜的功能或不影响(主动脉瓣膜中的)瓣膜窦移动和促进流动的能力。
图12K-12M示出第一人工心脏瓣膜支撑带265的另外变化。图12K中的修改的外带265’包括在尖瓣266’之一处的两个自由端,尖瓣266’保持与若干缠绕式接头(未标号)对齐。最初相对于带轴线轴向延伸的一个自由端的接头可以在组装期间围绕另一个自由端弯曲。在一个或另一自由端上的凹口或肩形件防止带265’被压缩,但该布置允许诸如用瓣膜内的扩张力扩展。在测试中,图12K中的重叠接头构造产生范围在1至5大气压之间的约3.17大气压的平均断裂压力。图12L示出具有在尖瓣266’处重叠的自由端的另一修改的外带265”,其中一个自由端在另一个自由端内侧径向地滑动。如以下图13A-13B中所示,缝合线而不是柔性套管被缠绕多次,例如四次,以保持两个自由端的对齐。此外,小接头(未标号)从每个自由端径向地向外延伸,以阻碍带的压缩,但接头被定位和倾斜使得其不会不适当地干扰带265”的扩展。当测试断裂强度时,图12L中的构造产生范围在2至4.25大气压之间的约3.0大气压的平均断裂压力。图12M示出具有在尖瓣266”’处的重叠自由端的另外的可替换带265”’。内自由端上的小接头向外穿过外自由端中类似大小的狭槽,类似于带扣。接头的形状可以类似于箭头,以提供各种各样的锁定并防止其从狭槽移除。同样,这限制了两个自由端到允许带扩展但防止压缩的一个方向的相对运动。图12M中用于带扣结构的断裂强度是在约6.5至8大气压之间。
最后,图12N示出具有带有穿过对齐孔固定的凸形部分A和凹形部分B的聚合物铆钉的另外的外带265””的连合部分。铆钉A/B可以扣合在一起,或通过加热或超声焊接熔合。一个变型是穿过对齐孔并通过锻造端部、粘合剂或用螺纹接合带的两个自由端的聚合物销或螺钉。分离端部并扩展带265””所需的力取决于所使用的聚合物的类型。另一种替代方案是形成生物可降解材料的铆钉A/B,其将在植入后将所述带保持在一起一段时间,并且然后溶解,从而使带265””容易扩展。另外,来自其中一个孔的材料可以诸如通过锻造被机械地变形为另一孔,以在需要时通过拖延力提供可以克服的某些干扰。当然,这些结构的组合也是可能的,诸如将带扣接头/狭槽与缠绕式接头组合。
现在参考图13A-13D,示出了可以与本文所公开的各种可扩展心脏瓣膜的任何一种一起使用的另外的可替换的第一带或外带273。带273具有在带的多个尖瓣中的一个尖瓣区域中重叠的两个自由端274a、274b。自由端274a、274b包括允许两个端部彼此滑离的交错接头275。在所示的实施例中,一个自由端274a具有包围另一自由端274b上的单个接头的一对接头275。期望的是,接头各自包括放大的头部和更细长的柄,其中头部径向地重叠并在特定的向外扩展下接合。自由端274a、274b因此防止带273的收缩并允许其有限的扩展。扩展需要相对低的力来使自由端274a、274b相对于彼此滑动,并且带273期望地与带有弱化尖瓣的内带耦连,诸如在图11E中的244处所示的。相同的交错结构可以被提供在所有三个尖瓣处或在连合处,尽管尖瓣区域非常适合于该结构。
最后,图14A-14C示出另一个“滑动”接合,其中第一带或外带276包括相对于彼此滑动的两个重叠自由端277a、277b。自由端277a、277b的形状基本上为矩形,并且一个端部径向地驻留在另一个端部内并紧靠另一个端部。套管278包围自由端277a、277b并径向地将它们保持在一起。期望的是,套管278包括诸如硅橡胶的弹性材料,并且被显示为透明的以示出配合的自由端277a、277b。参考图14C中的放大,两个自由端277a、277b可以滑开预定距离,同时仍然重叠。柔性套管278提供最小量的摩擦,但一般仅用来保持自由端277a、277b的对齐。每个自由端277a、277b还包括周向取向的狭槽279,其未达到终端并且为流体流提供路径。如在图14A和图14B中看到,狭槽279从套管278更远地向外延伸,使得流体可以总是进入该套管内的空间。在组装和存储期间,狭槽279允许流体在重叠自由端277a、277b之间的流动,以考虑到灭菌。
图15A示出为(现有)人工心脏瓣膜扩张和(置换)可扩展人工心脏瓣膜部署而构造的可扩展人工心脏瓣膜部署导管320。部署导管320具有细长的主体322、近端324和远端326。近端324包括手柄328。远端326包括其上安装可扩展人工瓣膜332的扩张球囊330。在所示的特定实施例中,可扩展的人工瓣膜332包括支架334。远端326也可以包括一个或多个不透射线标记333或类似可视标记,以当使用荧光透视或其他可视技术时改善装置在患者体内的可视性。
图15B-15D示出可扩展的人工心脏瓣膜332在心脏瓣膜环336内的部署,其中人工心脏瓣膜318已预先部署在心脏瓣膜环336中。先前部署的人工心脏瓣膜318可以使用任何方法部署,包括当前在本领域中已知的方法,诸如传统的(开胸)外科手术、微创(例如,钥孔)外科手术和经皮外科手术。根据特定的应用,如图15B-15D中所示,先前部署的人工心脏瓣膜318可以在可扩展的人工心脏瓣膜332的部署之前的若干年、若干日、若干小时或立即被部署在患者体中。
图15B示出图15A的可扩展的人工心脏瓣膜部署导管320,其中远端326被推进使得扩张球囊330和可扩展的人工心脏瓣膜332定位在患者心脏340中先前部署的人工心脏瓣膜318内。先前部署的人工心脏瓣膜318的横截面可见,以示出大致刚性和/或抗扩展的支撑框架338。
在图15B中所示的特定实施例中,部署导管320已经在导丝342之上推进,导丝342在部署导管320推进到患者体内之前推进到患者的心脏340和先前部署的人工心脏瓣膜318中。注意,导丝342的使用是任选的。除了或代替导丝,也可以使用其他引导装置。例如,可以使用引导导管,其中引导导管被推进到患者体内的期望位置,并且然后部署导管在引导导管的内部推进到患者体内,直到部署导管的远端从引导导管中的远侧开口延伸。也可以在不带有任何类型的导丝或引导导管的情况下使用部署导管,使得部署导管由其本身引导到期望的治疗位置中。
如图15C中所示,一旦扩张球囊330和可扩展的人工心脏瓣膜332适当地定位在心脏瓣膜环和先前部署的人工心脏瓣膜318内,扩张球囊330就扩展。扩展中的扩张球囊330迫使支架334向外扩展,并迫使先前部署的人工心脏瓣膜318的小叶抵靠心脏瓣膜环336。来自扩展中的扩张球囊330的力也使先前部署的人工心脏瓣膜318扩张,从而迫使先前部署的人工心脏瓣膜318的支撑框架338扩展。
在图15D中,扩张球囊330放气或以其他方式在直径上减小,其中新的可扩展人工瓣膜332部署在心脏瓣膜环336和先前部署的人工心脏瓣膜318中,并也由支架334保持在适当的位置。来自扩展的支架332的向外压力以及来自心脏瓣膜环336和来自先前部署的人工心脏瓣膜318的任何弹性部分(诸如芯、索和/或盖)的向内压力或来自先前部署的人工心脏瓣膜小叶344的向内压力组合,以牢固地将新的可扩展人工瓣膜332安置在心脏瓣膜环336和先前部署的人工心脏瓣膜318中的期望位置中。然后,部署导管320与扩张球囊330可以从心脏340抽出,将新的可扩展人工心脏瓣膜332留在患者体内其部署位置和先前部署的人工心脏瓣膜318中。
在本发明的另外的实施例中,先前部署的人工心脏瓣膜318在与可扩展的人工心脏瓣膜332的部署独立的步骤中扩张。图16A示出使用两个独立的球囊并更具体地远侧球囊330a和近侧球囊330b为先前部署的人工心脏瓣膜扩张和可扩展的人工心脏瓣膜部署而构造的可扩展的人工心脏瓣膜部署导管320。远侧球囊330a被构造成部署设置在远侧球囊330a上的新的可扩展人工瓣膜332,而近侧球囊330b被构造用于先前部署的人工心脏瓣膜318的扩张。
图16B-16D示出使用近侧球囊330b的先前部署的人工心脏瓣膜318和瓣膜环336的扩张。在图16B中,部署导管320已经推进到心脏330中,其中远侧球囊330a(在其上具有可扩展的人工瓣膜332)被推进穿过先前部署的人工心脏瓣膜318,并且近侧球囊330b设置在先前部署的人工心脏瓣膜318和瓣膜环336内。
近侧球囊330b被充气或以其他方式扩展,如图16C中所示,从而扩张先前部署的人工心脏瓣膜318和瓣膜环336。先前部署的人工心脏瓣膜318的支撑框架338被类似地扩展到先前相对于结合上面的图16C讨论的扩张而讨论的变化。
在先前部署的人工心脏瓣膜318的扩张之后,近侧球囊330b被放气或以其他方式在直径上减小,如图16D中所示。然后,部署导管320可以从患者体内抽出,直到近侧球囊330b在先前部署的人工心脏瓣膜318的近侧并且远侧球囊330a定位在先前部署的人工心脏瓣膜318内。远侧球囊330a将以与图15B中的球囊330所示的方式类似的方式定位在先前部署的人工心脏瓣膜318内。然后,远侧球囊330a将被扩展,从而以基本上与在图15B-15D中所讨论和所示的方式类似的方式部署可扩展的人工瓣膜332。远侧球囊330a将用来部署新的可扩展的人工瓣膜332,并且也可以用来进一步扩张先前部署的人工心脏瓣膜318和/或天然瓣膜环336。
注意在替代实施例中,两个独立的导管用于扩张先前植入的人工瓣膜。第一球囊导管是传统的扩张导管并且在患者体内被推进到先前部署的心脏瓣膜内的位置。第一球囊导管的球囊扩展到足以扩张(径向地扩展)先前植入的人工瓣膜的期望压力(例如,4-5大气压)。第一球囊导管然后从患者体内抽出,并且具有球囊和新的可扩展人工心脏瓣膜在其上的第二球囊导管(诸如图15A-15D中所示的导管)被推进到患者体内,该球囊被扩展以将新的可扩展人工心脏瓣膜部署在先前植入的(和现在扩张的)人工心脏瓣膜内,并且第二球囊导管从患者体内抽出。
注意,可扩展的人工瓣膜可以是自扩展的,在这种情况下部署导管可以不具有如图15A-15D和图16A-16D中所示的扩张球囊。而且,此类自扩展的人工心脏瓣膜可以在先前部署的人工心脏瓣膜的先前扩张或不扩张的情况下被部署。例如,自扩展的人工心脏瓣膜可以提供足够的向外径向力,以扩张先前部署的人工心脏瓣膜和/或以使现在扩张的先前部署的人工心脏瓣膜保持在扩展构造,以便为处于其扩展构造的自扩展人工心脏瓣膜提供足够的空间。
虽然本发明已经参考特定的实施例进行描述,但是将理解的是在不背离本发明的范围或其发明概念的情况下可以作出各种变化和额外的变型,并且等同物可以代替其元件。另外,可以作出许多修改,以使特定的情况或装置适应本发明的教导,而不脱离其实质范围。因此,本发明意在不限于本文公开的特定实施例,但是本发明将包括落入随附权利要求的范围内的所有实施例。
- 还没有人留言评论。精彩留言会获得点赞!