化合物在制备用于治疗脑胶质瘤的药物中的用途的制作方法
本发明涉及生物医药领域,具体地,本发明涉及一种化合物在制备用于治疗脑胶质瘤、特别是胶质母细胞瘤的药物中的用途。
背景技术:
胶质母细胞瘤是脑胶质瘤中恶性程度最高的胶质瘤。该肿瘤位于皮质下,多数生长于幕上大脑半球的各处;呈浸润性生长,常侵犯几个脑叶,并侵犯深部结构,还可经胼胝体波及对侧大脑半球;发生部位以额叶最多见,其他依次为颞叶、顶叶,少数可见于枕叶/丘脑和基底节等。
胶质母细胞瘤生长速度快、病程短,70-80%患者病程在3-6个月,病程超过1年者仅10%。个别病例因肿瘤出血,可呈卒中样发病,由于肿瘤生长迅速,脑水肿广泛颅内压增高症状明显,几乎全部患者都有头痛、呕吐、视盘水肿有头痛、精神改变、肢体无力、呕吐、意识障碍与言语障碍。该肿瘤浸润性破坏脑组织,造成一系列的局灶症状,患者有不同程度的偏瘫、偏身感觉障碍失语和偏盲等。神经系统检查可发现偏瘫、脑神经损害、偏身感觉障碍与偏盲。约33%的患者有癫痫发作,约20%的患者表现淡漠、痴呆、智力减退等精神症状。
胶质母细胞瘤可分为由低级别脑胶质瘤发展而来的继发性胶质母细胞瘤(secondaryglioblastoma)和不表现低度病变恶性前期的原发性胶质母细胞瘤(primaryglioblastoma)两类。
原发性胶质母细胞瘤是从第一次临床诊断即为iv级胶质母细胞瘤,其最明显的分子特征是egfr扩增、突变或过表达(40%),p53突变(30%),cdkn2a/b缺失(30-40%),rb1突变或缺失,10号染色体丢失(70%),以及pten突变(30%)等。
与其相对应地,继发性胶质母细胞瘤是由低级别脑胶质瘤(ii级或iii级)进展而来的iv级胶质母细胞瘤。它的临床第一次诊断为低级别胶质瘤,一般经过手术或者放化疗之后肿瘤再次出现,进而级别进展到iv级胶质母细胞瘤。研究发现,继发性胶质母细胞瘤的分子标志物及基因细胞通路与原发性胶质母细胞瘤不同。已经发现异柠檬酸脱氢酶(isocitratedehydrogenase,“idh”)的突变只在继发性胶质母细胞瘤中,但并非所有的继发性胶质母细胞瘤均会发生异柠檬酸脱氢酶的突变。目前继发性胶质母细胞瘤的分子标志研究中最受关注的是异柠檬酸脱氢酶1突变(70%),另外还包括p53突变(65%),pdgfa和pdgfra过表达(60%),19号染色体长臂的缺失(50%),以及rb1的突变或者缺失(25%)。这些分子标志物的发现为胶质母细胞瘤的靶向治疗提供了重要靶点。然而,虽然针对这些分子标志物的靶向药物已经很多,但都出于各种原因而未真正进入临床应用阶段,究其原因多为靶向关系的特异性低,导致药物的疗效较差且副作用大,不适于临床应用。
因此,对于脑胶质瘤、特别是胶质母细胞瘤,目前需要具有更高靶向特异性、能够实现精准治疗的药物。
肝细胞生长因子受体(hgfr,又称c-met),由met基因编码,属于受体酪氨酸激酶家族,在与其配体肝细胞生长因子结合后使受体细胞内的区域自动磷酸化而激活下游信号通路,从而调节细胞增殖、形态形成和能动性等。已发现存在多种c-met异常,常出现于不同肿瘤内。另外研究发现,由ptprz1基因编码的磷酸酶(属于受体蛋白酪氨酸激酶家族,又称rprpb)能够将c-met的特定磷酸位点去除而使met信号通路失活,由此推断,这个蛋白与c-met可能存在某种结合关系,并影响c-met在疾病发生、发展中的作用。
技术实现要素:
针对上述问题,本发明的目的是提供对脑胶质瘤、特别是胶质母细胞瘤具有高度靶向特异性、能够实现个性化精准治疗的药物。
本发明的发明人经过大量研究发现,对于脑胶质瘤、特别是胶质母细胞瘤,式a化合物作为c-met抑制剂,相比于其他c-met抑制剂,具有更为显著地抑制胶质母细胞瘤的作用;特别是在表达特定融合蛋白、从而造成预后更差的胶质母细胞瘤亚型中,其抑制作用更为显著。基于此,本发明提供以下技术方案:
本发明提供如式a所示的化合物在制备用于治疗脑胶质瘤的药物中的用途:
式a所示的化合物可以按照中国专利申请公开文件cn103122000a的实施例44中所述步骤与路线进行合成。
优选地,所述脑胶质瘤为胶质母细胞瘤。
更优选地,所述脑胶质瘤为继发性胶质母细胞瘤。
研究发现,一方面,在继发性胶质母细胞瘤中可表达特定融合蛋白,该融合蛋白包含c-met氨基酸序列的大部分,并且在c-met氨基酸序列部分的n端融合了ptprz1氨基酸序列的一部分。式a所示的化合物对表达该融合蛋白的胶质母细胞瘤亚型具有更好地增殖和成瘤抑制作用。
因此,优选地,本发明提供式a所示的化合物在制备用于治疗继发性胶质母细胞瘤亚型的药物中的用途,其中所述继发性胶质母细胞瘤为表达融合蛋白的继发性胶质母细胞瘤亚型,所述融合蛋白(本文又称为“zm”)由ptprz1外显子1、外显子1至2、外显子1至3或外显子1至8翻译的蛋白质与c-met外显子2至24翻译的蛋白质融合形成,其中ptprz1蛋白质部分处于c-met蛋白质部分的n端。
优选地,所述融合蛋白包含seqidno:1所示的氨基酸序列。
优选地,所述融合蛋白还包含seqidno:2所示的氨基酸序列。
更优选地,所述融合蛋白包含:seqidno:1所示的氨基酸序列;和在其n端的seqidno:2所示的氨基酸序列。
最优选地,所述融合蛋白包含seqidno:3、seqidno:4、seqidno:5或seqidno:6所示的氨基酸序列。
根据本发明的具体实施方式,所述融合蛋白的氨基酸序列如seqidno:3、seqidno:4、seqidno:5或seqidno:6所示。本文中将氨基酸序列如seqidno:3所示的融合蛋白命名为“zm1-2”,将氨基酸序列如seqidno:4所示的融合蛋白命名为“zm2-2”,将氨基酸序列如seqidno:5所示的融合蛋白命名为“zm3-2”,将氨基酸序列如seqidno:6所示的融合蛋白命名为“zm8-2”。
基于上述技术方案,本发明如上所述的融合蛋白在胶质母细胞瘤细胞中的表达可以使用抗体经由免疫杂交进行检测。在待检测蛋白的氨基酸序列已知的情况下,使用针对其的抗体(例如,单克隆抗体或多克隆抗体)经由免疫杂交来检测该蛋白在特定组织或细胞中的表达,属于本领域常规技术。检测可以针对融合蛋白的片段或全长进行。根据本发明的具体实施方式,可以采用抗人c-met蛋白的抗体来检测本发明如上所述的融合蛋白的表达。事实上,基于融合蛋白是否在胶质母细胞瘤细胞中表达,可以对胶质母细胞瘤进行分型,进而采用本发明提供的式a所示化合物进行治疗。
另一方面,在继发性胶质母细胞瘤中可包含特定融合转录物,该融合转录物包含c-met大部分的编码rna,并且在c-met的编码rna的5’端融合了ptprz1一部分的编码rna。式a所示的化合物对包含该融合转录物的胶质母细胞瘤亚型具有更好地增殖和成瘤抑制作用。
因此,优选地,本发明提供式a所示的化合物在制备用于治疗继发性胶质母细胞瘤亚型的药物中的用途,其中所述继发性胶质母细胞瘤为包含融合转录物的继发性胶质母细胞瘤亚型,所述融合转录物由ptprz1外显子1、外显子1至2、外显子1至3或外显子1至8转录的rna与c-met外显子2至24转录的rna部分连接而成,其中ptprz1的rna部分处于c-met的rna部分的5’端。
优选地,所述融合转录物包含seqidno:1所示氨基酸序列的编码rna。
优选地,所述融合转录物还包含seqidno:2所示氨基酸序列的编码rna。
更优选地,所述融合转录物包含:seqidno:1所示氨基酸序列的编码rna;和在其5’端的seqidno:2所示氨基酸序列的编码rna。
最优选地,所述融合转录物包含seqidno:3、seqidno:4、seqidno:5或seqidno:6所示氨基酸序列的编码rna。根据本发明的具体实施方式,所述融合转录物的核苷酸序列由seqidno:3、seqidno:4、seqidno:5或seqidno:6所示氨基酸序列的编码rna组成。
同样基于上述技术方案,本发明如上所述的融合蛋白在胶质母细胞瘤细胞中的表达也可以基于对上述融合转录物即其编码rna的检测。在待检测蛋白的氨基酸序列已知的情况下,对其编码rna进行检测也属于本领域常规技术,并且检测也可以针对融合蛋白的片段或全长进行。例如,可以提取总rna作为模板或者可以将总rna逆转录获得cdna作为模板,利用特定引物进行pcr扩增。事实上,基于融合转录物是否存在于胶质母细胞瘤细胞中,也可以对胶质母细胞瘤进行分型,进而采用本发明提供的式a所示化合物进行治疗。
因此,本文还提供融合蛋白zm1-2、zm2-2、zm3-2和zm8-2的cdna序列,分别如seqidno:7、seqidno:8、seqidno:9或seqidno:10所示。
基于本发明提供的技术方案,临床上可以采用式a所示的化合物进行脑胶质瘤、特别是胶质母细胞瘤的治疗,包括给有此需要的受试者施用治疗有效量的式a所示的化合物或者包含式a所示的化合物的任何类型的药物组合物。给药剂量与方式取决于受试者的个体健康状况、疾病症状及其严重程度等,并且需要由主治医师根据具体情况判定。
特别地,当实施精准治疗方案时,可以临床上先检测待治疗受试者的肿瘤样本、如胶质母细胞瘤样本中是否表达如上所述的融合蛋白或是否存在如上所述的融合转录物,和/或检测所述融合蛋白或所述融合转录物在样本中的含量,如果待治疗受试者的样本中存在如上所述的融合蛋白或融合转录物,或者如果所述融合蛋白或融合转录物的含量高于正常受试者或其他相关对照样本中的量,则使用式a所示的化合物或包含其的药物组合物进行给药。其中,所述融合蛋白或融合转录物在样本中的存在或其含量可以通过本领域已知常规技术进行检测,例如上文示例的免疫杂交和pcr。
临床研究表明,具有本发明所述融合蛋白表达或存在本发明所述融合转录物的胶质母细胞瘤具有更差的预后,患者的存活期要显著短于不具有所述融合蛋白或融合转录物的患者的存活期(127天相对于248天)。而对于这部分胶质母细胞瘤的患者,本发明提供的式a所示的化合物相对于其他同类药物具有特别的治疗优势。
并且,在进行脑胶质瘤、特别是胶质母细胞瘤的治疗时,式a所示的化合物可以与其它疗法或治疗剂共同施用,施用方式可以为同时、顺序或以一定时间间隔进行。给药剂量与方式取决于受试者的个体健康状况、疾病症状及其严重程度等,并且需要由主治医师根据具体情况判定。
与现有技术相比,本发明还具有以下有益技术效果:
本发明通过式a所示的化合物对胶质母细胞瘤细胞系的体外增殖、体内成瘤的实验,首次证明了式a所示的化合物相比于其他c-met抑制剂,可以更为显著地抑制胶质母细胞瘤的发展。具体而言,实验证明,与结构相近的c-met抑制剂化合物相比,式a所示的化合物实现了显著更强的细胞活力抑制效果,动物体内成瘤抑制效果也更强,其细胞与体内实验结果均证明,式a所示的化合物的胶质母细胞瘤抑制作用接近于克唑替尼,甚至强于克唑替尼。特别是,克唑替尼的分子量大于式a所示的化合物,因此更不容易通过血脑屏障,到达肿瘤的药量更少,发挥作用更有限。并且,克唑替尼是双靶点药物,研究表明它在抑制c-met的同时还抑制alk,因此导致较大副作用。相比之下,式a所示的化合物仅针对c-met,所以副作用比较小。
特别地,实验证明式a所示的化合物对表达特定融合蛋白的继发性胶质母细胞瘤具有更为显著的抑制作用,效果远高于其他同类化合物或已知治疗药物。通过对胶质母细胞瘤是否表达本文所述融合蛋白或是否存在本文所述融合转录物的检测,可以将表达融合蛋白或存在融合转录物的胶质母细胞瘤亚型与其他胶质母细胞瘤相区分,进而采用式a所示的化合物进行有效治疗,由此可以实现胶质母细胞瘤患者的个性化精准治疗,由此从根本上解决这种特定类型胶质母细胞瘤的不良预后的问题;同时基于式a所示化合物的作用机制,可以避免副作用,减轻患者痛苦,使得药物治疗更加安全、有效,最终提高该疾病治疗与预后的成本效益。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1显示了本发明提供的seqidno:3所示的融合蛋白(zm1-2)和seqidno:4所示的融合蛋白(zm2-2)的cdna序列部分测序结果。
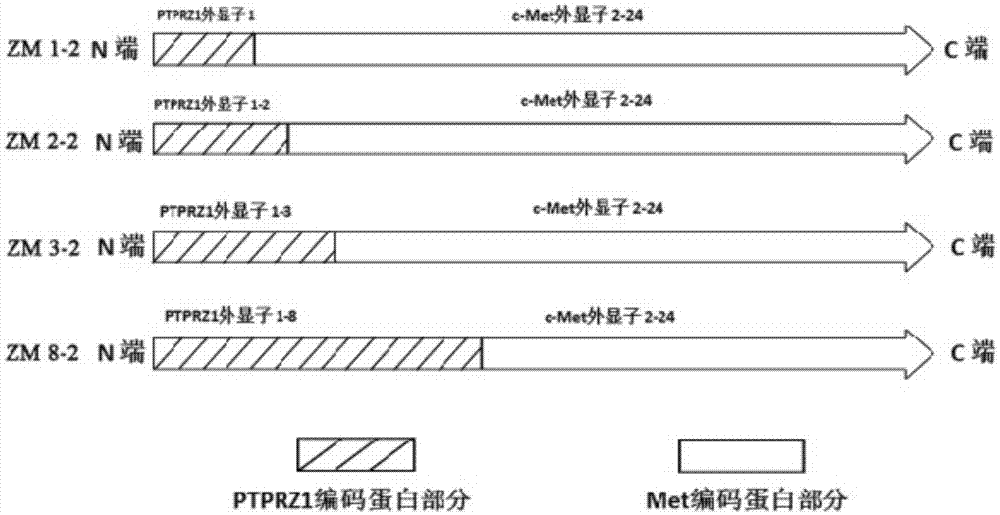
图2显示了本发明提供的融合蛋白的结构。
图3显示了实施例3中本发明提供的融合蛋白的免疫杂交印迹结果,其中条带1为融合蛋白zm8-2,条带2为融合蛋白zm2-2,条带3和4分别为对照。
图4显示了慢病毒载体pcdh-ef1-mcs-t2a-puro的结构示意图,其中示出了融合蛋白编码序列的插入位置。
图5显示了实施例5中体内肿瘤生长抑制实验的结果。
图6显示了实施例5中小鼠存活实验的结果。
图7显示了实施例5中胶质母细胞瘤体内成瘤实验的脑部核磁共振成像结果,其中图7a示出了建模得到的载体小鼠(2)的脑部,图7b示出了建模得到的zm2-2小鼠(2)的脑部,图7c示出了进行式a化合物给药的zm2-2小鼠(2)在首次给药后第16天的脑部,图7d示出了进行式a化合物给药的zm2-2小鼠在首次给药后第16天撤药并持续10天后的脑部。
具体实施方式
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。
实施例1:胶质母细胞瘤的rna和cdna的获得
使用符合医学伦理委员会标准的操作,收集胶质母细胞瘤的样本80例。其中,每一个收集样本都预先得到样本来源的患者本人及其治疗专家的同意,并具有书面的证明材料。样本的性别、年龄和疾病类型信息如表1所示。
表1
使用rna提取试剂盒(购自qiagen),按照其使用说明书提取胶质母细胞瘤样本的总mrna。经完整性分析仪检测,确认该总mrna完整性指数(rnaintegritynumber,rin)大于7.0。
使用反转录试剂盒(revertaidfirststrandcdnasynthesiskit,k1622,购自invitrogen),按照其使用说明书以该总mrna为模板进行20μl体系逆转录,从而合成双链cdna。
实施例2:本发明所述融合蛋白在胶质母细胞瘤中的检测
以实施例1中制得的双链cdna为模板,以下述引物序列进行扩增:
正向引物:
seqidno:11atgcgaatcctaaagcgtttcctcg
反向引物:
seqidno:12ctatgatgtctcccagaaggaggct
20μl扩增体系为:10μm正向引物1μl;10μm反向引物1μl;模板100ng;2xphusionmastermix(neb公司货号m0531)10μl;无核酸酶水补足到20μl;
pcr程序设定:98℃30sec;98℃10sec,60℃30sec,72℃1.5min,共30个循环;72℃5min;12℃保持。
pcr产物用1%的琼脂糖凝胶电泳,所出现的扩增条带使用dna凝胶回收试剂盒(qiaquickpcrpurificationkit,购自qiagen)进行回收,然后克隆至t载体(pgem-teasyvector,购自promega),并用dna测序仪(abiprism3730×ldnasequencer,购自appliedbiosystems)进行测序。
测序结果证明,扩增得到两条不同核苷酸序列,二者之间有66个核苷酸区别,分别如seqidno:7和seqidno:8所示。该核苷酸序列部分测序结果见图1。此外,还通过对部分样本的全基因组dna进行测序,发现了融合蛋白zm3-2和zm8-2基因组dna的存在。
对照样本来源,发现在表1的60、64、77、78和80号样本中存在相应融合蛋白的cdna或基因组dna,其中第60号发现了融合蛋白zm1-2,第64号和第78号发现了融合蛋白zm2-2,第77号发现了融合蛋白zm3-2,第80号发现了融合蛋白zm8-2。结果表明,本发明所述的融合蛋白与其编码rna或基因组dna特异性地出现在一部分胶质母细胞瘤中,而不出现在另外一部分胶质母细胞瘤中,且几乎全部发生在继发性胶质母细胞瘤中。
由此得到融合蛋白的氨基酸序列如seqidno:3(融合蛋白zm1-2)、seqidno:4(融合蛋白zm2-2)、seqidno:5(融合蛋白zm3-2)、和seqidno:6(融合蛋白zm8-2)所示,经过序列比对,发现四种融合蛋白从n端至c端均为ptprz1部分蛋白与c-met几乎完整蛋白融合而成,其中融合蛋白zm1-2为ptprz1外显子1和c-met外显子2-24融合形成,融合蛋白zm2-2为ptprz1外显子1-2和c-met外显子2-24融合形成,融合蛋白zm3-2为ptprz1外显子1-3和c-met外显子2-24融合形成,融合蛋白zm8-2为ptprz1外显子1-8和c-met外显子2-24融合形成,在四种融合蛋白中均不具有c-met启动子和外显子1(无作用元件),因此推测融合基因的转录采用ptprz1的启动子。四种融合基因的结构示意见图2。
此外,临床研究发现,存在本发明所述融合蛋白的胶质母细胞瘤的病例的平均中位生存时间为127天,短于已报道的胶质母细胞瘤的病例的平均中位生存时间(248天),由此说明继发性胶质母细胞瘤中,出现了本发明所述的表达融合蛋白的胶质母细胞瘤亚型的病例具有更差的预后。
实施例3:融合蛋白在胶质母细胞瘤中的免疫杂交验证
对实施例1收集的80例胶质母细胞瘤样本的总蛋白进行融合蛋白的免疫杂交验证。
免疫杂交验证所用的抗体为抗人c-met蛋白的抗体(抗体来源为兔,购自abcam,货号ab51067)。非融合的人c-met蛋白大小为145kda,而融合蛋白的分子量有所增大。免疫杂交的操作参照抗体说明书和免疫杂交试剂盒说明书进行。
杂交结果表明,免疫杂交条带的出现与实施例2的结果一致,即在表1样本的第60、64、77、78和80号样本(均为继发性胶质母细胞瘤样本)中出现杂交条带。图3示出了zm8-2和zm2-2的杂交结果,其中zm8-2分子量约为190kda,zm2-2与非融合的人c-met蛋白分子量接近,杂交条带显示为接近重合。
由此得知,发明所述的融合蛋白特异性地表达于部分胶质母细胞瘤中,而不表达于另一部分胶质母细胞瘤中,由此可以将胶质母细胞瘤分为表达融合蛋白的胶质母细胞瘤亚型和不表达表达融合蛋白的胶质母细胞瘤亚型。
实施例4:式a所示的化合物抑制胶质母细胞瘤细胞增殖的活性测定
采用式a所示的化合物与克唑替尼以及与式a结构相近的式b-h所示的化合物一起进行胶质母细胞瘤细胞增殖的抑制活性实验。
式a-h所示的化合物:按照中国专利申请公开文件cn103122000a中所述步骤与路线进行合成。
式a(cn103122000a中的实施例44)
式b(cn103122000a中的实施例28)
式c(cn103122000a中的实施例29)
式d(cn103122000a中的实施例37)
式e(cn103122000a中的实施例38)
式f(cn103122000a中的实施例46)
式g(cn103122000a中的实施例47)
式h(cn103122000a中的实施例49)
克唑替尼(crizotinib;pf-02341066):货号s1068,购自selleck,美国。
首先采用慢病毒载体pcdh(pcdh-ef1-mcs-t2a-puro,sbi公司,货号cd510b-1,结构示于图4),按其说明书操作,将seqidno:7和seqidno:8所示的核苷酸序列克隆到该载体中,制备表达seqidno:3和seqidno:4所示融合蛋白的表达载体,分别命名标记为“pcdh-zm1-2”和“pcdh-zm2-2”。然后用病毒的包装质粒(sbi公司,货号lv500a-1)共转染293t细胞以制备慢病毒。同样方法包装慢病毒载体pcdh,共转染293t细胞,制备具有空白载体的慢病毒,命名为“pcdh-blank”。
人类胶质瘤细胞系u87购自中国医学科学院细胞库,其不表达本发明提供的任意一种融合蛋白。用上文制备的慢病毒感染u87细胞,进行嘌呤霉素筛选(0.5μg/ml筛选,0.2μg/ml维持),从而建立稳定表达融合蛋白的细胞模型,并用免疫杂交和反转录pcr验证上述细胞模型具有融合蛋白的表达和融合基因的转录,最终分别得到稳定表达融合蛋白zm1-2和zm2-2的细胞系,分别命名为“pcdh-zm1-2表达细胞”和“pcdh-zm2-2表达细胞”。同样用具有空白载体的慢病毒pcdh-blank感染u87细胞,命名为“pcdh-blank表达细胞”,作为空白对照。
将大皿培养的处于对数生长期的u87细胞用无菌pbs洗一遍,然后用0.25%的胰酶消化2分钟,待细胞全部消化游离后用含10%胎牛血清(fbs)dmem完全培养液终止消化,细胞计数后将细胞浓度调整到20000个/ml,然后用排枪将细胞种到coring96孔板中(2000个/孔)。细胞在37℃培养箱,5%co2环境中培养24小时。将测试化合物(克唑替尼、式a-h)分别溶于dmso配成储存液,然后用储存液和完全培养基将药物配成不同浓度(0,5,10,20,40,60,80,100),单位为μμ。再次放入培养箱中培养72小时,然后每孔加入20μl的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt),培养箱中放置1-3小时候在酶标仪中测定吸光度,波长为490nm。计算出各浓度相对应的抑制率,用graphpad软件计算出ic50的值。结果见表2。
表2
由表2的结果可知,在人类胶质瘤细胞系u87本身以及空白对照细胞系u87中,与结构相近的式f-g所示的化合物相比,式a所示的化合物实现了显著更强的细胞活力抑制效果,其增殖抑制作用接近于克唑替尼,甚至强于克唑替尼。
此外,实验过程中发现具有融合蛋白zm1-2和zm2-2表达的胶质母细胞瘤的细胞增殖明显加快,而在这些细胞中,仅式a所示的化合物的施加能够显著抑制细胞活力,式b-h所示的化合物以及克唑替尼的细胞活力抑制效果均显著低于式a所示的化合物。
实施例5:式a所示的化合物抑制胶质母细胞瘤体内成瘤的活性测定
采用式a所示的化合物与克唑替尼一起进行胶质母细胞瘤体内成瘤的抑制实验。
(一)肿瘤生长抑制实验
首先建立荷瘤小鼠模型。购买维通利华公司balb/c(nu/nu)母系裸鼠,6-8周,体重16-18g左右。分别采用实施例4中制备的“pcdh-blank表达细胞”和“pcdh-zm2-2表达细胞”用pbs制成107个细胞/ml。将用75%酒精消毒后的裸鼠用100μl细胞悬浊液注射到右肩胛区皮下,其中pcdh-blank表达细胞注射7只裸鼠,pcdh-zm2-2表达细胞注射21只裸鼠。皮下接种约2-3天后,观察皮下实体瘤形成情况,约15天成瘤。一周测量2次肿瘤体积大小,老鼠体重变化。将“pcdh-blank表达细胞”注射得到的荷瘤小鼠命名为“载体小鼠(1)”,“pcdh-zm2-2表达细胞”注射得到的荷瘤小鼠命名为“zm2-2小鼠(1)”。
待瘤体长到体积大约100mm3时,将zm2-2小鼠(1)按瘤体大小平均后分成3组,包括式a所示的化合物给药组7只、克唑替尼给药组7只以及对照组7只。前两组分别进行式a所示的化合物给药10mg/kg/天,克唑替尼组50mg/kg/天体重的相应药物灌胃给药,药物用注射用生理盐水制成混悬液,持续搅拌给药,每天给药一次,持续给药。对照组进行生理盐水灌胃。一周2次测量肿瘤体积大小,老鼠体重变化。肿瘤直径用游标卡尺测量,肿瘤体积计算公式:肿瘤体积=0.5*长*宽2。肿瘤大小的变化如图5所示。结果证明,式a所示的化合物能够显著抑制zm2-2小鼠(1)组的肿瘤生长,其抑制作用甚至强于克唑替尼。
(二)小鼠生存实验
首先建立荷瘤小鼠模型。分别采用实施例4中制备的“pcdh-blank表达细胞”和“pcdh-zm2-2表达细胞”用pbs制成105个细胞/5μl。将用75%酒精消毒后的裸鼠用100μl细胞悬浊液进行种植,用小鼠脑立体定位仪确定细胞种植部位(前囟右侧旁开2mm,向后2mm),注射深度3.5mm,抬高0.6mm,注射细胞液5μl。注射完毕静止1分钟,常规皮肤缝合。带颅内观察到成瘤后,将采用“pcdh-blank表达细胞”得到的荷瘤小鼠命名为“载体小鼠(2)”,“pcdh-zm2-2表达细胞”注射得到的荷瘤小鼠命名为“zm2-2小鼠(2)”。
对小鼠进行脑部核磁共振成像发现,载体小鼠(2)颅内肿瘤体积方面要明显小于zm2-2小鼠(2)颅内肿瘤体积,由此证明,本发明所提供的融合蛋白的表达造成胶质母细胞瘤在小鼠体内的成瘤作用明显增强。结果分别见图7a和7b。
对载体小鼠(2)与zm2-2小鼠(2)各8只进行式a所示的化合物的给药,给药的剂量为50mg/kg体重/天,每天灌胃给药1次。同时,对另外一组8只zm2-2(2)小鼠进行生理盐水给药,作为对照。实验持续6周以上,结果发现,仅进行生理盐水给药的zm2-2小鼠(2)从20天开始陆续死亡,而进行式a所示的化合物给药的载体小鼠(2)全部存活,而式a所示的化合物给药下显著延长了zm2-2小鼠(2)的存活期,结果如图6所示。
在首次给药后第16天对式a化合物给药的zm2-2小鼠(2)进行脑部核磁共振成像,发现颅内肿瘤体积明显减小,结果见图7c,同样证明式a所示的化合物能够显著抑制zm2-2小鼠的肿瘤生长。
对另外8只zm2-2小鼠(2)也同样进行式a所示的化合物的给药,给药的剂量为50mg/kg体重/天,每天灌胃给药1次。然后在首次给药后第16天撤药,撤药后第10天进行了脑部核磁共振成像,发现肿瘤恢复快速生长,结果见图7d。
根据上述实验结果,可以看出,式a所示的化合物能够显著抑制表达本发明所提供融合蛋白的胶质母细胞瘤的生长,延长患者生存期,并且在撤去药物后肿瘤易复发。式a所示的化合物的抑瘤作用甚至强于克唑替尼,可以作为克唑替尼的替代药物。
并且,已经证明表达本发明所述融合蛋白的胶质母细胞瘤的病例的平均中位生存时间短于已报道的胶质母细胞瘤的病例的平均中位生存时间,由此说明胶质母细胞瘤中,出现了本发明所述的融合蛋白的病例具有更差的预后。而对于这种预后更差的胶质母细胞瘤亚型,式a所示的化合物相比于其他可作为c-met抑制剂的化合物以及克唑替尼,能够取得更好的疗效。
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
- 还没有人留言评论。精彩留言会获得点赞!