包封修饰的环糊精复合物的脂质体组合物及其应用的制作方法
本申请要求2014年1月14日提交的美国临时申请号61/927,233的优先权益,其内容通过引用结合到本文中。
权利声明
本发明是在政府支持下,在由美国国立卫生研究院(NIH)授予的资助CA 043460、CA 057345和CA 0062924下进行的。美国政府具有本发明的某些权利。本声明包括在内仅为遵守37 C.F.R. § 401.14(a)(f)(4)且不应视为本申请公开和/或要求仅仅一个发明的主张或认可。
发明背景
目前对开发用于药物传递的纳米颗粒有广泛的兴趣(Heidel和Davis (2011) Pharm. Res. 28:187-199; Davis等(2010) Nature 464:1067-1070; Choi等(2010) Proc. Natl. Acad. Sci. U.S.A. 107:1235-1240; Chertok等(2013) Mol. Pharm. 10:3531-3543; Hubbell和Langer (2013) Nat. Mater. 12:963-966; Mura等(2013) Nat. Mater. 12:991-1003; 和Kanasty等(2013) Nat. Mater. 12:967-977)。本研究领域特别涉及癌症药物,其中治疗比率(对有效性所需的剂量与造成毒性的剂量比)通常是低的。与用游离药物通过多种机制实现的治疗比率相比,携带药物的纳米颗粒可增加这种治疗比率。特别是,由纳米颗粒传递的药物由于增强渗透和滞留(EPR)效应,被认为选择性地提高药物在肿瘤中的浓度(Peer等(2007) Nat. Nanotech. 2:751-760; Gubernator (2011) Exp. Opin. Drug Deliv. 8:565-580; Huwyler等(2008) Int. J. Nanomed. 3:21-29; Maruyama等(2011) Adv. Drug Deliv. Rev. 63:161-169; Musacchio和Torchilin (2011) Front. Biosci. 16:1388-1412; Baryshnikov (2012) Vest. Ross. Akad. Med. Nauk. 23-31; Torchilin (2005) Nat. Rev. Drug Disc. 4:145-160; Matsumura和Maeda (1986) Cancer Res. 46:6387-6392; Maeda等(2013) Adv. Drug Deliv. Rev. 65:71-79; Fang等(2003) Adv. Exp. Med. Biol. 519:29-49; 和Fang等(2011) Adv. Drug Deliv. Rev. 63:136-151)。提高的渗透性由泄漏的肿瘤血管系统产生,而提高的滞留性由特征为恶性肿瘤的紊乱淋巴系统产生。
目前在这一领域的大量工作是致力于设计用于纳米颗粒生成的新材料。这种新一代的纳米颗粒可携带药物,特别是那些不溶于水性介质的药物,它们难以结合到传统的纳米颗粒如脂质体中。然而,老一代的纳米颗粒有一个重大的实际优势,即它们已在人类进行了广泛的测试并受到监管机构如美国食品和药品管理局和欧洲的欧洲药品署的批准。不幸的是,许多药物不能容易地或有效地加载到脂质体中,从而影响它们的一般应用。
一般来说,脂质体药物加载通过被动或者主动的方法实现(Gubernator (2011) Exp. Opin. Drug Deliv. 8:565-580; Kita和Dittrich (2011) Exp. Opin. Drug Deliv. 8: 329-342; Schwendener和Schott (2010) Method. Mol. Biol. 605:129-138; Fahr和Liu (2007) Exp. Opin. Drug Deliv. 4:403-416; Chandran等(1997) Ind. J. Exp. Biol. 35:801-809)。被动加载涉及干燥的脂质薄膜在含有感兴趣药物的水性溶液中的溶解。这种方法只能用于水溶性药物,且加载的效率往往是低的。相比之下,主动加载可以是极其有效的,导致高的脂质体内浓度和贵重化疗剂的最小的浪费(Gubernator (2011) Exp. Opin. Drug Deliv. 8:565-580; Fenske和Cullis (2008) Liposome Nanomed. 5:25-44;和Barenholz (2003) J. Liposome Res. 13:1-8)。在主动加载中,药物内化到预先形成的脂质体中通常是由跨膜pH梯度驱动的。脂质体外的pH允许一些药物以非离子化形式存在,能够跨脂质双层迁移。一旦在脂质体内,药物因不同的pH而被电离,就被截留在那里(图1A)。许多报告已强调脂质体负载对跨膜pH梯度的性质、膜-水分配、内部缓冲能力、药物的水溶性、脂质组成及其它因素的依赖性(Abraham等(2004) J. Control. Rel. 96:449-461; Haran等(1993) Biochim. Biophys. Acta 1151:201-215; Madden等(1990) Chem. Phys. Lipids 53:37-46; 和Zucker等(2009) J. Control. Rel. 139:73-80)。如在最近的模型中所述的(Zucker等(2009) J. Control. Rel. 139:73-80),药物的水溶性是有效的主动加载的必要条件之一。远程加载成功的另一个关键因素是小分子上弱碱性官能团的存在。
只有一小部分的化疗剂具有用已建立的技术主动加载所需的特征。这样的不可电离的药物主动加载到预形成的脂质体内的尝试导致差的加载效率(图1B)。这个问题的一个潜在的解决方案是添加弱碱性官能团至其它未能加载的药物,这种添加将提供必要的电荷以驱动这些药物越过pH梯度。然而,药物的共价修饰常常改变它们的生物学和化学特性,并且在许多情况下是不可取的。
因此,本领域存在对鉴定以高效率和大浓度包封治疗剂的脂质体组合物的很大的需求,所述治疗剂具有各种化学特性(例如,非离子性和/或疏水性)。
发明概述
本发明部分地基于这样的发现,即携带可电离的官能团(例如,在其溶剂-暴露的表面,例如脂质体内相表面上的弱碱性和/或弱酸性官能团)的环糊精能够有效地以高浓度包封治疗剂(例如,不可电离的和/或疏水的组合物),以及含有治疗剂的官能化的环糊精本身可被有效地以高浓度远程载入脂质体中,以生成脂质体组合物,其在体内给予时表现出意外地降低的毒性和增强的功效特性(见,例如图1C)。环糊精是一个通常被用来溶解疏水性药物的环状糖的家族(Albers和Muller (1995) Crit. Rev. Therap. Drug Carrier Syst.12:311-337; Zhang和Ma (2013) Adv. Drug Delivery Rev. 65:1215-1233; Laza-Knoerr等(2010) J. Drug Targ. 18:645-656; Challa等(2005) AAPS PharmSci. Tech.6:E329-E357; Uekama等(1998) Chem. Rev. 98:2045-2076; Szejtli (1998) Chem. Rev. 98:1743-1754; Stella和He (2008) Toxicol. Pathol. 36:30-42; Rajewski和Stella (1996) J. Pharm. Sci. 85:1142-1169; Thompson (1997) Crit. Rev. Therap. Drug Carrier Sys. 14:1-104; 和Irie和Uekama (1997) J. Pharm. Sci. 86:147-162)。
在一方面,提供一种包含环糊精、治疗剂和脂质体的脂质体组合物,其中脂质体包封具有至少一个面向脂质体内相的、用可电离的化学基团替代的羟基化学基团的环糊精并且其中环糊精包封治疗剂。在一个实施方案中,环糊精的至少一个α-D-吡喃葡糖苷单元具有至少一个选自用可电离的化学基团替代的C2、C3和C6羟基化学基团的羟基化学基团。在另一个实施方案中,环糊精的至少一个α-D-吡喃葡糖苷单元具有至少2个选自用可电离的化学基团替代的C2、C3和C6羟基化学基团的羟基化学基团。在又一个实施方案中,环糊精的至少一个α-D-吡喃葡糖苷单元的C2、C3和C6羟基化学基团用可电离的化学基团替代。在还一个实施方案中,环糊精的至少一个α-D-吡喃葡糖苷单元选自环糊精的2、3、4、5、6、7、8个和所有的α-D-吡喃葡糖苷单元。在另一个实施方案中,可电离的化学基团在所有替代的位置是相同的。在又一个实施方案中,可电离的化学基团是弱碱性官能团(例如,具有依据CH3-X的在6.5和8.5之间的pKa的基团X)或弱酸性官能团(例如,具有依据CH3-Y的在4.0和6.5之间的pKa的基团Y)。在还一个实施方案中,弱碱性或弱酸性官能团选自氨基、乙二氨基、二甲基乙二氨基、二甲基苯氨基、二甲基萘氨基、琥珀酰基、羧基、磺酰基和硫酸官能团。在另一个实施方案中,环糊精具有在4.0和8.5之间的pKa1。在又一个实施方案中,组合物是液体或固体药物制剂。在还一个实施方案中,治疗剂是不带电荷的或疏水的。在另一个实施方案中,治疗剂是化疗剂。在又一个实施方案中,治疗剂是小分子。在还一个实施方案中,环糊精选自β-环糊精、α-环糊精,和γ-环糊精。在另一个实施方案中,环糊精是β-环糊精、α-环糊精。
在另一方面,提供一种包含本文描述的脂质体组合物和使用说明书的药剂盒。
在又一方面,提供一种治疗患有癌症的受试者的方法,其包括给予受试者治疗有效量的本文描述的脂质体组合物。在一个实施方案中,治疗剂是化疗剂。在另一个实施方案中,脂质体组合物通过皮下或静脉内注射给予。在又一个实施方案中,受试者是哺乳动物。在还一个实施方案中,哺乳动物是人。
附图简述
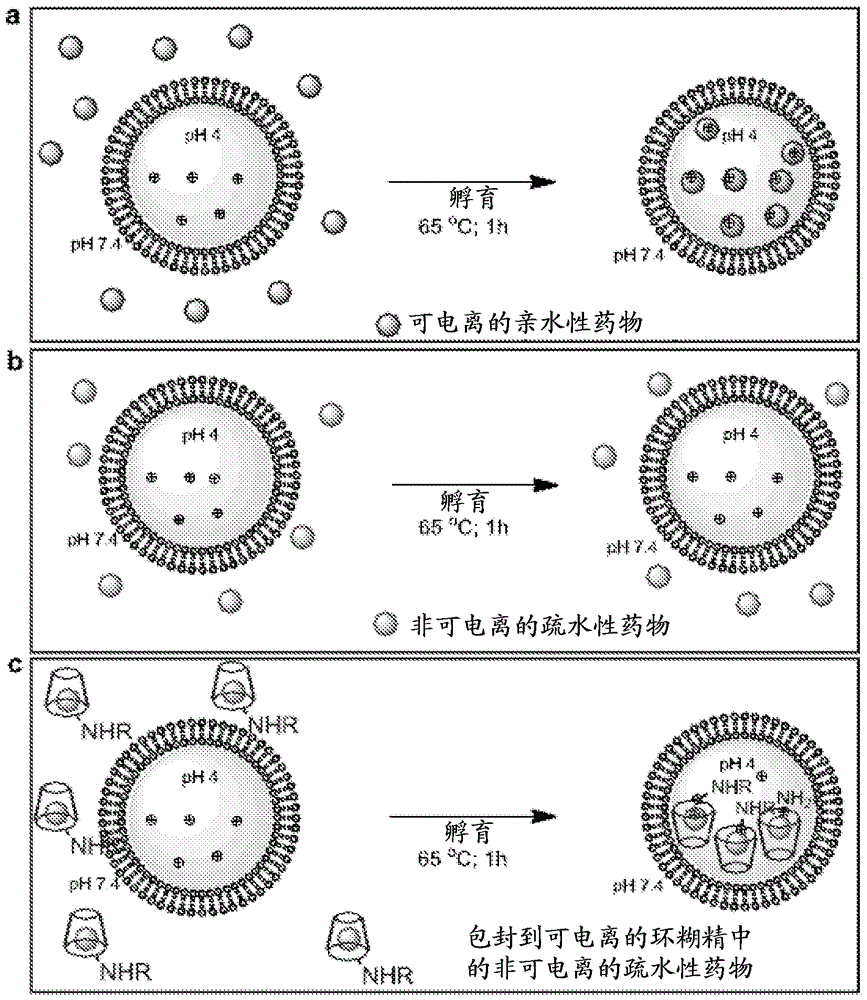
图1A-1C显示脂质体主动加载的图示的实施方案。图1A显示使用跨膜pH梯度远程加载可电离的亲水性药物导致有效的结合。图1B显示在图1A中所示的条件下,难溶性疏水药物导致极少结合到预形成的脂质体中。图1C显示,难溶性药物包封到可电离的环糊精(R = H,可电离的烷基或芳基基团)中提高其水溶性并允许通过pH梯度的有效的脂质体加载。
图2A-2C显示合成的可电离环糊精的实施方案。图2A显示形成一些本发明公开的合成可电离环糊精的化学反应的实施方案。图2B显示一些本发明公开的合成在其6’-位携带可电离基团的可电离环糊精的实施方案。图2C描述环状形状的环糊精。
图3A-3D显示修饰的β-环糊精使用跨膜pH梯度的主动加载。图3A显示在加载到具有pH梯度的脂质体(柠檬酸脂质体)中的β-环糊精V的荧光(相对荧光单位(RLU)),在pH梯度的不存在下加载到脂质体(PBS脂质体)中的相同化合物的荧光的比较。图3B显示动态光散射测量显示流体动力学半径的边际增加,但用环糊精V远程加载的脂质体的多分散性指数(PDI)没有变化。图3C-3D显示用pH梯度(柠檬酸脂质体; 图3C)或不用pH梯度(PBS脂质体; 图3D)加载的丹酰化(dansylated) β-环糊精V的cryoTEM图像。
图4通过分析在柠檬酸脂质体对比对照(PBS)脂质体中丹酰化I和环糊精IV的相对荧光单位(RLU)的荧光,显示结合到柠檬酸脂质体中的丹酰化环糊精。
图5A-5D显示使用修饰的β-环糊精,远程加载不溶性疏水的染料到脂质体中,如通过远程加载的香豆素102 (图5A)、香豆素314 (图5B)、香豆素334 (图5C)和环己基DNP (图5D)的荧光强度所示的。插图显示含有与环糊精-包封的染料(顶部)或游离染料(底部)孵育的脂质体的小瓶的照片。
图6显示各种环糊精转移香豆素314进入柠檬酸脂质体中的能力。显示未复合的香豆素314和与III (可电离的单-6-乙二氨基-6’脱氧-环糊精)和I (不可电离的β-环糊精)复合的香豆素314在经远程加载到柠檬酸脂质体后的相对荧光单位(RLU)的荧光。
图7显示BI-2536和PD-0325901的结构和物理特性。
图8A-8C显示PLK1抑制剂,BI-2536L的加载和活性。图8A显示用BI-2536和CYCL-BI-2536注射的动物的生存数据。所有治疗的动物(n = 5)接受单一iv剂量(125 mg/kg)的其游离形式的BI-2536过夜,而单一i.v.剂量的CYCL-BI-2536在类似的剂量(125 mg/kg; n = 5)或更高的剂量(500 mg/kg; n = 5)不引起任何急性毒性的体征。图8B显示用2个i.v.剂量(由箭头指示的那些天)的(i) 空脂质体、(ii) 游离BI-2536 (100 mg/kg)、(iii) CYCL-BI-2536 (100 mg/kg)和(iv) CYCL-BI-2536 (400 mg/kg)治疗携带HCT 116异种移植物的裸鼠(每组n = 4)的结果。图8C显示用单一i.v.剂量的(i) 空脂质体、(ii) BI-2536 (100 mg/kg)或(iii) CYCL-BI-2536 (100 mg/kg)治疗携带HCT 116异种移植物的裸鼠的结果。在任何药物治疗前和此后每24小时对中性粒细胞计数。每个治疗组中5只小鼠的中性粒细胞计数的均值和标准偏差(SD)被显示。
图9显示CYCL-香豆素334在2、24和48小时时间点的组织生物分布,如分别从左到右对每个组织的直方图所指示的。数据表示为均值和标准偏差。
图10A-10B显示MEK1抑制剂,PD-0325901的加载和活性。图10A显示用单一剂量的PD-0325901和CYCL-PD-0325901治疗的动物的生存曲线。携带RKO异种移植物的裸鼠用单一剂量(200 mg/kg)的其游离形式的PD-0325901,以低剂量(200 mg/kg; n = 5)或较高剂量(500 mg/kg; n = 5)的单一i.v.剂量的CYCL- PD-0325901治疗。图10B显示用2个i.v.剂量(由箭头指示的那些天)的(i) 空白脂质体、(ii) 游离PD-0325901 (150 mg/kg)或(iii) CYCL-PD-325901 (250 mg/kg)治疗携带RKO异种移植物的裸鼠的结果。脂质体制剂已被报道为游离药物的等价物。各个实验组的相对肿瘤体积和标准偏差被显示。
图11A-11C显示CYCL-BI-2536和CYCL-PD0325901在第二个异种移植物模型中的抗-肿瘤活性。脂质体制剂已被报道为游离药物的等价物。各个实验组的相对肿瘤体积和标准偏差被显示。
发明详述
本文已确定,携带可电离的官能团(例如,在它们的溶剂-暴露的表面,例如脂质体内相表面上的弱碱性和/或弱酸性官能团)的环糊精能够有效地以高浓度包封治疗剂(例如,不可电离的和/或疏水的组合物)并且含有治疗剂的官能化环糊精以高浓度被有效地远程加载到脂质体中,以生成脂质体组合物,其在体内给予时表现出意外地降低的毒性和增强的功效特性。因此,本发明提供(至少部分地)包含这样的修饰环糊精和治疗剂的脂质体组合物和药剂盒,以及制备和使用这样的组合物和药剂盒的方法。
A. 环糊精
术语“环糊精”指由6个或更多个α-D-吡喃葡糖苷单位组成的一个环状寡糖家族,所述糖苷单位通过具有环状拓扑结构的C1-C4键连接在一起,其中环状结构的较大和较小开口使α-D-吡喃葡糖苷单元的某些羟基暴露于周围的环境(例如,溶剂)。术语“惰性环糊精”指含有具有基本式C6H12O6的α-D-吡喃葡糖苷单元和没有任何另外的化学取代的葡萄糖结构的环糊精(例如,具有6个葡萄糖单体的α-环糊精、具有7个葡萄糖单体的β-环糊精,和具有8个葡萄糖单体的γ-环糊精)。术语“环糊精内相”指包含在(即,被包封在)环糊精结构的环状拓扑布局内的相对较少亲水性的区域。术语“环糊精外相”指不被环糊精结构的环状拓扑布局环绕的区域并当环糊精被包封在脂质体内时,可包括,例如脂质体内相。环糊精被用来溶解疏水性组分(见,例如Albers和Muller (1995) Crit. Rev. Therap. Drug Carrier Syst. 12:311-337; Zhang和Ma (2013) Adv. Drug Delivery Rev. 65:1215-1233; Laza-Knoerr等(2010) J. Drug Targ. 18:645-656; Challa等(2005) AAPS PharmSci. Tech. 6:E329-357; Uekama等(1998) Chem. Rev. 98:2045-2076; Szejtli (1998) Chem. Rev. 98: 1743-1754; Stella和He (2008) Toxicol. Pathol. 36:30-42; Rajewski和Stella (1996) J. Pharm. Sci. 85:1142-1169; Thompson (1997) Crit. Rev. Therap. Drug Carrier Sys. 14: 1-104; 和Irie和Uekama (1997) J. Pharm. Sci. 86:147-162)。位于环糊精内相内的任何物质被认为是“包封的”。
如本文所用的,对环糊精没有特别的限制,只要环糊精(a)可包封所需的治疗剂和(b) 携带可电离的(例如,弱碱性和/或弱酸性)官能团以促进被脂质体包封。
为了包封所需的治疗剂,环糊精可根据所需的治疗剂的特征和有效的、高-浓度加载于其中的参数进行选择和/或被化学修饰。例如,优选环糊精本身具有在水中的高溶解性,以促进较大量的环糊精在脂质体内相中的截留。在一些实施方案中,环糊精的水溶性是至少10 mg/mL、20 mg/mL、30 mg/mL、40 mg/mL、50 mg/mL、60 mg/mL、70 mg/mL、80 mg/mL、90 mg/mL、100 mg/mL或更高。实现这样的提高的水溶性的方法是本领域熟知的。
在一些实施方案中,一个大的与治疗剂的缔合常数是优选的并可通过基于治疗剂的尺寸选择环糊精中的葡萄糖单元的数目而获得(见,例如,Albers和Muller (1995) Crit. Rev. Therap. Drug Carrier Syst. 12:311-337; Stella和He (2008) Toxicol. Pathol. 36:30-42; 和Rajewski和Stella (1996) J. Pharm. Sci. 85:1142-1169)。当缔合常数取决于pH时,可选择环糊精以使缔合常数在脂质体内相的pH时变大。结果,在环糊精的存在下,治疗剂的溶解性(名义溶解度)可得到进一步提高。例如,环糊精与治疗剂的缔合常数可以是100、200、300、400、500、600、700、800、900、1,000,或更高。
通过与环糊精羟基(例如,衬在惰性环糊精环面的上下脊的那些羟基)反应所形成的衍生物可被容易地制备并提供一种修饰母体(惰性)环糊精的物理化学性质的方法。本文已确定修饰羟基,例如面向远离环糊精内相的那些羟基,可用可电离的化学基团替代以促进加载到脂质体中以及治疗剂,例如难溶性或疏水性药物在修饰环糊精内的加载。在一个实施方案中,具有至少一个用可电离的化学基团取代的羟基的修饰环糊精将导致在某些溶剂(例如,pH)条件下的荷电部分。术语“荷电的环糊精”指具有被荷电部分取代的一个或多个其羟基和携带电荷的部分的环糊精。这样的部分本身可以是荷电的基团或它可包含用一个或多个荷电部分取代的有机部分(例如,C1-C6烷基或C1-C6烷基醚部分)。
在一个实施方案中,“可电离的”或“荷电的”部分是弱可电离的。弱可电离的部分是那些为或者弱碱性或者弱酸性的部分。弱碱性官能团(X)具有依据CH3-X的在约6.0-9.0、6.5-8.5、7.0-8.0、7.5-8.0之间和其中任何范围的pKa。类似地,弱酸性官能团(Y)具有依据CH3-Y的在约3.0-7.0、4.0-6.5、4.5-6.5、5.0-6.0、5.0-5.5之间和其中任何范围的log解离常数(pKa)。pKa参数是一种物质的酸/碱性质的熟知的量度,pKa测定的方法在本领域是传统的和常规的。例如,许多弱酸的pKa值被列表于化学和药理学的参考书中。见,例如,药用盐的IUPAC手册(IUPAC Handbook of Pharmaceutical Salts),由P. H. Stahl和C. G Wermuth编辑, Wiley-VCH, 2002;化学和物理的CRC手册,第82版,由D. R. Lide编辑, CRC Press, Florida, 2001, p. 8-44至8-56。因为带有超过一个可电离的基团的环糊精具有各自用下标表示的第二个和随后的基团的pKa。
代表性的阴离子部分包括,而无任何限制,羧酸根、羧甲基、琥珀酰基、磺酰基、磷酸根、磺基烷基醚、硫酸根、碳酸根、硫代碳酸根、二硫代碳酸根、磷酸根、膦酸根、磺酸根、硝酸根和硼酸根基团。
代表性的阳离子部分包括,但不限于,氨基、胍,和季铵基团。
在另一个实施方案中,修饰的环糊精是“聚阴离子”或“聚阳离子”。聚阴离子是具有一个以上的带负电荷基团、导致超过两个单位的净负离子电荷的修饰环糊精。聚阳离子是具有一个以上的带正电荷基团、导致超过两个单位的净正离子电荷的修饰环糊精。
在另一个实施方案中,修饰的环糊精是“可荷电的两亲物”。所谓"可荷电的"意指两亲物具有在pH 4-pH 8或8.5范围内的pK。因此可荷电的两亲物可以是一种弱酸或弱碱。所谓"两性的"在这里指的是一种具有阴离子性质和阳离子性质两者的可电离基团的修饰环糊精,其中:1) 阳离子和阴离子两亲物的至少一个,且任选两个都是可荷电的,具有至少一个具有在4和8至8.5之间的pK的荷电的基团,2) 阳离子电荷最好在pH 4,和3) 阴离子电荷最好在pH 8-8.5。
在一些实施方案中,“可电离的”或“荷电的”环糊精作为一个整体,无论聚离子、两性分子的,或者另外的,都是弱可电离的(即,具有在约4.0-8.5、4.5-8.0、5.0-7.5、5.5-7.0、6.0-6.5之间和包含在其中的任何范围的pKa1)。
环糊精的任何一个、一些或全部α-D-吡喃葡糖苷单元的任何一个、一些或全部羟基可如本文所述被修饰为可电离的化学基团。由于各个环糊精羟基在化学反应性方面不同,与修饰部分的反应可产生一种位置和光学异构体的无定形混合物。作为选择,某些化学可允许预-修饰的α-D-吡喃葡糖苷单元反应以形成均匀的产物。
发生的总取代由称为取代度的术语描述。例如,具有取代度为7的6-乙二氨基-β-环糊精将由6-乙二氨基-β-环糊精的异构体的分布组成,其中每个6-乙二氨基-β-环糊精分子的乙二氨基的平均数是7。取代度可通过质谱或核磁共振波谱确定。理论上,对于α-环糊精,最大取代度是18,对于β-环糊精是21,而对于γ-环糊精是24,然而,具有羟基的取代基本身存在对另外的羟基烷基化的可能性。取代度可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24,或更多并可包括完全取代。
另一个参数是给定的羟基取代的立体化学定位。在一个实施方案中,至少一个面向远离环糊精内部的羟基被可电离的化学基团取代。例如,至少一个α-D-吡喃葡糖苷单元的C2-C3-C6羟基的C2、C3、C6、C2和C3、C2和C6、C3和C6,和所有3个被可电离的化学基团取代。羟基的任何这样的组合可类似地与修饰环糊精的至少2、3、4、5、6、7、8、9、10、11,直至全部的α-D-吡喃葡糖苷单元组合以及与本文描述的任何取代度组合。
组合一个或多个本文描述的环糊精也是可接受的。
B. 脂质体
术语“脂质体”指具有由脂质双层环绕的内相的微观封闭的囊泡。脂质体可以是一个小单层-膜脂质体如小单层囊泡(SUV)、大单层-膜脂质体如大单层囊泡(LUV)、一个更大的单层-膜脂质体如一个巨大的单层囊泡(GUV)、一个具有多个同心膜的多层脂质体如多层囊泡(MLV),或一个具有为不规则和不同心的多层膜的脂质体如多泡性囊泡(MVV)。对于熟知的脂质体形式的另外的描述,见U.S. Pat. Publ. 2012-0128757; U.S. Pat. No. 4,235,871; U.S. Pat. No. 4,737,323; WO 96/14057;New (1990) 脂质体:一种实用方法(Liposomes: A practical approach), IRL Press, Oxford, 33-104页;和Lasic (1993) 从物理到应用的脂质体(Liposomes from physics to applications), Elsevier Science Publishers BV, Amsterdam。
术语“脂质体内相”指包含在(即,被包封在)脂质体的脂质双层内的水性区域。比较起来,术语“脂质体外相”指未由脂质体的脂质双层环绕的区域,例如在其中脂质体分散于液体中的情况下远离内相和脂质双层的区域。
如本文所用的,对脂质体没有特别的限制,只要它能包封含有治疗剂的修饰的环糊精即可。在一些实施方案中,一旦包封在脂质体内相内,脂质体具有防止修饰的环糊精/治疗剂复合物从脂质体内相不需要地泄漏到外相的屏障功能。在其中它用作药物的情况下,当脂质体在体内给予时,优选脂质体表现出在体内的稳定性并具有防止所有的修饰环糊精/治疗剂复合物在血液中泄漏到脂质体外相的屏障功能。
在一些实施方案中,脂质体的膜成分包括磷脂和/或磷脂衍生物。这样的磷脂和磷脂衍生物的代表性实例包括,但不限于,磷脂酰乙醇胺、磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酰甘油、心磷脂、鞘磷脂、神经酰胺磷酸乙醇胺、神经酰胺磷酸甘油,神经酰胺磷酸甘油磷酸酯、1,2-二肉豆蔻酰-1,2-脱氧磷脂酰胆碱、缩醛磷脂,和磷脂酸。合并这些磷脂和磷脂衍生物的一个或多个也是可接受的。
对磷脂和磷脂衍生物中的脂肪-酸残基没有特别的限制并可包括具有8、9、10、11、12、13、14、15、16、17、18、19、20个或更长的碳链长度的饱和的或不饱和的脂肪-酸残基。代表性的非限制性实例包括源自脂肪-酸如月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、油酸,和亚油酸的酰基基团。从天然物质衍生的磷脂如蛋黄卵磷脂和大豆卵磷脂、部分氢化的蛋黄卵磷脂、(完全地)氢化的蛋黄卵磷脂、部分氢化的大豆卵磷脂,和(完全地)氢化的大豆卵磷脂(其不饱和的脂肪-酸残基被部分地或完全地氢化)等也可采用。
当制备脂质体时,对所用的磷脂和/或磷脂衍生物的混合量(摩尔分数)没有特别的限制。在一个实施方案中,可使用相对于整个脂质体膜组成的10-80%。在另一个实施方案中,可采用30-60%之间的范围。
除了磷脂和/或磷脂衍生物外,脂质体还可包含作为膜稳定剂的甾醇,例如胆甾醇和胆甾烷醇和具有饱和的或不饱和的酰基的脂肪酸,例如具有8、9、10、11、12、13、14、15、16、17、18、19、20或更长的碳原子数的那些。
当制备脂质体时,对所用的这些甾醇的混合量(摩尔分数)没有特别的限制,但相对于整个脂质体膜组成的1-60%是优选的,10-50%是更优选的,且30-50%是甚至更优选的。类似地,对脂肪酸的混合量(摩尔分数)没有特别的限制,但相对于整个脂质体膜组成的0-30%是优选的,0-20%是更优选的,和0-10%是甚至更优选的。至于抗氧化剂的混合量(摩尔分数),如果加入的量可获得抗氧化作用,则它是足够的,但整个脂质体膜组成的0-15%是优选的,0-10%是更优选的,和0-5%是甚至更优选的。
脂质体也可含有功能性脂质和修饰的脂质作为膜成分。功能性脂质的代表性的非限制性实例包括在血液中保留的脂质衍生物(例如,血型糖蛋白、神经节苷脂GM1、神经节苷脂GM3、葡萄糖醛酸衍生物、谷氨酸衍生物、聚甘油磷脂衍生物、聚乙二醇衍生物(甲氧基聚乙二醇缩合物等)如N-[羰基-甲氧基聚乙二醇-2000]-1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺、N-[羰基-甲氧基聚乙二醇-5000]-1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺、N-[羰基-甲氧基聚乙二醇-750]-1,2-二硬脂酰-sn甘油-3-磷酸乙醇胺、N-[羰基-甲氧基聚乙二醇-2000]-1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺 (MPEG 2000-二硬脂酰磷脂酰乙醇胺),和N-[羰基-甲氧基聚乙二醇-5000]-1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺,其是磷酸乙醇胺和甲氧基聚乙二醇的缩合物),温敏性脂质衍生物(例如,二棕榈酰基磷脂酰胆碱)、pH-敏感性脂质衍生物(例如,二油酰磷脂酰乙醇胺)等。在血液中保留的含有脂质衍生物的脂质体被用来改善脂质体的血液滞留,因为脂质体作为外来杂质变得难以在肝中捕获。类似地,含有温敏性脂质衍生物的脂质体被用来引起脂质体在特定温度下的破坏和/或引起脂质体表面特性的改变。此外,通过将此与靶位点的温度增加结合,有可能在靶位点破坏脂质体,并且在靶位点释放治疗剂。当由于内吞作用脂质体被结合到细胞中时,含有pH-敏感性脂质衍生物的脂质体被用来促进脂质体和内体的膜融合,从而改进治疗剂向细胞质的传输。
修饰脂质的代表性非限制性实例包括PEG脂质、糖脂、抗体-修饰的脂质、肽-修饰的脂质等。含有这样的修饰脂质的脂质体可靶向所需的靶细胞或靶组织。同样,当制备脂质体时,对所用的功能性脂质和修饰的脂质的混合量(摩尔分数)没有特别的限制。在一些实施方案中,这样的脂质组成整个脂质体膜成分脂质的0-50%、0-40%、0-30%、0-20%、0-15%、0-10%、0-5%、0-1%或更少。
基于以上描述和本领域熟知的方法,具有这样的膜渗透性的脂质体膜成分的组成可由本领域技术人员根据治疗剂、靶组织等以允许实际应用的水平适当地选择。
当用作药物时,优选治疗剂/环糊精复合物在脂质体抵达靶组织、细胞,或细胞内细胞器后从脂质体释放。相信在此描述的脂质体组合物含有膜成分,其本身通常是可生物降解的,并最终在靶组织等分解,并且包封的治疗剂/环糊精复合物由此通过稀释、化学平衡,和/或酶促环糊精降解作用而释放。
取决于所需的应用,脂质体的粒径可被调整。例如,当其作为注射产品等,目的是通过提高渗透性和滞留(EPR)效应,向癌组织或发炎的组织传送脂质体时,脂质体粒径为30-400 nm、50-200 nm、75-150 nm,和之间的任何范围是优选的。在意图是向巨噬细胞传送脂质体的情况下,优选脂质体粒径是30-1000 nm,和更优选粒径是100-400 nm。在脂质体组合物要用作口服制剂或经皮制剂的情况下,脂质体的粒径可以设置在几微米。应该注意到,在正常组织中,血管壁用作屏障(因为血管壁是由血管内皮细胞致密构成的),而微粒如特定大小的超分子和脂质体不能分布在该组织内。然而,在发病的组织中,血管壁是稀松的(因为血管内皮细胞之间存在缝隙),增加了血管渗透性,因而超分子和微粒可分布到血管外组织(提高了渗透性)。而且,淋巴系统在正常组织中有很好的发展,但已知淋巴系统在发病的组织中没有发展,并且超分子或微粒,一旦结合,不能通过一般系统回收,而是保留在发病的组织中(提高滞留性),其形成EPR作用的基础(Wang等(2012) Annu. Rev. Med. 63:185-198; Peer等(2007) Nat. Nanotech. 2:751-760; Gubernator (2011) Exp. Opin. Drug Deliv. 8:565-580; Huwyler等(2008) Int. J. Nanomed. 3:21-29; Maruyama等(2011) Adv. Drug Deliv. Rev. 63:161-169; Musacchio和Torchilin (2011) Front. Biosci. 16:1388-1412; Baryshnikov (2012) Vest. Ross. Akad. Med. Nauk. 23-31;和Torchilin (2005) Nat. Rev. Drug Disc. 4:145-160)。因此,有可能通过调整脂质体粒径控制脂质体的药代动力学。
术语“脂质体粒径”指根据动态光散射法(例如,准弹性光散射法(quasi-elastic light scattering method))的重均粒径。例如,脂质体粒径可使用动态光散射仪(例如,由Malvern Instruments Ltd.生产的Zetasizer Nano ZS型和由Otsuka Electronics Co., Ltd.生成的ELS-8000)测量。仪器测量粒子的Brownian运动,而粒径基于已建立的动态光散射方法学理论测定。
此外,对脂质体内相的溶剂没有特别的限制。示例性缓冲溶液包括,但不限于,如磷酸盐缓冲溶液、柠檬酸缓冲溶液,和磷酸盐-缓冲生理盐水溶液、生理盐水、用于细胞培养的培养基等。在缓冲溶液用作溶剂的情况下,优选缓冲剂的浓度是5-300 mM、10-100 mM,或之间的任何范围。对脂质体内相的pH也没有特别的限制。在一些实施方案中,脂质体内相具有在2和11、3和9、4和7、4和5之间,以及包含其中任何范围的pH。
C. 治疗剂
对本发明的治疗剂没有特别的限制,只要治疗剂被修饰的环糊精包封即可。例如,已知α-环糊精具有0.45-0.6的内相孔径大小,β-环糊精具有0.6-0.8 nm的内相孔径大小,和γ-环糊精具有0.8-0.95 nm的内相孔径大小。可选择与治疗剂的大小相匹配的环糊精以允许包封。如上所述,可选择对非-碳环糊精基团(例如,羟基基团)的修饰以调节环糊精和治疗剂之间的分子间相互作用,从而调节治疗剂被环糊精的包封。
作为治疗剂,可使用任何所需的药物,例如可用于药品(包括诊断药物)、化妆品、食品等领域的那些。例如,治疗剂可从各种已知类型的有用的药物中选择,包括,例如,蛋白质、肽、核苷酸、抗-肥胖药、营养药、糖皮质激素、弹性蛋白酶抑制剂、止痛药、抗真菌剂、肿瘤治疗剂、止吐药、镇痛剂、心血管药物、抗炎剂、驱虫药、抗心律失常药、抗生素(包括青霉素)、抗凝药、抗抑郁药、抗糖尿病药、抗癫痫药、抗组胺药、抗高血压药、抗毒蕈碱剂、抗分支杆菌药、抗肿瘤药、免疫抑制剂、抗甲状腺药、抗病毒药、焦虑镇静剂(催眠药和神经松弛剂)、收敛剂、β-肾上腺素受体阻断剂、血液制品和替代品,心脏正性肌力药物、造影剂、糖皮质激素,止咳药(祛痰剂和粘液溶解剂)、诊断剂、诊断成像剂、利尿剂、多巴胺类(抗帕金森病药)、止血剂、免疫剂、脂质调节剂、肌肉松弛剂、拟副交感神经药、甲状旁腺降钙素和双膦酸盐、前列腺素、放射性药物、性激素(包括类固醇)、抗过敏药、兴奋剂和减食欲剂、拟交感神经药、甲状腺药物、血管扩张剂和黄嘌呤类。至于治疗剂,合并一个或多个药物是可接受的。
在一个实施方案中,治疗剂可以是低分子化合物,例如小分子。在这些中,用作抗肿瘤剂、抗菌剂、抗炎剂、抗心肌梗死剂和造影剂的化合物是合适的。
至于治疗剂的分子量,100-2,000道尔顿的范围是优选的,200-1,500道尔顿的范围是更优选的,和300-1,000道尔顿的范围是甚至更优选的。在这些范围内,依据本文描述的组合物,治疗剂的脂质体膜渗透性通常是满意的。
本发明对抗-瘤形成剂或抗-肿瘤剂没有特别的限制。代表性实例包括,但不限于,BI-2536、PD-0325901、喜树碱;紫杉烷;异环磷酰胺、尼莫司汀盐酸盐(nimstine hydrochloride)、新制癌菌素、紫杉醇、carvocon、环磷酰胺、达卡巴嗪、噻替派、白消安、melfaran、雷莫司汀、雌莫司汀磷酸钠、6-巯基嘌呤核苷、依诺他滨、盐酸吉西他滨、carmfur、阿糖胞苷、阿糖胞苷十八碳磷酸盐(cytarabine ocfosfate)、替加氟、去氧氟尿苷、羟基脲、氟尿嘧啶、氨甲喋呤、巯基嘌呤、磷酸氟达拉滨、放线菌素D、盐酸阿柔比星、盐酸伊达比星、盐酸吡柔比星、盐酸表柔比星、盐酸柔红霉素、盐酸多柔比星、表柔比星、吡柔比星、柔红霉素、多柔比星、盐酸吡柔比星、盐酸博来霉素、净司他丁斯酯、新制癌菌素、丝裂霉素C、硫酸博来霉素、硫酸培洛霉素、依托泊苷、酒石酸长春瑞滨、硫酸长春新碱(vincrestine sulfate)、硫酸长春地辛、硫酸长春碱、盐酸氨柔比星、吉非替尼、依西美坦、卡培他滨、艾日布林(eribulin)、甲磺酸艾日布林等。至于在上述药物中记录为盐的化合物,任何盐是可接受的和游离实体也是可接受的。至于作为游离实体记录的化合物,任何盐是可接受的。
类似地,对抗菌剂没有特别的限制。代表性实例包括,但不限于,amfotericine B、己基头孢替安(cefotiam hexyl)、头孢菌素、氯霉素、双氯芬酸等。至于前述抗菌剂的化合物,任何盐是可接受的。
同样,对抗炎剂没有特别的限制。代表性实例包括,但不限于,前列腺素(PGE1和PGE2)、地塞米松、氢化可的松、匹洛西卡(pyroxicam)、吲哚美辛、泼尼松龙,等。至于前述抗炎剂的化合物,任何盐是可接受的。
对于抗-心肌梗死剂也没有特别的限制。代表性实例包括,但不限于,腺苷、阿替洛尔、吡西卡尼等。至于前述抗-心肌梗死剂的化合物,任何盐是可接受的。
对造影剂也没有特别的限制。代表性实例包括,但不限于,碘帕醇(iopamidol)、碘克沙酸、碘海醇、碘美普尔(iomeprol)等。至于造影剂,任何盐都是可接受的。
在一些实施方案中,治疗剂是“水溶性差的”或“疏水的”,这些术语可互换使用以包括微溶于水的治疗剂,如通过少于约10 mg/mL、9 mg/mL、8 mg/mL、7 mg/mL、6 mg/mL、5 mg/mL、4 mg/mL、3 mg/mL、2 mg/mL、1 mg/mL、900 μg/mL、800 μg/mL、700 μg/mL、600 μg/mL、500 μg/mL、400 μg/mL、300 μg/mL、200 μg/mL、100 μg/mL、95 μg/mL、90 μg/mL、85 μg/mL、80 μg/mL、75 μg/mL、70 μg/mL、65 μg/mL、60 μg/mL、55 μg/mL,和在一些情况下少于约50 μg/mL,或包含在其中的任何范围的室温水溶性所证实的。在一个实施方案中,当1份药物可被100-1000份溶剂(例如,水)溶解时,则适用于术语“微溶性”。应该理解,对于任何给定的化合物,室温水溶性可使用容易获得的化学技术和工具,例如高效液相色谱或分光光度法而容易地测定。
D. 脂质体组合物
术语“脂质体组合物”指含有脂质体并且还含有从其惰性形式经化学修饰的环糊精和脂质体内相的治疗剂。脂质体组合物可包括固体和液体形式。在脂质体组合物呈固体形式的情况下,通过将其溶解或悬浮于规定的溶剂中,可将其制备为液体形式。在脂质体组合物为冷冻固体的情况下,通过使其于室温下放置融化,可将其制备为一种液体形式。
脂质体组合物中的脂质体的浓度和治疗剂的浓度可根据脂质体组合物的目标、配方,和技术人员熟知的其它考虑而适当地设定。在脂质体组合物是液体制剂的情况下,脂质体的浓度作为构成脂质体的所有脂质的浓度可被设定在0.2-100 mM,并且优选地在1-30 mM。在脂质体组合物被用作药物的情况下,治疗剂的浓度(剂量)在下文描述。至于在脂质体组合物中的环糊精的量,优选其为相对于治疗剂的0.1-1000 mol当量,且更优选其为相对于治疗剂的1-100 mol当量。
在脂质体组合物是液体制剂的情况下,对脂质体组合物的溶剂没有特别的限制。代表性实例包括,但不限于,缓冲溶液如磷酸盐缓冲溶液、柠檬酸缓冲溶液,和磷酸盐-缓冲生理盐水溶液、生理盐水,和用于细胞培养的培养基。对脂质体组合物的脂质体外相的pH也没有特别的限制。在一些实施方案中,例如pH是在2和11、3和10、4和9之间、7.4、7.0,或高于脂质体内相的pH的任何pH。
在一些实施方案中,可加入药用赋形剂,例如糖,例如单糖如葡萄糖、半乳糖、甘露糖、果糖、肌醇、核糖,和木糖;二糖如乳糖、蔗糖、纤维二糖、海藻糖,和麦芽糖;三糖如棉子糖和松三糖;多糖如环糊精;和糖醇如赤藻糖醇、木糖醇、山梨醇(sortibol)、甘露醇和麦芽糖醇; 多元醇如甘油、双甘油、聚甘油、丙二醇、聚丙二醇、乙二醇、二乙二醇、三乙二醇、聚乙二醇、乙二醇单烷基醚、二乙二醇单烷基醚、1,3-丁二醇。糖和醇的组合也可采用。
为了分散于溶剂中的脂质体的长期稳定贮存的目的,从物理稳定性(包括凝固等)的角度来看,尽可能地多的消除溶剂中的电解质是优选的。而且,从脂质的化学稳定性的角度来看,将溶剂的pH从酸性设置接近中性(pH 3.0-8.0),并且通过鼓泡通入氮以除去溶解的氧是优选的。液体稳定剂的代表性实例包括,但不限于,正常盐水、等渗右旋糖、等渗蔗糖、林格氏溶液,和汉克斯(Hanks')溶液。可加入缓冲物质以提供为了贮存稳定性的最适pH。例如,在约6.0和约7.5之间的pH,更优选约6.5的pH对于脂质体膜脂质的稳定性是最适的,并提供截留实体的优良的滞留性。组氨酸、羟基乙基哌嗪-乙磺酸盐(HEPES)、吗啉代-乙磺酸盐(MES)、琥珀酸盐、酒石酸盐,和柠檬酸,通常以2-20 mM浓度存在,是示例性缓冲物质。其它合适的载体包括,例如,水、缓冲水性溶液、0.4% NaCl、0.3%甘氨酸等。可加入蛋白质、碳水化合物,或聚合物稳定剂和张力调节剂,例如,明胶、白蛋白,葡聚糖,或聚乙烯吡咯烷酮。组合物的张力可用葡萄糖或较惰性的化合物如乳糖、蔗糖、甘露醇,或糊精调节至0.25-0.35 mol/kg的生理水平。这些组合物可通过常规的、熟知的灭菌技术,例如,通过过滤灭菌。生成的水性溶液可为了使用而包装或在灭菌条件下过滤并冻干,冻干的制剂在给予前与无菌水性介质合并。
对脂质体组合物中含有的糖的浓度没有特别的限制,但在脂质体分散于溶剂的状态下,例如,优选糖的浓度是2-20% (W/V),而5-10% (W/V)是更优选的。至于多元醇的浓度1-5% (W/V)是优选的,和2-2.5% (W/V)是更优选的。
脂质体组合物的固体制剂也可包含药用赋形剂。这样的组分可包括,例如,糖,例如单糖如葡萄糖、半乳糖、甘露糖、果糖、肌醇、核糖,和木糖;二糖如乳糖、蔗糖、纤维二糖、海藻糖,和麦芽糖;三糖如棉子糖和松三糖;多糖如环糊精;和糖醇如赤藻糖醇、木糖醇、山梨醇、甘露醇,和麦芽糖醇。更优选葡萄糖、乳糖、蔗糖、海藻糖,和山梨醇的共混物。甚至更优选乳糖、蔗糖,和海藻糖的共混物。这是指,固体制剂可稳定地存放长时间。当冷冻时,优选固体制剂含有多元醇(水性溶液)如甘油、双甘油、聚甘油、丙二醇、聚丙二醇、乙二醇、二乙二醇、三乙二醇、聚乙二醇、乙二醇单烷基醚、二乙二醇单烷基醚和1,3-丁二醇。至于多元醇(水性溶液)、甘油、丙二醇,和聚乙二醇是优选的,和甘油和丙二醇是更优选的。这是指,固体制剂稳定地存放长时间是可能的。糖和多元醇可组合使用。
在此描述的脂质体组合物可进一步按照实体与脂质的比值(entity-to-lipid ratio)进行表征。一般来说,实体-脂质比值,例如,在加载药物时获得的治疗剂负载比取决于脂质体内截获的药物量,主动加载过程中的离子浓度,和离子的理化性质和所用的相反离子的类型。由于在组合物中和/或由本发明的方法获得的高加载效率,脂质体中捕获的实体的实体-脂质比值是基于吸收进入加载过程的实体和脂质体脂质的量("输入"比)计算的超过70%、75%、80%、85%、90%、95%、99%,或更高。实现100% (定量的)包封也是可能的。
脂质体中的实体-脂质比值可根据重量比(每重量或摩尔单位的脂质体脂质的实体重量)或摩尔比(每重量或摩尔单位的脂质体脂质的实体的摩尔数)进行特征表述。实体-脂质比值的1个单位可通过如下例举的常规计算转化为其它单位。在此描述的脂质体组合物中的实体重量比通常是每mg脂质至少0.05、0.1、0.2、0.35、0.5,或至少0.65 mg实体。就摩尔比而言,依据本发明的实体-脂质比值是至少从约0.02至约5,优选至少0.1-约2,和更优选从约0.15至约1.5摩尔的药物/摩尔脂质体脂质。
在一个实施方案中,实体-脂质比值比是每摩尔脂质体脂质至少0.1摩尔的治疗剂,且优选至少0.2、0.3、0.4、0.5,或更多。
本发明的脂质体组合物还可以它们的高效截留的治疗剂和低毒性的意外组合为特征。一般来说,依据本发明经脂质体包封的治疗剂的活性,例如,抗-癌治疗剂在哺乳动物中的抗-肿瘤活性是至少等于治疗剂实体(如果其以相同的量经由其常规的非-脂质体制剂,例如,不使用本发明的脂质体组合物给予)的活性,是其活性的至少2、2.5、3、3.5、4、4.5、5或更多倍,或比其高至少这样的倍数,同时脂质体包封的实体的毒性不超过以相同的剂量和进度表,但以游离的非-包封形式给予的相同治疗剂实体的毒性,是其毒性的至多1/2、至多1/3,或至多1/4。
E. 制备脂质体组合物的方法
许多方法是制备脂质体的领域熟知的。代表性实例包括,但不限于,脂质膜法(涡流法(Vortex method)、反相蒸发法、超声波法、预泡法(pre-vesicle method)、乙醇注入法、French press法、胆酸排除方法、Triton X-100批处理法、Ca2+融合法、乙醚注入法、退火法,冻融法等。
在脂质体制备中的各种条件(膜成分的量、温度等)可根据脂质体制备方法、靶脂质体组成、粒径等适当地选择。然而,已知环糊精具有从脂质体除去脂质(特别是胆甾醇等)的作用。因此优选的是用于脂质体制备的脂质的量在考虑了这种作用后设定。
治疗剂/环糊精复合物可通过在滴加治疗剂(例如,含有治疗剂的溶液)时搅动和混合环糊精(例如,含有环糊精的溶液)或者反过来而获得。依据治疗剂的物理特性,使用溶于溶剂的物质或固体物质作为治疗剂是可能的。对溶剂没有特别的限制,并且人们可使用,例如,与脂质体外相相同的物质。与环糊精混合的治疗剂的量可以是等摩尔量或不同的比例,这取决于组合所需的水平。在一些实施方案中,治疗剂的绝对量可在相对于环糊精的量的0.001-10 mol当量,0.01-1 mol当量范围内,或包含在任何范围之间。同样,对加热温度没有特别的限制。例如,5℃或更高、室温或更高(例如,20℃或更高也是优选的)或脂质体的脂质双层膜的相变温度或更高,都是可接受的。
必要时可任选地调节脂质体粒径。粒径可例如,通过在高压下使用规则孔径的膜过滤器进行挤出(挤出过滤)来调节。粒径调节可在制备脂质体组合物期间,在任何时间选择上进行。例如,粒径调节可在将治疗剂/环糊精复合物引入脂质体内相之前或在治疗剂/环糊精复合物已经远程加载到脂质体内相之后进行。
存在除去任何不需要的或未结合的复合物或组合物,例如不被环糊精包封的治疗剂或不被脂质体包封的治疗剂环糊精复合物的熟知的方法。代表性实例包括,但不限于,透析、离心分离,和凝胶过滤。
透析可例如使用透析膜进行。作为透析膜,人们可引用具有分子量截止的膜如纤维素管或Spectra/Por。至于离心分离,离心加速可优选地以100,000 g或更高,且更优选以300,000 g或更高来进行。凝胶过滤可,例如,通过基于分子量使用柱如Sephadex或Sepharose进行分馏来进行。
在一些实施方案中,可使用主动远程加载方法以将治疗剂/环糊精复合物包封在脂质体内。一般地,在脂质体的内部空间存在的离子梯度(例如,可滴定的铵,例如未取代的铵离子)可例如,经由"主动"、"远程",或"跨膜梯度-驱动"加载,提供提高的弱两性分子的碱的包封(Haran等, Biochim. Biophys. Acta, 1993, v. 1152, p. 253-258; Maurer-Spurej等, Biochim. Biophys. Acta, 1999, v. 1416, p. 1-10)。
例如,主动远程加载可通过使用跨膜pH梯度实现。脂质体内相和外相的pH相差1-5 pH单位、2-4 pH单位、0.5 pH单位、1 pH单位、2 pH单位、3 pH单位、3.4 pH单位、4 pH单位、5 pH单位、6 pH单位、7 pH单位,或包括的任何范围的pH单位。或者脂质体内相或者外相依据治疗剂的类型和修饰环糊精上可电离的基团,可具有较高的pH。在其它方面,如果脂质体内相和外相的pH没有显著的差别(即,脂质体外相和内相具有基本上相同的pH),则也是可接受的。
pH梯度可通过使用用于pH梯度方法的领域通常已知的化合物调节。代表性实例包括,但不限于,氨基酸如精氨酸、组氨酸,和甘氨酸;酸如抗坏血酸、苯甲酸、柠檬酸、谷氨酸、磷酸、乙酸、丙酸、酒石酸、碳酸、乳酸、硼酸、马来酸、富马酸、苹果酸、己二酸、盐酸,和硫酸;前述酸的盐如钠盐、钾盐,和铵盐;和碱性化合物如三羟甲基氨基甲烷、氨水、氢化钠、氢化钾等。
许多不同的离子可用于离子梯度方法。代表性的实例包括,但不限于,硫酸铵、氯化铵、硼酸铵、甲酸铵、乙酸铵、柠檬酸铵、酒石酸铵、琥珀酸铵、磷酸铵等。此外,至于离子梯度方法,脂质体内相的离子浓度可根据治疗剂的类型适当地选择。较高的离子浓度是更优选的并且优选地为10 mM或更高,更优选20 mM或更高,甚至更优选50 mM或更高。根据治疗剂的类型,或者脂质体内相或者外相可具有较高的离子浓度。在其它方面,如果脂质体内相和外相的离子浓度没有显著的差别,即脂质体外相和内相具有基本上相同的离子浓度,则也是可接受的。离子梯度也可通过取代或稀释脂质体外相来调节。
在一个实施方案中,可使用熟知的方法,增加其中脂质体的膜渗透性被提高的一个步骤。代表性实例包括,但不限于,加热含有脂质体的组合物,加入膜流化剂至含有脂质体的组合物中,等等。
在加热含有脂质体的组合物,例如溶液的情况下,通过加热至较高的温度,治疗剂/环糊精复合物可一般地更有效地被引入脂质体内相。特别地,考虑到治疗剂/环糊精复合物的热稳定性和使用的脂质体膜成分,设定加热的温度是优选的。特别是,优选将加热的温度设定在脂质体的脂质双层膜的相变温度或更高。
术语脂质体的脂质双层膜的“相变温度”指在升高的温度条件下的差热分析时吸热开始的温度(当吸热反应开始时的温度)。差热分析是一种通过测量作为时间或温度函数的样品和参照物质之间的温度差,同时改变样品和参照物质的温度,而能够分析样品的热性能的技术。在对脂质体膜成分进行差热分析的情况下,脂质体膜组分随着温度的升高而液态化,并且观察到吸热反应。其中观察到吸热反应的温度范围根据脂质体膜组分而有很大的变化。例如,在脂质体膜组分由纯脂质组成的情况下,其中观察到吸热反应的温度范围是极其窄的,且吸热反应常常在相对于吸热峰温度的±1℃的范围内观察到。在其它方面,在脂质体膜组分由多种脂质组成的情况下,且特别是在脂质体膜组分由源自天然材料的脂质组成的情况下,其中观察到吸热反应的温度范围倾向于放宽,并且观察到吸热反应,例如,在相对于吸热峰温度±5℃的范围内(即是说,观察到宽峰)。随着脂质体膜液态化增加,通过升高温度高于脂质体脂质双层膜的相变温度,增加治疗剂/环糊精复合物的膜渗透性。
例如,虽然取决于治疗剂/环糊精复合物的热稳定性和使用的脂质体膜成分,在一些实施方案中,温度范围可以是从脂质体脂质双层膜的相变温度至+20℃、+10℃、+5℃,或更低,或在例如这样的相变温度的+5℃至+10℃之间的任何范围。一般来说,加热温度的范围通常可在20-100℃、40-80℃、45-65℃之间,和其中的任何范围。优选加热温度高于或等于相变温度。
在加热步骤中,对温度维持在相变温度或相变温度以上的时间没有特别的限制,并且这可恰当地设置在例如,几秒钟至30分钟的范围内。考虑到治疗剂和脂质的热稳定性以及有效的大批量生产,在短时间内进行处理是理想的。即是说,优选升高的温度维持期为1-30分钟,而2分钟-5分钟是更优选的。然而,这些温度维持时间决不限制本发明。
此外,如上所述,通过加入膜流化剂至获得的混合溶液(即是说,将其加入到脂质体的外相侧)中,提高脂质体膜渗透性也是可能的。代表性实例包括,但不限于,水性溶剂中是可溶的有机溶剂、表面活性剂、酶等。代表性的有机溶剂包括,但不限于,一元醇如乙醇和苄醇;多元醇如甘油和丙二醇;非质子极性溶剂如二甲亚砜(DMSO)。代表性的表面活性剂包括,但不限于,阴离子表面活性剂如脂肪酸钠、一烷基硫酸盐,和一烷基磷酸盐;阳离子表面活性剂如烷基三甲基铵盐;两性表面活性剂如烷基二甲胺氧化物;和非-离子表面活性剂如聚氧乙烯烷基醚、烷基单甘油醚,和脂肪酸失水山梨醇酯。代表性的酶包括,但不限于,胆碱酯酶和胆固醇氧化酶。本领域技术人员在考虑了由于加入膜流化剂截留治疗剂的效率度,脂质体的稳定性等后,可根据脂质体膜成分的组成、膜流化剂等,设定膜流化剂的量。
制备在此描述的脂质体组合物的方法还可包括调节获得的脂质体组合物的脂质体外相的步骤和/或在包封治疗剂/环糊精复合物之前和/或之后干燥获得的脂质体组合物的步骤。
例如,在液体脂质体组合物中的脂质体外相可被调节(替代等)以制备最终的脂质体组合物,如果它被用作液体制剂的话。当脂质体组合物要被制备为固体制剂时,在上述引入步骤获得的液体脂质体组合物可被干燥以制备最终的固体脂质体组合物。冷冻干燥和喷雾干燥是干燥脂质体组合物的方法的代表性的、非限制性实例。在脂质体组合物是固体制剂的情况下,它可被溶于或悬浮于合适的溶剂中并用作液体制剂。使用溶剂可根据脂质体组合物的使用目的适当地设置。例如,在使用脂质体组合物作为一种注射产品的情况下,溶剂可以是无菌蒸馏水或其它与注射剂适配的溶剂。在使用脂质体组合物作为药物的情况下,临床医师或患者可将溶剂注入固体制剂已被封装入其中的小瓶中,例如,以在使用时制备制剂。在液体脂质体组合物是冷冻固体制剂的情况下,其可以冷冻状态贮存,并通过使其放置于室温下融化或通过在使用时加热快速地融化,使其回到液体状态而作为液体制剂使用。
F. 药物组合物和给药方法
在此描述的脂质体组合物可在医学领域用作药物组合物如治疗组合物或诊断组合物。例如,脂质体组合物可通过结合作为治疗剂的抗肿瘤剂被用作治疗组合物并可通过结合作为治疗剂的造影剂被用作诊断组合物。脂质体组合物也可用于任何数目的其它目的,例如化妆品或作为一种食品添加剂。
通常,本发明的脂质体药物组合物被制备为局部的或可注射的、或者作为液体溶液剂或者混悬剂。然而,也可制备为适合于在注射前在液体溶媒中的溶液或悬浮液的固体形式。组合物也可根据本领域已知的方法被配制为肠溶衣片剂或凝胶胶囊剂。
在本发明的脂质体组合物被用作药物组合物的情况下,脂质体组合物可通过注射(静脉内、动脉内,或局部注射)、口服、经鼻、皮下、肺,或通过滴眼液给予,除了静脉内注射、皮下注射、皮内注射外,优选动脉内注射,特别是局部注射至靶细胞群或器官或其它这样的注射。在口服给予的情况下,片剂、散剂、颗粒剂、糖浆剂、胶囊剂、液体剂等可作为脂质体组合物的制剂的实例给予。在非-口服给药的情况下,注射产品、滴注输液剂、滴眼液、软膏剂、栓剂、混悬剂、泥敷剂(cataplasm)、洗剂、气雾剂、膏药剂等可作为脂质体组合物的制剂的实例给予,而注射产品和滴注输液剂是特别优选的。
当脂质体组合物用作化妆品时,作为化妆品的一种形式,人们可采用,例如,洗剂、霜剂、爽肤水、保湿剂、泡沫剂、粉底霜、唇膏、面膜、皮肤洗剂、香波、漂洗剂、调理剂、护发素、洗发液、发膏等。
术语“给予”物质,例如治疗实体至动物或细胞,意欲指分散、传递或应用物质指预定的靶。至于治疗剂,术语“给予”意欲指通过用于传递治疗剂至动物的所需位置的任何合适的途径,包括以医学上可接受的任何方式,接触或分散、传递或应用治疗剂至动物,这可取决于待治疗的病症或损伤。可能的给药途径包括注射、经胃肠外途径如肌内、皮下、静脉内、动脉内、腹膜内、关节腔内、硬膜内、鞘内注射等,以及口、鼻、眼、直肠、阴道、局部,或肺,例如,通过吸入。为了传递根据本发明配制的脂质体药物至中枢神经系统的肿瘤,脂质体的缓慢,持续的颅内输注直接进入肿瘤(一种对流提高的传递,或CED)具有特别的优点(Saito等(2004) Cancer Res. 64:2572-2579;Mamot等(2004) J. Neuro-Oncology 68:1-9)。组合物也可直接应用于组织表面。缓慢释放、依赖pH的释放,或其它特定的化学或环境条件介导的释放给药也例如,通过这样的方式如贮库注射,或侵蚀的植入物特别地包括在本发明中。
药物组合物在给予时的剂量可以不同,取决于靶疾病的类型,治疗剂的类型,以及患者的年龄、性别和体重,症状的严重性,以及其它因素。要理解对于包封在脂质体内的任何给定治疗剂和对于给定的患者的适当剂量方案的测定完全在主治临床医师的技能范围内。例如,传递治疗有效剂量所必需的脂质体药物组合物的量可通过药物测试领域常见的常规体外和体内方法测定(例如,D. B. Budman, A. H. Calvert, E. K. Rowinsky (编辑). 抗癌药物开发手册(Handbook of Anticancer Drug Development), LWW, 2003)。
作为选择,对于给定的药物在以游离形式给予时,主治临床医师可依赖于推荐的剂量。一般地,对于各种治疗实体的治疗有效剂量是本领域技术人员熟知的。通常地,对于本发明的脂质体药物组合物的剂量范围在约0.005和约500 mg治疗实体每千克体重之间,最常见在约0.1和约100 mg治疗实体/kg体重之间。
G. 药剂盒
依据本发明,提供一种用于制备脂质体组合物的药剂盒。药剂盒可被用来制备作为一种治疗剂或诊断剂的脂质体组合物,其可由临床医师或或技术人员在临床环境或患者中使用。
药剂盒包括脂质体试剂。脂质体试剂可或者以固体或者以液体形式存在。如果脂质体试剂以固体形式存在,脂质体试剂可溶于或悬浮于适当的溶剂中以获得脂质体,而上述脂质体分散液可被干燥以获得脂质体试剂。干燥可以类似于上述对脂质体组合物的干燥进行。当使用药剂盒时,如果脂质体试剂以固体形式存在,脂质体试剂可溶于或悬浮于适当的溶剂中以制备脂质体分散液。当这样进行时,溶剂类似于上述脂质体分散液中的脂质体外相。
本发明的药剂盒优选地还含有治疗剂。治疗剂可呈现为或者固体或者液体形式(一种溶于或悬浮于溶剂的状态)。当使用药剂盒时,如果治疗剂以固体形式存在时,优选使其溶于或悬浮于适当的溶剂以制备液体形式。溶剂可适当地依据治疗剂的物理特性等设置,并可例如类似于上述脂质体分散液中的脂质体外相进行制备。
在药剂盒中,脂质体试剂和治疗剂可分开包装,或它们可呈现为固体形式并混合在一起。
在脂质体试剂和治疗剂二者均以固体形式存在并被包装在一起的情况下,使脂质体试剂和治疗剂的混合物适当地溶于或悬浮于溶剂中。当这样进行时,溶剂类似于上述脂质体分散液中的脂质体外相。从而可能形成一种其中脂质体分散液和治疗剂被混合的状态,此后其在制备上述脂质体组合物的方法中,通过进行在将治疗剂引入脂质体分散液的脂质体内相中的其它步骤,有可能被使用。
在另一个实施方案中,药剂盒可包含本文描述的脂质体组合物,包括用法说明书。
范例
以下实施例已被包括以提供给本领域普通技术人员实践本公开主题的代表性实施方案的指导。按照本公开内容和本领域技术人员的一般水平,技术人员可意识到,以下实施例仅意味着是示例性的,并且可采用许多改变、修饰和变更而不背离目前公开的主题的范围。以下实施例通过举例说明的方式提供而不作为限制。
实施例1:实施例2-4的材料和方法
A. 合成可电离的β-环糊精的通用方法
用在吡啶中的0.9摩尔当量的甲苯磺酰氯对β-环糊精(Sigma-Aldrich, St. Louis, MO)的6’伯羟基进行单甲苯磺酰化,以提供相应的甲苯磺酸盐,通过用碘化钠在丙酮中处理,将其转化为碘代-衍生物。碘代衍生物与适当的胺经于80℃加热8-12 h,被转化为所需的氨基化环糊精(Tang和Ng (2008) Nat. Protocol. 3:691-697)。通过用0.9当量的琥珀酸酐在DMF中处理母体β-环糊精,合成6’-单琥珀酰基-β-环糊精(Cucinotta等(2005) J. Pharmaceut. Biomed. Anal. 37: 1009-1014)。产物在丙酮中沉淀并在使用前经HPLC纯化。通过用过量的琥珀酸酐在DMF中处理并用丙酮沉淀,从β-环糊精合成6’,6’,6’,6’,6’,6’,6’-七-琥珀酰基-β-环糊精。分级结晶以~85%纯度提供所需的化合物。
通过用0.9摩尔当量的丹酰氯在吡啶中分别处理,从可市售获得的β-环糊精和化合物II和III合成丹酰化环糊精I、IV和V。
各中间体和最终的产物通过HPLC,使用制备型C18柱和0-95%溶剂B (乙腈)/溶剂A (水)的线性梯度纯化。所有环糊精通过1H NMR和电喷雾电离(ESI) MS进行特征鉴定并与以前发表的参考文献相匹配。
6’,6’,6’,6’,6’,6’,6’-七-氨基-β-环糊精购自CTD holdings并无需进一步纯化而使用。
BI-2536 (Hoffmann等(2004) WO Published Patent Appl. 2004-076454)和PD-0325901 (Warmus等(2008) Bioorga. Med. Chem. Lett. 18:6171-617)如前所述合成。
B. 用于脂质体制备的通用程序
使氢化卵磷脂酰胆碱(Avanti Polar Lipids)、胆甾醇和1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-N-[甲氧基(聚乙二醇)-2000 (DSPE-PEG 2000) (Avanti Polar Lipids) (摩尔比,50:45:5)溶于氯仿(20 ml)。真空除去溶剂,得到一个薄的脂质膜,其通过在适当的缓冲液(PBS, pH 7.4;200 mM柠檬酸盐, pH4.0;或80 mM Arg-HEPES, pH 9.0)中,于50℃震摇2小时被水合。将囊泡悬浮液超声处理30分钟,然后于50℃通过0.4-、0.2-和0.1-μm聚碳酸酯膜(Whatman, Nucleopore Track-Etch Membrane)连续挤出,获得最终的脂质体。然后通过脂质体针对300 mM蔗糖或磷酸盐-缓冲盐水(PBS)的平衡透析过夜创建跨膜梯度。平均尺寸和多分散性指数然后通过动态光散射(DLS)在Zetasizer Nano ZS90 (Malvern Instruments)以633 nm的波长和90°的检测角测定。
C. 被动加载脂质体的方案
方法1:BI-2536在脂质层中的包封。使氢化的卵磷脂酰胆碱(Avanti Polar Lipids)、胆甾醇,和DSPE-PEG2000 (Avanti Polar Lipids) (摩尔比50:45:5)溶于氯仿(20 mL)。加入10毫克的BI-2536 (在1 mL氯仿中)并蒸发溶剂以生成薄膜。加入1毫克的PBS (pH 7.4)以水合脂质层,并如上所述于50℃震摇该混合物2小时。超声处理囊泡悬浮液30 min,然后于50℃通过0.4-、0.2-和0.1-μm聚碳酸酯膜(Whatman;Nuclepore Track-Etched Membrane)连续挤出,以获得具有所需尺寸的低多分散性的最终脂质体。然后使脂质体在PBS中透析过夜以除去未截留药物。然后通过动态光散射实验在Malvern Z90上测量平均尺寸和多分散性指数。药物含量通过用等体积的甲醇裂解脂质体并在NanoDrop 1000上测量UV-vis吸光度来计算。
方法2:脂质层与BI-2536的水性制剂的水合作用。使氢化的卵磷脂酰胆碱(Avanti Polar Lipids)、胆甾醇,和DSPE-PEG2000 (Avanti Polar Lipids) (摩尔比50:45:5)溶于氯仿(20 mL),并真空蒸发溶剂以生成薄膜。加入1毫克的水性BI-2536 (4 mg;pH 5.5)以水合脂质层,并如上所述于50℃震摇该混合物2小时。超声处理囊泡悬浮液30分钟,然后于50℃通过0.4-、0.2-和0.1-μm聚碳酸酯膜(Whatman;Nuclepore Track-Etched Membrane)连续挤出,以获得具有所需尺寸的低多分散性的最终脂质体。然后使脂质体针对PBS透析过夜以除去未截留药物。然后通过动态光散射实验在Malvern Z90上测量平均尺寸和多分散性指数。药物含量通过用等体积的甲醇裂解脂质体并在NanoDrop 1000上测量UV-vis吸光度来计算。
D. 包封的复合物制备的通用程序
使等摩尔量的药物(0.1 mmol;30-50 mg)和适当的环糊精(0.11 mmol;110-185 mg)分别溶于甲醇(几乎饱和;~1-2 mL)和去离子水(~10-20 mg/mL)。然后将药物的甲醇溶液在搅拌下滴加入环糊精溶液中,确保一种均匀的悬浮液。然后使用Eppendorf Thermomixer R,将该悬浮液于55℃震摇36-48小时。过滤该溶液以除去颗粒物质并在干冰/丙酮浴中快速冷冻,接着冷冻干燥。将冻干的复合物于-20℃贮存直至进一步使用。
E. 远程加载脂质体的通用方案
上述冻干粉末复合物被粉碎并于65℃与适当的脂质体溶液(30-40 mg药物等价物在6 mL脂质体溶液中,以获得5-8 mg./mL浓度的加载比)孵育1小时。将它们以1,000 x g离心3分钟以除去颗粒物质,然后针对300 mM蔗糖或市售的PBS溶液(pH 7.4)透析过夜,以除去未加载到脂质体中的材料。脂质体制剂的尺寸分布使用上述的Malvern ZS90仪器鉴定。在用等体积的甲醇于367 nm对BI-2536和于277 nm对PD-0325901破坏脂质体溶液后,使用Nanodrop 100按一式三份测量BI-2536和PD-0325901在脂质体中的浓度。
F. 组织生物分布研究
香豆素334被用作药物代用品以评价环糊精-包封的脂质体的生物分布和药代动力学。使香豆素334 (3 mg)溶于甲醇(6 mL)并滴加入环糊精VI的水性溶液(14 mg在20 mL水中)。于55℃震摇该溶液48小时并冻干。使冻干粉末与柠檬酸脂质体(内部pH 4.0)于65℃孵育1小时。将脂质体溶液对PBS透析过夜。为评价加载效率,用100 μL甲醇破坏100 μL脂质体并分析荧光。加载效率被发现是90%。按照在Macdiarmid等(2007) Cancer Cell 11:431-445中描述的修改方案,将携带HCT116皮下异种移植物的雌性无胸腺nu/nu小鼠用于该研究。当肿瘤体积达到400-600 mm3时,12只小鼠用200 μL环糊精-包封的脂质体(CYCL-)香豆素334 (0.5 mg/mL)经静脉内(i.v.)治疗。治疗后,在时间点2、24和48小时对4只小鼠施行安乐死,切除肿瘤、脾、肝、肾、心,和肺并称重。也收集血液,并分离血浆并于4℃贮存。除了血浆,匀化各冷冻组织并在0.9%盐水[3 x 体积(μL)的组织质量(mg)]中超声处理。在涡流下将甲醇加入至最终体积33% (vol/vol)。将样品离心(6,000 x g持续10分钟),上清液中的荧光通过CytoFluor II荧光多层板阅读仪(Applied Biosystems),使用激发485 nm/发射530 nm测量。作为一种对组织自体荧光的对照,将用等效体积的空脂质体治疗的携带肿瘤的动物实施安乐死并收获它们的组织和血浆。
G. 小鼠体内治疗
将5百万HCT116 (p53-/-)、HCT116 (p53+/+),或RKO细胞皮下(s.c.)注入雌性无胸腺nu/nu小鼠的腹侧并允许生长3周,达到体积300-400 mm3。在CYCL-BI-2536的情况下,然后将动物随机分成4组。在所有的情况下,脂质体制剂(CYCL-药物)已被报道为游离药物的等价物。在2周的过程中,第一组接受空脂质体;第二组接受单一剂量100 mg/kg制剂的游离药物两次,使用在文献中报告的制剂(在0天和7天);第三和第四组在相同的时间点分别接受100 mg/kg和400 mg/kg的CYCL-BI-2536脂质体制剂。每48小时记录肿瘤体积。各个组的平均肿瘤尺寸被归一化为在治疗的第一天的肿瘤体积。在CYCL-PD-0325901的情况下,第一组用空脂质体在0天和8天处理两次,而其它两组在相同的时间点分别接受2个剂量的游离PD-0325901和CYCL-PD-0325901。为了清晰的实验结果,数据表示为各组归一化为在0天的肿瘤体积的平均肿瘤尺寸。终止在各种情况下的肿瘤消退实验并在对照动物的肿瘤达到2,000 mm3时对动物实施安乐死。
实施例2:远程加载化学修饰的β-环糊精至脂质体中
设计和合成一组在其6’-位携带可电离基团的修饰的β-环糊精(图2)。在类似物II-V中,6’伯羟基部分被修饰为氨基、乙二氨基,或二者中任一个的荧光形式,而类似物VIII涉及在该位引入琥珀酰基。其它的类似物(VI、VII和IX)具有全部7个被氨基、乙二氨基,或琥珀酰基部分替代的伯羟基。所有类似物经HPLC纯化并用MS和NMR谱特征鉴定。适当的阴性对照物通过引入不含可电离基团的类似大小的化学修饰合成。
对两个荧光(丹酰化)环糊精(化合物IV和V)测试其加载到脂质体的能力。脂质体通过脂质薄膜与200 mM柠檬酸盐缓冲液水合而生成,以致它们的内部pH是4.0。然后将这些脂质体在PBS (pH 7.4)中透析以从脂质体外侧除去柠檬酸盐,然后于65℃与已溶于PBS中的环糊精一起孵育1小时。作为对照,PBS-加载的脂质体通过脂质薄膜与代替柠檬酸盐的PBS再水合而生成。在相对高的温度(65℃)的孵育提高脂质双层的流动性,因此允许环糊精穿过它。然后使悬浮液在PBS中透析过夜以除去未结合到脂质体中的环糊精并分析丹酰基荧光。这些实验显示这些环糊精的每一种的>90%被截留在脂质体中(见,例如,图3A和4)。在pH梯度的不存在下,几乎没有相同的化合物结合到脂质体中(图3A)。光散射显示,预形成的“空”脂质体具有伴有窄的多分散性指数(<0.10)的98 nm的平均直径(图3B)。环糊精的结合仅稍稍增加平均直径至105 nm,而不改变多分散性指数(图3C)。冷冻透射电子显微镜观察发现,环糊精结合后的脂质体结构没有改变,除了增加脂质体内的密度外,大概反映在它们内部的高浓度环糊精(图3C)。相反,环糊精与对照品,无跨膜pH梯度的含PBS的脂质体一起孵育,导致不规则形状的大泡,没有证据表明,在它们内的环糊精结合(图3D)。用对照脂质体观察到的形状的变化大概是由于环糊精与脂质双层的缔合,导致脂质体结构的不稳定和“肿胀”。
实施例3:包封在化学修饰的β-环糊精内并输送到脂质体中的小的疏水化合物
使用有机染料(香豆素)以测定修饰的环糊精是否可包封和转运疏水性化合物越过脂质体双层。香豆素是非常疏水的并在它们被包封到6’-单乙二氨基-6’-脱氧-环糊精(化合物III)中后观察到水溶性的极大改善。已确定包封香豆素的最有效和便利的方法是通过冷冻干燥(Cao等(2005) Drug Dev. Industr. Pharm. 31:747-756;Badr-Eldin等(2008) Eur. J. Pharm. Biopharm. 70:819-827)。通过这种步骤,香豆素的溶解性增加至少10-至20-倍(从100 μg/mL至1-2 mg/mL)。一旦溶解,环糊精-香豆素复合物与预形成的完全如上所述的脂质体一起孵育,使用pH梯度以驱动化合物越过双层。在过夜透析以除去未结合的复合物后,接着用甲醇破坏脂质体并测量香豆素荧光。如通过荧光光谱法所示的,所有的环糊精-染料复合物被高效地结合到脂质体中(>95%;图5)。为确定这种高效加载确实是由于复合物越过脂质膜的主动转运,而不是仅仅由于提高的水溶性,评价了香豆素314在环糊精的不存在下的加载效率,发现其在相同条件下几乎不能结合到脂质体中(图6)。重要的是,包封在不可电离的天然β-环糊精中的香豆素314仅仅稍微提高了加载效率,尽管染料的水溶性大大增加。香豆素染料结合到脂质体中可容易地被肉眼辨别,因为香豆素-环糊精脂质体是亮黄色的,而对照脂质体(例如,不用环糊精制得)是无色的(图5A-5C)。
实施例4:包封在化学修饰的β-环糊精内并输送到脂质体中的化疗剂
氨基-官能化的环糊精产生BI-2536的脂质体制剂的能力被测定(图7)。由Boehringer Ingelheim开发的BI-2536是polo-样激酶(PLK1)的高度选择性抑制剂,所述激酶为一种适当执行有丝分裂所需的酶(Steegmaier等(2007) Curr. Biol. 17:316-322;Lenart等(2007) Curr. Biol. 17:304-315;和Stewart等(2011) Exp. Hematol. 39:330-338)。已显示BI-2536具有有效的对抗癌细胞,特别是那些在TP53中携带突变的癌细胞的杀灭肿瘤活性(Sur等(2009) Proc. Natl. Acad. Sci. U.S.A. 106:3964-3969;Sanhaji等(2013) Cell Cycle 12:1340-1351;Meng等(2013) Gynecol. Oncol. 128:461-469;和Nappi等(2009) Canc. Res. 69:1916-1923)。BI-2536是在患有肺、乳腺、卵巢和子宫癌症的患者中几个临床试验的主题(Mross等(2012) Br. J. Canc. 107:280-286;Ellis等(2013) Clin. Lung Canc. 14:19-27;Hofheinz等(2010) Clin. Canc. Res. 16:4666-4674;Sebastian等(2010) J. Thorac. Oncol. 5: 1060-1067;Schoffski等(2010) Eur. J. Canc. 46:2206-2215;和Mross等(2008) J. Clin. Oncol. 26:5511-5517)。虽然它已显示在癌症患者中有效的证据,其开发在II期试验显示在亚-治疗剂量的不可接受的毒性(4级中性粒细胞减少症)后被放弃。
本文已确定,氨基化环糊精V和VI极大地改善BI-2536的水溶性。至于香豆素,BI-2536复合物已被确定可使用化合物VI重复加载到脂质体中,获得稳定的含有10 mg/mL药物的水性溶液。比较起来,游离BI-2536的最大水溶性被测定为0.5 mg/mL。为评价环糊精-包封的、BI-2536的脂质体(CYCL)形式的活性,它们的作用在携带人HCT116结肠直肠癌细胞的皮下异种移植物的裸鼠中评价。在HCT116细胞皮下注入小鼠后3周,用空脂质体、游离BI-2536,或CYCL-BI-2536治疗它们。在治疗开始时,肿瘤已经是相对大的,平均~300 mm3并比小肿瘤更接近地模拟临床情况。当游离药物以125 mg/kg经静脉内(iv)给予时,几种急性毒性是明显的:小鼠在数分钟内变得昏睡,它们的眼睛变成玻璃状,它们表现出毛发竖起,并在数小时后死亡(图8A)。用稍稍较低剂量的游离BI-2536 (100 mg/kg)治疗的小鼠在药物给予之后即刻表现出有些迟钝,但仍存活。然而,迟发性毒性,表现为外周WBC的急剧下降,在游离药物给予后24-36小时内是明显的。这种类型的毒性与在人临床试验中观察到的毒性是相同的(Mross等(2008) J. Clin. Oncol. 26:5511-5517;Frost等(2012) Current Oncol. 19:e28-35;和Vose等(2013) Leuk. Lymphom. 54: 708-713)。虽然对骨髓有毒性,游离BI-2536能够诱导显著的抗-肿瘤反应,在以其最大耐受剂量(MTD)给予两个剂量后延缓肿瘤生长达~30% (图7B)。这样的效率以前在其它鼠科动物模型中观察到(Steegmaier等(2007) Curr. Biol. 17:316-322;Nappi等(2009) Canc. Res. 69:1916-1923;Ackermann等(2011) Clin. Canc. Res. 17:731-741;Grinshtein等(2011) Canc. Res. 71:1385-1395;Liu等(2011) Anti-Canc. Drugs 22:444-453;和Ding等(2011) Canc. Res. 71:5225-5234)并为临床试验提供了理论基础。
CYCL-BI-2536被证明在毒性和疗效两方面远远优于游离形式。CYCL-BI-2536,甚至在500 mg/kg的剂量,也不引起任何显著的不良反应;该剂量是杀死每一只动物的游离药物剂量的4-倍(图8A)。在100 mg/kg的剂量(等同于游离药物的MTD),CYCL-BI-2536诱导了显着改善的肿瘤反应,在仅仅两个剂量后延缓肿瘤生长几近80% (图8B)。在400 mg/kg的剂量,CYCL-BI-2536不仅导致肿瘤较慢的生长,而且还导致肿瘤的部分消退(图8B)。不能给予游离CYCL-BI-2536的等效剂量,因为小鼠在甚至接近于该量的剂量时不能存活(图8B)。而且,用CYCL-BI-2536治疗,导致相对很少的骨髓毒性,因为WBC降低非常少,因而没有对动物造成危险(图8C)。最后,已确定CYCL-BI-2536具有比游离药物对抗第二个人类结肠直肠癌模型(具有基因失活的TP53等位基因的HCT116细胞)大得多的效果。在两种情况下,用CYCL-形式的药物观察到明显的消退,但用游离药物未观察到消退。
为建立CYCL脂质体的生物分布和药代动力学,用包封在环糊精VI中的香豆素334加载的脂质体被用来经静脉内(i.v.)注射治疗携带HCT116的小鼠。对得自在治疗后2、24和48小时收获的主要组织的样品分析它们的荧光。如所期望的,香豆素334从治疗后48小时检查的大多数组织中清除。重要的是,包封在脂质体中的药物持续存在于血和肿瘤中,其与PEG化脂质体的典型的药代动力学一致(图9)。
基于环糊精的加载方法也与在脂质体中截留疏水的和不溶性药物的最常见的方法比较。首先,试图在脂质双层直接截留BI-2536。使BI-2536与氢化的卵磷脂酰胆碱-胆甾醇-1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-N-[甲氧基(聚乙二醇)-2000 (DSPE-PEG 2000)共蒸发以制备薄膜,其随后与1 mL PBS水合,并以700 psi通过100-nm聚碳酸酯膜挤出,以制备小单层囊泡(平均粒径(Zavg) 126 nm;PDI 0.09)。在针对PBS透析过夜以除去未截留药物后,含有药物的脂质体迅速肿胀(Zavg 539 nm;PDI 0.49)并释放几乎90%的截留药物。其次,脂质薄膜与BI-2536的水性制剂水合(被动加载)。脂质薄膜的水合,接着挤出和透析,导致稳定的脂质体。然而,包封效率是<10%,是用本文描述的修饰的环糊精获得的效率的1/20。
为了进一步证明这种方法的一般性,评价了PD-0325901,一种由Pfizer开发的有丝分裂原-激活的蛋白质激酶激酶1 (MEK1)抑制剂,其因为在2期试验引起视网膜静脉阻塞(RVO)而被放弃(Brown等(2007) Canc. Chemo. Pharmacol. 59:671-679;LoRusso等(2010) Clin. Canc. Res. 16:1924-1937;Haura等(2010) Clin. Canc. Res. 16:2450-2457;和Huang等(2009) J. Ocul. Pharmacol. Therap. 25:519-530)。对氨基化环糊精(图2,化合物VI和VII),以及琥珀酰基化环糊精(图2,化合物VIII和IX)测试了它们包封PD-0325901并将它们分别加载到酸性或碱性脂质体的能力。游离药物是极不溶性的(0.1 mg/mL在水中),而其溶解性在包封进入环糊精之后增加几乎40-倍。最好的脂质体加载用琥珀酰基化环糊精IX实现,并如上对BI-2536所述,在携带人肿瘤异种移植物的动物中,测试了这种制剂。与BI-2536一样,PD-0325901复合物被重复加载到脂质体中,获得稳定的含有5 mg/mL药物的溶液。
为了评价环糊精-复合的、PD-0325901的脂质体(CYCL)形式的活性,分析了它们在RKO异种移植物模型中的作用。以游离药物,严重的急性毒性是明显的。在先前的研究中,游离药物经口管饲给予,因为其溶解性不足以用于静脉内给药。以200 mg/kg经口管饲后,治疗的动物在数分钟内昏睡,并在接下来的几小时内它们出现耸肩(hunched)且总是在24小时内死亡(图10A)。用稍稍较低剂量的游离PD-0325901 (150 mg/kg)治疗的小鼠在给药后即刻表现出类似的症状,但经24小时恢复。然而,单一剂量的游离PD-0325901不能诱导显著的抗-肿瘤反应,仅延缓肿瘤生长达~5% (图10B)。这个结果与那些先前在其它鼠科动物模型中报告的结果一致;游离药物的较高效率需要多个剂量。
相比之下,CYCL-PD-0325901证明远远优于游离药物。甚至在500 mg/kg的剂量,CYCL-PD-0325901未引起任何显著的不良反应;该剂量是杀死每一只动物的游离药物剂量的2.5-倍(图10A)。在单一剂量250 mg/kg,CYCL-PD-0325901不仅导致肿瘤较慢的生长,而且还导致肿瘤的部分消退(图10B)。最后,针对两个其它的人类结肠直肠癌症模型(HCT116及其与基因失活的TP53等位基因的同基因的配对物)对CYCL-PD-0325901进行了评价并类似地观察到与游离药物比较的较高的效力和较低的毒性(图11)。
上述结果证实基于使用在它们的外表面上具有可电离基团的修饰的环糊精,将疏水的药物加载到脂质体中的一般策略(图2)。这些环糊精的“口袋”可包封疏水性药物并使用简单的pH梯度输送它们越过常规脂质体的双层膜。在此已证实,许多类型的化合物可成功地被包封进入修饰的环糊精中,包括香豆素染料和潜在临床意义的药物(图3、5、8和10)。这种结合不仅极大地增加所有这些化合物的水溶性,而且还允许它们被远程加载到脂质体中。而且,当在小鼠的癌症模型中试验时,加载的脂质体表现出基本上更少的毒性(图8)和更大的活性(图8和10)。
先前的使环糊精包合物与脂质体结合的尝试仅限于不溶性药物的被动加载(Zhu等(2013) J. Pharm. Pharmacol. 65(8):1107-1117;Malaekeh-Nikouei和Davies (2009) PDA J. Pharm. Sci. Technol. 63:139-148;Rahman等(2012) Drug Deliv. 19: 346-353;Ascenso等(2013) J. Liposome Res. 23:211-219;Dhule等(2012) Nanomedicine 8:440-451;Lapenda等(2013) J. Biomed. Nanotechnol. 9:499-510;和Mendonça等(2012) AAPS PharmSciTech. 13:1355-1366)或可溶性药物的主动加载(Modi等(2012) J. Control Release 162:330-339)。被动加载常常导致不希望的膜结合,降低脂质体稳定性,并且比主动加载的效率低得多。例如,通过本文描述的方法实现的药物与脂质比的范围为从0.4至0.6,其是通过被动加载通常获得的药物与脂质比的超过1,000-倍(Zhu等(2013) J. Pharm. Pharmacol. 65(8):1107-1117;Malaekeh-Nikouei和Davies (2009) PDA J. Pharm. Sci. Technol. 63:139-148;Rahman等(2012) Drug Deliv. 19:346-353;Ascenso等(2013) J. Liposome Res. 23:211-219;Dhule等(2012) Nanomedicine 8:440-451;和Modi等(2012) J. Control Release 162:330-339)。
因为现今和过去开发的许多最有前景的药物是相对不溶的,本文描述的方法可以是广泛适用的。所述方法不仅增加水溶性,而且还通过提高的渗透性和滞留(EPR)效应,提高药物传递至肿瘤的选择性(Wang等(2012) Annu. Rev. Med. 63:185-198;Peer等(2007) Nat. Nanotech. 2:751-760;Gubernator (2011) Exp. Opin. Drug Deliv. 8:565-580;Huwyler等(2008) Int. J. Nanomed. 3:21-29;Maruyama等(2011) Adv. Drug Deliv. Rev. 63:161-169;Musacchio和Torchilin (2011) Front. Biosci. 16:1388-1412;Baryshnikov (2012) Vest. Ross. Akad. Med. Nauk. 23-31;和Torchilin (2005) Nat. Rev. Drug Disc. 4:145-160)。使用BI-2536的结果提供这些属性的好处的一个突出的例子——同时增加溶解性和选择性肿瘤传递,这导致更少得多的毒性和增加的效力。因此这些策略具有“拯救”在艰苦和昂贵的药物开发过程中的最后步骤之一失败的药物的能力,允许以较高的剂量给予并具有比其它可获得的药物更少的毒性。
通过引用结合
本申请通篇引用的所有参考文献、专利申请、专利和公布的专利申请的内容,以及图和序列表通过引用结合到本文中。应该理解,虽然本文引用了许多专利申请、专利和其它参考文献,这样的参考并不构成对任何这些文件形成本领域一般常识的一部分的认可。
等同方案
本领域技术人员将认识到,或使用不超过常规实验能够确定,对本文所述的本发明的具体实施方案的许多等同方案。这样的等同方案意欲包括在随附的权利要求中。
- 还没有人留言评论。精彩留言会获得点赞!