癌干细胞的增殖抑制剂的制作方法
本发明涉及癌干细胞的增殖抑制剂,详细而言,涉及对现有的抗癌剂治疗法显示出抵抗性的癌干细胞的增殖抑制剂。
背景技术:
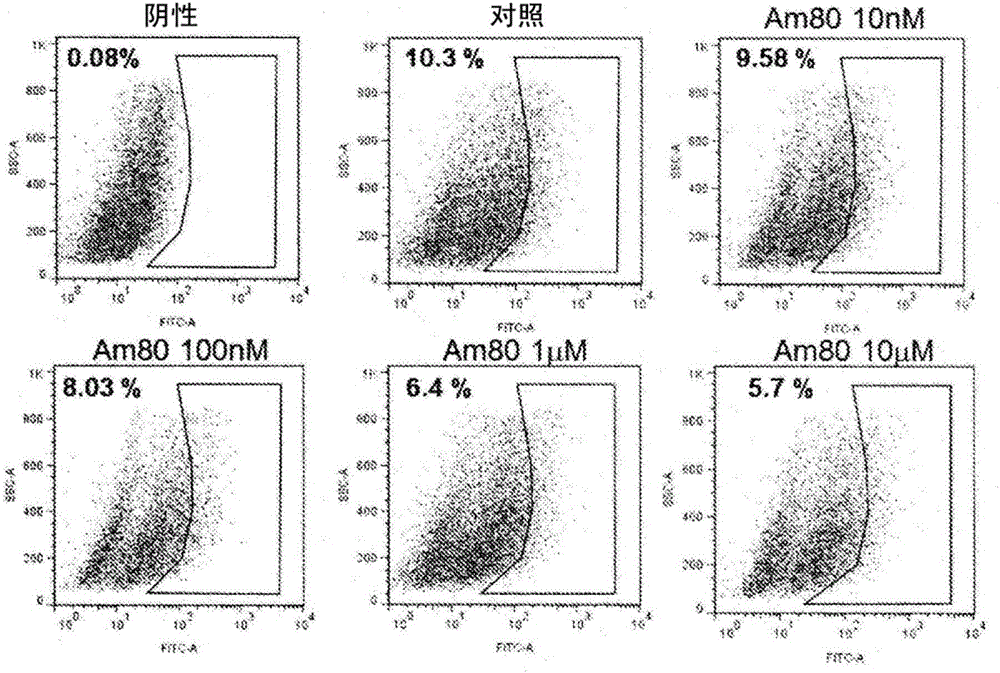
:医学进步中,癌的治疗是进步极其快的领域,其治疗法种类繁多。尽管如此,日本厚生劳动省的人口动态调查、世界卫生组织的调查中,预测由癌导致的死亡人数今后还会增加。其原因之一在于对现有的抗癌剂治疗显示出抵抗性的癌干细胞的存在受到关注。癌细胞由于遗传变异的蓄积、癌细胞周围的微小的环境变化等而具有高的增殖能力、浸润能力、转移能力,但构成癌组织的全部癌细胞不一定兼具这些特征。近年来,阐明了具有这些特征并使癌发生、恶化的能力高的细胞是整体中的极小一部份(非专利文献1)。具有这样的特征的癌细胞具有自我复制能力和能够分化成多种细胞的多分化能力这样在干细胞中共通观察到的2个特征,因此被称为癌干细胞。迄今为止,急性白血病、乳腺癌、大肠癌、脑肿瘤、前列腺癌、胰脏癌等癌种类中确认到其存在。另外,近年来,表明癌干细胞对现有的抗癌剂治疗法显示出抵抗性。例如,对于急性白血病,癌干细胞会留在被称为干细胞壁笼(niche)的微小环境,进入细胞分裂休止的休眠期(G0期),在该状态下对抗癌剂的治疗产生耐性。另外,大量实体癌的干细胞的P糖蛋白等的表达高,对抗癌剂显示出耐性。进而,阐明了抗癌剂治疗后的癌组织中存在的癌干细胞的比率与治疗前相比提高。这些被认为是抗癌剂治疗后无法根治癌而复发的一大原因,阐明了以癌干细胞为标靶的治疗剂的开发是根治癌的重要方法。迄今为止,报道了以癌干细胞为标靶的治疗剂抑制癌的增殖,增强现有的抗癌剂的治疗效果。然而,目前的临床现场中尚未确立以癌干细胞为标靶的治疗剂,现状是期望其开发(非专利文献2)。因此,本发明人等为了使用癌干细胞标记物以能够临床应用的癌干细胞为标靶的新治疗剂的开发而进行了研究(非专利文献3)。现有技术文献非专利文献非专利文献1:Proc.Natl.Acad.Sci.USA100,3983-3988(2003)非专利文献2:Nature453,338-344(2008)非专利文献3:Mol.CancerRes.7,330-338(2009)技术实现要素:发明要解决的问题然而,更强烈期望能够更有效地抑制对现有的抗癌剂治疗法显示出抵抗性的癌干细胞增殖的癌干细胞的增殖抑制剂。因此,本发明的目的在于,提供:能够有效地抑制对现有的抗癌剂治疗法显示出抵抗性的癌干细胞的增殖的癌干细胞的增殖抑制剂。用于解决问题的方案本发明人等为了解决上述课题,着眼于癌干细胞内信号传导通路进行了深入研究。即,癌干细胞通过大量细胞内信号传导通路维持为未分化状态,保持维持癌的能力。认为,妨碍这些信号传导通路的物质通过诱导癌干细胞的分化或细胞凋亡来抑制癌的增殖,从而变成新型抗癌剂的目标。因此,本发明人等使用类视黄醇(retinoid)和类视黄醇合成物(rexinoid),在类视黄醇和类视黄醇合成物所发挥的增殖、生存、分化、细胞凋亡等生理学的作用内,研究包含对癌干细胞的分化、细胞凋亡等的增殖抑制作用时,认为可以成为新型抗癌剂。研究癌干细胞的增殖抑制作用时,癌干细胞在癌细胞中是一部分集团,因此,以癌干细胞标记物为指标进行研究,人胰脏癌细胞表达各种癌干细胞标记物,使用该细胞进行了研究。其结果发现:通过单独使用类视黄醇激动剂、特别是他米巴罗汀(Am-80),或与类视黄醇合成物激动剂、特别是蓓萨罗丁联用,可以抑制人胰脏癌细胞的细胞数、形态、干细胞标记物的表达。另外,类视黄醇受体(RAR)和类视黄醇合成物受体(RXR)为核内转录因子之一,考虑与抑制表观遗传作用的化合物、药剂的相互作用,因此,与包含这些抑制化合物、作用机制不同的分子标靶药的抗癌剂联用,结果发现:表现出癌干细胞的强烈的增殖抑制作用。本发明是基于上述见解而完成的。即,本发明涉及如下的(1)~(7)。(1)一种癌干细胞的增殖抑制剂,其以类视黄醇激动剂(retinoidagonist)为有效成分。(2)根据前述(1)所述的癌干细胞的增殖抑制剂,其中,前述类视黄醇激动剂为他米巴罗汀(Am-80)。(3)根据前述(1)或(2)所述的癌干细胞的增殖抑制剂,其进一步以类视黄醇合成物激动剂(rexinoidagonist)为有效成分。(4)根据前述(3)所述的癌干细胞的增殖抑制剂,其中,前述类视黄醇合成物激动剂为蓓萨罗丁。(5)根据前述(1)~(4)中任一项所述的癌干细胞的增殖抑制剂,其包含抗癌剂。(6)根据前述(5)所述的癌干细胞的增殖抑制剂,其中,以0.5~20mg每一人类个体的量包含类视黄醇激动剂,以总计0.5~500mg每一人类个体的量包含类视黄醇激动剂和类视黄醇合成物激动剂并且以1.0~1000mg每一人类个体的量包含抗癌剂。(7)根据前述(5)或(6)所述的癌干细胞的增殖抑制剂,其中,前述抗癌剂选自由DNA相互作用剂、抗代谢物、微管蛋白相互作用剂、分子靶向治疗剂、表观遗传作用抑制剂和激素剂组成的组。发明的效果根据本发明,通过单独给予类视黄醇激动剂、或利用与类视黄醇合成物激动剂的联用的给予,可以减少癌干细胞。另外,通过进一步给予抗癌剂,可以使肿瘤块的体积减少或缩小。另外,同时给予类视黄醇激动剂和类视黄醇合成物激动剂与抗癌剂的方法也是有用的。作为本发明应当治疗的癌有:对抗癌剂治疗显示出抵抗性的急性骨髄性白血病、非霍奇金淋巴瘤等血液癌、胰脏癌、肝细胞癌、大肠癌等消化器官癌、肺癌、乳腺癌、前列腺癌和卵巢癌等。附图说明图1为示出在不同浓度的Am80存在下将Panc-1用Am80悬浮培养1周时的细胞数的变化的图。图2为示出在悬浮培养条件下、将Panc-1用Am80处理时的ALDH阳性细胞数减少的图。图3为示出在悬浮培养条件下、将Panc-1用Am80处理时的CD24/CD44/ESA阳性细胞数减少的图。图4为示出在悬浮培养条件下、将Panc-1在Am80存在下培养时的胰脏组织分化标记物上升的图。图5为示出将MIAPaca2细胞用Am80和蓓萨罗丁共处理1周时的细胞增殖活性的抑制的图。图6为示出将MIAPaca2细胞用Am80和5-氮杂-dC共处理1周时的细胞增殖活性的抑制的图。图7为示出将MIAPaca2细胞用Am80和SAHA共处理1周时的细胞增殖活性的抑制的图。图8为示出将MIAPaca2细胞用Am80和VPA共处理1周时的细胞增殖活性的抑制的图。图9为示出Am80对人胰脏癌细胞的细胞游走能力产生的影响的显微镜照片。图10为示出Am80对人胰脏癌细胞的癌转移抑制效果的图。图11为示出Am80对人胰脏癌细胞的致肿瘤抑制效果的图。图12为示出Am80对移植至裸鼠的人胰脏癌干细胞的抑制效果的图。图13为示出Am80对人胰脏癌细胞的致肿瘤抑制效果的病理标本照片。图14为示出Am80与抗癌剂·吉西他滨对人胰脏癌细胞的体外联用效果的图。图15为示出Am80与抗癌剂·吉西他滨对人胰脏癌细胞/裸鼠的体内联用效果的图。图16为示出Am80与表观遗传抑制剂VPA对人胰脏癌细胞/裸鼠的体内联用效果的图。图17为示出Am80与5-AZ对人白血病细胞Kasumi-1的联用效果的等效线图。图18为示出将MCF-7细胞用Am80和5-AZ共处理96小时时的细胞增殖活性的抑制的图。图19为示出将LNCaP细胞用Am80和5-AZ共处理96小时时的细胞增殖活性的抑制的图。具体实施方式以下,对本发明的实施方式进行具体说明。本发明的癌干细胞的增殖抑制剂以类视黄醇激动剂为有效成分。本发明中,类视黄醇激动剂中包含其药剂学上能够允许的有机或无机的酸加成盐。作为特别优选的类视黄醇激动剂,可以举出:他米巴罗汀(Am80)。另外,本发明的癌干细胞的增殖抑制剂可以适合地联用类视黄醇合成物激动剂。类视黄醇合成物激动剂也包含其药剂学上能够允许的有机或无机的酸加成盐,可以特别优选举出:蓓萨罗丁(Targretin)。本发明的癌干细胞的增殖抑制剂通过与各种抗癌剂联用,从而具有使抗癌剂的抗癌活性增强的作用。本发明中,作为抗癌剂的DNA相互作用剂,可以举出:烷基化剂的环磷酰胺、美法仑、顺铂、卡铂等,而且可以举出:DNA拓扑异构酶I抑制剂的喜树碱、DNA拓扑异构酶II抑制剂的依托泊苷、柔红霉素、阿霉素等。可以优选举出:能够口服给予的环磷酰胺、美法仑、顺铂、喜树碱、阿霉素。作为抗癌剂的抗代谢物,可以举出:叶酸拮抗剂的甲氨蝶呤和三甲氨蝶呤、嘧啶拮抗剂的5-氟尿嘧啶、5-氮杂-dC(5-aza-dC)、氮杂胞苷、阿糖胞苷和吉西他滨、嘌呤拮抗剂的氟达拉滨。可以优选举出:能够口服给予的甲氨蝶呤、5-氟尿嘧啶、5-氮杂-dC、氮杂胞苷、阿糖胞苷、吉西他滨、氟达拉滨。作为抗癌剂的微管蛋白抑制剂,可以优选举出:紫杉醇、多西他赛(Docetaxel)。作为抗癌剂的分子靶向治疗剂,可以举出:环氧化酶2抑制剂的塞来昔布、罗非昔布、增殖因子信号抑制剂的埃罗替尼、伊马替尼等。可以优选举出:能够口服给予的吉非替尼、伊马替尼。作为抗癌剂的表观遗传作用抑制剂,可以举出:DNA甲基化抑制剂的氮杂胞苷、组蛋白脱乙酰化酶抑制剂的丙戊酸、SAHA(伏立诺他(Vorinostat))、罗咪酯肽(Romidepsin(FK228))。可以优选举出:能够口服给予的氮杂胞苷、丙戊酸、SAHA(伏立诺他)。作为抗癌剂的激素剂,可以举出:醋酸亮丙瑞林、醋酸戈舍瑞林、抗雌激素剂的它莫西芬、抗雄激素剂的氟他胺、比卡鲁胺、恩杂鲁胺等。可以优选举出:能够口服给予的它莫西芬、氟他胺、比卡鲁胺、恩杂鲁胺。作为抗癌剂的组合,例如可以举出:紫杉醇(或多西他赛)与顺铂与TS-1的组合、多西他赛与奥沙利铂的组合、多西他赛与分子靶向药的组合等,但不限定于这些。本发明的癌干细胞的增殖抑制剂可以通过以口服、经直肠、局部、或非口服、向静脈内或肿瘤内的注射中的任一者给予有效量,从而可以有效地抑制人体的癌干细胞和癌组织的生长。本发明的癌干细胞的增殖抑制剂可以为片剂、胶囊、丸剂、脂质体等固体或凝胶状、或液态(参照CancerChemotherapyHandbookversion2,15-34(1994))。利用本发明的癌干细胞的增殖抑制剂进行治疗时,也可以根据治疗的癌的类型设为适当的任意量,应用有效量的方法根据治疗的癌干细胞的存在比例而变化。作为一例,可以设为:以总计0.5~500mg每一人类个体的量包含类视黄醇激动剂和类视黄醇合成物激动剂,且以1.0~1000mg每一人类个体的量包含抗癌剂。另外,类视黄醇激动剂可以适合地设为0.5~20mg每一人类个体。本发明的癌干细胞的增殖抑制剂优选单独使用类视黄醇激动剂或与类视黄醇合成物激动剂联用中同时给予抗癌剂,使癌干细胞分化,导致细胞凋亡,使癌细胞增殖抑制或缩小。为了抑制癌干细胞的增殖,可以根据需要给予2周~2年。实施例以下,基于实施例对本发明进行说明。需要说明的是,下述实施例是示例,当然不对本发明作出限定。〔实施例1〕<Am80对人胰脏癌细胞球状体的增殖抑制效果>使用人胰脏癌细胞株,在DMEM/F12中添加有B27、20ng/mLEGF、20ng/mLbFGF和4μg/mL肝素的培养基中,使用低粘附培养皿进行培养时,形成细胞团,能够以悬浮状态进行培养,可以在几个癌干细胞标记物和其他癌中被报道的标记物增加的状态下进行培养。首先,将包含该癌干细胞标记物阳性细胞的细胞团在添加了Am80的培养基中培养1周,分析对细胞团的增殖、癌干细胞标记物的表达量的影响。其结果,他米巴罗汀(Am80)的浓度依赖性地,细胞团的增殖受到抑制。细胞团的数量减少,细胞数也浓度依赖性地减少(图1)。进而,将该细胞团在含Am80培养基中总计培养2周时,细胞团进一步变得更小,细胞数减少。由以上表明,Am80具有抑制包含胰脏癌干细胞的细胞集团的增殖的作用。〔实施例2〕<Am80对人胰脏癌细胞Panc-1球状体的ALDH活性的抑制效果>如实施例1所示那样,Am80会抑制胰脏癌细胞株的悬浮培养状态下的细胞团形成,因此,认为变为此种的癌干细胞有减少的可能性。已知的是,在造血干细胞、祖细胞等中醛脱氢酶(ALDH)活性高,而在分化细胞中活性低。因此,在添加了Am80且进行了1周悬浮培养的胰脏癌细胞中加入前体Bodipy-aminoacetaldehyde(ALDEFLUOR,StemCellTechnologies),用流式细胞仪对由醛脱氢酶活性代谢而生成的Bodipy-aminoacetate的荧光阳性细胞数量进行定量分析。其结果,添加Am80进行培养时,ALDH活性浓度依赖性地降低,表示癌干细胞量减少的可能性(图2)。〔实施例3〕<Am80对存在于人胰脏癌细胞Panc-1球状体的CD24+/CD44+/ESA+细胞的抑制效果>使用对各种癌干细胞表面标记物的表达在蛋白质水平进行荧光标记的第一抗体,用流式细胞仪对添加了Am80并进行了1周悬浮培养的胰脏癌细胞进行分析,结果确认了,特别是CD24+/CD44+/ESA+阳性细胞的存在率由于添加了Am80而显著表现减少。特别是,在10μM的Am80存在下,CD24+/CD44+/ESA+阳性细胞的存在率减半。即,暗示了Am80有使癌干细胞减少的可能性(图3)。〔实施例4〕<对人胰脏癌细胞球状体的分化标记物增强效果>接着,从添加了Am80并进行了1周悬浮培养的胰脏癌细胞中提取总RNA,用针对胰脏组织特异性的分化标记物的引物进行定量RT-PCR,结果观察到Pdx1、胰高血糖素等的基因表达有Am80的浓度依赖性地上升的情况。由此暗示了,Am80有促进包含癌干细胞的细胞集团的分化的可能性(图4)。〔实施例5〕<Am80与蓓萨罗丁(bexarotene)的联用对人胰脏癌细胞MIA-Paca2球状体的细胞增殖活性的影响>将包含癌干细胞标记物阳性细胞的MIA-Paca2细胞团在添加了Am80(10nM-1μM)和蓓萨罗丁的培养基中悬浮培养1周,然后添加MTT试剂(CellCountingKit-8,Dojindo)进一步培养3小时,然后测定450nm的吸光度(OD450)来分析对细胞团的细胞增殖活性的影响。其结果,Am80和蓓萨罗丁的浓度依赖性地、缓慢地抑制了细胞团的细胞增殖活性(图5)。〔实施例6〕<Am80与DNA甲基抑制剂·5-氮杂-dC的联用对人胰脏癌细胞MIA-Paca2球状体的增殖活性的影响>将包含癌干细胞标记物阳性细胞的MIA-Paca2细胞团在添加了Am80(10nM-1μM)和5-氮杂-dC的培养基中悬浮培养1周,然后添加MTT试剂(CellCountingKit-8,Dojindo),进一步培养3小时,然后测定450nm的吸光度来分析对细胞团的细胞增殖的影响。其结果,Am80与5-氮杂-dC的浓度依赖性地抑制了细胞团的细胞增殖活性(图6)。〔实施例7〕<Am80与组蛋白脱乙酰化酶抑制剂·SAHA的联用对人胰脏癌细胞MIA-Paca2球状体的增殖抑制的影响>将包含癌干细胞标记物阳性细胞的MIA-Paca2细胞团在添加了Am80(10nM-1μM)和SAHA的培养基中悬浮培养1周,然后添加MTT试剂(CellCountingKit-8,Dojindo),进一步培养3小时,然后测定450nm的吸光度来分析对细胞团的细胞增殖活性的影响。其结果,Am80与SAHA的浓度依赖性地、缓慢地抑制了细胞团的细胞增殖活性(图7)。〔实施例8〕<Am80与组蛋白脱乙酰化酶抑制剂·丙戊酸(VPA)的联用对人胰脏癌细胞MIA-Paca2球状体的增殖抑制的影响>将包含癌干细胞标记物阳性细胞的MIA-Paca2细胞团在添加了Am80(6.3nM~100nM)和VPA的培养基中悬浮培养1周,然后添加MTT试剂(CellCountingKit-8,Dojindo),进一步培养3小时,然后以450nm的吸光度来测定对细胞团的细胞增殖的影响。其结果,Am80与VPA显示出协同的细胞团的细胞增殖抑制活性(图8)。〔实施例9〕<Am80对人胰脏癌干细胞的细胞游走能力的影响>将包含胰脏癌干细胞的胰脏癌细胞用抗体磁珠分离为CD133阳性细胞和阴性细胞,然后添加1μM的Am80,在博伊登室(Boydenchambers)中进行培养,观察游走至膜里侧的细胞。其结果,Am80在CD133阳性细胞的癌干细胞级分中显著抑制细胞游走能力(图9)。〔实施例10〕<Am80对人胰脏癌细胞的癌转移抑制效果>将包含胰脏癌干细胞的胰脏癌细胞(1×106个)移植至裸鼠的胰脏,测定1个月后转移至肝脏形成的肿瘤的大小(Tumorvolume)。以3mg/kg·天给予1个月的Am80。其结果,与对照相比,可以抑制胰脏癌的转移(图10)。〔实施例11〕<Am80对人胰脏癌细胞的致肿瘤抑制效果>将包含胰脏癌干细胞的胰脏癌细胞(1×106个)移植至裸鼠的皮下,2周后,对确认到形成肿瘤的小鼠,以3mg/kg·天给予1个月(用Am80处理后的天数,Am80处理后的天数)的Am80。其结果,未见对体重(Bodyweight)的影响(A),与对照相比可以在体内抑制胰脏癌的增殖(B)(图11)。〔实施例12〕<Am80对移植至裸鼠的人胰脏癌干细胞的抑制效果>将包含胰脏癌干细胞的胰脏癌细胞(1×106个)移植至裸鼠的皮下,2周后,对确认到形成肿瘤的小鼠,以3mg/kg·天给予1个月的Am80。之后,取出肿瘤,进行胰蛋白酶处理,使用抗CD133抗体,用流式细胞仪测定胰脏癌干细胞的比例,结果可知,Am80与对照相比,具有在体内抑制胰脏癌干细胞的作用(图12)。〔实施例13〕<Am80对人胰脏癌细胞的致肿瘤抑制效果>将包含胰脏癌干细胞的胰脏癌细胞(1×106个)移植至裸鼠的皮下,2周后,对确认到形成肿瘤的小鼠,以3mg/kg·天给予1个月的Am80。制作各肿瘤的病理标本,尝试评价细胞组织形态,结果可知,与没有给予Am80的对照组相比胰脏癌组织的形态显示出分化型(图13)。〔实施例14〕<抗癌剂·吉西他滨与Am80联用对人胰脏癌细胞的效果>将人胰脏癌细胞在悬浮培养状态下加入吉西他滨(10nM)并培养1周,然后进一步添加Am80,悬浮培养1周,计数细胞团的数量(形成的集落的数量)。其结果可知,Am80对抗癌剂处理后的胰脏癌细胞在体外也具有球状体形成抑制效果(图14)。〔实施例15〕<抗癌剂·吉西他滨与Am80联用对人胰脏癌细胞的效果>将包含胰脏癌干细胞的胰脏癌细胞(1×106个)移植至裸鼠的皮下,2周后,对确认到形成肿瘤的小鼠,以3mg/kg·天每天给予Am80,以50mg/kg、每隔3天给予1个月的吉西他滨(用Am80和Gem处理后的天数)。其结果可知,与对照(未给予Am80和吉西他滨)、单独给予吉西他滨相比,同时给予Am80与吉西他滨时,在体内更强地抑制胰脏癌的增殖(图15)。此处,Gem表示吉西他滨。〔实施例16〕<表观遗传抑制剂VPA与Am80联用对人胰脏癌细胞的效果>将包含胰脏癌干细胞的胰脏癌细胞(1×106个)移植至裸鼠的皮下,2周后,对确认到形成肿瘤的小鼠,以3mg/kg·天每天给予Am80,以500mg/kg、每隔3天给予1个月的VPA(用Am80和VPA处理后的天数)。其结果可知,与对照(未给予Am80和VPA)、单独给予VPA、单独给予Am80相比,同时给予Am80与VPA时,在体内更强地抑制胰脏癌的增殖(图16)。〔实施例17〕<Am80与多西他赛(DXL)的联用对人胰脏癌细胞MIA-Paca2/裸鼠的增殖抑制的影响>使用套管针,将包含癌干细胞标记物阳性细胞的人胰脏癌细胞MIA-Paca2的肿瘤片移植至6周龄的雌性BALB/cAJcl-nu裸鼠(4只/组、仅对照组为5只)的背侧部皮下。从肿瘤体积达到100-200mm3的时刻开始给药。Am80是以2mg/kg、1次/天、连续21天口服给予,DXL是将5mg/kg从第1天开始每隔4天静脈内给予3次。联用组是以与各单剂相同的用量、给予法来给予,直至给予结束第2天(第22天)测定肿瘤直径。将肿瘤的长径和短径的测定值代入长径×短径2/2的式子而求出肿瘤体积(mm3)。需要说明的是,对照组是将生理盐水从第1天开始每隔4天腹腔内给予3次。其结果,Am80与DXL的联用显示出提高各单剂的效果的协同的细胞增殖抑制活性。将结果示于下述表1。[表1]第1天第5天第9天第13天第17天第22天对照组140.8222.9300.3453.7648.7862.5Am80组151.3182.1255.5348.8429.9466.4DXL组136.7151.3135.793.776.377.3联用组138.2131.6110.371.260.141.2〔实施例18〕<Am80与DNA甲基化抑制剂·氮杂胞苷(5-AZ)的联用对人白血病细胞株Kasumi-1的增殖抑制的影响>将包含癌干细胞标记物阳性细胞的人白血病细胞株Kasumi-1在添加有20%FBS的RPMI1640培养基中进行培养,使用等效线图(Isobrogram),研究了Am80与5-AZ的联用所产生的增殖抑制作用。各IC50值为1.0μM、8.4μM。求出将它们的浓度设为1.0时的联用效果的比率,连接两轴的1.0的直线上的情况下显示出相加效果,在直线下侧的情况下显示出协同效果。Am80与5-AZ的联用在增殖抑制作用中显示出协同效果(图17)。〔实施例19〕<Am80与DNA甲基化抑制剂·5-AZ的联用对人乳腺癌细胞株MCF-7的增殖抑制的影响>将包含癌干细胞标记物阳性细胞的人乳腺癌细胞株MCF-7在添加有2%FBS的RPMI1640培养基中进行培养,研究了Am80与5-AZ的联用所产生的增殖抑制作用。暴露96小时的各IC50值为1μM、20μM,因此,研究了Am80在以2倍梯度从0.125μM至1μM的浓度范围内的增殖抑制作用;另外,研究了5-AZ在以2倍梯度从2.5μM至20μM的浓度范围的增殖抑制作用。联用的情况下,使用这些浓度研究了增殖抑制作用。Am80与5-AZ的联用在增殖抑制作用中显示出协同效果(图18)。〔实施例20〕<Am80与多西他赛(DXL)的联用对人乳腺癌细胞株MCF-7/裸鼠的增殖抑制的影响>使用套管针,将包含癌干细胞标记物阳性细胞的人乳腺癌细胞株MCF-7的肿瘤片移植至6周龄的雌性BALB/cAJcl-nu裸鼠(5只/组)的背侧部皮下。从肿瘤体积达到100-200mm3的时刻开始给药。Am80是以1mg/kg、1次/天、连续口服给予21天;DXL是以3.5mg/kg、从第1天开始间隔4天静脈内给予3次。联用组以与各单剂相同的用量、给予法来给予,直至给予结束第2天(第22天)测定肿瘤直径。使用卡尺测定肿瘤的长径和短径,根据长径×短径2/2的式子求出肿瘤体积(mm3)。需要说明的是,对照组是将生理盐水从第1天开始每隔4天腹腔内给予3次。其结果,对于增殖慢的人乳腺癌细胞株MCF-7,Am80与DXL的联用显示出提高各单剂的效果的协同的细胞增殖抑制活性。将结果示于下述表2。[表2]第1天第5天第9天第13天第17天第22天对照组150.1155.7205.5253.8276.7320.3Am80组155.3151.3155.5208.9229.4261.4DXL组143.5121.5110.083.366.571.3联用组141.2131.6100.161.350.545.1〔实施例21〕<Am80与DNA甲基化抑制剂·5-AZ的联用对人前列腺癌细胞株LNCaP的增殖抑制的影响>将包含癌干细胞标记物阳性细胞的人前列腺癌细胞株LNCaP在添加有10%FBS的RPMI1640培养基中进行培养,研究了Am80与5-AZ的联用所产生的增殖抑制作用。暴露96小时的各IC50值为2μM、25μM,因此,研究了Am80在以2倍梯度、从0.125μM至1μM的浓度范围内的增殖抑制作用;另外研究了5-AZ在以2倍梯度、从1.56μM至12.5μM的浓度范围的增殖抑制作用。联用的情况下,使用这些浓度研究了增殖抑制作用。Am80与5-AZ的联用在增殖抑制作用中显示出协同效果(图19)。〔实施例22〕<Am80与多西他赛(DXL)的联用对人前列腺癌细胞株LNCaP/裸鼠的增殖抑制的影响>使用套管针,将包含癌干细胞标记物阳性细胞的人前列腺癌细胞株LNCaP的肿瘤片移植至6周龄的雌性BALB/cAJcl-nu裸鼠(4只/组)的背侧部皮下。从肿瘤体积达到100-200mm3的时刻开始给药。Am80是以1mg/kg、1次/天、连续口服给予21天;DXL是以5mg/kg、从第1天开始间隔4天静脈内给予3次。联用组以与各单剂相同的用量、给予法来给予,直至给予结束第2天(第22天)测定肿瘤直径。使用卡尺测定肿瘤的长径和短径,根据长径×短径2/2的式子求出肿瘤体积(mm3)。需要说明的是,对照组是将生理盐水从第1天开始每隔4天腹腔内给予3次。其结果,对于人前列腺癌细胞株LNCaP,Am80与DXL的联用显示出提高各单剂的效果的协同的细胞增殖抑制活性。将结果示于下述表3。[表3]第1天第5天第9天第13天第17天第22天对照组120.8162.7225.5317.3478.7612.4Am80组121.3162.1205.8282.8409.9436.3DXL组126.7111.390.773.772.570.2联用组130.1111.490.361.660.347.7类视黄醇激动剂·他米巴罗汀(Am-80)单剂或联用类视黄醇合成物激动剂·蓓萨罗丁(Targretin)两剂时,抑制人胰脏癌干细胞的标记物表达和增殖,另外,通过与各种抗癌剂联用,确认到增强抗癌剂的效果。进而,对于各种癌,通过联用Am80与各种抗癌剂,确认到增强抗癌剂的效果。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种RNA抑制剂及其在肿瘤中的应用的制作方法与工艺
- 固氮鱼腥藻细胞受ALS抑制剂类除草剂损伤的修复方法与流程
- 一种修复细胞DNA损伤的抑制剂及其制作方法和应用与流程
- 一种修复细胞DNA损伤的抑制剂及其制作方法和应用与流程
- TLR3抑制剂在制备防治肿瘤转移产品中的应用的制作方法与工艺
- 一种提高酵母细胞对复合抑制剂耐受能力的方法与流程
- 免疫检查点抑制剂在中枢神经系统肿瘤中的用途的制造方法与工艺
- 作为MIDH1抑制剂用于治疗肿瘤的1‑环己基‑2‑苯基氨基苯并咪唑的制造方法与工艺
- 具有细胞渗透性的BCL‑XL抑制剂的抗体药物缀合物的制造方法与工艺
- 用于增强干细胞功能的内含抑制素纳米粒子制剂、以及含有其的功能增强干细胞及其制备方法与流程