含有抗EGFR1抗体的缀合物的制作方法
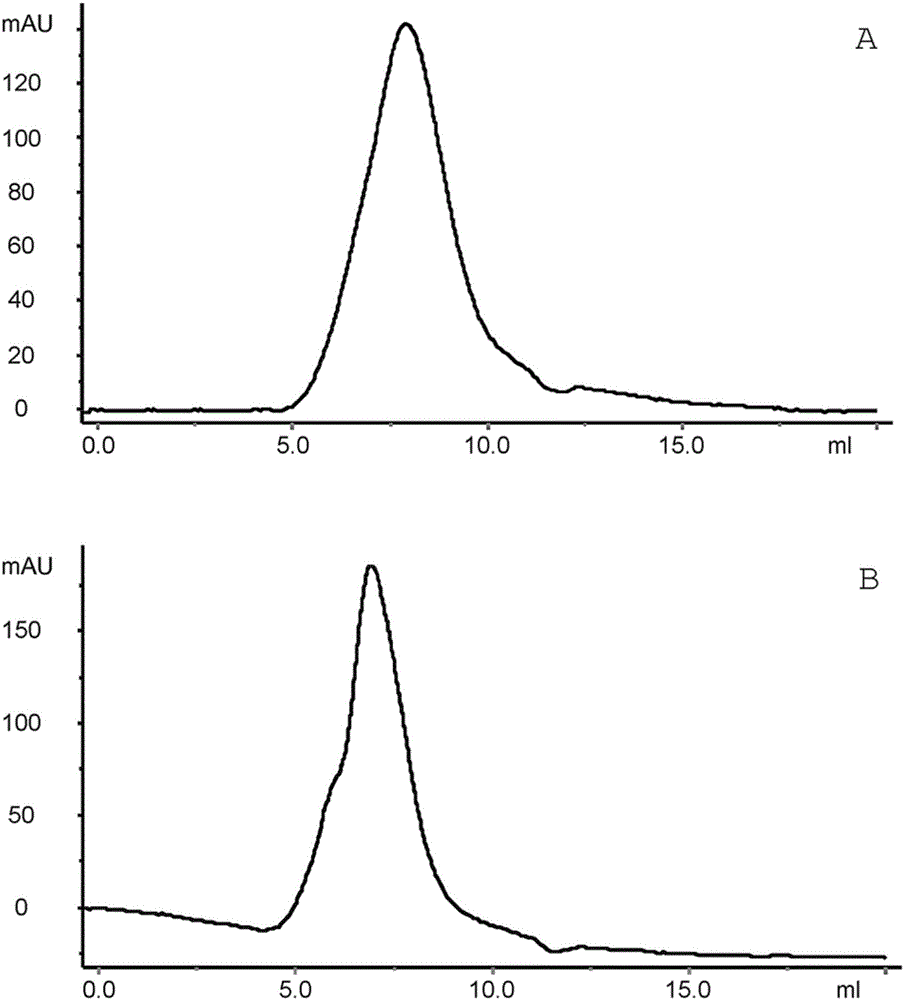
本发明涉及治疗或调节人类中表达EGFR1的肿瘤细胞生长的缀合物(conjugate)、药物组合物和方法。发明背景硼中子捕获疗法(BNCT)是恶性肿瘤例如原发性脑肿瘤和头颈癌的一种非侵入性治疗形式。在BNCT中,向患者注射具有肿瘤定位能力并携带非放射性硼-10原子的药物。当药物用低能量热中子照射时,发出生物破坏性α粒子和锂-7原子核。BNCT需要具有高含量硼-10并且能够专门定位于肿瘤的药物,例如缀合物。这类缀合物应当易于生产、稳定、可溶解且安全。然而,提供这类缀合物是复杂的,例如原因在于一些类型的化学物质似乎与含有硼-10的化合物不兼容。本发明的目的是提供如与已知缀合物相比具有改善特性并含有高含量硼-10的缀合物。发明概述本发明的缀合物以权利要求1中所呈现的内容为表征。本发明的药物组合物以权利要求18中所呈现的内容为表征。用作药物的本发明缀合物或药物组合物以权利要求19中所呈现的内容为表征。用于治疗癌症的本发明缀合物或药物组合物以权利要求20中所呈现的内容为表征。治疗或调节人类中表达EGFR1的肿瘤细胞生长的方法以权利要求22中所呈现的内容为表征。本发明的原核宿主细胞以权利要求26中所呈现的内容为表征。治疗或调节人类中表达EGFR1的肿瘤细胞生长的方法以权利要求56中所呈现的内容为表征。本发明的多核苷酸以权利要求57、58、59和60中所呈现的内容为表征。附图简述纳入的附图旨在提供对本发明的进一步理解并且构成本说明书组成的一部分,该附图示例了本发明的实施例并且连同说明书一起有助于解释本发明原理。在附图中:图1.BSH-葡聚糖的质子-NMR谱。硼连接的质子在0.8-2.0ppm之间共振,并且通过比较硼-质子的积分与葡聚糖质子的积分,可以估计BSH-葡聚糖的硼载量。未反应的烯丙基在4.22、5.29、5.39和5.99ppm产生信号。在2.225ppm处的锐信号是丙酮(内标物)。图2.BSH-Dex-缀合物的凝胶过滤分析。A.抗EGFR1-Fab-BSH(800B)-Dex。用YarraSEC-3000凝胶过滤柱分析时,缀合物在7.8ml洗脱。相比之下,抗EGFR1-Fab在9.1ml洗脱。B.抗EGFR1-Fab2-BSH(800B)-Dex。用YarraSEC-3000凝胶过滤柱分析时,缀合物在6.9ml洗脱。相比之下,抗EGFR1-Fab2在8.4ml洗脱。图3.在非还原条件(小图A)和还原条件(小图B)下,硼量不同的荧光标记的抗EGFR1Fab/F(ab’)2硼缀合物的SDS-PAGE分析。抗EGFR1-Fab-BSH-Dex缀合物:泳道1(900B)、泳道2(700B)、泳道4(560B)、泳道6(360B)。抗EGFR1-F(ab’)2-BSH-Dex缀合物:泳道3(700B)、泳道5(560B)、泳道7(360B)。泳道8是抗EGFR1-Fab-Dex并且泳道9是含有抗EGFR1-F(ab’)2和Fc片段的混合物的对照(Fab片段在凝胶上的迁移类似于Fc片段)。采用考马斯蓝凝胶染色。图4.HSC-2细胞对荧光标记的抗EGFR1-F(ab’)2(小图A和C)和抗EGFR1-F(ab’)2-BSH(900B)-Dex(小图B和D)的细胞表面结合和内化。在+4℃(与细胞表面结合)和+37℃(与细胞表面结合并内化)进行了温育。通过荧光显微术实施了分析。图5.用于信号肽优化的载体结构例子。鉴定的T5启动子、核糖体结合位点(RBS)、信号肽和抗EGFR1Fab重链序列和轻链序列。图6.针对Fab表达的启动子优化的结果。在液态LB培养基中用W3110pGF119(A)或BL21(DE3)pGF121(B)产生10ml表达培养物。将诱导后培养物在+20℃培育过夜,收获1ml样品并进行周质提取,随后蛋白质印迹检测。1)背景菌株w/o表达载体;2)W3110pGF119克隆#1;3)W3110pGF119克隆#2;4)W3110pGF119克隆#3;C)250ng对照Fab。图7.针对Fab表达的启动子优化的结果。用W3110pGF132在三个不同的诱导后温度产生10ml表达培养物:A)+20℃;B)+28℃和C)+37℃。使用不同的鼠李糖浓度用于诱导:1)rha0;2)rha0.25mM;3)rha1mM;4)rha4mM;5)rha8mM。C=100ng对照fab。将诱导后培养物在所示温度培育4小时,收获1ml样品并且进行周质提取,随后蛋白质印迹检测。图8.比较双顺反子启动子与双重启动子结构。pGF119和pGF121是双顺反子载体,pGF120和pGF131是双重启动子载体。1)未诱导的对照;2)W3110pGF119#13)W3110pGF119#2;4)W3110pGF120未诱导;5)W3110pGF120#1;6)W3110pGF120#2;7)Lemo21(De3)pGF131#1;8)Lemo21(De3)pGF131#2;9)Lemo21(De3)pGF121#1;10)BL21(De3)pGF131#1;11)BL21(De3)pGF131#2;C)100ng对照fab。图9.含有周质伴侣SKP(pGF134)和SKP/FkpA(pGF135)的大肠杆菌(E.coli)Lemo21(De3)和BL21(DE3)中的抗EGFR1Fab表达。利用使得鼠李糖精细调节作用成为可能的菌株内置特征,产生Lemo21(De3)培养物。泳道1)Lemo21(De3)pGF131;2)Lemo21(De3)pGF131pGF134;3)Lemo21(De3)pGF131pGF135;4)BL21(De3)pGF131;5)BL21(De3)pGF131pGF134;6)BL21(De3)pGF131pGF135;C)对照Fab100ng。在+28℃利用250uM鼠李糖,与Lemo21(De3)pGF131(泳道1)相比,Lemo21(De3)pGF131pGF134和–pGF135(泳道2和3)产生的抗EGFR1Fab数量明显增加。在+20℃,与BL21(De3)pGF131(泳道4)相比,BL21(De3)pGF131pGF134和–pGF135(泳道5和6)产生的抗EGFR1Fab数量明显增加。图10.周质表达的抗EGFR1Fab的蛋白质印迹分析。泳道1)分子量标记;泳道2)抗EGFR1Fab对照蛋白,100ng;泳道3)空白;泳道4)诱导前细胞沉淀物样品;泳道5)诱导后4小时细胞沉淀物样品;泳道6)诱导后16小时细胞沉淀物样品;泳道7-9)空白;泳道10)诱导前培养上清液样品;泳道11)诱导后4小时培养上清液样品;泳道12)诱导后16小时培养上清液样品。全部样品均代表10μl发酵罐培养物悬液。比较诱导后16小时细胞沉淀物样品中的条带强度(泳道6)与泳道2(100ng)中对照抗EGR1Fab的条带强度,估计发酵罐培养的大肠杆菌细胞的周质提取物中的抗EGFR1Fab浓度。泳道6据估计含有300ng抗EGR1Fab:300ng/10μl=30mg/L。图11.HiTrapSPFF纯化的周质提取物的色谱图。汇集级分A5-A10用于进一步纯化步骤。图12.蛋白质L纯化的样品的色谱图。汇集级分A5-A7。图13.纯化的抗EGFR1Fab的SDS-PAGE分析。样品按等量加载(24μL)。泳道1)分子量标记;泳道2)木瓜蛋白酶消化法产生的抗EGFR1Fab;泳道3)10%大肠杆菌产生的Fab样品;泳道4)40%大肠杆菌产生的Fab样品。在泳道3和泳道4中,LC(上部)和HC(下部)条带已经分离。在泳道2中,Fab糖基化并且LC和HC不能分离。图14.抗EGFR1Fab(上半小图)或FabBSH-葡聚糖(下半小图)与微阵列载玻片上的EGFR1结合。发明详述本发明涉及一种包含抗EGFR1抗体或其EGFR1结合片段和至少一种葡聚糖衍生物的缀合物,其中葡聚糖衍生物包含至少一个D-吡喃葡萄糖基单元,其中选自至少一个D-吡喃葡萄糖基单元的碳2、3或4中的至少一个碳由下式的取代基取代:-O-(CH2)n-S-B12H112-,其中n处于3至10范围内;并且葡聚糖衍生物借助由至少一个醛基和抗EGFR1抗体或其EGFR1结合片段的氨基之间反应形成的键而与抗EGFR1抗体或其EGFR1结合片段结合,所述至少一个醛基通过氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元而形成。缀合物适用于硼中子捕获疗法中。“硼中子捕获疗法”(BNCT)应当理解为指靶向放疗法,其中非放射性硼-10用低能量热中子照射以产生生物破坏性α粒子和锂-7原子核。非放射性硼-10可以通过将其并入肿瘤定位性药物例如肿瘤定位性缀合物中而被导引。“EGFR1”在本文中应当理解为指具有SEQIDNO:1中所述序列的人表皮生长因子受体1(EGFR1)。“抗EGFR1抗体”应当理解为指特异性结合EGFR1的抗体。术语“特异性结合”指抗体的这样一种能力,该能力区分EGFR1和任何其他蛋白质至如此程度,从而仅结合或显著地结合多个不同蛋白质作为潜在结合配偶体的集合中的EGFR1。仅作为例子,可以通过例如在Biacore装置上利用基于表面等离子体共振的方法、通过免疫学方法例如ELISA或通过例如蛋白质微阵列,测定特异性结合作用和/或动力学量值。“其EGFR1结合片段”应当理解为指能够特异性结合EGFR1的抗EGFR1抗体的任何片段。在一个实施方案中,抗EGFR1抗体是西妥昔单抗(cetuximab)、imgatuzumab、马妥珠单抗(matuzumab)、尼妥珠单抗(nimotuzumab)、necitumumab、帕尼单抗(panitumumab)或扎鲁木单抗(zalutumumab)。在一个实施方案中,抗EGFR1抗体是西妥昔单抗。在一个实施方案中,西妥昔单抗具有SEQIDNO:2和3中所述的序列。在一个实施方案中,西妥昔单抗包含在SEQIDNO:2和3中所述的序列或由其组成。在一个实施方案中,抗EGFR1抗体是尼妥珠单抗。在一个实施方案中,尼妥珠单抗具有SEQIDNO:4和5中所述的序列。在一个实施方案中,尼妥珠单抗包含在SEQIDNO:4和5中所述的序列或由其组成。抗EGFR1抗体可以是例如scFv、单结构域抗体、Fv、VHH抗体、双体抗体(diabody)、串联双体抗体(diabody)、Fab、Fab’、F(ab’)2、Db、dAb-Fc、taFv、scDb、dAb2、DVD-Ig、Bs(scFv)4-IgG、taFv-Fc、scFv-Fc-scFv、Db-Fc、scDb-Fc、scDb-CH3或dAb-Fc-dAb。另外,抗EGFR1抗体或其EGFR1结合片段可以按单价单特异性、多价单特异性、双价单特异性、或多价多特异性形式存在。在一个实施方案中,抗EGFR1抗体是人抗体或人源化抗体。在这种情况下,术语“人抗体”,如它在本领域中常用那样,将理解为意指具有其中构架区和互补决定区(CDR)均从人源序列衍生的可变区的抗体。在这种情况下,术语“人源化抗体”,如它在本领域中常用那样,将理解为意指抗体中来自人源抗体的CDR的残基由来自具有所需特异性、亲和力和能力的非人类物种(例如小鼠、大鼠或兔)CDR的残基替换。在一个实施方案中,抗EGFR1抗体片段包含西妥昔单抗的Fab片段。在一个实施方案中,抗EGFR1Fab片段具有SEQIDNO:6和3中所述的序列。在一个实施方案中,抗EGFR1Fab片段包含在SEQIDNO:6和3中所述的序列或由其组成。在一个实施方案中,抗EGFR1抗体包含西妥昔单抗的F(ab’)2片段。在一个实施方案中,抗EGFR1F(ab’)2片段具有SEQIDNO:7和3中所述的序列。在一个实施方案中,抗EGFR1F(ab’)2片段包含在SEQIDNO:7和3中所述的序列或由其组成。“葡聚糖”应当理解为指包含长度不同的链的支链葡聚糖,其中直链由D-吡喃葡萄糖基单元之间的α-1,6糖苷键组成。分支借助α-1,3糖苷键并且更低程度地借助α-1,2和/或α-1,4糖苷键结合。葡聚糖分子的直链的一部分在以下示意图中描述。“D-吡喃葡萄糖基单元”应当理解为指单个D-吡喃葡萄糖基分子。葡聚糖因此包含多个D-吡喃葡萄糖基单元。在葡聚糖中,每个D-吡喃葡萄糖基单元借助α-1,6糖苷键、借助α-1,3糖苷键或借助这两种键与至少一个其他D-吡喃葡萄糖基单元连接。葡聚糖的每个D-吡喃葡萄糖基单元包含6个碳原子,它们在以下示意图中编号为1至6。示意图显示借助α-1,6糖苷键与两个其他D-吡喃葡萄糖基单元(未显示)结合的单个D-吡喃葡萄糖基单元。碳2、3和4可以含有自由羟基。在借助α-1,3糖苷键与第二D-吡喃葡萄糖基单元结合的D-吡喃葡萄糖基单元中,在D-吡喃葡萄糖基单元的碳3借助醚键与第二D-吡喃葡萄糖基单元的碳1结合的情况下,碳2和4可以由自由羟基取代。在借助α-1,2或α-1,4糖苷键与第二D-吡喃葡萄糖基单元结合的D-吡喃葡萄糖基单元中,在D-吡喃葡萄糖基单元的碳2或4借助醚键与第二D-吡喃葡萄糖基单元的碳1结合的情况下,碳3和4或2和3分别可以由自由羟基取代。糖命名基本上依据IUPAC-IUB生物化学命名委员会的建议进行(例如CarbohydrateRes.1998,312,167;CarbohydrateRes.1997,297,1;Eur.J.Biochem.1998,257,293)。术语“葡聚糖衍生物”应当理解为指葡聚糖,其中选自至少一个D-吡喃葡萄糖基单元的碳2、3或4中的至少一个碳是由下式的取代基取代:-O-(CH2)n-S-B12H112-,其中n处于3至10范围内;并且葡聚糖衍生物借助由至少一个醛基和抗EGFR1抗体或其EGFR1结合片段的氨基之间反应形成的键而与抗EGFR抗体或其EGFR1结合片段结合,所述至少一个醛基通过氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元而形成。葡聚糖衍生物还可以含有对基本葡聚糖结构的其他修饰,例如,如下文描述。“BSH”、“B12H11-SH”和“Na2B12H11SH”应当理解为指硼卡钠(sodiumborocaptate),又称作巯基十二硼酸钠和硫氢基硼烷。“B12H112-”因此指BSH的硼烷部分。选自至少一个D-吡喃葡萄糖基单元的碳2、3和4中的一个或多个,即一个、两个或三个碳可以由式-O-(CH2)n-S-B12H112-的取代基取代。在一个实施方案中,n是3、4、5、6、7、8、9或10。在一个实施方案中,n处于3至4的范围内、或处于3至5的范围内、或处于3至6的范围内、或处于3至7的范围内、或处于3至8的范围内、或处于3至9的范围内。可以通过氧化性切割羟基取代的两个毗邻碳之间的键,切割葡聚糖的D-吡喃葡萄糖基单元。氧化性切割作用切割邻位二醇,即其中两个(自由)羟基占据邻位位置的D-吡喃葡萄糖基单元。其中碳2、3和4含有自由羟基的D-吡喃葡萄糖基单元可以因此在碳2和3或碳3和4之间遭氧化切割。因此可以是氧化切割选自碳2和3之间键和碳3和4之间键的键。可以使用氧化剂例如高碘酸钠、高碘酸和乙酸铅(IV)或能够氧化切割邻位二醇的任何其他氧化剂,通过氧化性切割作用切割葡聚糖的D-吡喃葡萄糖基单元。D-吡喃葡萄糖基单元的氧化性切割形成两个醛基,在通过氧化性切割作用形成的链的每个末端处一个醛基。在缀合物中,醛基可以原则上是自由醛基。然而,一般不希望缀合物中存在自由醛基。因此,自由醛基可以封端(cap)或与抗EGFR1抗体或其EGFR1结合片段的氨基或例如与示踪分子反应。葡聚糖衍生物借助由至少一个醛基和抗EGFR1抗体或其EGFR1结合片段的氨基之间反应形成的键而与抗EGFR抗体或其EGFR1结合片段结合,所述至少一个醛基通过氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元而形成。葡聚糖衍生物也可以借助由至少一个醛基和抗EGFR1抗体或其EGFR1结合片段的氨基之间反应形成的基团与抗EGFR1抗体或其EGFR1结合片段结合,所述至少一个醛基通过氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元而形成。由氧化性切割形成的醛基轻易地与氨基在溶液例如水溶液中反应。然而,所得到的基团或形成的键可能变动并且不总是轻易地预测和/或表征。在氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元所形成的至少一个醛基和抗EGFR1抗体或其EGFR1结合片段的氨基之间的反应可以例如导致西夫碱形成。因此,葡聚糖衍生物藉此与抗EGFR1抗体或其EGFR1结合片段结合的基团可以例如是西夫碱(亚胺)或还原型西夫碱(仲胺)。在一个实施方案中,葡聚糖衍生物具有约3至约2000kDa范围内的分子质量。在这种情况下,葡聚糖衍生物的分子质量应当理解为包括含有葡聚糖和其取代基的葡聚糖衍生物的分子质量,但不是抗EGFR1抗体或其EGFR1结合片段的分子质量。在一个实施方案中,葡聚糖衍生物具有30至约300kDa范围内的分子质量。在一个实施方案中,缀合物包含约10至约300个或约20至约150个式-O-(CH2)n-S-B12H112-的取代基。在一个实施方案中,缀合物包含约300个硼原子(300B)、约800个硼原子(800B)、约900个硼原子(900B)、或约1200个硼原子。例如,“900B”指每一摩尔蛋白质携带一摩尔葡聚糖的缀合物,其在BSH分子中携带约900摩尔硼原子。抗EGFR1抗体或其EGFR1结合片段一般含有至少一个氨基,例如N末端胺基和/或赖氨酸残基的氨基。在一个实施方案中,抗EGFR1抗体或其EGFR1结合片段的氨基是抗EGFR1抗体或其EGFR1结合片段的赖氨酸残基的氨基。在一个实施方案中,缀合物还包含与葡聚糖衍生物或与抗EGFR1抗体或其EGFR1结合片段结合的至少一个示踪分子。“示踪分子”指可检测的分子。这种可检测的分子可以例如是放射性同位素(例如14C)、包含放射性同位素的化合物、放射性核素、包含放射性核素的化合物、荧光标记物分子(例如FITC、TRITC、Alexa和Cy染料等)、螯合剂,例如DOTA(1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸)、或MRI活性分子,例如钆-DTPA(钆-五乙酸二亚乙基三胺)。实现示踪分子与葡聚糖衍生物或与抗EGFR1抗体或其EGFR1结合片段结合的方法是本领域熟知的。示踪分子可以允许在缀合物已经施用至患者并导引至特定细胞后对其定位;以这种方式,可以将低能量热中子照射指向所导引的缀合物的位置。在一个实施方案中,示踪分子借助键或基团与葡聚糖衍生物结合,所述键或基团由氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元所形成的至少一个醛基和示踪分子的基团之间的反应形成。示踪分子的合适基团可以例如是氨基。氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元所形成的一个或多个醛基可能不与抗EGFR1抗体或其EGFR1结合片段的氨基或不与示踪分子反应。在一个实施方案中,葡聚糖衍生物包含由氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元所形成的被封端的至少一个醛基。所述至少一个醛基可以借助合适基团例如还原型西夫碱并封端。所述至少一个醛基也可以借助至少一个醛基和亲水封端剂例如乙醇胺、赖氨酸、甘氨酸或Tris之间的反应所形成的基团而被封端。在一个实施方案中,乙醇胺包含14C。封端过程可以使用还原剂,例如NaCNBH3稳定化。可以因此形成封端基团例如还原型西夫碱。在一个实施方案中,葡聚糖衍生物包含由氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元所形成的至少一个醛基,所述醛基不与抗EGFR1抗体或其EGFR1结合片段的氨基或不与示踪分子反应并且是被封端的。在一个实施方案中,由氧化性切割葡聚糖衍生物的一个或多个D-吡喃葡萄糖基单元形成的醛基基本上全部都被封端的。在一个实施方案中,葡聚糖衍生物包含由氧化性切割葡聚糖衍生物的D-吡喃葡萄糖基单元所形成的多个醛基,其中由氧化性切割葡聚糖衍生物的一个或多个D-吡喃葡萄糖基单元形成的醛基基本上全部都被封端。在一个实施方案中,选自葡聚糖衍生物的至少一个D-吡喃葡萄糖基单元的碳2、3或4中的至少一个碳由下式的取代基取代:-O-(CH2)mCH=CH2,其中m处于1至8的范围内。尽管这种实施方案一般不合乎需要,但是当所述取代基尚未与BSH反应时,它可以作为副产物出现。在一个实施方案中,缀合物是通过包括以下步骤的方法可获得的:a)链烯基化葡聚糖的至少一个羟基以获得链烯基化葡聚糖;b)硼卡钠(BSH)与从a)步骤可获得的链烯基化葡聚糖反应以获得BSH-葡聚糖;c)氧化切割BSH-葡聚糖的至少一个D-吡喃葡萄糖基残基,从而形成醛基;d)从c)步骤可获得的氧化切割的BSH-葡聚糖与抗EGFR1抗体或其EGFR1结合片段反应以获得缀合物。本发明还涉及通过包括以下步骤的方法可获得的缀合物:a)链烯基化葡聚糖的至少一个羟基以获得链烯基化葡聚糖;b)硼卡钠(BSH)与从a)步骤可获得的链烯基化葡聚糖反应以获得BSH-葡聚糖;c)氧化切割BSH-葡聚糖的至少一个D-吡喃葡萄糖基残基,从而形成醛基;d)从c)步骤可获得的氧化切割的BSH-葡聚糖与抗EGFR1抗体或其EGFR1结合片段反应以获得缀合物。在一个实施方案中,葡聚糖具有处于约3至约2000kDa、或约10至约100kDa、或约5至约200kDa、或约10至约250kDa范围内的分子质量。具有所述范围内分子质量的葡聚糖应当理解为指未经历步骤a)-d)的葡聚糖。在这种情况下,术语“链烯基化”或“链烯基化”应当理解为指链烯基转移至葡聚糖的D-吡喃葡萄糖基单元以产生链烯基醚。也就是说,葡聚糖的D-吡喃葡萄糖基单元至少一个羟基变成链烯氧基。在步骤a)中,与至少一个葡聚糖的D-吡喃葡萄糖基单元的碳2、3或4结合的一个或多个羟基可以在链烯基化反应中反应。葡聚糖的一个或多个或多重D-吡喃葡萄糖基单元可以链烯基化。在一个实施方案中,使用链烯基化剂,使葡聚糖在步骤a)中链烯基化,其中链烯基化剂具有下式的结构:X-(CH2)mCH=CH2,其中m处于1至8的范围内,并且X是Br、Cl或I。在一个实施方案中,m是1、2、3、4、5、6、7或8。在一个实施方案中,m处于1至2的范围内、或处于1至3的范围内、或处于1至4的范围内、或处于1至5的范围内、或处于1至6的范围内、或处于1至7的范围内。在一个实施方案中,链烯基化剂是烯丙基溴。在一个实施方案中,选自从a)步骤可获得的链烯基化葡聚糖的至少一个D-吡喃葡萄糖基单元的碳2、3或4中的至少一个碳由下式的取代基取代-O-(CH2)mCH=CH2,其中m处于1至8的范围内。在一个实施方案中,m是1、2、3、4、5、6、7或8。在一个实施方案中,m处于1至2的范围内、或处于1至3的范围内、或处于1至4的范围内、或处于1至5的范围内、或处于1至6的范围内、或处于1至7的范围内。在步骤b)中,BSH的硫氢基可以与链烯基化葡聚糖的链烯基反应以形成BSH-葡聚糖,从而产生硫醚。一个或多个BSH分子可以与链烯基化葡聚糖反应。因此,从步骤b)可获得的BSH-葡聚糖可以含有多个BSH部分(即,式-S-B12H112-的基团)。BSH的硫氢基可以与含有多于一个链烯基的单个链烯基化D-吡喃葡萄糖基单元的链烯基或与两个或更多个链烯基化D-吡喃葡萄糖基单元的链烯基反应。因此,从步骤b)可获得的BSH-葡聚糖可以是这样的葡聚糖衍生物,其中选自至少一个D-吡喃葡萄糖基单元的碳2、3或4中的至少一个碳由下式的取代基取代:-O-(CH2)n-S-B12H112-,其中n处于3至10范围内。在一个实施方案中,从步骤b)可获得的BSH-葡聚糖包含约10至约100个或约20至100个式-O-(CH2)n-S-B12H112-的取代基或约10至约300个或约20至约150个前述取代基,其中n处于3至10范围内。在一个实施方案中,BSH与从a)步骤可获得的链烯基化葡聚糖在自由基引发物存在下在步骤b)中反应。自由基引发物能够催化BSH的硫氢基与链烯基化葡聚糖的链烯基之间的反应。在这种情况下,“自由基引发物”应当理解为指能够在温和条件下产生自由基种类并促进自由基反应的化学物质。术语“自由基引发物”还可以指UV(紫外)线。紫外线照射能够产生自由基,例如在合适的光引发物存在下。合适的自由基引发物包括但不限于无机过氧化物例如过硫酸铵或过二硫酸钾、有机过氧化物和紫外线。在一个实施方案中,BSH与从a)步骤可获得的链烯基化葡聚糖在选自过硫酸铵、过二硫酸钾和紫外线的自由基引发物存在下在步骤b)中反应。在步骤b)中,可以适当地选择BSH对从步骤a)可获得的链烯基化葡聚糖的重量比或摩尔比,从而获得其中每个(葡聚糖衍生物的)葡聚糖部分的BSH部分的数目(即式-O-(CH2)n-S-B12H112-取代基的数目)变动的缀合物。BSH-葡聚糖的每个葡聚糖部分的BSH部分数目可以例如通过实施例2中所述的核磁共振或通过实施例9中所述的电感耦合等离子体质谱法(ICP-MS)测量。在一个实施方案中,步骤b)存在的BSH对链烯基化葡聚糖的比率处于1:5至2:1的范围内、或以重量计处于1:4至1:1的范围内、或以重量计处于1:2至3:4的范围内。一般,BSH对链烯基化葡聚糖的比率越高,BSH-葡聚糖的每个葡聚糖部分的BSH部分数目越大。也可以变动步骤b)中自由基引发物(例如过硫酸铵或过二硫酸钾)的比率。在一个实施方案中,步骤b)存在的自由基引发物对BSH和/或对葡聚糖的比率处于1:5至2:1的范围内、或以重量计处于1:4至1:1的范围内、或以重量计处于1:2至3:4的范围内。在一个实施方案中,步骤b)存在的自由基引发物对链烯基化葡聚糖的比率处于1:5至2:1的范围内、或以重量计处于1:4至1:1的范围内、或以重量计处于1:2至3:4的范围内。如上文所述,可以在步骤c)中氧化切割选自碳2和3之间键和碳3和4之间键的键。在氧化性切割中,D-吡喃葡萄糖基环在邻位二醇之间打开,留下两个醛基。从步骤c)可获得的氧化切割的BSH-葡聚糖的醛基可以与抗EGFR1抗体或其EGFR1结合片段反应以获得缀合物。醛基可以与合适的基团例如氨基反应。原则上可以使用能够在自由羟基取代的两个邻位碳之间氧化切割D-吡喃葡萄糖基单元的任何氧化剂,氧化切割BSH-葡聚糖的至少一个D-吡喃葡萄糖基残基。氧化剂也可以如此选择,从而它基本上特异性氧化切割BSH-葡聚糖的至少一个D-吡喃葡萄糖基残基。这种氧化剂可以不氧化BSH-葡聚糖的其他基团或部分。在一个实施方案中,将BSH-葡聚糖的至少一个D-吡喃葡萄糖基残基在步骤c)中使用选自高碘酸钠、高碘酸和乙酸铅(IV)的氧化剂氧化切割。在一个实施方案中,将BSH-葡聚糖的至少一个D-吡喃葡萄糖基残基在步骤c)中于水溶液中氧化切割。在一个实施方案中,该方法还包括步骤:从步骤c)可获得的氧化切割的BSH-葡聚糖或从步骤d)可获得的缀合物与示踪分子反应。在这种情况下,示踪分子可以是本文件中描述的任何示踪分子。示踪分子可以与从步骤c)可获得的氧化切割的BSH-葡聚糖的至少一个醛基反应。可以与至少一个醛基反应的示踪分子的合适基团可以例如是氨基。在一个实施方案中,该方法还包括步骤e):将从步骤c)可获得的氧化切割的BSH-葡聚糖或从步骤d)可获得的缀合物的未反应的醛基封端。在一个实施方案中,未反应的醛基使用亲水封端剂例如乙醇胺、赖氨酸、甘氨酸或Tris封端。在一个实施方案中,亲水封端剂是选自乙醇胺、赖氨酸、甘氨酸和Tris。在一个实施方案中,包含14C的乙醇胺是示踪分子。在一个实施方案中,选自步骤a)、b)、c)和d)的一个或多个步骤在水溶液中进行。合适的水溶液可以例如是pH约6至8的含水磷酸盐缓冲液。在一个实施方案中,步骤a)-d)全部都在水溶液中进行。抗EGFR1抗体或其EGFR1结合片段一般含有至少一个氨基,例如N末端胺基和/或赖氨酸残基的氨基。在步骤d)中,从步骤c)可获得的氧化切割的BSH-葡聚糖的醛基因此可以与抗EGFR1抗体或其EGFR1结合片段的至少一个氨基反应。在一个实施方案中,抗EGFR1抗体或其EGFR1结合片段的氨基是抗EGFR1抗体或其EGFR1结合片段的赖氨酸残基的氨基。在一个实施方案中,通过将氧化切割的BSH-葡聚糖和抗EGFR1抗体或其EGFR1结合片段在步骤d)中在室温于具有约6至8pH的磷酸盐缓冲水溶液中温育,使氧化切割的BSH-葡聚糖与抗EGFR1抗体或其EGFR1结合片段反应。缀合物可以例如通过凝胶过滤纯化,例如如实施例4中所述。本发明还涉及在原核宿主细胞中产生抗EGFR1抗体或其EGFR1结合片段。与其他多肽生产系统相比,细菌,尤其大肠杆菌,提供许多独特的优点。所用的原料(即细菌细胞)价廉并易于生长,因此降低产品成本。原核宿主比例如哺乳动物细胞生长快得多,从而允许更迅速的遗传操作分析。代次时间较短和易于放大也使细菌发酵成为更有吸引力的大量产生蛋白质的手段。已经深入研究许多细菌物种(包括大肠杆菌)的基因组结构和生物学活性并且可获得多种合适载体,这使得表达合乎需要的抗体更便利。原核系统中的抗体或抗体片段表达可以按不同规模实施。摇瓶培养(在2-5升范围)一般产生少于5mg/升的产物(例如抗体片段),而发酵系统中可以获得50-300mg/升规模。另外,原核宿主细胞可以产生无糖基化的抗EGFR抗体或其EGFR1结合片段。在一个实施方案中,原核宿主细胞包含一种或多种多核苷酸,所述多核苷酸编码抗EGFR1抗体或其EGFR1结合片段的i)轻链可变区和ii)重链可变区。术语“一个或多个多核苷酸”可以指可以或可以不直接共价连接或借助一个或多个序列间接共价连接的两种或更多个多核苷酸或多核苷酸分子。例如,两个或更多个多核苷酸可以包含于表达盒或载体中。作为一个例子,两个或更多个多核苷酸可以直接或间接地融合,从而编码包含轻链可变区和重链可变区的融合蛋白。它们也可以包含于两个独立的表达盒或载体中。术语“一个或多个多核苷酸”还可以指单个连续多核苷酸分子,其包含编码抗EGFR1抗体或其EGFR1结合片段的轻链可变区和重链可变区的一种或多种多核苷酸或多核苷酸片段。在一个实施方案中,宿主细胞包含根据本说明书中描述的一个或多个实施方案的编码抗EGFR1抗体或其EGFR1结合片段的多核苷酸。宿主细胞可以包含共同编码抗EGFR1抗体或EGFR1结合片段的一个或多个多核苷酸。载体可以是任何类型,例如,重组载体如表达载体。可以使用多种原核宿主细胞的任一种。在一个实施方案中,原核宿主细胞是大肠杆菌细胞。在一个实施方案中,编码轻链可变区和重链可变区的一条或多条多核苷酸是针对宿主细胞(例如大肠杆菌细胞)进行密码子优化的。在一个实施方案中,宿主细胞包含编码抗EGFR1抗体或其EGFR1结合片段的轻链可变区和重链可变区的单条连续多核苷酸。这种连续的多核苷酸可以是双顺反子的或多顺反子的。在一个实施方案中,原核宿主细胞包含编码抗EGFR1抗体或其EGFR1结合片段的轻链可变区的多核苷酸和编码抗EGFR1抗体或其EGFR1结合片段的重链可变区的另一个多核苷酸。在一个实施方案中,轻链可变区前有信号肽。多核苷酸因此编码前置于轻链可变区的信号肽和轻链可变区。信号肽可以紧邻轻链可变区前置,或可以在信号肽和轻链可变区之间存在序列片段。信号肽可以选自gIII、malE、phoA、ompA、pelB、stII和stII。信号肽也可以选自ompA、pelB、stII和stII。这些信号肽可以允许在原核宿主细胞(例如大肠杆菌)中产生产率特别高的抗体或片段。在一个实施方案中,重链可变区前有信号肽。信号肽可以选自gIII、malE、phoA、ompA、pelB、stII和stII。信号肽也可以选自ompA、pelB、stII、和stII。在一个实施方案中,轻链可变区和重链可变区前置有信号肽。在一个实施方案中,前置于轻链可变区的信号肽不同于前置于重链可变区的信号肽。在一个实施方案中,前置于轻链可变区和重链可变区的信号肽独立地选自gIII、malE、phoA、ompA、pelB、stII和stII。在一个实施方案中,前置于轻链可变区和重链可变区的信号肽独立地选自mpA、pelB、stII和stII。在一个实施方案中,前置于轻链可变区的信号肽与前置于重链可变区的信号肽相同,并且其中信号肽选自gIII、malE、phoA、ompA、pelB、stII和stII。在一个实施方案中,前置于轻链可变区的信号肽与前置于重链可变区的信号肽相同,并且其中信号肽选自ompA、pelB、stII和stII。在一个实施方案中,轻链可变区前置有pelB信号肽并且重链可变区前置有ompA信号肽。在一个实施方案中,轻链可变区和重链可变区均前置有stII信号肽。在一个实施方案中,多核苷酸包含在SEQIDNO:8中所述的序列和SEQIDNO:9中所述的序列或由其组成。在一个实施方案中,编码轻链可变区的多核苷酸包含在SEQIDNO:8或与SEQIDNO:8至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列,以及在SEQIDNO:9或与SEQIDNO:9至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列,或由其组成。在一个实施方案中,编码轻链可变区的多核苷酸包含在SEQIDNO:8中所述的序列或由其组成并且编码重链可变区的多核苷酸包含SEQIDNO:9中所述的序列或由其组成。在一个实施方案中,编码轻链可变区的多核苷酸包含在SEQIDNO:8或与SEQIDNO:8至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成,并且编码重链可变区的多核苷酸包含在SEQIDNO:9或与SEQIDNO:9至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,原核宿主细胞包含一种或多种多核苷酸,所述多核苷酸编码抗体的抗EGFR1结合片段的i)轻链和ii)重链。在一个实施方案中,所述一个或多个多核苷酸编码的抗EGFR1结合片段Fab或scFv。在一个实施方案中,编码轻链的多核苷酸包含在SEQIDNO:10中所述的序列或由其组成,并且编码重链序列的多核苷酸包含SEQIDNO:11中所述的序列或由其组成。在一个实施方案中,编码轻链的多核苷酸包含在SEQIDNO:10或与SEQIDNO:10至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成,并且编码重链序列的多核苷酸包含在SEQIDNO:11或与SEQIDNO:11至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,一条或多条多核苷酸包含在SEQIDNO:10中所述的轻链序列和SEQIDNO:11中所述的重链序列,或由其组成。在一个实施方案中,一条或多条多核苷酸包含在SEQIDNO:10或与SEQIDNO:10至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的轻链序列,以及在SEQIDNO:11或与SEQIDNO:11至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的重链序列,或由其组成。在一个实施方案中,宿主细胞包含多核苷酸,所述多核苷酸包含在SEQIDNO:12或与SEQIDNO:12至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,宿主细胞包含多核苷酸,所述多核苷酸包含在SEQIDNO:13或与SEQIDNO:13至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,宿主细胞包含伴侣蛋白和/或编码伴侣蛋白的一条或多条多核苷酸。伴侣蛋白可以是原核伴侣蛋白,例如Dsb蛋白(DsbA、DsbB、DsbC、DsbD、FkpA和/或DsbG)。在一个实施方案中,伴侣蛋白在宿主细胞中过量表达。在一个实施方案中,伴侣蛋白是DsbA和/或DsbC。在一个实施方案中,伴侣蛋白选自DnaK、DnaJ、GrpE、Skp、FkpA、GroEL和GroES。在一个实施方案中,伴侣蛋白是Skp。如本文所用的术语“原核宿主细胞”意在指通过引入外源多核苷酸(例如重组质粒或载体)已经发生遗传改变或能够发生遗传改变的原核细胞。应当理解这类术语不仅意指具体的目标细胞,还意指这种细胞的子代。因为某些修饰可以因突变或环境影响而出现于后续世代中,所以这类子代实际上可以与亲代细胞不完全相同,但仍包含于如本文中所用的术语“原核宿主细胞”的范围内。将原核宿主细胞用(例如,在表达载体或克隆载体中的)编码抗EGFR1抗体或其EGFR1结合片段的上述多核苷酸转化并且在常规营养培养基中培养,如果适宜,调整所述常规营养培养基以诱导启动子、选择转化体或扩增编码所需抗体或抗体片段序列的基因。适合随原核宿主一起使用的启动子包括PhoA启动子、β-内酰胺酶和乳糖启动子系统、色氨酸(trp)启动子系统和杂合启动子例如tac或trc启动子。然而,在细菌(例如其他已知细菌)中有功能的其他启动子也合适。它们的核苷酸序列已经公开,因而使得技术人员能够利用提供任何所需限制性位点的接头或衔接子可操作地将它们连接至编码目标轻链和重链(Siebenlist等人,(1980)Cell20:269)的顺反子。在一个实施方案中,所述一个或多个多核苷酸受独立选自T7、T5和Rham的启动子驱动,即与之有效连接。在一个实施方案中,所述一个或多个多核苷酸受启动子T7驱动。用来产生抗EGFR1抗体或其EGFR1结合片段的原核宿主细胞可以通常如“MolecularCloning”laboratorymanual(MichaelGreen和JosephSambrook;第4版;ColdSpringHarbourLaboratoryPress;2012)中所述那样培养。适于表达本发明抗体的原核宿主细胞包括古细菌和真细菌,例如革兰氏阴性或革兰氏阳性生物。可用细菌的例子包括埃希氏菌(Escherichia)(例如,大肠杆菌)、芽孢杆菌(Bacilli)(例如,枯草芽孢杆菌(B.subtilis))、肠杆菌(Enterobacter)、假单胞菌属物种(例如,铜绿假单胞菌(P.aeruginosa))、鼠伤寒沙门氏菌(Salmonellatyphimurium)、粘质沙雷氏菌(Serratiamarcescans)、克雷伯氏菌(Klebsiella)、变形菌(Proteus)、志贺氏菌(Shigella)、根瘤菌(Rhizobia)、透明颤菌(Vitreoscilla)或副球菌属(Paracoccus)。在一个实施方案中,使用革兰氏阴性细胞。在一个实施方案中,使用大肠杆菌细胞作为本发明的宿主。大肠杆菌菌株的例子包括菌株W3110(Bachmann,CellularandMolecularBiology,第2卷(Washington,D.C.:AmericanSocietyforMicrobiology,1987)第1190-1219页;ATCC保藏编号27,325)及其衍生物,包括具有基因型W3110ΔfhuA(ΔtonA)ptr3lacIqlacL8ΔompTΔ(nmpc-fepE)degP41kanR的菌株33D3(美国专利号5,639,635)和菌株63C1和64B4。其他菌株及其衍生物,例如大肠杆菌294(ATCC31,446)、大肠杆菌B、大肠杆菌1776(ATCC31,537)和大肠杆菌RV308(ATCC31,608)也是合适的。这些例子是示意性的而非限制性的。通常可能需要考虑复制子在细菌细胞中的复制能力,选择适宜的细菌。例如,当熟知的质粒例如pBR322、pBR325、pACYC177或pKN410用来供应复制子时,可以适当地使用大肠杆菌物种作为宿主。一般,宿主细胞可能分泌最小量的蛋白水解酶,可以合乎需要地向细胞培养物掺入额外的蛋白酶抑制剂。在一个实施方案中,宿主细胞缺少一种或多种蛋白水解酶。在一个实施方案中,蛋白水解酶选自蛋白酶III、OmpT、DegP、Tsp、蛋白酶I、蛋白酶Mi、蛋白酶V、蛋白酶VI和Lon。在转化后,将用来产生抗EGFR1抗体或其EGFR1结合片段的原核细胞在本领域已知并适于培养所选择宿主细胞的培养基中培养。合适的培养基的例子包括Luria培养液(L)、Terrific培养液(TB)和合成性极限培养基加养分补充物例如酵母提取物、大豆水解物和其他植物水解物。在一些实施方案中,培养基还含有基于表达载体构建过程选择的选择剂,以选择性地允许含有表达载体的原核细胞生长。例如,添加氨苄青霉素至培养表达氨苄青霉素耐药性基因的细胞的培养基。也可以按适宜浓度纳入除碳源、氮源和无机磷酸盐源之外的任何必需补充物,所述补充物单独或作为与另一个补充物或培养基例如复杂氮源的混合物而引入。任选地,培养基可以含有选自谷胱甘肽、半胱氨酸、胱胺、硫乙醇酸盐、二硫代赤藓醇和二硫苏糖醇的一种或多种还原剂。在合适的温度培养原核宿主细胞。例如,对于大肠杆菌生长,优选的温度范围从约20℃至约39℃。培养基的pH可以是范围从约5至约9的任何pH,主要取决于宿主生物。对于大肠杆菌,pH优选地是从约6.8至约7.4,并且更优选地是约7.0。如果表达载体中使用诱导型启动子,则在适于激活该启动子的条件下诱导抗EGFR1抗体或EGFR1结合片段蛋白质表达。在一个实施方案中,抗EGFR1抗体或其EGFR1结合片段被分泌入原核宿主细胞的周质并从中回收。蛋白质回收一般包括通常通过诸如渗透冲击、超声处理或溶胞作用的方式破坏微生物。一旦破坏细胞,可以通过离心或过滤移除细胞残片或完整细胞。可以进一步纯化蛋白质,例如,通过适于纯化Fab片段的亲和树脂色谱或蛋白L柱纯化。备选地,蛋白质可以被转运至培养基中并在其中分离。细胞可以从培养物移除并且过滤并浓缩培养上清液以进一步纯化产生的蛋白质。表达的多肽可以使用公知方法例如聚丙烯酰胺凝胶电泳(PAGE)和蛋白质印迹测定法进一步分离和鉴定。在本发明的一个方面,通过发酵方法大量产生抗EGFR1抗体或EGFR1结合片段。多种大规模补料分批发酵法可用于产生重组蛋白。大规模发酵具有至少500升容量。这些发酵罐使用搅拌器叶轮以分布氧气和养分、尤其葡萄糖(优选的碳源/能量源)。小规模发酵通常指在体积容量不超过大约100升的发酵罐中的发酵并且可以是从约1升至约100升。在发酵方法中,一般在细胞已经在合适条件下培养至的期望的密度(例如,OD550约180-220)后,启动蛋白质表达的诱导,在此阶段细胞处于早期静止期。如本领域已知和上文描述,可以根据使用的载体构建体,使用多种诱导物。可以将细胞在诱导之前培养较短时间。通常诱导细胞约12-50小时,不过可以使用较长或较短的诱导时间。为了改善抗EGFR1抗体或EGFR1结合片段的产生率和质量,可以调节各种发酵条件。例如,为了改善分泌的抗体多肽的正确装配和折叠,可以使用过量表达伴侣蛋白,例如Dsb蛋白(DsbA、DsbB、DsbC、DsbD、和/或DsbG)、Skp或FkpA(具有伴侣蛋白活性的肽酰基脯氨酰顺,反-异构酶)的额外载体用来共转化宿主原核细胞。已经证明伴侣蛋白促进细菌宿主细胞产生的异源蛋白的正确折叠和溶解。Chen等人,(1999)J.Biol.Chem.274:19601-19605;Georgiou等人,美国专利号6,083,715;Georgiou等人,美国专利号6,027,888;Bothmann和Pluckthun(2000)J.Biol.Chem.275:17100-17105;Ramm和Pluckthun,(2000)J.Biol.Chem.275:17106-17113;Arie等人,(2001)Mol.Microbiol.39:199-210。在一个实施方案中,伴侣蛋白例如DnaK/DnaJ/GrpE、Skp、Skp/FkpA、GroEL/GroE在细菌宿主细胞例如大肠杆菌中表达。为了最大限度减少表达的抗EGFR1抗体或其EGFR1结合片段(尤其蛋白酶解敏感的那些)的蛋白酶解,可以使用缺乏蛋白水解酶的某些宿主菌株。例如,可以修饰宿主细胞菌株,以在编码已知细菌蛋白酶(例如蛋白酶III、OmpT、DegP、Tsp、蛋白酶I、蛋白酶Mi、蛋白酶V、蛋白酶VI及其组合)的基因中实现遗传突变。一些缺少蛋白酶的大肠杆菌菌株是可获得的并且在,例如,Joly等人,(1998)、上文;Georgiou等人,美国专利号5,264,365;Georgiou等人,美国专利号5,508,192;Hara等人,MicrobialDrugResistance,2:63-72(1996)中描述。在一个实施方案中,使用缺乏蛋白水解酶并用过量表达一种或多种伴侣蛋白的质粒转化的大肠杆菌菌株作为本发明表达系统中的宿主细胞。抗EGFR1抗体或其EGFR1结合片段的纯化可以使用本领域认可的方法实现。以下方法是合适纯化方法的示例:在亲和色谱柱或离子交换柱上分级、乙醇沉淀、反相HPLC、硅胶或阳离子树脂(例如DEAE)上色谱、聚焦色谱、SDS-PAGE、硫酸铵沉淀和例如使用SephadexG-75的凝胶过滤。在一个实施方案中,固相上固定的蛋白A用于抗EGFR1抗体的免疫亲和纯化。在一个实施方案中,固相上固定的蛋白L用于本发明抗EGFR1抗体片段的免疫亲和纯化。作为纯化的第一步骤,将源自如上文所述的细胞培养物的制备物施加到蛋白A或蛋白L固定的固相上,以允许抗EGFR1抗体与蛋白A或者抗EGFR1抗体片段(例如Fab片段)与蛋白L特异性结合。随后洗涤该固相以除去与固相非特异性结合的杂质。最后,通过洗脱从固相回收抗体或抗体片段。在一个实施方案中,轻链可变区前置有pelB信号肽并且重链可变区前置有ompA信号肽,宿主细胞包含伴侣蛋白Skp和/或编码伴侣蛋白Skp的多核苷酸;并且宿主细胞缺少蛋白水解酶Lon和OmpT。在一个实施方案中,轻链可变区和重链可变区前置有stII信号肽,宿主细胞包含伴侣蛋白Skp和/或编码伴侣蛋白Skp的多核苷酸;并且宿主细胞缺少蛋白水解酶Lon和OmpT。还公开了多核苷酸,编码抗EGFR1抗体或其EGFR1结合片段的i)轻链可变区和ii)重链可变区。在这种情况下,术语“多核苷酸”可以指可以直接共价连接或可以借助一个或多个序列间接共价连接的一种、两种或更多种多核苷酸或多核苷酸分子。例如,两种或更多种多核苷酸可以包含于表达盒或载体中。作为一个例子,两个或更多个多核苷酸可以直接或间接地融合,从而编码包含轻链可变区和重链可变区的融合蛋白。它们也可以包含于两个独立的表达盒或载体中。术语“多核苷酸”还可以指单一连续多核苷酸分子,其包含编码轻链可变区和重链可变区的一个或多个多核苷酸或多核苷酸片段。该多核苷酸可以是双顺反子的或多顺反子的。在一个实施方案中,编码轻链可变区和重链可变区的一个或多个多核苷酸针对宿主细胞进行密码子优化。宿主细胞可以是原核细胞,例如大肠杆菌细胞。在一个实施方案中,编码轻链可变区的多核苷酸包含在SEQIDNO:8或与SEQIDNO:8至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,编码重链可变区的多核苷酸包含在SEQIDNO:9或与SEQIDNO:9至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,编码轻链可变区的多核苷酸包含在SEQIDNO:8中所述的序列或由其组成并且编码重链可变区的多核苷酸包含SEQIDNO:9中所述的序列或由其组成。在一个实施方案中,编码轻链可变区的多核苷酸包含在SEQIDNO:8或与SEQIDNO:8至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成,并且编码重链可变区的多核苷酸包含在SEQIDNO:9或与SEQIDNO:9至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,多核苷酸编码抗体的抗EGFR1结合片段的i)轻链和ii)重链。在一个实施方案中,多核苷酸编码的抗EGFR1结合片段是Fab或scFv。在一个实施方案中,该多核苷酸包含在SEQIDNO:10或与SEQIDNO:10至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的轻链序列或由其组成。在一个实施方案中,该多核苷酸包含在SEQIDNO:11或与SEQIDNO:11至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的重链序列或由其组成。在一个实施方案中,多核苷酸包含在SEQIDNO:10中所述的轻链序列和SEQIDNO:11中所述的重链序列,或由其组成。在一个实施方案中,多核苷酸包含在SEQIDNO:10或与SEQIDNO:10至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的轻链序列以及在SEQIDNO:11或与SEQIDNO:11至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的重链序列,或由其组成。在一个实施方案中,该多核苷酸包含在SEQIDNO:12或与SEQIDNO:12至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,该多核苷酸包含在SEQIDNO:13或与SEQIDNO:13至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列或由其组成。在一个实施方案中,轻链可变区和重链可变区前置有信号肽。多核苷酸因此编码信号肽和轻链可变区以及信号肽和重链可变区。两个信号肽可以彼此独立地选择,或它们可以是相同的信号肽。在一个实施方案中,前置于轻链可变区的信号肽不同于除前置于重链可变区的信号肽。在一个实施方案中,前置于轻链可变区和重链可变区的信号肽独立地选自gIII、malE、phoA、ompA、pelB、stII和stII。在一个实施方案中,前置于轻链可变区和重链可变区的信号肽独立地选自mpA、pelB、stII和stII。在一个实施方案中,前置于轻链可变区的信号肽与前置于重链可变区的信号肽相同,并且其中信号肽选自gIII、malE、phoA、ompA、pelB、stII和stII。在一个实施方案中,前置于轻链可变区的信号肽与前置于重链可变区的信号肽相同,并且其中信号肽选自ompA、pelB、stII和stII。在一个实施方案中,轻链可变区前置有pelB信号肽并且重链可变区前置有ompA信号肽。在一个实施方案中,轻链可变区和重链可变区均前置有stII信号肽。多核苷酸也可以有效连接至启动子,即受其驱动,或包含该启动子。启动子可以允许多核苷酸的有效表达。启动子也可以是诱导型启动子,从而允许多核苷酸的诱导表达。在一个实施方案中,多核苷酸受选自T7、T5和Rham的启动子驱动,即与之有效连接,或包含该启动子。在一个实施方案中,多核苷酸受启动子T7驱动或包含该启动子。在一个实施方案中,原核宿主细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1抗体或抗EGFR1抗体的EGFR1结合片段。在一个实施方案中,大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1抗体或抗EGFR1抗体的EGFR1结合片段。在一个实施方案中,大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1Fab。在一个实施方案中,大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1scFv。在一个实施方案中,大肠杆菌细胞包含在SEQIDNO:8或与SEQIDNO:8至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的多核苷酸以及在SEQIDNO:9或与SEQIDNO:9至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列,或由其组成,并且大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1抗体或抗EGFR1抗体的EGFR1结合片段。在一个实施方案中,大肠杆菌细胞包含在SEQIDNO:8或与SEQIDNO:8至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的多核苷酸以及在SEQIDNO:9或与SEQIDNO:9至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的序列,或由其组成,并且大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1Fab或抗EGFR1scFv。在一个实施方案中,大肠杆菌细胞包含在SEQIDNO:8中所述的多核苷酸和SEQIDNO:9中所述的序列或由其组成并且大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1Fab或抗EGFR1scFv。在一个实施方案中,大肠杆菌细胞包含在SEQIDNO:10或与SEQIDNO:10至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的多核苷酸以及在SEQIDNO:11或与SEQIDNO:11至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的重链序列,或由其组成,并且大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1抗体或抗EGFR1抗体的EGFR1结合片段。在一个实施方案中,大肠杆菌细胞包含在SEQIDNO:10或与SEQIDNO:10至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的多核苷酸以及在SEQIDNO:11或与SEQIDNO:11至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的重链序列,或由其组成,并且大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1Fab。在一个实施方案中,大肠杆菌细胞包含在SEQIDNO:12或与SEQIDNO:12至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的多核苷酸或由其组成,并且大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1scFv。在一个实施方案中,大肠杆菌细胞包含在SEQIDNO:13或与SEQIDNO:13至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、或至少99%相同的序列中所述的多核苷酸或由其组成,并且大肠杆菌细胞产生至少20mg/L、至少30mg/L、至少50mg/L、至少100mg/L、至少200mg/L、或至少500mg/L的抗EGFR1scFv。本发明还涉及一种药物组合物,其包含根据本发明一个或多个实施方案的缀合物。本发明的药物组合物还可以包含可药用载体。合适的可药用载体的例子是本领域熟知的并且可以包括例如磷酸盐缓冲盐水溶液、水、油/水乳液、润湿剂和脂质体。可以通过本领域熟知的方法配制这类载体的组合物。药物组合物还可以包含其他组分例如溶媒、添加物,防腐剂、同时施用的其他药物组合物等。在一个实施方案中,药物组合物包含有效量的根据本发明一个或多个实施方案的缀合物。在一个实施方案中,药物组合物包含治疗有效量的根据本发明一个或多个实施方案的缀合物。术语缀合物的“治疗有效量”或“有效量“应当理解为指,当癌细胞遭受中子辐射轰击或暴露于BNCT时调节癌细胞生长和/或治疗患者疾病的剂量方案。可以根据多种因素选择治疗有效量,所述因素包括患者的年龄、体重、性别、膳食和医学状况、疾病严重程度和药理学考虑,例如所用特定缀合物的活性、效力、药代动力学特征和毒理学特征。治疗有效量也可以通过参考标准医学教材(例如PhysiciansDeskReference2004)确定。患者可以是男性或女性,并且可以是婴儿、儿童或成人。术语“治疗过程”或“治疗”按常规意义使用并且意指陪伴、照顾和护理患者,旨在防止、减少、减弱或缓和疾病或健康异常并改善因这种疾病(例如,因癌疾病)受损的生活状况。在一个实施方案中,药物组合物包含供例如口服、胃肠道外、经皮、管腔内、动脉内、鞘内、肿瘤内(i.t.)和/或鼻内施用或供直接注射入组织的组合物。药物组合物的施用可以按不同方式实现,例如通过静脉内、腹膜内、皮下、肌内、肿瘤内、局部或真皮内施用实现。本发明还涉及根据本发明一个或多个实施方案的缀合物或包含根据本发明一个或多个实施方案的缀合物的药物组合物,其用作药物。本发明还涉及根据本发明一个或多个实施方案的缀合物或包含根据本发明一个或多个实施方案的缀合物的药物组合物,其用作硼中子捕获疗法的药物。“硼中子捕获疗法”(BNCT)应当理解为指导引放疗法,其中非放射性硼-10用低能量热中子照射以产生α粒子和锂-7原子核。可以通过并入肿瘤定位药物例如肿瘤定位缀合物中而导引非放射性硼-10。本发明还涉及根据本发明一个或多个实施方案的缀合物或包含根据本发明一个或多个实施方案的缀合物的药物组合物,其用于硼中子捕获疗法中。本发明还涉及根据本发明一个或多个实施方案的缀合物或包含根据本发明一个或多个实施方案的缀合物的药物组合物,其用于治疗癌症。在一个实施方案中,癌是头颈癌。在一个实施方案中,癌选自头颈癌、白血病、淋巴瘤、乳腺癌、前列腺癌、卵巢癌、结直肠癌、胃癌、鳞状癌、小细胞肺癌、多药耐药性癌和睾丸癌。本发明还涉及根据本发明一个或多个实施方案的缀合物或包含根据本发明一个或多个实施方案的缀合物的药物组合物,其用于硼中子捕获疗法治疗癌症。本发明还涉及根据本发明一个或多个实施方案的缀合物或药物组合物用于制造药物的用途。本发明还涉及根据本发明一个或多个实施方案的缀合物或药物组合物用于制造硼中子捕获疗法用药物的用途。本发明还涉及根据本发明一个或多个实施方案的缀合物或药物组合物用于制造治疗癌症的药物的用途。在一个实施方案中,癌是头颈癌。在一个实施方案中,癌选自头颈癌、白血病、淋巴瘤、乳腺癌、前列腺癌、卵巢癌、结直肠癌、胃癌、鳞状癌、小细胞肺癌、多药耐药性癌和睾丸癌。本发明还涉及根据本发明一个或多个实施方案的缀合物或药物组合物用于制造通过硼中子捕获疗法治疗癌症的药物的用途。在一个实施方案中,药物通过硼中子捕获疗法用于肿瘤内治疗头颈癌。在一个实施方案中,药物通过硼中子捕获疗法用于静脉内治疗头颈癌。在一个实施方案中,药物通过硼中子捕获疗法用于肿瘤内和静脉内治疗头颈癌。本发明还涉及一种治疗或调节人类中表达EGFR1的肿瘤细胞生长的方法,其中根据本发明一个或多个实施方案的缀合物或药物组合物以有效量施用至人类。在一个实施方案中,根据本发明一个或多个实施方案的缀合物或药物组合物在硼中子捕获疗法中以有效量施用至人类。在一个实施方案中,在施用缀合物或药物组合物后分析肿瘤细胞中的硼浓度。在一个实施方案中,在施用缀合物或药物组合物后分析血液中的硼浓度。在一个实施方案中,在施用缀合物或药物组合物后分析肌肉中或其他非肿瘤组织中的硼浓度。肿瘤细胞中、血液中或两者中的硼浓度可以例如通过电感耦合等离子体质谱法(ICP-MS)或电感耦合等离子体原子发射光谱法(ICP-AES)(例如实施例9)分析或测量。这些方法测量样品中硼原子的量(以摩尔计)或浓度。肿瘤细胞中、血液中或两者中的硼浓度也可以间接地分析或测量,例如通过使用包含示踪分子的缀合物的实施方案并分析或测量示踪分子的浓度。例如,如果示踪分子是荧光或放射性的,则可以测量或可视化示踪分子的荧光或放射性活度。在一个实施方案中,在施用缀合物或药物组合物后分析肿瘤细胞中和血液中的硼浓度,并且肿瘤细胞中硼浓度对血液中硼浓度的比率高于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、15:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1、110:1、120:1、130:1、140:1、150:1、200:1、210:1、220:1、230:1、240:1或250:1。在一个实施方案中,在施用缀合物或药物组合物后分析肿瘤细胞中和肌肉中、或其他非肿瘤组织中的硼浓度,并且肿瘤细胞中硼浓度对肌肉或其他非肿瘤组织中硼浓度的比率高于1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、15:1、20:1、30:1、40:1、50:1、60:1、70:1、80:1、90:1、100:1、110:1、120:1、130:1、140:1、150:1、200:1、210:1、220:1、230:1、240:1或250:1。在一个实施方案中,肿瘤细胞中硼浓度对血液中、肌肉中或其他非肿瘤组织中硼浓度的比率是肿瘤细胞中的硼原子对血液中、肌肉中或其他非肿瘤组织中的硼原子的摩尔比。本发明还涉及一种调节表达EGFR1蛋白的细胞群体生长的方法,其中该方法包括步骤:使根据本发明一个或多个实施方案的缀合物或根据本发明一个或多个实施方案的药物组合物与表达EGFR1蛋白的细胞群体接触。在一个实施方案中,表达EGFR1蛋白的细胞群体是癌细胞群体或肿瘤细胞群体。在这种情况下,术语“癌细胞群体”应当理解为指一个或多个癌细胞群体。缀合物可以在体外、体内和/或离体接触细胞群体,例如癌细胞,例如包括血浆、肺、乳房、结肠、前列腺、肾、胰腺、脑、骨、卵巢、睾丸和淋巴器官的癌;更优选地肺癌、结肠癌、前列腺癌、浆细胞癌、血液癌或结肠癌;“调节癌细胞群体的生长”包括抑制细胞群体增殖避免产生更多细胞的分裂;如与例如未处理的细胞相比,减少细胞分裂增长的速率;杀伤细胞群体;和/或阻止细胞群体(例如癌细胞)转移。可以在体外、在体内或离体调节细胞群体的生长。在一个实施方案中,癌选自头颈癌、白血病、淋巴瘤、乳腺癌、前列腺癌、卵巢癌、结直肠癌、胃癌、鳞状癌、小细胞肺癌、多药耐药性癌和睾丸癌。本发明还涉及一种治疗和/或调节人类中肿瘤细胞的生长和/或预防所述肿瘤细胞的方法,其中根据本发明一个或多个实施方案的缀合物或药物组合物以有效量施用至人类。在一个实施方案中,有效量是治疗有效量。在一个实施方案中,根据本发明一个或多个实施方案的缀合物或药物组合物在硼中子捕获疗法中以有效量施用至人类。在一个实施方案中,肿瘤细胞选自白血病细胞、淋巴瘤细胞、乳腺癌细胞、前列腺癌细胞、卵巢癌细胞、结直肠癌细胞、胃癌细胞、鳞状癌细胞、小细胞肺癌细胞、头颈癌细胞、多药耐药性癌细胞及转移性、睾丸癌细胞、晚期、抵抗药物或抵抗激素的多药耐药性癌细胞及其各种形式。本发明还涉及一种治疗人类癌症的方法,其中根据本发明一个或多个实施方案的缀合物或药物组合物是以有效量施用至人类。在一个实施方案中,根据本发明一个或多个实施方案的缀合物或药物组合物在硼中子捕获疗法中以有效量施用至人类。在一个实施方案中,有效量是治疗有效量。在一个实施方案中,根据本发明一个或多个实施方案的缀合物或药物组合物在硼中子捕获疗法中以治疗有效量静脉内施用至人类。在一个实施方案中,根据本发明一个或多个实施方案的缀合物或药物组合物在硼中子捕获疗法中以治疗有效量肿瘤内方式施用至人类。在一个实施方案中,根据本发明一个或多个实施方案的缀合物或药物组合物在硼中子捕获疗法中以治疗有效量肿瘤内和静脉内方式施用至人类。在一个实施方案中,根据本发明一个或多个实施方案的缀合物或药物组合物在硼中子捕获疗法中以治疗有效量肿瘤内方式施用至头颈部肿瘤。在一个实施方案中,癌选自头颈癌、白血病、淋巴瘤、乳腺癌、前列腺癌、卵巢癌、结直肠癌、胃癌、鳞状癌、小细胞肺癌、多药耐药性癌和睾丸癌。在一个实施方案中,根据一个或多个实施方案的缀合物或药物组合物包含通过包括以下的方法可获得的抗EGFR1抗体或其EGFR1结合片段:培养根据一个或多个实施方案的原核宿主细胞;并且分离和/或纯化抗EGFR1抗体或其EGFR1结合片段。在一个实施方案中,根据一个或多个实施方案的缀合物或药物组合物的抗EGFR1抗体或其EGFR1结合片段包含在SEQIDNO:14或SEQIDNO:15中所述的氨基酸序列或由其组成。本发明还涉及一种治疗或调节人类中表达EGFR1的肿瘤细胞生长的方法,其中根据一个或多个实施方案的缀合物或根据一个或多个实施方案的药物组合物以有效量施用至人类。前文所述的本发明实施方案可以彼此在任何组合下使用。几个实施方案可以合并在一起以形成本发明的又一个实施方案。与本发明相关的产品、用途或方法可以包含本文所述的本发明至少一个实施方案。根据本发明一个或多个实施方案的缀合物具有众多有利的特性。根据本发明一个或多个实施方案的缀合物在低能量中子照射不存在的情况下相对无毒并且具有低抗原性。它含有大量的硼-10原子/缀合物分子。另外,它显示出相对良好的水溶解性。根据本发明一个或多个实施方案的缀合物还显示出良好的药代动力学。它在血液具有合适的停留过程,在它靶向的细胞中具有高摄取量且在它未靶向的细胞中具有低摄取量。它的生产过程相对简单并且可以在水溶液中进行。根据本发明一个或多个实施方案的缀合物在制造期间或在生理状态下例如在血清、血浆或组织中对化学降解作用或生物化学降解作用足够稳定。实施例下文中,将更详细地描述本发明。现在将详细地参照本发明的实施方案,所述实施方案的例子例如在附图中示例。以下描述以这样的细节公开了本发明的一些实施方案,从而所属
技术领域:
的技术人员能够基于公开内容利用本发明。并未详细讨论实施方案的全部步骤,因为基于本说明书,许多步骤将对于本领域技术人员显而易见。实施例1.葡聚糖的烯丙基化200mg葡聚糖70kD(Sigma)溶解于2ml0.6MNaOH中。添加250μl烯丙基溴(Sigma)并且允许反应在60℃推进3小时。随后用1M乙酸中和反应混合物并且通过用10体积冷丙酮(-20℃)沉淀,分离产物。将沉淀物通过离心收集并用丙酮洗涤两次。烯丙基化葡聚糖(方案1)经历1H-NMR分析,该分析显示烯丙基化水平是大约40%。方案1.使用烯丙基溴的葡聚糖烯丙基化。实例2.添加BSH至烯丙基葡聚糖如实施例1中所述那样制备的50mg烯丙基葡聚糖70kD、50mg过硫酸铵和50mg硼卡钠(BSH;KatchemLtd,捷克共和国)溶解于0.5mlH2O中。允许反应在50℃进行2小时。使用离心滤器(Amicon、10K截断值),用超滤分离反应产物BSH-葡聚糖(方案2)。1H-NMR分析显示,平均100个BSH单位连接至烯丙基葡聚糖,对应于1200个硼原子/葡聚糖链(图1)。例如通过葡聚糖中使用较低的烯丙基化水平,采用少量修饰,获得了具有约900个硼或800个硼/葡聚糖链的BSH葡聚糖。方案2.在过硫酸盐催化的反应中添加硼卡钠至烯丙基葡聚糖。通过变动上文所述反应中BSH和过硫酸盐的量,可以制备具有明显较低BSH水平的BSH-葡聚糖:1)在含有20mg烯丙基葡聚糖、15mg过硫酸铵和15mgBSH的反应中,发现分离的BSH-葡聚糖含有大约700个硼原子/葡聚糖链。2)在含有20mg烯丙基葡聚糖、10mg过硫酸铵和10mgBSH的反应中,发现分离的BSH-葡聚糖含有大约560个硼原子/葡聚糖链。3)在含有20mg烯丙基葡聚糖、5mg过硫酸铵和5mgBSH的反应中,发现分离的BSH-葡聚糖含有大约360个硼原子/葡聚糖链。实例3.BSH-葡聚糖的氧化如实施例2中所述那样制备的50mgBSH-葡聚糖溶解于含3ml25mMNaIO4的0.1M乙酸钠(pH5.5)中。反应管用铝箔覆盖并且在室温温育过夜。使用离心滤器(Amicon、10K截断值),用超滤分离反应产物—氧化型BSH-葡聚糖(方案3)。方案3.通过用途高碘酸钠氧化BSH-葡聚糖。实施例4.氧化的BSH-葡聚糖缀合至抗EGFR1Fab/F(ab’)22ml磷酸盐缓冲盐水(PBS)中的2mg(40nmol)抗EGFR1Fab与1.6mlPBS中的5.1mg(60nmol)氧化的BSH-葡聚糖(实施例3)混合。允许反应在室温推进过夜。添加400μl0.5MNaCNBH3至反应以稳定醛-赖氨酸键并且将反应在室温温育2小时。添加800μl0.2M乙醇胺-HClpH8并将反应在室温温育1小时。添加400μl0.5MNaCNBH3以稳定乙醇胺封端过程并且将反应在室温温育2小时。使用PBS作为洗涤洗脱液,根据制造商的说明通过Amicon离心滤器装置(MWCO30K)移除低分子量试剂。2ml磷酸盐缓冲盐水(PBS)中的2mg(40nmol)抗EGFR1F(ab’)2与1.6mlPBS中的2.56mg(30nmol)氧化BSH-葡聚糖(实施例3)混合。将缀合物如上文那样稳定化、封端并通过超滤纯化。使用10%乙腈(ACN)-50mMTris-HCl(pH7.5)作为洗脱缓冲液,通过纯化仪(GEHealthcare)以Yarra3μmSEC-3000凝胶过滤柱(300x7.8mm;Phenomenex)分析两种缀合物(图2)。实施例5.抗EGFR1-Fab和抗EGFR1-F(ab’)2以及对照-Fab片段和对照-F(ab’)2片段的产生从商业西妥昔单抗(Erbitux,Roche)或CHO细胞产生的西妥昔单抗(FreedomCHO-S试剂盒,Invitrogen)生成Fab片段和F(ab’)2片段。FreedomCHO-S试剂盒(LifeTechnologies)用于开发产生西妥昔单抗的稳定细胞系。这项工作根据制造商的说明书进行。编码重链序列和轻链序列的优化核苷酸序列购自GeneArt(LifeTechnologies)并分别克隆入pCEP4表达载体(LifeTechnologies)。为了稳定表达,将FreeStyleTMCHO-S细胞用线性化的1:1轻链载体和重链载体转染。用嘌呤霉素和氨甲喋呤选择转染子,此后通过有限稀释克隆法进行克隆分离。扩充克隆的细胞系并评估其生产力。对照-Fab片段和对照-F(ab’)2片段从商业奥马佐单抗(抗IgE)(Xolair,Novartis)产生。根据制造商的说明书在少量修改下,通过用固定化的木瓜蛋白酶(Pierce)消化抗体,制备抗EGFR1Fab片段。所用的酶对底物比率是1:60(%w/w)并且温育时间是7小时。根据制造商的说明,将Fab片段用固定化蛋白A柱(ThermoScientific)与未消化的IgG和Fc片段分离。通过用FragITMaxiSpin(Genovis)根据制造商的说明书或用Fabricator酶(Genovis)在少量修改下根据制造商的说明消化抗体,制备抗EGFR1F(ab’)2片段。Fabricator酶消化用每mg抗体120单位酶在50mM磷酸钠缓冲液pH6.6中进行并且温育时间是在+37℃1小时。F(ab’)2片段用固定化的HiTrap蛋白L柱(GEHealthcare)根据制造商的说明纯化。采用AmiconUltra浓缩器(Millipore)(10kD截断值),将反应缓冲液变成PBS。用SDS-PAGE鉴定生成的片段并且通过测量280nm处的紫外吸光度测定每种片段的蛋白质浓度。实施例6.硼缀合物的SDS-PAGE分析使用SDS-PAGE分析抗EGFR1Fab片段和抗EGFR1F(ab’)2片段的硼缀合物,旨在验证缀合已经获得成功并且缀合后不存在未缀合的Fab片段或F(ab’)2片段。图3显示在非还原条件(小图A)和还原条件(小图B)下,梯度凝胶(Bio-Rad、4-15%)中硼量不同的抗EGFR1Fab/F(ab’)2硼缀合物的SDS-PAGE分析。小图A的结果显示缀合已经完成(或接近完成),因为没看到未缀合的Fab片段或F(ab’)2片段。BSH是带负电荷的分子并且与蛋白质缀合时,缀合物的迁移速率在凝胶上快于基于其理论分子量预计的迁移速率。图3(小图A)的例子显示,硼量高的缀合物在非还原凝胶上迁移快于硼量较少的缀合物(例如,比较泳道1、2、4和6)。图3(小图A)的结果还显示,大部分缀合物在非还原凝胶上分离成为两个条带,这提示样品含有两个不同种类缀合物的混合物。硼缀合物在还原条件下的SDS-PAGE分析(图3,小图B)显示,硼量不同的全部Fab缀合物在凝胶上在还原条件下均类似地迁移(泳道1、2、4、6)。同样地,硼量不同的还原型F(ab’)2缀合物迁移相同(泳道3、5、7)。从总体上看,还原的硼缀合物在凝胶上迁移快于没有还原的缀合物。实施例7.硼缀合物的体外内化测定法硼缀合物的AlexaFluor488标记将5μgAlexaFluor488羧酸、琥珀酰亚胺酯标记物(Invitrogen)与100μg硼缀合物(抗EGFR1-Fab、抗EGFR1-F(ab’)2、抗EGFR1-mAb、对照-Fab、对照-F(ab’)2、对照-mAb)或相应的未缀合化合物在室温在含有10μl1MNaHCO3、pH9的100μlPBS缓冲液内温育15分钟。在温育后,通过采用AmiconUltra浓缩器(Millipore)(10kD截断值)将缓冲液变成PBS,移除过量标记物。通过测量280nm处的紫外吸光度测定每种化合物的蛋白质浓度并且根据制造商的说明(Invitrogen)计算标记的程度。硼缀合物的氚标记通过蒸发移除甲苯溶剂后,将100μCi氚标记的N-琥珀酰亚胺基丙酸酯(PerkinElmer)与100μg抗EGFR1-Fab-BSH(800B)-Dex、抗EGFR1-F(ab’)2-BSH(800B)-Dex、抗EGFR1-mAb和对照-mAb在含有20μl1M硼酸钠的100μlPBS(pH8.8)缓冲液中温育。允许反应在室温推进过夜并且随后通过采用AmiconUltra浓缩器(10kD截断值)将缓冲液变成PBS,移除过量标记物。用闪烁计数器在闪烁计数流体混合物(UltimaGold,PerkinElmer)存在下测量放射性活度的量。化合物中氚标记物的量计算为cpm/μg蛋白质。细胞培养物将HSC-2细胞(人口腔鳞状细胞癌,JCRPCellbank,日本)和FaDu细胞(人咽鳞状细胞癌,ATCC)在T75瓶的含2%谷氨酰胺、10%胎牛血清和1%青霉素/链霉素的Eagle’s极限基本培养基中培养。HEK(人胚肾、ATCC)细胞在T75瓶的含2%谷氨酰胺、10%胎牛血清和1%青霉素/链霉素的Dulbecco改良Eagle培养基中培养。荧光显微术中可视化的内化测定法在腔式载玻片上接种HSC-2细胞(5x104个)并且允许其生长24小时。随后,将细胞在+37℃或在+4℃在含有10μg/mlAlexaFluor488标记的BSH-缀合物的100μl培养基中温育3小时。在温育后,将细胞用PBS洗涤两次并用4%多聚甲醛固定20分钟。添加封片剂(含DAPI的ProlongGold荧光衰减试剂)并且用显微镜盖玻片覆盖细胞。细胞用荧光显微术(ZeissAxioScopeA1;ProgResC5,JENOPTIKAG)照相。通过荧光显微术分析HSC-2肿瘤细胞系对抗EGFR1-F(ab’)2-BSH(900B)-Dex和未缀合的抗EGFR1-F(ab’)2的内化(图4)。实验在+4℃(化合物与细胞表面结合,但不能内化)和在+37℃(细胞能够内化表面结合的化合物)实施。未缀合的抗EGFR1-F(ab’)2和硼缀合物在+4℃均与细胞表面结合(小图A和B)并且在+37℃内化(小图C和D)。实际上,硼缀合物比未缀合的抗EGFR1-F(ab’)2更高效地内化。采用抗EGFR1-Fab-BSH(900B)-Dex和EGFR1-mAb-BSH(900B)-Dex和相应的未缀合抗EGFR1-Fab和抗EGFR1-mAb的内化测定给出了与图4中所展示的数据(未显示)非常类似的结果。使用硼量不同的硼缀合物(抗EGFR1-Fab-BSH-Dex和抗EGFR1-F(ab’)2-BSH-Dex)检查硼载量对内化的影响。结果显示,具有更多硼的缀合物在+37℃比硼载量低的缀合物被HSC-2细胞更高效内化(未显示)。对照-F(ab’)2-BSH(900B)-Dex仅非常微弱地内化(未显示)。内化测定法(FACS)在24孔平板上接种HSC-2、FaDu和HEK细胞(2x105)并且允许其生长24小时。随后,将细胞在+37℃在含有5μg/mlAlexaFluor488标记的化合物的300μl培养基中温育3小时。在温育后,将细胞用PBS洗涤两次并通过与100μl胰蛋白酶-EDTA在+37℃温育10分钟脱离。通过添加300μl培养基中和细胞并使其重悬于PBS中并使用流式细胞仪(FACSLRSII)分析。使用FACSDiva软件计算每份样品的平均荧光强度。表1-3中展示的数据表述为“归一化的平均荧光强度”,其中荧光强度已经对每种化合物的标记程度归一化。FACS测定法使用FACS评价人HNC癌细胞系HSC-2对荧光标记的硼缀合物(900个硼原子)和未缀合的Ab片段的内化。结果代表当细胞已经在+37℃温育时出现的内化加细胞表面结合的化合物(表1)。抗EGFR1-Fab-BSH-Dex比其他硼缀合物或未缀合的抗EGFR1-Fab更高效地内化。其他抗EGFR1硼缀合物(抗EGFR1-F(ab’)2-BSH-Dex和抗EGFR1-mAb-BSH-Dex)与未缀合的抗EGFR1-Fab和抗EGFR1-F(ab’)2同等良好地内化。对照-F(ab’)2和对照-mAb的硼缀合物非常微弱地内化。表1.HSC-2细胞对荧光标记的硼缀合物和未缀合的化合物的细胞表面结合和内化。已经通过FACS实施分析并且荧光强度已经对每种化合物的标记程度归一化。硼量不同(360-900个硼原子)的硼缀合物由抗EGFR1F(ab’)2和抗EGFR1-Fab合成,以研究硼载量在内化过程中的影响。实施例显示了使用人HNC癌细胞系HSC-2和人对照细胞系HEK的荧光标记缀合物的内化测定法。来自流式细胞分析的结果代表当细胞已经在+37℃温育时出现的内化加细胞表面结合的化合物(表2)。通过流式细胞术分析,抗EGFR1Ab片段的全部硼缀合物的内化非常相似。然而,采用显微术的实验揭示,具有更多硼的缀合物比硼载量低的缀合物更高效地内化(未显示)。表2.HSC-2对硼量不同的荧光标记的硼缀合物的细胞表面结合和内化。已经通过流式细胞仪实施分析并且荧光强度已经对每种化合物的标记程度归一化。使用流式细胞术评价人HNC癌细胞系(HSC-2和FaDu)和对照细胞系HEK对荧光标记的硼缀合物(1200或800个硼原子)和未缀合的Ab片段的内化。结果代表当细胞已经在+37℃温育时出现的内化加细胞表面结合的化合物(表3)。HSC-2和FaDu细胞对抗EGFR1-Fab-BSH(1200B)-Dex和未缀合的抗EGFR1-Fab显示最强烈的内化。FaDu细胞内化始终比HSC-2细胞更弱,这或许归因于细胞表面上EGFR1受体的量较少。对照硼缀合物(对照-Fab-BSH(800B)-Dex和对照-F(ab’)2-BSH(800B)-Dex)和相应的未缀合的化合物非常微弱地内化。对照细胞系HEK仅非常微弱地内化硼缀合物和未缀合的化合物。表3.由HSC-2细、FaDu和HEK细胞对荧光标记的硼缀合物(1200B或800B)和未缀合的化合物的细胞表面结合和内化。已经通过流式细胞仪实施分析并且荧光强度已经对每种化合物的标记程度归一化。放射标记的样品的内化测定法在24孔平板上接种HSC-2、FaDu和HEK细胞(2x105)并且允许其生长24小时。随后,将细胞在+37℃在含有5μg/ml氚标记的化合物的300μl培养基中温育3小时。在温育后移除培养基并且将细胞用PBS洗涤3次并通过添加300μl1MNaOH裂解。用闪烁计数器在闪烁计数流体混合物(UltimaGold)存在下测量培养基和细胞裂解物中放射性活度的量。从每孔的放射性活度总量计算内化的化合物的量并将其对100,000个细胞归一化。抗EGFR1-Fab和抗EGFR1-F(ab’)2硼缀合物(800个硼原子)以及未缀合的抗EGFR1-mAb用氚标记至蛋白质组成部分的赖氨酸残基。使用人HNC癌细胞系HSC-2和FaDu以及对照细胞系HEK,实施放射标记的化合物的内化测定法。结果代表当细胞已经在+37℃温育时出现的内化加细胞表面结合的化合物。结果(表4)显示,HSC-2和FaDu细胞对抗EGFR1-Fab和抗EGFR1–F(ab’)2的硼缀合物的内化与未缀合的抗EGFR1-mAb同样高效。HSC-2细胞的内化比FaDu细胞强100倍,这或许归因于HSC-2细胞中细胞表面上EGFR1受体的量更高。对照细胞系HEK仅显示非常微弱的内化。表4.HSC-2、FaDu和HEK细胞对放射标记的硼缀合物的内化。已经从每孔的放射性活度总量计算内化的化合物的量并将其对100,000个细胞归一化。结果是三次测定的平均数+/-S.D。实施例8.氚标记的缀合物的体内实验制备用于液体闪烁计数的小鼠组织和血液样品称重的小鼠器官每0.2g组织1ml组织溶解剂(SolvableTM,PerkinElmer)溶解。样品在+60℃温育过夜。随后每300μl溶解的器官和样品添加150μlH2O2并在+60℃温育1小时。将骨首先用1MHCl在+60℃过夜处理并随后用Solvable和H2O2处理。用闪烁计数器在闪烁计数流体混合物(UltimaGoldTM,PerkinElmer)存在下测量器官中放射性活性的量。数据显示为以克组织计的总注射剂量%。结果是三只小鼠的平均数+/-SEM。由于每只小鼠具有两个肿瘤,肿瘤的结果是六次测定的平均数+/-SEM。在微量离心管中采集清除试验中的血液样品并且在添加100μlSolvable后测量体积并且在+60℃温育过夜。随后添加100μlH2O2并在+60℃温育1小时。用闪烁计数器在闪烁计数流体混合物(UltimaGold,PerkinElmer)存在下测量血液样品中放射性活性的量。数据表示为总注射剂量%。结果是两只小鼠的平均数。无非肿瘤小鼠中硼缀合物的血液清除使用相同年龄的雌性成年小鼠(HarlanHSD:无胸腺裸鼠Foxn1nu)。将具有800B和300B硼载量的抗EGFR1-Fab和-F(ab’)2的放射标记(3H)的硼缀合物经尾静脉在100μlPBS中静脉内注射。注射的剂量是30μg=1.3-2x106cpm/小鼠并且每样品使用两只小鼠。在注射之前和之后的不同时间点采集大约10μl血液样品并计数放射性活性。在实验结束(48小时)时,处死小鼠并且收集器官及计数放射性活性以确定缀合物的组织生物分布。使用具有800B和300B硼载量的抗EGFR1-Fab和-F(ab’)2的3H标记的硼缀合物,实施无肿瘤小鼠中的血液清除研究。两个不同硼载量用来观察硼载量是否影响从血液循环清除缀合物。结果表明硼缀合物的血液清除快速并且与硼载量无关(表5)。清除过程与相应未缀合的F(ab’)2片段和Fab片段的清除过程相当(未显示)。组织分布研究显示,硼缀合物在48小时不蓄积入任何器官(未显示)。表5.无非肿瘤小鼠中硼缀合物的血液清除。结果是两次测定的平均数。时间是施用后的时间(min)并且值是总注射剂量%。HSC-2肿瘤小鼠中硼缀合物的生物分布使用相同年龄的雌性成年小鼠(HarlanHSD:无胸腺裸鼠Foxn1nu)。将EME-培养基和50%基质胶中的二百五十万至三百万个HSC-2细胞(JCRPCellbank,日本)在150μl中接种至裸鼠的两侧腹部。当每只小鼠的至少一个肿瘤已经生长到尺寸大致对应于肿瘤体积100-500mm3的至少6mm直径(6–10mm)时,进行给药。将抗EGFR1-Fab/F(ab’)2和对照-Fab/F(ab’)2的放射标记(3H)的硼缀合物(800B)经尾静脉在100μlPBS中静脉内注射。注射的剂量是50μg=1.3-2.6x106cpm/小鼠并且使用三只小鼠/样品。将小鼠在不同时间点(24小时、48小时和72小时)处死并且收集器官及计数放射性活性以确定缀合物的组织生物分布。硼缀合物的组织分布(表6)显示,抗EGFR1-Fab和抗EGFR1-F(ab’)2的硼缀合物蓄积入肿瘤,但是不蓄积在任何其他器官中,而对照硼缀合物未显著蓄积入肿瘤中。抗EGFR1-Fab和抗EGFR1-F(ab’)2的硼缀合物的肿瘤蓄积在24小时最高并在更晚的时间点(48小时和72小时)缓慢减少。表6.HSC-2肿瘤小鼠中硼缀合物的生物分布。结果代表三次测定的平均数+/-SEM,肿瘤例外地是六次测定平均数+/-SEM。值是总注射剂量%/g器官。在不同时间点(24小时、48小时和72小时)计算HSC-2异种移植物小鼠中硼缀合物的肿瘤对血液分布(表7)。对于抗EGFR1-Fab缀合物,肿瘤/血液比率是4-5,并且对于抗EGFR1-F(ab’)2缀合物,是2-6。抗EGFR1-Fab-BSH-Dex(24小时)比抗EGFR1-F(ab’)2-BSH-Dex(48小时)更早达到最大比率。对照缀合物的肿瘤/血液比率在整个研究期间自始至终保持在恒定水平(大约1-2)。表7.HSC-2肿瘤小鼠中硼缀合物的肿瘤/血液分布。对于血液样品,结果基于三次测定的平均数,对于肿瘤,基于六次测定的平均数(每只小鼠2个肿瘤)+/-S.D。FaDu肿瘤小鼠中硼缀合物的生物分布使用相同年龄的雌性成年小鼠(CharlesRiverCrl:无胸腺裸鼠Foxn1nu)。将EME-培养基和50%基质胶中的三百万个FaDu细胞(ATCC)在150μl中接种至裸鼠的两侧腹部。当每只小鼠的至少一个肿瘤已经生长到至少6mm直径(6–10mm,尺寸大致对应于肿瘤体积100-500mm3)时,进行给药。将抗EGFR1-Fab/F(ab’)2和对照-Fab/F(ab’)2的放射标记(3H)的硼缀合物(800B或1200B)经尾静脉在100μlPBS中静脉内注射。注射的剂量是50μg=2.3-2.7x106cpm/小鼠,并且每样品使用三只小鼠。将小鼠在两个不同时间点(24小时和48小时)处死并且收集器官及计数放射性活性以确定缀合物的组织生物分布。使用抗EGFR1-F(ab’)2-BSH(800B)-Dex和抗EGFR1-Fab(800B或1200B)-BSH-Dex和对照-F(ab’)2和对照-Fab的硼缀合物(800B)实施FaDu异体移植肿瘤小鼠中的生物分布研究。缀合物放射标记(3H)至蛋白质的赖氨酸残基。在两个不同时间点(24小时和48小时)计数组织样品(包括肿瘤和血液)中的放射性活性。硼缀合物的组织分布(表8)显示,抗EGFR1-Fab和抗EGFR1-F(ab’)2的硼缀合物蓄积入肿瘤,但是不显著地蓄积在任何其他器官中,而对照硼缀合物未显著蓄积入肿瘤中。对照-F(ab’)2-BSH(800B)-Dex在24小时仍然可以存在于血液循环中和全部器官中、但在48小时从循环清除。抗EGFR1-Fab和抗EGFR1-F(ab’)2的硼缀合物的肿瘤蓄积在24小时最高并在48小时减少。表8.FaDu肿瘤小鼠中硼缀合物的生物分布。结果代表三次测定的平均数+/-SEM,肿瘤例外的是六次测定平均数+/-SEM。值是总注射剂量%/g器官。在24小时和48小时计算FaDu异种移植物小鼠中硼缀合物的肿瘤对血液分布(表9)。具有1200硼对于抗EGFR1-Fab缀合物和抗EGFR1-F(ab’)2缀合物在24h时肿瘤/血液比率是大约7,并且该比率在48小时降至3-4,这表明标记的蛋白质降解并分泌离开细胞。具有800B硼的抗EGFR1-Fab缀合物的肿瘤/血液比率在所述两个时间点是大约4-5。对照缀合物的肿瘤/血液比率保持在恒定水平(大约1-2)。表9.FaDu肿瘤小鼠中硼缀合物的肿瘤/血液分布。对于血液样品,结果基于三次测定的平均数,对于肿瘤,基于六次测定的平均数(每只小鼠2个肿瘤)+/-S.D。硼缀合物24小时48小时抗EGFR-Fab-BSH(800)-dex4.4±2.25.5±1.5抗EGFR-Fab-BSH(1200)-dex6.9±2.83.4±2.0抗EGFR-Fab2-BSH(1200)-dex7.6±1.74.2±1.1对照-Fab-BSH(800)-dex1.8±0.51.5±0.2对照-Fab2-BSH(800)-dex1.7±0.41.2±0.4实施例9.通过电感耦合等离子体质谱法(ICP-MS)对BSH-葡聚糖中的硼定量(mol硼/molBSH-葡聚糖)从BSH-葡聚糖的质子-NMR谱估计BSH-葡聚糖的硼载量(图1)并且ICP-MS用来定量样品中硼的量。基于NMR分析,实施例中分析的BSH-葡聚糖样品据估计含有约1200个硼。基本上如Laakso等人,2001,ClinicalChemistry47,1796–1803中所述,将大约2.1μg(0.0228nmol)BSH-葡聚糖(平均MW92kDa)用微波辅助湿灰化法液化并通过ICP-MS分析。通过ICP-MS分析不同稀释度的样品并且从样品扣除背景硼。代表7次测定的平均数的结果显示,样品含有大约0.341μg(31.5nmol)硼原子或一摩尔BSH-葡聚糖含有1381摩尔硼原子。实施例10.体内实验和硼定量使用相同年龄的雌性成年小鼠(CharlesRiverCrl:无胸腺裸鼠Foxn1nu)。将EME-培养基和50%基质胶中的二百三十万个HSC-2或五百万个FaDu细胞在150μl中接种至裸鼠的右侧腹部。当肿瘤已经生长到尺寸至少6mm直径(6–10mm,大致对应于肿瘤体积100-500mm3)时,进行给药。抗EGFR-Fab-BSH(1200)-dex或抗EGFR-F(ab’)2-BSH(1200)-dex(二者均未标记)缀合物经尾静脉在100μlPBS中静脉内注射。注射的剂量是50μg或250μg/小鼠并且每样品使用三只小鼠。将小鼠在(24小时和48小时处死并且收集器官用于硼测定。组织样品(包括血液)在微波炉(Milestone,ETHOS1200)中的封闭teflon容器内消化。消化温度是200℃并且消化的持续时间是50分钟。消化中所用的酸是HNO3(6.0ml,E.Merck,Suprapur)。在冷却后,将所得到的溶液用Milli-Q水稀释至25ml。消化的样品用1%HNO3进一步稀释(1:10或1:50)供ICP-MS分析。将内标物铍添加至样品,以在样品中达到终浓度10ppbBe。浓度为1、5、10和20μg/L的分析用标准溶液从Spectrascan单元素标准溶液稀释(H2O中1000ug/ml作为H3BO3的硼)。从多元素标准溶液通过SPEX(CLM-4)制备分析用对照样品。用高分辨率扇形场电感耦合等离子体质谱仪(HR-ICP-MS,Element2,ThermoScientific)进分析。根据10B和11B的峰按低分辨率模式(R≈300)和中等分辨率模式(R≈4000)确定稀释样品中的硼浓度。在样品之间,将样品引入系统首先用5%HNO3洗涤并且随后用1%HNO3以排除对硼而言常见的记忆效应。在24小时两个HSC-2肿瘤小鼠的初始硼分析显示,硼肿瘤/肌肉比率是5.3和6.3。使用肌肉而非血液作为对照组织,因为来自血液的初始硼测量不确定或超出检测限。实施例11.14C标记的抗EGFR1FabBSH-葡聚糖的体内实验抗EGFR1FabBSH-葡聚糖的制备BSH-葡聚糖分别如实施例1和2中所述那样制备。根据NMR分析,BSH-葡聚糖含有大约650个硼。氧化如实施例3中所述那样进行,但是在两个批次中进行;一个具有50mgBSH-葡聚糖,另一个具有100mgBSH-葡聚糖。通过如实施例5中所述的木瓜蛋白酶消化法制备抗EGFR1Fab片段。缀合反应如实施例4中那样实施,但是在四个批次中实施:1)29mg氧化性BSH-葡聚糖和10.4mg抗EGFR1Fab、2)16.5mg氧化性BSH-葡聚糖和5.9mg抗EGFR1Fab、3)50mg氧化性BSH-葡聚糖和19.8mg抗EGFR1Fab、4)50mg氧化性BSH-葡聚糖和19.7mg抗EGFR1Fab,总计产生55.8mg抗EGFR1Fab。全部均在如实施例6中那样的SDS-PAGE中分析并且每份样品用AlexaFluor488-NHS标记。如实施例7中所述那样,用HSC-2细胞进行AlexaFluor488-NHS标记的分子的内化测定法。合并未标记的Fab-BSH-葡聚糖批次以产生39mg抗EGFR1FabBSH-葡聚糖。在合并未标记的和14C标记的抗EGFR1FabBSH-葡聚糖及后续无菌过滤之前,将样品缓冲液变成PBS中的5%甘露糖醇–0.1%Tween80。14C标记的抗EGFR1FabBSH-葡聚糖的制备通过(如实施例4中那样的)在含有NaCNBH3的PBS中与66μCi14C-乙醇胺(AmericanRadiolabeledChemicalsInc.)温育过夜,将3mgFab-BSH-葡聚糖(在乙醇胺封端前)进行14C标记,此后,用非放射性乙醇胺2小时完成封端,并且如实施例4中所述那样移除低分子量试剂。这种反应产生含有9.21μCi放射性活性的14C标记的抗EGFR1FabBSH-葡聚糖。对于动物研究,将14C标记的抗EGFR1FabBSH葡聚糖与未标记的“冷”抗EGFR1FabBSH葡聚糖按表10中所示的份数混合。表10.试验材料的制备。14C标记的抗EGFR1FabBSH-葡聚糖的体内实验异种移植物小鼠如实施例8中所述那样生成,不同在于HSC-2细胞接种在右侧腹部并且当肿瘤已经生长到尺寸大致对应于肿瘤体积200-800mm3的至少8mm直径(8–12mm)时进行给药。将放射标记(14C)的抗EGFR1-Fab硼缀合物经尾静脉按静脉内方式注射或通过瘤内注射法(组X)在含有5%甘露糖醇和0.1%聚山梨醇酯的100μlPBS中注射(表10中列出研究组)。每样品使用三只小鼠。向每只小鼠施用约400000cpm缀合物(见上文,动物研究用抗EGFR1FabBSH葡聚糖缀合物的制备;表10)。将小鼠在24小时或48小时(组IX)处死并且收集器官及计数放射性活性,以确定缀合物的组织生物分布。还在施用硼缀合物后30分钟、2小时和8小时采集血液样品。如实施例8中所述那样制备用于14C定量的组织。清除试验中的血液样品如实施例8中那样制备,例外是使用200μlSolvable和90μlH2O2。结果是三只小鼠的平均数。表11显示施用14C标记的抗EGFR1Fab葡聚糖缀合物的小鼠的肿瘤对血液比率。表11:HSC-2肿瘤小鼠中14C硼缀合物的肿瘤/血液比率。GIX的值是肿瘤/脑比率,因为测定血液中的放射性活性是0%(在扣除背景水平后全部血液样品均阴性)。组I:250μg;组II:500μg;组III:1000μg;组IV:1500μg;组V:2000μg;组X:250μg;组VIII:250μg+2小时后250μg;和组IX:250μg+24小时后250μg。全部组均静脉内施用,例外是组X瘤内施用。在24小时收集器官,例外是组IX在48小时收集器官。来自一只小鼠的组VIII肿瘤/血液比率(因该组中存在一个血液cpm值)。GIGIIGIIIGIVGVGXGVIIIGIX11.212.89.723.828.84394.39.36.2表12.三个组中14C硼缀合物的血液清除。左列显示施用后时间(min/小时)并且值是总注射剂量%/g血液。实施例12.通过直接硼定量的抗EGFR1FabBSH-葡聚糖体内实验抗EGFR1FabBSH-葡聚糖的制备抗EGFR1FabBSH-葡聚糖分别如实施例1和2中所述那样制备。氧化如实施例3中所述那样进行,但是在两个批次中进行;一个是80mgBSH-葡聚糖,另一个是96mgBSH-葡聚糖。根据NMR分析,BSH-葡聚糖样品分别含有大约880个硼和500个硼。如实施例5中所述通过木瓜蛋白酶消化法制备抗EGFR1Fab片段。缀合反应如实施例4中那样实施,但是在四个批次中实施:两个是15.7mg抗EGFR1Fab和40mg氧化性BSH-葡聚糖、其他两个是18.8mg抗EGFR1Fab和48mg氧化性BSH-葡聚糖。如实施例6中那样,全部硼缀合物均在SDS-PAGE中分析并且用Alexa488-NHS标记。如实施例7中所述HSC-2细胞内化测定法用AlexaFluor标记的分子进行。在小鼠试验样品制备和无菌过滤之前,将样品缓冲液变成PBS中的5%甘露糖醇–0.1%Tween80。抗EGFRFabBSH-葡聚糖的体内实验异种移植物小鼠如实施例11中那样生成。抗EGFRFabBSH-葡聚糖在100μl甘露糖醇/Tween/PBS溶液中静脉内施用或在40μl甘露糖醇/Tween/PBS溶液中瘤内(i.t.)施用。在瘤内施中,针头经单个注射部位通入肿瘤并且按细针吸取技术(fanningtechnique)移动以分布测试物质遍及整个肿瘤。取决于肿瘤尺寸和形状,使用总计三个或四次通入。在24小时收集器官并且在30分钟、2小时和8小时采集血液样品(研究组II和V)。硼定量制备组织用于如上文所述的ICP-MS直接硼定量。还消化含有约150mgNIS参比标准品1573番茄叶的三份对照样品。将消化的样品稀释至1:10或1:100。表13显示在选择的器官中的硼并且表14显示肿瘤对血液比率。与静脉内施用相比,瘤内施用显示显著较高的肿瘤硼浓度。表13.依据硼定量的HSC-2肿瘤小鼠中抗EGFR1FabBSH-葡聚糖缀合物的生物分布。结果代表四次测定的平均数+/-SEM。研究组是:组I:仅缓冲液(甘露糖醇/Tween/PBS),静脉内;组II:2mg,静脉内;组III:2mg+葡聚糖,静脉内;组IV:250μg,瘤内;组V:2mg,瘤内。值是以g器官计的μg硼。对于组II与组III并且对组IV与组V的肿瘤硼值进行Studentst检验(使用Statistica12软件[StatSoft])。组IV和组V显示硼量之间的显著差异(p值=0.009)。组II组III组IV组V组I血液0.56±0.180.87±0.140.1±0.050.22±0.010.32±0.21肝18.3±1.2517.54±1.151.02±0.336.97±0.860.27±0.09肾6.57±0.576.44±0.410.87±0.273.78±0.240.76±0.31肌肉1.87±0.341.51±0.90.56±0.250.7±0.310.87±0.51皮肤2.11±0.161.46±0.140.43±0.131.27±0.850.17±0.09肿瘤2.19±1.019.54±8.599.22±2.353.09±11.450.62±0.53脾4.95±0.95.91±0.882.01±0.51.88±0.591.34±0.53表14.肿瘤对血液比率+/-SEM。组II组III组IV组V组I10.8±7.113.6±12.5131.3±40.7240.8±49.44.6±3.6实施例13.大肠杆菌中产生抗EGFR1Fab优化抗EGFR1Fab周质分泌的信号肽抗EGFR1Fab的表达策略是靶向周质,在此可以形成稳定的二硫键。商业载体套件pDD441-SSKT(T5启动子,卡那霉素选择)用于信号肽优化。使用以下信号肽:i)MalE(麦芽糖结合蛋白)、ii)pelB(果胶酸盐裂合酶)、iii)ompA(外膜蛋白A)、iv)phoA(细菌碱性磷酸酯酶)和v)gIII(PRV包膜糖蛋白)。通过使用合成性DNA序列、高保真聚合酶的PCR扩增和无缝Gibson组合体作为例行工具,构建了载体pGF115–pGF119。此外,根据Carter等人1992:HighlevelE.coliexpressionandproductionofbivalenthumanizedantibodyfragment,Biotechnology(NY),10(2)163-7,构建含重链和轻链用信号肽stII(热稳定性肠毒素II)的载体pGF150。载体pGF150是双顺反子的并且具有T7启动子用于表达。抗EGFR1Fab的表达盒是双顺反子的,重链和轻链之间具有内部核糖体结合位点。图5中例举用于优化信号肽的通用表达载体结构。表15中列出载体pGF115–pGF119中的信号肽组合。表15.载体pGF115–pGF119中的信号肽组合。用程序Ec2脉冲,根据制造商的说明,将载体pGF115–pGF119用BioradGenePulser转化至电感受态大肠杆菌W3110(ATCC微生物学保藏中心)细胞。转化物铺种至LB+琼脂+卡那霉素25mg/L并在+37℃培养过夜。单菌落根据标准方案接受表达筛选。在第1天,将过夜预培养物接种至补充有终浓度20mg/L的卡那霉素的5ml液态LB,在+37℃220转/分钟振摇培养。在第2天,200μL过夜预培养物再接种至10mL液态LB+卡那霉素10mg/L。培养以220转/分钟振摇在+37℃继续进行,直至OD600达到0.6–0.9水平。用终浓度500μM的IPTG诱导Fab产生。培养以220转/分钟振摇在+20℃继续进行过夜。诱导后时间点4小时和过夜采集1mL样品。将细胞通过8000xG离心10分钟收获,弃去上清液,沉淀物重悬成100μl10xTEpH7.5(100mMTris-HCl、10mMEDTA)。将样品在室温强力涡旋混合1小时,按16000xG沉淀10分钟并将上清液作为周质提取物收集到新的微量离心管。周质提取物进一步用蛋白质印迹法分析。将100μl提取物与20μl还原性或非还原性上样缓冲液混合。将20μl混合物上样至4-20%PreciseTris-甘氨酸SDS-Page凝胶(ThermoScientific)。将凝胶在1xLaemmli运行缓冲液中在200V运行约45分钟并在Tris-甘氨酸印迹缓冲液中以350mA印迹至硝酸纤维素膜约5分钟。BioRadMini-protean系统用于SDS-Page和印迹。印迹的膜用PBS中的1%BSA封闭。用抗人IgG(Fab特异性)连同过氧化物酶缀合物(SigmaAldrich;目录号A0293)和LuminataForte蛋白质印迹HRP底物(Millipore;目录号WBLUF0500)进行检测。用Fujifilm发光图像分析仪LAS4000检测化学发光反应根据几种表达培养物的蛋白质印迹分析,载体pGF119和pGF115似乎比其他更好。然而在这些初步实验中,产生至周质的Fab的量保持在0.3–0.8mg/L的水平。选择载体pGF119中所用的组合(ompA信号肽用于HC和pelB信号肽用于LC)继续进行。将含有T7启动子和信号序列stII的载体pGF150转化至菌株BL21(DE3),所述信号序列stII用于导引抗EGFR1Fab的重链和轻链至周质。与其他载体相比,它看上去至少与载体pGF119中所用轻链用pelB和重链用ompA的一样好。优化启动子用于Fab表达初步筛选中使用三种不同的启动子:IPTG诱导型T5、IPTG诱导型T7和鼠李糖诱导型Rham。启动子序列源自商业载体pET-15b、pD441和pD881。信号肽ompA用于HC并且pelB用于LC。表达盒按双顺反子方式构建,内部核糖体结合位点taaGGATCCGAATTCAAGGAGATAAAAAatg(SEQIDNO:22)在每个载体中的重链和轻链之间。表16中展示载体代码和启动子。表16:用于Fab表达的启动子系统优化;所用的载体代码和启动子。载体启动子pGF119T5pGF121T7pGF132Rham将pGF119和pGF132如上文所述那样电穿孔至大肠杆菌菌株W3110。根据供应商提供的热休克方案,将T7启动子载体pGF121转化至化学感受态大肠杆菌BL21(DE3)细胞(NewEnglandBiolabs)。如上述那样进行表达培养、样品制备和周质提取物分析。首先,在菌株W3110pGF119和BL21(De3)pGF121之间进行比较。用10XTE缓冲液及用0.05%脱氧胆酸盐缓冲液平行产生周质提取物。如图6中例举,T7启动子略微好于T5启动子,不过差异并不非常明显。采用菌株W3110pGF119和BL21(De3)pGF121的重复实验无论如何都揭示,具有BL21(DE3)pGF121的表达培养物比W3110pGF119更稳定和更有重复性。用BL21(De3)pGF121实现了比W3110pGF119更快的生长速率和更高的细胞密度(数据未显示)。启动子筛选中的第二步骤是分析来自W3110pGF132(鼠李糖诱导型启动子)的小规模培养物的初步表达水平。鼠李糖诱导型启动子的优点之一是可以通过变动鼠李糖浓度精细调节表达水平。对于一些目的蛋白,较低表达水平实际上导致较高的总滴度,因为靶蛋白正确折叠和装配并且生产菌株的细胞密度较高。因此,用并行的10ml液态LB培养物中渐增浓度的鼠李糖(0、0.25mM、1mM、4mM和8mM)进行诱导。使用三个不同的诱导后温度:+20℃、+28℃和+37℃。在诱导后4小时的时间点收获1ml样品。采样、周质提取物和分析如实施例1中所述那样进行。如图7中所示,采用鼠李糖诱导型启动子时表达水平仍低于用BL21(De3)pGF121(T7启动子)实现的水平。用渐增浓度的鼠李糖调节启动子在+20℃最有效。无论如何,用鼠李糖系统在+28℃实现最高滴度。基于上文描述的重复实验,选择BL21(DE3)和T7启动子系统作为大肠杆菌中产生抗EGFR1Fab的基本平台。用于大肠杆菌细胞中表达的抗EGFR1Fab的密码子优化测试了具有不同针对大肠杆菌的密码子优化样式的三个HC/LC序列和最初针对CHO细胞优化的一个HC/LC序列。如对pGF119、双顺反子方式和T5启动子驱动表达所述那样构建载体。表达宿主是大肠杆菌W3110。如上述那样进行小规模培养、采样和周质提取物分析。选择载体pGF119中的序列作为基线水平。密码子优化样式对表达水平造成大幅度(表17)。大肠杆菌版本2序列(pGF128)和CHO细胞优化的序列(pGF126)在W3110宿主菌株中不工作,通过蛋白质印迹法仅从表达培养物检出衡量的Fab。用大肠杆菌版本3(pGF129)实现的表达水平显著更好,但是仍然类似于基线水平。因为大部分载体已经用大肠杆菌版本1(pGF119)产生并且因为与基线相比通过改变密码子优化样式未产生改善,因此选用来自载体pGF119的大肠杆菌版本1序列(SEQIDNO:10和SEQIDNO:11)。表17.测试密码子优化样式不同的抗EGFR1Fab编码序列。载体编码和结果。比较双顺反子载体结构与双重启动子载体结构。在双顺反子载体结构中,重链和轻链之间的间隔序列(包含核糖体结合位点)相对短,pGF119中仅25个核苷酸。为了扩大重链和轻链之间的这个间距,构建载体pGF120和pGF131,其中两条链分别在独立的T5或T7启动子控制下表达。通过利用双顺反子载体pGF121上的现存序列,构建载体。一旦完成,将pGF120电穿孔至菌株W3110并将pGF131转化至化学感受态BL21(DE3)和Lemo21(De3)大肠杆菌细胞。小规模表达试验如上进行并且在双顺反子载体和双重启动子载体(pGF119与pGF120;pGF121与pGF131)之间作比较。如图8中证明,双重T5启动子比双顺反子结构明显更高效地产生抗EGFR1Fab。采用T7启动子时,差异不是那样明显,但是注意采用双重启动子系统时出现了比采用双顺反子结构时数量更多的未装配的Fab链。计划的下一个优化步骤是对表达菌株采用伴侣蛋白辅助质粒以促进正确折叠和装配。选择具有T7启动子的双重启动子结构(载体pGF131)继续进行。伴侣蛋白辅助质粒的构建为了增强Fab表达,选择周质伴侣蛋白和细胞质伴侣蛋白用于随载体pGF131共表达。作为伴侣蛋白辅助质粒的骨架载体,选择pCDF-1b(Novagen)。pCDF-1b具有T7启动子、lac操纵基因、衍生自CloDF13的复制起点和链霉素/壮观霉素抗生素耐药性。它相容于采用pET载体的共表达并且适合与具有pET-15b骨架的pGF133一起表达。用PCR和高保真phusion聚合酶(ThermoScientific)从大肠杆菌基因组DNAPCR扩增伴侣蛋白序列。利用传统消化/连接克隆和无缝Gibson组合体,将扩增的片段克隆至pCDF-1b主链。表18-20.5–7中更详细地描述伴侣蛋白辅助质粒的结构。表18.伴侣蛋白辅助质粒pGF134、pGF135、pGF137、pGF138的克隆策略表19.用于构建伴侣蛋白辅助质粒的引物序列。表20.所用的伴侣蛋白采用辅助质粒的抗EGFR1Fab共表达根据制造商的说明,将载体pGF131转化至化学感受态BL21(DE3)和Lemo21(De3)细胞。挑出少数克隆并且如上文所述,通过初步表达培养验证抗EGFR1Fab的表达。选择最佳克隆作为采用伴侣蛋白辅助质粒共表达的背景。电感受态BL21(De3)pGF131和Lemo21(De3)pGF131细胞如下构建。5ml预培养物在补充有卡那霉素20mg/L的液态LB中培养过夜。在第2天,1ml预培养物再接种至含卡那霉素20mg/L的50ml液态LB。培养在220转/分钟,+37℃继续进行约3小时,直至OD600达到0.5水平。将细胞通过8000xg离心10分钟收获并且重悬入10ml10%冰冷的甘油。重复离心收获,随后重悬至5ml10%冰冷的甘油。细胞分成10x500ul等分试样并贮存在-80℃。将伴侣蛋白辅助质粒pGF134和pGF135用BioRadGenePulser、程序Ec2电穿孔至BL21(DE3)和Lemo21(De3)菌株。将混合物在+37℃短时预培养后铺种至LB+km+stre并且将平板在+37℃过夜培育。如上产生初步表达培养物。如图9中例举,SKP伴侣蛋白对产生过程具有明显有益的作用,但是与仅携带表达质粒pGF131的背景菌株的差异不明显。无论如何,具有伴侣蛋白辅助质粒的克隆倾向于生长得更快并实现更高的细胞密度。具有伴侣蛋白辅助质粒pGF134的培养物也更可重复及更稳定。在周质伴侣蛋白辅助质粒pGF4134(SKP伴侣蛋白)和pGF135(SKP和FkpA伴侣蛋白)之间不存在差异。来自辅助质粒pGF138的细胞质伴侣蛋白DnaK/JGrpE表达未进一步改善表达水平。选择其菌株Lemo21(De3)pGF131pGF134和BL21(De3)pGF131pGF134用于继续进行和发酵方法开发。抗EGFR单链构建了具有信号序列ompA(SEQIDNO:13)的抗EGFR1scFv的表达载体pGF155并且用高保真聚合酶和Gibson组合体PCR扩增至pET-15b主链。在构建体中,编码轻链可变区和重链可变区的多核苷酸由编码SEQIDNO:30中所述的15-mer接头序列的G4S接头/间隔序列(SEQIDNO:29)分割。将载体pGF155单独或与伴侣蛋白辅助质粒组合转化至背景菌株BL21(DE3),并且基于10mL初步培养物评价表达水平。发酵培养的大肠杆菌菌株(BL21[DE3]pGF131pGF134)中的抗EGFR1Fab产生;补充有酵母提取物的培养物。接种将来自LB琼脂平板的几个(5-8个菌落)大肠杆菌菌落(BL21[DE3]pGF131pGF134)接种于补充有卡那霉素(25mg/L)和链霉素(30mg/L)的5ml液态LB培养基中。将接种物(第一接种物)在+37℃、220转/分钟温育5小时。1ml第一接种物用来接种500ml摇瓶中补充有卡那霉素(25mg/L)和链霉素(30mg/L)的100ml接种物培养基(下文)(第二接种物)。第二接种物在+37℃、220转/分钟温育<16小时。将10ml第二接种物转移入500ml摇瓶中补充有卡那霉素(25mg/L)和链霉素(30mg/L)的100ml接种物培养基(下文)(第三接种物)。第三接种物在+37℃、220转/分钟温育,直至达到OD600约2.0,并且这种接种物用来接种发酵培养罐(2l)中补充有卡那霉素(25mg/L)和链霉素(30mg/L)的900ml发酵罐分批培养培养基(下文),产生1000ml终体积,OD600值是0.2。表21.接种培养基组分(微量金属元素[TME]从FeCl3x6H2O至MgSO4x7H2O)。试剂Mw(g/mol)mg/lc(mmol/l)Na2HPO4x2H2O177,99860048,317K2HPO4174,2300O17,222NH4Cl53,49100018,695NaCl58,445008,556FeCl3x6H2O270,33660,245H3BO361,8330,045MnCl3x2H2O161,87120,076EDTAx2H2O372,248,40,023CuCl2x2H2O170,481,50,005Na2MoO4x2H2O429,892,50,006CoCl2x6H2O237,932,50,011ZnSO4x7H2O287,54100,036葡萄糖180,161000055,506MgSO4x7H2O246,476002,434表22.发酵分批培养培养基(微量金属元素[TME]从FeCl3x6H2O至MgSO4x7H2O)。试剂Mw(g/mol)mg/lc(mmol/l)K2HPO4174,21660095,293(NH4)2HPO4132,07400030,287柠檬酸x1H2O210,14229710,931FeCl3x6H2O270,33830,306H3BO361,833,80,061MnCl2x2H2O161,87150,095EDTAx2H2O372,2410,50,028CuCl2x2H2O170,481,90,011Na2MoO4x2H2O429,893,10,007CoCl2x6H2O237,933,10,013ZnSO4x7H2O287,54130,046葡萄糖180,1625000138,766MgSO4x7H2O246,4715006,086发酵分批阶段在接种发酵培养物罐后,使用BPlus数字控制单元设置以下参数:-温度+37℃-pH6.8(12.5%NH3、15%H3PO4)-pO2(级联模式)>25%-搅拌速率15%-75%(=300转/分钟–1500转/分钟)-气流量(空气)13%-50%(=0.4L–1.5L)在发酵分批阶段约8.5小时的时间点,DOT(溶解氧张力)值剧烈增高,导致搅拌速度和气流量减少。这表明分批培养培养基中的葡萄糖(25g/l)耗尽并且发酵分批阶段结束。在发酵分批阶段期间达到OD600值31。发酵补料分批阶段将FS(进料溶液)1.1(67%Glc、2%MgSO4)泵送入发酵培养罐,0.24mL/分钟,持续6小时20分钟。在这个FS1.1补料分批阶段期间,达到OD600值70。将FS1.2(50%Glc、1.5%MgSO4、7.4g/100mL酵母提取物,与发酵分批培养培养基相比15倍TME[微量金属元素]浓度、0.32g/L硫胺素)泵送入发酵培养罐,0.24mL/分钟,持续7小时。达到OD600值134。在此时刻,泵送速度降低至0.13mL/分钟,持续11小时40分钟。OD600值自134不增加。另外,在不补充酵母提取物的情况下进行另一个发酵,并且根据下文的蛋白质印迹分析估计,这个发酵罐产生约20mg/L抗EGFR1Fab,。在补料分批阶段期间,根据制造商的说明书使用Keto-diabur-检查5000棒(Roche,目录号号10647705187),追踪培养物悬液中的葡萄糖浓度。蛋白质合成的诱导在IPTG诱导蛋白质合成之前,培养温度从+37℃降至+20℃。在OD600值86,IPTG诱导蛋白质合成(IPTG终浓度1mM)。实施蛋白质合成的诱导16小时。在发酵轮次期间收集样品在不同时间点收集用于蛋白质印迹分析的样品(2X1mL沉淀物样品和2X1mL上清液样品)。紧邻IPTG诱导蛋白质合成前采集诱导前样品。在4小时的诱导时间点收集另一组样品。在收获培养物之前在16小时的诱导时间点收集最后一组样品。将样品中的细胞沉淀(+4℃,5000Xg,15分钟)并将上清液转移在新管中。样品贮存在-20℃直至使用蛋白质印迹法分析。细胞收获使用WatsonMarlow504U056.3762.00泵在SLA3000离心管(SorvallRC6)中收集发酵培养物悬液,并且平衡离心管。将细胞沉淀(+4℃,5000Xg,60分钟)并抛弃上清液。细胞沉淀贮存在-20℃。周质表达的抗EGFR1Fab的蛋白质印迹分析代表1mL发酵培养物悬液的沉淀物样品重悬于1mL10xTEpH7.5(100mMTris-HCl,10mMEDTA)中。将样品在室温强力涡旋混合2小时,在+4℃以12,000xg沉淀10分钟并将上清液作为周质提取物收集。周质提取物进一步用蛋白质印迹法分析。100μL提取物与25μL非还原性上样缓冲液混合。将12.5μL混合物上样至4-20%PreciseTris-甘氨酸SDS-Page凝胶(ThermoScientific)。将凝胶在1xLaemmli运行缓冲液中在200V运行约45分钟,并在Tris-甘氨酸印迹缓冲液中印迹至硝酸纤维素膜,350mA印迹约1.5小时。BioRadMini-protean系统用于SDS-Page和印迹。印迹的膜用PBS中的1%BSA封闭。用抗人IgG(Fab特异性)连同过氧化物酶缀合物(SigmaAldrich;目录号A0293)和LuminataForte蛋白质印迹HRP底物(Millipore;目录号WBLUF0500)进行检测。用Fujifilm发光图像分析仪LAS4000检测化学发光反应10μL每份培养上清液样品与2.5μL非还原性上样缓冲液混合并且如上文对周质提取物样品所述那样,将这些样品在SDS-PAGE凝胶中电泳并印迹在硝酸纤维素膜上。图10中显示结果。Fab纯化在借助5ml阳离子交换柱(HiTrapSPFF,GEHealthcare)的第一纯化步骤之前,使用AmiconUltra10K离心滤器,将过滤的周质提取物的缓冲液交换成50mMMESpH6。移动相A是50mMMESpH6并且流动相B是50mMMESpH6+500mMNaCl。运行前,通过1.2μm膜过滤样品。首先,将10%样品按流速2.5ml/分钟持续5分钟注射至该柱,此后,将流速变成5ml/分钟。该柱用57.5ml相A运行,并且随后施加35ml范围内从0%B至100%B的线性梯度。收集2.5mL级分并汇集级分A5-A9。其余样品在两个独立的试验中如上文所述那样运行并且汇集级分A5-A10(图11)。使用木瓜蛋白酶消化的抗EGFR1Fab作为对照。在不改变缓冲液的情况下,将汇集的级分(A5-A10)注射在蛋白L柱(1ml)上。蛋白L在样品注射期间按流速0.2ml/分钟运行并且在洗涤和洗脱期间按流速1mL/分钟运行。移动相A是PBS并且移动相B是pH3的0.1M柠檬酸钠。将样品用100%B洗脱。蛋白质洗脱具有锐峰(图12)并将级分A5-A7汇集并用2MTris-HClpH9中和。在两个纯化步骤后,估计Fab的产率是约44mg/L。另一个批次仅经历蛋白L纯化并且这产生约72mg/L的Fab级分。使用木瓜蛋白酶消化的抗EGFR1Fab作为对照。在SDS-PAGE中分析汇集的级分。来自采用蛋白L柱的色谱试验的这三个汇集样品的每份样品24μL与6μL还原性上样缓冲液混合,并且在SDS-PAGE凝胶中运行。凝胶用基于考马斯的染液染色(图13)。实施例14.抗EGFR1Fab和抗EGFR1FabBSH-葡聚糖与EGFR1的结合CHO细胞产生的蛋白A纯化的抗EGFR1用木瓜蛋白酶消化,用NAb蛋白A加离心柱纯化并用重组EndoF2(脑膜炎败血伊丽莎白菌(Elizabethkingiameningosepticum)(大肠杆菌中产生,Calbiochem)处理,所述重组EndoF2切割双天线状低聚糖和高甘露糖,将GlcNAc单元留给天冬酰胺,从而获得非糖基化的Fab片段。将100mU添加至大约1mg抗EGFR1Fab并且在+37℃在50mMNaAcpH4.5中温育过夜。使用单反应性AmershamCy3根据生产商说明书,将100μg抗EGFR1Fab和100μg抗EGFR1FabBSH-葡聚糖进行Cy3-标记,并且在柠檬酸盐/磷酸盐缓冲液pH7中制备0.5mg/ml溶液待用于微阵列印刷。将六种不同分子(HER2、人EGFR1、CD64、CD16a、HSA和抗葡聚糖IgG)的阵列印刷在胺反应性N-羟基琥珀酰亚胺(NHS)活化的微阵列载玻片上(每分子四个平行点)。在载玻片的独立孔上以范围0.4nM至900nM的8个浓度温育Cy3-标记的抗EGFR1FabBSH-葡聚糖缀合物和抗EGFR1Fab。使用10x未缀合的BSH葡聚糖去除非特异性结合。在洗涤载玻片后,使用激光扫描仪检测荧光信号。从四个平行数据点计算每个浓度点的平均强度和标准偏差。通过数据对以下格缪尔等温线拟合,计算Kd值:F=(Fmax[p])/([p]+Kd)其中F=荧光强度,Fmax=饱和时的最大强度,[p]=Cy3标记的分子的浓度并且Kd=解离常数。抗EGFR1FabBSH-葡聚糖缀合物与EGFR1结合,解离常数约Kd=97nM。未缀合的Fab对EGFR1的亲和力并抗EGFR1FabBSH葡聚糖高约2倍(图14)。抗EGFR1FabBSH-葡聚糖或未缀合的Fab与HER2、CD64、CD16a、HSA或抗葡聚糖IgG的结合作用低于检测限。所属
技术领域:
的技术人员显而易见的是,随着技术进步,本发明的基本构思可以按多种方式实施。本发明和其实施方案因此不限于上文描述的实施例,它们可以在权利要求书范围内变动。序列表<110>腾博龙公司<120>缀合物<130>P-WO90874M<150>FI20155114<151>2015-02-20<150>FI20145552<151>2014-06-13<160>30<170>BiSSAP1.3<210>1<211>1210<212>PRT<213>人(Homosapiens)<220><223>EGF受体,人NP_005219.2<400>1MetArgProSerGlyThrAlaGlyAlaAlaLeuLeuAlaLeuLeuAla151015AlaLeuCysProAlaSerArgAlaLeuGluGluLysLysValCysGln202530GlyThrSerAsnLysLeuThrGlnLeuGlyThrPheGluAspHisPhe354045LeuSerLeuGlnArgMetPheAsnAsnCysGluValValLeuGlyAsn505560LeuGluIleThrTyrValGlnArgAsnTyrAspLeuSerPheLeuLys65707580ThrIleGlnGluValAlaGlyTyrValLeuIleAlaLeuAsnThrVal859095GluArgIleProLeuGluAsnLeuGlnIleIleArgGlyAsnMetTyr100105110TyrGluAsnSerTyrAlaLeuAlaValLeuSerAsnTyrAspAlaAsn115120125LysThrGlyLeuLysGluLeuProMetArgAsnLeuGlnGluIleLeu130135140HisGlyAlaValArgPheSerAsnAsnProAlaLeuCysAsnValGlu145150155160SerIleGlnTrpArgAspIleValSerSerAspPheLeuSerAsnMet165170175SerMetAspPheGlnAsnHisLeuGlySerCysGlnLysCysAspPro180185190SerCysProAsnGlySerCysTrpGlyAlaGlyGluGluAsnCysGln195200205LysLeuThrLysIleIleCysAlaGlnGlnCysSerGlyArgCysArg210215220GlyLysSerProSerAspCysCysHisAsnGlnCysAlaAlaGlyCys225230235240ThrGlyProArgGluSerAspCysLeuValCysArgLysPheArgAsp245250255GluAlaThrCysLysAspThrCysProProLeuMetLeuTyrAsnPro260265270ThrThrTyrGlnMetAspValAsnProGluGlyLysTyrSerPheGly275280285AlaThrCysValLysLysCysProArgAsnTyrValValThrAspHis290295300GlySerCysValArgAlaCysGlyAlaAspSerTyrGluMetGluGlu305310315320AspGlyValArgLysCysLysLysCysGluGlyProCysArgLysVal325330335CysAsnGlyIleGlyIleGlyGluPheLysAspSerLeuSerIleAsn340345350AlaThrAsnIleLysHisPheLysAsnCysThrSerIleSerGlyAsp355360365LeuHisIleLeuProValAlaPheArgGlyAspSerPheThrHisThr370375380ProProLeuAspProGlnGluLeuAspIleLeuLysThrValLysGlu385390395400IleThrGlyPheLeuLeuIleGlnAlaTrpProGluAsnArgThrAsp405410415LeuHisAlaPheGluAsnLeuGluIleIleArgGlyArgThrLysGln420425430HisGlyGlnPheSerLeuAlaValValSerLeuAsnIleThrSerLeu435440445GlyLeuArgSerLeuLysGluIleSerAspGlyAspValIleIleSer450455460GlyAsnLysAsnLeuCysTyrAlaAsnThrIleAsnTrpLysLysLeu465470475480PheGlyThrSerGlyGlnLysThrLysIleIleSerAsnArgGlyGlu485490495AsnSerCysLysAlaThrGlyGlnValCysHisAlaLeuCysSerPro500505510GluGlyCysTrpGlyProGluProArgAspCysValSerCysArgAsn515520525ValSerArgGlyArgGluCysValAspLysCysAsnLeuLeuGluGly530535540GluProArgGluPheValGluAsnSerGluCysIleGlnCysHisPro545550555560GluCysLeuProGlnAlaMetAsnIleThrCysThrGlyArgGlyPro565570575AspAsnCysIleGlnCysAlaHisTyrIleAspGlyProHisCysVal580585590LysThrCysProAlaGlyValMetGlyGluAsnAsnThrLeuValTrp595600605LysTyrAlaAspAlaGlyHisValCysHisLeuCysHisProAsnCys610615620ThrTyrGlyCysThrGlyProGlyLeuGluGlyCysProThrAsnGly625630635640ProLysIleProSerIleAlaThrGlyMetValGlyAlaLeuLeuLeu645650655LeuLeuValValAlaLeuGlyIleGlyLeuPheMetArgArgArgHis660665670IleValArgLysArgThrLeuArgArgLeuLeuGlnGluArgGluLeu675680685ValGluProLeuThrProSerGlyGluAlaProAsnGlnAlaLeuLeu690695700ArgIleLeuLysGluThrGluPheLysLysIleLysValLeuGlySer705710715720GlyAlaPheGlyThrValTyrLysGlyLeuTrpIleProGluGlyGlu725730735LysValLysIleProValAlaIleLysGluLeuArgGluAlaThrSer740745750ProLysAlaAsnLysGluIleLeuAspGluAlaTyrValMetAlaSer755760765ValAspAsnProHisValCysArgLeuLeuGlyIleCysLeuThrSer770775780ThrValGlnLeuIleThrGlnLeuMetProPheGlyCysLeuLeuAsp785790795800TyrValArgGluHisLysAspAsnIleGlySerGlnTyrLeuLeuAsn805810815TrpCysValGlnIleAlaLysGlyMetAsnTyrLeuGluAspArgArg820825830LeuValHisArgAspLeuAlaAlaArgAsnValLeuValLysThrPro835840845GlnHisValLysIleThrAspPheGlyLeuAlaLysLeuLeuGlyAla850855860GluGluLysGluTyrHisAlaGluGlyGlyLysValProIleLysTrp865870875880MetAlaLeuGluSerIleLeuHisArgIleTyrThrHisGlnSerAsp885890895ValTrpSerTyrGlyValThrValTrpGluLeuMetThrPheGlySer900905910LysProTyrAspGlyIleProAlaSerGluIleSerSerIleLeuGlu915920925LysGlyGluArgLeuProGlnProProIleCysThrIleAspValTyr930935940MetIleMetValLysCysTrpMetIleAspAlaAspSerArgProLys945950955960PheArgGluLeuIleIleGluPheSerLysMetAlaArgAspProGln965970975ArgTyrLeuValIleGlnGlyAspGluArgMetHisLeuProSerPro980985990ThrAspSerAsnPheTyrArgAlaLeuMetAspGluGluAspMetAsp99510001005AspValValAspAlaAspGluTyrLeuIleProGlnGlnGlyPhePhe101010151020SerSerProSerThrSerArgThrProLeuLeuSerSerLeuSerAla1025103010351040ThrSerAsnAsnSerThrValAlaCysIleAspArgAsnGlyLeuGln104510501055SerCysProIleLysGluAspSerPheLeuGlnArgTyrSerSerAsp106010651070ProThrGlyAlaLeuThrGluAspSerIleAspAspThrPheLeuPro107510801085ValProGluTyrIleAsnGlnSerValProLysArgProAlaGlySer109010951100ValGlnAsnProValTyrHisAsnGlnProLeuAsnProAlaProSer1105111011151120ArgAspProHisTyrGlnAspProHisSerThrAlaValGlyAsnPro112511301135GluTyrLeuAsnThrValGlnProThrCysValAsnSerThrPheAsp114011451150SerProAlaHisTrpAlaGlnLysGlySerHisGlnIleSerLeuAsp115511601165AsnProAspTyrGlnGlnAspPhePheProLysGluAlaLysProAsn117011751180GlyIlePheLysGlySerThrAlaGluAsnAlaGluTyrLeuArgVal1185119011951200AlaProGlnSerSerGluPheIleGlyAla12051210<210>2<211>449<212>PRT<213>人工序列<220><223>重链,西妥昔单抗,INN7906H,来自IMGT<400>2GlnValGlnLeuLysGlnSerGlyProGlyLeuValGlnProSerGln151015SerLeuSerIleThrCysThrValSerGlyPheSerLeuThrAsnTyr202530GlyValHisTrpValArgGlnSerProGlyLysGlyLeuGluTrpLeu354045GlyValIleTrpSerGlyGlyAsnThrAspTyrAsnThrProPheThr505560SerArgLeuSerIleAsnLysAspAsnSerLysSerGlnValPhePhe65707580LysMetAsnSerLeuGlnSerAsnAspThrAlaIleTyrTyrCysAla859095ArgAlaLeuThrTyrTyrAspTyrGluPheAlaTyrTrpGlyGlnGly100105110ThrLeuValThrValSerAlaAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysArgValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGlyGlyPro225230235240SerValPheLeuPheProProLysProLysAspThrLeuMetIleSer245250255ArgThrProGluValThrCysValValValAspValSerHisGluAsp260265270ProGluValLysPheAsnTrpTyrValAspGlyValGluValHisAsn275280285AlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArgVal290295300ValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLysGlu305310315320TyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGluLys325330335ThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyrThr340345350LeuProProSerArgGluGluMetThrLysAsnGlnValSerLeuThr355360365CysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrpGlu370375380SerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProValLeu385390395400AspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAspLys405410415SerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHisGlu420425430AlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerProGly435440445Lys<210>3<211>214<212>PRT<213>人工序列<220><223>轻链,西妥昔单抗,INN7906L,来自IMGT<400>3AspIleLeuLeuThrGlnSerProValIleLeuSerValSerProGly151015GluArgValSerPheSerCysArgAlaSerGlnSerIleGlyThrAsn202530IleHisTrpTyrGlnGlnArgThrAsnGlySerProArgLeuLeuIle354045LysTyrAlaSerGluSerIleSerGlyIleProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuSerIleAsnSerValGluSer65707580GluAspIleAlaAspTyrTyrCysGlnGlnAsnAsnAsnTrpProThr859095ThrPheGlyAlaGlyThrLysLeuGluLeuLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>4<211>453<212>PRT<213>人工序列<220><223>尼妥珠单抗_HC<400>4GlnValGlnLeuGlnGlnSerGlyAlaGluValLysLysProGlySer151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrAsnTyr202530TyrIleTyrTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpIle354045GlyGlyIleAsnProThrSerGlyGlySerAsnPheAsnGluLysPhe505560LysThrArgValThrIleThrValAspGluSerThrAsnThrAlaTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaPheTyrPheCys859095AlaArgGlnGlyLeuTrpPheAspSerAspGlyArgGlyPheAspPhe100105110TrpGlyGlnGlySerThrValThrValSerSerAlaSerThrLysGly115120125ProSerValPheProLeuAlaProSerSerLysSerThrSerGlyGly130135140ThrAlaAlaLeuGlyCysLeuValLysAspTyrPheProGluProVal145150155160ThrValSerTrpAsnSerGlyAlaLeuThrSerGlyValHisThrPhe165170175ProAlaValLeuGlnSerSerGlyLeuTyrSerLeuSerSerValVal180185190ThrValProSerSerSerLeuGlyThrGlnThrTyrIleCysAsnVal195200205AsnHisLysProSerAsnThrLysValAspLysArgValGluProLys210215220SerCysAspLysThrHisThrCysProProCysProAlaProGluLeu225230235240LeuGlyGlyProSerValPheLeuPheProProLysProLysAspThr245250255LeuMetIleSerArgThrProGluValThrCysValValValAspVal260265270SerHisGluAspProGluValLysPheAsnTrpTyrValAspGlyVal275280285GluValHisAsnAlaLysThrLysProArgGluGluGlnTyrAsnSer290295300ThrTyrArgValValSerValLeuThrValLeuHisGlnAspTrpLeu305310315320AsnGlyLysGluTyrLysCysLysValSerAsnLysAlaLeuProAla325330335ProIleGluLysThrIleSerLysAlaLysGlyGlnProArgGluPro340345350GlnValTyrThrLeuProProSerArgGluGluMetThrLysAsnGln355360365ValSerLeuThrCysLeuValLysGlyPheTyrProSerAspIleAla370375380ValGluTrpGluSerAsnGlyGlnProGluAsnAsnTyrLysThrThr385390395400ProProValLeuAspSerAspGlySerPhePheLeuTyrSerLysLeu405410415ThrValAspLysSerArgTrpGlnGlnGlyAsnValPheSerCysSer420425430ValMetHisGluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSer435440445LeuSerProGlyLys450<210>5<211>219<212>PRT<213>人工序列<220><223>尼妥珠单抗_LC<400>5AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgSerSerGlnAsnIleValHisSer202530AsnGlyAsnThrTyrLeuAspTrpTyrGlnGlnThrProGlyLysAla354045ProLysLeuLeuIleTyrLysValSerAsnArgPheSerGlyValPro505560SerArgPheSerGlySerGlySerGlyThrAspPheThrPheThrIle65707580SerSerLeuGlnProGluAspIleAlaThrTyrTyrCysPheGlnTyr859095SerHisValProTrpThrPheGlyGlnGlyThrLysLeuGlnIleThr100105110ArgGluValAlaAlaProSerValPheIlePheProProSerAspGlu115120125GlnLeuLysSerGlyThrAlaSerValValCysLeuLeuAsnAsnPhe130135140TyrProArgGluAlaLysValGlnTrpLysValAspAsnAlaLeuGln145150155160SerGlyAsnSerGlnGluSerValThrGluGlnAspSerLysAspSer165170175ThrTyrSerLeuSerSerThrLeuThrLeuSerLysAlaAspTyrGlu180185190LysHisLysValTyrAlaCysGluValThrHisGlnGlyLeuSerSer195200205ProValThrLysSerPheAsnArgGlyGluCys210215<210>6<211>226<212>PRT<213>人工序列<220><223>重链Fab<400>6GlnValGlnLeuLysGlnSerGlyProGlyLeuValGlnProSerGln151015SerLeuSerIleThrCysThrValSerGlyPheSerLeuThrAsnTyr202530GlyValHisTrpValArgGlnSerProGlyLysGlyLeuGluTrpLeu354045GlyValIleTrpSerGlyGlyAsnThrAspTyrAsnThrProPheThr505560SerArgLeuSerIleAsnLysAspAsnSerLysSerGlnValPhePhe65707580LysMetAsnSerLeuGlnSerAsnAspThrAlaIleTyrTyrCysAla859095ArgAlaLeuThrTyrTyrAspTyrGluPheAlaTyrTrpGlyGlnGly100105110ThrLeuValThrValSerAlaAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysArgValGluProLysSerCysAspLys210215220ThrHis225<210>7<211>238<212>PRT<213>人工序列<220><223>重链F(ab')2<400>7GlnValGlnLeuLysGlnSerGlyProGlyLeuValGlnProSerGln151015SerLeuSerIleThrCysThrValSerGlyPheSerLeuThrAsnTyr202530GlyValHisTrpValArgGlnSerProGlyLysGlyLeuGluTrpLeu354045GlyValIleTrpSerGlyGlyAsnThrAspTyrAsnThrProPheThr505560SerArgLeuSerIleAsnLysAspAsnSerLysSerGlnValPhePhe65707580LysMetAsnSerLeuGlnSerAsnAspThrAlaIleTyrTyrCysAla859095ArgAlaLeuThrTyrTyrAspTyrGluPheAlaTyrTrpGlyGlnGly100105110ThrLeuValThrValSerAlaAlaSerThrLysGlyProSerValPhe115120125ProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAlaLeu130135140GlyCysLeuValLysAspTyrPheProGluProValThrValSerTrp145150155160AsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaValLeu165170175GlnSerSerGlyLeuTyrSerLeuSerSerValValThrValProSer180185190SerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLysPro195200205SerAsnThrLysValAspLysArgValGluProLysSerCysAspLys210215220ThrHisThrCysProProCysProAlaProGluLeuLeuGly225230235<210>8<211>324<212>DNA<213>人工序列<220><223>抗-EGFR1_LC_可变_DNA<400>8gatattctgctgacccagtcaccggttattctgagcgttagtccgggtgaacgtgttagc60tttagctgtcgtgcaagccagagcattggcaccaatattcattggtatcagcagcgtacc120aatggtagtccgcgtctgctgatcaaatatgcaagcgaaagcattagcggtattccgagc180cgttttagcggttctggtagcggcaccgattttaccctgagtattaatagcgttgaaagc240gaagatatcgccgattattactgccagcaaaataacaattggccgaccacctttggtgca300ggtacaaaactggaactgaaataa324<210>9<211>357<212>DNA<213>人工序列<220><223>抗-EGFR1_HC_可变_DNA<400>9caggtgcagctgaaacagagcggtccgggtctggttcagccgagccagagcctgagcatt60acctgtaccgttagcggttttagcctgaccaattatggtgttcattgggttcgtcagagt120ccgggtaaaggtctggaatggctgggtgttatttggagcggtggtaataccgattataac180accccgtttaccagccgtctgagcatcaataaagataatagcaaaagccaggtgttcttt240aaaatgaatagcctgcagagcaatgataccgccatctattattgtgcacgtgccctgaca300tattatgattatgaatttgcatattggggacagggcaccctggttaccgttagtgcc357<210>10<211>645<212>DNA<213>人工序列<220><223>anti-EGFR1FablightchainDNA,codonoptimizedforE.coli<400>10gatattctgctgacccagagtccggttattctgagcgttagtccgggtgaacgtgttagc60tttagctgtcgtgcaagccagagcattggcaccaatattcattggtatcagcagcgtacc120aatggtagtccgcgtctgctgatcaaatatgcaagcgaaagcattagcggtattccgagc180cgttttagcggtagcggtagtggcaccgattttaccctgagcattaatagcgttgaaagc240gaagatatcgccgattattactgccagcagaacaataattggccgaccacctttggtgca300ggtacaaaactggaactgaaacgtaccgttgcagcaccgagcgtttttatctttccgcct360agtgatgaacagctgaaaagcggcaccgcaagcgttgtttgtctgctgaataacttttat420ccgcgtgaagcaaaagttcagtggaaagttgataatgcactgcagagcggtaatagccaa480gaaagcgttaccgaacaggatagcaaagatagcacctatagcctgagcagcaccctgacc540ctgagtaaagcagattatgaaaaacacaaagtgtatgcctgcgaagttacccatcagggt600ctgagcagtccggtgaccaaaagctttaatcgtggtgaatgttaa645<210>11<211>678<212>DNA<213>人工序列<220><223>抗-EGFR1Fab重链DNA,针对E.coli进行密码子优化<400>11caggtgcagctgaagcagtccggccctggcctggtgcagccttcccagtccctgtccatc60acctgtaccgtgtccggcttctccctgaccaactacggcgtgcactgggtgcgacagtcc120cccggcaagggcctggaatggctgggagtgatttggagcggcggcaacaccgactacaac180acccccttcacctcccggctgtccatcaacaaggacaactccaagtcccaggtgttcttc240aagatgaactccctgcagtccaacgacaccgccatctactactgcgccagagccctgacc300tactatgactacgagttcgcctactggggccagggcaccctggtgacagtgtccgccgct360tccaccaagggcccctccgtgttccctctggccccctccagcaagtccacctctggcggc420accgctgccctgggctgtctggtgaaagactacttccccgagcccgtgaccgtgtcctgg480aactctggcgccctgacctccggcgtgcacaccttccctgccgtgctgcagtcctccggc540ctgtactccctgtcctccgtggtgaccgtgccctccagctctctgggcacccagacctac600atctgcaacgtgaaccacaagccctccaacaccaaggtggacaagcgggtggaacccaag660tcctgcgacaagacccac678<210>12<211>726<212>DNA<213>人工序列<220><223>抗-EGFR1_scFV_DNA<400>12caggtgcagctgaaacagagcggtccgggtctggttcagccgagccagagcctgagcatt60acctgtaccgttagcggttttagcctgaccaattatggtgttcattgggttcgtcagagt120ccgggtaaaggtctggaatggctgggtgttatttggagcggtggtaataccgattataac180accccgtttaccagccgtctgagcatcaataaagataatagcaaaagccaggtgttcttt240aaaatgaatagcctgcagagcaatgataccgccatctattattgtgcacgtgccctgaca300tattatgattatgaatttgcatattggggacagggcaccctggttaccgttagtgccggt360ggtggtggtagcggtggtggcggttcaggtggcggtggttcagatattctgctgacccag420tcaccggttattctgagcgttagtccgggtgaacgtgttagctttagctgtcgtgcaagc480cagagcattggcaccaatattcattggtatcagcagcgtaccaatggtagtccgcgtctg540ctgatcaaatatgcaagcgaaagcattagcggtattccgagccgttttagcggttctggt600agcggcaccgattttaccctgagtattaatagcgttgaaagcgaagatatcgccgattat660tactgccagcaaaataacaattggccgaccacctttggtgcaggtacaaaactggaactg720aaataa726<210>13<211>792<212>DNA<213>人工序列<220><223>抗-EGFR1_scFV_DNA_具有_ompA<400>13atgaaatacctgctgccgaccgcagcagcgggtctgctgctgctggcagcacagcctgca60atggcacaggtgcagctgaaacagagcggtccgggtctggttcagccgagccagagcctg120agcattacctgtaccgttagcggttttagcctgaccaattatggtgttcattgggttcgt180cagagtccgggtaaaggtctggaatggctgggtgttatttggagcggtggtaataccgat240tataacaccccgtttaccagccgtctgagcatcaataaagataatagcaaaagccaggtg300ttctttaaaatgaatagcctgcagagcaatgataccgccatctattattgtgcacgtgcc360ctgacatattatgattatgaatttgcatattggggacagggcaccctggttaccgttagt420gccggtggtggtggtagcggtggtggcggttcaggtggcggtggttcagatattctgctg480acccagtcaccggttattctgagcgttagtccgggtgaacgtgttagctttagctgtcgt540gcaagccagagcattggcaccaatattcattggtatcagcagcgtaccaatggtagtccg600cgtctgctgatcaaatatgcaagcgaaagcattagcggtattccgagccgttttagcggt660tctggtagcggcaccgattttaccctgagtattaatagcgttgaaagcgaagatatcgcc720gattattactgccagcaaaataacaattggccgaccacctttggtgcaggtacaaaactg780gaactgaaataa792<210>14<211>241<212>PRT<213>人工序列<220><223>抗-EGFR1_scFV<400>14GlnValGlnLeuLysGlnSerGlyProGlyLeuValGlnProSerGln151015SerLeuSerIleThrCysThrValSerGlyPheSerLeuThrAsnTyr202530GlyValHisTrpValArgGlnSerProGlyLysGlyLeuGluTrpLeu354045GlyValIleTrpSerGlyGlyAsnThrAspTyrAsnThrProPheThr505560SerArgLeuSerIleAsnLysAspAsnSerLysSerGlnValPhePhe65707580LysMetAsnSerLeuGlnSerAsnAspThrAlaIleTyrTyrCysAla859095ArgAlaLeuThrTyrTyrAspTyrGluPheAlaTyrTrpGlyGlnGly100105110ThrLeuValThrValSerAlaGlyGlyGlyGlySerGlyGlyGlyGly115120125SerGlyGlyGlyGlySerAspIleLeuLeuThrGlnSerProValIle130135140LeuSerValSerProGlyGluArgValSerPheSerCysArgAlaSer145150155160GlnSerIleGlyThrAsnIleHisTrpTyrGlnGlnArgThrAsnGly165170175SerProArgLeuLeuIleLysTyrAlaSerGluSerIleSerGlyIle180185190ProSerArgPheSerGlySerGlySerGlyThrAspPheThrLeuSer195200205IleAsnSerValGluSerGluAspIleAlaAspTyrTyrCysGlnGln210215220AsnAsnAsnTrpProThrThrPheGlyAlaGlyThrLysLeuGluLeu225230235240Lys<210>15<211>263<212>PRT<213>人工序列<220><223>抗-EGFR1_scFV_具有_ompA<400>15MetLysTyrLeuLeuProThrAlaAlaAlaGlyLeuLeuLeuLeuAla151015AlaGlnProAlaMetAlaGlnValGlnLeuLysGlnSerGlyProGly202530LeuValGlnProSerGlnSerLeuSerIleThrCysThrValSerGly354045PheSerLeuThrAsnTyrGlyValHisTrpValArgGlnSerProGly505560LysGlyLeuGluTrpLeuGlyValIleTrpSerGlyGlyAsnThrAsp65707580TyrAsnThrProPheThrSerArgLeuSerIleAsnLysAspAsnSer859095LysSerGlnValPhePheLysMetAsnSerLeuGlnSerAsnAspThr100105110AlaIleTyrTyrCysAlaArgAlaLeuThrTyrTyrAspTyrGluPhe115120125AlaTyrTrpGlyGlnGlyThrLeuValThrValSerAlaGlyGlyGly130135140GlySerGlyGlyGlyGlySerGlyGlyGlyGlySerAspIleLeuLeu145150155160ThrGlnSerProValIleLeuSerValSerProGlyGluArgValSer165170175PheSerCysArgAlaSerGlnSerIleGlyThrAsnIleHisTrpTyr180185190GlnGlnArgThrAsnGlySerProArgLeuLeuIleLysTyrAlaSer195200205GluSerIleSerGlyIleProSerArgPheSerGlySerGlySerGly210215220ThrAspPheThrLeuSerIleAsnSerValGluSerGluAspIleAla225230235240AspTyrTyrCysGlnGlnAsnAsnAsnTrpProThrThrPheGlyAla245250255GlyThrLysLeuGluLeuLys260<210>16<211>18<212>PRT<213>人工序列<220><223>gIII<400>16MetLysLysLeuLeuPheAlaIleProLeuValValProPheTyrSer151015HisSer<210>17<211>21<212>PRT<213>人工序列<220><223>ompA<400>17MetLysLysThrAlaIleAlaIleAlaValAlaLeuAlaGlyPheAla151015ThrValAlaGlnAla20<210>18<211>26<212>PRT<213>人工序列<220><223>malE<400>18MetLysIleLysThrGlyAlaArgIleLeuAlaLeuSerAlaLeuThr151015ThrMetMetPheSerAlaSerAlaLeuAla2025<210>19<211>21<212>PRT<213>人工序列<220><223>phoA<400>19MetLysGlnSerThrIleAlaLeuAlaLeuLeuProLeuLeuPheThr151015ProValThrLysAla20<210>20<211>22<212>PRT<213>人工序列<220><223>pelB<400>20MetLysTyrLeuLeuProThrAlaAlaAlaGlyLeuLeuLeuLeuAla151015AlaGlnProAlaMetAla20<210>21<211>23<212>PRT<213>人工序列<220><223>stII<400>21MetLysLysAsnIleAlaPheLeuLeuAlaSerMetPheValPheSer151015IleAlaThrAsnAlaTyrAla20<210>22<211>31<212>DNA<213>人工序列<220><223>内部核糖体结合位点<400>22taaggatccgaattcaaggagataaaaaatg31<210>23<211>50<212>DNA<213>人工序列<220><223>用于构建GP1113的引物序列<400>23cgggatccaagaaggagatataccatggcaaaaaagtggttattagctgc50<210>24<211>35<212>DNA<213>人工序列<220><223>用于构建GP1114的引物序列<400>24ataatgcggccgcattatttaacctgtttcagtac35<210>25<211>56<212>DNA<213>人工序列<220><223>用于构建GP1115的引物序列<400>25ataatgcggccgcaagaaggagatataccatggcaaaatcactgtttaaagtaacg56<210>26<211>33<212>DNA<213>人工序列<220><223>用于构建GP1116的引物序列<400>26ataatctcgagattattttttagcagaatctgc33<210>27<211>54<212>DNA<213>人工序列<220><223>用于构建GP1147的引物序列<400>27tgacccgctaatgcggccgcactgagtgcttcccttgaaaccctgaaactgatc54<210>28<211>59<212>DNA<213>人工序列<220><223>用于构建GP1148的引物序列<400>28ggtttctttaccagactcaaacggcccggcattcgcatgcagggccgtgaattattacg59<210>29<211>45<212>DNA<213>人工序列<220><223>G4S_连接子/间隔子_DNA<400>29ggtggtggtggtagcggtggtggcggttcaggtggcggtggttca45<210>30<211>15<212>PRT<213>人工序列<220><223>G4S_连接子/间隔子<400>30GlyGlyGlyGlySerGlyGlyGlyGlySerGlyGlyGlyGlySer151015当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1