注射用药物组合物的制作方法
本发明属于癌症免疫疗法的领域,并且涉及包含具有细胞毒性T细胞诱导活性的WT1蛋白衍生的癌抗原肽的可注射药物组合物。
[
背景技术:
]
通常,WT1蛋白衍生的癌抗原肽是衍生自由449个氨基酸(SEQ ID NO:2)组成的人WT1蛋白的部分肽,并且具体是由8-12个氨基酸组成的肽或其二聚体。其被呈递至主要组织相容性复合体(MHC) I类抗原,并且包括被细胞毒性T细胞(细胞毒性T淋巴细胞,下文被称为CTL)抗原识别的肽。人类中的MHC被称为人白细胞抗原(HLA)。
在WT1蛋白衍生的部分肽中,由Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu (SEQ ID NO:3)所示的氨基酸序列组成的部分肽(WT1126-134肽)和通过将从由Cys-Met-Thr-Trp-Asn-Gln-Met-Asn-Leu (SEQ ID NO:6)所示的氨基酸序列组成的部分肽(WT1235-243肽)的N末端起第二个氨基酸从甲硫氨酸修饰为酪氨酸而获得的修饰的肽(即,由Cys-Tyr-Thr-Trp-Asn-Gln-Met-Asn-Leu (SEQ ID NO:5)所示的氨基酸序列组成的肽)已被报道为可用作结合HLA以诱导CTL的肽(参见专利文献1-4)。然而,通过经由半胱氨酸残基之间的二硫键缀合这两种肽而获得的修饰肽是未知的,并且其最佳癌症疫苗组合物也是未知的。
另一方面,在WT1蛋白衍生的部分肽中,由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的部分肽(WT134-51肽)本身可用作结合HLA以诱导CTL的肽,并且还报道了与上述肽组合使用提供作为辅助肽的效果(参见专利文献5)。然而,含有该肽的最佳癌症疫苗组合物是未知的。
由于含有WT1126-134肽和/或修饰的WT1235-243肽和WT134-51肽的最佳癌症疫苗组合物可用作癌症疫苗,所以期望开发确保这些肽的稳定性的制剂。
[文献列表]
[专利文献]
专利文献1: WO 00/06602
专利文献2: WO 02/079253
专利文献3: WO 2004/063217
专利文献4: WO 2007/063903
专利文献5: WO 2010/123065。
[发明概述]
[本发明待解决的问题]
本发明的一个问题是提供由式(1)表示的肽或由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的WT1部分肽的稳定的可注射药物组合物,其可用于配制包含以下肽的癌症疫苗制剂:
其中Cys和Cys之间的键显示二硫键,Leu-OH显示Leu的C-末端是游离羧基,而其它键是肽键。
[解决问题的方式]
本发明人已进行深入研究以试图解决上述问题,并且发现含有由式(1)表示的肽或具有SEQ ID NO:1中所示的序列的WT1部分肽以及海藻糖和pH调节剂的液体制剂提供制剂稳定性优异的液体制剂和/或冷冻干燥的制剂,其导致本发明的完成。
也就是说,本发明涉及以下内容。
1. 可注射药物组合物,其包含以下组分:
(a)一种或多种肽,其选自:
由式(1)表示的肽:
其中Cys和Cys之间的键是二硫键,Leu-OH显示Leu的C-末端是游离羧基,而其它键是肽键,
由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的肽及其盐,
(b)海藻糖或海藻糖水合物,和
(c)pH调节剂。
2. 1的组合物,其中所述组分(a)是一种或多种肽,其选自由式(1)表示的肽及其盐。
3. 2的组合物,其还包含甘露醇。
4. 3的组合物,其中所述甘露醇是D-甘露醇。
5. 2-4中任一项的组合物,其还包含甲硫氨酸。
6. 5的组合物,其中所述甲硫氨酸是L-甲硫氨酸。
7. 2-6中任一项的组合物,其具有1-3的pH。
8. 2-7中任一项的组合物,其为液体制剂或悬浮液制剂,其中组分(b)的含量为1-100 mg/g。
9. 3-8中任一项的组合物,其为液体制剂或悬浮液制剂,其中甘露醇的含量为1-50 mg/g。
10. 5-9中任一项的组合物,其为液体制剂或悬浮液制剂,其中甲硫氨酸的含量为1-30 mg/g。
11. 1的组合物,其中组分(a)是一种或多种肽,其选自由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)表示的氨基酸序列组成的肽及其盐。
12. 11的组合物,其还包含增溶剂。
13. 12的组合物,其中所述增溶剂是柠檬酸、乳酸、酒石酸、乙酸或三氟乙酸。
14. 12的组合物,其中所述增溶剂是酒石酸。
15. 12-14中任一项的组合物,其具有2-3的pH。
16. 11的组合物,其具有5-10的pH。
17. 11-16中任一项的组合物,其为液体制剂或悬浮液制剂,其中组分(b)的含量为1-100 mg/g。
18. 12-15中任一项的组合物,其为液体制剂或悬浮液制剂,其中增溶剂的含量为0.1-10 mg/g。
19. 11-18中任一项的组合物,其中用作pH调节剂的酸是弱酸。
20. 1的组合物,其中组分(a)包含一种或多种选自由式(1)表示的肽及其盐的肽,和一种或多种选自由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的肽及其盐的肽。
21. 20的组合物,其还包含甘露醇。
22. 20或21的组合物,其还包含甲硫氨酸。
23. 20-22中任一项的组合物,其还包含增溶剂。
24. 20-23中任一项的组合物,其具有2-3的pH。
25. 20-24中任一项的组合物,其为液体制剂或悬浮液制剂,其中组分(b)的含量为1-100 mg/g。
26. 21-25中任一项的组合物,其为液体制剂或悬浮液制剂,其中甘露醇的含量为1-50 mg/g。
27. 22-26中任一项的组合物,其为液体制剂或悬浮液制剂,其中甲硫氨酸的含量为1-30 mg/g。
28. 23-27中任一项的组合物,其为液体制剂或悬浮液制剂,其中增溶剂的含量为0.1-10 mg/g。
29. 冷冻干燥的制剂,其通过将8-10、17、18和25-28中任一项的组合物冷冻干燥而获得。
30. 1-18中任一项的组合物,其为液体制剂、悬浮液制剂或冷冻干燥的制剂。
31. 1-7、11-16、19-24和30中任一项的组合物,其为液体制剂或悬浮液制剂。
32. 20-24中任一项的组合物,其通过向冷冻干燥的制剂的形式的2-7中任一项的组合物中添加液体制剂的形式的11-15中任一项的组合物而产生。
33. 32的组合物,其为液体制剂或悬浮液制剂。
34. 癌症疫苗组合物,其包含1-28和30-33中任一项的组合物。
35. 34的组合物,其还包含佐剂。
36. 35的组合物,其中所述佐剂是Montanide。
37. 改善可注射药物组合物中的组分(a)的稳定性的方法:
(a)一种或多种肽,其选自:
由式(1)表示的肽:
其中Cys和Cys之间的键是二硫键,Leu-OH显示Leu的C-末端是游离羧基,而其它键是肽键,
由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的肽及其盐,
所述方法包括在组合物中共混上述组分(a)以及以下组分(b)和(c):
(b)海藻糖或海藻糖水合物,
(c)pH调节剂。
38. 改善癌症疫苗组合物中的肽(a)的稳定性的方法:
(a)一种或多种肽,其选自:
由式(1)表示的肽:
其中Cys和Cys之间的键是二硫键,Leu-OH显示Leu的C-末端是游离羧基,而其它键是肽键,
由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的肽及其盐,
所述方法包括在组合物中共混上述组分(a)以及以下组分(b)、(c)和(d):
(b)海藻糖或海藻糖水合物,
(c)pH调节剂,
(d)甲硫氨酸。
39. 产生20-24中任一项的组合物的方法,其中向冷冻干燥的制剂的形式的2-7中任一项的组合物中添加液体制剂的形式的11-15中任一项的组合物。
40. 生产癌症疫苗组合物的方法,其包括向佐剂中添加通过39的方法获得的组合物。
41. 18的组合物,其中组分(b)的含量为1-100 mg/g。
42. 1-18中任一项的组合物,其中所述pH调节剂是盐酸和/或氢氧化钠。
[发明效果]
使用本发明的可注射的药物组合物,可以产生稳定含有具有细胞毒性T细胞诱导活性的本发明的肽的癌症疫苗组合物,并且可以制备制剂稳定性优异的癌症疫苗。此外,当将可注射的药物组合物冷冻干燥以得到冷冻干燥的制剂时,可以制备稳定保持肽的冷冻干燥的制剂。
[附图简述]
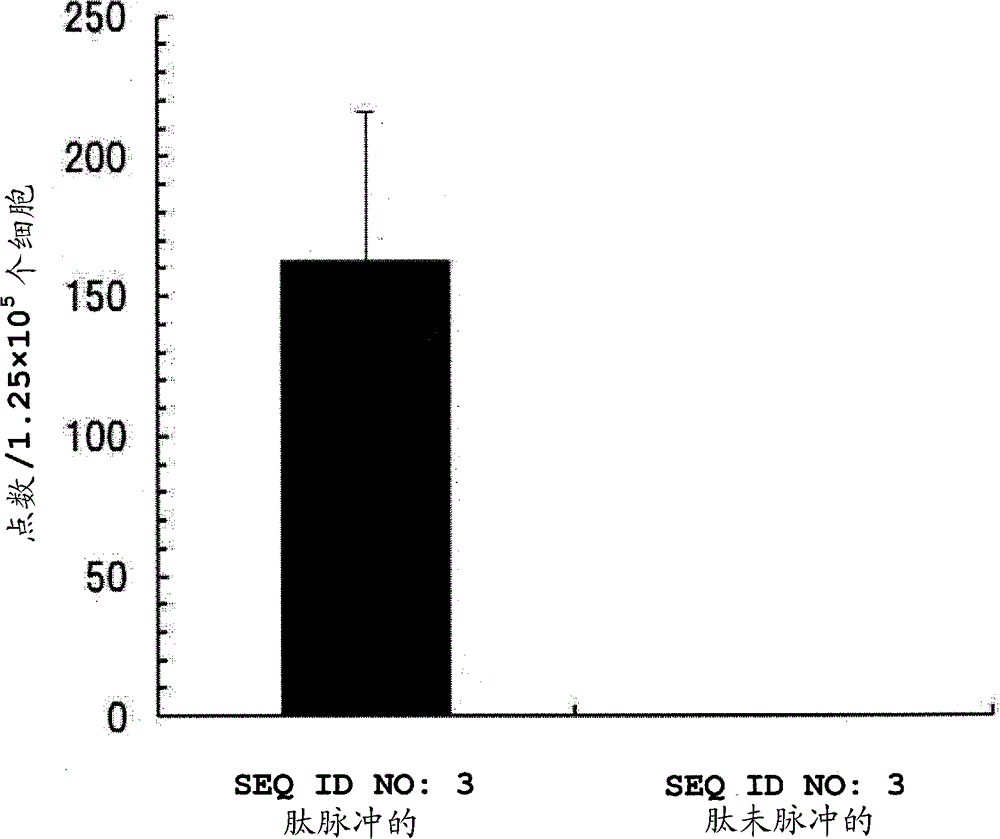
图1是显示实验实施例4的结果的图。纵轴显示接种细胞数中反应的细胞数,而横轴显示在体外脉冲(パルス)的肽。在图1中,黑色条显示通过脉冲SEQ ID NO:3中所示的肽的HLA-A*02:01转基因小鼠来源的脾细胞的培养结果,而白色条显示没有脉冲的培养结果。
图2是显示实验实施例4的结果的图。纵轴显示接种细胞数中反应的细胞数,而横轴显示在体外脉冲的肽。在图2中,黑色条显示通过脉冲SEQ ID NO:5中所示的肽的HLA-A*24:02转基因小鼠来源的脾细胞的培养结果,而白色条显示没有脉冲的培养结果。
[实施方案的描述]
下面详细解释本发明的实施方案。
在本说明书中,各示例的优选实施方案可以与其它示例的优选实施方案组合,或者可以并入上述1-42中描述的相应示例。
在本发明中,“可注射的药物组合物”是指含有本发明的肽和一种或多种除所述肽以外的组分的组合物。癌症疫苗组合物可以通过混合可注射的药物组合物和各种佐剂来制备。
本发明的可注射的药物组合物可以以溶液、悬浮液、冷冻干燥的制剂等的形式提供。
在本发明中,“液体制剂”是指“可注射的药物组合物”中含有的各组分,其溶解在溶剂中。尽管在本发明中通常使用水作为“溶剂”,但可以将药理学上可接受的溶剂诸如丙二醇、聚乙二醇等与水部分混合,只要不影响本发明的效果。优选水。另外,添加至水中且溶解于其中的下述“冷冻干燥的制剂”也包括在本发明的“液体制剂”中。
在本发明中,“悬浮液制剂”通过将“可注射的药物组合物”中含有的各组分与分散介质混合并悬浮于其中而获得。尽管在本发明中通常使用水作为“分散介质”,但可以将药理学上可接受的溶剂诸如丙二醇、聚乙二醇等与水部分混合,只要不影响本发明的效果。优选水。另外,添加至水中且悬浮于其中的下述“冷冻干燥的制剂”也包括在“本发明的悬浮液制剂”中。
在本发明中,“冷冻干燥的制剂”通过将本发明中的“液体制剂”或“悬浮液制剂”冷冻干燥而获得。通常,将其进行以改善在“液体制剂”或“悬浮液制剂”中的肽的化学或物理稳定性。当其用作癌症疫苗时,添加适量的水,并将混合物搅拌以得到液体制剂或悬浮液制剂,其与各种佐剂混合以制备癌症疫苗组合物。
在本发明中,所述“肽”是用于制备癌症疫苗的癌抗原肽,并且是选自由式(1)表示的肽和由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的肽的肽或其盐。
其中Cys和Cys之间的键是二硫键,Leu-OH显示Leu的C-末端是游离羧基,而其它键是肽键。
在本说明书中,所述肽在左侧具有N末端,且各氨基酸符号表示以下氨基酸残基。
Ala或A:丙氨酸残基
Arg或R:精氨酸残基
Asn或N:天冬酰胺残基
Asp或D:天冬氨酸残基
Cys或C:半胱氨酸残基
Gln或Q:谷氨酰胺残基
Glu或E:谷氨酸残基
Gly或G:甘氨酸残基
His或H:组氨酸残基
Ile或I:异亮氨酸残基
Leu或L:亮氨酸残基
Lys或K:赖氨酸残基
Met或M:甲硫氨酸残基
Phe或F:苯丙氨酸残基
Pro或P:脯氨酸残基
Ser或S:丝氨酸残基
Thr或T:苏氨酸残基
Trp或W:色氨酸残基
Tyr或Y:酪氨酸残基
Val或V:缬氨酸残基。
“由式(1)表示的肽”是指由Cys-Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu (SEQ ID NO:4)所示的氨基酸序列组成的肽,其中半胱氨酸残基与Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu (SEQ ID NO:3)的N末端键合,并且由Cys-Tyr-Thr-Trp-Asn-Gln-Met-Asn-Leu (SEQ ID NO:5)所示的肽的半胱氨酸残基通过二硫键彼此键合。
由Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu (SEQ ID NO:3)所示的氨基酸序列组成的肽是从由蛋白(具体地,由449个氨基酸(SEQ ID NO:2)组成的人WT1蛋白)(其为维尔姆斯氏肿瘤的肿瘤抑制基因WT1的基因产物)的N末端起的第126位精氨酸(Arg)至第134位亮氨酸(Leu)的9个连续氨基酸组成的部分肽(WT1126-134)。该肽是呈递给MHC I类抗原并被CTL识别为抗原的肽。
由Cys-Tyr-Thr-Trp-Asn-Gln-Met-Asn-Leu (SEQ ID NO:5)所示的氨基酸序列组成的肽是修饰肽,其为由从WT1蛋白的N末端起的第235位半胱氨酸(Cys)至第243位亮氨酸(Leu)的9个连续氨基酸组成的部分肽(WT1235-243肽),其中从N末端起的第二个氨基酸从甲硫氨酸(Met)修饰为酪氨酸(Tyr)。该肽是呈递给MHC I类抗原并被CTL识别为抗原的肽。
“由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的肽”是从WT1蛋白的N末端起的第34位色氨酸(Trp)至第51位亮氨酸(Leu)的18个氨基酸组成的部分肽(WT134-51肽)。该肽是呈递给MHC II类抗原的肽,并诱导WT1特异性辅助T细胞。
由式(1)表示的肽或由SEQ ID NO:1所示的氨基酸序列组成的肽的盐没有特别限制,只要其为药学上可接受的盐。本发明中的“盐”的实例包括酸加成盐和碱加成盐。酸加成盐的实例包括无机酸盐诸如盐酸盐、氢溴酸盐、硫酸盐、氢碘酸盐、硝酸盐、磷酸盐等,以及有机酸盐诸如柠檬酸盐、草酸盐、乙酸盐、甲酸盐、丙酸盐、苯甲酸盐、三氟乙酸盐、马来酸盐、酒石酸盐、甲磺酸盐、苯磺酸盐、对甲苯磺酸盐等。碱加成盐的实例包括与无机碱的盐诸如钠盐、钾盐、钙盐、镁盐、铵盐等,与有机碱的盐诸如三乙基铵盐、三乙醇铵盐、吡啶鎓盐、二异丙基铵盐等,等,以及碱性或酸性氨基酸诸如精氨酸、天冬氨酸、谷氨酸等的氨基酸盐。
本发明的肽还涵盖由式(1)表示的肽或其盐、由SEQ ID NO:1所示的氨基酸序列组成的肽或其盐的水合物、溶剂化物诸如乙醇溶剂化物等。此外,本发明的肽涵盖可以存在的由式(1)表示的肽的任何立体异构体或其盐诸如任何非对映异构体、对映异构体等以及任何实施方案中的任何晶体。
由式(1)表示的肽或其盐可以通过本说明书中的实施例中描述的方法或已知方法(参见专利文献2-4等)来产生。另一方面,由SEQ ID NO:1所示的氨基酸序列组成的肽或其盐可以通过已知方法产生(参见专利文献5)。此外,本发明的肽可以通过相关技术领域中通常使用的方法来产生。产生方法的实例包括文献(Peptide Synthesis, Interscience, New York, 1966; The Proteins, Vol. 2, Academic Press Inc., New York, 1976; peptide synthesis, Maruzen Co., LTD., 1975; Basics and Experiment of Peptide Synthesis, Maruzen Co., LTD., 1985; Development of Pharmaceutical Product subsequent vol. 14, Peptide Synthesis, Hirokawa Shoten, 1991)等中描述的方法。
当通过上述方法获得的本发明的肽是游离形式时,游离形式可以通过已知方法或与其类似的方法转化为合适的盐。相反,当本发明的肽作为盐获得时,所述盐可以通过已知方法或与其类似的方法转化为游离形式或其它盐。
本发明的可注射药物组合物可以各自单一含有由式(1)表示的肽或其一种盐,或者可以含有所述肽及其一种或多种盐,或所述肽的两种或更多种盐(下文有时总称为“肽(1)”)。类似地,本发明的可注射药物组合物可以各自单一含有由SEQ ID NO:1所示的氨基酸序列组成的肽或其一种盐,或者可以含有所述肽及其一种或多种盐,或所述肽的两种或更多种盐(下文有时总称为“肽(2)”)。此外,本发明的可注射药物组合物任选地含有肽(1)和肽(2)两者。
当本发明的可注射药物组合物是液体制剂或悬浮液制剂(下文有时称为“本发明的液体形式的制剂”)时,本发明的肽相对于本发明的液体形式的制剂的重量的含量没有特别限定,并且其仅需要是药理学可接受的或性质可接受的。在本发明的肽中,例如,肽(1)的含量(当含有两种或更多种肽时,其总量)优选为0.5 mg-200 mg/g,进一步优选0.5 mg-100 mg/g,0.5 mg-50 mg/g或1 mg-25 mg/g,其可以根据目标进行选择。另一方面,肽(2)的含量(当含有两种或更多种肽时,其总量)优选为0.05 mg-200 mg/g,进一步优选0.05 mg-100 mg/g,0.05 mg-50 mg/g或0.1 mg-25 mg/g,其可以根据目标进行选择。当本发明的液体制剂含有肽(1)和肽(2)两者时,肽(1)和肽(2)的重量比可以从1:0.1-1:5的范围适当选择。
当本发明的可注射药物组合物是冷冻干燥的制剂(下文有时称为“本发明的冷冻干燥的制剂”)时,每体积本发明的肽的含量没有特别限定。本发明的冷冻干燥的制剂通过将本发明的液体形式的制剂冷冻干燥而获得,并且肽的含量仅需要满足液体形式的制剂的含量。具有比冷冻干燥前更高的浓度的本发明的液体形式的制剂,可以通过在本发明的冷冻干燥的制剂的复水期间溶解或分散于比冷冻干燥前的本发明制剂的液体形式的制备物的液体量更少的量的水中来获得。
除了本发明的上述肽(组分(a))外,本发明的可注射药物组合物特征性地含有以下组分(b)和(c):
(b)海藻糖或海藻糖水合物
(c)pH调节剂。
在本发明中,“海藻糖”是通过葡萄糖的1,1-糖苷键形成的一种二糖。海藻糖可以是无水物或其水合物。优选海藻糖水合物。本发明的可注射药物组合物可以含有无水物或其水合物的单一形式的海藻糖,或者可以组合含有其两种或更多种。在本发明的可注射药物组合物中,海藻糖相对于组合物的重量的含量没有特别限定。其相对于本发明的液体形式的制剂的重量的含量(当以包括两种或更多种的形式包含时,其全部量)为例如1-50 mg/g,1-70 mg/g,1-100 mg/g,1-150 mg/g,1-200 mg/g,3-50 mg/g,3-70 mg/g,3-100 mg/g,3-150 mg/g,3-200 mg/g,5-50 mg/g,5-70 mg/g,5-100 mg/g,5-150 mg/g,5-200 mg/g等。
在本发明中,“pH调节剂”是通常用于药物制剂的pH调节剂。其具体实例包括无机酸诸如盐酸、硫酸、磷酸、磷酸二钠、磷酸氢二钾、磷酸二氢钠、磷酸二氢钾、磷酸三钠等或其盐,有机酸诸如硝酸、乙酸、柠檬酸、酒石酸、乳酸、马来酸、乙酸钠水合物、无水乙酸钠、柠檬酸钠水合物、柠檬酸二氢钠、酒石酸钠等或其盐,无机碱诸如氢氧化钠、氢氧化钾、氨水等,以及有机碱诸如氨丁三醇、组氨酸、L-精氨酸、葡甲胺等。优选柠檬酸、乳酸、酒石酸、盐酸、硫酸、硝酸、氢氧化钠和氢氧化钾、氨丁三醇、组氨酸、L-精氨酸和葡甲胺,并且进一步优选酒石酸、盐酸和氢氧化钠、氨丁三醇、L-精氨酸和葡甲胺。
从另一个方面来看,当组分(a)是肽(2)时,作为pH调节剂的酸优选为弱酸。
添加pH调节剂以调节本发明的液体形式的制剂的pH以落入能够确保本发明的肽的稳定性的pH范围内。由于能够确保本发明的肽的稳定性的pH范围根据如下所述的本发明的液体形式的制剂中含有的肽的种类而变化,所以使用适合于其的pH调节剂。
当本发明的可注射药物组合物仅含有肽(1)时,本发明的液体形式的制剂具有1-10的pH。从溶解度和稳定性的方面来看,当液体形式的制剂是液体制剂时,pH为优选1-4,进一步优选1-3,最优选2-3。鉴于溶解度,当液体形式的制剂是悬浮液制剂时,优选pH 5-10。在除了上述那些实施方案以外的实施方案中,当液体形式的制剂是液体制剂时,优选的pH包括1.5-4.5、1.5-3.5、1.5-3.0、2.0-3.0。对于悬浮液制剂,优选的pH包括4-9、4-6、5-9。
另一方面,当本发明的可注射药物组合物仅含有肽(2)时,本发明的液体形式的制剂具有pH 2-10,更具体地2-3、3-9、6-9、7。从稳定性的方面来看,pH优选为5-10,进一步优选6-8。
此外,当本发明的可注射药物组合物含有肽(1)和肽(2)时,本发明的液体形式的制剂具有2-10的pH。从稳定性的方面来看,当液体形式的制剂是液体制剂时,优选的pH包括2-4、2-3、1.7-3.2和1.5-3.5。
在本说明书中,将数字四舍五入至所述数字之下一位。例如,当数字为2时,其显示不小于1.5且小于2.5。
当本发明的液体形式的制剂不含pH调节剂并显示比所需pH范围更高的pH值时,可以通过添加无机酸、有机酸等作为pH调节剂将pH调节至所需pH。作为无机酸和有机酸,可以使用上述那些。
当本发明的液体形式的制剂不含pH调节剂并显示比所需pH范围更低的pH值时,可以使用无机碱或有机碱作为pH调节剂。作为无机碱和有机碱,可以使用上述那些。当本发明的可注射药物组合物仅含有肽(2)时,优选使用无机碱或有机碱作为pH调节剂。具体地,可以提及磷酸氢二钠、氨丁三醇、组氨酸、L-精氨酸和葡甲胺等。优选磷酸氢二钠、氨丁三醇、L-精氨酸和葡甲胺。在本发明的可注射药物组合物中,有机碱相对于组合物的重量的含量没有特别限定。其相对于本发明的液体形式的制剂的重量的含量为例如1-100 mg/g,1-50 mg/g,1-150 mg/g,5-100 mg/g,5-50 mg/g,5-150 mg/g,10-100 mg/g,10-50 mg/g,10-150 mg/g 等。
当本发明的可注射药物组合物含有肽(1)作为组分(a)时,所述组合物可以含有甘露醇。
在本发明中,“甘露醇”是一种糖醇,分类为己糖醇,并且对应于甘露糖的还原形式。甘露醇含有光学异构体,包括D型、L型和DL型,并且这些中的任一种的使用都显示不影响本发明的效果。优选天然存在的D-甘露醇。尽管甘露醇包括多种晶体体系,但它们中的任一种的使用显示不影响本发明的效果。在本发明的可注射药物组合物中,甘露糖相对于组合物的重量的含量没有特别限定。其相对于本发明的液体形式的制剂的重量的含量为例如1-20 mg/g,1-30 mg/g,1-50 mg/g,3-20 mg/g,3-30 mg/g,5-20 mg/g,5-30 mg/g等。
当本发明的可注射药物组合物含有肽(2)作为组分(a)时,所述组合物优选还含有增溶剂以防止肽的溶解性变得不稳定。作为“增溶剂”,可以使用有机酸。使用增溶剂,肽(2)可以在液体制备物的溶解步骤中快速溶解。此外,对于通过将本发明的液体形式的制剂冷冻干燥而获得的冷冻干燥的制剂,当使用注射用水重构冷冻干燥的制剂时,其可以迅速再溶解。增溶剂的具体实例包括柠檬酸、乳酸、酒石酸、乙酸和三氟乙酸等。优选柠檬酸、乳酸和酒石酸,并且进一步优选酒石酸。在本发明的可注射药物组合物中,增溶剂相对于组合物的重量的含量没有特别限定。其相对于本发明的液体形式的制剂的重量的含量为例如1-5 mg/g,1-10 mg/g,1-15 mg/g,1-20 mg/g,3-10 mg/g,3-15 mg/g,3-20 mg/g,5-10 mg/g,5-15 mg/g,5-20 mg/g,0.1-5 mg/g,0.1-10 mg/g,0.1-15 mg/g,0.1-20 mg/g,0.3-10 mg/g,0.3-15 mg/g,0.3-20 mg/g,0.5-10 mg/g,0.5-15 mg/g或0.5-20 mg/g。
当本发明的可注射药物组合物含有肽(1)作为组分(a)时,鉴于所述肽当其作为癌症疫苗组合物制备时的稳定性,所述组合物期望地还含有甲硫氨酸。通过含有甲硫氨酸,当其作为癌症疫苗组合物制备时,可以抑制肽(1)中含有的甲硫氨酸残基的氧化。
本发明中的“甲硫氨酸”是必需氨基酸之一,并且是侧链中包含硫原子的疏水性氨基酸。尽管“甲硫氨酸”具有光学异构体且包括D型、L型和DL型,但可以使用这些中的任一种,而不影响本发明的效果。甲硫氨酸经常用作药物产品的赋形剂,并且日本药典(第16版)中描述的L型是优选的。在本发明的可注射药物组合物中,甲硫氨酸相对于组合物的重量的含量没有特别限定。其相对于本发明的液体形式的制备物的重量的含量为例如1-5 mg/g,1-10 mg/g,1-20 mg/g,1-30 mg/g,3-10 mg/g,3-20 mg/g,3-30 mg/g,5-10 mg/g,5-20 mg/g,5-30 mg/g等。
另外,除了上述组分,本发明的可注射药物组合物,还可以适当地包含通常用于药物制剂的赋形剂,诸如稳定剂、增溶剂、缓冲剂、等渗剂等,只要不影响本发明的效果。
本发明的可注射药物组合物可以通过通常用于产生药物产品等的方法来产生。例如,在维持在5-25℃的恒定温度的环境下将注射用水添加至合适的容器中,并向其中添加预先称重的肽和赋形剂,同时缓慢搅拌混合物。然后,将混合物最终调节至具有所需pH。将混合物通过过滤等灭菌,并填充在容器诸如玻璃小瓶等中,其用橡胶塞等密封。当产生冷冻干燥的制剂时,可以通过本身已知的方法将获得的本发明的液体形式的制剂冷冻干燥。
尽管本发明的肽也可以各自单一用作癌症疫苗的抗原肽,但癌症疫苗组合物中也可以含有肽(1)和肽(2)。由于肽(2)本身单一结合HLA并诱导CTL,以及当与肽(1)组合使用时提供作为辅助肽的效果,预期含有肽(1)和肽(2)两者的癌症疫苗组合物显示协同疫苗效果。当癌症疫苗组合物中含有两种肽时,可以将含有两种肽的本发明的单一可注射药物组合物与佐剂混合,或者可以将含有每种肽的本发明的两种可注射药物组合物与佐剂混合以形成三种材料的混合物。
含有肽(1)和肽(2)两者的本发明的液体形式的制剂可以通过将两种肽进行上述产生方法来直接制备(在单个步骤中),或者也可以通过使每种肽进行上述产生来制备单独的液体制剂或悬浮液制剂并混合它们来获得。在一个优选实施方案中,可以提及这样的方法,其包括将含有肽(1)的液体制剂或悬浮液制剂冷冻干燥,并添加含有肽(2)的液体制剂或悬浮液制剂以溶解或悬浮含有肽(1)的冷冻干燥的制剂。或者,制备两种含有各肽的冷冻干燥的制剂,将含有肽(2)的冷冻干燥的制剂重新溶解或再悬浮于比冷冻干燥前的液体制剂或悬浮液制剂更少量的水中,并且将溶液或悬浮液添加至含有肽(1)的冷冻干燥的制剂中以溶解或悬浮于其中,由此可以制备具有比冷冻干燥前的液体制剂或悬浮液制剂的浓度更高的浓度的液体制备物或悬浮液制剂。
尽管使用本发明的可注射药物组合物的癌症疫苗的制备方法没有特别限制,但可以提及,例如,通过与适当佐剂混合来制备癌症疫苗的方法;通过预先与适当佐剂混合并将混合物冷冻干燥等来制备癌症疫苗的方法;通过当使用时将本发明的液体形式的制剂与各种佐剂混合来制备癌症疫苗的方法等。佐剂的实例包括沉降性佐剂、油性佐剂等。沉降性佐剂是吸附肽的无机物质的悬浮液。沉降性佐剂的具体实例包括氢氧化钠、氢氧化铝(Alum)、磷酸钙、磷酸铝、硫酸铝钾、PEPES、羧基乙烯基聚合物等。油性佐剂是油性乳剂,其中含有肽的水溶液包封在矿物油中以形成用于乳化的胶束。油性佐剂的具体实例包括液体石蜡、羊毛脂、弗氏佐剂(完全弗氏佐剂、不完全弗氏佐剂)、Montanide、W/O乳剂(参见WO 2006/078059)等。
使用本发明的可注射药物组合物制备的癌症疫苗可用于预防或治疗与WT1基因的表达水平升高相关的癌症,例如血液癌症诸如白血病,骨髓增生异常综合征,多发性骨髓瘤,恶性淋巴瘤等,以及实体瘤诸如胃癌,结肠直肠癌,肺癌,乳腺癌,生殖细胞癌,肝癌,皮肤癌,膀胱癌,前列腺癌,子宫癌,子宫颈癌,卵巢癌,脑肿瘤等。
由于本发明的可注射药物组合物可以稳定地保持作为活性成分的癌抗原肽,所以可以选择各种施用形式。具体地,可以提及经口、经鼻、经肺、经皮、皮内、皮下、肌肉内、静脉内或腹膜内施用等,并且可以根据使用目标通过上述方法制备癌症疫苗。通常,作为优选用于用癌症疫苗的免疫刺激的施用途径,肠胃外施用是已知的,并且可以提及,例如,腹膜内施用,皮下施用,皮内施用,肌肉内施用,静脉内施用,以及经鼻施用,经皮施用等。这些中,可以优选提及通过注射的施用,诸如皮下施用,皮内施用,腹膜内施用,肌肉内施用等。
[实施例]
以下通过参考实施例、比较实施例、实验实施例等更详细地进行解释本发明,所述实施例、比较实施例、实验实施例等不应当被解释为限制性的。
作为由Trp-Ala-Pro-Val-Leu-Asp-Phe-Ala-Pro-Pro-Gly-Ala-Ser-Ala-Tyr-Gly-Ser-Leu (SEQ ID NO:1)所示的氨基酸序列组成的肽(肽(2)),使用通过专利文献(WO 2010/123065)中描述的方法产生的肽;作为海藻糖,使用作为海藻糖水合物的“海藻糖SG(由Hayashibara Biochemical Lab制造)”;且作为D-甘露醇,使用“mannit S(由Mitsubishi Shoji Foodtech制造)或低内毒素的D-(-)-甘露醇(由Merck制造)”。作为氨丁三醇,使用“氨丁三醇(由Nacalai Tesque制造)”;作为组氨酸,使用“组氨酸(由Nacalai Tesque制造)”;作为L-精氨酸,使用“L-精氨酸盐酸盐(由Nacalai Tesque制造);且作为葡甲胺,使用“葡甲胺(由Nacalai Tesque制造)”。作为乳酸,使用“乳酸(由Nacalai Tesque制造)”;作为酒石酸,使用“L(+)-酒石酸,粉末(由Merck制造)”;且作为柠檬酸,使用“柠檬酸单水合物(由Nacalai Tesque制造)”。作为甲硫氨酸,使用“L-甲硫氨酸(由Kyowa Hakko Bio Co., Ltd.制造)”。作为pH调节剂,使用盐酸,“1 mol/l盐酸(由Nacalai Tesque制造)”;作为氢氧化钠,使用“1 mol/l氢氧化钠溶液(由Nacalai Tesque制造)”;并且作为磷酸二氢钠,使用“磷酸二氢钠(由Nacalai Tesque制造)”。作为Montanide,使用“(Montanide ISA 51 VG(由SEPPIC制造)”。
[肽的合成]
由式(1)表示的肽(肽(1))的合成
步骤1. H-Cys(Npys)-Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu-OH的合成
(C(Npys)RMFPNAPYL的合成)
使用282 mg Fmoc-Leu-Alko-树脂(Alko是对烷氧基苄醇)(由Watanabe Chemical制造;0.71 mmol/g,0.2 mmol)作为起始材料,根据Fmoc/tBu方法,通过固相合成组装肽链。使用由CS Bio制造的CS336X肽合成仪进行固相合成,并通过用20%哌啶的DMF溶液处理5分钟和20分钟来进行Fmoc基团的脱保护。通过与1.05 mmol受保护的氨基酸、1 mmol HBTU和2 mmol DIPEA的DMF溶液反应1小时来进行受保护的氨基酸的偶联。获得的树脂用DMF和乙醚洗涤,并在减压下干燥,以得到Boc-Cys(Npys)-Arg(Pmc)-Met-Phe-Pro-Asn(Trt)-Ala-Pro-Tyr(tBu)-Leu-Alko-树脂(630 mg)。向该肽树脂中添加TFA/H2O/TIS=95/2.5/2.5的混合物(10 ml),并将混合物在室温下振荡2小时。过滤掉树脂,并将反应混合物在减压下浓缩。将反应混合物冰冷却并添加二乙醚(50 ml)。将所得沉淀通过过滤收集,用乙醚洗涤并在减压下干燥,以得到粗肽(217 mg)。将获得的粗肽溶液溶解于20%乙酸水溶液(7 ml)和乙腈(1 ml)的混合物中,并通过反相HPLC纯化。
泵: 由Shimazu制造;LC-8A
柱: YMC ODS-A 3 cm ×25 cm L, 10 μm
洗脱液1: H2O/0.1% TFA
洗脱液2: CH3CN/0.1% TFA
流速: 20 ml/min
检测: UV 220 nm。
将粗肽溶液注入用15%的洗脱液2平衡的柱中。其后,将洗脱液2的浓度经10分钟升高至37%,并且其后以每分钟0.24%的速率升高。收集含有目标产物的级分并冷冻干燥,以得到H-Cys(Npys)-Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu-OH (53 mg)。
质谱: LC-ESI/MS m/z =1366.1 [M+1]+ (计算值 = 1366.6)
步骤2. (H-Cys-Tyr-Thr-Trp-Asn-Gln-Met-Asn-Leu-OH)(H-Cys-Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu-OH)二硫键的合成
[由式(1)表示的化合物的合成:
其中Cys和Cys之间的键是二硫键,Leu-OH显示Leu的C-末端是游离羧基,而其它键是肽键。]。
将步骤1中获得的H-Cys(Npys)-Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu-OH (50 mg)和通过已知方法(例如,WO 07/063903)合成的H-Cys-Tyr-Thr-Trp-Asn-Gln-Met-Asn-Leu-OH (即,CYTWNQMNL (SEQ ID NO:4)) (43 mg)混合,添加DMSO (1 mL),并将混合物在室温下搅拌20分钟。将反应混合物用0.1% TFA水(5 ml)稀释,并通过反相HPLC纯化。
泵: 由Shimazu制造;LC-8A
柱: YMC ODS-A 3 cm ×25 cm L, 10 μm
洗脱液1: H2O/0.1% TFA
洗脱液2: CH3CN/0.1% TFA
流速: 20 ml/min
检测: UV 220 nm。
将反应溶液注入用25%的洗脱液2平衡的柱中。其后,洗脱液2的浓度以每分钟0.25%的速率升高。将含有目标产物的级分收集,冷冻干燥,通过反相HPLC再纯化,并冷冻干燥,以得到(H-Cys-Tyr-Thr-Trp-Asn-Gln-Met-Asn-Leu-OH)(H-Cys-Arg-Met-Phe-Pro-Asn-Ala-Pro-Tyr-Leu-OH)二硫键(即,由式(1)表示的肽(肽(1))(21 mg)。
质谱: LC-ESI/MS m/z =1191.8 [M+2]2+ (计算值 =1191.9)
其中Cys和Cys之间的键是二硫键,Leu-OH显示Leu的C-末端是游离羧基,而其它键是肽键。
[液体制剂或悬浮液制剂的制备]
[实施例1]
将作为肽的上述肽(1)(组分(a))和作为组分(b)的海藻糖以表1中所述的量溶解于注射用水中,并将混合物用作为pH调节剂的盐酸和/或氢氧化钠(组分(c))调节至pH 1。在过滤通过0.2 μm除菌过滤器后,将混合物填充在玻璃小瓶中至1 mL并用丁基橡胶塞紧密密封,由此获得实施例1的液体制剂。
[实施例2-10]
以与实施例1中相同的方式,以表1或2中所述的量制备肽(1)、海藻糖、pH调节剂(盐酸和/或氢氧化钠)和注射用水,将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例2、3、5-8和10的液体制剂。
以与实施例1中相同的方式,以表1或2中所述的量制备肽(1)、海藻糖、pH调节剂(盐酸和/或氢氧化钠)和注射用水,将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例4和9的液体制剂。
[实施例11-19]
以与实施例1中相同的方式,以表3或4中所述的量制备作为组分(a)的SEQ ID NO:1 (WAPVLDFAPPGASAYGSL)中所示的肽(下文为肽(2))、海藻糖、pH调节剂(盐酸和/或氢氧化钠)和注射用水,将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例12、15和18的液体制剂。
以与实施例1中相同的方式,以表3或4中所述的量制备作为组分(a)的SEQ ID NO:1 (WAPVLDFAPPGASAYGSL)中所示的肽(下文为肽(2))、海藻糖、pH调节剂(盐酸和/或氢氧化钠)和注射用水,将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例11、13、14、16、17和19的液体制剂。
[实施例20-24]
以与实施例1中相同的方式,以表5中所述的量制备肽(1)、海藻糖、D-甘露醇、注射用水、pH调节剂(盐酸和/或氢氧化钠),将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例20-24的液体制剂。
[实施例25]
将以表6中所述的量制备的肽(1)和海藻糖添加至适量的注射用水中,并通过搅拌机分散混合物,其后将pH用作为pH调节剂的盐酸和/或氢氧化钠调节至4,以得到实施例25的悬浮液制剂。
[实施例26-29]
以与实施例25中相同的方式,将以表6中所述的量制备的肽(1)和海藻糖添加至适量的注射用水中,并使用表6中所述的pH调节剂,并调节至表6的pH以得到实施例26-29的悬浮液制剂。
[实施例30]
将作为肽的肽(2)(组分(a))、海藻糖(组分(b))、作为pH调节剂的氨丁三醇(组分(c))溶解于注射用水中至表7中所述的量。在过滤通过0.2 μm除菌过滤器后,并且将混合物填充在玻璃小瓶中至1 mL并用丁基橡胶塞紧密密封,由此获得实施例30的液体制剂。
[实施例31-34]
以与实施例30中相同的方式,以表7中所述的量制备肽(2)、海藻糖、pH调节剂和注射用水,将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例31-34的液体制剂。
[实施例35-37]
以与实施例1中相同的方式,以表8中所述的量制备肽(2)、海藻糖、增溶剂(柠檬酸、乳酸、酒石酸)、pH调节剂(盐酸)和注射用水,将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例35-37的液体制剂。
[实施例38-43]
以与实施例1中相同的方式,以表9或10中所述的量制备肽(2)、海藻糖、增溶剂(酒石酸)、pH调节剂(盐酸)和注射用水,将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例38-43的液体制剂。
[实施例44-47]
以与实施例1中相同的方式,以表11中所述的量制备肽(2)、海藻糖、增溶剂(酒石酸)、pH调节剂(盐酸)和注射用水,将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例44-47的液体制剂。
[实施例48-50]
以与实施例1中相同的方式,以表12中所述的量制备肽(1)、海藻糖、D-甘露醇、注射用水和pH调节剂(盐酸),将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例48-50的液体制剂。
[实施例51-54]
以与实施例1中相同的方式,以表13中所述的量制备肽(1)、海藻糖、D-甘露醇、甲硫氨酸、注射用水和pH调节剂(盐酸),将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例52的液体制剂。
以与实施例1中相同的方式,以表13中所述的量制备肽(1)、海藻糖、D-甘露醇、甲硫氨酸、注射用水和pH调节剂(盐酸),将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例51、53和54的液体制剂。
[实施例55-58]
以与实施例1中相同的方式,以表14中所述的量制备肽(2)、海藻糖、酒石酸、注射用水和pH调节剂(盐酸),将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例55和56的液体制剂。
以与实施例1中相同的方式,以表14中所述的量制备肽(2)、海藻糖、酒石酸、注射用水和pH调节剂(盐酸),将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例57和58的液体制剂。
[实施例59-66]
以与实施例1中相同的方式,以表15或16中所述的量制备肽(1)、肽(2)、海藻糖、D-甘露醇、L-甲硫氨酸、酒石酸、注射用水和pH调节剂(盐酸),将其填充于小瓶中,并用丁基橡胶塞紧密密封,由此获得实施例59-66的液体制剂。
[冷冻干燥的制剂的制备]
[实施例1A-66A]
将实施例1、4、6、9、11、13、14、16、17、19、20、51、53、54和57-66中产生的液体制剂或悬浮液制剂填充于玻璃小瓶中,置于冷冻干燥机中并冷冻干燥,以得到实施例1A、4A、6A、9A、11A、13A、14A、16A、17A、19A、20A、51A、53A、54A和57A-66A的冷冻干燥的制剂。冷冻干燥在以下条件下进行,所述条件包括在接近-40℃下冷冻液体制剂或悬浮液制剂,将冷冻干燥机中的压力降低至真空,同时将冷冻干燥机中的温度升高至接近-20℃,并干燥约20小时,并将冷冻干燥机中的温度升高至接近30℃并干燥约12小时。
将实施例2、3、5、7、8、10、12、15、18、21-50、52、55和56中产生的液体制剂填充于玻璃小瓶中,置于冷冻干燥机中并冷冻干燥,以得到实施例2A、3A、5A、7A、8A、10A、12A、15A、18A、21A-50A、52A、55A和56A的冷冻干燥的制剂。冷冻干燥在以下条件下进行,所述条件包括在接近-40℃下冷冻液体制剂或悬浮液制剂,将冷冻干燥机中的压力降低至真空,同时将冷冻干燥机中的温度升高至接近-20℃,并干燥约20小时,并将冷冻干燥机中的温度升高至接近30℃并干燥约12小时。
[实验实施例1] 液体和悬浮液制剂的稳定性的评估
将实施例2、3、5、7、8、10、12、15、18、21-26、30-34和52的液体制剂在25℃下储存1周,并评估纯度。通过反相高效液相色谱法(检测波长:220nm),使用C18反相柱(2.1 mm×150 mm,1.7 μm或4.6 mm×150 mm,5 μm)和纯水、乙腈、三氟乙酸作为流动相测量纯度。使用通过该方法测量的峰面积,通过下式计算基于肽的纯度和储存前的纯度(作为100%)的相对纯度(相比于初始值)。
肽的纯度(%)=肽的峰面积/含有相关物质的总峰面积 × 100
相对纯度(相比于初始值)(%)=储存样品上肽的纯度/储存前肽的纯度× 100
结果显示于表17中。每种制剂在25℃、1周下显示不小于80%,并且可以获得稳定的制剂。
[实验实施例2] 冷冻干燥的制剂的稳定性的评估
将实施例5A、10A、12A、15A、18A、23A-26A、30A-43A、48A-50A、52A、55A和56A的冷冻干燥的制剂在60℃下保存2周,并添加注射用水以转化为液体制剂,并评估纯度。以与实验实施例1中相同的方式测量和计算纯度。
结果显示于表18中。每种制剂在60℃、2周下显示不小于80%,并且可以获得稳定的制剂。
[实验实施例3] 冷冻干燥的制剂的再溶解性的评估
将实施例44A-47A的冷冻干燥的制剂在40℃下储存1个月,并通过目视观察证实添加注射用水以重构水时的再溶解特性。结果显示于表19中。表19的结果表明,预先添加酒石酸作为增溶剂改善了再溶解性。
[实验实施例4] 特异性CTL诱导活性的证实
获得实施例67的液体制剂,其含有与实施例51中相同的组成比的肽(1)、海藻糖、D-甘露醇、甲硫氨酸、注射用水、pH调节剂(盐酸),且具有调节至2.7的pH。将实施例67的液体制剂填充于小瓶中到2 mL,置于冷冻干燥机中并冷冻干燥,以得到实施例67A的冷冻干燥的制剂。将实施例67A的含有肽(1)的冷冻干燥的制剂和实施例55A的含有肽(2)的冷冻干燥的制剂与佐剂混合,以得到癌症疫苗组合物。另外,以与实验实施例2中相同的方式评估实施例67A的冷冻干燥的制剂的稳定性。作为结果,在25℃下储存3个月后的相对纯度(相比于初始值)为100%,并且可以获得稳定的制剂。
1) 癌症疫苗组合物的制备
将实施例55A的含有肽(2)的冷冻干燥的制剂重构于1.2 mL注射用水中。将重构的溶液收集到1 mL,添加并重新溶解于实施例67A的含有肽(1)的冷冻干燥的制剂中,以得到实施例68的液体制剂。将液体制剂(0.9 mL)与作为佐剂的Montanide (0.9 mL)混合,并将混合物乳化,以得到实施例67的癌症疫苗组合物。
2) CTL诱导活性评估
通过使用HLA-A*02:01转基因小鼠和HLA-A*24:02转基因小鼠的体内CTL诱导测试评估上述癌症疫苗组合物的CTL诱导能力。
小鼠MHC有缺陷的HLA-A*02:01转基因小鼠表达人MHC HLA-A*02:01和小鼠MHC H-2Db以及HLA-DRB1*01:01的嵌合HLA。使用该小鼠,可以选择能够在HLA-A*02阳性人中诱导CTL的肽(Eur J Immunol.2004; 34:3060-9)。另一方面,HLA-A*24:02转基因小鼠(C57BL/6CrHLA-A2402/Kb)是表达作为人MHC的HLA-A*24:02和作为小鼠MHC的H-2Kb的嵌合HLA的小鼠。使用该小鼠,可以选择能够在HLA-A*24阳性人中诱导CTL的肽(Int J Cancer.2002; 100:565-70)。
将上述癌症疫苗组合物以50 μL/部位皮内施用至小鼠尾基部中的两个部位。为了评估癌症疫苗组合物的肽特异性T细胞诱导,使用IFNγ ELISPOT测定试剂盒。在施用后一周,用CO2气体将小鼠安乐死,分离脾脏,并制备脾细胞。在脾细胞制备的前一天,将ELISPOT板用抗小鼠IFNγ抗体处理,并在脾细胞制备当天用含有10% FBS的RPMI1640培养基封闭。将制备的来源于HLA-A*02:01转基因小鼠的脾细胞以1.25×105个细胞/孔接种,并将制备的来源于HLA-A*24:02转基因小鼠的脾细胞以5×105个细胞/孔接种,各自都在封闭的ELISPOT板中。将肽(SEQ ID NO:3、5)以40 mg/mL溶解于DMSO中,并用含有10% FBS的RPMI 1640培养基进一步稀释至40μg/mL。将稀释的肽(SEQ ID NO:3)以10μg/mL的终浓度添加至HLA-A*02:01转基因小鼠来源的脾细胞。此外,将稀释的肽(SEQ ID NO:5)以10μg/mL的终浓度添加至HLA-A*24:02转基因小鼠来源的脾细胞。此后,将细胞在37℃、5% CO2下培养18-20小时,以在体外用肽再刺激。培养后,除去上清液,并根据所附方案使ELISPOT板显色。通过ImmunoSpot分析仪(由C.T.L.制造)测量显色的斑点的数量。
使用HLA-A*02:01转基因小鼠的IFNγ ELISPOT测定的结果显示于图1中,并且使用HLA-A*24:02转基因小鼠的IFNγ ELISPOT测定的结果显示于图2中。
在图1和2中,纵轴显示在接种细胞中反应的细胞数,而横轴显示在体外脉冲的肽。在图1中,黑色条显示通过脉冲SEQ ID NO:3中所示的肽的HLA-A*02:01转基因小鼠来源的脾细胞的培养结果,而白色条显示没有脉冲的培养结果。也就是说,黑色条和白色条的值的差异显示肽特异性CTL的数量,并且显示施用上述癌症疫苗组合物在小鼠体内诱导对SEQ ID NO:3中所示的肽特异性的CTL。在图1中,白色条不显示值。这意味着当目标肽未被脉冲时,HLA-A*02:01转基因小鼠的脾细胞没有反应。作为该测试的结果,在来源于HLA-A*02:01转基因小鼠的脾细胞中证实了对SEQ ID NO:3中所示的肽特异性的IFNγ的产生。
此外,在图2中,黑色条显示通过脉冲SEQ ID NO:5中所示的肽的HLA-A*24:02转基因小鼠来源的脾细胞的培养结果,而白色条显示没有脉冲的培养结果。也就是说,黑色条和白色条的值的差异显示肽反应性细胞的数量,并且显示施用上述癌症疫苗组合物在小鼠体内诱导对SEQ ID NO:5中所示的肽特异性的CTL。在图2中,白色条不显示值。这意味着当目标肽未被脉冲时,HLA-A*24:02转基因小鼠的脾细胞没有反应。作为该测试的结果,在来源于HLA-A*24:02转基因小鼠的脾细胞中证实了对SEQ ID NO:5中所示的肽特异性的IFNγ的产生。
由此清楚的是,上述癌症疫苗组合物可以在体内诱导对SEQ ID NO:3和SEQ ID NO:5中所示肽特异性的CTL。因此,表明从其中包括肽(1)的肽是稳定的制剂和其中包括肽(2)的肽是稳定的制剂重新制备的制剂可以用作癌症疫苗。
[产业实用性]
根据本发明,可以提供含有WT1蛋白衍生的癌抗原肽且显示良好的悬浮性的悬浮液制剂和通过冷冻干燥该悬浮液制剂而获得且具有高稳定性的冷冻干燥的制剂,并且可以使用该肽作为癌症疫苗。
本申请基于在日本提交的专利申请号2014-197667(申请日:2014年9月27日),其内容完全并入本文。
序列表
<110> Sumitomo Dainippon Pharma Co., Ltd.
<120> 注射用药物组合物
<130> 092363
<150> JP 2014-197667
<151> 2014-09-27
<160> 6
<210> 1
<211> 18
<212> PRT
<213> 智人
<220>
<223> 肽
<400> 1
Trp Ala Pro Val Leu Asp Phe Ala Pro Pro Gly Ala Ser Ala Tyr Gly
1 5 10 15
Ser Leu
<210> 2
<211> 449
<212> PRT
<213> 智人
<400> 2
Met Gly Ser Asp Val Arg Asp Leu Asn Ala Leu Leu Pro Ala Val Pro
1 5 10 15
Ser Leu Gly Gly Gly Gly Gly Cys Ala Leu Pro Val Ser Gly Ala Ala
20 25 30
Gln Trp Ala Pro Val Leu Asp Phe Ala Pro Pro Gly Ala Ser Ala Tyr
35 40 45
Gly Ser Leu Gly Gly Pro Ala Pro Pro Pro Ala Pro Pro Pro Pro Pro
50 55 60
Pro Pro Pro Pro His Ser Phe Ile Lys Gln Glu Pro Ser Trp Gly Gly
65 70 75 80
Ala Glu Pro His Glu Glu Gln Cys Leu Ser Ala Phe Thr Val His Phe
85 90 95
Ser Gly Gln Phe Thr Gly Thr Ala Gly Ala Cys Arg Tyr Gly Pro Phe
100 105 110
Gly Pro Pro Pro Pro Ser Gln Ala Ser Ser Gly Gln Ala Arg Met Phe
115 120 125
Pro Asn Ala Pro Tyr Leu Pro Ser Cys Leu Glu Ser Gln Pro Ala Ile
130 135 140
Arg Asn Gln Gly Tyr Ser Thr Val Thr Phe Asp Gly Thr Pro Ser Tyr
145 150 155 160
Gly His Thr Pro Ser His His Ala Ala Gln Phe Pro Asn His Ser Phe
165 170 175
Lys His Glu Asp Pro Met Gly Gln Gln Gly Ser Leu Gly Glu Gln Gln
180 185 190
Tyr Ser Val Pro Pro Pro Val Tyr Gly Cys His Thr Pro Thr Asp Ser
195 200 205
Cys Thr Gly Ser Gln Ala Leu Leu Leu Arg Thr Pro Tyr Ser Ser Asp
210 215 220
Asn Leu Tyr Gln Met Thr Ser Gln Leu Glu Cys Met Thr Trp Asn Gln
225 230 235 240
Met Asn Leu Gly Ala Thr Leu Lys Gly Val Ala Ala Gly Ser Ser Ser
245 250 255
Ser Val Lys Trp Thr Glu Gly Gln Ser Asn His Ser Thr Gly Tyr Glu
260 265 270
Ser Asp Asn His Thr Thr Pro Ile Leu Cys Gly Ala Gln Tyr Arg Ile
275 280 285
His Thr His Gly Val Phe Arg Gly Ile Gln Asp Val Arg Arg Val Pro
290 295 300
Gly Val Ala Pro Thr Leu Val Arg Ser Ala Ser Glu Thr Ser Glu Lys
305 310 315 320
Arg Pro Phe Met Cys Ala Tyr Pro Gly Cys Asn Lys Arg Tyr Phe Lys
325 330 335
Leu Ser His Leu Gln Met His Ser Arg Lys His Thr Gly Glu Lys Pro
340 345 350
Tyr Gln Cys Asp Phe Lys Asp Cys Glu Arg Arg Phe Ser Arg Ser Asp
355 360 365
Gln Leu Lys Arg His Gln Arg Arg His Thr Gly Val Lys Pro Phe Gln
370 375 380
Cys Lys Thr Cys Gln Arg Lys Phe Ser Arg Ser Asp His Leu Lys Thr
385 390 395 400
His Thr Arg Thr His Thr Gly Lys Thr Ser Glu Lys Pro Phe Ser Cys
405 410 415
Arg Trp Pro Ser Cys Gln Lys Lys Phe Ala Arg Ser Asp Glu Leu Val
420 425 430
Arg His His Asn Met His Gln Arg Asn Met Thr Lys Leu Gln Leu Ala
435 440 445
Leu
<210> 3
<211> 9
<212> PRT
<213> 智人
<220>
<223> 肽
<400> 3
Arg Met Phe Pro Asn Ala Pro Tyr Leu
1 5
<210> 4
<211> 10
<212> PRT
<213> 人工
<220>
<223> 肽
<400> 4
Cys Arg Met Phe Pro Asn Ala Pro Tyr Leu
1 5 10
<210> 5
<211> 9
<212> PRT
<213> 人工
<220>
<223> 肽
<400> 5
Cys Tyr Thr Trp Asn Gln Met Asn Leu
1 5
<210> 6
<211> 9
<212> PRT
<213> 智人
<220>
<223> 肽
<400> 6
Cys Met Thr Trp Asn Gln Met Asn Leu
1 5
- 还没有人留言评论。精彩留言会获得点赞!