使用生物可降解的聚合物纳米复合材料的骨再生以及其应用的制作方法
本公开是由政府支持在美国国防部颁发的批准号W81XWH-10-2-0130下做出的。政府对本公开具有一定的权利。
相关专利申请的交叉引用
该PCT申请要求由Alexandru S.Biris在2014年10月8日提交的名称为“使用生物可降解的聚合物纳米复合材料的骨再生以及其应用(BONE REGENERATION USING BIODEGRADABLE POLYMERIC NANOCOMPOSITE MATERIALS AND APPLICATIONS OF THE SAME)”的美国专利申请序列号14/509,719(以下称为'719申请)的优先权和权益。719申请是由Alexandru S.Biris在2013年7月22日提交的名称为“使用生物可降解的聚合物纳米复合材料的骨再生以及其应用(BONE REGENERATION USING BIODEGRADABLE POLYMERIC NANOCOMPOSITE MATERIALS AND APPLICATIONS OF THE SAME)”的美国专利申请序列号13/947,770(以下称为'770申请)的部分继续申请。'770申请是由Alexandru S.Biris和Peder Jensen在2006年9月11日提交的名称为“用于组织再生和骨再生的系统和方法(SYSTEM AND METHOD FOR TISSUE GENERATION AND BONE RECENERATION)”的美国专利申请序列号11/519,316的部分继续申请,现在专利号8,518,123和本身要求在2005年9月9日提交的美国临时申请序列号60/715,841,和在2005年10月13日提交的美国临时申请序列号60/726,383的优先权和权益。'770申请也要求在2013年3月15日提交的名称为“使用生物可降解的聚合物纳米复合材料的骨再生以及其应用(BONE REGENERATION USING BIODEGRADABLE POLYMERIC NANOCOMPOSITE MATERIALS AND APPLICATIONS OF THE SAME)”的美国临时申请序列号61/800,588的优先权和权益。
本申请也是由Alexandru S.Biris在2013年7月22日提交的名称为“生物可降解的聚合物纳米复合材料以及其应用(BIODEGRADABLE POLYMERIC NANOCOMPOSITE MATERIALS AND APPLICATIONS OF THE SAME)”的美国专利申请序列号13/947,827的部分继续申请,后者本身要求在2013年3月15日提交的名称为“使用生物可降解的聚合物纳米复合材料的骨再生以及其应用(BONE REGENERATION USING BIODEGRADABLE POLYMERIC NANOCOMPOSITE MATERIALS AND APPLICATIONS OF THE SAME)”的美国临时申请序列号61/800,588的优先权和权益。
在本公开的说明书中引用和讨论了一些参考文献,其可包括专利、专利申请和各种公布。提供这些参考文献的引用和/或讨论只是为了阐明本公开的说明书并不是承认任何此类参考是本文所述的公开内容的“现有技术”。在本说明书中引用和讨论的所有参考文献通过引用整体并入本文并且在相同程度上如同每个参考文献单独引用并入。
技术领域
本公开大体上涉及具有一种或多种用于骨和组织再生的基底结构的生物相容性结构,并且更具体地涉及并入聚合物、纳米结构羟基磷灰石和任选的其它有益因子的生物可降解和生物可再吸收的纳米复合物。
背景技术:
本文提供的背景描述是为了大体上呈现本公开的上下文。当前署名的发明人的工作就其在该背景部分所描述的以及在提交时可以不另外被作为现有技术的多个方面的描述而言既不明确地也不隐含地被认可为本公开的现有技术。
来自创伤、肿瘤和骨疾病、或异常发育的骨骼缺陷经常需要外科手术来尝试恢复正常的骨骼功能。虽然这些治疗大多数是成功的,但它们都有问题和局限性。
因此,本领域迄今尚未解决上述缺陷和不足。
技术实现要素:
本公开的某些方面涉及包括两种或更多种生物相容性结构的植入体。生物相容性结构的每一个都是生物可降解和生物可再吸收的。
在一个方面中,本公开涉及一种制造用于骨和组织再生的生物相容性结构的方法。该方法包括:
通过以下步骤形成多个第一聚合物层:将第一聚合物溶解在第一溶剂中以形成第一溶液;将第一组织形成纳米颗粒加入所述第一溶液中以形成第二溶液,其中所述第一组织形成纳米颗粒与所述第一聚合物的第一重量百分比是约0.01-95%;将所述第二溶液施加到第一表面以在第一表面上形成第一聚合物膜,其中所述第一组织形成纳米颗粒分散在所述第一聚合物膜中;以及将所述第一聚合物膜分成所述多个第一聚合物层;
通过以下步骤形成多个第二聚合物层:将第二聚合物溶解在第二溶剂中以形成第三溶液;将第二组织形成纳米颗粒加入所述第三溶液中以形成第四溶液,其中所述第二组织形成纳米颗粒与所述第二聚合物的第二重量百分比大于所述第一重量百分比;将所述第四溶液施加到第二表面以在所述第二表面上形成第二聚合物膜,其中所述第二组织形成纳米颗粒分散在所述第二聚合物膜中;以及将所述第二聚合物膜分成所述多个第二聚合物层;以及
通过第一聚合物层、第一分隔颗粒、所述第二聚合物层、第二分隔颗粒和第五溶液形成所述生物相容性结构。
在一个实施例中,所形成的生物相容性结构包括所述第一聚合物层、所述第二聚合物层、位于两个所述第一聚合物层之间的所述第一分隔颗粒以及位于两个所述第二聚合物层之间的所述第二分隔颗粒。
在一个实施例中,所述第五溶液包括所述第一组织形成颗粒和所述第二组织形成颗粒中的至少一种、所述第一聚合物和所述第二聚合物中的至少一种、以及所述第一溶剂和所述第二溶剂中的至少一种。
在一个实施例中,形成所述多个第一聚合物层的所述步骤进一步包括:搅拌所述第一溶液以将所述第一聚合物均匀地分布在所述第一溶液中;超声处理所述第二溶液以将所述第一聚合物和所述第一组织形成纳米颗粒均匀地分布在所述第二溶液中;以及将在所述第一表面上的所述第二溶液干燥以在所述第一表面上形成所述第一聚合物膜。
在一个实施例中,形成所述多个第二聚合物层的所述步骤进一步包括:搅拌所述第三溶液以将所述第二聚合物均匀地分布在所述第三溶液中;超声处理所述第四溶液以将所述第二聚合物和所述第二组织形成纳米颗粒均匀地分布在所述第四溶液中;以及将在第二表面上的所述第四溶液干燥以在所述第二表面上形成所述第二聚合物膜。
在一个实施例中,形成所述生物相容性结构的所述步骤包括:通过交替地堆叠所述第一聚合物层和第一分隔层来构造第一基底结构,其中所述第一分隔层中每一个由所述第一分隔颗粒形成;通过交替地堆叠所述第二聚合物层和第二分隔层,在所述第一基底结构上构造第二基底结构,其中所述第二分隔层中每一个由所述第二分隔颗粒形成;将所述第五溶液施用到所述第一基底结构和所述第二基底结构以形成涂覆结构;以及将第三分隔颗粒加到所述涂覆结构以形成所述生物相容性结构。
在一个实施例中,在将所述第三分隔颗粒加到所述涂覆结构后,进一步包括对所述涂覆结构进行等离子体处理。等离子体处理可以是氮或氧等离子体处理。
在一个实施例中,所述第一聚合物层、所述第二聚合物层、所述第一基底结构、所述第二基底结构和所述生物相容性结构中的至少一个通过3D印刷或逐层2D印刷制造。
在一个实施例中,所述第一聚合物层的厚度、两个相邻的第一聚合物层之间的距离、所述第一分隔层的厚度、所述第一分隔颗粒的孔隙率中的至少一个分别不同于所述第二聚合物层的厚度、两个相邻的第二聚合物层之间的距离、所述第一分隔层的厚度、所述第二分隔颗粒的孔隙率,使得当施用于植入部位时,所述第一基底结构和所述第二基底结构中的每一个对应于所述植入部位中的组织类型,并且促进相应组织的再生。
在一个实施例中,所述第一基底结构的降解速率比所述第二基底结构的降解愤怒慢。
在一个实施例中,所述第一基底结构和所述第二基底结构中的每一个具有与植入部位的相应组织的尺寸和形状一致的尺寸和形状。
在一个实施例中,所述第一聚合物与所述第二聚合物相同,所述第一组织形成纳米颗粒与所述第二组织形成纳米颗粒不同,所述第一溶剂与所述第二溶剂相同,所述第一重量百分比是约15-30%,并且所述第二重量百分比是约10-25%。
在一个实施例中,所述第一聚合物与所述第二聚合物相同,所述第一组织形成纳米颗粒与所述第二组织形成纳米颗粒相同,所述第一溶剂与所述第二溶剂相同,所述第一重量百分比是约15-30%,并且所述第二重量百分比是约10-25%。
在一个实施例中,所述第一重量百分比是约17-23%,并且所述第二重量百分比是约15-20%。
在一个实施例中,所述第一重量百分比是约25%,并且所述第二重量百分比是约22%。
在一个实施例中,所述第一聚合物和第二聚合物中的每一种包含合成的生物可降解的聚合物、衍生自天然来源的生物可降解的聚合物或其混合物。合成的生物可降解的聚合物包括聚氨酯、聚丙交酯(PLA)、聚乙交酯(PGA)、聚(丙交酯-共-乙交酯)(PLGA)、聚(e-己内酯)、聚二氧杂环己酮、聚酐、三亚甲基碳酸酯、聚(β-羟基丁酸酯)、聚(g-乙基谷氨酸酯)、聚(DTH亚氨基碳酸酯)、聚(双酚A亚氨基碳酸酯)、聚(原酸酯)、聚氰基丙烯酸酯、聚磷腈或其混合物。所述衍生自天然来源的生物可降解的聚合物包括改性多糖、改性蛋白质或其混合物。所述第一组织形成纳米颗粒和所述第二组织形成纳米颗粒中的每一种包括羟基磷灰石、磷酸三钙、混合磷酸钙和碳酸钙的纳米颗粒、异种移植物的骨颗粒、同种异体移植物的骨颗粒、自体移植物的骨颗粒、异质移植物的骨颗粒、聚合物纳米颗粒、纳米纤维或其混合物。所述表面是聚四氟乙烯(PTFE)表面。所述第二组织形成颗粒包括纳米尺寸的骨颗粒、微米尺寸的骨颗粒或其混合物。
在一个实施例中,所述方法进一步包括将第三组织形成材料加到所述生物相容性结构。所述第三组织形成材料包括生物活性材料、细胞或其混合物。所述生物活性材料包括蛋白质、酶、生长因子、氨基酸、骨形态发生蛋白、血小板衍生生长因子、血管内皮生长因子或其混合物。所述细胞包括上皮细胞、神经元、神经胶质细胞、星形细胞、足细胞、乳腺上皮细胞、胰岛细胞、内皮细胞、间充质细胞、干细胞、成骨细胞、肌肉细胞、横纹肌细胞、成纤维细胞、肝细胞、韧带成纤维细胞、腱成纤维细胞、软骨细胞或其混合物。在一个实施例中,所述细胞包括干细胞、骨细胞或特定组织所需的细胞。
在一个实施例中,所述第一聚合物层和所述第二聚合物层中的至少一个具有约0.005-50厘米的长度、约0.002-50厘米的宽度和约0.001-500毫米的厚度,并且所述第一基底结构和所述第二基底结构中的每一个为圆柱形或球形。
在一个方面中,本公开涉及一种制造用于骨和组织再生的生物相容性结构的方法。在某些实施例中,所述生物相容性结构包括第一基底结构、第二基底结构和涂层。所述第一基底结构和所述第二基底结构中每一个包括多个聚合物层和多个去矿物质的骨组分颗粒层。在一个实施例中,将所述聚合物层和所述去矿物质的骨组分颗粒层交替地堆叠。所述涂层覆盖所述第一基底结构和所述第二基底结构。所述方法包括通过包括聚合物和溶剂的第一溶液的空气喷雾沉积、电喷雾、逐滴沉积、2D印刷或3D印刷来沉积所述聚合物层中的每一个,以及通过包括去矿物质的骨组分颗粒和所述溶剂的第二溶液的静电沉积或空气喷雾来沉积所述去矿物质的骨组分颗粒层中的每一个。
在一个方面中,本公开涉及一种生物相容性结构。在一个实施例中,所述生物相容性结构包括第一基底结构、被设置在所述第一基底结构上的第二基底结构、围绕所述第一基底结构和所述第二基底结构的涂层以及附着在所述涂层的外表面上的多个第三分隔颗粒。
在一个实施例中,所述第一基底结构包括多个第一聚合物层和被设置在所述两个相邻的第一聚合物层中的每一个之间的多个第一分隔层。所述多个第一聚合物层被堆叠成具有预定形状。所述第一聚合物层中每一个由第一聚合物和第一组织形成纳米颗粒形成。所述第一组织形成纳米颗粒与所述第一聚合物层的第一重量百分比在约0.5-95%的范围内。所述第一分隔层中每一个包括第一分隔颗粒。
在一个实施例中,所述第二基底结构包括多个第二聚合物层和被设置在所述两个相邻的第二聚合物层中的每一个之间的多个第二分隔颗粒层。所述多个第二聚合物层被堆叠成具有预定形状。所述第二聚合物层中每一个由第二聚合物和第二组织形成纳米颗粒形成。所述第二组织形成纳米颗粒与所述第二聚合物层的第二重量百分比在约0.5-95%的范围内。所述第一重量百分比大于所述第二重量百分比。所述第二分隔层中每一个包括第二分隔颗粒。
在一个实施例中,所述第一聚合物与所述第二聚合物相同,所述第一组织形成纳米颗粒是HAP纳米颗粒,所述第二组织形成纳米颗粒是纳米纤维,所述第一重量百分比是约15-30%,并且所述第二重量百分比是约10-25%。
在一个实施例中,所述第一聚合物与所述第二聚合物相同,所述第一组织形成纳米颗粒与所述第二组织形成纳米颗粒相同,所述第一分隔颗粒和所述第二分隔颗粒与所述第三分隔颗粒相同,所述第一重量百分比是约15-30%,并且所述第二重量百分比是约10-25%。
在一个实施例中,所述第一重量百分比是约17-23%,所述第二重量百分比是约15-20%。
在一个实施例中,所述第一重量百分比是约20%,所述第二重量百分比是约18%。
在一个实施例中,所述第一聚合物层的厚度、两个相邻的第一聚合物层之间的距离、所述第一分隔层的厚度、所述第一分隔颗粒的孔隙率中的至少一个分别不同于所述第二聚合物层的厚度、两个相邻的第二聚合物层之间的距离、所述第一分隔层的厚度、所述第二分隔颗粒的孔隙率,使得当施用于植入部位时,所述第一基底结构和所述第二基底结构中的每一个对应于所述植入部位中的组织类型,并且利于相应组织的再生。
在一个实施例中,两个相邻的第一聚合物层之间的所述距离大于两个相邻的第二聚合物层之间的所述距离。
在一个实施例中,所述第一分隔层中所述第一分隔颗粒的密度大于所述第二分隔层中所述第二分隔颗粒的密度。
在一个实施例中,所述第一基底结构的降解速率比所述第二基底结构的降解愤怒慢。
在一个实施例中,所述生物相容性结构的所述第一基底结构和所述第二基底结构中的每一个具有与所述植入部位的所述相应组织的尺寸和形状一致的尺寸和形状。
在一个实施例中,所述第一聚合物和所述第二聚合物中的每一种包括合成的生物可降解的聚合物、衍生自天然来源的生物可降解的聚合物或其混合物。
在一个实施例中,所述合成的生物可降解的聚合物包括聚氨酯、聚丙交酯(PLA)、聚乙交酯(PGA)、聚(丙交酯-共-乙交酯)(PLGA)、聚(e-己内酯)、聚二氧杂环己酮、聚酐、三亚甲基碳酸酯、聚(β-羟基丁酸酯)、聚(g-乙基谷氨酸酯)、聚(DTH亚氨基碳酸酯)、聚(双酚A亚氨基碳酸酯)、聚(原酸酯)、聚氰基丙烯酸酯、聚磷腈或其混合物。
在一个实施例中,所述衍生自天然来源的生物可降解的聚合物包括改性多糖、改性蛋白质或其混合物;
在一个实施例中,所述第一组织形成纳米颗粒和所述第二组织形成纳米颗粒中的每一种包括羟基磷灰石(HAP)、磷酸三钙、混合磷酸钙和碳酸钙的纳米颗粒、异种移植物的骨颗粒、同种异体移植物的骨颗粒、自体移植物的骨颗粒、异质移植物的骨颗粒、聚合物纳米颗粒、纳米纤维或其混合物。
在一个实施例中,所述第一分隔颗粒、所述第二分隔颗粒和所述第三分隔颗粒中的每一种包括纳米尺寸的骨颗粒、微米尺寸的骨颗粒、聚合物纳米颗粒、纳米纤维或其混合物。
在一个实施例中,所述第一分隔颗粒是骨颗粒,并且所述第二分隔颗粒是聚合物纳米颗粒或聚合物纳米纤维。
在一个实施例中,所述生物相容性结构进一步包括第三组织形成材料。
在一个实施例中,所述第三组织形成材料包括生物活性材料、细胞或其混合物。
在一个实施例中,所述生物活性材料包括蛋白质、酶、生长因子、氨基酸、骨形态发生蛋白、血小板衍生生长因子、血管内皮生长因子或其混合物。
在一个实施例中,所述细胞包括上皮细胞、神经元、神经胶质细胞、星形细胞、足细胞、乳腺上皮细胞、胰岛细胞、内皮细胞、间充质细胞、干细胞、成骨细胞、肌肉细胞、横纹肌细胞、成纤维细胞、肝细胞、韧带成纤维细胞、腱成纤维细胞、软骨细胞或其混合物。
在一个实施例中,所述第一聚合物层和所述第二聚合物层中的至少一个具有约0.05-200厘米的长度、约0.02-50厘米的宽度和约0.01-500毫米的厚度,并且所述第一支架和所述第二支架中的每一个为圆柱形、矩形或球形。
在一个实施例中,对权利要求的所述生物相容性结构进行等离子体处理。等离子体处理可以是氮或氧等离子体处理。
本公开的某些方面涉及一种治疗骨缺损的方法。该方法包括将植入物施用于植入手术部位。植入物包括一种或多种生物相容性结构。所述生物相容性结构包括被堆叠成具有预定形状的聚合物层、被设置在所述两个相邻聚合物层中每一个之间的骨颗粒层;围绕所述聚合物层和骨颗粒层的涂层;以及附着在所述涂层的外表面上的骨颗粒。所述聚合物层中每一个由聚合物和第一组织形成纳米颗粒形成。所述植入手术部位可能具有不同组织的缺损。所述植入物中每个生物相容性结构的预定形状被配置成符合所述植入手术部位的相应组织。所述第一组织形成纳米颗粒与所述聚合物的重量百分比是约5-50%,使得所述生物相容性结构的吸收速率基本上与所述生物相容性结构中的组织生成速率相匹配。
附图说明
附图说明了本公开的一个或多个实施例,并且与书面说明书一起用于解释本公开的原理。在整个附图中可以使用相同的附图标记来表示实施例中相同或相似的元件。
图1A说明了根据本公开的某些实施例的生物相容性结构。
图1B说明了根据本公开的某些实施例的插入到植入手术部位中的生物相容性结构。
图1C说明了图1B中圈出部分的放大视图。
图2A说明了根据本公开的某些实施例的具有两个基底结构的生物相容性结构。
图2B说明了根据本公开的某些实施例的生物相容性结构的基底结构。
图2C说明了根据本公开的某些实施例的生物相容性结构的基底结构的一部分。
图3A说明了根据本公开的某些实施例的具有一个基底结构的生物相容性结构。
图3B示意性地显示了根据本公开的某些实施例的低分辨率下的生物相容性结构的扫描电子显微镜图像。
图3C-3E示意性地显示了根据本公开的某些实施例的高分辨率下的生物相容性结构的扫描电子显微镜图像。
图4A和4B示意性地显示了根据本公开的某些实施例的用于制造具有两个基底结构的生物相容性结构的步骤。
图5示意性地显示了根据本公开的某些实施例的用于制造具有两个基底结构的生物相容性结构的步骤。
图6示意性地显示了根据本公开的某些实施例的用于制造具有两个基底结构的生物相容性结构的步骤。
图7A和7B示意性地显示了根据本公开的某些实施例的用于测量聚合物膜的最大负荷和最大应力的拉伸测试装置。
图8示意性地显示了根据本公开的某些实施例的聚合物膜的最大负荷。
图9示意性地显示了根据本公开的某些实施例的聚合物膜的最大应力。
具体实施方式
现在将参考附图在下文中更全面地描述本公开,在附图中显示了本公开的示例性实施例。然而,本发明可以以许多不同的形式实施并且不应被视为限于本文所阐述的实施例。相反,提供这些实施例使得本公开彻底并完整,并向本领域技术人员充分地传达本公开的范围。全文中相似的附图标记表示相似的元件。
在本公开的上下文中,以及在使用每个术语的具体上下文中,本说明书中使用的术语通常具有本领域的普通含义。用于描述本公开的某些术语在下文或说明书的其它地方有进行讨论,以向实践者提供关于本公开的说明的附加指导。为了方便起见,可以突出显示某些术语,例如使用斜体和/或引号。使用突出显示和/或大写字母对术语的范围和含义没有影响;一个术语的范围和含义在相同的上下文中是相同的,不管它是突出显示和/或以大写字母表示。应认识到,同样的事情可以用一种以上的方式叙述。因此,替代语言和同义词可以用于本文中讨论的任何一个或多个术语,对于术语是否在本文中进行阐述或讨论也没有任何特别的意义。提供某些术语的同义词。一个或多个同义词的叙述不排除使用其它同义词。在本说明书中的任何地方使用实例,包括本文所讨论的任何术语的实例,只是说明性的,并且不以任何方式限制本公开或任何示例术语的范围和含义。同样,本公开不限于本说明书中给出的各种实施例。
应当理解,当一个元件被称为在另一个元件“上”时,其可以直接地在另一个元件上或者其间可以存在插入元件。相反,当元件被称为“直接在另一个元件上”时,不存在插入元件。如本文所用,术语“和/或”包括相关的列出项目中一个或多个的任何和所有组合。
应当理解,虽然术语第一、第二、第三等在文中可以用于描述各种元件、组件、区域、层和/或部分,但是这些元件、组件、区域、层和/或部分不应受这些术语限制。这些术语只是用于将一个元件、组件、区域、层或部分与另一个元件、组件、区域、层或部分区分开来。因此,以下讨论的第一元件、组件、区域、层或部分可以被称为第二元件、组件、区域、层或部分,而不脱离本公开的教示。
应当理解,当一个元件被称为“在另一个元件上”、“附接到另一个元件”,“连接到另一个元件”、“与另一个元件耦合”、“接触另一个元件”等时,它可以直接在另一个元件上、附接到另一个元件,连接到另一个元件、与另一个元件耦合或接触另一个元件或也可以存在插入元件。相反,当将一个元件被称为例如“直接在另一个元件上”、“直接附接到另一个元件”、“直接连接到另一个元件”、“直接与另一个元件耦合”或“直接接触另一个元件”时,则不存在插入元件。本领域技术人员还将认识到,对与另一个特征“相邻”设置的结构或特征的引用可以具有与相邻特征重叠或在其下的部分。
本文使用的术语只是用于描述特定实施例,并且不用于限制本公开。如本文所使用,单数形式“一”和“所述”也用于包括复数形式,除非上下文另外明确指出。还应理解,当术语“包含(comprises)”和/或“包含(comprising)”、或“包括(includes)”和/或“包括(including)”或“具有(has)”和/或“具有(having)”在本说明书中使用时,其指定了所述特征、区域、整数、步骤、操作、元件和/或组件的存在,但不排除存在或添加一个或多个其它特征、区域、整数、步骤、操作、元件、组件和/或其群组。
此外,例如“下”或“底”以及“上”或“顶”的相对术语在本文中用以描述一个元件与另一个元件的关系,如图中所述。应当理解,除了图中所示的取向外,相对术语用以包括装置的不同取向。例如,如果将一个图中的装置翻转,则描述为在其它元件的“下”侧上的元件将在其它元件的“上”侧上取向。因此,示例性术语“下”可以包含下和上的取向,这取决于图的特定取向。类似地,如果将一个图中的装置翻转,则描述为在其它元件“下”或“下方”的元件将“在其它元件上”取向。因此,示例性术语“下”或“下方”可以包括上和下两者的取向。
除非另有定义,本文使用的所有术语(包括技术和科学术语)具有与本发明所属领域的普通技术人员通常理解的相同含义。还应理解,术语(例如常用字典中定义的那些术语)应被解释为具有与其在相关领域和本公开的上下文中的含义一致的含义,并不会以理想或过度正式的意义加以理解,除非文中明确定义。
如本文所用,术语“包含(comprise)”或“包含(comprising)”、“包括(include)”或“包括(including)”、“携带(carry)”或“携带(carrying)”、“具有(has/have)”或“具有(having)”、“含有(contain)”或“含有(containing)”、“涉及(involve)”或“涉及(involving)”等被理解为开放式的,即意味着包括但不限于此。
如本文所用,短语“A、B和C中的至少一个”应被解释为意指使用非排他性逻辑或的逻辑(A或B或C)。应理解,方法中的一个或多个步骤可以以不同的顺序(或同时)实施而不改变本公开的原理。
通常,除非另外说明,例如“约”、“近似”、“大体上”、“基本上”等的术语意指在给定值或范围的20%以内、优选地在10%以内、优选地在5%以内、以及甚至更优选地在3%以内。本文给出的数量是近似值,意指如果没有明确说明,可以推断出术语“约”、“近似”、“大体上”或“基本上”。
通常,“纳米级尺度(nanoscopic-scale)”、“纳米级(nanoscopic)”、“纳米尺度(nanometer-scale)”、“纳米尺度(nanoscale)”、“纳米-”前缀等是指宽度或直径小于约1μm,优选地在一些情况中小于约100nm的元件或制品。指定的宽度可以是最小宽度(即,指定的宽度,在该位置处,制品在不同的维度上可以具有较大的宽度)或最大宽度(即,在该位置处,制品的宽度不宽于指定值,但可以具有更大的长度),除非另有指出。
在大多数组织创伤中,在人或动物的植入手术部位中存在多于一种类型的组织的损失。生物相容性结构可以适于包括具有不同性质的多个基底结构,从而促进人或动物的植入手术部位的两个或更多个组织的再生,或促进人或动物的非植入手术部位的组织再生,然后转移到植入部位,或促进体外或实验室中组织的再生,然后转移到植入手术部位。或者,生物相容性结构可以只具有一个基底结构。
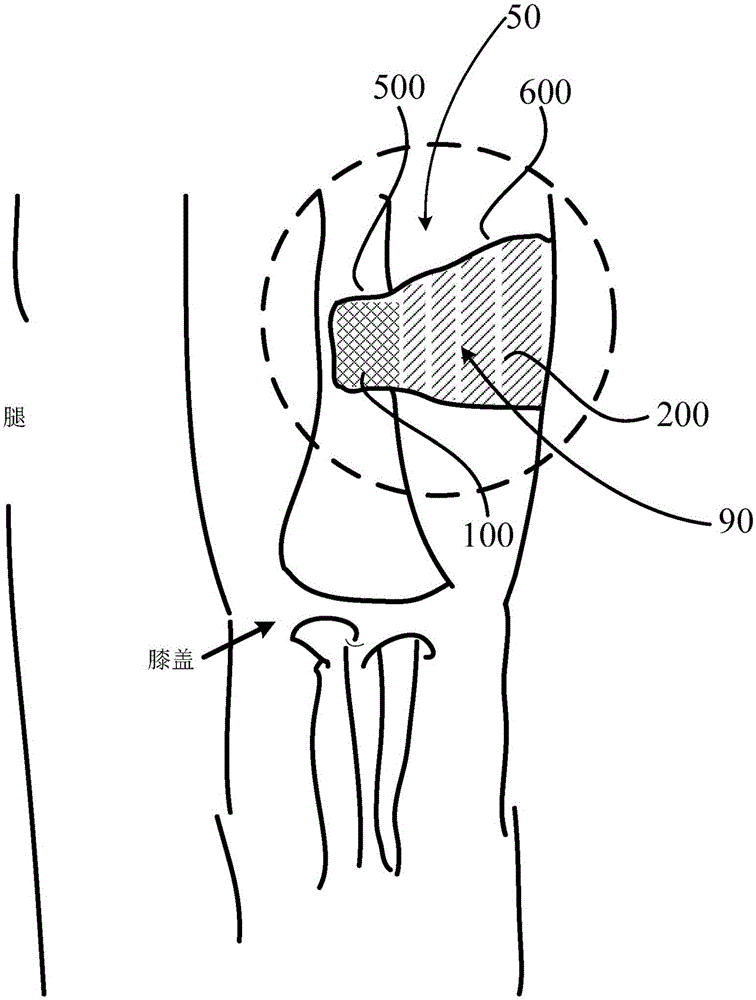
图1A示意性地显示了根据本公开的某些实施例的生物相容性结构90的结构。在图1A所示的一个实施例中,生物相容性结构90具有两个基底结构。或者,生物相容性结构90可以包括各种数量(例如三个、四个、五个和六个或更多个)基底结构。在一个实施例中,植入手术部位可能具有骨组织损失和肌肉组织损失。在某些实施例中,生物相容性结构90具有第一基底结构100和第二基底结构200,其具有用于促进植入部位中不同组织再生的不同性质。第一基底结构100具有特定的聚合物层厚度、聚合物层距离、分隔颗粒层厚度、分隔颗粒密度和降解速率,这些允许在植入手术部位的骨损失部分中的骨再生。第二基底结构200具有特定的聚合物层厚度、聚合物层距离、分隔颗粒层厚度、分隔颗粒密度和降解速率,这些允许在植入手术部位的肌肉组织损失部分中的肌肉再生。生物相容性结构90可以是符合植入部位形状的任何形状。例如,第一基底结构100和第二基底结构200中的每一个可以具有圆柱形状、矩形形状或球形形状。
在某些实施例中,生物相容性结构90中的基底结构100和200具有不同的性质,例如机械性质或生物性质,机械性能可以包括强度、孔密度等,并且不同的基底结构对应于植入手术部位中的不同组织。在某些实施例中,如图1B和图1C所示,植入手术部位50包括骨区域500和肌肉区域600。相应地,将包括第一基底结构100和第二基底结构200的生物相容性结构90施用于植入手术部位50。第一基底结构100的尺寸和形状对应于骨区域500的尺寸和形状,第一基底结构100的性质适于骨区域500中骨组织的再生。例如,基底100可以被配置成满足骨组织再生的需求,可以具有与要再生的组织匹配的机械性质,并且可以递送对骨再生具有特异性的生长因子、细胞和/或可以递送抗微生物剂。第二基底结构200的尺寸和形状对应于肌肉区域600的尺寸和形状,第二基底结构200的性质适于肌肉区域600中肌肉的再生,第二基底结构200可以携带细胞和/或对这种类型的组织再生具有特异性的生长因子。在其它实施例中,第一基底结构100和第二基底结构200对应于骨损失的不同部分,并且被配置用于骨损失的不同部分的组织再生。骨损失的不同部分具有不同的性质,例如,一个骨损失部分具有比其它骨损失部分更高的密度。
图2A示意性地显示了根据本公开的某些实施例的生物相容性结构90。生物相容性结构90可以包括一个或多个基底结构。在一个实施例中,生物相容性结构90包括第一基底结构100和第二基底结构200。基底结构中的每一个可以是符合植入部位的形状或形状的一部分的任何形状。例如,基底结构中的每一个可以具有圆柱形形状、矩形形状或球形形状。
如图2A-2C所示,生物相容性结构90包括第一基底结构100、第二基底结构200和围绕第一基底结构100和第二基底结构200的涂层300。
第一基底结构100包括堆叠在一起的两个或更多个第一聚合物层102。图2A中只显示了三个第一聚合物层102-1、102-2和102-3。但是,如图2B所示,第一聚合物层102的数量可以是m,其中m是正整数。在某些实施例中,第一基底结构100包括逐层堆叠的第一聚合物层102-1、第一分隔层106-1、第一聚合物层102-2、第一分隔层106-2、第一聚合物层102-3、第二分隔层106-3……第一分隔层106-(m-1)、第一聚合物层102-m和任选地第一分隔层106-m。如下所述,第一聚合物层102各自具有分散在第一聚合物基质114中的第一组织形成纳米颗粒112。在某些实施例中,第一组织形成纳米颗粒112的尺寸是约0.1nm至1000nm。在某些实施例中,第一组织形成纳米颗粒112的尺寸是约1nm至500nm。在某些实施例中,第一组织形成纳米颗粒112的尺寸是约2-300nm。在某些实施例中,第一组织形成纳米颗粒112的尺寸是约50-150nm。在某些实施例中,第一组织形成纳米颗粒112是羟基磷灰石(HAP)纳米颗粒。在某些实施例中,第一聚合物层102的厚度是约0.001mm-100mm。在某些实施例中,第一聚合物层102的厚度是约0.01mm-50mm。在某些实施例中,第一聚合物层102的厚度是约0.1mm-20mm。在某些实施例中,第一聚合物层102的厚度是约1mm-3mm。在某些实施例中,第一聚合物层102可以制成条带。在某些实施例中,第一聚合物层102各自可以具有0.005-50cm的长度、0.002-50cm的宽度和0.001-50mm的厚度。在某些实施例中,第一聚合物层102各自可以具有0.05-10cm的长度、0.02-5cm的宽度和0.01-5mm的厚度。在某些实施例中,第一聚合物层102各自可以具有0.5-5cm的长度、0.2-3cm的宽度和0.1-3mm的厚度。在某些实施例中,第一聚合物层102各自可以具有约1-3cm的长度、约0.5-2cm的宽度和约0.5-2mm的厚度。进一步,第一分隔颗粒116位于任何两个第一聚合物层102之间并可以用作第一聚合物层102之间的第一分隔层106。在某些实施例中,第一分隔颗粒116各自具有约2-100μm的直径。在某些实施例中,第一分隔颗粒116各自具有约0.5-1000μm的直径。在某些实施例中,第一分隔颗粒116各自具有约2-100μm的直径。在某些实施例中,第一分隔颗粒116各自具有约10-50μm的直径。在某些实施例中,第一分隔颗粒116部分地嵌入或捕获在第一聚合物层102的表面部分中。在某些实施例中,每个第一分隔层106可以具有近似0.001mm至近似50mm的厚度。在某些实施例中,第一分隔层106的厚度是约0.001mm-100mm。在某些实施例中,第一分隔层106的厚度是约0.01mm-50mm。在某些实施例中,第一分隔层106的厚度是约0.1mm-20mm。在某些实施例中,第一分隔层106的厚度是约1mm-3mm。在某些实施例中,每个第一分隔层106可以具有近似0.001mm至近似50mm,但通常小于3mm的厚度。这些层可以在体外、体内或原位彼此堆叠。在某些实施例中,第一分隔颗粒116可以是如下所述的骨颗粒或复合颗粒。在某些实施例中,第一分隔颗粒116可以是如下所述的HAP颗粒。在某些实施例中,一个第一聚合物层102的一部分可以接触相邻的第一聚合物层102的一部分。在某些实施例中,那些接触部分可以彼此交联。在某些实施例中,基底100被覆盖或包含由亲水性聚合物结构形成的表面膜,所述亲水性聚合物结构具有高液体吸收能力,使得在插入时就稍微增加了支架的尺寸并将其自身锁定在骨缺损中。
第二基底结构200包括堆叠在一起的两个或更多个第二聚合物层202。图2A中只显示了三个第二聚合物层202-1、202-2和202-3。。但是,如图2B所示,第二聚合物层202的数量可以是n,其中n是正整数。根据第一基底结构100和第二基底结构200所需的尺寸和厚度,整数m和n可以是相同值或不同值。在某些实施例中,第二基底结构200包括逐层堆叠在第一基底结构100上的第二聚合物层202-1、第二分隔层206-1、第二聚合物层202-2、第二分隔层206-2、第二聚合物层202-3、第二分隔层206-3……第二分隔层206-(n-1)、第二聚合物层202-n以及任选地第二分隔层206-n。在某些实施例中,第一基底结构和第二基底结构被第一分隔层106或第二分隔层206分开。在某些实施例中,第一基底结构和第二基底结构具有第一聚合物层102-第二分隔层206界面。在某些实施例中,第一基底结构和第二基底结构具有第一聚合物层102-第二聚合物层202界面。在某些实施例中,第一基底结构和第二基底结构具有第一分隔层106-第二聚合物层202界面。在某些实施例中,第一基底结构和第二基底结构具有第一分隔层106-第二分隔层206界面。
如下所述,第二聚合物层202各自具有分散在第二聚合物基质214中的第二组织形成纳米颗粒212。在某些实施例中,第二组织形成纳米颗粒212的尺寸是约0.1nm至1000nm。在某些实施例中,第二组织形成纳米颗粒212的尺寸是约1nm至500nm。在某些实施例中,第二组织形成纳米颗粒212的尺寸是约2-300nm。在某些实施例中,第二组织形成纳米颗粒112的尺寸是约50-150nm。第二组织形成纳米颗粒212的尺寸可以与第一组织形成纳米颗粒112相同或不同。在某些实施例中,第一基底结构100和第二基底结构200被配置用于不同骨部分的再生,并且第二组织形成纳米颗粒212是羟基磷灰石(HAP)纳米颗粒。在某些实施例中,第一基底结构和第二基底结构200被配置分别用于植入部位的骨损失和肌肉组织损失的再生,并且第二组织形成纳米颗粒212是聚合物纳米颗粒或纳米纤维。在某些实施例中,当第二基底结构200被配置用于肌肉组织的再生时,HAP纳米颗粒不适合作为第二组织形成纳米颗粒212。在某些实施例中,第二聚合物层202可以制成条带。在某些实施例中,第二聚合物层202各自可以具有0.005-50cm的长度、0.002-50cm的宽度和0.001-50mm的厚度。在某些实施例中,第二聚合物层202各自可以具有0.05-10cm的长度、0.02-5cm的宽度和0.01-5mm的厚度。在某些实施例中,第二聚合物层202各自可以具有0.5-5cm的长度、0.2-3cm的宽度和0.1-3mm的厚度。在某些实施例中,第二聚合物层202各自可以具有约1-3cm的长度、约0.5-2cm的宽度和约0.5-2mm的厚度。
进一步,第二分隔颗粒216位于任何两个第二聚合物层202之间并且可以用作第二聚合物层202之间的第二分隔层206。在某些实施例中,第二分隔颗粒216各自具有约0.002-100μm的直径。在某些实施例中,第二分隔颗粒216各自具有约0.002-1000μm的直径。在某些实施例中,第二分隔颗粒216各自具有约0.002-100μm的直径。在某些实施例中,第二分隔颗粒216各自具有约10-50μm的直径。在某些实施例中,第二分隔颗粒216可以与第一分隔颗粒116相同或不同。在某些实施例中,第二分隔颗粒216部分地嵌入或捕获在第二聚合物层202的表面部分中。在某些实施例中,第二分隔颗粒206是聚合物纳米颗粒或聚合物纳米纤维。第二聚合物纳米颗粒216或第二聚合物纳米纤维206可以通过电喷雾、空气喷雾或可以沉积聚合物纳米颗粒或纳米纤维的任何其它方法沉积在第二聚合物层202上。在某些实施例中,每个第二分隔层206可以具有近似0.001mm至近似50mm的厚度。在某些实施例中,第二分隔层206的厚度是约0.001mm-100mm。在某些实施例中,第二分隔层206的厚度是约0.01mm-50mm。在某些实施例中,第二分隔层206的厚度是约0.1mm-20mm。在某些实施例中,第二分隔层206的厚度是约1mm-3mm。在某些实施例中,每个第二分隔层206可以具有近似0.001mm至近似50mm,但通常小于3mm的厚度。在某些实施例中,第二分隔层206可以具有与第一分隔层106的厚度相同或不同的厚度。这些层可以在体外、体内或原位彼此堆叠。在某些实施例中,第二分隔颗粒216可以是如下所述的骨颗粒或复合颗粒。在某些实施例中,当第二基底结构200被配置用于肌肉再生时,第二分隔颗粒216是并非HAP纳米颗粒的聚合物纳米颗粒,或者第二分隔颗粒216是聚合物纳米纤维。在某些实施例中,一个第二聚合物层202的一部分可以接触相邻的第二聚合物层202的一部分。在某些实施例中,那些接触部分可以彼此交联。
在某些实施例中,第一基底结构100和第二基底结构200具有不同的性质。在某些实施例中,第一组织形成纳米颗粒112和第二组织形成纳米颗粒212是相同的材料,第一聚合物基质114和第二聚合物基质214是相同的材料,并且第一分隔颗粒116和第二分隔颗粒216是相同的材料。或者,在某些实施例中,第一聚合物基质114和第二聚合物基质214是相同的材料,但是第一组织形成纳米颗粒112和第二组织形成纳米颗粒212是不同的材料,并且第一分隔颗粒116和第二分隔颗粒216是不同的材料。
在某些实施例中,第一组织形成纳米颗粒112和第二组织形成纳米颗粒两者都是HAP纳米颗粒,并且第一基底结构100和第二基底结构200的聚合物膜中的HAP纳米颗粒的重量百分比是不同的。在一个实施例中,第一聚合物膜102中HAP纳米颗粒的重量百分比大于第二聚合物膜202中HAP纳米颗粒的重量百分比。在某些实施例中,第一基底结构100与第二基底结构200的聚合物层之间的距离是不同的。在一个实施例中,第一基底结构100中第一聚合物层102之间的距离小于第二基底结构200中第二聚合物层202之间的距离。在某些实施例中,第一基底结构100中第一分隔颗粒116的尺寸、形状、密度和孔隙率中的至少一个与第二基底结构200中第二分隔颗粒216的那项不同。在某些实施例中,第一分隔层106的密度高于第二分隔层中206的密度。在某些实施例中,层的密度是每体积(例如,单位是立方毫米)的重量(例如,单位是克)。或者,层的密度可以是每体积(例如,单位是立方毫米)的颗粒数量(例如,纳米颗粒的数量)。在某些实施例中,第一基底结构100中第一分隔层106的厚度不同于第二基底结构200中第二分隔层206的厚度。在某些实施例中,第一基底结构100中第一分隔层106的厚度大于第二基底结构200中第二分隔层206的厚度。在某些实施例中,生物相容性结构的第一基底结构100和第二基底结构200可以具有不同的降解速率。在某些实施例中,第一基底结构100的降解速率比第二基底结构200的降解速率慢。
在某些实施例中,第一组织形成纳米颗粒112是HAP纳米颗粒并且第二组织形成纳米颗粒212是聚合物纳米颗粒或纳米纤维,并且第一基底结构100的聚合物膜中HAP纳米颗粒的重量百分比和第二基底结构200中聚合物纳米颗粒或纳米纤维的重量百分比是不同的。在一个实施例中,第一聚合物膜102中HAP纳米颗粒的重量百分比大于第二聚合物膜202中聚合物纳米颗粒或纳米纤维的重量百分比。在某些实施例中,第一基底结构100和第二基底结构200的聚合物层之间的距离是不同的。在一个实施例中,第一基底结构100中第一聚合物层102之间的距离小于第二基底结构200中第二聚合物层202之间的距离。在某些实施例中,第一基底结构100中第一分隔颗粒116的尺寸、形状、密度和孔隙率中的至少一个与第二基底结构200中第二分隔颗粒216的那项不同。在某些实施例中,第一分隔层106的密度高于第二分隔层中206的密度。在某些实施例中,层的密度是每体积的重量(例如,克/立方毫米)。或者,层的密度可以是每体积的颗粒数量(例如,纳米颗粒的数量/立方毫米或摩尔/立方毫米)。在某些实施例中,第一基底结构100中第一分隔层106的厚度不同于第二基底结构200中第二分隔层206的厚度。在某些实施例中,第一基底结构100中第一分隔层106的厚度大于第二基底结构200中第二分隔层206的厚度。在某些实施例中,生物相容性结构的第一基底结构100和第二基底结构200可以具有不同的降解速率。在某些实施例中,第一基底结构100的降解速率比第二基底结构200的降解速率慢。
在某些实施例中,生物相容性结构90包括聚合物涂层300,其包围堆叠的基底结构100和200。在某些实施例中,涂层300的表面可以具有捕获的第三分隔颗粒316。在某些实施例中,第三分隔颗粒316可以形成层并覆盖整个涂层300的主要部分。第三分隔颗粒316的材料可以与第一分隔颗粒106或第二分隔颗粒206的材料相同。在某些实施例中,第三分隔颗粒316各自具有约0.5-1000μm的直径。在某些实施例中,第三分隔颗粒316各自具有约2-100μm的直径。在某些实施例中,第三分隔颗粒316各自具有约10-50μm的直径。在某些实施例中,第三分隔颗粒316可以与第一分隔颗粒116或第二分隔颗粒216相同或不同。
如上所述,分散在第一聚合物层102中的第一组织形成纳米颗粒112或分散在第二聚合物层202中的第二组织形成纳米颗粒212是HAP纳米颗粒并且可以具有1-100纳米(nm)的尺寸范围。羟基磷灰石(也称为羟磷灰石(hydroxyapatite)(HA或HAP))是一种具有式Ca5(PO4)3(OH)的天然存在的矿物形式的钙磷灰石,但通常被写成Ca10(PO4)6(OH)2以表示晶体单胞包含两个实体。羟基磷灰石是复合磷灰石群组的羟基端员。OH-离子可以被氟离子、氯离子或碳酸根离子替代,产生氟磷灰石或氯磷灰石。其以六方晶系结晶。纯羟基磷灰石粉末是白色。但是,天然存在的磷灰石也可以具有棕色、黄色或绿色着色,与氟牙症的变色相当。高达50重量%的骨是羟基磷灰石的改性形式(称为骨矿物质)。在某些实施例中,分散在聚合物层中的HAP纳米颗粒可以由纯HAP组成,具有明显的结晶度和因表面上存在氧基而具有非常好的分配性。
其中,第一聚合物膜114中第一HAP纳米颗粒112的存在有助于第一聚合物膜114的孔径和强度。此外,当第一聚合物膜114用作植入材料时,第一HAP纳米颗粒112的浓度也与第一聚合物膜114的降解速率有关。第二聚合物膜214中第二HAP纳米颗粒212的存在尤其有助于第二聚合物膜214的孔径和强度。此外,当第二聚合物膜用作植入材料时,第二HAP纳米颗粒212的浓度也与第二聚合物膜214的降解速率有关。
在某些实施例中,第一HAP纳米颗粒112可以增强骨/骨细胞中的矿化。第一HAP纳米颗粒112与其它纳米材料一起具有增强骨细胞中成骨和矿化的能力。在某些实施例中,第二HAP纳米颗粒212与其它纳米材料一起具有加快肌肉细胞生长的能力。
在其它实施例中,分散在第一聚合物层102中的第一组织形成纳米颗粒112是HAP纳米颗粒并且分散在第二聚合物层202中的第二组织形成纳米颗粒212是聚合物纳米颗粒或纳米纤维。HAP纳米颗粒112和纳米纤维212可以具有1-100纳米(nm)的尺寸范围。
其中,第一聚合物膜114中第一HAP纳米颗粒112的存在有助于第一聚合物膜114的孔径和强度。此外,当第一聚合物膜114用作植入材料时,第一HAP纳米颗粒112的浓度也与第一聚合物膜114的降解速率有关。其中,第二聚合物膜214中聚合物纳米颗粒212的纳米纤维的存在有助于第二聚合物膜214的孔径和强度。此外,当第二聚合物膜用作植入材料时,聚合物纳米颗粒212的纳米纤维的浓度也与第二聚合物膜214的降解速率有关。
在某些实施例中,第一HAP纳米颗粒112可以增强骨/骨细胞中的矿化。第一HAP纳米颗粒112与其它纳米材料一起具有增强骨细胞中成骨和矿化的能力。在某些实施例中,纳米纤维或聚合物纳米颗粒212与其它纳米材料一起具有加快肌肉细胞生长的能力。
在某些实施例中,本公开的第一聚合物层102之间的第一分隔颗粒116或第二聚合物层202之间的第二分隔颗粒216是骨颗粒、聚合物纳米颗粒或聚合物纳米纤维。在某些实施例中,骨颗粒可以是自体移植物、同种异体移植物、异种移植物(通常是牛)或异体骨移植物(合成的,例如磷酸三钙)。在某些实施例中,利用骨矿物质产品或复合颗粒对第一和第二骨颗粒116和216进行处理。来自屠宰动物的骨头是一种可大量获得以制造骨矿物质的廉价原材料。骨通常含有50至60%的改性的羟基磷灰石形式的非常细小的晶粒,其通过胶原组织结合并且含有显著品质的蛋白物质和其它物质以及相关的脂肪和肌肉组织。这种纯态的改性的羟基磷灰石具有其重要的晶体结构,代表一种高度生物相容性的重塑骨植入材料。
在某些实施例中,第一骨颗粒和第二骨颗粒116和216包括具有特定结晶度、惯态和尺寸(不规则的片状形态,厚5-10nm,长10-50nm)的羟基磷灰石样晶体。第一骨颗粒和第二骨颗粒116和216的特定表面化学由钙与磷酸根的比率(37.5-38.0%钙和15.5-19.0%磷)产生。第一骨颗粒和第二骨颗粒116和216的无机相含有包括天然存在与通过去除有机相产生的晶体之间的超微结构间隙(10-100nm)的孔隙率,并且包括骨细胞陷窝、小管、血管通道、福尔克曼氏管(volkman's canals)和哈弗系统的管(100-500nm)的微观空间(1-20μm)。通过水银孔率法测定,作为孔隙率量度的比表面积在50至100m2/g的范围内。第一骨颗粒和第二骨颗粒116和216的结晶度可以通过X-射线衍射和利用电子显微镜的孔隙率和微晶形态和尺寸来表征。
在某些实施例中,本公开的第一骨颗粒和第二骨颗粒116和216是从Geistlich BioOss,INC.购买的去矿物质的骨颗粒。第一骨颗粒和第二骨颗粒116和216可以是牛来源并经处理,从而只剩下无机结构,但去除了有机材料。第一骨颗粒和第二骨颗粒116和216由具有0.01-100微米(μm)的直径的粉末颗粒组成。
在某些实施例中,第一分隔颗粒和第二分隔颗粒116和216可以是例如在实验室中制得的HAP的大颗粒或复合颗粒(聚合物和无机颗粒)。
在某些实施例中,分隔物216可以是具有2nm至100微米的直径的聚合物颗粒、聚合物纳米颗粒或纳米纤维。纳米纤维的长度可以在2nm与几厘米之间变化,并且可以由用于层202的相同聚合物或不同的聚合物制得。
在某些实施例中,第一基底结构100可以包括第一生物活性材料126。在某些实施例中,可以将第一生物活性材料126喷雾在第一基底结构100的表面上和/或并入第一聚合物结构102中以促进骨生长。
在某些实施例中,第二基底结构200可以包括第二生物活性材料226。在某些实施例中,可以将第二生物活性材料226喷雾在第二基底结构200的表面上和/或并入第二聚合物结构202中以促进肌肉生长。
第一生物活性物质和第二生物活性物质126和226可以是蛋白质/肽、HA、药物、生长因子、抗生素(例如四环素、妥布霉素或其它)和骨形态发生蛋白。优选的第一生物活性剂和第二生物活性剂126和226是增强组织再生和/或组织粘附的那些。说明性实例包括生长因子、抗生素、免疫刺激剂和免疫抑制剂。在一个实施例中,第一生物活性剂和第二生物活性剂126和226中的一种可以是骨形态发生蛋白,例如骨形态形成蛋白(BMP)。在另一个实施例中,第二生物活性剂和第一生物活性剂226和126中的一种可以是生长因子,例如成纤维细胞生长因子(FGF)或促进结缔组织生成的药剂。在某些实施例中,第一生物活性剂126促进骨组织的再生并且第二生物活性剂226促进肌肉组织的再生。
在某些实施例中,组织也可以通过将生物相容性结构90和干细胞或其它类型的合适细胞(用于肝组织生长的肝细胞;用于替换/恢复损伤的心脏组织的心肌肉细胞、肌肉细胞;用于皮肤移植物的上皮细胞、结缔组织细胞;用于骨生成的成骨细胞)植入到植入部位而体内生长。或者,组织可以在生物相容性结构90上体外生长,然后植入(例如,用于动脉移植物的结缔组织/冠状血管的生长)。
合适的活细胞可以在植入前放置在生物相容性结构90中,或者与生物相容性结构90一起植入体内。活细胞包括上皮细胞(例如角质细胞、脂肪细胞、肝细胞)、神经元、神经胶质细胞、星形胶质细胞、足细胞、乳腺上皮细胞、胰岛细胞、内皮细胞(例如,主动脉、毛细血管和静脉内皮细胞)和间充质细胞(例如,真皮成纤维细胞、间皮细胞、成骨细胞)、平滑肌细胞、横纹肌细胞、韧带成纤维细胞、腱成纤维细胞、软骨细胞、成纤维细胞和各种干细胞中的任一种。也适用于具有一个或多个基底结构的生物相容性结构90是基因改性的细胞、免疫屏蔽的细胞等。可以将合适的细胞外基质蛋白(ECM)加入到生物相容性结构中以进一步促进支架内的细胞向内生长、组织发育和细胞分化。ECM蛋白可以包括纤维连接蛋白、层粘连蛋白、玻连蛋白、腱生蛋白、巢蛋白、血小板反应蛋白、弹性蛋白、明胶、胶原蛋白、原纤蛋白、分区蛋白、锚蛋白、软骨粘连蛋白、连接蛋白、骨涎蛋白、骨钙蛋白、骨桥蛋白、环蛋白、透明质粘连蛋白、粗纤维调节素、表皮整联配体蛋白和缰蛋白。
并入第一基底结构100和第二基底结构200中的额外的第一生物活性剂和第二生物活性剂126和226尤其包括有助于细胞生长、形态发生、分化和组织构建的生物活性大分子,包括生长因子、蛋白聚糖、糖胺聚糖和多糖。认为这些化合物含有用于组织结构发育或再生和功能的生物、生理和结构信息。
在某些实施例中,可以对具有一个或多个基底结构的生物相容性结构90进行等离子体处理/活化/电喷雾以使生物相容性结构10的表面官能化。表面处理可以改善生物相容性结构90的亲水性并促进细胞的定植和骨颗粒对生物相容性结构10的表面和孔的粘附。表面也可以通过电子或离子轰击、激光照射和/或通过影响表面附近的键的任何其它物理或化学表面反应来官能化。这些方法也可以有助于植入物的灭菌。等离子体处理破坏了聚合物的表面键。等离子体处理可以是氮或氧等离子体处理。在一个实例中,在氧等离子体处理后,氧原子“附着”到表面,改变表面的表面能,使得表面变得更亲水并且具有富氧和富氮的官能团。
本公开的具有一个或多个基底结构的生物相容性结构90是高度多孔的(例如,高表面积、空隙、空腔等的存在)、生物相容的并允许骨/组织再生的血管向内生长。在不同的条件或方法下,表面通常不会阻止任何生物实体相互作用并且是亲水性或潜在地变成亲水性。用于构建组织/骨工程和再生的结构的合适材料是某些聚合物、陶瓷、碳基材料以及金属和金属复合材料。在某些实施例中,本公开的第一基底结构100的第一聚合物层102或第二基底结构200的第二聚合物层202由聚氨酯形成。在某些实施例中,生物相容性结构90具有由可含有其它物质(例如生物活性物质或促进组织生长发生的物质)的聚合物材料组成的层状结构。那些物质可以在第一聚合物层102内或在聚合物层102的表面上和/或在第二聚合物层202内或在第二聚合物层202的表面上形成。一些生物可再吸收的聚合物可以或可以不需要酶来降解。层状多孔设计使得该结构具有非常高的表面积用于组织再生所必需的新血管形成和细胞生长。此外,干细胞、成骨细胞和其它类型的合适的细胞可以并入系统中以帮助组织产生。生物相容性结构90可以呈现特定应用可能需要的不同形状和尺寸。生物相容性结构90可以直接地或与医学销、螺钉或其它装置适当地定位在手术部位处。
具有一个或多个基底结构的生物相容性结构90被配置使得生物相容性结构90的降解速率或再吸收速率基本上与生物相容性结构10中的组织产生速率相匹配。生物相容性结构90的可控降解速率也可以提供生物相容性结构10中形成的生物活性物质或细胞的可控释放。聚合物可以具有与生物相容性结构10不同的降解速率,但是其显著地有助于生物相容性结构10的降解速率。因此,选择具有合适的降解性质的聚合物以制得本公开的生物相容性结构90。在某些实施例中,生物相容性结构200的第一基底结构100部分和第二基底结构200部分具有分别对应于植入部位的不同部分的组织类型的不同的降解速率。
聚合物层102和202可以通过几种机理降解。最常见的机理是扩散。进一步,生物相容性结构的生物活性物质(药剂)可以以各种方式扩散。生物活性剂(药物)可以具有由惰性扩散障壁包围的核心,惰性扩散障壁可以是膜、胶囊、微胶囊、脂质体和中空纤维。或者,活性剂可以分散或溶解在惰性聚合物中。通过聚合物基质的药物扩散是速率限制步骤,并且释放速率由聚合物的选择及其对要释放药物的扩散和分配系数的随后影响决定。通过调节生物活性剂或细胞的扩散方法以及生物相容性结构组件的组件,实现生物活性剂或细胞的合适速率。
在某些实施例中,在植入后,生物相容性结构90可以最终被身体吸收,例如通过将不溶于水的材料转化为水/液体可溶性材料,因此不需要通过手术去除。
在某些实施例中,生物相容性结构90中的聚合物层102或202是生物相容的、可加工的、可灭菌的并且能够响应于生物条件控制稳定性或降解。设计随时间降解的生物相容性结构10的原因通常超出了消除收回需要的明显需求。例如,用于骨固定的刚性金属植入物的高强度可能导致“应力屏蔽”的问题,而生物可再吸收的植入物可以在治愈时通过缓慢地将负载转移到骨骼来增加骨骼的最终强度。对于药物递送,可以精确地定制各种可降解系统的具体特性以实现药物或活性剂的最佳释放动力学。
用于医疗应用的理想的生物可降解聚合物层102或202通常具有足够的机械性能以匹配应用(强度足够但不太强),不引起炎症或其它毒性反应,一旦其降解,可被完全代谢,并且可灭菌并容易加工成具有可接受保质期的最终产品。一般而言,聚合物降解通过主链或端基中更大的亲水性、主链中水解基团之间更强的反应性、更小的结晶度、更大的孔隙率和更小的成品装置尺寸而加速。
可以使用各种合成的生物可降解聚合物来形成本公开的聚合物基质102或202,包括聚丙交酯(PLA)、聚乙交酯(PGA)、聚(丙交酯-共-乙交酯)(PLGA)、聚(e-己内酯)、聚二氧杂环己酮、聚酐、三亚甲基碳酸酯、聚(β-羟基丁酸酯)、聚(g-乙基谷氨酸酯)、聚(DTH亚氨基碳酸酯)、聚(双酚A亚氨基碳酸酯)、聚(原酸酯)、聚氰基丙烯酸酯和聚磷腈。也存在许多衍生自天然来源的生物可降解的聚合物,例如可用于形成本公开的聚合物基质的改性多糖(纤维素、几丁质、葡聚糖)或改性蛋白(纤维蛋白、酪蛋白)。
其它材料可以是酪氨酸衍生的聚碳酸酯聚(DTE-共-DT碳酸酯),其中通过酪氨酸-氨基酸-的侧基是乙酯(DTE)或游离羧酸酯(DT)。通过改变DTE与DT的比率,可以操纵材料的疏水/亲水平衡和体内降解速率。显示出,随着DT含量增加,孔径减小,聚合物变得更亲水并变成阴离子性,并且细胞更容易附着。
使这些材料进行水解(通过酯键)和氧化(通过醚键)。降解速率受PEO分子量和含量影响,并且吸水率最高的共聚物降解最快。
这些聚合物材料102和/或202也可以以使它们在生物环境中是稳定的,并且只在特定酶条件(纤溶酶等)下降解的方式开发。这些材料也可以包括人或动物纤维蛋白的部分表达片段,使得系统只与纤溶酶接触时降解。
聚合物114和/或214优选地在溶液中与合适的溶剂混合,并且可以将其它物质加入溶液中,例如胶原蛋白、药物、蛋白质、肽、羟基磷灰石晶体(HA)和抗生素,这取决于要生长的组织的类型。可以对该溶液进行超声处理以促进组分的混合。
通过选择合适的聚合物114和/或214,生物相容性结构90可实现治疗性、止痛和/或抗菌物质、生长因子、蛋白质、肽、药物、组织亚组分的可控供应,组织亚组分包括但不限于骨颗粒和羟基磷灰石,其促进生长、预防感染等。
在某些实施例中,生物相容性结构包括一个或多个基底结构。一个或多个基底结构可以具有不同的性质。例如,对于具有第一基底结构100和第二基底结构200的生物相容性结构90,基底结构100和200可以具有如下不同的性质。
在某些实施例中,第一聚合物膜/层102中第一组织形成纳米颗粒112的重量百分比被定义为第一组织形成纳米颗粒112的总重量(例如,克)除以用于制备第一聚合物膜102的第一组织形成纳米颗粒112的重量(克)和固体第一聚合物114的重量(克)的总和。例如,总共A克第一纳米颗粒112和总共B克第一聚合物114用于制备第一聚合物膜102。第一聚合物膜102中第一组织形成纳米颗粒112的重量百分比被计算为A/(A+B)。在某些实施例中,聚合物层102中第一组织形成纳米颗粒112的重量百分比是约0.05-95%。在某些实施例中,聚合物层102中第一组织形成纳米颗粒112的重量百分比是约5-60%。在某些实施例中,聚合物层102中第一组织形成纳米颗粒112的重量百分比是约10-30%。在某些实施例中,聚合物层102中第一组织形成纳米颗粒112的重量百分比是约15-25%。在某些实施例中,聚合物层102中组织形成纳米颗粒112的重量百分比是约20%。在某些实施例中,第二聚合物层202可以具有与第一聚合物层102相似的特征或不同的特征。在某些实施例中,聚合物层202中第二组织形成纳米颗粒212的重量百分比低于第一聚合物层102中的重量百分比。在某些实施例中,聚合物层202可以不含有组织形成纳米颗粒212。在某些实施例中,聚合物层202中组织形成纳米颗粒212的重量百分比比第一聚合物层102中的重量百分比低0.1-50%。在某些实施例中,聚合物层202中组织形成纳米颗粒212的重量百分比比第一聚合物层102中的重量百分比低1-5%。在某些实施例中,聚合物层202中组织形成纳米颗粒212的重量百分比比第一聚合物层102中的重量百分比低2%。
在某些实施例中,第一聚合物层102的第一聚合物基质114可以是聚氨酯。分散在第一聚合物基质114中的第一组织形成纳米颗粒112可以是HAP纳米颗粒。在某些实施例中,第二聚合物层202的第二聚合物基质214可以是聚氨酯。分散在第二聚合物基质214中的第二组织形成纳米颗粒212可以是HAP纳米颗粒,使得第一基底结构100和第二基底结构200被配置成再生骨损失的不同部分。在其它实施例中,分散在第二聚合物基质214中的第二组织形成纳米颗粒212可以是聚合物纳米颗粒或纳米纤维,使得第一基底结构100和第二基底结构200被配置成分别再生植入部位的骨损失和肌肉损失。
在某些实施例中,第一组织形成纳米颗粒112和第二组织形成纳米颗粒212是HAP纳米颗粒,并且第一聚合物114和第二聚合物214是相同的聚合物。聚合物膜中HAP纳米颗粒的重量百分比在第一基底结构100和第二基底结构200中是不同的。在一个实施例中,第一基底结构100的第一聚合物层102中HAP纳米颗粒的第一重量百分比是10-30%,并且第二基底结构200的第二聚合物层202中HAP纳米颗粒的第二重量百分比是8-28%。在一个实施例中,第一重量百分比是15-25%,并且第二重量百分比是13-23%。在一个实施例中,第一重量百分比是18-22%,并且第二重量百分比是16-20%。在一个实施例中,第一重量百分比是20%,并且第二重量百分比是18%。在某些实施例中,第一基底结构100中第一聚合物层102的厚度不同于第二基底结构200中第二聚合物层202的厚度。
在某些实施例中,第一组织形成纳米颗粒112是HAP纳米颗粒,第二组织形成纳米颗粒212是纳米纤维或聚合物纳米颗粒,并且第一聚合物114和第二聚合物214是相同的聚合物。第一聚合物膜102中HAP纳米颗粒的重量百分比不同于第二聚合物膜202中纳米纤维或聚合物纳米颗粒。在一个实施例中,第一基底结构100的第一聚合物层102中HAP纳米颗粒的第一重量百分比是10-30%,并且第二基底结构200的第二聚合物层202中纳米纤维或聚合物纳米颗粒的第二重量百分比是8-28%。在一个实施例中,第一重量百分比是15-25%,并且第二重量百分比是13-23%。在一个实施例中,第一重量百分比是18-22%,并且第二重量百分比是16-20%。在一个实施例中,第一重量百分比是20%,并且第二重量百分比是18%。在某些实施例中,第一基底结构100中第一聚合物层102的厚度不同于第二基底结构200中第二聚合物层202的厚度。
在某些实施例中,第一基底结构100中第一聚合物层102的尺寸和形状不同于第二基底结构200中第二聚合物层202的尺寸和形状。
在某些实施例中,第一聚合物层102和第二聚合物层202的厚度是约0.001mm-50mm。在某些实施例中,第一聚合物层102的厚度不同于第二聚合物层202的厚度。在某些实施例中,第一聚合物层102的厚度小于第二聚合物层202的厚度。在某些实施例中,第一聚合物层102的厚度是约0.1mm-20mm,并且第二聚合物层202的厚度是约0.2mm-30mm。在某些实施例中,第一聚合物层102的厚度是约2mm-5mm,并且第二聚合物层202的厚度是约3mm-10mm。在某些实施例中,第一聚合物层102的厚度是约3mm,并且第二聚合物层202的厚度是约5mm。
在某些实施例中,第一基底结构100与第二基底结构200中的聚合物层之间的距离是不同的。在某些实施例中,第一聚合物层102之间的距离大于第二聚合物层202之间的距离。在某些实施例中,第一聚合物层102之间的距离是约0.002mm-50mm,并且第二聚合物层202之间的距离是约0.001-40mm。在某些实施例中,第一聚合物层102之间的距离是约0.02mm-10mm,并且第二分隔层206的厚度是约0.01mm-8mm。在某些实施例中,第一聚合物层102之间的距离是约0.2mm-8mm,并且第二聚合物层202之间的距离是约0.1mm-6mm。在某些实施例中,第一聚合物层102之间的距离是约1mm-5mm,并且第二聚合物层202之间的距离是约0.5mm-3mm。在某些实施例中,第一聚合物层102之间的距离是约2mm,并且第二聚合物层202之间的距离是约1mm。
在某些实施例中,第一基底结构100中的第一分隔颗粒116不同于第二基底结构200中的第二分隔颗粒216。在某些实施例中,第一分隔颗粒116的尺寸、形状、密度和孔隙率不同于第二分隔颗粒216的尺寸、形状、密度和孔隙率。在某些实施例中,第一分隔层106的密度高于第二分隔层206的密度。在某些实施例中,第一分隔颗粒116的孔隙率小于第二分隔颗粒216的孔隙率。在某些实施例中,第一分隔颗粒116的孔隙率是约50-90m2/g,并且第二分隔颗粒216的孔隙率是约60-100m2/g。在某些实施例中,第一分隔颗粒116的孔隙率是约60-80m2/g,并且第二分隔颗粒216的孔隙率是约70-90m2/g。在某些实施例中,第一分隔颗粒116的孔隙率是约70m2/g,并且第二分隔颗粒216的孔隙率是约80m2/g。在某些实施例中,第一分隔颗粒216是骨颗粒或骨纳米颗粒,并且第二分隔颗粒226是聚合物纳米颗粒或聚合物纳米纤维。
在某些实施例中,第一基底结构100中第一分隔层106的厚度不同于第二基底结构200中第二分隔层206的厚度。在某些实施例中,第一分隔层106的厚度大于第二分隔层206的厚度。在某些实施例中,第一分隔层106的厚度是约0.002mm-50mm,并且第二分隔层206的厚度是约0.001mm-40mm。在某些实施例中,第一分隔层的厚度是约0.02mm-10mm,并且第二分隔层206的厚度是约0.01mm-8mm。在某些实施例中,第一分隔层106的厚度是约0.2mm-8mm,并且第二分隔层206的厚度是约0.1mm-6mm。在某些实施例中,第一分隔层106的厚度是约1mm-5mm,并且第二分隔层206的厚度是约0.5mm-3mm。在某些实施例中,第一分隔层106的厚度是约2mm,并且第二分隔层206的厚度是约1mm。
在某些实施例中,第一基底结构100中第一分隔层106的密度不同于第二基底结构200中第二分隔层206的密度。在一个实施例中,第一分隔层106的密度高于第二分隔层206的密度。
在某些实施例中,生物相容性结构90的第一基底结构100和第二基底结构200可以具有不同的降解速率。在一个实施例中,第一基底结构100的降解速率比第二基底结构200的降解速率慢。
当放置在植入部位时,患者的新组织可以横跨生物相容性结构的表面上的孔生长,并且在生物相容性结构的中空内部生长。
在某些实施例中,生物相容性结构90的第一基底结构100和第二基底结构200中的每一个可以接种有每种组织的相应类型的细胞(或干细胞)。例如,可以将骨形成细胞接种到第一基底结构100,并且可以将肌肉细胞接种到第二基底结构200。
在某些实施例中,生物相容性结构90中的基底结构的每一个可以利用抗生素和或相应的生长因子进行装饰。
在某些实施例中,基底结构的每一个可以在本体和表面上掺杂各种纳米材料。
在某些实施例中,当放置在植入部位50时,因为其形态特征,所以生物相容性结构90快速地从植入部位50吸收液体,并且体积膨胀约2-5%,使得生物相容性结构90将其自身锁定在植入部位50中并保持良好的附着。在某些实施例中,根据具有第一基底结构100和第二基底结构200的生物相容性结构90的组件、患者的状况和植入部位50,生物相容性结构90在放置在植入部位50后体积膨胀约1-50%。在一个实施例中,生物相容性结构90在放置在植入部位50后体积膨胀高达约10-15%。在一个实施例中,生物相容性结构90在放置在植入部位50后体积膨胀约2-5%。在一个实施例中,生物相容性结构90在放置在植入部位50后在体积膨胀约4%。在某些实施例中,生物相容性结构90的第一基底结构100部分和第二基底结构200部分可以具有不同的膨胀率。例如,生物相容性结构90的第一基底结构100和第二基底结构200中的每一个具有与植入部位50的相应组织部分的要求一致的膨胀率。在某些实施例中,根据具有第一基底结构100和第二基底结构200的生物相容性结构90的组件、患者的状况和植入部位50,第一基底结构100在放置在植入部位50的骨区域500后体积膨胀约0-8%,并且第二基底结构200在放置在植入部位50的肌肉区域600后体积膨胀约1-10%。在某些实施例中,第一基底结构100部分的膨胀比第二基底结构200部分的膨胀低。在一个实施例中,第一基底结构100在放置在骨区域500后体积膨胀约1-5%,并且第二基底结构200在放置在肌肉区域600后体积膨胀约2-6%。在一个实施例中,第一基底结构100在放置在骨区域500后体积膨胀约3%,并且第二基底结构200在放置在肌肉区域600后体积膨胀约4%。
在某些实施例中,根据具有第一基底结构100和第二基底结构200的生物相容性结构90的组件、患者的状况和植入部位50的状况,膨胀可能在植入过程的头30天内发生。在一个实施例中,膨胀在植入的头5天内发生。在一个实施例中,膨胀在植入的头24小时内发生。在一个实施例中,膨胀在植入的头12小时内发生。在一个实施例中,膨胀在植入的头6小时内发生。
在一个实施例中,植入物在头10天内稳定。也就是说,在头10天后,植入物没有实质性膨胀。在一个实施例中,植入物在头5天内稳定。在一个实施例中,植入物在头24小时内稳定。在一个实施例中,植入物在头12小时内稳定。在一个实施例中,植入物在头6小时内稳定。
在某些实施例中,第一基底结构100的膨胀发生时间和膨胀持续时间不用于第二基底结构200的那些时间。
图3A说明了根据本公开的某些实施例的具有一个基底结构的生物相容性结构30。
图3B示意性地显示了根据本公开的某些实施例的低分辨率下的具有一个基底结构的生物相容性结构30的扫描电子显微镜图像。生物相容性结构30在多孔聚合物膜基质和中空内部上具有骨颗粒316以促进细胞生长和血液流动。在图3B中,显示出生物活性材料326在生物相容性结构30的表面上。在某些实施例中,可以将生物活性材料326喷雾在生物相容性结构30的表面上和/或并入聚合物层中以促进骨生长。
图3C-3E示意性地显示了根据本公开的某些实施例的高分辨率下的具有一个基底结构的生物相容性结构30的扫描电子显微镜图像。如图3C-3E所示,由聚氨酯聚合物和羟基磷灰石纳米颗粒制成的生物相容性结构30的表面可以是非常粗糙的并且可以具有一个或多个聚合孔304。聚合孔304通常尺寸大。聚合孔304的尺寸可以是约0.001μm至约10mm。生物相容性结构30表面的纳米结构羟基磷灰石308可以具有约1nm至约500nm的尺寸,并且大部分的纳米结构羟基磷灰石308可以具有约2nm至约300nm的尺寸。因为骨颗粒所提供层体之间的间隔,所以生物相容性结构30内部是半空的。孔径应在纳米(nm)范围和微米(μm)范围内变化。
在某些实施例中,用于骨和组织再生的生物相容性结构90包括一个或多个基底结构。具有两个基底结构100和200的生物相容性结构90可以通过以下步骤制得。
如图4A所示,在操作402中,将第一聚合物114溶解在第一溶剂中以形成第一溶液。
在某些实施例中,第一聚合物114可以是合成的生物可降解的聚合物、衍生自天然来源的生物可降解的聚合物或它们的混合物。在某个实施例中,合适的合成的生物可降解的聚合物可包括聚氨酯、聚丙交酯(PLA)、聚乙交酯(PGA)、聚(丙交酯-共-乙交酯)(PLGA)、聚(e-己内酯)、聚二氧杂环己酮、聚酐、三亚甲基碳酸酯、聚(β-羟基丁酸酯)、聚(g-乙基谷氨酸酯)、聚(DTH亚氨基碳酸酯)、聚(双酚A亚氨基碳酸酯)、聚(原酸酯)、聚氰基丙烯酸酯、聚磷腈或它们的混合物。在某些实施例中,衍生自天然来源的生物可降解的聚合物可包括改性多糖(纤维素、几丁质、葡聚糖)、改性蛋白(纤维蛋白、酪蛋白)或它们的混合物。
在某些实施例中,第一聚合物114是具有50-65%的线性膨胀的酯型亲水性聚氨酯。第一聚合物114的吸水率随其组成变化,在30-90%之间任何一点上。第一聚合物114是热塑性的。或者,热固性第一聚合物114可以同样良好地工作。在某个实施例中,第一聚合物114可与其它聚合物混合以控制其降解速率。在某个实施例中,聚合物是具有约0.02-50mm的直径的颗粒粉末。
第一溶剂可以是甲醇或乙醇或所用聚合物的任何溶剂。在某个实施例中,也可以使用其它有机或无机溶剂(极性非质子和质子)。在某些实施例中,溶剂是丙酮、甲基乙基酮、硝基甲烷、正丙醇、正丁醇、异丙醇、碳酸亚丙酯、二甲基亚砜、乙腈、二甲基甲酰胺、乙酸乙酯和四氢呋喃、二氯甲烷中的至少一种。
将第一聚合物114均匀地分布在第一溶液中。在某些实施例中,可以使用低功率加热来帮助聚合物在溶剂中的溶解。在某些实施例中,使用搅拌来加速聚合物在第一溶液中的均匀分布。在某个实施例中,固体聚合物在溶剂中完全溶解后,第一溶液具有低粘度。
在操作406中,将第一组织形成纳米颗粒112添加到第一溶液中以形成第二溶液。
在某些实施例中,第一组织形成材料112可以包括羟基磷灰石(HAP)、磷酸三钙、混合磷酸钙和碳酸钙的纳米颗粒、异种移植物、同种异体移植物、自体移植物、异质移植物的骨颗粒或其混合物。
在某个实施例中,HAP纳米颗粒112具有1-100nm的尺寸范围。HAP纳米颗粒112可以由纯HAP组成,具有显著的结晶度,并且由于表面上存在氧基而具有非常好的分配性。
将第一聚合物114和第一组织形成材料112均匀地分布在第二溶液中。在某些实施例中,使用超声处理来加速第一聚合物114和第一组织形成材料112在第二溶液中的均质化。
第二溶液中第一聚合物114与第一组织形成材料112的重量百分比是约20:1至2:1。所述比率与所制得的第一基底结构100的特征相关。第一基底结构100的特征包括耐负载性和应力、孔隙率、降解速率等。在某些实施例中,可以调节聚合物第一114与第一组织形成材料112的比率以满足患者状况的需求,包括患者的骨或肌肉植入位置、大小和代谢率。
在某个实施例中,第一聚合物114是聚氨酯并且第一组织形成材料112是含有HAP纳米颗粒的HAP纳米粉末。添加的干燥HAP纳米粉末与添加的聚合物的干质量的重量比随使用目的而变化。
在某个实施例中,以下结合图8-9描述,如果干燥的HAP纳米粉末与聚氨酯的干质量的第一重量比低于25%(即,干燥的HAP纳米粉末在干燥的HAP纳米粉末和聚合物的干质量的总重量的重量百分比是约20%),则如下所述的所制得的第一聚合物膜102是坚硬的。如果干燥的HAP纳米粉末与聚氨酯的第一重量百分比高于40%,则如下所述的所制得的聚合物膜是脆弱的并容易断裂。在某个实施例中,HAP纳米颗粒112不允许聚合物链的良好交联。因此,以高比率的HAP纳米颗粒112制得的第一聚合物膜完全成粉状并且非常容易断裂。
在操作410中,将第二溶液施用到第一表面以在表面上形成第一聚合物膜。第一组织形成纳米颗粒112与聚合物的第一重量百分比是约0.5-95%。
在某个实施例中,通过将第二溶液施用到第一表面并使其干燥而形成第一聚合物膜。在某个实施例中,可以使第二溶液在室温(例如25℃)下干燥。在某个实施例中,将第二溶液温和地加热以在表面上形成聚合物膜,例如在高于室温(例如25℃)和低于80℃的温度下。在某个实施例中,干燥过程是在真空条件下。在某个实施例中,表面是特氟纶表面。在某个实施例中,第一表面是聚四氟乙烯(PTFE)表面。在某个实施例中,第二溶液可以在PTFE表面上在真空下和在温和加热下干燥少于24小时以形成聚合物膜。聚合物膜的厚度可以是约2-10mm。
在操作414中,将第一聚合物膜切成多个第一条带,即第一聚合物层102。
可以将第一层102切成任何合适的形状和尺寸以制得具有预定形状和尺寸的生物相容性结构。在某个实施例中,第一层102的每一个与其它条带相同。在某个实施例中,条带的每一个具有约0.002-50cm的长度、约0.002-50cm的宽度和约0.001-50mm的厚度。
同时或顺序地,可以使用上述操作402至414中所公开的材料和方法来制得多个第二条带202。具体地,如操作402所示,将第二聚合物214溶解在第二溶剂中以形成第三溶液。如操作406所示,将第二组织形成纳米颗粒212加入第三溶液中以形成第四溶液。第四溶液中第二聚合物214与第二组织形成材料212的第二重量百分比是约20:1至2:1。在某些实施例中,可以调节第二聚合物214与第二组织形成材料212的比率以满足患者状况的需求,包括患者的骨或肌肉植入位置、大小和代谢率。如操作410所示,将第四溶液施用到第二表面以在第二表面上形成第二聚合物膜。第二组织形成材料与聚合物的第二重量百分比是约0.5-95%。如操作414所示,将第二聚合物膜切成多个第二条带,即第二聚合物层202。
在某些实施例中,第二纳米颗粒212可以与第一纳米颗粒112相同或不同。在某些实施例中,第二聚合物214可以与第一聚合物114相同或不同。在某些实施例中,第二溶剂可以与第一溶剂相同或不同。在某些实施例中,第二表面可以与第一表面相同或不同。在某个实施例中,第二表面是第一表面。在某个实施例中,第二重量百分比不同于第一重量百分比,使得第一层102比第二条带202硬,即第一层102的密度大于第二条带202的密度。在某个实施例中,第一组织形成纳米颗粒112和第二组织形成纳米颗粒212两者都是HAP纳米颗粒。在其它实施例中,第一组织形成纳米颗粒112、第一聚合物114、第一溶剂和第一重量百分比中的至少一个不同于相应的第二组织形成纳米颗粒212、第二聚合物214、第二溶剂和第二重量百分比。在某些实施例中,第二组织形成纳米颗粒212是聚合物纳米颗粒或纳米纤维。
如图4B所示,通过将第一层102、第一骨颗粒层106、第二条带202和第二骨颗粒层206堆叠来形成生物相容性结构90。然后,通过由第五溶液形成的涂层300涂覆该结构,并且然后将第三骨颗粒316加到涂层300的表面上。第五溶液可以与第二溶液和/或第四溶液相同或不同。
图4B中只显示了三个第一聚合物层102-1、102-2和102-3以及三个第二聚合物层202-1、202-2、202-3。但是,如图2B所示,第一聚合物层102的数量可以是m,并且第二聚合物层的数量可以是n,其中m和n是正整数。
在某些实施例中,如操作418所示,第一聚合物层102-1被设置在表面上,第一分隔层106-1被堆叠在第一聚合物层102-1上,第一聚合物层102-2被堆叠在第一分隔层106-2上,第一分隔层106-2被堆叠在第一聚合物层102-2上,第一聚合物层102-3被堆叠在第一分隔层106-2上,并且第一分隔层106-3被堆叠在第一聚合物层102-3上。通过交替地设置第一聚合物层102和第一分隔层106,构建具有预定形状和尺寸的第一基底结构100。在某些实施例中,至少一个第一聚合物层102作为第一基底结构100的外层之一被定位。在某个实施例中,至少一个第一分隔层106作为第一基底结构100的外层之一被定位。
在某些实施例中,如操作422所示,第二聚合物层202-1被设置在第一分隔层106-3上,第二分隔层206-1被堆叠在第二聚合物层202-1上,第二聚合物层202-2被堆叠在第二分隔层206-1上,第二分隔层206-2被堆叠在第二聚合物层202-2上,并且第二聚合物层202-3被堆叠在第二分隔层206-2上。通过交替地设置第二聚合物层202和第二分隔层206,构建具有预定形状和尺寸的第二基底结构200。在某些实施例中,聚合物层202作为第二基底结构200的最外层被定位。在某个实施例中,第二分隔层206作为第二基底结构200的最外层之一被定位。在某些实施例中,第二聚合物层202作为与第一基底结构100相邻的最内侧层被定位。在某个实施例中,第二分隔层206作为与第一基底结构相邻的最内侧层被定位。因此,第一基底结构100与第二基底结构200之间的界面可以是第一聚合物层102-第二聚合物层202界面、第一聚合物层102-第二分隔颗粒层206界面、第一分隔层106-第二聚合物层202界面或第一分隔层106-第二分隔层206界面。
在某些实施例中,如图4B所示,通过交替地堆叠第一聚合物层102和第一分隔层106,以及将第二聚合物层202和第二分隔层106交替地堆叠在交替布置的第一聚合物层102和第一分隔层106上,在操作418和422的一个步骤中形成第一基底结构100和第二基底结构200。
操作422进一步可以包括液化堆叠的第一基底结构100和第二基底结构200。为了使整个结构保持在一起,通过例如移液来添加甲醇或聚合物的其它溶剂以在表面液化聚合物层102和202,使得当结构干燥时,分隔颗粒116和226可被“捕获”在聚合物层102和202中。分隔颗粒116和216可以部分地嵌入聚合物层102和202中。在聚合物层102和202重新固化后,骨颗粒层106和206与聚合物层102和202连接。
在此实施例中,使第一基底结构100和第二基底结构200在一个操作中液化。在某些实施例中,液化溶液可以是甲醇或可以液化基底结构的任何其它溶剂、第一溶液、第二溶液、第三溶液、第四溶液或任何其它溶液。在某些实施例中,可以使用相同的溶液或不同的溶液来液化第一基底结构100和第二基底结构200。在某些实施例中,将第一基底结构100和第二基底结构200单独地制造,单独地液化,单独地干燥,并且然后堆叠在一起。
在某些实施例中,当需要具有多于两个基底结构的生物相容性结构时,上述方法包括将多于两个,例如3、4、5、6或更多个基底结构堆叠在一起。
在操作426中,将第五溶液施用于第一基底结构100和第二结构200的堆叠结构以形成涂覆结构。在某些实施例中,第五溶液是第二溶液或第四溶液。在某个实施例中,第五溶液中组织形成纳米颗粒的重量百分比是在第二溶液中组织形成纳米颗粒的第一重量百分比与第四溶液中组织形成纳米颗粒的第二重量百分比之间。在某些实施例中,然后通过利用液体形式的聚合物膜覆盖来涂覆如上所述构建的堆叠结构。在某个实施例中,第五溶液是施用到堆叠结构前的粘性溶液。在某个实施例中,倾倒在堆叠结构的表面上的第五溶液的一部分渗透到堆叠结构的内部。倾倒的第五溶液在层叠结构的表面上形成涂层300并有助于将堆叠结构的组件保持在一起。
在某个实施例中,操作426进一步包括将第三分隔颗粒316添加到涂覆结构以形成生物相容性结构90。在某个实施例中,第三分隔颗粒316可以是纳米尺寸的骨颗粒、微米尺寸的骨颗粒或其混合物。然后将该结构在真空和温和热量下干燥过夜以形成根据本公开的生物相容性结构90。
生物相容性结构90可以是任何形状和尺寸,使得生物相容性结构90与需要再生的骨缺损的大小匹配。在某个实施例中,生物相容性结构90具有圆柱形形状或球形形状。在某好实施例中,生物相容性结构90的长度是约2.5cm(1英寸)并且直径是约0.1-1cm,其与需要更换的骨的直径相匹配。
在某个实施例中,所述方法进一步包括使具有一个或多个基底结构的生物相容性结构90进行等离子体处理。例如,一旦完全干燥,将生物相容性结构90放置在玻璃小瓶中用于储存。将生物相容性结构90在氧气、氮气或氧气和氮气的混合环境下通过射频(RF)等离子体放电装置进行等离子体处理。在某个实施例中,RF等离子体处理时间是约10-30分钟。在某个实施例中,RF等离子体处理时间是约5-15分钟。在某个实施例中,RF等离子体处理时间是约1-3分钟。在某个实施例中,将等离子体处理的生物相容性结构90灭菌并用于动物研究。等离子体处理的目的是破坏聚合物的表面键。在等离子体处理后,氧原子“附着”到表面,改变表面的表面能,使得表面变得更亲水并具有富含氧和氮的官能团。
在某个实施例中,制造生物相容性结构90的方法进一步包括将第三组织形成材料326加到生物相容性结构90中。在某个实施例中,第三组织形成材料326包括生物活性材料、细胞或其混合物。生物活性材料包括蛋白质、酶、生长因子、氨基酸、骨形态发生蛋白、血小板衍生生长因子、血管内皮生长因子或其混合物。细胞包括上皮细胞、神经元、神经胶质细胞、星形细胞、足细胞、乳腺上皮细胞、胰岛细胞、内皮细胞、间充质细胞、干细胞、成骨细胞、肌肉细胞、横纹肌细胞、成纤维细胞、肝细胞、韧带成纤维细胞、腱成纤维细胞、软骨细胞或其混合物。在某些实施例中,位于对应于第一基底结构100的生物相容性结构90的表面部分中的第三组织形成材料326不同于位于对应于第二基底结构200的生物相容性结构90的表面部分中的第三组织形成材料326。
在其它实施例中,如图5所示,第一基底结构100和第二基底结构200可以单独地在相同或分开的表面上形成,并且然后堆叠第一基底结构100和第二基底结构体,涂覆堆叠结构,并任选地进行等离子体处理以形成生物相容性结构。
或者,如图6所示,可以对第一基底结构100进行涂覆并任选地处理以形成第一生物相容性子结构。可以对第二基底结构100进行涂覆并任选地进行等离子体处理以形成第二生物相容性结构。然后将第一生物相容性子结构和第二生物相容性子结构堆叠在一起,涂覆并且任选地进行等离子体处理以形成生物相容性结构。或者,可以通过有机粘合剂结合,或通过任何其它方式,而不是另一种涂覆方法,进行经涂覆、干燥和任选地经等离子处理的第一生物相容性子结构和第二生物相容性子结构的组合,使得第一生物相容性子结构和第二生物相容性子结构稳定地组合成一体。
在某个实施例中,除了制造生物相容性结构90并且然后将其用作植入材料,生物相容性结构90也可以原位形成。例如,将第一聚合物层空气喷雾在植入部位或骨缺损区域,然后将第一层骨颗粒加入到聚合物层中并沉积在聚合物层上。然后,将第二聚合物层空气喷雾在第一骨颗粒层上,随后加入第二层骨颗粒。重复该过程直到包括交替的聚合物层和骨颗粒层的生物相容性结构与植入部位匹配或模拟需要替换的骨缺损。原位形成的生物相容性结构90也可以包括一个或多个基底结构。例如,首先形成一系列交替堆叠的第一聚合物层和第一骨颗粒层,对应于骨区域500;然后首先形成一系列交替堆叠的第一聚合物层和第一骨颗粒层,对应于肌肉区域600。
在某个实施例中,医学博士(MD)可以采取患者的3D计算机轴向断层扫描(CAT)并例如通过将CAT扫描文件发送给制造商来发送结果。然后,制造商可以根据本公开构建植入物以完全匹配实际的骨缺损。
根据图4A和图4B所示的过程提供一个实例。
在操作402中,将500ml甲醇加入到1L烧杯中。将烧杯置于磁力搅拌器上并使用磁力搅拌棒进行混合。然后将80克聚氨酯114加入到烧杯中的甲醇中。通过搅拌棒混合溶液以将聚氨酯完全地溶解在甲醇溶剂中并且将聚氨酯114均匀地分布在溶液中。聚氨酯的混合和溶解是在室温下。在某个实施例中,可以加热该溶液以加速该过程。
在操作406中,然后将20克HAP纳米颗粒112(例如,Berkeley Advanced Biomaterials,Inc.)加入溶液中。应用超声处理以保证HAP纳米颗粒112在溶液中的均匀分布。
在操作410中,从烧杯中吸取10ml溶液并施加到PTFE表面。在PTEF表面上形成一层薄溶液。使溶液薄层在室温下干燥一段可变时间以形成聚合物膜。或者,可以将PTFE表面上的溶液层放置在烘箱中加热或低压一段时间以加速聚合物膜的形成。在某个实施例中,温度可以是约30-70℃,并且加热时间是约2-1500分钟。在某个实施例中,允许第二溶液在PTFE表面上在真空下在温和热量下干燥少于24小时以形成聚合物膜。聚合物膜的厚度可以是约0.01-50mm。
在操作414中,然后将聚合物膜切成具有约0.05-20cm长度,约0.02-5cm宽度和约0.01-50mm厚度的相同条带。在某个实施例中,可以将聚合物膜切成具有不同形状和尺寸的条带。那些条带是第一聚合物层102。
操作402、406、410和414可用于制备第一多个层102。在相同的事项中,操作402、406、410和414可用于制备第二聚合物层202。第一聚合物层102的总重量中HAP纳米颗粒的重量百分比与第二聚合物层202中的重量百分比不同。在一个实施例中,第一聚合物层102的总重量中HAP纳米颗粒的第一重量百分比是约15-30%。在一个实施例中,第一聚合物层102的总重量中HAP纳米颗粒的第一重量百分比是约17-23%。在一个实施例中,第一聚合物层102的总重量中HAP纳米颗粒的第一重量百分比是约20%。在一个实施例中,第二聚合物层202的总重量中HAP纳米颗粒的第二重量百分比是约10-25%。在一个实施例中,第二聚合物层202的总重量中HAP纳米颗粒的第二重量百分比是约15-20%。在一个实施例中,第二聚合物层202的总重量中HAP纳米颗粒的第二重量百分比是约18%。在某些实施例中,第一重量百分比大于第二重量百分比。在某些实施例中,第一重量百分比比第二重量百分比大0.1-50%。在某些实施例中,第一重量百分比比第二重量百分比大0.5-10%。在某些实施例中,第一重量百分比比第二重量百分比大1-5%。在某些实施例中,第一重量百分比比第二重量百分比大2%。
在某些实施例中,如操作418所示,将第一聚合物层102-1、第一分隔层106-1、第一聚合物层102-2、第一分隔层106-2、第一聚合物层102-3、第一分隔层106-3……第一分隔层106-m、第二聚合物层202-1、第二分隔层206-1、第二聚合物层202-2、第二分隔层206-2、第二聚合物层202-3……第二聚合物层202-n堆叠以形成三维结构。
在该实例中,第一分隔层106的分隔颗粒116和第二分隔层206的分隔颗粒216是骨颗粒。在某些实施例中,第一骨颗粒116的骨颗粒密度和厚度与第二骨颗粒216的骨颗粒密度和厚度不同。在某些实施例中,第一骨颗粒116的密度大于骨颗粒216的密度。
在堆叠三维结构后,为了使整个结构保持在一起,通过例如移液来添加甲醇或聚合物的其它溶剂以在表面上使聚合物层102和202液化,使得当结构干燥时,骨颗粒116和206可被“捕获”在聚合物层102和202中。骨颗粒116和216可以部分地嵌入聚合物层102和202中。在聚合物层102和202重新固化后,骨颗粒层106和206与聚合物层102和202连接。或者,在三维结构的堆叠期间可以执行液化步骤两次或更多次。
在操作426中,将一定体积(例如1ml)甲醇/聚氨酯/HAP纳米颗粒溶液加到三维结构的表面并使其干燥。在一个实施例中,甲醇/聚氨酯/HAP纳米颗粒溶液是第二溶液或第四溶液。因此,在三维结构的表面上形成涂层300以形成涂覆结构。在某个实施例中,涂层300不仅覆盖三维结构的外部,而且可以渗透到三维结构的内部。
进一步,可以将与第一骨颗粒116和第二骨颗粒216相同的第三分隔颗粒316或其它合适的颗粒添加到涂层300的表面。
在某个实施例中,然后将涂覆结构在真空下干燥过夜。在某个实施例中,进一步对所述结构进行等离子体处理以形成生物相容性结构90。等离子体处理可以是氮或氧等离子体处理。
在某个实施例中,生物相容性结构90的第一基底结构100和第二基底结构200被配置成用于骨损失/植入部位的两个不同部分的再生,其中第一基底结构100对应于骨损失的硬质部分并且第二基底结构200对应于骨损失的较软部分。
根据图4A和图4B所示的过程提供一个实例。
在操作402中,将500ml甲醇加入到1L烧杯中。将烧杯置于磁力搅拌器上并使用磁力搅拌棒进行混合。然后将80克聚氨酯114加入到烧杯中的甲醇中。通过搅拌棒混合溶液以将聚氨酯完全地溶解在甲醇溶剂中并且将聚氨酯114均匀地分布在溶液中。聚氨酯的混合和溶解是在室温下。在某个实施例中,可以加热该溶液以加速该过程。
在操作406中,然后将20克HAP纳米颗粒112(例如,Berkeley Advanced Biomaterials,Inc.)加入溶液中。应用超声处理以保证HAP纳米颗粒112在溶液中的均匀分布。
在操作410中,从烧杯中吸取10ml溶液并施加到PTFE表面。在PTEF表面上形成一层薄溶液。使溶液薄层在室温下干燥一段可变时间以形成聚合物膜。或者,可以将PTFE表面上的溶液层放置在烘箱中加热或低压下一段时间以加速聚合物膜的形成。在某个实施例中,温度可以是约30-70℃,并且加热时间是约2-1500分钟。在某个实施例中,允许第二溶液在PTFE表面上在真空下在温和热量下干燥少于24小时以形成聚合物膜。聚合物膜的厚度可以是约0.01-50mm。
在操作414中,然后将聚合物膜切成具有约0.05-20cm长度,约0.02-5cm宽度和约0.01-50mm厚度的相同条带。在某个实施例中,可以将聚合物膜切成具有不同形状和尺寸的条带。那些条带是第一聚合物层102。
操作402、406、410和414可用于制备第一多个层102。在相同的事项中,操作402、406、410和414可用于制备第二聚合物层202,但是第二组织形成材料212是纳米纤维或聚合物纳米颗粒。第一聚合物层102的总重量中HAP纳米颗粒的重量百分比与第二聚合物层202中纳米纤维的重量百分比不同。在一个实施例中,第一聚合物层102的总重量中HAP纳米颗粒的第一重量百分比是约15-30%。在一个实施例中,第一聚合物层102的总重量中HAP纳米颗粒的第一重量百分比是约17-23%。在一个实施例中,第一聚合物层102的总重量中HAP纳米颗粒的第一重量百分比是约20%。在一个实施例中,第二聚合物层202的总重量中纳米纤维的第二重量百分比是约10-25%。在一个实施例中,第二聚合物层202的总重量中纳米纤维的第二重量百分比是约15-20%。在一个实施例中,第二聚合物层202的总重量中纳米纤维的第二重量百分比是约18%。在某些实施例中,第一重量百分比大于第二重量百分比。在某些实施例中,第一重量百分比比第二重量百分比大0.1-50%。在某些实施例中,第一重量百分比比第二重量百分比大0.5-10%。在某些实施例中,第一重量百分比比第二重量百分比大1-5%。在某些实施例中,第一重量百分比比第二重量百分比大2%。
在某些实施例中,如操作418所示,将第一聚合物层102-1、第一分隔层106-1、第一聚合物层102-2、第一分隔层106-2、第一聚合物层102-3、第一分隔层106-3……第一分隔层106-m、第二聚合物层202-1、第二分隔层206-1、第二聚合物层202-2、第二分隔层206-2、第二聚合物层202-3……第二聚合物层202-n堆叠以形成三维结构。
在该实例中,第一分隔层106的分隔颗粒116是骨颗粒并且第二分隔层206的分隔颗粒216是纳米纤维或聚合物纳米颗粒。在某些实施例中,第一骨颗粒116的骨颗粒密度和厚度与纳米纤维或聚合物纳米颗粒216的骨颗粒密度和厚度不同。在某些实施例中,第一骨颗粒116的密度大于纳米纤维或聚合物纳米颗粒216的密度。
在堆叠三维结构后,为了使整个结构保持在一起,通过例如移液来添加甲醇或聚合物的其它溶剂以在表面上使聚合物层102和202液化,使得当结构干燥时,骨颗粒116和纳米纤维或聚合物纳米颗粒216可被“捕获”在聚合物层102和202中。骨颗粒116和纳米纤维216可以部分地嵌入聚合物层102和202中。在聚合物层102和202重新固化后,骨颗粒层106和纳米纤维层或聚合物纳米颗粒层206与聚合物层102和202连接。或者,在三维结构的堆叠期间可以执行液化步骤两次或更多次。
在操作426中,将一定体积(例如1ml)甲醇/聚氨酯/HAP纳米颗粒溶液或甲醇/聚氨酯/纳米纤维溶液加到三维结构的表面并使其干燥。在一个实施例中,甲醇/聚氨酯/HAP纳米颗粒溶液甲醇/聚氨酯/纳米纤维溶液是第二溶液或第四溶液。因此,在三维结构的表面上形成涂层300以形成涂覆结构。在某个实施例中,涂层300不仅覆盖三维结构的外部,而且可以渗透到三维结构的内部。
进一步,可以将与第一骨颗粒116或第二纳米纤维或聚合物纳米颗粒216相同的第三分隔颗粒316或其它合适的颗粒添加到涂层300的表面。
在某个实施例中,然后将涂覆结构在真空下干燥过夜。在某个实施例中,进一步对所述结构进行等离子体处理以形成生物相容性结构90。
在某个实施例中,生物相容性结构90的第一基底结构100和第二基底结构200被配置成用于具有骨损失和肌肉损失的植入部位的再生。第一基底结构100对应于植入部位的骨丢失部分,促进骨组织的再生。第二基底结构200对应于植入部位的肌肉损失部分,促进肌肉组织的再生。
在某个实施例中,生物相容性结构90可以具有三个部分,一个对应于软质骨损失部分,一个对应于诗人骨损失部分,并且一个对应于肌肉部分。
根据上述实例,可以制得具有一个或多个基底结构的各种生物相容性结构90。在某些实施例中,基底结构可以在聚合物层中具有不同的HAP/纳米纤维/聚合物纳米颗粒浓度,其中聚合物膜中的HAP/纳米纤维/聚合物纳米颗粒浓度与相应的基底结构的特征密切相关。在某个实施例中,基底结构可以具有不同的聚合物层与聚合物层的距离。在某个实施例中,基底结构可以具有不同厚度的骨颗粒层或纳米纤维/聚合物纳米颗粒层。在某个实施例中,基底结构可以具有不同的颗粒孔密度。聚合物膜中HAP/纳米纤维/聚合物纳米颗粒的浓度以及颗粒层中颗粒的厚度和密度与所制得的生物相容性结构的特征密切相关。
3D印刷或附加制造是一种从数字模型制造几乎任何形状的三维实体的过程。使用附加过程实现3D打印,其中将材料的连续层放置成不同的形状。用于制造本公开的生物相容性结构的材料包括聚合物和颗粒,并且生物相容性结构基本上是分层结构。因此,在某些实施例中,本公开的生物相容性结构适于3D印刷。在其它实施例中,本公开的生物相容性结构也适于逐层2D印刷。
在某些实施例中,为植入手术部位构建3D模型。3D模型可以使用计算机辅助设计包或通过3D打印机创建。植入手术部位可以是具有骨和肌肉组织损失的骨和肌肉手术部位、需要冠状物的牙齿部位或需要更换的牙齿、具有组织或皮肤损失的组织或皮肤区域或需要植入物的患者的任何其它植入手术部位。3D模型可以基于例如x射线计算机断层(CT)图像、磁共振成像(MRI)图像或可以帮助构建3D模型的任何其它方法的3D图像来构建。3D模型可以基于手术部位的形状、尺寸、强度、力度或其它结构特征直接构建,或者基于分离组织(例如失去的牙齿)的形状、尺寸、强度、力度或其它结构特征,或与植入手术部位对称的正常身体部分的形状、尺寸、强度、力度或其它结构特征构建。在某些实施例中,3D结构模型数据库用于辅助植入手术部位的3D模型的构建。3D结构模型数据库可以从不同患者或对象收集的3D图像生成,并且通过适当的算法进行处理。一旦构建了植入手术部位或与植入手术部位互补的植入物的3D模型,就可以通过3D打印机生成植入物。
3D打印机是一种能够在计算机控制下执行附加过程的有限类型的工业机器人。可以使用来自Stratasys Inc、Hewlett-Packard Company、3D systems Corp.、the ExOne Company、Voxeljet AG、Group Gorge、Camtek LTD.等的3D打印机。在某个实施例中,可以使用Solidoodle、Cubify Cube、Stratasys Mojo、Hyrel E2Hobbyist或定制的RepRap 3D打印机或任何其它市售或实验室构建的3D打印机来生成本公开的植入物。
3D打印技术用于成型和分布式制造以及应用于建筑、构造(AEC)、工业设计、汽车、航空航天、军事、工程、土木工程、牙科和医疗行业、生物技术(人体组织更换)、时尚、鞋类、珠宝、眼镜、教育、地理信息系统、食品等众多领域。一项研究发现,开源3D印刷可能成为大众市场项目,因为国内3D打印机可以通过使消费者避免与购买普通家庭用品相关的成本来抵消其资金成本。
现在可使用多种附加过程。它们的不同之处在于层沉积以产生部件的方式和可以使用的材料。一些方法熔化或软化材料以产生层,例如,选择性激光熔化(SLM)或直接金属激光烧结(DMLS)、选择性激光烧结(SLS)、熔融沉积建模(FDM),而其它固化液体材料使用不同的复杂技术,例如立体光刻(SLA)。对于层压物品制作(LOM),将薄层切割成形并连接在一起(例如纸、聚合物、金属)。每种方法都有自己的优点和缺点,并且一些公司因此在粉末与聚合物之间选择用于构建物品的材料。
在本公开的某个实施例中,可以将HAP颗粒、骨颗粒、聚合物、溶液或聚合物膜用作3D打印机的材料以生成包括分层结构的植入物。
在某个实施例中,通过3D印刷或逐层2D印刷制造整个生物相容性结构,并用作植入物。在某个实施例中,由聚合物条带层和组织形成颗粒层的层形成的基底结构通过3D印刷或逐层2D印刷制得,并且然后组装以生成生物相容性结构。在某个实施例中,聚合物膜通过3D印刷或逐层2D印刷制造,并且然后用于生成基底结构。在某个实施例中,多种细胞,例如骨细胞、干细胞、成纤维细胞等可以接种或印刷在生物相容性结构、基底结构或聚合物膜上。
生物相容性结构90可以是任何形状、尺寸和重量以适合植入部位。在某个实施例中,通过手术从山羊的胫骨移除长骨,并且根据本公开的符合山羊的植入部位的生物相容性结构用于山羊的骨再生。
在某个实施例中,当具有一个基底结构100的生物相容性结构90用于为了骨再生的牙齿应用时,HAP纳米颗粒的浓度可以远高于用于一些其它骨再生(例如胫骨再生)的植入物或生物相容性结构中HAP纳米颗粒的浓度。在某个实施例中,用于牙齿应用的生物相容性结构90可以破碎并且形成大量具有高表面积的颗粒。
图7A和7B显示了根据本公开的某些实施例的用于测量具有各种浓度的聚氨酯和HAP纳米颗粒的聚合物膜750的最大负载和最大应力的拉力测试系统700。在一个实例中,使用ADMET 7600 EXPERT单柱通用机电测试机分析复合材料的机械性能。仪器通过在其轴向方向上拉伸聚合物膜进行“拉力测试”,并且使用eP2数字控制器和规格安全基准测试软件(Gauge Safe Basic Testing Software)立即生成“csv”文件。拉力测试系统700包括拉力测试结构710、数字控制器730和任选地计算机750。拉力测试结构710具有基座711、固定到基座711并且垂直于基座711的柱713、与彼此相对的两个底部把手717a和717b连接的底部头部715、与彼此相对的两个顶部把手719a和719b连接的顶部头部721、附接到柱子713的标尺723以及放置在柱子713中的轨道725。顶部头部721和底部头部715中至少一个与导轨725连接并可沿轨道725移动。在该实施例中,顶部头部721通过链条或电缆连接到电动机(未显示)并且链条或者电缆沿着轨道725拉动/驱动顶部头部721。顶部把手719a/719b一起移动并且以与顶部头部721相同的速度移动。
制得并测试聚合物膜750。在某个实施例中,聚合物膜750含有各种浓度的聚氨酯和HAP纳米颗粒。在一个实施例中,聚合物膜中HAP纳米颗粒的重量百分比分别是0%、0.5%、1%、2%、3%、5%、10%、15%、20%以及30%。如上所述,HAP纳米颗粒的重量百分比被定义为用于制备聚合物膜的HAP纳米颗粒粉末(克)的重量除以HAP纳米颗粒粉末(克)和用于制备聚合物膜750的固体聚合物(克)的总重量。用于测试的聚合物膜750具有预定的尺寸。在某些实施例中,聚合物膜750的尺寸是6cm×1.5cm×0.02cm。在某个实施例中,制备尺寸不同的具有相同浓度的HAP纳米颗粒的聚合物膜用于测试。
在最大负载和最大应力测试过程期间,顶部把手721a/721b和底部把手717a/717b夹在聚合物膜750的长度方向上的聚合物膜750的两端。将聚合物膜750的尺寸和要使用的力的参数输入到数字控制器730中。在某些实施例中,在计算中使用的聚合物膜的长度是通过刻度测量的例如从顶部把手719a/719b的底部边缘到底部把手717a/717b的顶部边缘的有效长度。在某些实施例中,如果夹在顶部把手7191/b和底部把手717a/b之间的聚合物膜750具有狗骨形状,则用于计算的长度是狗骨形状的狭窄部分。当测试开始时,电动机移动顶部头部721和底部头部715中的至少一个,例如顶部头部721。顶部把手719a/719b一起移动并以与顶部头部721相同的速度以预定速度拉动聚合物膜750。在某个实施例中,速度可以是每分钟0.01-2.5mm。顶部把手719a/719b以预定的速度沿轨道725移动以拉动聚合物膜750直到聚合物膜750断裂。记录聚合物膜750的原始尺寸、顶部把手719a/719b的移动速度、聚合物膜750将要断裂时的长度。计算最大负载和最大应力。在某些实施例中,通过计算机750的处理器(未显示)进行计算。最大负载是当聚合物膜断裂时施加到聚合物膜750的拉力(牛顿)。最大应力(KPa)是当聚合物膜750断裂时施加到聚合物膜750的拉力除以聚合物膜750的横截面积(原始宽度乘以聚合物膜750的原始厚度)。
对根据本公开制得的聚合物膜750进行负载和应力测试。在某些实施例中,聚合物膜含有各种浓度的聚氨酯和HAP纳米颗粒。
图8是二维坐标系中聚合物膜750的负载图,其显示了聚合物膜中HAP纳米颗粒的重量百分比与该聚合物膜的最大负载之间的函数关系。坐标系的X轴是HAP纳米颗粒的重量百分比,并且坐标系的Y轴是聚合物膜的最大负载。如图8所示,测量并计算含有0%、0.5%、1%、2%、3%、5%、10%、20%以及30%HAP纳米颗粒的聚合物膜750的最大负载(牛顿)。当HAP浓度从0%增加到约1%时,最大负载从约20牛顿(N)急剧增加到约44N。然后当HAP浓度从1%增加到约10%时,最大负载下降到约31N。之后,在约20%HAP浓度下,最大负载再次增加到约41N,并且在约30%HAP浓度下降至约38N。因此,负载图具有对应于1%和约20%的HAP浓度的两个峰。在某个实施例中,负载图中约20%HAP浓度下的第二个峰称为负载峰。
图9是二维坐标系中的聚合物膜750的应力图,其显示了聚合物膜中HAP纳米颗粒的重量百分比与该聚合物膜的最大负载之间的函数关系。坐标系的X轴是HAP纳米颗粒的重量百分比,并且坐标系的Y轴是聚合物膜550的最大应力。如图9所示,测量并计算含有0%、0.5%、1%、2%、3%、5%、10%、20%以及30%HAP纳米颗粒的聚合物膜的最大应力(KPa)。当HAP浓度从0%增加到约1%时,最大应力从约11,000KPa增加到约15,000KPa。然后当HAP浓度从1%增加到约3%时,最大应力降低到约13,600KPa。之后,当HAP浓度从约3%增加到约20%时,最大应力增加到约22,000KPa。将聚合物膜中的HAP浓度从约20%进一步增加到30%可导致最大应力从22,000降到约20,800KPa。因此,应力图具有对应于1%和20%的HAP浓度的两个峰。在某个实施例中,应力图中20%HAP浓度下的第二个峰称为应力峰。
在某些实施例中,可以使用计算机750根据一系列聚合物膜750的上述负载和应力图来计算聚合物膜750中HAP的最佳重量百分比。计算机750利用一个或多个CPU可以接收来自拉力测试结构710和数字控制器730的数据,运行计算软件,并且然后将结果呈现在监视器上。
基于来自计算机730的负载图和应力图的结果确定聚合物膜750中HAP的最佳重量百分比。在某些实施例中,负载图和应力图都具有至少两个峰。负载图中的第一峰804对应于较低的HAP浓度,并且负载图中的第二峰808对应于较高的HAP浓度。应力图中的第一峰904对应于较低的HAP浓度,并且应力图中的第二峰908对应于较高的HAP浓度。负载图中的第二峰808被称为负载峰808,并且应力图中的第二峰908被称为应力峰908。提取来自负载峰808和应力峰908的峰值。在此实例中,负载峰808和应力峰908都对应于20%的HAP重量百分比(HAP浓度)。确定负载峰808和应力峰708的最大值和最小值。在该实例中,最大值和最小值两者均为20%。最佳浓度范围具有上限值和下限值。上限值是最大值加上第一预定值。下限值是最小值减去第二预定值。第一预定值和第二预定值中的每一个可以是例如10%、5%或0%。因此,在该实例中,聚合物膜中HAP的最佳浓度范围为10%-30%,优选地15%-25%,以及更优选地20%。
在另一个实例中,负载峰808和应力峰908具有不同的值。例如,负载峰可以在17.5%下并且应力峰值可以在22.5%下。因此,最大值是22.5%并且最小值是17.5%。在第一和第二预定值是约10%,优选地5%,以及更优选地0%时,聚合物膜中HAP重量百分比的最佳浓度范围是7.5%-32.5%,优选地12.5%-27.5%,以及更优选地17.5%-22.5%。在其它实施例中,第一预定值和第二预定值可以是不同的值。
在某些实施例中,根据图8和9所示结果,具有20%HAP浓度的聚合物膜显示出良好的结构稳定性和强度。
在某些实施例中,生物相容性结构90包括根据本公开制得的一个基底结构100用于治疗动物和/或人。在某个实施例中,通过手术从山羊的胫骨切除长骨。为了生成这些山羊的长骨,使用约1.0-2.5克(g)重量的生物相容性结构。例如,分别使用重量为2.39g、2.34g、2.11g、1.86g、2.135g、2.18g、1.55g、2.5g、1.22g和1.69g的10个植入物来生成长骨用于手术切除了胫骨部分的山羊。对于上述10个实例,通过使用4.52g聚合物(聚氨酯)、0.45g HAP纳米颗粒以及15g骨颗粒来制得生物相容性结构。
使用具有根据本公开的实施例的一种或多种生物相容性结构100的植入物的骨生长具有成熟度和完整性。
本公开的示例性实施例的前述说明书只是为了说明和描述的目的而呈现的,并且不旨在穷举或将本公开限制为所公开的精确形式。鉴于上述教导,许多修改和变化是可能的。
选择和描述实施例是为了解释本公开的原理及其实际应用,以便激发本领域的其他技术人员去利用本公开和各种实施例以及适于预期的特定用途的各种修改。在不脱离本发明的精神和范围下,对于本公开所属领域的技术人员而言,替代实施例将变得显而易见。因此,本公开的范围由所附权利要求书限定,而不是前述的说明书和其中描述的示例性实施例。
- 还没有人留言评论。精彩留言会获得点赞!