用于去除淀粉样蛋白斑的包含人参皂苷F1的组合物的制作方法
本发明涉及一种用于去除淀粉样蛋白斑的包含人参皂苷F1或所述人参皂苷F1的食品学上可容许的盐的食物组合物。另外,本发明涉及一种用于去除淀粉样蛋白斑的包含人参皂苷F1或所述人参皂苷F1的食品学上可容许的盐的饲料组合物。另外,本发明涉及一种包含将人参皂苷F1投用到除人体以外的个体的步骤的淀粉样蛋白斑去除方法。
背景技术:
阿尔茨海默病是在高龄人群中发病率最高的疾病,65~85岁人群的10%、以及85岁以上人群的约40%患得此疾病。所述阿尔茨海默病是在1907年由德国的阿尔茨海默(Alois Alzheimer)首次发现阿尔茨海默病患者脑部的海马体(hippocampus)及新皮质(neocortex)的神经细胞受损,在神经细胞的细胞体内具有看似凝结的线团的神经原纤维缠结(neurofibrillary tangle:NTF)及如老年斑(senile plaque)的非正常结构而被世人所熟知。
其中,还被称为淀粉样蛋白斑的老年斑是淀粉样肽(amyloid peptide)的细胞外部积累物,围绕在神经突(neurite)、星形细胞(astrocyte)、微胶质细胞(microglial cell)等,主要在大脑部边缘(limbic structure)或联合新皮质(association neocortex)部位发现。
为了查明这种非正常组织特性是否为阿尔茨海默病的发病原因,进行了较多的研究。
具体而言,在占据阿尔茨海默病患者的大部分的散发性阿尔茨海默病(Sporadic Alzheimer′s disease:SAD)的情况下,至今为止未发现因特定基因的突变而发病的情况,但根据散发性阿尔茨海默病患者确认到阿尔茨海默病的病理特征即出现老年斑及神经原纤维缠结。特别是,在散发性阿尔茨海默病及遗传性阿尔茨海默病中均发生β-淀粉样蛋白的过度沉着,由此暗示β-淀粉样蛋白是阿尔茨海默病的主要发病原因(Nature,1999,399:A23-A31)。
由此,目前以跨国制药公司为中心而研究以β-淀粉样蛋白斑为标靶的治疗剂,但迄今为止开发出的治疗剂的效果微小、为暂时性的且表现出严重的毒性等而至今为止在临床实验中无一成功事例。
由此,本发明人等为了开发去除成为所述阿尔茨海默病的原因的淀粉样蛋白斑的物质而进行锐意研究,结果确认到天然物质即人参皂苷F1在淀粉样蛋白斑的去除中具有优异效果,由此完成了本发明。
技术实现要素:
[发明要解决的问题]
本发明的主要目的在于提供一种用于去除淀粉样蛋白斑的包含人参皂苷F1或所述人参皂苷F1的食品学上可容许的盐的食物组合物。
本发明的另一目的在于提供一种用于去除淀粉样蛋白斑的包含人参皂苷F1或所述人参皂苷F1的食品学上可容许的盐的饲料组合物。
本发明的又一目的在于提供一种包含将人参皂苷F1投用到处人体以外的个体的步骤的淀粉样蛋白斑去除方法。
[解决问题的手段]
作为用以达成所述目的的一实施方式,本发明提供一种用于去除淀粉样蛋白斑的包含人参皂苷F1或所述人参皂苷F1的食品学上可容许的盐的食物组合物。
本发明中所使用的术语“人参皂苷F1”指以化学式1表示的化合物。
[化学式1]
在本发明中,所述组合物可为以组合物的总重量的0.01重量%至99.9重量%、更优选为1重量%至80重量%的比率包含人参皂苷F1的组合物,并不限制于此,可为以技术人员为基准而按照可使用人参皂苷F1的范围内的比率包含所述人参皂苷F1的组合 物。
在食品为饮料的情况下,以100ml为基准而按照0.1至1g、优选为0.3至0.7g的比率包含人参皂苷F1。另外,所述组合物可包含通常使用在食物组合物中而可提高气味、口味、视觉效果等的追加效果。例如,可包含维生素A、维生素C、维生素D、维生素E、维生素B1、维生素B2、维生素B6、维生素B12、烟酸(niacin)、生物素(biotin)、叶酸(folate)、泛酸(panthotenic acid)等。另外,可包含锌(Zn)、铁(Fe)、钙(Ca)、铬(Cr)、镁(Mg)、锰(Mn)、铜(Cu)等矿物质。另外,可包含赖氨酸、色氨酸、半胱氨酸、缬氨酸等氨基酸。另外,可添加防腐剂(山梨酸钾、苯甲酸钠、水杨酸、去水醋酸钠等)、杀菌剂(漂白粉及高浓度漂白粉、次氯酸钠等),抗氧化剂(丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)等)、着色剂(煤焦油色素等)、固色剂(亚硝酸钠、亚醋酸钠等)、漂白剂(亚硫酸钠)、调味料(MSG谷氨酸钠等)、甜味剂(甘素、甜蜜素、糖精、钠等)、香料(香草醛、内酯类等)、膨胀剂(明矾、D-酒石酸氢钾等)、强化剂、乳化剂、增稠剂(糊料)、覆膜剂、添加剂、泡沫抑制剂、溶剂、改良剂等食品添加剂(food additives)。根据食品的种类选择所述添加物,并适量使用。
本发明的所述食物组合物可通过在本技术领域中常用的方法来制备,在制备所述食物组合物时,可添加在本技术领域中普遍添加的原料及成分来制备。另外,其与普通的药物不同地以食品为原料,具有不存在因长期服用药物引起的副作用等的优点,且便携性优异。
本发明中所使用的术语“食品学上可容许的盐”是指不损坏食品组成物中所包含的人参皂苷F1的生物学活性及物性的剂型。
所述食品学上可容许的盐包含由如下酸形成的酸加成盐:形成含有食品学上容许的阴离子的无毒性酸加成盐的酸、例如盐酸、硫酸、硝酸、磷酸、氢溴酸、氢碘酸等无机酸、酒石酸、甲酸、柠檬酸、乙酸、三氯乙酸、三氟乙酸、葡萄糖酸、苯甲酸、乳酸、反丁烯二酸、顺丁烯二酸、柳酸等有机碳酸、甲磺酸、乙磺酸、苯磺酸、对甲苯磺酸等磺酸。例如,食品学上可容许的羧酸盐包含由锂、钠、钾、钙、镁等形成的金属盐或碱土金属盐、赖氨酸、精氨酸、胍等氨基酸盐、二环己基胺、N-甲基-D-葡萄糖胺、三(羟甲基)甲胺、二乙醇胺、胆碱及三乙胺等有机盐等。
本发明中所使用的术语“淀粉样蛋白斑”是β-淀粉样蛋白凝集而形成块体而成,是指存在至少18次以上的不适宜的折叠(folded)的不溶性纤维蛋白集合体。已知在所述淀粉样蛋白斑存在于脑部区域的情况下,会成为神经退行性疾病的发病原因。
本发明中所使用的术语“β-淀粉样蛋白”是从由695个氨基酸残基构成的淀粉样蛋 白前驱蛋白质分解所述氨基酸残基的蛋白质分解酶即β-分泌酶及γ-分泌酶的代谢产物,并不限制于此,可指由39至43个氨基酸残基构成的肽。
在本发明的一实施例中,为了确认人参皂苷F1去除淀粉样蛋白斑的效果而观察摄入包含人参皂苷F1的混合物的阿尔茨海默病模型小鼠的脑部区域即海马体中的淀粉样蛋白斑的个数。其结果,确认到摄入包含人参皂苷F1的混合物的阿尔茨海默病模型小鼠的海马体中的淀粉样蛋白斑数量相比摄入普通饲料的阿尔茨海默病模型小鼠的淀粉样蛋白斑数量减少2倍(图3)。
另外,在本发明的一实施例中,作为因毒性引起的细胞凋亡数量的测定方法而利用当细胞受损时测定从细胞内向外部释出的乳酸脱氢酶的活性的方式,测定人参皂苷F1对因所凝集的β-淀粉样蛋白诱发的细胞毒性的抑制效果。其结果,确认到与不对人参皂苷F1进行处理的情况相比,在对β-淀粉样蛋白进行处理后处理人参皂苷F1的情况下,细胞毒性减小(图4)。这种结果意味着人参皂苷F1减小因β-淀粉样蛋白诱发的细胞毒性。
另外,在本发明的一实施例中,对结合所凝集的β-淀粉样蛋白与硫代黄素T表现出的荧光光谱的变化进行测定而确认人参皂苷F1对所凝集的β-淀粉样蛋白的凝集减少效果。其结果,确认到在对所凝集的β-淀粉样蛋白处理人参皂苷F1的情况下,荧光值减小(图5)。这种结果意味着人参皂苷F1减少β-淀粉样蛋白的凝集而抑制淀粉样蛋白斑的形成。
在本发明中,所述组合物的特征可在于:诱发胰岛素分解酶(Insulin-degrading enzyme,IDE)及奈溶酶(Neprilysin)的表达。
在本发明的一实施例中,对人参皂苷F1是否可增加可分解所凝集的β-淀粉样蛋白的蛋白质即胰岛素分解酶(Insulin-degrading enzyme)及奈溶酶(Neprilysin)的表达进行确认,结果确认到人参皂苷F1可增加胰岛素分解酶(Insulin-degrading enzyme)及奈溶酶(Neprilysin)的mRNA(messenger ribonucleic acid,信使核糖核酸)水平及其蛋白表达水平(图6a至图6d)。
在本发明中,所述食物组合物还可包含食品学上可容许的载体。
本发明中所使用的术语“食品学上可容许的载体”可指不刺激生物体且不阻碍注入的化合物的生物学活性及特性的载体或稀释剂。可使用在本发明的所述载体的种类并无特别限制,只要为在本技术领域内普遍使用的载体,则可使用任一载体。作为所述载体的非限制性的例,可列举食盐水、灭菌水、林格氏液,缓冲食盐水、白蛋白注射溶液、葡萄糖溶液、麦芽糖糊精溶液,甘油、乙醇等。这些可单独使用或混合两种以上来使用。所述载体可包含非天然载体(non-naturally occuring carrier)。
可添加本发明的包含人参皂苷F1的组合物的食品的种类并无特别限制,例如有各种饮料、口香糖、茶、维生素复合剂、健康保健食品类等。在所述食物组合物中,可追加不会阻碍淀粉样蛋白斑的去除的其他成分,其种类并无特别限制。例如,可像普通食品一样含有多种生药萃取物、食品学上可容许的食品保健添加剂或天然碳水化合物等作为追加成分。
在制备各种剂型的健康功能食品时添加所述食品保健添加剂,可由技术人员适当地选择使用。例如,包含各种营养剂、维生素、矿物质(电解质),合成调味剂及天然调味剂等调味剂、着色剂及填充剂、果胶酸及其盐、褐藻酸及其盐、有机酸、保护性凝胶增粘剂、pH值调节剂、稳定化剂、防腐剂、甘油、酒精、使用在碳酸饮料中的碳酸化剂等,但其种类并不限制于所述例。
所述食品可包含健康功能食品。
健康功能食品(functional food)是与特定保健用食品(food for special health use,FoSHU)相同的术语,指除供给营养以外还可有效地呈现生物体调节功能的医学、医疗效果明显的食品,为了获得人参皂苷F1去除淀粉样蛋白斑的有利效果,所述食品可制备成片剂、胶囊、粉末、颗粒、口服液、丸剂等各种形态。
所述人参皂苷F1是包含在作为天然物质的人参中的物质,其稳定性在长期使用过程中得到认可,因此可制备成即可日常服用又可去除淀粉样蛋白斑的食品形态来摄取。
作为另一实施方式,本发明提供一种用于去除淀粉样蛋白斑的包含人参皂苷F1或所述人参皂苷F1的食品学上可容许的盐的饲料组合物。
所述饲料用组合物可包含饲料添加剂。本发明的饲料添加剂相当于饲料管理法中的辅助饲料。
在本发明中,术语“饲料”可指供动物食用、摄取及消化或适当的任一天然规定餐或人工规定餐、一顿餐等或者所述一顿餐的成分。
所述饲料的种类并无特别限制,可使用本技术领域中普遍使用的饲料。作为所述饲料的非限制性的例,可列举谷物类、根果类、食品加工副产物类、藻类、纤维质类、制药副产物类、油脂类、淀粉类、瓢类或谷物副产物类等植物性饲料;蛋白质类、无机物类、乳脂类、矿物性类、油脂类、单细胞蛋白质类、动物性浮游生物类或食物等动物性饲料。这些饲料可单独使用或混合两种以上来使用。
在本发明中,所述组合物能够为以组合物的总重量的0.01重量%至99.9重量%、更优选为1重量%至80重量%的比率包含人参皂苷F1,并无限制于此,能够以技术人员为基准而按照人参皂苷F1的可用范围内的比率包含人参皂苷F1。
本发明中所使用的术语“食品学上可容许的盐”与上述内容相同。
在本发明中,所述饲料组合物还可包含食品学上可容许的载体。
本发明中所使用的术语“食品学上可容许的载体”与上述内容相同。
作为又一实施方式,本发明提供一种包含将人参皂苷F1投用到除人体以外的个体的步骤的淀粉样蛋白斑去除方法。
本发明中所使用的术语“个体”可指包含可成为所述淀粉样蛋白斑去除对象的人体的所有动作。所述动物不仅为人类,而且还可为牛、马、绵羊、猪、山羊、骆驼、羚羊、狗、猫等哺乳动物,但并不限制于此。
本发明中所使用的术语“投用”是指采用某种适当的方法向个体导入本发明的人参皂苷F1,只要可到达靶组织则本发明的人参皂苷F1的投用路径可为口服或非口服的各种路径。
本发明的人参皂苷F1的投用方式并无特别限制,可采用在本技术领域中普遍使用的方法。作为所述投用方式的非限制性的例,可通过口服投用方式或非口服投用方式而投用人参皂苷F1。本发明的人参皂苷F1可根据目标投用方式而制备成各种剂型。
本发明的人参皂苷F1的投用频度并无特别限制,可一天投用一次或分量投用多次。
在本发明的一实施例中,对已诱发阿尔茨海默病的小鼠投用混合有人参皂苷F1的混合物,之后为了确认人参皂苷F1是否对小鼠的记忆力恢复有效果而实施Y形迷宫(Y-maze)测试及空间恐惧记忆测试。其结果,确认到摄入包含人参皂苷F1的混合物的小鼠的交替行为的比率提高约1.5倍,对空间的恐惧记忆也提高约1.5倍(图2a、图2b)。这种结果表示人参皂苷F1对阿尔茨海默病模型小鼠的记忆力恢复有效果。
去除所述淀粉样蛋白斑的方法可将所述淀粉样蛋白斑较不投用人参皂苷F1的个体减少2倍以上。
在本发明的一实施例中,将包含人参皂苷F1的组合物投用到阿尔茨海默病模型小鼠,结果确认到小鼠的海马体中的淀粉样蛋白斑数量较投用普通饲料的小鼠的淀粉样蛋白斑数量减少2倍(图3)。
[发明的效果]
本发明具有包含人参皂苷F1的混合物去除脑部区域即海马体中的淀粉样蛋白斑而改善记忆力恢复的效果。
附图说明
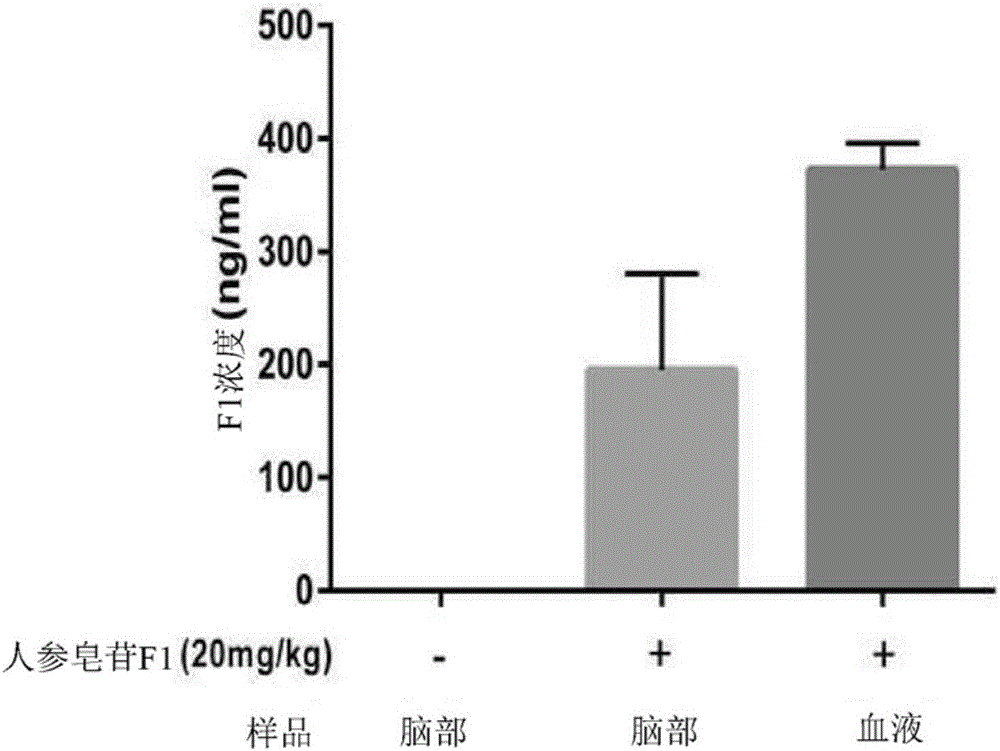
图1是表示在摄入包含人参皂苷F1的混合物的小鼠的脑部及血液样品中检测人参 皂苷F1的图。
图2a是表示摄入包含人参皂苷F1的混合物的阿尔茨海默病模型小鼠的交替行为比率的图。
图2b是表示摄入包含人参皂苷F1的混合物的阿尔茨海默病模型小鼠的空间恐惧测试结果的图。
图3是表示摄入包含人参皂苷F1的混合物的阿尔茨海默病模型小鼠的脑部区域即海马体中的淀粉样蛋白斑数量的图。
图4是表示人参皂苷F1对因所凝集的β-淀粉样蛋白诱发的细胞毒性的毒性抑制效果的图。
图5是表示1uM至2.5uM浓度的人参皂苷F1对所凝集的β-淀粉样蛋白的凝集减少效果的图。
图6a是表示进行人参皂苷F1处理时的胰岛素分解酶(Insulin-degrading enzyme)的mRNA表达水平的图。
图6b是表示人参皂苷F1处理时的奈溶酶(Neprilysin)的mRNA表达水平的图。
图6c是表示人参皂苷F1处理时的胰岛素分解酶的蛋白表达水平的图。
图6d是表示人参皂苷F1处理时的奈溶酶的蛋白表达水平的图。
具体实施方式
以下,通过实施例及实验例而更详细地对本发明的构成及效果进行说明。这些实施例及实验例仅用以例示本发明,本发明的范围并不限定于这些实施例及实验例。
实施例1:用于动物实验的阿尔茨海默病模型小鼠的准备
为了确认人参皂苷F1的记忆力恢复效果,准备对C57B6、JXSJL及J杂交小鼠导入(knock-in)阿尔茨海默病疾病相关基因的阿尔茨海默病模型小鼠。
具体而言,采集使C57B6、JXSJL及J野生纯种雌鼠与具有阿尔茨海默病基因的C57B6、JXSJL及J杂交雄鼠交配而出生的小鼠的尾部样品。在确认所述样品的基因型后,使用具有阿尔茨海默病基因的小鼠,且将同一代的野生小鼠用作对照组。实验中所使用的小鼠使用出生6个月以上的小鼠,在行为实验中仅使用雄鼠。
实施例2:投用到成为实验对象的小鼠的人参皂苷F1混合物的制备
为了将人参皂苷F1投用到成为实验对象的小鼠,制备包含人参皂苷F1的饲料混合物。
具体而言,以人参皂苷F1成为每天20mg/kg的分量的方式混合到饲料而制备。以 30g重量的小鼠为基准而每天平均饲料摄取量为5g,因此以人参皂苷F1在饲料粉末35g中成为4.2mg的方式混合到饲料而制备混合物。
实施例3:用于体外(in vitro)实验的细胞培养及β-淀粉样蛋白的凝集
实施例3-1:细胞的培养
准备作为小鼠脑组织细胞之一的Neuro-2a(N2a)细胞。在5%二氧化碳、90%湿度及37℃的条件下,在包含10%的惰性化胎牛血清(FBS)的90%DMEM培养基中培养所述细胞。
实施例3-2:β-淀粉样蛋白的凝集
将β-淀粉样蛋白以成为10mM浓度的方式溶解到经灭菌的PBS(phosphate buffer saline,磷酸盐缓冲盐水)缓冲液。此后,防止37小时至48小时而诱发β-淀粉样蛋白的凝集。
实施例3-3:人参皂苷F1的准备
将人参皂苷F1以成为100mM浓度的方式溶解到DMSO(Dimethylsulfoxide,二甲亚砜)。此后,按照各步骤稀释所述人参皂苷F1而使用。
实验例1:确认摄入人参皂苷F1混合物时的人参皂苷F1向脑部的传达
确认人参皂苷F1是否有效地传达到摄入在所述实施例2中准备的包含人参皂苷F1的混合物的小鼠的脑部。
具体而言,在利用毛细管从摄入所述实施例2中所制备的饲料混合物的小鼠的眼部采血后,准备血液样品。另外,通过腹腔注射将83mg/kg浓度的戊巴比妥(pentobarbital)注射到所述小鼠而麻醉小鼠。此后,利用生理盐水对经麻醉的所述小鼠进行再灌注(perfusion),之后摘除脑部而准备样品。利用所准备的所述血液样品及脑部样品执行LC-MS(Liquid Chromatography-Mass Spectrometry,液相色谱质谱分析)/MS(Mass Spectrometry,质谱分析)而对人参皂苷F1进行分析。
其结果,在摄入包含人参皂苷F1的饲料混合物的小鼠的脑部及血液样品中检测到人参皂苷F1,由此确认到人参皂苷有效地传达到脑部(图1)。
实验例2:利用投用人参皂苷F1的小鼠的动物实验
在对所述实施例1中所准备的阿尔茨海默病模型小鼠投用混合油在所述实施例2中所制备的人参皂苷F1的混合物后,为了确认人参皂苷F1是否对记忆力恢复有效果而实施动物实验。
实验例2-1:Y-maze测试
为了验证人参皂苷F1对阿尔茨海默病模型小鼠的记忆恢复产生的效果,实施如下 的Y-maze测试:在使实验动物位于宽度为60mm、高度为125mm的Y-maze腔室中央后,使所述实验动物自由探索8分钟。
具体而言,给予实施例1中所准备的阿尔茨海默病模型小鼠3分钟适应Y-maze腔室的时间,将之后的5分钟设定为实际测试时间而对实验动物的动作进行分析。具体而言,将小鼠进入到三个方向中的一个分支(arm)的情况计为一次入场,对总入场次数进行确认。将连续三次的入场均进入到不同的分支的情况计为一次交替行为(alternation behavior)并进行记录,通过下式对交替行为的比率进行分析:
交替行为的比率=(交替行为次数/(总分支的入场次数一2)*100(%)。
其结果,确认到与摄入不包含人参皂苷F1的普通饲料的阿尔茨海默病模型小鼠相比,摄入包含人参皂苷F1的混合物的阿尔茨海默病模型小鼠的交替行为的比率提高约1.5倍以上(图2a)。由此,确认到人参皂苷F1对阿尔茨海默病模型小鼠的记忆恢复有效果。
实验例2-2:空间恐惧记忆测试
为了验证人参皂苷F1对阿尔茨海默病模型小鼠的记忆恢复产生的效果,实施阿尔茨海默病模型小鼠的空间恐惧记忆测试。
具体而言,使实施例1中所准备的阿尔茨海默病模型小鼠位于恐惧条件化腔室。在实验动物进入到腔室后,当经过180秒时,施加0.5mA的电击2秒钟。在从施加电击经过30秒后,从腔室取出实验动物而再次转移到home cage(笼子)(以上为恐惧记忆条件化实验)。
在从所述恐惧记忆条件化实验经过24小时后,使同一实验动物位于同一恐惧条件化腔室。在使所述实验动物位于位于腔室后,观察实验动物的动作5分钟。在未发现除实验动物的呼吸以外的其他动作时,视为“实验动物freezing(冻结)”而记录freezing的总时间。以freezing5分钟为标准而对实验动物的“空间恐惧记忆”进行分析。
其结果,确认到与摄入不包含人参皂苷F1的普通饲料的阿尔茨海默病模型小鼠相比,摄入包含人参皂苷F1的混合物的阿尔茨海默病模型小鼠的空间恐惧记忆提高约1.5倍(图2b)。
由此,确认到人参皂苷F1对阿尔茨海默病模型小鼠的记忆恢复有效。
实验例3:投用人参皂苷F1的小鼠的淀粉样蛋白斑的个数的观察
观察摄入实施例2中所准备的饲料混合物的实施例1的阿尔茨海默病模型小鼠的脑部区域即海马体的淀粉样蛋白斑的个数。
具体而言,将戊巴比妥(pentobarbital,83mg/kg)注射到所述小鼠的腹腔而麻醉小鼠。 在利用生理盐水及甲醛溶液灌注(perfusion)经麻醉的小鼠后,摘除脑部样品而保管到甲醛溶液。在经过24小时后,将脑部样品保管到30%糖溶液。在经过约48小时后,如果脑部样品沉淀到糖溶液的底部,则冷冻脑部样品而低温切割(cryosection)成40μm厚度的切片。将所准备的脑部切片放入到包含0.02%叠氮化钠(sodium azide)的PBS溶液而冷藏保管(以上为准备脑部切片样品的过程)。
在以此方式准备脑部切片样品后,通过如下方法对淀粉样蛋白斑进行染色(各步骤之间,利用生理盐水清洗10分钟,且反复清洗4次):
a)在常温下将所准备的脑部切片样品放置在0.3%过氧化氢水中30分钟。
b)在常温下将所述脑部切片样品在Blocking solution(阻断液)(0.1%BSA(Bovine Serum Albumin,牛血清白蛋白)、0.2%Triton X-100(聚乙二醇辛基苯基醚)、2%山羊血清PBS(goat-serum in PBS))中放置1小时。
c)此后,将兔子的抗β-淀粉样蛋白(rabbit anti-amyloid beta)抗体以1∶1000的比率处理到脑部切片样品,之后在4℃下培养48小时。
d)在将结合有HRP(Horse Radish Peroxidase,辣根过氧化物酶)的山羊的抗兔(HRP conjugated goat anti-rabbit)抗体以1∶2000的比率处理到在所述步骤c)中培养的脑部切片样品后,在常温下培养2小时。
e)在常温下将在所述步骤d)中培养的脑部切片样品在ABC溶液中培养1小时。
f)在常温下将在所述步骤e)中培养的脑部切片样品在DAB溶液中培养8分钟后,添加0.3%过氧化氢水30μl而在常温下培养1分30秒。
g)在将通过所述a)至f)步骤而染色的脑部切片样品放置到载片后,利用添加有二甲苯的cytoseal进行密封(mounting)而测定脑部区域即海马体的淀粉样蛋白斑的数量。
其结果,确认到与摄入普通饲料的阿尔茨海默病模型小鼠的淀粉样蛋白斑数量相比,摄入包含人参皂苷F1的混合物的阿尔茨海默病模型小鼠的海马体中的淀粉样蛋白斑数量减少2倍(图3)。
这种结果表示人参皂苷F1去除淀粉样蛋白斑的效果优异,对阿尔茨海默病等因淀粉样蛋白斑的累积而诱发的疾病具有治疗效果。
实验例4:人参皂苷F1对因所凝集的β-淀粉样蛋白诱发的细胞毒性的抑制效果
在对所述实施例3-1中所培养的细胞处理所凝集的β-淀粉样蛋白及人参皂苷F1后,使用那个LDH(Lactate Dehydrogenase,乳酸脱氢酶)assay kit(检测试剂盒)测定细胞毒性。
用于实施实验的样品的准备步骤如下。
a)将在所述实施例3-1中所培养的老鼠的脑组织细胞放置到无胎牛血清的48-孔细胞 培养基中。
b)在将所述实施例3-2中所凝集的β-淀粉样蛋白以成为10uM的方式放入到所述a)步骤的培养基后,培养30分钟。
c)在将所述实施例3-3中所准备的人参皂苷F1以成为100uM的方式放入到所述b)步骤的培养基后,培养48小时。
d)将所述b)步骤及c)步骤的培养上清液转移到48-孔板而冷藏保管。
在经过所述样品的准备步骤后,按照1∶45的比率混合由LDH kit制造商(Roche)提供的催化剂与染色溶液而制备反应混合物。此后,将所述d)步骤中所准备的培养上清液按照100μl/孔浓度转移到96-孔板,将所述反应混合物以100μl为单位放入到各孔。此后,利用微孔板酶标仪(Microplate reader)在490nm测定吸光度(LDH assay)。
其结果,仅处理β-淀粉样蛋白的群组的细胞毒性较无处理群组增加1.4倍。相反地,在处理β-淀粉样蛋白后,处理人参皂苷F1的群组的细胞毒性按照与无处理群组无差异的程度减少。另外,与无处理群组相比,仅处理人参皂苷F1的群组几乎不会表现出细胞毒性(图4)。
由此,确认到人参皂苷F1抑制β-淀粉样蛋白的细胞毒性。另外,确认到人参皂苷F1本身也不会对脑细胞表现出细胞毒性。结果,确认到人参皂苷F1是对脑细胞安全的物质,同时确认到具有抑制β-淀粉样蛋白的细胞毒性的效果。
实验例5:人参皂苷F1对所凝集的β-淀粉样蛋白的凝集抑制测定
为了确认人参皂苷F1对所凝集的β-淀粉样蛋白的凝集抑制效果,对所凝集的β-淀粉样蛋白与硫代黄素T(Thioflavin T)结合而表现出的荧光光谱的变化进行测定。
具体而言,在将所述实施例3-2中所凝集的β-淀粉样蛋白以成为10uM的方式放入到无胎牛血清的细胞培养基后,培养30分钟。此后,按照各浓度将所述实施例3-3中所准备的人参皂苷F1以成为1uM及2.5uM的方式放入到所述培养基而培养48小时。
另一方面,用于测定β-淀粉样蛋白的凝集程度的方法如下。
a)将硫代黄素T(Thioflavin T)以300uM的浓度溶解到100mM甘氨酸缓冲液(pH值为8.5)。
b)在使用前,将溶解为300uM浓度的硫代黄素T溶液稀释50倍。
c)向结束培养的所述试样100μl添加稀释的硫代黄素T溶液100μl而在常温下以暗室状态放置30分钟。
d)利用多模式微孔板酶标仪(multi mode microplate reader)在激发(excitation)450nm及释出(emission)490nm测定荧光值。
其结果,仅处理β-淀粉样蛋白的群组的荧光值表现地非常高。相反地,确认到在处理人参皂苷F1的情况下,荧光值变低,特别是在人参皂苷F1的处理浓度为2.5uM的情况下,荧光值降低为一半以下(图5)。由此,确认到对于所凝集的β-淀粉样蛋白,人参皂苷F1减少β-淀粉样蛋白的凝集。
实验例6:由人参皂苷F1诱导对所凝集的β-淀粉样蛋白的分解进行作用的蛋白质的表达
为了确认是否由人参皂苷F1诱导对所凝集的β-淀粉样蛋白的分解进行作用的蛋白质即胰岛素分解酶(Insulin-degrading enzyme,IDE)及奈溶酶(Neprilysin,NPE)的表达,利用实时PCR(Polymerase Chain Reaction,聚合酶链反应)及免疫印迹法(Western blot)对mRNA表达及蛋白表达的变化进行测定。
具体而言,将所述实施例3-3中所准备的人参皂苷F1以成为1uM及2.5uM的方式按照各浓度放入到无胎牛血清的细胞培养基中而培养24小时。用于测定对所凝集的β-淀粉样蛋白的分解进行作用的蛋白质即胰岛素分解酶(Insulin-degrading enzyme)及奈溶酶(Neprilysin)的mRNA的表达水平的方法如下。
a)从培养结束的60mm细胞培养基去除培养液。
b)将由RNA萃取试剂(RNA extraction reagent)制造商(TaKaRa)提供的试剂分别以600μ1放入到所述a)步骤培养基的各细胞培养基而进行溶解。
c)将所述b)步骤中所溶解的液体转移到1.5ml离心分离管,以300μl放入氯仿溶液而进行混合,之后进行离心分离而回收存在RNA的上清液。
d)放入与所述c)步骤中回收的液体相同量的异丙醇进行离心分离而获得RNA小球。
e)利用75%乙醇清洗所述d)步骤中获得的RNA小球并进行干燥而获得高纯度的RNA小球。
f)在利用经焦碳酸二乙酯(diethylpyrocarbonate,DEPC)处理的蒸馏水溶解所述e)步骤中获得的RNA小球后,利用纳米滴落装置(Nano-drop machine)对RNA量进行定量。
g)使用由逆转录酶kit制造商(Solgent)提供的试剂将所述f)步骤中获得的RNA在50℃下反应2小时而合成cDNA(Complementary Deoxyribonucleic Acid,互补脱氧核糖核酸)。
h)在向所述g)步骤中制成的cDNA连同合委托引物(Primer)制造商(genotech)制备的胰岛素分解酶(Insulin-degrading enzyme)、奈溶酶(Neprilysin)及β-肌动蛋白(β-actin)Primer一同分别混合由SYBR premix Ex Taq kit制造商(TaKaRa)提供的试剂后,使用实时PCR 设备(real-time PCR machine)测定胰岛素分解酶(Insulin-degrading enzyme)及奈溶酶(Neprilysin)的mRNA转录水平(real-time PCR)。
其结果,确认到在处理人参皂苷F1的情况下,胰岛素分解酶(Insulin-degrading enzyme)及奈溶酶(Neprilysin)的mRNA转录水平增加。具体而言,确认到在处理2.5uM的人参皂苷F1的情况下,胰岛素分解酶的mRNA转录水平增加1.5倍以上,奈溶酶的mRNA转录水平增加2.5倍以上(图6a及图图6b)。
另一方面,用于确认对所凝集的β-淀粉样蛋白的分解进行作用的蛋白质即胰岛素分解酶(Insulin-degrading enzyme)及奈溶酶(Neprilysin)的蛋白表达程度的方法如下。
a)从培养结束的细胞培养基去除培养液。
b)在所述a)步骤的培养基放入1×PBS(pH值为7.4)1ml,利用细胞刮棒(cell scraper)回收细胞而放入到1.5ml的离心分离管,之后进行离心分离而获得细胞小球。
c)向所述b)步骤中获得的小球放入添加有蛋白质分解酶抑制剂的细胞溶解缓冲液100μl进行混合而溶解细胞,之后进行离心分离而获得上清液。
d)使用由蛋白质定量kit制造商(iNtRON)提供的试剂对所述c)步骤中获得的上清液的蛋白质进行定量。
e)在分别混合SDS-PAGE(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,十二烷基硫酸钠聚丙烯酰胺凝胶电泳)还原用染色液与所述d)步骤中定量的蛋白质而烧煮5分钟后,点滴到12%SDS-PAGE凝胶而以70伏特进行电泳1小时30分钟。
f)利用膜转移装置将所述e)步骤中进行电泳的SDS-PAGE凝胶转移到PVDF(Polyvi nylidene Fluoride,聚偏氟乙烯)膜。
g)利用5%脱脂乳对所述f)步骤中所转移的PVDF膜进行1小时的阻断。
h)使用1×TBST溶液对所述g)步骤的膜进行清洗,分别放入大鼠胰岛素分解酶(Ins ulin-degrading enzyme)、奈溶酶(Neprilysin)及β-肌动蛋白(β-actin)一次抗体而反应2小时。
i)使用1×TBST溶液对所述h)步骤的膜进行清洗,分别放入结合有HRP的抗兔免疫球蛋白二次抗体或结合有HRP的抗鼠免疫球蛋白二次抗体而反应2小时。
j)按照1∶1的比率混合由免疫印迹法检测kit制造商(iNtRON)提供的基质溶液与放大溶液而制备反应混合物。使用1×TBST溶液对所述i)步骤的膜进行清洗,使所述反应混合物2ml与膜进行反应。此后,利用荧光及化学影像分析装置检测蛋白质(Western blot)。
其结果,确认到处理2.5uM的人参皂苷F1的群组的胰岛素分解酶(Insulin-degrading enzyme)的蛋白表达水平较对照组增加1.3倍以上(图6c)。另外,确认到奈溶酶(Neprilysin)的蛋白表达水平以浓度依赖的方式增加1.5倍以上(图6d)。
由此,确认到人参皂苷F1可增加胰岛素分解酶及奈溶酶的表达水平而去除所凝集的淀粉样蛋白斑。
根据以上说明,本发明所属的技术领域的技术人员应可理解可不变更本发明的技术思想或必要特征而以其他具体形态实施。与此相对,以上所记载的实施例应仅理解为在所有方面均为例示,并不具有限定性。本发明的范围相较所述详细说明而应解释为根据随附的权利要求书的含义、范围及其等同的概念导出的所有变更或变形的形态包含在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!