IAP抑制剂和溶瘤病毒在制备抗肿瘤药物中的应用的制作方法
本发明属于生物医药领域,涉及Caspase活化剂与溶瘤病毒的联用在制备抗肿瘤药物中的应用。
背景技术:
溶瘤病毒(oncolytic virus)是一类靶向性感染并杀伤肿瘤细胞,而不破坏正常细胞的可复制病毒。溶瘤病毒疗法(oncolytic virotherapy)是一种创新的肿瘤靶向治疗策略,它利用天然的或经基因工程改造的病毒选择性的感染肿瘤细胞,并在肿瘤细胞中复制,达到靶向性溶解、杀伤肿瘤细胞的作用,但是对正常细胞无害。
M1病毒(Alphavirus M1)属于甲病毒属(Alphavirus),其在制备抗肿瘤药物方面具有比较好的应用效果。例如中国发明专利申请201410425510.3公开了M1病毒能选择性引起肿瘤细胞死亡而不影响正常细胞存活,其在抗肿瘤方面具有非常好的应用前景。然而,不同肿瘤对M1病毒的敏感性不一,对于某些肿瘤,M1病毒单独用药时,溶瘤作用还不够理想。例如中国发明专利申请201410425510.3所记载的,M1作为抗肿瘤药物使用时,对于结直肠癌、肝癌、膀胱癌和乳腺癌的效果不如胰腺癌、鼻咽癌、前列腺癌和黑色素瘤明显;而胶质瘤、宫颈癌、肺癌则更其次;而胃癌则最不显著。
发明人此前申请的专利201510990705.7中,将大黄酚及其衍生生物作为M1病毒的抗瘤增效剂,二者组合可以将肿瘤细胞的存活率降低至39.6%,但其抗癌强度存在很大的进步空间。本发明的目的在于提供一种M1抗瘤增效剂,能够起到更好的抗癌效果。
技术实现要素:
本发明的目的之一在于提供Caspase活化剂在制备溶瘤病毒抗瘤增效剂方面的应用。
本发明的另一个目的在于提供一种抗瘤药物组合物,其可以使得-溶瘤病毒发挥更好的抗瘤效果。
本发明的另一个目的在于提供一种针对溶瘤病毒不敏感的肿瘤,安全有效的溶瘤病毒增效药物。
发明通过以下技术方案实现上述目的。
发明人发现Caspase活化剂与甲病毒联用作为抗癌疗法,在抗癌效果上获得令人惊叹的效果。
活化的Caspase引起细胞凋亡的作用是已知的。Caspase家族蛋白酶具有三大亚族,Caspase-1、4、5、11属于第一亚族;Caspase-2、9属于第二亚族;Caspase-3、、7、8、10属于第三亚族。起始Caspase在外来蛋白信号的作用下被切割激活,激活的Caspase对执行者Caspase进行切割并使之激活,被激活的执行者Caspase进而通过对Caspase靶蛋白的水解,导致程序性细胞死亡。
在溶瘤病毒与Caspase联合治疗的方案中,溶瘤病毒与Caspase的相互作用机制尚未非常明确。但可以发现的是,在一些联合方案中,溶瘤病毒和Caspase活化剂并不能起到协同性的促凋亡机制。
本发明首次提供了Caspase活化剂在制备溶瘤病毒抗肿瘤增效剂方面的应用;所述的溶瘤病毒选自至少一种甲病毒;优选地,所述的甲病毒选自M1病毒和盖塔病毒中的至少一种。M1病毒属于盖塔相似病毒,据报道在已发现的相关病毒中,这两者的同源性高达97.8%。
在一个实施例中,采用的溶瘤病毒为保藏编号CCTCC V201423(具体信息如中国专利104814984A所记载)的M1病毒。
优选地,所述的Caspase活化剂为Caspase-3、7、8和9的活化剂中的至少一种;
更优选地,所述的Caspase活化剂为Caspase抑制解除剂;更优选地,所述的Caspase活化剂为IAP抑制剂;更优选地,所述的IAP抑制剂选自cIAP-1、cIAP-2和XIAP中的至少一种。
作为可选的方案,所述的IAP抑制剂选为抑制IAP蛋白活性的物质、或降解IAP蛋白的物质、或降低IAP蛋白水平的基因工具;
优选地,所述的抑制IAP蛋白活性的物质或降解IAP蛋白的物质选自蛋白或化合物;
更优选地,所述的抑制IAP蛋白活性的物质或降解IAP蛋白的物质选自Smac蛋白或Smac类似化合物;
或者更优选地,所述的抑制IAP蛋白活性的物质或降解IAP蛋白的物质选自Smac类似化合物为LCL161、Birinapant中的至少一种;
或者更优选地,所述的降低IAP蛋白水平的基因工具为RNA干扰、microRNA、基因编辑或基因敲除材料。
同时,发明也提供了含有上述Caspase活化剂和溶瘤病毒的药物组合物;或者药品套装,在所述的药品套装中IAP抑制剂和溶瘤病毒被分开包装。
药物组合物还可以包含药学上可接受的载体;所述载体优选地选自冻干粉针、注射剂、片剂、胶囊、试剂盒或贴剂。
作为抗肿瘤疗法,所述的肿瘤可以为实体瘤或血液瘤;
优选地,所述的实体瘤为肝癌、结直肠癌、膀胱癌、乳腺癌、宫颈癌、前列腺癌、胶质瘤、黑色素瘤、胰腺癌、鼻咽癌、肺癌或胃癌;
或者优选地,所述的肿瘤为对所述溶瘤病毒不敏感的肿瘤;
更优选地,所述肿瘤为对溶瘤病毒不敏感的肝癌、结直肠癌、膀胱癌、乳腺癌、宫颈癌、前列腺癌、胶质瘤、黑色素瘤、胰腺癌、鼻咽癌、肺癌或胃癌。
在实施治疗性的方案中,蛋白类或基因工具类的Caspase活化剂,或化合物类的活化剂均是可选的。
Smac蛋白的全称为second mitochondria-derived activator of caspase,其存在于线粒体,在凋亡发生时其从线粒体转运至细胞浆并调控凋亡相关通路。同时,Smac(包括其类似物)能使肿瘤细胞对TNF-α,TRAIL等细胞因子敏感,从而增强旁细胞效应。Smac主要通过抑制IAP家族蛋白水平和功能发挥作用。目前一共有8种IAP蛋白,其中cIAP-1,cIAP-2和XIAP研究得最为透彻,IAP通过抑制caspase的激活发挥抑制凋亡的功能。IAP蛋白在多种肿瘤中高表达并且与肿瘤发展和预后不良相关,因此利用Smac(包括Smac类似化合物)抑制IAP能选择性在肿瘤中发挥抗肿瘤作用。
目前,已有人尝试将Smac类似化合物与其他的化疗药物联合治疗胰腺癌。如Dineen等利用JP1021(Smac类似物)与吉西他汀联合使用可明显减少细胞的增殖。在其实验中,未加药的细胞早期凋亡率为17%,单独应用JP1021(10μmol/L)和单独应用吉西他汀(10μmol/L)的凋亡率分别为31%和58%,而二者联合作用的早期凋亡率仅比单独使用吉西他汀稍有提升,二者联合并未显示出协同作用。
许多组合物的治疗效果是难以预期的。例如,一些药物之间相互作用降低治疗效果或引起不期望的副作用,一些药物组合物之间以单个药物组合证明他们的治疗效力,而一些药物组合物在治疗指数上大于单个药物组合,具有协同作用。
本发明则首次发现,Caspase活化剂例如是IAP抑制剂和溶瘤病毒具有协同作用,可以作为溶瘤病毒的抗瘤增效剂。
发明人通过用cIAP1和cIAP2干扰片段(Si RNA)抑制这两个基因的表达,降低相应蛋白的表达量,结果发现,单独干扰cIAP1和cIAP2和未干扰并未引起细胞形态病变,同时单独应用M1病毒也不引起细胞形态病变,干扰cIAP1或cIAP2联合应用M1病毒则细胞的存活率显著的下降。因此推测抑制cIAP1和cIAP2可以显著增强溶瘤病毒的抗肿瘤效应。此外,发明人将IAP抑制剂——Smac类似物LCL161和Birinapant与溶瘤病毒联用,结果发现,二者均可以协同增加溶瘤病毒的抗肿瘤效应。
作为示例性的方案,化合物类的活化剂LCL161或Birinapant与溶瘤病毒的应用示例为:化合物与溶瘤病毒的配比为:0.01~15mg:103~109PFU;优选0.01~10mg:104~109PFU;进一步优选0.01~10mg:105~109PFU;
进一步优选地,使用剂量为:LCL161或Birinapant使用范围为0.01mg/kg至15mg/kg,同时溶瘤病毒使用滴度为MOI从103至109(PFU/kg);优选LCL161或Birinapant使用范围为0.01mg/kg至10mg/kg,同时溶瘤病毒使用滴度为MOI从104至109(PFU/kg);更优选LCL161使用范围为0.1mg/kg至10mg/kg,同时溶瘤病毒使用滴度为MOI从105至109(PFU/kg)。
化合物的获取方式可选但不限于:自己化学分离或合成或者从商业途径购买。
作为示例性的方案,Caspase活化剂也可以为cIAP1和cIAP2的干扰RNA片段。
本发明所说的溶瘤病毒(例如M1病毒、盖塔病毒等甲病毒)可以尤其地指目前已有的溶瘤病毒,但也不排除一些可能发生自然变异或者进行了突变、修饰、序列增加、减少等的病毒,只要这些变异、突变、修饰、序列增加或减少等的变化并不影响所说的溶瘤病毒发挥本发明所述的作用,则属于本发明所述的同质的病毒。所说的IAP抑制剂为能起到敲低或影响IAP基因表达或者降低IAP蛋白量或蛋白活性的物质或工具(例如化合物、或氨基酸序列、核苷酸序列等),本领域技术人员可以对这些化合物、氨基酸序列或者基因工具进行修饰、替换、改变等,但只要起到上述抑制IAP的作用的,则属于本发明的IAP抑制剂,属于上述化合物、氨基酸序列、工具等的同质替换。
本发明还提供药物组合物或药品套装。药品套装区别于组合物的地方在于,在药品套装中,Caspase活化剂(或其衍生物或它们的组合)未必、并且通常不与溶瘤病毒混合存在,而是通常地被分开包装。分开包装的溶瘤病毒与Caspase活化剂也可含有其各自的佐剂。所述的佐剂是指在药学中,可辅助药物疗效的手段。药品套装也可以包含独立包装的Caspase活化剂或其衍生物或它们的组合,以及独立包装的溶瘤病毒。药物套装中Caspase活化剂或其衍生物或它们的组合,以及溶瘤病毒的施用,可以是同时施用或者是以任意的前后顺序施用,其中患者先用一种药物治疗,然后再给以另一种药物。所述的患者是指哺乳动物受治疗者,尤其是人类。
本发明发现Caspase活化剂,例如LCL161和Birinapant可以增加溶瘤病毒的抗肿瘤效应,以提高溶瘤病毒作为抗肿瘤药物时的治疗有效性。细胞学实验证明M1病毒分别和LCL161、Birinapant联合应用,可显著引起肿瘤细胞的形态学病变,从而显著增强对肿瘤细胞的抑制作用。
发明人联合LCL161或Birinapant与M1病毒作用于人结直肠癌HCT116细胞株,出人意料的发现抗病毒化合物LCL161和M1病毒联合应用,显著增加肿瘤细胞形态病变,显著降低肿瘤细胞生存率。例如在本发明的一个实施例中,当M1病毒(MOI=10)单独处理结直肠癌HCT116细胞时,肿瘤细胞存活率为84%,而当以5μM的LCL161与同样MOI的M1病毒联用时,肿瘤细胞存活率大幅下降至33.6%。与单用M1病毒的抗肿瘤效果相比,LCL161与M1联用时,溶瘤效果显著提升。
发明人此前将大黄酚及其衍生物作为M1病毒的抗癌增效剂,经试验发现,50uM的大黄酚与(MOI=0.001)M1病毒联用后,能明显杀伤肝癌细胞株Hep3B。而本研究将5μM LCL161与M1联用后,能明显杀伤结直肠癌细胞株HCT116,相比于Hep3B(0.001MOI处理后细胞存活率为85.1%)细胞,HCT116对M1细胞更为不敏感(10MOI处理后细胞存活率为84.0%),与大黄酚相比,本发明的M1抗肿瘤增效剂能显著提高不敏感肿瘤的杀伤力,同时,LCL161的药物剂量仅为大黄酚的十分之一,具备显著地优越性。
尽管LCL161本身已被报道可通过抑制肿瘤细胞内凋亡抑制蛋白cIAP1,cIAP2发挥抗肿瘤效应,然而,本发明发现,LCL161与溶瘤病毒联合应用处理肿瘤细胞,对肿瘤细胞杀伤作用显著优于单用相同浓度的LCL161,例如当同样例如以5μM的LCL161处理肿瘤细胞时,肿瘤细胞存活率仍高达92.6%,当以5μM的LCL161与M1病毒联用时,肿瘤细胞存活率大幅下降至33.6%。可见,LCL161与M1联用时大幅提升的溶瘤效果,是得益于LCL161与M1病毒之间的协同性机制,并非简单地通过LCL161的抗肿瘤机制发挥作用。
本发明的重要意义还在于,对于一些对用药敏感性较弱的肿瘤,本发明所提供的特定的联用方案为该类肿瘤的治疗提供了可靠而有效的方案。
附图说明
图1 LCL161与M1病毒显著增加人结直肠癌细胞株形态学病变;
图2 LCL161/Birinapant与M1病毒联合处理显著降低人结直肠癌细胞株和人肝细胞癌株生存率;
图3 LCL161在协同溶瘤病毒抗肿瘤的机理研究;
图4 LCL161与M1病毒联合处理显著抑制人肝细胞癌株和人结直肠癌株移植瘤生长。
图5 LCL161与M1病毒联合应用显著上调人结直肠细胞癌株和肝细胞癌株caspase-3/7、8和9活性
图标说明:
LCL161:LCL161处理组;
Birinapant:Birinapant处理组;
M1+LCL161:M1病毒与LCL161联用处理组;
M1+Birinapant:M1病毒与Birinapant联用处理组;
M:单用M1病毒组;
M+L:M1病毒与LCL161联用处理组;
具体实施方式
以下实施方式是对本发明作进一步说明,但本发明的实施方式不局限于以下的实施例介绍,凡依照本发明的原理或理念所作的等同的变化或变通都应视为本发明保护的范畴。
在没有特别指明的情况下,本发明采用的材料及实验方法为常规材料及方法。
实施例1 LCL161与M1病毒显著增加人结直肠细胞癌株形态学病变
材料:
人结直肠细胞癌HCT116,M1病毒,高糖DMEM培养基,倒置相差显微镜。
方法:
a)细胞的培养:人结直肠细胞癌HCT116生长在含10%FBS、100U/ml青霉素及0.1mg/ml链霉素的DMEM完全培养基中;所有细胞株均置于5%CO2,37℃恒温密闭式孵箱(相对湿度95%)内培养传代,倒置显微镜观察生长情况。大约2~3天传代一次,取处于对数生长期的细胞用于正式实验。
b)细胞处理和形态学观察:选择对数生长期细胞,DMEM完全培养液(含10%胎牛血清、1%双抗)制成细胞悬液,细胞以2.5×104/孔的密度接种在24孔培养板内。用LCL161(5μM)单独处理、M1病毒(MOI=0.01)感染细胞、M1病毒(MOI=0.01)联合LCL161(5μM)处理细胞,以不加M1病毒和LCL161为对照,72小时后在倒置相差显微镜下观察细胞形态学的变化。
结果:
如图1所示,相差显微镜下观察细胞形态,HCT116细胞是单层贴壁生长,并且细胞紧密排列,表型一致。而LCL161(5μM)与M1病毒(MOI=1)处理72h后,细胞的形态发生了明显改变,较对照组细胞,与M1单独处理组与LCL161单独处理组比较,联合处理组细胞数目明显减少,胞体收缩成球状,折光率明显增强,呈死亡病变样。
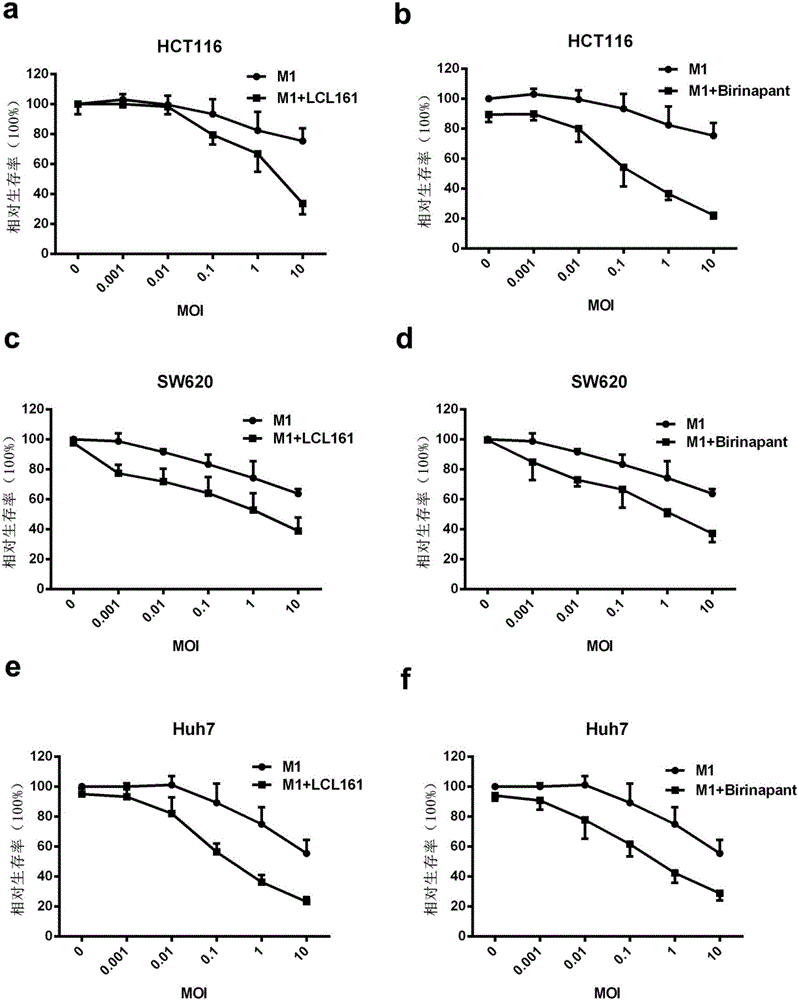
实施例2 LCL161/Birinapant与M1病毒联合处理显著降低人结直肠细胞癌株和人肝细胞癌株生存率;
材料:
人结直肠细胞癌HCT116,SW480,人肝细胞癌Huh7,PLC,M1病毒,高糖DMEM培养基,自动酶联检测酶标仪。
方法:
a)接种细胞、给药处理:选择对数生长期细胞,DMEM完全培养液(含10%胎牛血清、1%双抗)制成细胞悬液,以每孔4×103/孔的密度接种在96孔培养板内。12小时后见细胞完全贴壁,实验分对照组,单独药物组(单独使用5μM LCL161或Birinapant),M1感染组和LCL161/M1或Birinapant/M1联用组。所用剂量为:M1病毒感染细胞,设置不同的MOI剂量梯度;LCL161和Birinapant浓度为5μM。
b)MTT与细胞内的琥珀酸脱氢酶反应:培养至72h时,每孔加入MTT 20μl(5mg/ml),继续孵育4小时,此时镜检可观察到、活细胞内形成的颗粒状蓝紫色甲臜结晶。
c)溶解甲臜颗粒:小心吸去上清,加DMSO 100μl/孔溶解形成的结晶,在微型振荡器上震荡5min,然后在酶联检测仪上用波长570nm检测各孔的光密度(OD值)。每组实验重复3次。细胞存活率=药物处理组OD值/对照组OD值×100%。
结果:
如图2a所示,M1病毒单独处理对肿瘤细胞HCT116具有较小的生存率抑制作用(肿瘤细胞存活率达到84.0%),5μM的LCL161处理肿瘤细胞存活率仍高达92.6%。然而,当M1与LCL161联用时(M1+LCL161),肿瘤细胞存活率显著下降,低至33.6%。同样,与M1病毒单独处理组或单独的LCL161处理组相比,各剂量组LCL161/M1联合处理后的肿瘤细胞存活率均显著下降。类似的结果Birinapant/M1联合应用在HCT116中同样观察到(图2b)。另外,LCL161或Birinapant与M1联用也显著降低肿瘤细胞SW620(图2c和d)、Huh7细胞(图2e和f)以及PLC细胞(图2g和h)的存活率。
实施例3 抑制cIAP1和cIAP2协同M1溶瘤病毒抗肿瘤效应
材料:
M1病毒,人结直肠癌细胞HCT116,肝癌细胞Huh7,cIAP1和cIAP2的RNA干扰片段,MTT(甲基偶氮唑蓝),相差显微镜。
cIAP1干扰片段(Si RNA):
干扰片段1:
正义链(SEQ ID NO.1)
5’-GUGAGUUCUUGAUACGAAUdTdT-3’
反义链(SEQ ID NO.2)
5’-AUUCGUAUCAAGAACUCACdTdT-3’
干扰片段2:
正义链(SEQ ID NO.3)
5’-GAAUACGUCUCCAAUGAGAdTdT-3’
反义链(SEQ ID NO.4)
5’-UCUCAUUGGAGACGUAUUCdTdT-3’
干扰片段3:
正义链(SEQ ID NO.5)
5’-GCAAGUGCUGGAUUCUAUUdTdT-3’
反义链(SEQ ID NO.6)
5’-AAUAGAAUCCAGCACUUGCdTdT-3’
cIAP2干扰片段(Si RNA):
干扰片段1:
正义链(SEQ ID NO.7)
5’-GAUUGUGCUCCUUCUUUAAdTdT-3’
反义链(SEQ ID NO.8)
5’-UUAAAGAAGGAGCACAAUCdTdT-3’
干扰片段2:
正义链(SEQ ID NO.9)
5’-GAUAUUUCCGUGGCUCUUAdTdT-3’
反义链(SEQ ID NO.10)
5’-UAAGAGCCACGGAAAUAUCdTdT-3’
干扰片段3:
正义链(SEQ ID NO.11)
5’-GAUUGUGCUCCUUCUUUAAdTdT-3’
反义链(SEQ ID NO.12)
5’-UUAAAGAAGGAGCACAAUCdTdT-3’
方法:
选择对数生长期细胞,DMEM完全培养液调制成细胞悬液,细胞以1×105的密度接种在6孔板内。24小时后,加入脂质体包裹的Si RNA目标基因片段48时后,感染M1病毒。感染48小时后,处理样本。
(1)收集蛋白质样本,进行Western blot检测干扰效率。
(2)MTT法计算细胞存活率;
结果:
在用不同的干扰片段分别干扰cIAP1和cIAP2之后,Western blot检测发现针对每一种IAP蛋白,至少两条siRNA片段能引起cIAP1和cIAP2(图3a和3b)蛋白表达显著下降,证明干扰片段能从蛋白水平干扰cIAP1和cIAP2蛋白的表达。
图3c-d中,control表示对照组,即不含任何处理组,mock表示单用转染试剂组(RNAiMAX),NC表示乱序siRNA干扰组,后三列则表示采用siRNA片段进行干扰表达的细胞。
MTT实验数据表明,单独干扰cIAP1和cIAP2和未干扰(control组)或乱码干扰组(NC)相比并未引起细胞存活率的改变,同时单独应用M1病毒也不引起细胞存活率改变,干扰cIAP1或cIAP2和M1联用能显著降低肿瘤细胞的存活率(图3c和3d)。将数据进行ANOVA统计,*表示p<0.05,**表示p<0.01,***表示p<0.001,显示细胞存活率的降低具有统计学意义。
以上结果说明cIAP1和cIAP2的抑制与M1联合作用,发挥抗肿瘤效应。
实施例4 LCL161与M1病毒联合应用显著抑制人结直肠细胞癌株和肝细胞癌株移植瘤生长。
材料:
M1病毒、结直肠癌细胞株HCT116、肝细胞癌株Huh7、4周龄雌性BALB/c裸鼠。
方法:
本实验采用随机的、单盲的设计。将5×106HCT116或者1×107Huh7细胞注入到4周龄BALB/c裸鼠背侧皮下。
当肿瘤大小达到50mm3时分组,包括不处理的对照组(Control)、单独应用LCL161组(腹腔注射20mg/kg/d)、单独应用M1感染组(HCT116癌株移植瘤尾静脉注射M1病毒2×106PFU/次、Huh7癌株移植瘤尾静脉注射M1病毒5×105PFU/次)和LCL161/M1联用组(相同方式给予相同剂量的LCL161和M1病毒),连续注射4次。每两天测量肿瘤的长宽和体重,肿瘤的体积依据公式(长×宽2)/2。测量肿瘤体积后进行One way ANOVA统计,***表示p<0.001,**表示p<0.01、*表示p<0.05。
结果:
在两种肿瘤细胞移植瘤动物体内,病理解剖测定肿瘤体积表明,和对照组比较,单独应用LCL161组和单独M1感染组只能引起肿瘤体积轻微的缩小。
对于HCT116肿瘤,LCL161组与对照组相比肿瘤体积仅减少了29.15%,M1组与对照组相比肿瘤体积仅减少了27.93%,而LCL161/M1联用组能引起肿瘤体积显著地缩小(图4),与对照组相比肿瘤体积减少了80.42%。
对于Huh7肿瘤,LCL161组与对照组相比肿瘤体积仅减少了18.1%,M1组与对照组相比肿瘤体积仅减少了4.7%,而LCL161/M1联用组能引起肿瘤体积显著地缩小(图4),与对照组相比肿瘤体积减少了70.3%。One way ANOVA统计表明具有统计学差异。
实施例5 LCL161与M1病毒联合应用显著上调人结直肠细胞癌株和肝细胞癌株caspase-3/7、8和9活性。
材料:
M1病毒、LCL161、caspase3/7/8/9活性检测试剂盒、DMEM完全培养液(含10%胎牛血清、1%双抗)、结直肠癌细胞株HCT116、肝细胞癌株Huh7、自动酶联检测酶标仪
方法:
选择对数生长期细胞,DMEM完全培养液(含10%胎牛血清、1%双抗)调制成细胞悬液,细胞以4×103的密度接种在96孔板内。12小时后见细胞完全贴壁,实验分对照组,单独药物组(单独使用LCL161),M1感染组和LCL161/M1联用组。所用剂量为:M1剂量为1MOI(HCT116细胞)或0.1MOI(Huh7细胞),LCL161浓度为5μM。同时设置4组重复上述处理组,用于检测MTT以及caspase3/7、8和9的活性。处理72小时候,每孔按体积分别加入caspase3/7、8和9检测液,置于孵箱继续培养半小时,将液体吸入不透光96孔板,用酶标仪检测化学发光强度。同时检测MTT,计算细胞存活率。将化学发光值比上MTT值对caspase活性进行标化。
结果:
Caspase3/7、8和9活性检测结果表明,在HCT116细胞和Huh7细胞中,相比于对照组(Ctrl),单用LCL161或M1(M)组只能轻微引起caspase3/7、8和9活性的上调,但在LCL161与M1联用组(LM)观察到显著的caspase3/7、8和9活性上调(图5a-e),表明caspase活性剂LCL161和M1联用能显著激活caspase3/7、8和9活性。
本发明所记载的实施方式仅为阐释性例子,本发明的实施方式并不受上述的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等同的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!