痘病毒溶瘤载体的制作方法
本申请是2010年5月18日提交的美国专利申请系列第12/743,402号的部分继续申请,上述申请是2008年11月17日提交的PCT/EP2008/009720的美国国家阶段,其指定美国并以英语于2009年5月28日公开为WO 2009/065546 A1,并根据35U.S.C.§119要求2007年11月19日提交的EP 07301557.0的优先权;在此出于所有目的将各内容均明确整体并入作为参考,每个均转让给其受让人。
发明领域
溶瘤病毒是一类新的用于治疗癌症的治疗剂,其具有依赖于肿瘤的自我永存的独特特性(HERMISTON.A demand for next-generation oncolytic adenoviruses.Current opinion in molecular therapeutics.2006,第8卷,no.4,第322-30页)。溶瘤病毒能够选择性地在恶性肿瘤细胞中复制,因此能够提供潜在地远高于常规癌症治疗的效力和特异性水平(FISHER.Striking out at disseminated metastases:the systemic delivery of oncolytic viruses.Current opinion in molecular therapeutics.2006,第8卷,no.4,第301-13页)。使用这些病毒的益处在于,当它们复制时,它们会溶解其宿主细胞。癌细胞是许多病毒的理想的宿主,因为它们具有失活的抗病毒干扰素路径,或者具有能够使病毒复制不受阻碍地进行的突变的肿瘤抑制基因(CHERNAJOVSKY,等人.Fighting cancer with oncolytic viruses.British medical journal.2006,第332卷,no.7534,第170-2页)。
一些病毒天然地能够选择性在肿瘤细胞中复制,但溶瘤病毒也可以通过修饰天然存在的病毒获得。出于该目的,目前用于修饰病毒的主要策略包括:必要病毒基因中的功能性缺失;用于控制这些病毒基因表达的肿瘤或组织特异性启动子:和趋性修饰以将腺病毒再导向至癌细胞表面。在不久的将来,溶瘤腺病毒需要加以优化,以充分实现其作为关键抗癌工具的潜力,并因此,改善恶性神经胶质瘤患者的预后(JIANG等人Oncolytic adenoviruses as antiglioma agents.Expert review of anticancer therapy.2006,第6卷,no.5,第697-708页)。
例如,选择性修饰成在具有p53突变的细胞中复制并将其杀死的腺病毒ONYX-015正在由Onyx Pharmaceuticals开发用于多种实体瘤包括头颈、胃肠道和胰腺肿瘤的潜在治疗。其是在E1B基因座处具有功能丧失突变的重组腺病毒,其产物是与p53肿瘤抑制蛋白结合并使其失活的55kDa蛋白质。因此,认为ONYX-015腺病毒使得正常细胞不感染。p53肿瘤抑制基因的突变是癌症中遗传异常最常见的类型,在半数以上所有主要癌症类型中发生。因此,这些细胞对病毒易感,所述病毒将会很容易复制并导致细胞死亡。ONYX-015正在进行治疗复发头颈癌的III期试验,结肠直肠、卵巢、胰腺和口腔肿瘤的II期试验,以及消化系疾病、食道和肝肿瘤的I期试验(COHEN,等人.ONYX-015.Onyx Pharmaceuticals.Current opinion in investigational drugs.2001,第2卷,no.12,第1770-5页)。
天然溶瘤病毒是具有选择性感染肿瘤细胞并将其杀死的先天能力的有复制能力的病毒。尽管五十年前用于用活病毒治疗癌症的最初尝试,对天然溶瘤病毒的关注落后于对于改造的腺病毒和疱疹病毒用作癌症治疗剂的支持。但是,近年来,重新兴起对于这些天然存在的活性剂的高效力和选择性的关注(ROBERTS等人Naturally oncolytic viruses.Current opinion in molecular therapeutics.2006,第8卷,no.4,第314-21页)。
在天然溶瘤病毒当中,牛痘病毒(痘病毒)具有许多用于溶瘤病毒疗法的理想病毒骨架所必需的关键特性。这些包括生命周期短,细胞-细胞传播迅速,溶解能力强,克隆能力大,以及分子生物学明确。此外,尽管能够在人细胞中复制,它们并不视作是天然的健康问题,尤其是明确表征在消灭天花运动中已经传递至数百万个体。使用疫苗株或遗传修饰疫苗株的早期临床结果已经证实了抗肿瘤效果(THORNE等人Vaccinia virus and oncolytic virotherapy of cancer.Current opinion in molecular therapeutics.2005,第7卷,no.4,第359-65页)。
相反,痘病毒粘液瘤病毒是新的溶瘤候选物,其没有直接用于人的历史,因为其具有明显和绝对的对兔类动物(兔子)的宿主物种趋性。最近发现粘液瘤病毒也能够选择性地感染并杀死人肿瘤细胞——与大多数人癌症中发现的细胞内信号传导路径调节异常有关的独特趋性。该综述概述了粘液瘤病毒对于人癌细胞的趋性的现有知识,以及显示其在癌症动物模型中能够感染并清除肿瘤的临床前数据(STANFORD等人Myxoma virus and oncolytic virotherapy:a new biologic weapon in the war against cancer.Expert opinion on biological therapy.2007,第7卷,no.9,第1415-25页)。
技术问题
注射实现抗肿瘤效果所需的高剂量痘病毒引起毒性问题。大多数不良事件较小,通常与牛痘病毒有关的不良反应是自限性的,包括发热、头痛、疲劳、肌痛、发冷、局部皮肤反应、非特异性皮疹、多形性红斑、淋巴结病和种痘部位疼痛。其他反应可能需要额外的治疗(例如,一线治疗VIG和二线治疗西多福韦(cidofovir))。可能需要进一步评价或治疗的不良反应包括偶然接种、全身性牛痘(GV)、痘性湿疹(EV)、进行性牛痘(PV)、种痘后中枢神经系统疾病和胎儿牛痘(CONO等人Smallpox vaccination and adverse reactions.Guidance for clinicians.MMWR.Recommendations and reports:Morbidity and mortality weekly report.Recommendations and reports/Centers for Disease Control.2003,第52卷,no.RR-4,第1-28页)。
因此,对于溶瘤活性与其天然对应物同样好的更加安全的痘病毒存在需求。
背景技术:
US 5364773(VIROGENETICS CORPORATION(TROY,NY))15/11/1994描述了一种修饰的重组痘病毒,更具体地,一种具有失活的非必需病毒编码的编码的遗传功能的牛痘病毒,使得重组痘病毒的毒力减弱,安全性提高。具体地,通过删除编码毒力因子的可读框,或者通过编码毒力因子的可读框的插入性失活,使遗传功能失活。更具体地,该专利描述了其中J2R、B13R+B14R、A26L、A56R、C7L-K1L和I4L可读框已经失活的牛痘病毒。该病毒(NYVAC)可以改造成为用于外源核酸的载体,并且用作用于在宿主动物中诱导免疫反应的疫苗。但是,NYVAC在大多数哺乳动物细胞中不能有效复制,并且不能用作溶瘤病毒(XIANGZHI等人Vaccinia virus K1L protein supports viral replication in human and rabbit cells through a cell-type-specific set of its ankyrin repeat residues that are distinct from its binding site for ACAP2.Journal of virology.2006,第353卷,no.1,第220-233页)。
WO 2004/014314(KIRN DAVID(US))描述了一种在其病毒基因组中包括一个或多个突变的变更的牛痘病毒。所描述的突变属于一种或多种以下多肽分类:1)干扰素调节多肽;2)互补控制多肽;3)TNF或趋化因子调节多肽;4)丝氨酸蛋白酶抑制剂;5)IL-lp调节多肽;6)非感染性EEV形式多肽;和7)作用于抑制感染性病毒从细胞释放的病毒多肽(抗感染病毒形式的多肽)。此外,还公开了牛痘病毒A41L或C11R中的突变。
本申请更具体地说明了牛痘基因组区,例如A34R、A41L、A53R、B5R、B7R、B8R、B13R、B15R、B18R、B22R、B28R、B29R、CUR、E3L、K2L、N1L、vC12L和vCKBP。本发明的方法涉及使用在此讨论的任意痘病毒。发明人还公开了通过给予癌细胞或患者有效量的该变更的牛痘病毒治疗癌症的方法。
技术实现要素:
发明人出人意料地发现,包括缺陷性I4L和/或F4L基因的痘病毒具有提高的安全性谱,但保持着相等的溶瘤活性(与其天然对应物相比较)。
本发明涉及包括缺陷性I4L和/或F4L基因的痘病毒,其条件是所述痘病毒不是NYVAC。
如申请文件通篇所用,除非上下文明显另外指出,术语“a”和“an”以其表示“至少一种”、“至少第一”、“一种或多种”或“多个”所引组分或步骤的含义使用。例如,术语“细胞”包括多个细胞,包括其混合物。
术语“和/或”在本文任意处使用时均包括以下含义:“和”、“或”和“所述术语相连的元素的所有或任意其他组合”。
如本文所用,术语“大约”或“约”是指在指定值或范围的20%以内,优选10%以内,更优选5%以内。
如本文所用,术语“包括”和“包括有”是指产品、组成和方法包括所引的组分或步骤,但不排除其他。当定义产品、组成和方法时,“基本上由……组成”应当指排除其他具有任何重要意义的组分或步骤。因此,基本上由所描述组分组成的组合物不排除痕量污染物和可药用的载体。“由……组成”应当指排除其他组分或步骤的痕量元素。
如本文所用,术语“包括缺陷性基因的痘病毒”是指在缺陷性基因的一个或多个核苷酸中包括删除、置换或加入或者这些可能性的任意组合的痘病毒,其中所述的修饰导致痘病毒不能产生具有未修饰基因所产生蛋白质的活性的蛋白质。在本发明的优选实施方式中,包括缺陷性基因的痘病毒是指其中全部基因序列被删除的痘病毒。突变可以使用重组技术以若干种本领域技术人员已知的方式进行。修饰痘病毒基因组的方法在本领域是可获得的。例如,以下文献中公开的方法可以用于产生本发明的痘病毒:MCCART等人Systemic cancer therapy with a tumor selective vaccinia virus mutant lacking thymidine kinase and vaccinia growth factor genes..Cancer res..2001,no.61,第8751-57页;KIM等人Systemic armed oncolytic ans immunologic therapy for cancer with JX-594,a targeted poxvirus expressing GM-CSF.Molecular Therapeutic.2006,no.14,第361-70页;WO 2004/014314(KIRN DAVID(US))19/02/2004和US 5364773(VIROGENETICS CORPORATION(TROY,NY))15/11/1994。本申请实施例中公开的方法具体地有关产生根据本发明的痘病毒。多种痘病毒基因组的序列是本领域可获得的,例如,牛痘病毒(vaccinia virus)、牛痘病毒(cowpox virus)、金丝雀痘病毒、鼠痘病毒、粘液瘤病毒基因组可获自Genbank(编号分别为NC_006998、NC_003663、NC_005309、NC_004105、NC_001132)。
如本文所用,术语“痘病毒”是指属于痘病毒科家族的病毒。根据优选的实施方式,根据本发明的痘病毒属于脊椎动物痘病毒(Chordopoxvirinae)亚科,更优选地,属于正痘病毒(Orthopoxvirus)属,再更优选地,属于牛痘病毒物种。
例如,可以使用牛痘病毒Dairen I、IHD-J、L-IPV、LC16M8、LC16MO、Lister、LIVP、Tashkent、WR 65-16、Wyeth、安卡拉(Ankara)、哥本哈根(Copenhagen)、天坛(Tian Tan)和WR株。根据特别优选的实施方式,根据本发明的痘病毒是牛痘病毒哥本哈根株。
痘病毒牛痘含有大的双链DNA基因组(187千碱基对),是唯一在感染的细胞的细胞质中复制的已知DNA病毒家族的成员。由于感染的细胞必须将大量DNA前体递送至细胞质复制位点,病毒编码并表达许多DNA代谢和合成所需的酶活性,包括核糖核苷酸还原酶和脱氧尿苷5’-三磷酸核苷酸水解酶(dUTPase)。
核糖核苷酸还原酶(EC 1.17.4.1)催化核糖核苷酸还原成脱氧核糖核苷酸——代表DNA生物合成中第一提交步骤的反应。病毒酶在亚基结构上与哺乳动物酶相似,由两个称作R1和R2的异源性亚基组成。编码病毒核糖核酸还原酶亚基的基因已得以测序,并定位于牛痘基因组上的位置,被35千碱基隔开(SLABAUGH等人.Journal of virology.1988,第62卷,519-27页;TENGELSEN等人.Virology.1988,no.164,第121-31页;SCHMITT等人.Journal of virology.1988,no.62,第1889-97页)。牛痘病毒大的亚基的单体(称作R1,由I4L基因编码)是86-kDa的多肽,含有核苷酸底物变构效应器结合位点(SLABAUGH等人.Journal of virology.1984,no.52,第507-14页;SLABAUGH等人.Journal of virology.1984,no.52,第501-6页)。小的亚基(称作R2,由F4L基因编码)是包括两个37-kDa多肽的同二聚体;每个多肽含有催化要求的基于铁稳定化蛋白质的自由基(HOWELL等人.Journal of Biological Chemistry.1992,no.267,第1705-11页)。I4L和F4L基因的序列及其在多种痘病毒基因组中的位置可获自公开数据库,例如,经由登陆号DQ437594、DQ437593、DQ377804、AH015635、AY313847、AY313848、NC_003391、NC_003389、NC_003310、M35027、AY243312、DQ011157、DQ011156、DQ011155、DQ011154、DQ011153、Y16780、X71982、AF438165、U60315、AF410153、AF380138、U86916、L22579、NC_006998、DQ121394和NC_008291。
除非另外指出,本文使用的基因命名是哥本哈根牛痘株,并也用于其他痘病毒科的同源基因。但是,基因命名可以根据痘株而不同。供参考,哥本哈根和MVA基因之间的对应关系可以见于ANTOINE.Virology.1998,no.244,第365-396页的表1。
根据优选实施方式,本发明的痘病毒还包括缺陷性J2R基因。
J2R基因编码胸苷激酶(TK),其形成嘧啶脱氧核糖核苷酸合成补救途径的一部分。由TK催化的反应涉及将γ-磷酰基部分从ATP转移至2'脱氧-胸苷(dThd),产生胸苷5'-单磷酸(dTMP)。牛痘病毒的TK是2型的。与1型相比较,2型TK具有较小的多肽链,为~25KDa,但形成同四聚体。它们对于代谢途径末端产生的反馈抑制物dTDP或dTTP敏感。与1型TK相比较,2型TK的底物特异性要窄得多,仅磷酸化2'脱氧尿苷(dU)和/或dThd(EL OMARI等人Structure of vaccinia virus thymidine kinase in complex with dTTP:insights for drug design.BMC structural biology.2006,no.6,第22页)。
J2R区域缺陷性的痘病毒及其获得方法可获自本领域。例如,可以使用以下文献的教导产生J2R区域删除的痘病毒:MCCART等人Systemic cancer therapy with a tumor-selective vaccinia virus mutant lacking thymidine kinase and vaccinia growth factor genes.cancer research.2001,第61卷,no.24,第8751-7页;PUHLMANN等人Vaccinia as a vector for tumor-directed gene therapy:biodistribution of a thymidine kinase-deleted mutant.Cancer gene therapy.2000,第7卷,no.1,第66-73页;GNANT等人Systemic administration of a recombinant vaccinia virus expressing the cytosine deaminase gene and subsequent treatment with 5-fluorocytosine leads to tumor-specific gene expression and prolongation of survival in mice.Cancer Research.1999,第59卷,no.14,第3396-403页。
根据优选的实施方式,本发明的痘病毒还包括缺陷性F2L基因。
脱氧尿苷5’-三磷酸核苷酸水解酶(dUTP酶,EC 3.6.1.23)在Mg(2+)离子的存在下催化dUTP水解成dUMP和焦磷酸。在从dNTP库除去dUTP并产生dUMP时,dUTP酶涉及保持DNA复制的保真度以及通过胸苷酸合酶提供产生TMP的前体。牛痘dUTP酶是由F2L基因编码的15kDa蛋白质(MCGEOGH..Nucleic Acids Research.1990,no.18,第4105-10页;BROYLES..Virology.1993,no.195,第863-5页)。牛痘病毒F2L基因的序列可经由登陆号M25392获自genbank,F2L基因在多种痘病毒基因组中的序列和位置也可以获自genbank,例如,经由登陆号NC_006998、DQ121394、NC_001611、AY689436、AY689437、NC_008291、DQ437594、DQ437593、AY313847、AY313848、NC_006966、NC_005309、NC_003391、NC_003389、NC_001132、NC_003310、NC_002188、M35027、AY243312、AF170726、DQ011157、DQ011156、DQ011155、DQ011154、DQ011153、X94355、Y16780、AY318871、U94848、AF198100和M34368。
根据优选的实施方式,根据本发明的痘病毒还包括目标核酸。
在优选的实施方式中,目标核酸含有编码其为治疗分子的基因产物的至少一段目标序列(即,治疗基因)。“治疗分子”是当适当给予患者特别是患有疾病或疾病状况或者应当针对该疾病或状况受保护的患者时具有药理学或保护活性的分子。这样的药理学或保护活性是预期与在所述疾病或所述状况的进程或症状方面的有益效果相关的活性。当技术人员在本发明的过程中选择编码治疗分子的基因时,他通常将其选择与之前获得并且可以在没有过度实验的情况下合理预期的结果相关联,而不是实施要求保护的发明,以获得这样的药学特性。根据本发明,目标序列与其导入的目标细胞可以是同源的或异源的。有利地,目标所述序列编码全部或部分多肽,特别是具有治疗或预防特性的治疗或预防性多肽。多肽理解成多核苷酸的任意翻译产物,无论其大小,是否糖基化,并且包括肽和蛋白质。作为主要的例子,治疗性多肽包括可以补偿动物或人机体中缺陷性或缺乏的蛋白质的多肽,或者通过毒性效果作用以限制有害细胞并将其从体内去除的多肽。它们还可以是免疫性赋予多肽,其起到内源性抗原的作用,以激发体液或细胞反应或者二者。
治疗性基因编码的多肽的例子包括编码以下的基因:细胞因子(α、β或γ干扰素,白介素特别是IL-2、IL-6、IL-10或IL-12,肿瘤坏死因子(TNF),集落刺激因子GM-CSF、C-CSF、M-CSF…,免疫刺激多肽(B7.1、B7.2等),凝血因子(FVIII、FIX…),生长因子(转化生长因子TGF、成纤维细胞生长因子FGF等),酶(脲酶、肾素、凝血酶、金属蛋白酶、一氧化氮合酶NOS、SOD、过氧化氢酶…),酶抑制剂(α1-抗胰蛋白酶、抗凝血酶III、病毒蛋白酶抑制剂、纤溶酶原激活物抑制剂PAI-1),CFTR(囊性纤维化跨膜传导调节子)蛋白,胰岛素,肌萎缩蛋白,I类或II类MHC抗原,可以调控/调节细胞基因表达的多肽,能够抑制细菌、寄生虫或病毒感染或其发展的多肽(抗原多肽、抗原表位、通过竞争抑制天然蛋白质作用的反式显性(transdominant)变体…),细胞凋亡诱导剂或抑制剂(Bax、Bcl2、BclX…),细胞静止剂(p21、p16、Rb…),载脂蛋白(ApoAI、ApoAIV、ApoE…),血管生成抑制剂(血管抑素、内皮抑素…),血管生成多肽(血管内皮生长因子VEGF家族、FGF家族、CCN家族,包括CTGF、Cyr61和Nov),氧自由基清除剂,具有抗肿瘤效果的多肽,在本领域识别为可用于治疗或预防临床状况的抗体、毒素、免疫毒素和标记物(β-半乳糖苷酶、荧光素酶…)或任何其他目标基因。
合适的抗肿瘤基因包括但不限于编码肿瘤抑制物的基因(例如Rb、p53、DCC、NF-1、Wilm肿瘤、NM23、BRUSH-1、p16、p21、p56、p73及其各自的突变体)、自杀基因产物、抑制细胞分裂或转导信号的抗体、多肽。
根据特别优选的实施方式,本发明的痘病毒还包括自杀基因。
自杀基因是指编码能够将药物前体转化成细胞毒性化合物的蛋白质的基因。
自杀基因包括但不限于编码具有胞嘧啶脱氨酶活性、胸苷激酶活性、尿嘧啶磷酸核糖转移酶活性、嘌呤核苷磷酸化酶活性和/或胸苷酸激酶活性的蛋白质的基因。
自杀基因和包括一个核碱基部分的对应药物前体的例子公开于下表:
表1
根据本发明的优选实施方式,自杀基因编码具有至少一种CD酶活性的蛋白质。CD酶涉及嘧啶代谢途径,通过该途径外源性胞嘧啶通过水解脱氨的方式转化成尿嘧啶。尽管CD酶活性已经在原核生物和低等真核生物中得以证明(JUND等人.Journal of Bacteriology.1970,no.102,第607-15页;BECK等人.Journal of Bacteriology.1972,no.110,第219-28页;HOEPRICH等人.Journal of Infectious Diseases.1974,no.130,第112-18页;ESDERS等人.J.biol.chem..1985,no.260,第3915-22页),它们在哺乳动物中并不存在(KOECHLIN等人.Biochemical pharmacology.1966,no.15,第435-46页;POLAK等人.Chemotherapy.1976,no.22,第137-53页)。
CD酶还使胞嘧啶的类似物即5-氟胞嘧啶(5-FC)脱氨,从而形成5-氟尿嘧啶(5-FU),这是当其转化成5-氟-UMP(5-FUMP)时具有高度细胞毒性的化合物。由于使编码酶的基因失活的突变或者由于其在该酶中天然缺陷而缺少CD酶活性的细胞,由于是哺乳动物细胞,对5-FC有抗性(JUND等人.Journal of Bacteriology.1970,no.102,第607-15页;KILLSTRUP等人.Journal of Bacteriology.1989,no.171,第2124-2127页)。相反,向其中转移编码CD酶活性的序列的哺乳动物细胞变得对5-FC敏感(HUBER等人.Cancer Research.1993,no.53,第4619-4626页;MULLEN等人.Proceedings of the National Academy of Sciences of the United States of America.1992,no.89,第33-37页;WO 93/01281(US HEALTH))。此外,相邻的未转化的细胞也变得对5-FC敏感(HUBER等人.Proceedings of the National Academy of Sciences of the United States of America.1994,no.91,第8302-6页)。这一现象称作旁观者效应(bystander effect),是由于表达CD酶活性分泌5-FU的细胞接着通过跨质膜的直接扩散使相邻细胞中毒。5-FU在被动扩散中的这一特性代表了与其中旁观者效应要求与表达tk的细胞有接触的tk/GCV参考系统相比较的优势(MESNIL等人.Proceedings of the National Academy of Sciences of the United States of America.1996,no.93,第1831-35页)。因此,可以很容易地理解CD酶在基因治疗特别是抗癌基因治疗背景中提供的所有优势。
分别编码这两种生物的CD酶的酿酒酵母(S.cerevisiae)FCY1、白色念珠菌FCA1和大肠杆菌codA基因是已知的,其序列已得到公开(分别是SEQ ID NO:4;SEQ ID NO:5;SEQ ID NO:6)。
在这一方面,根据本发明更优选的实施方式,编码具有CD酶活性的蛋白质的基因是FCY1、FCA1或CodA或其类似物。这些基因的类似物是指核酸序列与亲本基因核酸序列的同一性程度大于70%、有利地大约80%、优选大于90%、最优选大于95%的基因。
专利WO 2005/007857公开了编码具有提高的CD酶活性的蛋白质的基因。该多肽通过加入氨基酸序列衍生自天然CD酶。根据本发明另一优选实施方式,具有CD酶活性的蛋白质是WO 2005/007857公开的多肽,更优选序列标识符SEQ ID NO:2中表示的FCU1-8多肽及其类似物。
在原核生物和低等真核生物中,尿嘧啶通过尿嘧啶磷酸核糖转移酶(UPRT酶)的作用转化成UMP。该酶将5-FU转化成5-FUMP。根据本发明另一优选实施方式,自杀基因编码具有UPRT酶活性的蛋白质。
所讨论的UPRT酶可以是任何来源的,特别是原核生物、真菌或酵母来源。通过说明的方式,在本发明的上下文中,可以使用编码来自以下的UPRT酶的核酸序列:大肠杆菌(E.coli)(ANDERSEN等人Characterization of the upp gene encoding uracil phosphoribosyltransferase of Escherichia coli K12.European Journal of Biochemistry.1992,no.204,第51-56页);乳酸乳球菌(Lactococcus lactis)(MARTINUSSEN等人Cloning and characterization of upp,a gene encoding uracil phosphoribosyltransferase from Lactococcus lactis.Journal of Bacteriology.1994,第176卷,no.21,第6457-63页);牛分枝杆菌(Mycobacterium bovis)(KIM等人Complete sequence of the UPP gene encoding uracil phosphoribosyltransferase from Mycobacterium bovis BCG.Biochemistry and molecular biology international.1997,vol.41,no.6,p.1117-24);和枯草杆菌(Bacillus subtilis)(MARTINUSSEN等人Two genes encoding uracil phosphoribosyltransferase are present in Bacillus subtilis.Journal of Bacteriology.1995,第177卷,no.1,第271-4页)。但是,最特别优选使用酵母UPRT酶,特别是由酿酒酵母FUR1基因编码的酵母UPRT酶,公开于以下文献中的所述基因的序列在此并入作为参考:KERN等人The FUR1gene of Saccharomyces cerevisiae:cloning,structure and expression of wild-type and mutant alleles.(Gene.1990,第88卷,no.2,第149-57页)。作为指导,基因序列和对应的UPRT酶的序列可以见于文献和专业数据库中(SWISSPROT、EMBL、Genbank、Medline等)。
申请EP 0998568 A说明了在使得合成UPRT酶的编码部分的5’缺乏105核苷酸的FUR1基因,上述酶在N-端位置处前35个残基已经被删除,并以天然蛋白质中36位处的甲硫氨酸开始。突变体基因的表达产物命名为FUR1Δ105,能够补充酿酒酵母的fur1突变体。此外,截短的突变体表现出比天然酶更高的UPRT酶活性。因此,根据本发明特别有利的实施方式,自杀基因编码天然UPRT酶的缺失突变体。缺失优选地位于原始UPRT酶N-端区域中。其可以是完全的(影响所述N-端区的所有残基),或者是部分的(影响一级结构中一个或多个连续或不连续的残基)。通常,多肽由N-端、中间和C-端部分组成,每个代表分子的大约三分之一。例如,由于酿酒酵母UPRT酶具有251个氨基酸,其N-端部分由位于天然形式第一位处的以所谓的起始子甲硫氨酸开始的前83个氨基酸组成。对于大肠杆菌UPRT酶,其N-端部分包括位置1-69。
优选的具有UPRT酶活性的蛋白质包括基本上如EP 0998568 A的序列标识符SEQ ID NO:1所示的氨基酸序列,以1位上的Met残基开始,以216位上的Val残基结束。术语“基本上”是指与所述序列SEQ ID NO:1 EP 0998568 A的同一性程度大于70%,有利地大于80%,优选大于90%,最优选大于95%。再更优选地,其包括序列标识符SEQ ID NO:1 EP 0998568 A中所示的氨基酸序列。如上所述,其可以包括额外的突变。具体可以提及2位(天然UPRT酶中的37位)上的丝氨酸残基被丙氨酸残基置换。
根据本发明另一优选实施方式,自杀基因编码具有至少一种CD酶和至少一种UPRT酶活性的蛋白质。专利申请WO 96/16183和EP 0998568 A描述了使用编码具有两种具有CD酶和UPRT酶活性的结构域的酶的融合蛋白,并表明由表达质粒携带的杂合基因codA::upp或FCY1::FUR1或FCY1::FUR1Δ105(即FCU1)的转移增加了转染的B16细胞对5-FC的敏感性。根据本发明更优选的实施方式,自杀基因编码包括基本上如序列标识符SEQ ID NO:3(coda::upp)、SEQ ID NO:1(FCU1)或FCY1::FUR1表示的氨基酸序列的多肽。术语“基本上”是指与所述序列的同一性程度大于70%,有利地大于80%,优选大于90%,最优选大于95%。再更优选地,其包括序列标识符SEQ ID NO:3(coda::upp)、SEQ ID NO:1(FCU1)或FCY1::FUR1中所示的氨基酸序列。如上所述,其可以包括额外的突变。
根据使用中的常规技术,核酸序列可以很容易地通过克隆、通过PCR或通过化学合成得到。它们可以是天然基因,或者是通过突变、缺失、置换和/或加入一个或多个核苷酸由后者得到的基因。而且,其序列在本领域技术人员可以查阅的文献中得以广泛说明。
本领域技术人员能够由公开的数据克隆CD酶或UPRT酶序列,进行可能的突变,根据现有技术或者基于申请EP 0998568 A中所示的方案在非细胞或细胞系统中测试突变体形式的酶活性,并且具体地分阶段融合具有CD酶和UPRT酶活性的多肽,并因此融合全部或部分的对应的基因。
根据更优选的实施方式,本发明的痘病毒还包含包括编码通透酶的基因的核酸序列。
通透酶是指涉及包括一个核碱基部分的药物或其前体通过细胞膜转移的跨膜蛋白。
通透酶包括但不限于嘌呤通透酶、胞嘧啶通透酶和核苷转运体。
根据本发明优选的实施方式,通透酶是酿酒酵母嘌呤或胞嘧啶通透酶。酿酒酵母核碱基转运体由称作FCY2的嘌呤-胞嘧啶通透酶和称作FUR4的尿嘧啶通透酶组成。嘌呤-胞嘧啶通透酶FCY2介导质子和腺嘌呤、鸟嘌呤、次黄嘌呤和胞嘧啶跨酵母质膜的同向转运(Grenson 1969,Jund和Lacroute 1970;Polak和Grenson 1973;Chevallier等人1975;Hopkins等人1988)。FCY2蛋白质还介导胞嘧啶的类似物5-氟胞嘧啶的转运(Grenson 1969;Jund和Lacroute 1970)。FCY2基因编码最初预测具有10-12个(Weber等人1990)、现在赞同9个(Ferreira等人1999)跨膜-跨越结构域的533个氨基酸的蛋白质(58kDa)。FCY2对于嘌呤核碱基和胞嘧啶表现出相似的亲和性(Brethes等人1992)。尿嘧啶摄取到酿酒酵母中通过尿嘧啶通透酶FUR4介导(Jund和Lacroute 1970;Jund等人1977)。FUR4是尿嘧啶-质子同向转运蛋白(Hopkins等人1988),其预测是具有10个跨膜结构域和长的细胞质亲水性N-和C-端尾部(Jund等人1988;Garnier等人1996)的633个氨基酸的蛋白质(71.7kDa)。FUR4蛋白质还可以介导尿嘧啶的类似物5-氟尿嘧啶的转运(Jund和Lacroute1970)。
FCY2和Fur4的氨基酸序列尤其可获自swissprot数据库(登录号分别为P17064和P05316)。优选地,通透酶具有选自包含如专利申请WO2006/048768中所公开的氨基酸序列SEQ ID NO:1和SEQ ID NO:2的组的氨基酸序列。
就这一方面,根据本发明优选实施方式,通透酶选自包含FCY2和Fur4的组及其类似物。Fur4和FCY2类似物是指氨基酸序列与本文以上所述的亲本蛋白质氨基酸序列具有大于70%,有利地大于80%,优选大于90%,最优选大于95%的同一性程度并且保持穿过细胞膜转运包括至少一个核碱基部分的药物的能力的多肽。
本领域技术人员能够选择通透酶,其将与药物或包括一个碱基部分的药物前体有关。例如,FCY2和Fur4优选地与5-氟胞嘧啶(5-FC)有关。
根据更优选的实施方式,本发明的痘病毒还可以包括目标核苷酸的表达所必需的元件。
根据更优选的实施方式,本发明的痘病毒还可以包含包括编码通透酶的基因的核酸序列的表达所必需的元件。
目标核酸和/或包括编码通透酶的基因的核酸的表达所必需的元件包括将所述DNA转录为mRNA以及如果需要的话将mRNA翻译成多肽所要求的元件。适合用于许多脊椎动物系统的转录启动子在文献中得以广泛描述。例如,合适的启动子包括病毒启动子例如RSV、MPSV、SV40、CMV或7.5k,牛痘启动子,诱导型启动子等。优选的启动子分离自痘病毒,例如,牛痘病毒7.5K、H5R、TK、p28、p11或K1L。另外可选地,可以使用例如CHAKRABARTI.Biotechniques.1997,no.23,第1094-97页;HAMMOND等人.Journal of Virological Methods.1997,no.66,第135-38页;和KUMAR.Virology.1990,no.179,第151-8页中所述的合成启动子以及早期和晚期痘病毒启动子之间的嵌合启动子。
目标核酸序列和包括编码通透酶的基因的核酸序列还可以包括额外的功能元件,例如内含子序列、靶向序列、转运序列、分泌信号、核定位信号、IRES、聚A转录终止序列、三联体前导序列和涉及复制或整合的序列。所述序列在文献中已经报道,本领域技术人员可以很容易地获得。
本发明还涉及制备根据本发明的痘病毒的方法,其包括:
(i)将根据本发明的痘病毒引入到细胞中,
(ii)将所述细胞在适合于能够产生所述痘病毒的条件下培养,和
(iii)从细胞培养物中回收所述痘病毒。
尽管痘病毒当然可以从培养物上清液中回收,其也可以自细胞回收。常用的方法之一在于通过连续冷冻/解冻循环的方式溶解细胞,以收集溶解上清液中的病毒体。然后可以将病毒体扩增,并使用本领域技术纯化(色谱方法、超离心方法,特别是通过氯化铯梯度等)。
本发明还涉及包括根据本发明的痘病毒与可药用的赋形剂的组合的组合物。
根据本发明的组合物更加具体地通过基因治疗的方式用于疾病的预防或治愈性治疗,更具体地目的在于增殖性疾病(癌症、肿瘤、再狭窄等)或目的在于与破骨细胞活性增加有关的疾病(例如,类风湿性关节炎、骨质疏松症)。
根据本发明的组合物可以就其局部、肠胃外或消化途径给药而言常规制造。具体地,将治疗有效量的本发明的重组载体或痘病毒与可药用的赋形剂组合。可以预期有许多种给药途径。可以提到的例子有胃内、皮下、心脏内、肌内、静脉内、腹膜内、肿瘤内、鼻内、肺内和气管内途径。在后三个实施方式的情形中,给药通过气溶胶或通过滴注方式进行是有利的。给药可以作为单一剂量或者作为特定时间间隔后一个或多个时机重复的剂量进行。适当的给药路径和剂量取决于许多参数,例如,个体、要治疗的疾病或者要转移的目标基因。基于根据本发明的病毒颗粒的制剂可以配置成剂量104至1014pfu(斑形成单位)、有利地105至1013pfu、优选106至1012pfu、更优选106至107pfu的形式。
组合物可以包括就药学观点而言可接受的稀释剂、佐剂或赋形剂以及增溶剂、稳定剂和防腐剂。在注射给药的情形中,优选含水、非水或等渗溶液中的制剂。其可以呈现为液体或干燥(粉末、冻干物等)形式的单剂量或多剂量,所述冻干物可以在使用时使用适当的稀释剂重建。
本发明还涉及根据本发明的痘病毒或组合物用于制备意在通过基因疗法用于治疗人或动物体的药物的用途。药物可以在体内直接给药(例如,通过静脉内注射至可接近的肿瘤中,通过气溶胶方式至肺内,使用适当的导管至血管系统中)。优选的用途在于治疗或预防癌症、肿瘤和有害细胞增殖导致的疾病。可以提及的可想到的应用为乳腺癌、子宫癌(特别是由乳头状瘤病毒导致者)、前列腺癌、肺癌、膀胱癌、肝癌、结肠癌、胰腺癌、肺癌、食道癌、喉癌、中枢神经系统癌症(例如成胶质细胞瘤)和血癌(淋巴瘤、白血病等)。另一优选的用途在于治疗或预防类风湿性关节炎、骨质疏松症和其他与破骨细胞活性增加有关的疾病。也可以用于心血管疾病背景,例如,为了抑制或延迟血管壁平滑肌细胞的增生(再狭窄)。最后,在感染性疾病的情形中,可以预期药物应用于AIDS。
当使用本发明的痘病毒、组合物或方法用于治疗癌症时,优选的给药途径是全身途径,因为根据本发明的痘病毒能够特异性地靶向肿瘤细胞。
本发明还延伸至用于治疗疾病的方法,其特征在于将根据本发明的痘病毒、组合物给予对该治疗有需求的宿主生物或细胞。
根据有利的实施方式,治疗用途或治疗方法还包括额外的步骤,其中给予宿主生物或细胞可药用量的前药,有利地为胞嘧啶类似物,特别是5-FC。例如,可以使用50-500mg/kg/天的剂量,优选200mg/kg/天或100mg/kg/天的剂量。在本发明上下文中,前药根据标准实践(例如,口服,全身)给药。
优选地,给药在施用根据本发明的治疗剂之后进行,优选在施用治疗剂之后至少3天,更优选至少4天,再更优选至少5天。根据本发明再更优选的实施方式,前药的给药在施用治疗剂之后7天进行。优选口服途径。可以给予单剂量前药,或者在足够长能够使毒性代谢物在宿主生物或细胞内产生的时间内重复给予多剂量。
而且,根据本发明的组合物或方法可以与一种或多种加强5-FU细胞毒性作用的物质组合。具体地可以提及抑制嘧啶从头生物合成途径的酶的药物(例如下文所提及者),例如甲酰四氢叶酸的药物(Waxman等人,1982,Eur.J.Cancer Clin.Oncol.18,685-692),其在5-FU代谢产物(5-FdUMP)的存在下增加胸苷酸合酶的抑制,导致复制所要求的dTMP库降低,最后是例如氨甲碟呤(methotrexate)的药物(Cadman等人,1979,Science 250,1135-1137),其通过抑制二氢叶酸还原酶并增加PRPP(磷酸核糖焦磷酸)库,使得5-FU掺入到细胞RNA内增加。
根据本发明,抑制嘧啶从头生物合成路径的酶的药物优选地选自PALA(N-(膦酰基乙酰基)-L-天冬氨酸;Moore等人,1982,Biochem.Pharmacol.31,3317-3321);来氟米特(Leflunomide)A771726(来氟米特活性代谢物;Davis等人,1996,Biochem.35,1270-1273)和布喹那(Brequinar)(Chen等人,1992,Cancer Res.52,3251-3257)。
根据本发明的组合物或方法可以与一种或多种抗癌治疗有效的物质组合。在可以与根据本发明的组合物联合或组合使用的抗癌治疗有效的药学物质当中,可以提到的有烷基化剂,例如,如丝裂霉素C、环磷酰胺、白消安、异环磷酰胺(ifosfamide)、异环磷酰胺(isosfamide)、美法仑、六甲嘧胺、噻替派(thiotepa)、苯丁酸氮芥(chlorambucil)或达卡巴嗪(dacarbazine);抗代谢物,例如,如吉西他滨(gemcitabine)、卡培他滨(capecitabine)、5-氟尿嘧啶、阿糖孢苷、2-氟脱氧胞苷、氨甲碟呤、idatrexate、tomudex或三甲曲沙(trimetrexate);拓扑异构酶II抑制剂,例如,如阿霉素、表阿霉素、依托泊苷(etoposide)、替尼泊苷(teniposide)或米托蒽醌(mitoxantrone);拓扑异构酶I抑制剂,例如,如伊力替康(CPT-11)、7-乙基-10-羟基-喜树碱(SN-38)或拓扑替康;抗有丝分裂药物,例如,如紫杉醇、多西紫杉醇、长春花碱、长春新碱或长春瑞滨;和铂衍生物,例如,如顺铂、草酸铂、顺螺铂(spiroplatinum)和卡铂(carboplatinum)。
一种或多种抗癌治疗中有效的物质和本发明的组合物可以通过本领域技术人员公知的方法一次或数次给药,包括全身给药和直接注射到肿瘤中。可以通过团注或灌注进行(例如,0.5-6小时中)。抗癌物质和/或痘病毒组合物的多种给药可以彼此以适当时间分开,并使用相同或不同的剂量在相同位点或不同位点通过相同途径或通过不同途径进行。剂量可以由从业人员鉴于多种参数例如要治疗的癌症的性质、给药的模式和频率以及给予药物常规考虑的其他因素加以调适。
在一实施方式中,本发明的方法或组合物与特别优选伊力替康的拓扑异构酶I抑制剂结合。优选地,伊力替康和痘病毒组合物静脉内给药。例如,伊力替康的适当剂量可以从5-100mg/kg/天变化,痘病毒剂量为从1x106至1x109pfu。优选地,痘病毒组合物将静脉内注射1-3次,伊力替康以适当的周期性(例如一周一次)注射对于一个或多个循环。此外,在首次给予痘病毒组合物之后数天(例如,3-10天)将进行伊力替康治疗。
在另一实施方式中,本发明的方法或组合物与特别优选草酸铂的抗有丝分裂药物结合。优选地,草酸铂将腹膜内或静脉内给药,并且根据本发明的痘病毒组合物通过静脉内途径给药。例如,草酸铂的适当剂量可以从0.5-10mg/kg/天变化,痘病毒剂量为从1x106至1x109pfu。优选地,痘病毒组合物将静脉内注射1-3次,草酸铂以适当的周期性(例如每两周)注射,对于一个或多个循环。此外,优选的方法包括首次给予痘病毒组合物,然后在首次痘病毒注射之后数天(例如,3-10天)给予草酸铂治疗。
而且,本发明的方法或组合物还包括额外的步骤,其中如上所述将可药用量的前药给予宿主生物或细胞。本发明上下文中优选的前药是5-FC。
根据本发明的组合物或方法还可以与放疗结合使用。
根据本发明的组合物或方法还可以与一种或多种其他药剂结合使用,其包括但不限于免疫调节剂,例如,如α、β或γ干扰素,白介素(IL-2、IL-6、IL-10或IL-12)或肿瘤坏死因子;影响细胞表面受体调节的药剂,例如,如表皮生长因子受体抑制剂(特别是西妥昔单抗(cetuximab)、帕尼单抗(panitumumab)、扎鲁木单抗(zalutumumab)、尼妥珠单抗(nimotuzumab)、马妥珠单抗(matuzumab)、吉非替尼(gefitinib)、厄洛替尼(erlotinib)或拉帕替尼(lapatinib))或人表皮生长因子受体-2抑制剂(特别是曲妥珠单抗(trastuzumab));和影响血管生成的药剂,例如,如血管内皮生长因子抑制剂(特别是贝伐单抗(bevacizumab)或兰尼单抗(ranibizumab))。
附图说明
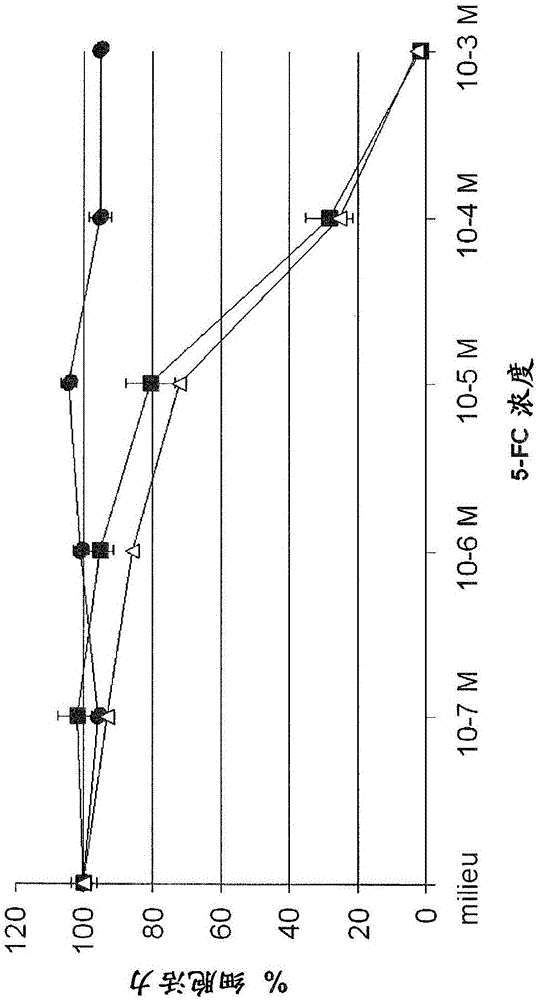
图1.牛痘病毒感染的人结肠直肠肿瘤细胞(LoVo)对5-FC的体外敏感性。将在0.0001MOI下用所示的病毒(模拟物(●)VVTK-/FCU1(■)或VVTK-I4L-/FCU1(△))感染的LoVo细胞暴露于多个浓度的5-FC。感染后5天测量细胞存活。结果以存在或不存在药物的情况下细胞存活力的百分比表示。数值以没有由于病毒复制的细胞死亡的情况下三次独立测量的平均值±SD表示。
图2.牛痘病毒感染的人结肠直肠肿瘤细胞(LoVo)对5-FC的体外敏感性。将在0.0001MOI下用所示的病毒(模拟物(●)VVTK-/FCU1(■)或VVTK-F4L-/FCU1(◇)感染的LoVo细胞暴露于多个浓度的5-FC。感染后5天测量细胞存活。结果以存在或不存在药物的情况下细胞生存力的百分比表示。数值以没有由于病毒复制的细胞死亡的情况下三次独立测量的平均值±SD表示。
图3.在0.0001MOI下用所示病毒感染的LoVo中在感染后第5天VVTK-/FCU1和VVTK-I4L-/FCU1的体外复制效力。数值以三次独立测量的平均值±SD表示。
图4.在0.0001MOI下用所示病毒感染的LoVo中在感染后第5天VVTK-/FCU1和VVTK-F4L-/FCU1的体外复制效力。数值以三次独立测量的平均值±SD表示。
图5.静脉注射病毒之后Swiss裸鼠中皮下LoVo的平均肿瘤体积±SEM。接种肿瘤(可触及肿瘤)之后7天,将小鼠用107pfu缓冲液+盐水(◇)、缓冲液+5-FC(◆)、VVTK-I4L-/FCU1+盐水(△)或VVTK-I4L-/FCU1+5-FC(▲)处理。病毒注射后7天在3周时间内,一天两次将动物用盐水或5-FC 100mg/kg/j通过口腔喂食处理。一周两次测量肿瘤体积。
图6.静脉注射病毒之后Swiss裸鼠中皮下LoVo的平均肿瘤体积±SEM。接种肿瘤(可触及肿瘤)之后7天,将小鼠用107pfu缓冲液+盐水(◇)、缓冲液+5-FC(◆)、VVTK-F4L-/FCU1+盐水(□)或VVTK-F4L-/FCU1+5-FC(■)处理。病毒注射后7天在3周时间内,一天两次将动物用盐水或5-FC 100mg/kg/j通过口腔喂食处理。一周两次测量肿瘤体积。
图7.静脉注射病毒之后Swiss裸鼠中皮下LoVo的平均肿瘤体积±SEM。接种肿瘤(可触及肿瘤)之后11天,将小鼠用以下处理:缓冲液+H2O(◇),或者缓冲液+5-FC(◆),或者一次注射107pfu VVTK-I4L-/FCU1+H2O(○),或者一次注射107pfu VVTK-I4L-/FCU1+5-FC(病毒注射之后7天并且在3周时间内施用5-FC)(●),或者两次(第11天和第33天)注射107pfu VVTK-I4L-/FCU1+H2O(□),或者两次(第11天和第33天)注射107pfu VVTK-I4L-/FCU1+5-FC(从第18天到第32天和从第40天到第54天给予5-FC)(■)。一天两次将动物用100mg/kg 5-FC通过口腔喂食处理。一周两次测量肿瘤体积。
图8.静脉注射病毒之后Swiss裸鼠中皮下U87-MG(成胶质细胞瘤肿瘤细胞)的平均肿瘤体积±SEM。接种肿瘤(可触及肿瘤)之后11天,将小鼠用以下处理:缓冲液+H2O(◇),或者缓冲液+5-FC(◆),或者107pfu VVTK-I4L-/FCU1+H2O(○),或者107pfu VVTK-I4L-/FCU1+5-FC(●)。病毒注射之后7天在3周时间内,一天两次将动物用100mg/kg5-FC通过口腔喂食处理。一周两次测量肿瘤体积。
图9.分裂细胞中与汇合细胞中病毒收率的比例。将PANC1(人胰腺肿瘤)、H1299(人肺肿瘤)或U118MG(人胶质瘤肿瘤)细胞用100pfuVVTK-/FCU1或VVTK-I4L-/FCU1感染。感染后48h,测定病毒滴度。数值是分裂细胞中与汇合细胞中病毒收率之间的比例。
图10.分裂细胞中与汇合细胞中病毒收率的比例。将PANC1(人胰腺肿瘤)、H1299(人肺肿瘤)或U118MG(人胶质瘤肿瘤)细胞用100pfuVVTK-/FCU1或VVTK-F4L-/FCU1感染。感染后48h,测定病毒滴度。数值是分裂细胞中与汇合细胞中病毒收率之间的比例。
图11.用1x106PFU的VVTK-/FCU1或VVTK-I4L-/FCU1静脉感染到荷有皮下人肿瘤的Swiss裸鼠中之后的第6天和第21天,器官或肿瘤中的病毒滴度(pfu/mg组织)。
图12.用1x106PFU的VVTK-/FCU1或VVTK-F4L-/FCU1静脉感染到荷有皮下人肿瘤的Swiss裸鼠中之后的第6天和第21天,器官或肿瘤中的病毒滴度(pfu/mg组织)。
图13.通过静脉注射用1x108pfu的VVTK-/FCU1(■)或VVTK-I4L-/FCU1处理之后Swiss裸鼠的存活。
图14.通过静脉注射用1x107pfu(A)或1x108pfu(B)的VVTK-/FCU1(■)或VVTK-I4L-/FCU1(◇)处理之后具有免疫力的B6D2小鼠的存活。
图15.感染后第13天和感染后第34天在Swiss裸鼠中静脉注射1x106pfu VVTK-/FCU1或VVTK-I4L-/FCU1之后尾部痘痕的平均数量。
图16.感染后第13天和感染后第34天在Swiss裸鼠中静脉注射1x106pfu VVTK-/FCU1或VVTK-F4L-/FCU1之后尾部痘痕的平均数量。
图17.感染后第15天和感染后第31天在Swiss裸鼠中静脉注射1x107pfu VVTK-/FCU1或VVTK-I4L-/FCU1之后尾部痘痕的平均数量。
图18.感染后第15天和感染后第31天在Swiss裸鼠中静脉注射1x107pfu VVTK-/FCU1或VVTK-F4L-/FCU1之后尾部痘痕的平均数量。
具体实施方式
实施例
构建载体质粒
使用胸苷激酶基因缺失并在牛痘合成启动子p11K7.5的控制下表达FCU1基因的牛痘病毒哥本哈根株(登陆号M35027)构建缺失I4L的穿梭质粒。通过PCR扩增I4L的DNA侧翼区域。I4L的下游侧翼区域的引物为5’-TCC CCC GGG TTA ACC ACT GCA TGA TGT ACA-3’(SEQ ID NO:7;SmaI位点加下划线)和5’-GCC GAG CTC GAG GTA GCC GTT TGT AAT TCT-3’(SEQ ID NO:8;SacI位点加下划线)。上游区的引物为5’-GCC TGG CCA TAA CTC CAG GCC GTT–3’(SEQ ID NO:9;MscI位点加下划线)和5’–GCC CAG CTG ATC GAG CCG TAA CGA TTT TCA–3’(SEQ ID NO:10;PvuII位点加下划线)。将扩增的DNA片段用限制性内切酶SmaI/SacI或MscI/PvuII消化,并连接到PpolyIII质粒中相应的位点中。I4L的下游侧翼区域的重复区域通过PCR使用以下引物扩增:5’-GCC GCA TGC ATC CTT GAA CAC CAA TAC CGA–3’(SEQ ID NO:11;SphI位点加下划线)和5’-GCT CTA GAG AGG TAG CCG TTT GTA ATC TG–3’(SEQ ID NO:12;XbaI位点加下划线),并插入到PpolyIII质粒中。在缺失的病毒的产生过程中使用重复区域消除选择盒。将与pH5R牛痘启动子控制下的GFP/GPT融合基因对应的选择盒插入到PpolyIII质粒中的SacI/SphI位点中。得到的质粒是缺失I4L基因的称作pΔI4L的重组穿梭质粒。
使用牛痘病毒哥本哈根株(登陆号M35027)构建缺失F4L的穿梭质粒。通过PCR扩增F4L的DNA侧翼区域。F4L的下游侧翼区域的引物为5’-CGC GGA TCC TTT GGT ACA GTC TAG TAT CCA-3’(SEQ ID NO:13;BamHI位点加下划线)和5’-TCC CCC GGG TTA TAA CAG ATG CAG TAT CCA-3’(SEQ ID NO:14;SmaI位点加下划线)。上游区域的引物为5’-GCC CAG CTGTTC AAT GGC CAT CTG AAA TCC–3’(SEQ ID NO:15;PvuII位点加下划线)和5’–GAA GAT CTA GTA TCG CAT CTA AAA GAT GG–3’(SEQ ID NO:16;BglII位点加下划线)。将扩增的DNA片段用限制性内切酶BamHI/SmaI或BglII/PvuII消化,并连接到PpolyIII质粒中相应的位点中。I4L的下游侧翼区域的重复区域通过PCR使用以下引物扩增:5’-GCC GAG CTC ACC CAC ACG TTT TTC GAA AAA–3’(SEQ ID NO:17;SacI位点加下划线)和5’-GCC GCA TGC TTA TAA CAG ATG CAG TAT CAA–3’(SEQ ID NO:18;SphI位点加下划线),并插入到PpolyIII质粒中。在缺失的病毒的产生过程中使用重复区域消除选择盒。将与pH5R牛痘启动子控制下的GFP/GPT融合基因对应的选择盒插入到PpolyIII质粒中的SacI/SmaI位点中。得到的质粒是缺失F4L基因的称作pΔF4L的重组穿梭质粒。.
产生重组牛痘病毒
将CEF细胞用VVTK-FCU1(牛痘病毒,J2R激酶基因缺陷性,在合成启动子p11k7.5的控制下表达FCU1基因)哥本哈根株在0.1MOI下感染,并在37℃下孵育2h,然后用重组穿梭质粒(0.2μg)的CaCl2共沉淀物转染。将细胞在37℃下孵育48h。然后使用出现的病毒稀释物在含有最终浓度15μg/ml的次黄嘌呤、最终浓度250μg/ml的黄嘌呤和最终浓度250μg/ml的霉酚酸的选择培养基中感染CEF细胞。分离荧光(GFP)和阳性(GPT选择)斑块,并在GPT选择培养基的存在下在CEF细胞中进行数轮选择。使用在缺失区域内的引物通过40个PCR循环确定VVTK-FCU1的存在或不存在。消除亲代病毒之后,使用双缺失病毒在没有GPT选择培养基的情况下感染CEF,以消除选择盒。分离非荧光斑块,并在CEF中进行2轮选择。将最终的重组VV病毒在CEF中扩增,提纯,并通过斑块测定在CEF上对病毒储液进行滴定。
对5-FC的体外细胞敏感性
将人肿瘤细胞由在0.0001MOI的各自的重组VV转导。将总计3x 105细胞/孔在2ml含有多种浓度5-FC的培养基中在6-孔培养皿中铺平板。然后将细胞在37℃下培养5天,通过台盼蓝拒染法对活细胞进行记数。图1、2、3和4所示的结果表示,比起在I4L和J2R基因缺陷性病毒中或者比起在F4L和J2R基因缺陷性病毒中,在J2R基因缺陷性病毒中FCU1活性是等同的。
培养的细胞中的体外复制
将分裂或汇合细胞在6孔斑块中以100PFU病毒(几乎MOI 0.0005)感染。对于分裂细胞加入补充有10%FCS、对于汇合细胞加入不补充的2mL培养基。感染后48小时收获细胞。将细胞在-20℃下储存,并进行超声,以释放病毒,病毒也通过斑块滴定在CEF细胞上加以量化。分裂细胞与汇合细胞中的复制之间的比例在所有细胞中是类似的。两种病毒VVTK-/FCU1、VVTK-I4L-/FCU1和VVTK-F4L-/FCU1在分裂细胞中比在汇合细胞中复制得更多。
作为检验复制病毒特异性的间接方式,测定分裂相比汇合的肿瘤细胞(人胰腺肿瘤PANC1;人肺肿瘤H1299;人胶质瘤肿瘤U118MG)中产生的病毒的收率。将汇合细胞以1x106细胞/孔平板铺平板,并在完全培养基中培养7天,然后在感染之前1天,将细胞洗涤,并在无血清培养基中培养。感染之前1天将分裂的细胞以3x105细胞/孔平板铺平板。为了评价细胞分裂的水平,在细胞铺平板之后5小时、24小时和48小时测量滴定的胸苷并入到核酸中的量。在该时间过程中,胸苷并入在汇合细胞中相对恒定,而在分裂细胞中随着时间观察到并入增加。然后将细胞用100pfu病毒感染,感染后48小时通过CEF上的斑块滴定测定分裂肿瘤细胞中和汇合肿瘤细胞中产生的病毒收率之间的比例。图9和图10中所示的结果说明,两种病毒VVTK-/FCU1、VVTK-I4L-/FCU1和VVTK-F4L-/FCU1均在分裂细胞中比在汇合细胞中复制得更多。而且,通过与VVTK-/FCU1比较,对于两种病毒VVTK-I4L-/FCU1和VVTK-F4L-/FCU1,图9和图10中所示的结果在所有不同类型的细胞中均表现出比例的增加。所有不同类型细胞中比例的增加是因为两种病毒VVTK-I4L-/FCU1和VVTK-F4L-/FCU1在汇合细胞中的复制较低。这些结果说明,与VVTK-/FCU1相比较,两种病毒VVTK-I4L-/FCU1和VVTK-F4L-/FCU1均表现出朝向分裂细胞的增加的特异性。
皮下肿瘤模型
雌性Swiss裸鼠获自Charles River Laboratories。研究中使用的动物年龄均一(6周),体重范围23-26g。Swiss裸鼠皮下(s.c.)注射5x106LoVo细胞至侧腹中。当肿瘤达到直径50-70mm3时,以盲模式将小鼠随机化,并用所示载体处理用于体内实验。
病毒的生物分布
通过肿瘤和器官样品中的病毒滴定评价多种病毒的存在。通过尾静脉注射将1x106PFU VV-FCU1或VVTK-I4L-/FCU1或VVTK-F4L-/FCU1静脉内(i.v.)注射到荷有建立的皮下LoVo肿瘤的裸鼠中。在所示的时间点将小鼠处死,收集肿瘤和其他器官并称重。将肿瘤和器官在PBS中均质化,如之前所述在CEF上测定滴度。将病毒滴度标准化至毫克组织。表2、表3、表4和表5中所示的结果(病毒滴度范围以pfu/mg组织表示)表明,14天之后,根据本发明的病毒主要在肿瘤中发现。图11和图12中所示的结果表明,两种病毒VVTK-/FCU1、VVTK-I4L-/FCU1和VVTK-F4L-/FCU1均靶向肿瘤,在肿瘤中的病毒大约比在其他分析的器官中多1 000至10 000倍,VVTK-/FCU1的情形中尾部除外。在第6天在肺、脾脏、肾脏和淋巴结中检测到少量VVTK-/FCU1(小于10pfu/mg),在皮肤、尾部和骨髓中更多,在第21天,在皮肤和尾部检测到。相反,VVTK-I4L-/FCU1和VVTK-F4L-/FCU1具有更高的肿瘤特异性,在第6天仅有少量在淋巴结和尾部,在第21天仅在肿瘤中。
表2
表3
表4
表5
本发明的痘病毒在皮下肿瘤模型中的抗肿瘤活性
将荷有建立的皮下LoVo肿瘤(50-70mm3)的裸鼠分别用所示载体以1.107PFU的剂量静脉内(通过尾静脉)处理一次。病毒注射之后第7天开始,通过口服喂食以100mg/kg(0.5ml 5-FC 0.5%水中)一天两次给予5-FC,给药3周。使用卡尺每周两次测量肿瘤大小。使用公式(p/6)(长度x宽度2)以mm3计算肿瘤体积。图5和图6中所示的结果表明,多种病毒具有能够控制肿瘤生长的溶瘤活性的相似的效力(p<0.05),并且给予5-FC的组合的活性(病毒的溶瘤和FCU1基因的治疗性)可以进一步提高肿瘤生长的控制(p<0.01)。
根据以下将荷有建立的皮下LoVo肿瘤(50-70mm3)的裸鼠也用1.107PFU剂量的所示载体静脉内(通过尾静脉)处理:用肿瘤(可触及肿瘤)接种之后11天,将小鼠通过以下处理:缓冲液+H2O,或者缓冲液+5-FC,或者注射一次107pfu VVTK-I4L-/FCU1+H2O,或者注射一次107pfu VVTK-I4L-/FCU1+5-FC(病毒注射之后7天给予5-FC,给药3周),或者注射两次(第11天和第33天)107pfu VVTK-I4L-/FCU1+H2O,或者注射两次(第11天和第33天)107pfu VVTK-I4L-/FCU1+5-FC(第18-32天和第40-54天给予5-FC)。一天两次将动物通过口服喂食用100mg/kg的5-FC处理。使用卡尺一周两次测量肿瘤大小。使用公式(p/6)(长度x宽度2)计算单位mm3的肿瘤体积。图7中所示的结果表明,注射一次或两次之后单独的病毒没有抗肿瘤活性。当与载体组以及单独的病毒(没有5-FC)直至第50天相比较时,加入5-FC处理表现出统计学上显著的肿瘤生长的抑制(p<0.05)。正如一次单次注射一样,与载体组和仅注射两次病毒(无5-FC)相比较,两次静脉内注射VVTK-I4L-/FCU1+5-FC表现出显著的抗肿瘤活性(p<0.05)。而且,在与5-FC治疗组合的一次和两次注射病毒之间观察到从第56天起病毒进化方面的显著差异(p<0.05)。
根据以下将荷有建立的皮下U87-MG(成胶质细胞瘤肿瘤细胞)的裸鼠用1.107PFU剂量的所示载体静脉内(通过尾静脉)处理:用肿瘤(可触及肿瘤)接种之后11天,将小鼠通过以下处理:缓冲液+H2O,或者缓冲液+5-FC,或者107pfu VVTK-I4L-/FCU1+H2O,或者107pfu VVTK-I4L-/FCU1+5-FC。病毒注射后7天在3周时间内,一天两次将动物通过口服喂食用100mg/kg的5-FC处理。使用卡尺一周两次测量肿瘤大小。使用公式(π/6)(长度x宽度2)计算单位mm3的肿瘤体积。图8所示结果表明了VVTK-I4L-/FCU1对U87-MG细胞的高溶瘤活性,其导致强抗肿瘤活性(p<0.0001)。通过口服喂食加入5-FC的组合的活性导致类似的活性(p<0.0001)。
病毒病原性
使用Swiss裸鼠(图13)和免疫活性B6D2小鼠(图14)上进行的存活研究对病毒致病性进行评价。将小鼠静脉内注射每小鼠100μL缓冲液中1.107或1.108PFU的全部VVTK-/FCU1和VVTK-I4L-/FCU1。整个实验进程中每天观察小鼠。在Swiss裸鼠(图13)中,注射1x108PFU VVTK-/FCU1导致注射后3天40%的动物死亡。其余小鼠在注射后50天和80天之间死亡。给予VVTK-I4L-/FCU1致病性较低,大多数动物在65-140天之间死亡(p<0.01)。107pfu下两种病毒均没有观察到毒性证据(图14(A))。静脉内注射108pfu VVTK-/FCU1之后所有小鼠均死亡(图14(B))。与VVTK-/FCU1感染的小鼠相比较VVTK-I4L-/FCU1处理组存活显著延长至70%(图14(B))。因此,该结果证明了双缺失病毒VVTK-I4L-/FCU1毒性的降低。
痘痕尾部损伤模型
将Swiss裸鼠静脉注射1.106(图15和16)或1.107(图17和18)PFU每种病毒。每周一次计算尾部损伤。与注射VVTK-/FCU1的小鼠在感染后第13天小鼠平均8个痘痕相比较,注射1.106PFU VVTK-I4L-/FCU1或VVTK-F4L-/FCU1的小鼠具有小于1痘痕/小鼠(p<0.001),如图15(A)和图16(A)所示。注射后第34天结果类似,与VVTK-I4L-/FCU1或VVTK-F4L-/FCU11几乎1个比较,VVTK-/FCU1平均4个痘痕(p<0.0001),如图15(B)和图16(B)所示。感染后第15天,与注射1.107PFU VVTK-/FCU1的小鼠平均10痘痕/小鼠相比较,注射1.107PFU VVTK-I4L-/FCU1或VVTK-F4L-/FCU1的小鼠分别平均3痘痕/小鼠和2痘痕/小鼠(图17(A)和图18(A))。感染后第31天,与注射VVTK-/FCU1的小鼠平均7痘痕/小鼠相比较,注射VVTK-I4L-/FCU1或VVTK-F4L-/FCU1的小鼠分别平均1.5痘痕/小鼠和2痘痕/小鼠(图17(B)和图18(B))。VVTK-/FCU1与VVTK-I4L-/FCU1和VVTK-F4L-/FCU1二者之间痘痕数的差异在统计学上是显著的(p<0.01)。痘痕形成与尾部的病毒复制有关,因此与毒力和毒性有关。静脉注射VVTK-I4L-/FCU1或VVTK-F4L-/FCU1毒性小于单缺失TK病毒。
VVTK-I4L-/FCU1和伊力替康的组合
VVTK-I4L-/FCU1治疗与伊力替康组合的治疗效果在存在和不存在5FC前药的情况下在人胰腺癌MiaPaca2细胞系(编号:CRL-1420TM)上在体内评价。更具体地,将裸鼠(n=12小鼠/组)皮下注射5x 106MiaPaca2细胞。当肿瘤具有100-200mm3时,在肿瘤植入后第24、28和30天静脉注射1x 106PFU VVTK-I4L-/FCU1。在第28、31、35、38、42、45天静脉给予33mg/kg/天伊力替康。从肿瘤植入后第31天起,每天两次通过口服喂食给予100mg/kg的5-FC 3周。使用卡尺测量肿瘤大小。使用公式(π/6)(长度x宽度2)以mm3为单位计算肿瘤体积。当肿瘤大小超过体积4000mm3时,将小鼠处死。使用Mann-Whitney U-检验确定各组之间的肿瘤体积差异。P值<0.05视作具有显著性。
在肿瘤植入日后73天时间内全身注射VVTK-I4L-/FCU1+/-5-FC和伊力替康之后,定期(每4-6天)测量人胰腺MiaPaca2植入肿瘤的肿瘤体积。表6提供了植入后第24、39、50、59、63和73天多个小鼠组中测得的以mm3为单位的平均肿瘤体积。“iri”表示伊力替康,“VV”表示VVTK-I4L-/FCU1。
表6
当肿瘤体积>4000mm3时将小鼠安乐死。
在MiaPaca2模型中,就肿瘤生长而言,对照(未处理)组和单独5-FC组之间没有差异。在有或没有5-FC的情况下给予VVTK-I4L-/FCU1导致轻微的抗肿瘤效果。与无处理相比较,在有或没有5-FC的情况下给予伊力替康表现出显著的肿瘤生长控制。就肿瘤生长控制而言,在给予或不给予5-FC的情况下VVTK-I4L-/FCU1与伊力替康组合观察到最大的益处。
总之,与其他组相比较,使用VVTK-I4L-/FCU1与伊力替康的组合(有或没有5-FC)治疗导致肿瘤生长的显著抑制。
VVTK-I4L-/FCU1与草酸铂的组合
VVTK-I4L-/FCU1治疗与草酸铂组合的治疗效果在存在和不存在5FC前药的情况下在结肠直肠癌LoVo细胞系上进行体内评价。5FU也在这些条件下测试。
更具体地,将裸鼠(n=11小鼠/组)皮下注射5x 106LoVo细胞。当肿瘤具有100-200mm3时,在肿瘤植入后第21天静脉注射1x 107PFU VVTK-I4L-/FCU1。在第24、27、31、3/4、38、41天腹膜内给予2.5mg/kg/天草酸铂。从肿瘤植入后第28天起,每天两次通过口服喂食给予100mg/kg 5-FC 3周。从肿瘤植入后第23天起,腹膜内给予200mg/kg/天5-FC 3周。使用卡尺测量肿瘤大小。使用公式(π/6)(长度x宽度2)以mm3为单位计算肿瘤体积。当肿瘤大小超过体积4000mm3时,将小鼠处死。使用Mann-Whitney U-检验确定各组之间的肿瘤体积差异。P值<0.05视作具有显著性。
在肿瘤植入日后52天的时间内全身注射VVTK-I4L-/FCU1+/-5-FC和草酸铂之后定期(每4-6天)测量人结肠直肠LoVo植入肿瘤的肿瘤体积。表7提供了植入后第19、25、32、46、49和52天多个小鼠组中测量的以mm3为单位的肿瘤体积平均值。“oxa”表示草酸铂,“VV”表示VVTK-I4L-/FCU1。
表7
在LoVo模型中,就肿瘤生长而言,与对照(未处理)小鼠相比较,用单独的草酸铂、单独的5-FC、草酸铂+5-FC、单独的5-FU、草酸铂+5-FU或者单独的VVTK-I4L-/FCU1处理提供轻微的肿瘤生长控制。与无处理相比较,VVTK-I4L-/FCU1+草酸铂或VVTK-I4L-/FCU1+5-FC导致显著的肿瘤生长控制。就肿瘤生长控制而言,VVTK-I4L-/FCU1+5-FC+草酸铂组合观察到最大的益处。与无处理、单独草酸铂、单独的5-FC、草酸铂+5-FC、单独的VVTK-I4L-/FCU1、VVTK-I4L-/FCU1+草酸铂或者VVTK-I4L-/FCU1+5-FC相比较,用该组合处理导致显著的肿瘤生长抑制。而且,与单独的化疗药物5-FU或者与草酸铂组合(5-FU以最大耐受浓度腹膜内给予)相比较,用VVTK-I4L-/FCU1+5-FC+草酸铂组合处理导致显著的抗肿瘤效果。
总之,与VVTK-I4L-/FCU1和草酸铂中的每一个以及与标准抗肿瘤药物5FU相比较,在5-FC的存在下用VVTK-I4L-/FCU1和草酸铂的组合处理显著证明提供增强的抗肿瘤效果。
统计学分析
统计学分析使用非参数Mann-Whitney U检验和STATISTICA 7.1软件(StatSoft,Inc.)进行。P<0.05视作在统计学上具有显著性。
参考文献
US 5364773(VIROGENETICS CORPORATION(TROY,NY))15.11.1994
WO 2004/014314(KIRN DAVID(US))19.02.2004
WO 2004/014314(KIRN DAVID(US))19.02.2004
US 5364773(VIROGENETICS CORPORATION(TROY,NY))15.11.1994
WO 93/01281(US HEALTH)
WO 2005/007857
WO 2005/007857
EP 0998568 A
EP 0998568 A
EP 0998568 A
EP 0998568 A
WO 96/16183
EP 0998568 A
EP 0998568 A
WO 2006/048768
HERMISTON.A demand for next-generation oncolytic adenoviruses.Current opinion in molecular therapeutics.2006,第8卷,no.4,第322-30页.
FISHER.Striking out at disseminated metastases:the systemic delivery of oncolytic viruses.Current opinion in molecular therapeutics.2006,第8卷,no.4,第301-13页.
CHERNAJOVSKY等人.Fighting cancer with oncolytic viruses.British medical journal.2006,第332卷,no.7534,第170-2页.
JIANG等人.Oncolytic adenoviruses as antiglioma agents.Expert review of anticancer therapy.2006,第6卷,no.5,第697-708页.
COHEN等人.ONYX-015.Onyx Pharmaceuticals.Current opinion in investigational drugs.2001,第2卷,no.12,第1770-5页.
ROBERTS等人.Naturally oncolytic viruses.Current opinion in molecular therapeutics.2006,第8卷,no.4,第314-21页.
THORNE等人.Vaccinia virus and oncolytic virotherapy of cancer.Current opinion in molecular therapeutics.2005,第7卷,no.4,第359-65页.
STANFORD等人.Myxoma virus and oncolytic virotherapy:a new biologic weapon in the war against cancer.Expert opinion on biological therapy.2007,第7卷,no.9,第1415-25页.
CONO等人.Smallpox vaccination and adverse reactions.Guidance for clinicians.MMWR.Recommendations and reports:Morbidity and mortality weekly report.Recommendations and reports/Centers for Disease Control.2003,第52卷,no.RR-4,第1-28页.
XIANGZHI等人.Vaccinia virus K1L protein supports viral replication in human and rabbit cells through a cell-type-specific set of its ankyrin repeat residues that are distinct from its binding site for ACAP2.Journal of virology.2006,第353卷,no.1,第220-233页.
MCCART等人.Systemic cancer therapy with a tumor selective vaccinia virus mutant lacking thymidine kinase and vaccinia growth factor genes..Cancer res..2001,no.61,第8751-57页.
KIM等人.Systemic armed oncolytic ans immunologic therapy for cancer with JX-594,a targeted poxvirus expressing GM-CSF.Molecular Therapeutic.2006,no.14,第361-70页.
SLABAUGH等人.Journal of virology.1988,第62卷,第519-27页.
TENGELSEN等人.Virology.1988,no.164,p.121-31.
SCHMITT等人.Journal of virology.1988,no.62,第1889-97页.
SLABAUGH等人.Journal of virology.1984,no.52,第507-14页.
SLABAUGH等人.Journal of virology.1984,no.52,第501-6页.
HOWELL等人.Journal of Biological Chemistry.1992,no.267,第1705-11页.
ANTOINE..Virology.1998,no.244,第365-396页.
EL OMARI等人.Structure of vaccinia virus thymidine kinase in complex with dTTP:insights for drug design.BMC structural biology.2006,no.6,第22页.
MCCART等人.Systemic cancer therapy with a tumor-selective vaccinia virus mutant lacking thymidine kinase and vaccinia growth factor genes.cancer research.2001,第61卷,no.24,第8751-7页.
PUHLMANN等人.Vaccinia as a vector for tumor-directed gene therapy:biodistribution of a thymidine kinase-deleted mutant.Cancer gene therapy.2000,第7卷,no.1,第66-73页.
GNANT等人.Systemic administration of a recombinant vaccinia virus expressing the cytosine deaminase gene and subsequent treatment with 5-fluorocytosine leads to tumor-specific gene expression and prolongation of survival in mice.Cancer Research.1999,第59卷,no.14,第3396-403页.
MCGEOGH..Nucleic Acids Research.1990,no.18,第4105-10页.
BROYLES..Virology.1993,no.195,第863-5页.
JUND等人.Journal of Bacteriology.1970,no.102,第607-15页.
BECK等人.Journal of Bacteriology.1972,no.110,第219-28页.
HOEPRICH等人.Journal of Infectious Diseases.1974,no.130,第112-18页.
ESDERS等人.J.biol.chem..1985,no.260,第3915-22页.
KOECHLIN等人.Biochemical pharmacology.1966,no.15,第435-46页.
POLAK等人.Chemotherapy.1976,no.22,第137-53页.
JUND等人.Journal of Bacteriology.1970,no.102,第607-15页.
KILLSTRUP等人.Journal of Bacteriology.1989,no.171,第2124-2127页.
HUBER等人.Cancer Research.1993,no.53,第4619-4626页.
MULLEN等人.Proceedings of the National Academy of Sciences of the United States of America.1992,no.89,第33-37页.
HUBER等人.Proceedings of the National Academy of Sciences of the United States of America.1994,no.91,第8302-6页.
MESNIL等人.Proceedings of the National Academy of Sciences of the United States of America.1996,no.93,第1831-35页.
ANDERSEN等人.Characterization of the upp gene encoding uracil phosphoribosyltransferase of Escherichia coli K12.European Journal of Biochemistry.1992,no.204,第51-56页.
MARTINUSSEN等人.Cloning and characterization of upp,a gene encoding uracil phosphoribosyltransferase from Lactococcus lactis.Journal of Bacteriology.1994,vol.176,no.21,第6457-63页.
KIM等人.Complete sequence of the UPP gene encoding uracil phosphoribosyltransferase from Mycobacterium bovis BCG.Biochemistry and molecular biology international.1997,vol.41,no.6,第1117-24页.
MARTINUSSEN等人.Two genes encoding uracil phosphoribosyltransferase are present in Bacillus subtilis.Journal of Bacteriology.1995,vol.177,no.1,第271-4页.
KERN等人.The FUR1gene of Saccharomyces cerevisiae:cloning,structure and expression of wild-type and mutant alleles.Gene.1990,vol.88,no.2,第149-57页.
CHAKRABARTI..Biotechniques.1997,no.23,第1094-97页.
HAMMOND等人.Journal of Virological Methods.1997,no.66,第135-38页.
KUMAR..Virology.1990,no.179,第151-8页.
权利要求书(按照条约第19条的修改)
1.组合物,其包含溶瘤痘病毒,所述溶瘤痘病毒包含缺陷性I4L和/或F4L基因并且还包含自杀基因,用于与在抗癌治疗中有效的一种或多种物质组合治疗癌症,其中在抗癌治疗中有效的一种或多种物质选自伊力替康和草酸铂。
2.根据权利要求1的用于治疗癌症的组合物,其中所述痘病毒还包含缺陷性J2R基因。
3.根据权利要求1或2的用于治疗癌症的组合物,其中所述痘病毒是牛痘病毒哥本哈根株。
4.根据权利要求1至3中任一项的用于治疗癌症的组合物,其中所述组合物和所述一种或多种物质经由全身路径给药或者给药至肿瘤中,优选静脉内给药。
5.根据权利要求1至4中任一项的用于治疗癌症的组合物,其中伊力替康的剂量包括从5至100mg/kg/天,并且痘病毒的剂量包括从1x106至1x109pfu。
6.根据权利要求5的用于治疗癌症的组合物,其中静脉注射所述痘病毒1至3次,并且在所述痘病毒的首次给药之后3至10天注射伊力替康。
7.根据权利要求1至4中任一项的用于治疗癌症的组合物,其中草酸铂静脉内或腹膜内给药,并且痘病毒静脉内给药。
8.根据权利要求7的用于治疗癌症的组合物,其中草酸铂的剂量包括从0.5至10mg/kg/天,并且痘病毒的剂量包括从1x106至1x109pfu。
9.根据权利要求7或8的用于治疗癌症的组合物,其中所述痘病毒静脉内注射1至3次,并且草酸铂每2周对于1个或多个循环。
10.根据权利要求9的用于治疗癌症的组合物,其中在所述痘病毒组合物的首次给药之后3至10天给药所述草酸铂。
11.根据权利要求1至10中任一项的用于治疗癌症的组合物,其中所述自杀基因编码蛋白质,所述蛋白质具有至少一种胞嘧啶脱氨酶和一种尿嘧啶磷酸核糖转移酶活性。
12.根据权利要求1至10中任一项的用于治疗癌症的组合物,其中自杀基因编码包含基本上如序列标识符SEQ ID NO:1或SEQ ID NO:3中的序列所表示的氨基酸序列的多肽。
13.根据权利要求11或12的用于治疗癌症的组合物,其中所述使用还包括可药用量的前药。
14.根据权利要求13的用于治疗癌症的组合物,其中所述前药是5-氟胞嘧啶。
15.根据权利要求14的用于治疗癌症的组合物,其中在所述痘病毒组合物给药之后优选至少3天,更优选至少4天,和再更优选至少5天给药所述前药。
16.根据权利要求1至15中任一项的用于治疗癌症的组合物,其中所述癌症选自乳腺癌、子宫癌、前列腺癌、肺癌、膀胱癌、肝癌、结肠癌、胰腺癌、胃癌、食道癌、喉癌、中枢神经系统癌症(例如成胶质细胞瘤)和血癌,优选胰腺癌和结肠直肠癌。
- 还没有人留言评论。精彩留言会获得点赞!