一种恩诺沙星纳米混悬液及其制备方法与流程
本发明属于兽用制剂领域,具体涉及一种恩诺沙星纳米混悬液及其制备方法。
背景技术:
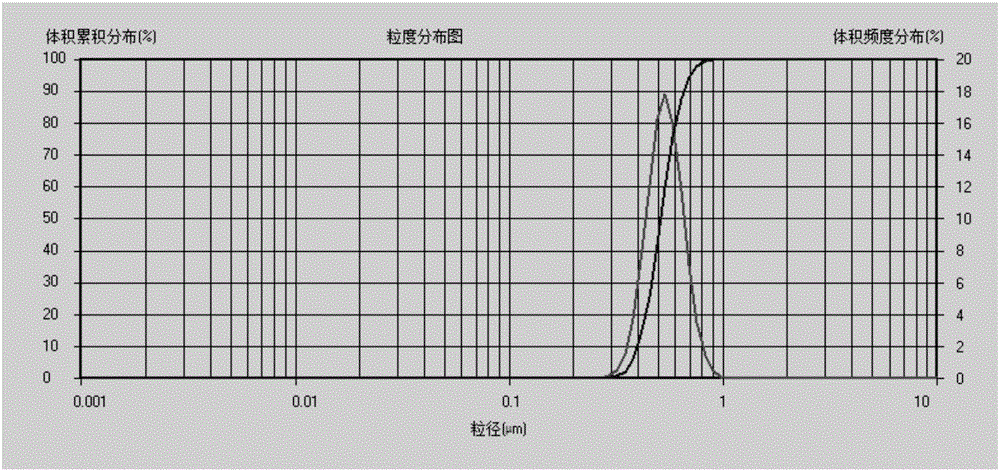
:恩诺沙星(Enrofloxacin,ENR)又名乙基环丙沙星,是动物专用的第三代喹诺酮类抗菌药,其作用机理是通过抑制细菌DNA螺旋酶达到抗菌效果,在动物体内的代谢主要是脱去乙基而成为环丙沙星。恩诺沙星为光谱杀菌药,对支原体、大肠杆菌、克雷白杆菌、沙门氏菌、变形杆菌、绿脓杆菌、嗜血杆菌、多杀性巴氏杆菌、溶血性巴氏杆菌、金葡萄球菌、链球菌等都具有杀菌作用,具有杀菌谱广,体内分布广,与其他药物无交叉耐药等优点,兽医临床上主要用于防治动物细菌感染和支原体感染性疾病。由于恩诺沙星水溶性差、味苦、刺激性大、易分解,所以大大限制了在兽医临床上的应用,目前,常用的恩诺沙星制剂主要有乳剂、固体颗粒剂和注射剂等,而普通注射剂的半衰期短,体内消除迅速,需要多次给药,费时费力;乳剂药物含量低,需要大量多次给药;固体颗粒剂的生物利用度低,不利于大规模给药。技术实现要素:为了克服现有技术的不足,本发明的目的在于提供一种恩诺沙星纳米混悬液,该恩诺沙星纳米混悬液药物浓度高、吸收好、作用时间长、稳定性好,还能提高其生物利用度。本发明的另一目的在于提供一种恩诺沙星纳米混悬液的制备方法。实现本发明的目的可以通过采取如下技术方案达到:一种恩诺沙星纳米混悬液,其是由恩诺沙星和稳定剂制备而成,所述恩诺沙星与稳定剂的质量比为1:(0.1~10);所述稳定剂为吐温80、大豆卵磷脂、聚乙烯吡咯烷酮K30、泊洛沙姆188、泊洛沙姆407、羟丙基甲基纤维素、脱氧胆酸钠、羟基乙基淀粉钠、单硬脂酸甘油酯、聚乙二醇400、辛酸癸酸聚乙二醇甘油酯(Labrasol)、月桂酸聚乙二醇甘油酯(Gelucire44/14)、辛酸癸酸甘油酯(Glyceride)中的一种或几种。优选地,所述稳定剂为辛酸癸酸聚乙二醇甘油酯与大豆卵磷脂的混合物,辛酸癸酸聚乙二醇甘油酯与大豆卵磷脂的质量比为1:(0.1~20)。优选地,所述稳定剂为泊洛沙姆188与月桂酸聚乙二醇甘油酯的混合物,泊洛沙姆188与月桂酸聚乙二醇甘油酯的质量比为1:(0.1~20)。优选地,所述恩诺沙星纳米混悬液的粒径为200~1000nm。优选地,所述恩诺沙星纳米混悬液的粒径为300~800nm。一种恩诺沙星纳米混悬液的制备方法,包括以下步骤:1)将恩诺沙星溶解在pH=7~9的碱性溶液中,得到良溶剂;2)将稳定剂溶解在pH=1~4的酸性溶液中,得到不良溶剂;3)将步骤1)得到的良溶剂加入步骤2)得到的不良溶剂中,低温下搅拌分散,形成初纳米混悬液;4)将初纳米混悬液置于高压均质机中,制得恩诺沙星纳米混悬液。优选地,所述步骤1)中的碱性溶液为氢氧化钠水溶液、氢氧化钾、磷酸盐缓冲液中的一种。优选地,所述步骤2)中的酸性溶液为盐酸水溶液、乙酸水溶液、乳酸水溶液、磷酸水溶液中的一种。优选地,所述步骤3)具体为:将步骤1)得到的良溶剂以0.1~20mL/min的流速加入步骤2)得到的不良溶剂中,控制温度在0~15℃,20~150KHz超声分散或搅拌分散,控制搅拌速度为100~3000r/min,加入完毕,继续搅拌15min~2h,形成初纳米混悬液。优选地,所述步骤4)具体为:将初纳米混悬液置于高压均质机中,控制压力300~1200bar,循环次数为2~13次,制得恩诺沙星纳米混悬液。本发明的有益效果在于:1、本发明的恩诺沙星纳米混悬液药物浓度高、吸收好、作用时间长、稳定性好,还能提高其生物利用度;2、本发明的恩诺沙星纳米混悬液中,卵磷脂等非离子表面活性剂,可在纳米粒子表面吸附形成保护层能有效屏蔽粒子间的范德瓦尔斯作用,而作为空间稳定剂,空间稳定剂为大豆卵磷脂、吐温80、聚乙烯吡咯烷酮K30、泊洛沙姆188、泊洛沙姆407、羟丙基甲基纤维素、单硬脂酸甘油酯、聚乙二醇400、Labrasol、Gelucire44/14、Glyceride中的任意一种或几种;脱氧胆酸钠等阴离子表面活性剂作为电荷稳定剂,可在纳米粒子间形成双电层,电荷稳定剂为脱氧胆酸钠、羟基乙基淀粉钠;两种稳定剂联合使用,制备的纳米混悬液,药物粒径较小,粒径范围优选在300~800nm,稳定时间更长;3、本发明的恩诺沙星纳米混悬液是以少量表面活性剂或其它材料为助剂将纯药物粒子稳定在水中,所形成的一种纳米胶体分散体;作为一种中间剂型,纳米混悬液可以进一步制备为适合口服、注射或其他给药途径的药物剂型,从而提高药物的吸收和生物利用度;纳米混悬液处方中不含载体和共溶剂,注射给药的毒副作用很低;由于纳米混悬液具有提高药物溶解度和溶出速率、良好的黏膜组织粘附性、增加药物有效性和安全性等优点,其在各种给药途径中都体现出独特的优势,如生物利用高,疗效是常规剂型的几倍,因此减少了给药次数、降低了用药成本;4、本发明的恩诺沙星纳米混悬液,可以提高恩诺沙星的溶解度、口服生物利用度;这是因为纳米混悬液中药物颗粒粒径小,比表面积大,肠胃道生物膜有很强的黏附性,不易被清除,从而延长了恩诺沙星在肠胃中的滞留时间和吸收时间,增大了生物利用度;纳米混悬液中的表面活性剂和高分子聚合物对药物颗粒的保护作用,及纳米尺寸的恩诺沙星晶体提高了制剂的化学稳定性;5、本发明的恩诺沙星纳米混悬液可直接制成口服混悬液、注射混悬液,也可通过高速离心、冻干干燥或喷雾干燥进行固化,用于多种制剂形式如预混剂、颗粒剂等;6、本发明的制备方法将恩诺沙星溶解在pH=7~9的碱性溶液作为良溶剂,含有稳定剂的pH=1~4酸性溶液为不良溶剂,然后将良溶剂加入到不良溶剂中,利用恩诺沙星在良溶剂和不良溶剂中的溶解度差异,形成过饱和溶液而析出结晶,在稳定剂、特定温度和搅拌速度等条件作用下,控制恩诺沙星结晶的粒径在纳米尺寸。附图说明图1为实施例1的恩诺沙星纳米混悬液的透射电镜图片。图2为实施例1的恩诺沙星纳米混悬液的粒径分布图。图3为实施例1的恩诺沙星纳米混悬液的Zeta电位分析图。具体实施方式下面,结合附图以及具体实施方式,对本发明做进一步描述:实施例1:一种恩诺沙星纳米混悬液,该恩诺沙星纳米混悬液的制备方法包括如下步骤:1)称取恩诺沙星原料药4.2g、羟基乙基淀粉钠0.1g溶于25mL的氢氧化钠溶液(pH=8.1)中,形成良溶剂A;2)称取0.65g泊洛沙姆188、0.56gGelucire44/14、0.50g聚乙二醇400溶于75mL盐酸水溶液中(pH=2.5),形成不良溶剂B;3)控制温度在10℃下,将上述良溶剂A以5mL/min的滴速滴入不良溶剂B中,同时控制超声频率为45KHz,以超声搅拌分散,滴加完毕,继续超声分散0.5h,形成有蓝色乳光的初纳米混悬液;4)将所得初纳米混悬液至于高压均质机中,在800bar压力下,循环5次,制得恩诺沙星纳米混悬液。用激光纳米粒度仪检测恩诺沙星纳米混悬液,检测出平均粒径为436.7nm,多分散指数为0.39。图1为本实施例的透射电镜图片,图2为本实施例的恩诺沙星纳米混悬液的粒径分布图,图3为本实施例的恩诺沙星纳米混悬液的Zeta电位分析图。实施例2一种恩诺沙星纳米混悬液,该恩诺沙星纳米混悬液的制备方法包括如下步骤:1)称取恩诺沙星原料药4.5g、羟基乙基淀粉钠0.1g,溶于25mL的氢氧化钠溶液(pH=8.2)形成良溶剂A;2)称取0.85g大豆卵磷脂、0.60gLabrasol,溶于75mL磷酸水溶液中(pH=2.1),形成不良溶剂B;3)控制温度在8℃下,将上述良溶剂A以2.5mL/min的滴速滴入不良溶剂B中,同时控制超声频率为45KHz,以超声搅拌分散,滴加完毕,继续超声分散15min,形成有蓝色乳光的初纳米混悬液;4)将所得初纳米混悬液至于高压均质机中,在500bar压力下,循环10次,制得恩诺沙星纳米混悬液;用激光纳米粒度仪检测恩诺沙星纳米混悬液,检测出平均粒径为611.3nm,多分散指数为0.57。实施例3一种恩诺沙星纳米混悬液,该恩诺沙星纳米混悬液的制备方法包括如下步骤:1)称取恩诺沙星原料药4.05g、羟基乙基淀粉钠0.15g溶于25mL的磷酸缓冲液(pH=8.5)中,形成良溶剂A;2)称取0.82g的Labrasol、0.49g聚乙二醇400溶于75mL磷酸水溶液中(pH=2.8)形成不良溶剂B;3)控制温度在2℃下,将上述良溶剂A以10mL/min的滴速滴入不良溶剂B中,同时控制搅拌速度为200r/min,以高剪切乳化机搅拌分散,滴加完毕,继续搅拌2h,形成初纳米混悬液;4)将所得初纳米混悬液至于高压均质机中,在1000bar压力下,循环4次,制得恩诺沙星纳米混悬液;用激光纳米粒度仪检测恩诺沙星纳米混悬液,检测出平均粒径为601.4nm,多分散指数为0.27。实施例4一种恩诺沙星纳米混悬液,该恩诺沙星纳米混悬液的制备方法包括如下步骤:1)称取恩诺沙星原料药4.15g、脱氧胆酸钠0.2g溶于25mL的氢氧化钾溶液(pH=8.1)形成良溶剂A;2)称取大豆卵磷脂0.85g、羟丙基甲基纤维素0.48g溶于75mL乙酸水溶液中(pH=1.8)形成不良溶剂B;3)控制温度在12℃下,将上述良溶剂A以2.5mL/min的滴速滴入不良溶剂B中,同时控制搅拌速度为1000r/min,以高剪切乳化机搅拌分散,滴加完毕,继续搅拌1h,形成初纳米混悬液;4)将所得初纳米混悬液至于高压均质机中,在400bar压力下,循环11次,制得恩诺沙星纳米混悬液。用激光纳米粒度仪检测恩诺沙星纳米混悬液,检测出平均粒径为647.2nm,多分散指数为0.45。实施例51)称取恩诺沙星原料药4.4g、脱氧胆酸钠0.15g溶于25mL的氢氧化钠溶液(pH=8.6),形成良溶剂A;2)称取0.8g吐温80、Gelucire44/140.65g溶于75mL乳酸水溶液中(pH=1.7)形成不良溶剂B;3)控制温度在15℃下,将上述良溶剂A以10mL/min的滴速滴入不良溶剂B中,同时以高剪切乳化机搅拌分散,控制搅拌速度为3000r/min,滴加完毕,继续搅拌1.5h,形成初纳米混悬液;4)将所得初纳米混悬液至于高压均质机中,在800bar压力下,循环2次,制得恩诺沙星纳米混悬液。用激光纳米粒度仪检测恩诺沙星纳米混悬液,检测出平均粒径为514.8nm,多分散指数为0.38。实施例6本发明制得的恩诺沙星纳米混悬液的性能效果测试:以恩诺沙星注射液为对照组进行动物体内药动学实验,考察实施例1制得的恩诺沙星纳米混悬液在动物体内的吸收和生物利用度。方法是将体重18±2kg的健康仔猪6头,随机分为两组,分别肌肉注射2.5%恩诺沙星注射液和恩诺沙星纳米混悬液,给药剂量均为2.5mg/kg.b.w,猪只仰卧保定,定期从前腔静脉采血。采用高效液相色谱法测定恩诺沙星的血药浓度,计算药动学参数,结果如表1所示:表1恩诺沙星动物药动学实验结果Cmax(mg/L)Tmax(h)AUC(mg/L·h)F(%)恩诺沙星注射液0.26±0.033.17±1.573.50±0.81实施例10.25±0.114.3±2.564.28±0.83122.4%结果表明,与注射液相比,恩诺沙星纳米混悬液的最大血药浓度(Cmax)相当,达峰时间(Tmax)延长,药时曲线下面积(AUC)显著增加,生物利用度(F)显著提高。实施例7取实施例1-5中任一制得的恩诺沙星纳米混悬液,加入葡萄糖3%(重量比),微粉硅胶5%(重量比),混合均匀后喷雾干燥得白色或淡黄色粉末,或加入甘露糖3%(重量比),混合均匀后冷冻干燥得淡黄色粉末;取上述粉末适量,与其他辅料淀粉、羧甲基纤维素钠、微晶纤维素、硬脂酸镁充分混合,湿法制粒,得到符合要求的恩诺沙星预混剂。实施例8取实施例1-5中任一制得的恩诺沙星纳米混悬液,按比例加入0.5%羧甲基纤维素钠和0.25%苯甲酸钠,混合后,高压灭菌,按每支4g恩诺沙星的规格分装,得到符合要求的恩诺沙星注射混悬液。对于本领域的技术人员来说,可根据以上描述的技术方案以及构思,做出其它各种相应的改变以及变形,而所有的这些改变以及变形都应该属于本发明权利要求的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1