羧甲基壳聚糖‑大黄酸偶联物及其合成工艺的制作方法
本发明涉及一种羧甲基壳聚糖-大黄酸偶联物,以及该羧甲基壳聚糖-大黄酸偶联物的合成工艺。
背景技术:
紫杉醇(Paclitaxel,PTX)是从中药红豆杉中提取分离得到的二萜类化合物,其独特的微管解聚抑制作用机制使其成为过去数十年里发现的最好的抗癌药物之一。由于紫杉醇在水中溶解度极低(<6μg·mL-1),现用于临床的紫杉醇制剂多用聚氧乙烯蓖麻油(Cremophor EL)-乙醇(1∶1)配制的注射剂,临用前稀释使用(久置紫杉醇会沉淀析出),应用极不方便,且所采用的增溶辅料聚氧乙烯蓖麻油不仅易产生神经毒性、肾毒性、心脏毒性等不良反应,而且在给药过程中能溶解输液管中的增塑剂,易产生过敏反应,大大限制了其临床应用。并且长期应用后,显示药物耐受,最终导致治疗失败。
由于紫杉醇在胃肠道中溶解性差、渗透性差,肝脏首过效应以及肠道内大量P-gp的外排作用,所以口服生物利用度低(<10%),口服给药存在严重问题。近年来,国内外许多研究者利用新剂型和新技术来解决这个问题,如前药,脂质体,纳米乳,胶束,纳米粒等,取得了一定的效果,但大多处于研究阶段,也仍然存在一些缺陷,例如,脂质体载药量偏低,稳定性稍差;纳米乳属热力学不稳定系统,并需用大量的表面活性剂和助表面活性剂;一些纳米粒制备复杂,除递送药物外功能性较差。相比较而言,聚合物胶束载药量大,能在水及水性溶液中自组装等优势成为解决难溶性药物用药缺陷的有效的解决办法。
高分子聚合物是近年来新剂型的重要辅料之一。两亲性高分子聚合物在水性溶液中能够自组装成纳米级壳-核结构的聚合物胶束(Polymeric Micelles)。其疏水内核可作为难溶性药物的储库,增溶并缓释药物;其亲水性外壳决定胶束在水溶液中的稳定性,并能保护药物在胃肠道复杂环境中免受胃酸、酶类等的破坏,减少药物对胃肠道的刺激性;其纳米级粒径使其易于被吸收,能够躲避网状内皮系统的识别与吞噬,易实现长循环,并可通过EPR效应被动靶向肿瘤。近年来,国内外多种高分子聚合物被研发用于口服给药系统。
在新型高分子聚合物材料的研发过程中,壳聚糖成为研究者关注的目标之一。壳聚糖(Chitosan)是一种含氨基的天然多糖,化学名为β-(1,4)-2-氨基-2-脱氧-D-葡聚糖,无毒、来源丰富、生物相容性和生物可降解性良好,在医学领域有着极广阔的应用前景。壳聚糖及其水溶性衍生物羧甲基壳聚糖具有黏膜黏附性,能通过调节肠道上皮细胞的紧密连接,对药物透过肠壁有很强的促进作用。多种两亲性壳聚糖衍生物,能促进药物口服吸收,提高疗效并降低毒副作用。
大黄酸(Rhein)是中药芦荟、大黄等的主要有效成分,属1,8-二羟基蒽醌衍生物,溶于碱液,不溶于水及很多有机溶剂。药理学研究证明,大黄酸能通过抗血管生成、影响线粒体、调控细胞周期素等机理抗癌,并能逆转肿瘤细胞的多药耐药,其作用机制可能与下调P-gp及MRP-1蛋白表达有关。大黄酸能保护肠粘膜。水溶性赖氨大黄酸抗肺癌并增强紫杉醇对肺癌细胞的杀伤和诱导凋亡,减少毒副作用。
技术实现要素:
本发明要解决的技术问题之一,在于提供一种羧甲基壳聚糖-大黄酸偶联物的合成工艺。
本发明是这样实现的:一种羧甲基壳聚糖-大黄酸偶联物的合成工艺,包括以下步骤:
(1)称取羧甲基壳聚糖于反应瓶中,加入10mL蒸馏水溶胀30min;取大黄酸粉末于广口瓶中,加入10mL 1%NaHCO3溶液,加热使大黄酸完全溶解,冷却至室温,加入EDC·HCl,活化20min,再加入NHS;然后边搅拌边将混合液加入到羧甲基壳聚糖溶液中,避光搅拌反应24h;其中,各物质的摩尔比为羧甲基壳聚糖:大黄酸:EDC·HCl:NHS=1:1:3:1;
(2)用95%乙醇沉淀反应液,静置后抽滤,并用95%乙醇洗涤沉淀物至洗涤液无色;将抽干后的沉淀物溶解于水中,冰水浴条件下探头超声20min后,3000rpm离心10min,取上清液过0.8μm的滤膜,取滤液置于透析袋中透析72h;
(3)透析结束后,将所述滤液再置于冰水浴中探头超声20min后,3000rpm离心10min,取上清液过0.8μm的滤膜,滤液冷冻干燥,即得羧甲基壳聚糖-大黄酸偶联物。
本发明要解决的技术问题之二,在于提供一种羧甲基壳聚糖-大黄酸偶联物。
本发明是这样实现的:一种所述的羧甲基壳聚糖-大黄酸偶联物,所述羧甲基壳聚糖-大黄酸偶联物的结构式如下:
n=361~459。
本发明的优点在于:反应条件温和;所用溶剂毒性小,有机溶剂仅用乙醇;操作简单易行,无须使用大型仪器,也无需控制反应温度及气体保护。
附图说明
下面参照附图结合实施例对本发明作进一步的说明。
图1是本发明中各紫杉醇制剂在肠道中的吸收速度常数示意图。
图2是本发明中各紫杉醇制剂在肠道中的表观渗透系数示意图。
图3是本发明中口服给予各紫杉醇制剂的血药浓度-时间曲线图。
图4是本发明中给予各紫杉醇制剂后荷瘤小鼠的肿瘤体积变化曲线图。
图5是本发明中给予各制剂后荷瘤小鼠的体重变化曲线图。
具体实施方式
一种羧甲基壳聚糖-大黄酸偶联物的合成工艺,包括以下步骤:
(1)称取羧甲基壳聚糖(CMCS)于反应瓶中,加入10mL蒸馏水溶胀30min;取大黄酸粉末于广口瓶中,加入10mL 1%NaHCO3溶液,加热使大黄酸完全溶解,冷却至室温,加入EDC·HCl(1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐),活化20min,再加入NHS(N-羟基琥珀酰亚胺);然后边搅拌边将混合液加入到羧甲基壳聚糖溶液中,避光搅拌反应24h;其中,各物质的摩尔比为羧甲基壳聚糖:大黄酸:EDC·HCl:NHS=1:1:3:1;大黄酸在加热下可溶解在1%的NaHCO3溶液中,且冷却至室温后也不会有沉淀析出。
(2)用95%乙醇沉淀反应液,静置后抽滤,并用95%乙醇洗涤沉淀物至洗涤液无色;将抽干后的沉淀物溶解于水中,冰水浴条件下探头超声20min后,3000rpm离心10min,取上清液过0.8μm的滤膜,取滤液置于透析袋(MWCO14000)中透析72h。
(3)透析结束后,将所述滤液再置于冰水浴中探头超声20min后,3000rpm离心10min,取上清液过0.8μm的滤膜,滤液冷冻干燥,即得羧甲基壳聚糖-大黄酸(CR)偶联物。
所述羧甲基壳聚糖-大黄酸偶联物的结构式如下:
n=361~459。
羧甲基壳聚糖(Carboxymethyl Chitosan,CMCS)和大黄酸(Rhein,Rh),两个部分以酰胺键连接,合成路线如下:
将本发明制得的羧甲基壳聚糖-大黄酸偶联物(羧甲基壳聚糖-大黄酸偶联物在下文简称为CR偶联物)进行促吸收及辅助抗肿瘤效果实验,实验结果如下:
(1)在体肠吸收实验结果
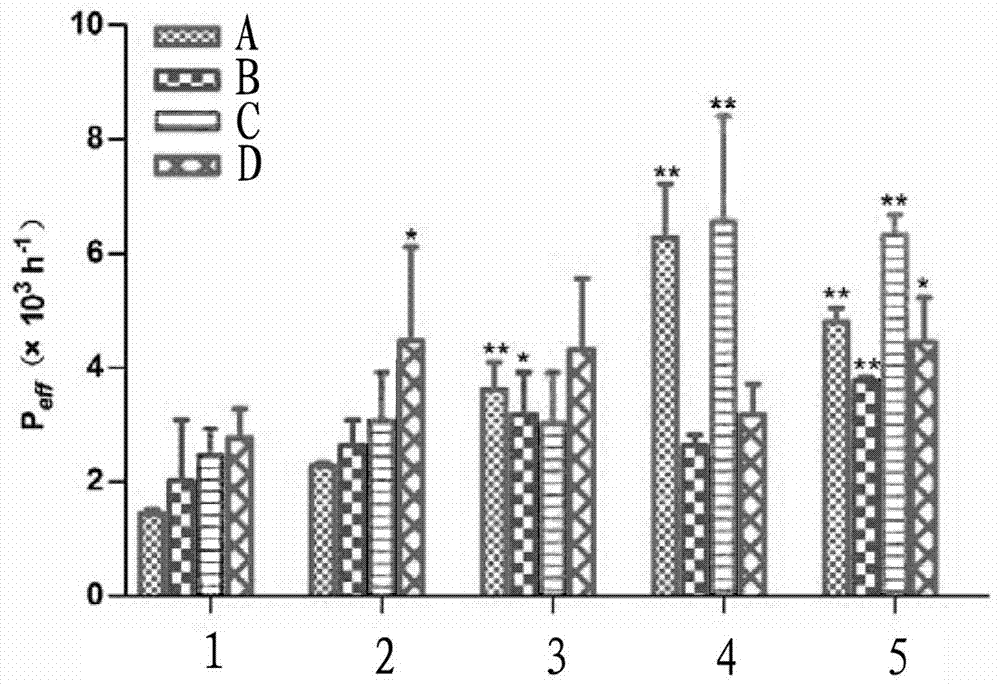
大鼠在体肠吸收实验显示,各制剂组在大鼠肠道内吸收的情况见图1和图2,图1和图2中各标识指代含义如下:
A—十二指肠,B—空肠,C—回肠,D—结肠;
1—泰素(紫杉醇的市售制剂),2—泰素+维拉帕米,3—泰素+CR偶联物,4—载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束,5—载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束+维拉帕米。
载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束组中的紫杉醇在全肠段吸收速率常数Ka和表观渗透系数Peff均有不同程度提高,十二指肠、空肠、结肠、回肠的吸收速率常数Ka相比泰素(紫杉醇的市售制剂)组分别提高2.87、2.62、2.26、1.44倍,载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束在回肠部位吸收最快(p<0.01),其次是十二指肠(p<0.01),结肠、空肠部位吸收稍慢。载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束组在十二指肠的表观渗透系数Peff相比泰素(紫杉醇的市售制剂)组提高3.09倍;在回肠和结肠段分别提高2.73、2.34倍,说明载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束对紫杉醇有很好的促吸收作用。
在载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束中加入维拉帕米后,在全肠段的吸收速率常数Ka和表观渗透系数Peff无明显变化,推测载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束进入肠道的途径与P-糖蛋白无关。
(2)药动学实验结果
30只大鼠,随机分为6组,每组5只,禁食12h,不禁水。分别灌胃给予各种紫杉醇制剂后,分别于设定时间点于大鼠眼底静脉丛取血,血样经处理后用UPLC-MS分析,所测得血药浓度-时间曲线如图3所示,图3中各标识所指代的实验组如下:
1—泰素(紫杉醇的市售制剂),2—泰素+维拉帕米,3—载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束,4—泰素+CR偶联物,5—泰素+羧甲基壳聚糖。
根据药动学数据计算结果可知,大鼠口服给予各紫杉醇制剂后,泰素+维拉帕米、载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束、泰素+CR偶联物、泰素+羧甲基壳聚糖组的AUC0-48h分别是泰素(紫杉醇的市售制剂)对照组的3.14、7.66、1.05、1.02倍,载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束组具有极显著性;Cmax分别是泰素对照组的4.35、26.00、1.14、1.13倍,Tmax分别是泰素对照组的0.78、2、1.62、0.63倍。结果表明,载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束能够显著提高紫杉醇的口服生物利用度,延长在血液中的循环时间,达到缓释效果。
(4)CR偶联物的细胞毒实验结果
用Caco-2细胞进行的细胞毒实验结果,用GraphPad Prism软件计算CR偶联物的IC50值结果见表1。CR偶联物在24、48、72h的IC50值均大于100μg/mL,说明CR偶联物安全性较高,可以作为一种安全的药用辅料使用。
表1CR偶联物在24、48、72h对Caco-2细胞的IC50值(n=3)
注:Blank vehicle是泰素的溶剂聚氧乙烯蓖麻油-乙醇(1∶1)。
(5)体内药效学实验
荷瘤小鼠分别给予各组紫杉醇制剂(20mg/kg)后,隔天给药,给药5次,肿瘤生长曲线见图4,图4中各标识所指代的实验组如下:
1—生理盐水,2—泰素(紫杉醇的市售制剂),3—泰素+维拉帕米,4—泰素+CR偶联物,5—载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束。
由图4可知,泰素组、泰素+维拉帕米组、泰素+CR偶联物组和载紫杉醇的CR偶联物胶束组的肿瘤生长速度和生长趋势明显小于生理盐水组。载紫杉醇的CR偶联物胶束组与泰素+维拉帕米组的肿瘤生长速度和生长趋势相近。泰素组、泰素+维拉帕米组、泰素+CR偶联物组和载紫杉醇的CR偶联物胶束组肿瘤体积分别是生理盐水组的59.46%、41.12%、54.49%、39.98%。载紫杉醇的CR偶联物胶束组与泰素组比具有显著性意义,肿瘤体积是泰素组的67.24%,说明载紫杉醇的CR偶联物胶束对肿瘤有较强的抑制作用。
给药5次后,第10天剖取肿瘤组织,称重,解剖后的瘤重及抑瘤率见表2。从表2中可以看出,各给药组对肿瘤的治疗均有一定的效果,与生理盐水组相比,泰素+CR偶联物组瘤重明显减少(P<0.05),泰素+维拉帕米组和载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束组瘤重减少更明显(P<0.01)。各紫杉醇制剂组中,载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束组瘤重最小,抑瘤率达到45.76%(P<0.05),是泰素组抑瘤率的1.83倍,抑瘤效果最好,表2的结果与肿瘤生长曲线的结果相一致。
表2荷瘤小鼠的肿瘤重量和抑瘤率(n=10)
*P<0.05vs.生理盐水,**P<0.01vs.生理盐水,#P<0.05vs.泰素.
给药后,每天给小鼠称重一次,绘制荷瘤小鼠体重变化曲线见图5,图5中各标识所指代的实验组如下:
1—生理盐水,2—泰素(紫杉醇的市售制剂),3—泰素+维拉帕米,
4—泰素+CR偶联物,5—载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束。
由图5可知,载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束组小鼠体重一直处于增加状态,较泰素组、泰素+维拉帕米组体重增加明显(P<0.05),说明荷瘤小鼠在经过载紫杉醇的羧甲基壳聚糖-大黄酸偶联物胶束治疗后,不仅肿瘤生长得到抑制,并且生长状态得到改善,在提高紫杉醇的抗肿瘤效应的同时还能减轻紫杉醇带来的毒副作用。
本发明具有以下优点:
1、具有增溶作用,能增加紫杉醇溶解度,同时也增加大黄酸溶解度;
2、促进药物即紫杉醇的口服吸收;
3、形成纳米胶束,递送抗肿瘤药物,提高药效;
4、具有增强紫杉醇抗肿瘤作用;
5、可作为前药:大黄酸本身有抗肿瘤作用,当CR偶联物在体内酰胺键断裂后可释放出大黄酸。
本发明由羧甲基壳聚糖和大黄酸构成高分子偶联物,是两亲性高分子聚合物,能在水性溶液中自组装成纳米胶束,包载紫杉醇,增加紫杉醇的水溶性,解决紫杉醇水溶性差的问题,并减少紫杉醇对胃肠道的损伤;借助羧甲基壳聚糖口服促吸收作用,及大黄酸保护肠粘膜作用,促进紫杉醇在肠道的吸收,提高紫杉醇的口服生物利用度,并减少对胃肠道的刺激;大黄酸抗肿瘤与紫杉醇协同作用、并能逆转多药耐药,提高肿瘤细胞的敏感度,该羧甲基壳聚糖-大黄酸偶联物形成的纳米胶束对紫杉醇在体内的传递和EPR效应被动靶向肿瘤。综合以上,羧甲基壳聚糖-大黄酸偶联物作为一个功能性口服促吸收的辅料,对紫杉醇等水溶性差、渗透性差的抗肿瘤药物起到口服递送、提高其抗肿瘤效果的作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种羧甲基壳聚糖pH敏感性水凝胶药物载体的制备方法与流程
- 一种低分子量的Y型亲水基两亲分子化合物在提高沥青乳液粘度和稳定性方面的应用的制作方法与工艺
- 一种低分子量的Y型亲水基两亲分子化合物在提高沥青乳液粘度和稳定性方面的应用的制作方法与工艺
- 一种衣康酸均聚物接枝羧甲基壳聚糖纳米粒的制备方法与流程
- 一种羧甲基‑β‑环糊精接枝壳聚糖离子交联纳米粒、制备方法及其应用与流程
- 一种基于铁蛋白/壳聚糖的天然色素分子包埋物的制备方法与流程
- 一种含偕胺肟基的壳聚糖改性吸附剂及其制备方法与流程
- 一种磁性羧甲基壳聚糖纳米材料及其制备方法与流程
- 一种创面修复PAMAM/羧甲基壳聚糖复合物及其制备方法和应用与流程
- 一种添加壳聚糖的无铬水基黄铜抗氧化剂及其制作方法与流程