己糖激酶2特异性抑制剂在急性中枢神经系统损伤疾病中的应用的制作方法
本发明属于生物医药领域,涉及己糖激酶2特异性抑制剂等在防治急性中枢神经系统损伤疾病中的应用。
背景技术:
脑卒中又称脑中风,是一种急性脑血管疾病,是由于脑部血管突然破裂或因血管堵塞导致脑血流减少而引起脑组织损伤的一种疾病,包括缺血性和出血性脑中风,其中缺血性脑中风占总病例的85%左右。
目前组织型纤溶酶原激活剂(t-PA)是FDA批准用于抗中风的药物。但t-PA只适用于中风发生后的3-6小时内,同时患者接受治疗后也存在脑出血和脑水肿的风险,这些缺陷使得t-PA的应用十分受限,并且受益患者也非常少。因此安全有效的能用于急性缺血性脑中风防治的药物显得备受期待。
急性缺血性脑卒中后免疫系统介导的炎症反应是一个被广泛研究的治疗靶点。但目前以此机制为治疗靶点的药物在临床试验中的结果并不理想。例如:芬戈莫德(Fingolimod)和那他珠单抗(Natalizumab)这些针对外周免疫系统炎症反应的药物尽管可有效抑制淋巴细胞向脑实质的渗透,但临床试验结果显示接收治疗后并不能使得中风患者群体受益。因此,对缺血后小胶质细胞所介导的中枢神经系统炎症反应进行深入探索可望为急性缺血性脑卒中的防治提供新的治疗靶点和策略。
技术实现要素:
本发明的发明人通过筛选获得了一系列糖酵解通路基因,鉴定出己糖激酶2的选择性上调介导了缺氧诱导的小胶质细胞的激活过程。发明人证实,具有己糖激酶2选择性抑制活性的一系列生物活性物质可抑制缺氧诱导的小胶质细胞的激活过程。而且,发明人还发现,己糖激酶1和己糖激酶3干扰不能抑制缺氧诱导的小胶质细胞的激活过程。
因此,本发明一方面提供己糖激酶2特异性抑制剂在制备预防和治疗急性中枢神经系统损伤疾病的药物中的应用。
本发明另一方面提供包含己糖激酶2特异性抑制剂的组合物在制备预防和治疗急性中枢神经系统损伤疾病的药物中的应用。
本发明再一方面提供一种预防和治疗急性中枢神经系统损伤疾病的方法,所述方法包括向有需要的对象施用预防有效量或治疗有效量的己糖激酶2特异性抑制剂或包含己糖激酶2特异性抑制剂的组合物。
本发明发现了己糖激酶2特异性抑制剂在防治急性中枢神经系统损伤疾病中的神经保护作用。细胞学实验和体内动物实验表明选择性己糖激酶2上调表达调控了缺氧诱导的小胶质细胞的激活过程以及缺血后小胶质细胞介导的神经炎症反应,而己糖激酶2选择性抑制剂和基因敲低都可显著抑制小胶质细胞介导的炎症反应从而发挥神经保护作用。
附图说明
图1:缺氧所引起的糖酵解通路的增强对于小胶质细胞的激活是必须的。
图2:缺氧诱导的小胶质细胞激活过程涉及到己糖激酶家族成员的上调表达。
图3 :己糖激酶2干扰能有效抑制由缺氧诱导的小胶质细胞的激活过程。
图4:己糖激酶1和己糖激酶3干扰不能抑制缺氧诱导的小胶质细胞的激活过程。
图5:丙酮酸激酶M2亚型(PKM2)干扰不能抑制缺氧诱导的小胶质细胞的激活过程。
图6 :己糖激酶2抑制剂氯尼达明能有效抑制由缺氧诱导的小胶质细胞的激活过程。
图7 :己糖激酶2的上调表达导致组蛋白乙酰化的增加和促炎细胞因子Il1b的转录表达。
图8 :氯尼达明有效保护大鼠免于中脑动脉梗塞所造成的脑损伤。
图9 :体内基因敲低己糖激酶2有效保护大鼠免于中脑动脉梗塞所造成的脑损伤。
具体实施方式
以下实施方式是对本发明作进一步说明,但本发明的实施方式不局限于以下的实施例介绍,凡依照本发明的原理或理念所作的等同的变化或变通都应视为本发明保护的范畴。
在一个方面,本发明提供一种己糖激酶2特异性抑制剂在制备预防和治疗急性中枢神经系统损伤疾病的药物中的应用。所述己糖激酶2特异性抑制剂是指能够特异性或选择性抑制己糖激酶2(也称为己糖激酶II或HK2)的生物学活性的物质。
在一些实施方式中,所述己糖激酶2特异性抑制剂包括己糖激酶2的抗体或其片段。所述抗体是指能够特异性结合至己糖激酶2并抑制或淬灭己糖激酶2的活性的蛋白质。抗体的片段可包括例如Fab、Fab'、(Fab')2和 Fv。抗体或其片段的生产及纯化在本领域是已知的。
在一些实施方式中,本发明所述的己糖激酶2抗体还可以编码该抗体的氨基酸序列、核苷酸序列、包含该核苷酸序列或氨基酸序列的表达载体的形式存在。在一些实施方式中,本发明所述的己糖激酶2抗体还可以融合蛋白的形式存在于表达载体或宿主细胞中。
在一些实施方式中,所述己糖激酶2特异性抑制剂包括能够特异性抑制己糖激酶2的mRNA翻译的物质,或能够特异性降解己糖激酶2的mRNA的物质,例如siRNA,shRNA、miRNA或其修饰物,从而通过RNAi机制干扰己糖激酶2的合成。siRNA,shRNA或miRNA可通过体外合成技术获得,这在本领域是熟知的。在一些实施方式中,本发明所述siRNA,shRNA或miRNA存在于特定载体中,例如细胞中。
在一些实施方式中,所述急性中枢神经系统损伤疾病是指由急性缺血或缺氧引起的中枢神经系统损伤的疾病或病症,包括但不限于,急性脊柱损伤、脑外伤、视网膜损伤、缺氧性脑损伤、急性缺血性脑损伤、缺血性脑卒中、缺氧性脑卒中、新生儿缺氧缺血性脑病、中毒性脑病、急性脑梗塞、腔隙性脑梗死、短暂性脑缺血发作、重型颅脑损伤、脑脊髓手术和脑脊髓放疗等导致的脑、脊髓神经损伤。
在另一个方面,本发明提供包含己糖激酶2特异性抑制剂的组合物在制备预防和治疗急性中枢神经系统损伤疾病的药物中的应用。
在一些实施方式中,所述组合物中所包含的己糖激酶2特异性抑制剂如上所述,并且该组合物还可包含其他己糖激酶2抑制剂。所述其他己糖激酶2抑制剂包括但不限于,2-脱氧葡萄糖;氯尼达明(Lonidamine);3-溴丙酮酸(bromopyruvic acid);6-磷酸葡萄糖(glucose 6-phosphate);伊马替尼(Imatinib);5-硫代葡萄糖(5-thio-glucose);茉莉酮酸甲酯(methyl jasmonate)。
本发明再一方面提供一种预防和治疗急性中枢神经系统损伤疾病的方法,所述方法包括向有需要的对象施用预防有效量或治疗有效量的己糖激酶2特异性抑制剂或包含己糖激酶2特异性抑制剂的组合物。
在一些实施方式中,所述对象是指哺乳动物对象,例如人类。所述施用是指通过皮下、经皮、肌内、静脉内、动脉内、舌下、口腔、胃肠道等给药方式将药物用于例如人体。在一些实施方式中,可通过基因疗法将己糖激酶2特异性抑制剂(例如核酸形式)施用至被治疗或预防的对象。
本发明再一方面提供一种预防和治疗急性中枢神经系统损伤疾病的方法,所述方法包括有此需要的对象体内选择性或特异性降低或灭活己糖激酶2的活性。所述降低或灭活己糖激酶的活性可通过例如基因工程手段降低或消除己糖激酶2蛋白质的表达来实现。一个示例性的手段为通过定点突变改变己糖激酶2编码核苷酸的序列。另一个示例性的手段为通过RNAi技术干扰己糖激酶2的mRNA的翻译过程。任何本领域技术人员已知的在细胞内降低特定蛋白质表达的方法预期都可以用于本发明的方法中。
在没有特别指明的情况下,本发明采用的材料及实验方法为常规材料及方法。
实施例1 缺氧所引起的糖酵解通路的增强对于小胶质细胞的激活是必须的
材料:小鼠BV2小胶质细胞株,高糖DMEM培养基 (Gibco, 11965-118),胎牛血清(Gibco, 10099-141),2-脱氧葡萄糖(Sigma-Aldrich, D8375),2-(N-7-硝基-2,1,3-苯并二唑-4-氨基)-2-脱氧葡萄糖 (2-NBDG,Thermo Fisher Scientific, N13195),Annexin/PI染色试剂盒(Biotool, B32115), 流式细胞分析仪(CytoFLEX S),激光共聚焦显微镜 (Nikon A1 Spectral Confocal Microscope),缺氧工作站(Coy LABORATORY PRODUCTS)。
免疫印迹以及免疫荧光使用抗体信息:
CD 11b抗体 (Novus biologicals, NB 110-89474);
TNF-α 抗体 (CST, 11498);
IL-1β抗体 (CST, 12507);
IL-6抗体 (Bioss, bs-6309R);
α-Tubulin 抗体 (Bioworld, AP0064)。
方法:
a)细胞的培养:小鼠小胶质细胞株BV2生长在含有10%FBS的高糖DMEM培养基中,置于5% CO2,37°C恒温密闭式孵箱(相对湿度95%)内培养传代,在倒置显微镜下观察生长情况。大约2-3天传代一次,取对数生长期细胞用于正式实验。缺氧处理组细胞置于Coy缺氧工作站中,氧气含量设置为1%,CO2含量设置为5%,其余以N2填充;其他同正常培养条件。
b)细胞蛋白提取与促炎细胞因子蛋白表达检测:细胞接种至35mm培养基中静置24小时后,给以缺氧处理相应时间。之后提取细胞总蛋白检测促炎细胞因子TNF-α,IL-1β和IL-6的蛋白表达。
c)免疫荧光检测CD 11b表达:BV2细胞接种于激光共聚焦专用培养板中,给予缺氧处理24小时后使用4%多聚甲醛室温固定20分钟,之后使用PBST洗涤三次,每次5分钟。洗涤结束后,加入由DAKO抗体稀释液稀释过的CD 11b抗体在4°C孵育过夜。次日加入对应的荧光标记二抗37°C孵育1小时。孵育结束后,加入DAPI工作液进行细胞核染色10分钟。处理结束后,以PBST洗涤三次并利用激光共聚焦显微镜进行成像。
d)2-NBDG摄取实验:BV2细胞接种于96孔板培养板(侧边黑色,底部透明)中,24小时后更换为含有200 μM 2-NBDG的DPBS缓冲液,分别置于常氧或者缺氧环境中培养1小时,之后更换为新鲜的DPBS在荧光显微镜下拍照并利用多功能酶标仪检测各个处理组的荧光值以代表葡萄糖的相对摄取量。
e) Annexin/PI 染色:细胞接种至35mm培养皿中静置24小时后,给以缺氧处理24小时。用0.25%胰酶消化收集细胞。之后按照试剂盒说明书加入Annexin和PI染料,30分钟后利用流式细胞仪细胞检测缺氧是否引起细胞的死亡。
f) 代谢物质的检测:BV2细胞接种至60mm培养皿静置24小时后,给以常氧或者缺氧培养6小时。以预冷PBS洗涤细胞三次后,加入1.5ml冰冻的80%的甲醇,-80°C冰箱中孵育30分钟。收集细胞, 4°C 14,000g离心15分钟。取上层甲醇/水相转移至新的离心管中-80°C冰箱中再次孵育30分钟。离心收集上清至新的离心管中,在氮气氛围中吹干样品。样品经液相-质谱分析之前置于-80°C保存。
结果:
如图1A所示,缺氧可以诱导小胶质细胞的形态呈现出明显的激活状态,特点为胞体增大,伪足增多;且这种变化具有时间依赖性,在缺氧24小时后,出现激活形态的细胞大约占总细胞的52%左右(如图1B所示)。同时,在图1C免疫荧光的结果中可以看到缺氧24小时后,小胶质细胞被激活的分子标记物CD 11b也有显著增强。另外,如图1D所示,促炎细胞因子TNF-α,IL-1β和IL-6在正常对照组几乎无表达,随着缺氧时间的延长这些蛋白的表达量也有明显增加。而在整个缺氧过程中,并没有发现1%的缺氧环境会造成细胞的死亡(如图1E和1F所示)。以上结果表明,缺氧可使得小胶质细胞呈现一种炎性的激活表型。
随着缺氧的进行,BV2细胞的有氧糖酵解通路也明显增强。如图1G和1H所示,缺氧1小时即可以引起BV2细胞葡萄糖摄取量增加约1.6倍。同时,这个过程也伴随着糖酵解通路代谢物的累积增加,如1I所示,相比于正常对照组,1,6-二磷酸果糖,磷酸二羟丙酮和3-磷酸甘油醛在缺氧处理6小时组都有显著的增加。而在使用2-脱氧葡萄糖对糖酵解通路进行抑制后,由缺氧引起的小胶质细胞的激活表型被显著抑制(如图1J-1L所示)。综上所述,糖酵解通路的增强对于缺氧诱导的小胶质细胞的激活是必须的。
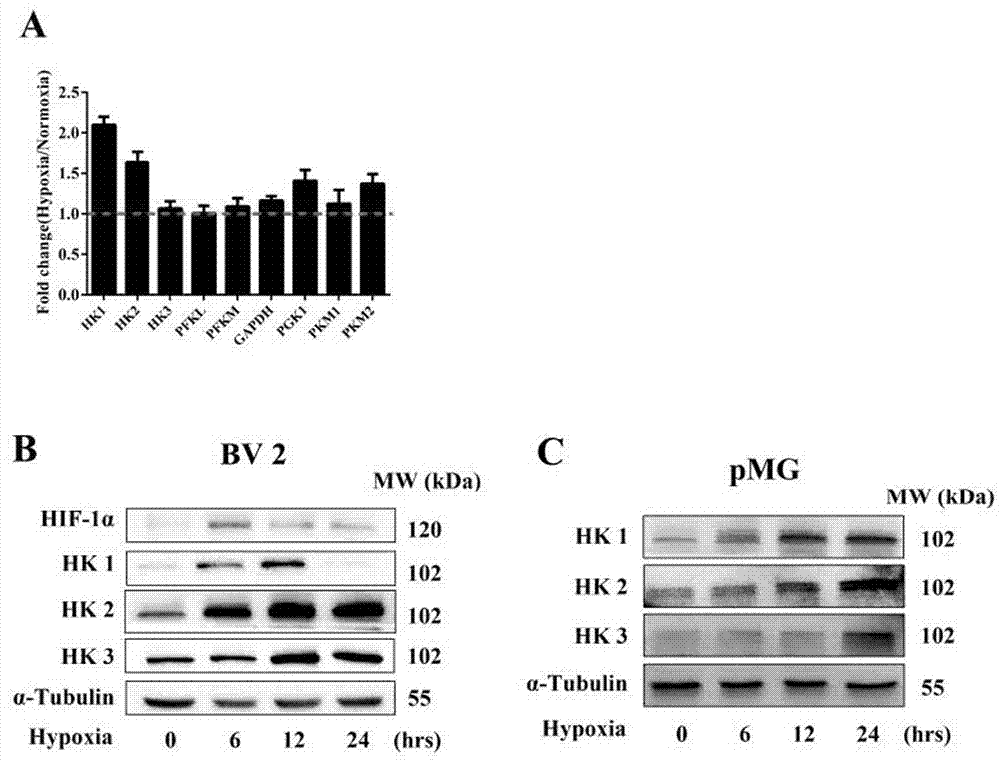
实施例2缺氧诱导的小胶质细胞激活过程涉及到己糖激酶家族成员的上调表达
材料:小鼠BV2小胶质细胞株,原代培养小鼠小胶质细胞,高糖DMEM培养基 (Gibco, 11965-118),胎牛血清(Gibco, 10099-141),RNA提取试剂TRIzol (Thermo Fisher Scientific, 15596-018),RNA定量试剂盒(Thermo Fisher Scientific, Q10211),SuperReal qPCR PreMix (SYBR Green) (Tiangen, FP202-01),实时荧光定量PCR仪(Applied Biosystems),缺氧工作站(Coy LABORATORY PRODUCTS)。
免疫印迹使用抗体信息:
Hexokinase 1 抗体 (Abcam,150423);
Hexokinase 2 抗体 (CST, 2867s);
Hexokinase 3 抗体 (Santa Cruz, sc-28890) ;
α-Tubulin 抗体 (Bioworld, AP0064)。
实时荧光定量PCR所使用的引物信息如下:
小鼠HK1正向引物: GTAGGGGTACGCTTAGGTGG;
小鼠HK1反向引物: ACCCAGGAGTCCATAAAGCC;
小鼠HK2正向引物: GAGAAAGCTCAGCATCGTGG;
小鼠HK2反向引物: TCCATTTGTACTCCGTGGCT;
小鼠HK3正向引物: GCTCCGTTGAGAGCAGATTT;
小鼠HK3反向引物: TTGCTGCAAGCATTCCAGTT;
小鼠PFKM正向引物: GTTTGGAAGCCTCTCCTCCTC;
小鼠PFKM反向引物: GACGGCAGCATTCATACCTT;
小鼠PFKL正向引物: CGCAAGGTATGAATGCTGCT;
小鼠PFKL反向引物: CGATGGTCAAGTGTGCGTAG;
小鼠PGK1正向引物: CGAGCCTCACTGTCCAAACT;
小鼠PGK1反向引物: GTCTGCAACTTTAGCGCCTC;
小鼠PKM1正向引物: CGTCCGCAGGTTTGATGAGA;
小鼠PKM1反向引物: TTCAAACAGCAGACGGTGGA;
小鼠PKM2正向引物: GGCTCCTATCATTGCCGTGA;
小鼠PKM2反向引物: AAGGTACAGGCACTACACGC;
小鼠Actb正向引物: TGAGCTGCGTTTTACACCCT;
小鼠Actb反向引物: TTTGGGGGATGTTTGCTCCA。
方法:
a) 细胞的培养:小鼠小胶质细胞株BV2生长在含有10%FBS的高糖DMEM培养基中,置于5% CO2,37°C恒温密闭式孵箱(相对湿度95%)内培养传代,在倒置显微镜下观察生长情况。大约2-3天传代一次,取对数生长期细胞用于正式实验。
原代培养小胶质细胞:细胞分离至出生后0-2天的C57BL/6J乳鼠,具体如下:取出大脑皮层,去除脑膜和血管;用组织剪剪碎组织块,用0.125%的胰酶于37℃消化15分钟。以含有10% FBS的DMEM终止消化,分离的单细胞接种于培养皿中。待混合培养细胞长至融合时,轻摇培养皿分离出悬浮的小胶质细胞。细胞的纯度使用小胶质细胞特异性的分子标记物CD 11b确定。
b) 细胞蛋白提取与己糖激酶家族蛋白表达检测:细胞接种至35mm培养中静置24小时后,给以缺氧处理相应时间。之后提取细胞总蛋白检测己糖激酶家族的蛋白表达。
结果:
如图2A所示,相比于正常对照组,BV2细胞缺氧处理6小时后糖酵解通路代谢酶在mRNA水平都有不同程度的上调表达。其中,己糖激酶1,己糖激酶2和己糖激酶3都有显著升高。另外,BV2细胞和原代培养小胶质细胞在缺氧处理不同时间后,图2B和2C中也可以看到己糖激酶家族成员在蛋白质水平都有瞬时性或者持续性上调表达。
实施例3 己糖激酶2,而不是其他己糖激酶家族成员介导缺氧诱导的小胶质细胞的激活过程
(1) 己糖激酶2干扰能有效抑制由缺氧诱导的小胶质细胞的激活过程
材料:小鼠BV2小胶质细胞株,原代培养小鼠小胶质细胞,高糖DMEM培养基 (Gibco, 11965-118),胎牛血清(Gibco, 10099-141),siRNA片段,siRNA转染试剂(Lipofectamine RNAiMAX Reagent,Thermo Fisher Scientific, 13778-500),倒置相差显微镜(Nikon ECLIPSE Ti Microscope),激光共聚焦显微镜 (Nikon A1 Spectral Confocal Microscope),缺氧工作站(Coy LABORATORY PRODUCTS)。
免疫印迹使用抗体信息:
Hexokinase 1 抗体 (Abcam,150423);
Hexokinase 2 抗体 (CST, 2867s);
Hexokinase 3 抗体 (Santa Cruz, sc-28890) ;
CD 11b抗体 (Novus biologicals, NB 110-89474);
α-Tubulin 抗体 (Bioworld, AP0064)。
方法:
a) 细胞的培养:小鼠小胶质细胞株BV2生长在含有10%FBS的高糖DMEM培养基中,置于5% CO2,37°C恒温密闭式孵箱(相对湿度95%)内培养传代,在倒置显微镜下观察生长情况。大约2-3天传代一次,取对数生长期细胞用于正式实验。
b) RNA干扰:细胞接种至35mm培养中静置24小时后,采用RNAiMAX转染50nM siRNA片段,乱序RNA作为对照,12小时后更换为新鲜的培养基。之后给予缺氧处理24小时以检测相应蛋白的表达量。
结果:
如图3A-3D所示,BV2细胞转染入HK2不同的干扰片段后,能有效抑制由缺氧诱导的小胶质细胞形态学改变;同时缺氧引起的细胞激活的标记物CD 11b的上调表达也有明显减少。而在过程中,HK2的干扰对HK1和HK3的表达并没有影响。
己糖激酶1和己糖激酶3干扰不能抑制缺氧诱导的小胶质细胞的激活过程
材料:小鼠BV2小胶质细胞株,高糖DMEM培养基 (Gibco, 11965-118),胎牛血清 (Gibco, 10099-141),siRNA片段,siRNA转染试剂(Lipofectamine RNAiMAX Reagent,Thermo Fisher Scientific, 13778-500),倒置相差显微镜(Nikon ECLIPSE Ti Microscope),缺氧工作站 (Coy LABORATORY PRODUCTS)。免疫印迹使用抗体信息:Hexokinase 1 抗体 (Abcam,150423);Hexokinase 3 抗体 (Santa Cruz, sc-28890) ;α-Tubulin 抗体 (Bioworld, AP0064)。
方法:
a) 细胞的培养:小鼠小胶质细胞株BV2生长在含有10%FBS的高糖DMEM培养基中,置于5% CO2,37°C恒温密闭式孵箱(相对湿度95%)内培养传代,在倒置显微镜下观察生长情况。大约2-3天传代一次,取对数生长期细胞用于正式实验。
b) RNA干扰:细胞接种至35mm培养中静置24小时后,采用RNAiMAX转染50nM siRNA片段,乱序RNA作为对照,12小时后更换为新鲜的培养基。之后给予缺氧处理24小时以检测相应蛋白的表达量。
结果:
如图4A和4C所示,使用HK1和HK3干扰片段分别干扰己糖激酶1和己糖激酶3后,并不能有效抑制由缺氧引起的小胶质细胞的激活相关的形态学改变(图4B和4D所示)。
丙酮酸激酶M2亚型(PKM2)干扰不能抑制缺氧诱导的小胶质细胞的激活过程
材料:小鼠BV2小胶质细胞株,高糖DMEM培养基 (Gibco, 11965-118),胎牛血清 (Gibco, 10099-141),siRNA片段,siRNA转染试剂(Lipofectamine RNAiMAX Reagent,Thermo Fisher Scientific, 13778-500),倒置相差显微镜(Nikon ECLIPSE Ti Microscope),缺氧工作站 (Coy LABORATORY PRODUCTS)。免疫印迹使用抗体信息:PKM2 抗体 (Abcam,150423);CD 11b抗体 (Novus biologicals, NB 110-89474);α-Tubulin 抗体 (Bioworld, AP0064)。
方法:
a) 细胞的培养:小鼠小胶质细胞株BV2生长在含有10%FBS的高糖DMEM培养基中,置于5% CO2,37°C恒温密闭式孵箱(相对湿度95%)内培养传代,在倒置显微镜下观察生长情况。大约2-3天传代一次,取对数生长期细胞用于正式实验。
b) RNA干扰:细胞接种至35mm培养中静置24小时后,采用RNAiMAX转染50nM siRNA片段,乱序RNA作为对照,12小时后更换为新鲜的培养基。之后给予缺氧处理24小时以检测相应蛋白的表达量。
结果:
如图5A所示,在缺氧诱导的小胶质细胞的激活过程中,PKM2蛋白呈现出瞬时上升表达的趋势;但使用PKM2干扰片段干扰PKM2的表达后,并不能有效抑制由缺氧引起的小胶质细胞的激活相关的形态学改变(图5B和5C所示)。
)己糖激酶2抑制剂氯尼达明能有效抑制由缺氧诱导的小胶质细胞的激活过程
材料:小鼠BV2小胶质细胞株,原代培养小鼠小胶质细胞,高糖DMEM培养基 (Gibco, 11965-118),胎牛血清(Gibco, 10099-141),氯尼达明(Selleck,S2610),倒置相差显微镜(Nikon ECLIPSE Ti Microscope),激光共聚焦显微镜 (Nikon A1 Spectral Confocal Microscope),缺氧工作站 (Coy LABORATORY PRODUCTS)。免疫荧光使用抗体信息:CD 11b抗体 (Novus biologicals, NB 110-89474);α-Tubulin 抗体 (Bioworld, AP0064)。
方法:
a) 细胞的培养:小鼠小胶质细胞株BV2生长在含有10%FBS的高糖DMEM培养基中,置于5% CO2,37°C恒温密闭式孵箱(相对湿度95%)内培养传代,在倒置显微镜下观察生长情况。大约2-3天传代一次,取对数生长期细胞用于正式实验。
原代培养小胶质细胞:细胞分离至出生后0-2天的C57BL/6J乳鼠,具体如下:取出大脑皮层,去除脑膜和血管;用组织剪剪碎组织块,用0.125%的胰酶于37℃消化15分钟。以含有10% FBS的DMEM终止消化,分离的单细胞接种于培养皿中。待混合培养细胞长至融合时,轻摇培养皿分离出悬浮的小胶质细胞。细胞的纯度使用小胶质细胞特异性的分子标记物CD 11b确定。
b) 免疫荧光检测CD 11b表达:BV2细胞和原代培养小胶质细胞接种于激光共聚焦专用培养板中,给予缺氧处理24小时后使用4%多聚甲醛室温固定20分钟,之后使用PBST洗涤三次,每次5分钟。洗涤结束后,加入由DAKO抗体稀释液稀释过的CD 11b抗体在4°C孵育过夜。次日加入对应的荧光标记二抗37°C孵育1小时。孵育结束后,加入DAPI工作液进行细胞核染色10分钟。处理结束后,以PBST洗涤三次并利用激光共聚焦显微镜进行成像。
结果:
如图6A和6B所示,BV2细胞和原代小胶质细胞中,给予缺氧处理24小时后,CD 11b的蛋白表达明显上调,同时也可以观察到呈现明显的激活样形态;但在己糖激酶2抑制剂氯尼达明存在时,CD 11b的上调表达被明显抑制,而加入DMSO的溶剂对照组对CD 11b的表达并没有影响。氯尼达明使用剂量为:50 μM,DMSO为其溶剂。
实施例4 己糖激酶2的上调表达导致组蛋白乙酰化的增加和促炎细胞因子Il1b的转录表达。
材料:小鼠BV2小胶质细胞株,原代培养小鼠小胶质细胞,高糖DMEM培养基 (Gibco, 11965-118),胎牛血清(Gibco, 10099-141),氯尼达明(Selleck,S2610),3-溴丙酮酸(Sigma,16490),RNA提取试剂TRIzol (Thermo Fisher Scientific, 15596-018),RNA定量试剂盒(Thermo Fisher Scientific, Q10211),SuperReal qPCR PreMix (SYBR Green) (Tiangen, FP202-01),实时荧光定量PCR仪(Applied Biosystems),染色质免疫沉淀试剂盒(Millipore,17-245),缺氧工作站 (Coy LABORATORY PRODUCTS),倒置相差显微镜(Nikon ECLIPSE Ti Microscope)。免疫印迹使用抗体信息:acetyl-Histone H3 抗体 (Millipore,06-599);acetyl-Histone H4抗体 (Millipore,06-866);α-Tubulin 抗体 (Bioworld, AP0064)。
方法:
a) 细胞的培养:
小鼠小胶质细胞株BV2生长在含有10%FBS的高糖DMEM培养基中,置于5% CO2,37°C恒温密闭式孵箱(相对湿度95%)内培养传代,在倒置显微镜下观察生长情况。大约2-3天传代一次,取对数生长期细胞用于正式实验。
原代培养小胶质细胞:细胞分离至出生后0-2天的C57BL/6J乳鼠,具体如下:取出大脑皮层,去除脑膜和血管;用组织剪剪碎组织块,用0.125%的胰酶于37℃消化15分钟。以含有10% FBS的DMEM终止消化,分离的单细胞接种于培养皿中。待混合培养细胞长至融合时,轻摇培养皿分离出悬浮的小胶质细胞。细胞的纯度使用小胶质细胞特异性的分子标记物CD 11b确定。
b) 细胞蛋白提取与乙酰化组蛋白表达检测:BV2细胞和原代培养小胶质细胞接种至35mm培养中静置24小时后,给以缺氧处理相应时间。之后提取细胞总蛋白检测乙酰化组蛋白蛋白的表达。
c) 代谢物质的检测:BV2细胞接种至60mm培养皿静置24小时后,给以常氧或者缺氧培养6小时。以预冷PBS洗涤细胞三次后,加入1.5ml冰冻的80%的甲醇,-80°C冰箱中孵育30分钟。收集细胞, 4°C 14,000g离心15分钟。取上层甲醇/水相转移至新的离心管中-80°C冰箱中再次孵育30分钟。离心收集上清至新的离心管中,在氮气氛围中吹干样品。样品经液相-质谱分析之前置于-80°C保存。
d) 染色质免疫沉淀实验检测乙酰化组蛋白H3和乙酰化组蛋白H4与Il1b基因启动子区域的结合:BV2细胞接种于100mm培养皿中静置24小时,以DMSO或者氯尼达明预处理1小时后给予缺氧处理6小时。缺氧处理结束后,在细胞培养基中加入甲醛溶液(Sigma, F8775)使之终浓度为1%,交联10分钟。收集细胞,使用超声破碎仪使之DNA断裂成为100-1000 bp。稀释样品,取出10%作为input。剩余样品加入乙酰化组蛋白H3或者乙酰化组蛋白H4抗体4℃孵育过夜。同时,等量的正常兔来源的IgG作为阴性对照。次日,加入蛋白G-琼脂糖反应2小时。之后以洗涤液洗涤样品,在0.2M NaCl溶液中65℃孵育4小时以解交联。酚-氯仿法提取DNA后进行后续定量PCR反应以检测Il1b的结合量。Il1b启动子区域的引物序列如下:
正向:5’-AGGTCAAAGGTTTGGAAGCAG-3’;
反向:5’-ATGGAAGTCTGTCTGCTCAGTATTG-3’。
结果:
如图7A所示,相比于正常对照组,缺氧6小时处理组后糖酵解通路,三羧酸循环通路和戊糖磷酸通路代谢物都有不同程度的改变,其中缺氧使得乙酰辅酶A的累积最为明显;同时这种改变可以被己糖激酶2的抑制剂氯尼达明(使用剂量:50 μM)和3-溴丙酮酸(使用剂量:10 μM)所抑制(如7B所示)。另外,如图7C所示,随着缺氧时间的延长,BV2和原代小胶质细胞中的乙酰化组蛋白H3和乙酰化组蛋白H4也呈现出与瞬时上调表达或者持续上调表达的趋势。
在BV2细胞中,缺氧6小时所导致的乙酰化组蛋白的上调表达也是可以被己糖激酶2的抑制剂所逆转的,图7D所示。进一步对促炎细胞因子的mRNA表达水平进行检测,如7E所示,实时荧光定量PCR结果显示缺氧引起Tnfa,Il1b和Il6的mRNA上调表达,但只有Il1b可明显被氯尼达明(使用剂量:50 μM)和3-溴丙酮酸(使用剂量:10 μM)所抑制。染色质免疫沉淀结果进一步显示:缺氧后可以使得乙酰化组蛋白和Il1b的启动子结合增加,而氯尼达明预处理显著抑制两者的结合(7F所示)。
实施例5 己糖激酶2的抑制通过抑制小胶质细胞介导的神经炎症有效保护大鼠免于中脑动脉梗塞所造成的脑损伤。
氯尼达明有效保护大鼠免于中脑动脉梗塞所造成的脑损伤
材料:氯尼达明(Selleck,S2610),健康雄性SPF级Spague-Dawley(SD)大鼠,2,3,5-氯化三苯基四氮唑(2,3,5-TriphenylTetrazolium Chloride,TTC)(分析纯),水合氯醛(分析纯)(购自天津市科密欧化学试剂有限公司),MCAo尼龙栓线。
方法:
a) 采用右侧颈内动脉尼龙线线栓法制作大脑中动脉阻塞(MiddleCerebral Artery Occlusion, MCAO)模型。SD大鼠术前禁食12 h,自由饮水。用10%的水合氯醛腹腔注射麻醉,仰卧位固定于37℃恒温手术台上,保持呼吸通畅。颈正中切口,钝性分离下颌下腺,显微镜下游离右侧颈总动脉,使用微血管夹夹闭。游离右侧颈外动脉,结扎其远端,在右颈总动脉分叉至前一颈外动脉结扎线之间打一松结,游离右颈内动脉并用微血管夹夹闭。用显微眼科手术剪刀在两结扎线之间剪一小口,将尼龙栓线向下插入至颈总动脉处,将松结扎紧,在颈外动脉远端结扎处下方、栓线插入的上方剪断右颈外动脉,撤离颈内动脉处的微血管夹,并使栓线插入端在右颈总动脉分叉处。将颈外动脉拉向外下方,使其与颈内动脉处于同一直线。将栓线向颈内动脉方向插入直至感受到阻力,为防止出血将栓线扎紧。撤离微血管夹,缝合切口。手术2小时后,给予氯尼达明或者相对应溶剂对照10mg/kg,之后拔出线刷,再灌注24小时后进行脑梗死体积测量。
b) 根据相关文献介绍方法进行脑梗死体积测量,具体为断头处死大鼠,迅速取出鼠脑,置于冰盐水中10 min,取冠状面均匀切成2 mm厚脑片,迅速放入1%的TTC溶液中于37℃染色30 min,然后用4%多聚甲醛缓冲液固定。24 h后用数码相机拍照,输入计算机,用图像处理软件(ADOBE PHOTOSHOP CS6)计算每片脑片的梗死面积(粉红色区为正常脑组织,白色区为梗死区)后积分转换为梗死容积。梗死容积百分比=每片脑片的梗死区域体积之和/每片脑片的全脑组织体积之和×100%。
结果:
如图8A所示,经TTC染色后观察,脑缺血2小时再灌注24小时后模型组大鼠脑组织和溶剂对照组脑组织都出现明显的梗死区域,与之相比药物处理组相应脑区的梗死程度明显减轻。计算脑梗死体积经过统计学分析显示,与溶剂对照组相比,10 mg/kg的氯尼达明对大鼠中脑动脉梗塞造成的缺血脑损伤具有显著保护作用(如图8B)。
体内基因敲低己糖激酶2有效保护大鼠免于中脑动脉梗塞所造成的脑损伤
材料:氯尼达明(Selleck,S2610),健康雄性SPF级Spague-Dawley(SD)大鼠,2,3,5-氯化三苯基四氮唑(2,3,5-TriphenylTetrazolium Chloride,TTC)(分析纯),水合氯醛(分析纯)(购自天津市科密欧化学试剂有限公司),MCAo尼龙栓线,携带shHK2片段的重组腺相关病毒血清型9型(rAAV-shHK2),携带乱序对照片段的重组腺相关病毒血清型9型(rAAV-shNC),免疫组织化学试剂盒(Abcam, ab80436),脑立体定位仪,倒置相差显微镜(Nikon ECLIPSE Ti Microscope),激光共聚焦显微镜 (Nikon A1 Spectral Confocal Microscope)。
方法:
a) 采用右侧颈内动脉尼龙线线栓法制作大脑中动脉阻塞(MiddleCerebral Artery Occlusion, MCAO)模型。SD大鼠术前禁食12 h,自由饮水。用10%的水合氯醛腹腔注射麻醉,仰卧位固定于37℃恒温手术台上,保持呼吸通畅。颈正中切口,钝性分离下颌下腺,显微镜下游离右侧颈总动脉,使用微血管夹夹闭。游离右侧颈外动脉,结扎其远端,在右颈总动脉分叉至前一颈外动脉结扎线之间打一松结,游离右颈内动脉并用微血管夹夹闭。用显微眼科手术剪刀在两结扎线之间剪一小口,将尼龙栓线向下插入至颈总动脉处,将松结扎紧,在颈外动脉远端结扎处下方、栓线插入的上方剪断右颈外动脉,撤离颈内动脉处的微血管夹,并使栓线插入端在右颈总动脉分叉处。将颈外动脉拉向外下方,使其与颈内动脉处于同一直线。将栓线向颈内动脉方向插入直至感受到阻力,为防止出血将栓线扎紧。撤离微血管夹,缝合切口。
b) 根据相关文献介绍方法进行脑梗死体积测量,具体为断头处死大鼠,迅速取出鼠脑,置于冰盐水中10 min,取冠状面均匀切成2 mm厚脑片,迅速放入1%的TTC溶液中于37℃染色30 min,然后用4%多聚甲醛缓冲液固定。24 h后用数码相机拍照,输入计算机,用图像处理软件(ADOBE PHOTOSHOP CS6)计算每片脑片的梗死面积(粉红色区为正常脑组织,白色区为梗死区)后积分转换为梗死容积。梗死容积百分比=每片脑片的梗死区域体积之和/每片脑片的全脑组织体积之和×100%。
c) 脑纹状体注射rAAV9病毒:在293T细胞进行病毒包装,qPCR测定其滴度为3.2 ×1012-3.5 ×1012 V.G./ml。使用的针对于HK2的干扰序列为:5′- GCGCAACATTCTCATCGATTT -3′;5′-AAATCGATGAGAATGTTGCGC -3′;乱序对照组shRNA序列为TTCTCCGAACGTGTCACGT。使用脑立体定位仪将上述病毒分别注入大脑纹状体区域,具体坐标为:前囟前方1.0mm,中线右侧3.0mm,硬膜下4.5mm。注射病毒体积为2 μL,注射速度为每分钟0.2 μL。注射完毕后,微量注射剂停留在注射部位5分钟之后再拔出。
d) 组织免疫荧光检测病毒在脑内的分布(eGFP),己糖激酶2以及Iba-1(小胶质细胞激活的另一个分子标记物)的表达:大鼠脑缺血2小时再灌注24小时后经麻醉取出完整的脑组织,经固定石蜡包埋后切片,脑片厚度大约为4 μm。脑片经过脱蜡,复水以及抗原修复后孵育上述抗体,4℃过夜。次日加入荧光标记二抗,37℃孵育1小时。孵育结束后,加入DAPI工作液进行细胞核染色10分钟。处理结束后,以PBST洗涤三次并利用激光共聚焦显微镜进行成像。
e) 免疫组织化学检测IL-1β的表达:大鼠脑缺血2小时再灌注24小时后经麻醉取出完整的脑组织,经固定石蜡包埋后切片,脑片厚度大约为4 μm。脑片经过脱蜡,复水以及抗原修复后孵育上述抗体,4℃过夜。次日样品经过PBS洗涤后加入HRP连接的二抗,室温孵育15分钟后,加入DAB显色液孵育1分钟。最后,用苏木精进行细胞核染色,之后利用尼康显微镜进行成像。
结果:
注射rAAV9-shHK2和rAAV9-shNC 20天后,称量两组动物体重,经过统计分析后并没有显著差异(两组动物体重分别为273.2 ± 6.9 g 和269.3 ± 5.0 g)。手术前每组挑选三只取出完整脑组织后根据eGFP的表达检测病毒在脑内的分布,9A成像结果显示病毒在大脑内有较好的组织分布。手术后切片经染色显示:与正常对照相比,手术梗死侧己糖激酶2显著上调表达。而随着病毒的扩散,rAAV9-shHK2组的己糖激酶2表达被明显抑制,而注射rAAV9-shNC后对己糖激酶2的表达并没有显著影响(如图9B所示)。TTC染色结果表明(9C和9D所示),与rAAV9-shNC组大鼠相比, rAAV9-shHK2组大鼠的脑梗死面积有显著减少。同时如9E所示,纹状体区域Iba-1染色显示在rAAV9-shNC组大鼠脑梗死半球,小胶质细胞突起缩起,呈现激活形态;而shHK2组,小胶质细胞呈现正常形态,且Iba-1的表达也有明显下降。如9F所示,对皮层和纹状体区域的Il-1β进行免疫组织化学染色表明:体内己糖激酶2的敲低所介导的神经保护作用是与降低Il-1β的表达相关的;在对照组,Il-1β分布在皮层和纹状体区域,而在rAAV9-shHK2组,Il-1β的表达被显著抑制。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速检测BCR/ABL基因融合的探针组、试剂盒及方法与流程
- 酪氨酸激酶抑制剂的制造方法与工艺
- 芳香族酰胺类衍生物、其制备方法及其在医药上的应用与制造工艺
- 包含5α‑还原酶抑制剂的药物组合物的制造方法与工艺
- 作为脾酪氨酸激酶抑制剂的二氮杂螺烷酮取代的噁唑衍生物的制造方法与工艺
- 包含热弹性感觉剂和TRPA1受体抑制剂的皮肤接合剃刮助剂的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 5‑溴‑7‑氮杂吲哚啉‑2‑酮类化合物及其制备方法与制造工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种抗癌药物的晶体化合物及其制备方法与制造工艺