pH调控的短链多肽水凝胶及其制备和应用方法与流程
本发明涉及多肽水凝胶材料,具体涉及pH调控的短链多肽水凝胶及其制备和应用方法。
背景技术:
多肽分子因其序列可调,合成方便,能够响应外界刺激而自发自组装成水凝胶,最近二十年逐渐发展为流行的药物载体材料。Schneider课题组在2004年报道了光敏水凝胶系列MAX7两亲多肽,在光催化作用下自组装成凝胶。该方法制得的多肽水凝胶机械强度适中,抗外力干扰能力强,凝胶态稳定,是良好的载药材料。Castelletto等人研究了一种多肽凝胶体的稳定性和药代动力学,发现该凝胶体系可以缓慢而可逆地吸收和释放小分子药物。然而,多数报道中的两亲多肽序列等同度高,其凝胶态调控机制的可逆性差。
技术实现要素:
本发明的目的是:提供一种pH调控的短链多肽水凝胶及其制备和应用方法,针对生理条件下药物传输和释放设计多肽水凝胶序列及凝胶可逆形成pH控制机制,酸性pH水凝胶提高药物的生物利用率,降低毒副作用,对于高端昂贵药物而言既节约成本,又提高经济效益。
本发明的技术解决方案是:首先合成多肽单体序列,再以稀盐酸溶液调节体系pH以得到多肽水凝胶;该pH调控的短链多肽水凝胶的单体序列为:E(EVVE)nEEEEE-NH2,其中E = 谷氨酸,V= 缬氨酸,n =1, 2, 3;序列C端以氨基保护。
其中,所说的单体序列反平行排列,以主链及侧链多中心氢键连接反平行排列为纤维束状β2-折叠聚集态结构;EEVVEEEEEE-NH2的一维链状结构(a)及β2 -折叠聚集态结构(b)如下:
。
其中,pH调控的短链多肽水凝胶的制备方法,它包括下述步骤:
(1)凝胶初始化:向初始pH=7的1-1.5%wt的E(EVVE)nEEEEE-NH2多肽水溶液中缓慢滴加0.01M HCl溶液,容器放置于摇床上,振摇速度控制在100rpm以下,距离凝胶初始化pH 0.1时停止振摇,继续滴加稀盐酸溶液,并控制滴加速度为每次加入稀盐酸导致的pH变化为0.01,直至到达凝胶初始化pH值;
(2)凝胶化完成:将上述到达凝胶初始化pH值的多肽溶液放置于37oC培养箱中静置,多肽自发自组装成凝胶将于1-2小时内完成,呈无色透明胶状固体,在该温度和pH条件下稳定,冷冻干燥后得白色或淡黄色粉末;
(3)冻干粉的凝胶恢复:步骤(2)所得白色或淡黄色粉末,以对应凝胶pH值的稀盐酸或缓冲溶液快速溶解,并超声波或者振摇,在37oC静置1-2小时,恢复凝胶态。
其中,步骤(1)中,对于n=1的单体序列,凝胶初始化pH=4.15。
其中,步骤(1)中,对于n=2的单体序列,凝胶初始化pH=4.30。
其中,步骤(1)中,对于n=3的单体序列,凝胶初始化pH=4.45。
其中,将一定比例的凝胶冻干粉和药物分子混匀,以对应凝胶pH值的稀盐酸溶液快速溶解,并超声波或者振摇,在37oC静置1-2小时,得到包结药物水凝胶;在包结药物水凝胶中加入pH 7.40的20 mM磷酸盐缓冲溶液,37oC恒温培养箱中静置,凝胶缓慢溶解2-4小时,得无色透明溶液。
本发明具有以下优点:
1、本发明的制备工艺方法简单,易于实现,一方面通过序列中谷氨酸和缬氨酸亲水疏水的片段诱发水凝胶的形成,另一方面通过谷氨酸残基中羧基与主链肽键羰基的多中心氢键稳定酸性pH下的凝胶结构,增敏pH响应性,得到可逆凝胶新结构及对药物分子的控释新功能。
2、本发明选用含有谷氨酸和缬氨酸的亲水疏水残基片段的多肽序列通过多肽分子的自组装制备了具有一定规则纳米结构并且响应pH控制的可逆水凝胶材料,该材料在pH=4时为无色透明胶状固体,微观结构为多中心氢键稳定的β2 -条带结构,该固体冻干后可快速恢复为凝胶,中性pH时凝胶溶解为无色或微黄色溶液,这样的结构及功能特性的新颖材料在药物包结和pH调控药物释放和注射冻干剂型方面等药物制剂科学领域将会到广泛的应用。
3、本发明可控多肽纳米水凝胶材料成功地将微观上具有β2结构的富含谷氨酸多肽序列的聚集行为与两亲多肽序列的凝胶行为结合在一起,制备了生物友好的pH调控纳米水凝胶系列材料;多肽水凝胶材料的序列中,采用“两亲头,双氢键尾”的创新设计,利用谷氨酸和缬氨酸亲水疏水的两亲排列构成了多肽聚集体的蓄水凝胶核心,同时借助谷氨酸侧链羧基对多肽主链的多中心氢键体系,进一步稳定了凝胶中多肽的β2致密排列,完善了凝胶材料的pH响应性。
4、本发明所得水凝胶材料可在生理pH条件下进行控制溶胶,不仅生物友好性高于一般凝胶材料,且有作为药物控释载体的极大潜力,此特点奠定了这种多肽水凝胶材料在药物传输和释放技术领域的应用价值。
5、凝胶冻干粉中多肽单体和药物分子(替莫唑胺)物质的量比为10:1,不同的药物比例需要调整,这种多肽序列制得的凝胶是特别针对酸性pH下稳定、生理条件下不稳定的药物分子的传输而设计的。
附图说明
图1为两亲多肽序列及微观排列结构图;
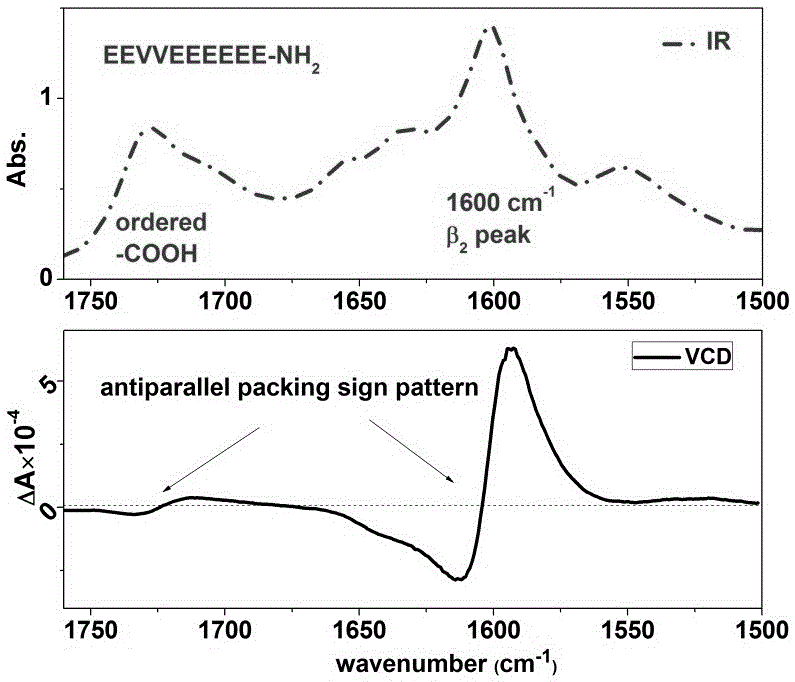
图2为多肽水凝胶红外谱图及振动圆二色谱图;
图3为多肽水凝胶TEM图像和宏观展示;
图4为多肽水凝胶释放替莫唑胺动力学曲线。
具体实施方式
下面结合实施例进一步说明本发明的技术方案,但不能理解为是对技术方案的限制。
实施例1:依以下步骤制备pH调控短链多肽水凝胶
(1)凝胶初始化:向初始pH=7的1.0%wt的E(EVVE)nEEEEE-NH2多肽水溶液中缓慢滴加0.01M HCl溶液,容器放置于摇床上,振摇速度控制在100rpm以下,距离凝胶初始化pH=4.15还有 0.1时停止振摇,继续滴加稀盐酸溶液,并控制滴加速度为每次加入稀盐酸导致的pH变化为0.01,直至到达凝胶初始化pH=4.15;
(2)凝胶化完成:将上述到达凝胶初始化pH=4.15的多肽溶液放置于37oC培养箱中静置,多肽自发自组装成凝胶将于1小时内完成,呈无色透明胶状固体,在37oC和pH=4.15条件下稳定,冷冻干燥后得白色粉末;
(3)冻干粉的凝胶恢复:步骤(2)所得白色粉末,以pH=4.15的稀盐酸溶液快速溶解,超声波辅助,在37oC静置1小时,恢复凝胶态。
实施例2:依以下步骤制备pH调控短链多肽水凝胶
(1)凝胶初始化:向初始pH=7的1.25%wt的E(EVVE)nEEEEE-NH2多肽水溶液中缓慢滴加0.01M HCl溶液,容器放置于摇床上,振摇速度控制在100rpm以下,距离凝胶初始化pH=4.30还有 0.1时停止振摇,继续滴加稀盐酸溶液,并控制滴加速度为每次加入稀盐酸导致的pH变化为0.01,直至到达凝胶初始化pH=4.30;
(2)凝胶化完成:将上述到达凝胶初始化pH=4.30的多肽溶液放置于37oC培养箱中静置,多肽自发自组装成凝胶将于1.5小时内完成,呈无色透明胶状固体,在37oC和pH=4.30条件下稳定,冷冻干燥后得淡黄色粉末;
(3)冻干粉的凝胶恢复:步骤(2)所得淡黄色粉末,以pH=4.30的缓冲溶液快速溶解,并振摇,在37oC静置1.5小时,恢复凝胶态。
实施例3:依以下步骤制备pH调控短链多肽水凝胶
(1)凝胶初始化:向初始pH=7的1.5%wt的E(EVVE)nEEEEE-NH2多肽水溶液中缓慢滴加0.01M HCl溶液,容器放置于摇床上,振摇速度控制在100rpm以下,距离凝胶初始化pH=4.45还有 0.1时停止振摇,继续滴加稀盐酸溶液,并控制滴加速度为每次加入稀盐酸导致的pH变化为0.01,直至到达凝胶初始化pH=4.45;
(2)凝胶化完成:将上述到达凝胶初始化pH=4.45的多肽溶液放置于37oC培养箱中静置,多肽自发自组装成凝胶将于2小时内完成,呈无色透明胶状固体,在37oC和pH=4.45条件下稳定,冷冻干燥后得白色粉末;
(3)冻干粉的凝胶恢复:步骤(2)所得白色粉末,以pH=4.45的稀盐酸溶液快速溶解,并超声波,在37oC静置2小时,恢复凝胶态。
实施例4:EEVVEEEEEE-NH2多肽水凝胶包结替莫唑胺
取实施例1所得凝胶冻干粉,将摩尔比为10:1的凝胶冻干粉和药物分子混合后,以对应凝胶pH=4.15的稀盐酸溶液快速溶解,并超声波或者振摇,在37oC静置1小时,得到包结药物水凝胶;此包结药物水凝胶中加入pH 7.40的20 mM磷酸盐缓冲溶液,37oC恒温培养箱中静置,凝胶缓慢溶解2小时,得无色透明溶液。
实施例5:EEVVEEEEEE-NH2多肽水凝胶包结替莫唑胺
取实施例2所得凝胶冻干粉,将摩尔比为10:1的凝胶冻干粉和药物分子混合后,以对应凝胶pH=4.30的稀盐酸溶液快速溶解,并超声波或者振摇,在37oC静置1.5小时,得到包结药物水凝胶;此包结药物水凝胶中加入pH 7.40的20 mM磷酸盐缓冲溶液,37oC恒温培养箱中静置,凝胶缓慢溶解3小时,得无色透明溶液。
实施例6:EEVVEEEEEE-NH2多肽水凝胶包结替莫唑胺
取实施例3所得凝胶冻干粉,将摩尔比为10:1的凝胶冻干粉和药物分子混合后,以对应凝胶pH=4.45的稀盐酸溶液快速溶解,并超声波或者振摇,在37oC静置2小时,得到包结药物水凝胶;此包结药物水凝胶中加入pH 7.40的20 mM磷酸盐缓冲溶液,37oC恒温培养箱中静置,凝胶缓慢溶解4小时,得无色透明溶液。
多肽水凝胶的表征:
(1)实施例1-3所得多肽水凝胶的多肽序列及微观排列结构如图1所示。
(2)EEVVEEEEEE-NH2多肽水凝胶的红外及圆二色光谱表征:多肽水凝胶的构象由Bruker-80 IR红外光谱仪和色散型振动圆二色谱仪测定(自制VCD,A. Lakhani, P. Malon, and T. A. Keiderling, Appl. Spectrosc. 63, 775 (2009).),如图2所示,红外谱图中1730cm-1峰代表谷氨酸侧链羧基的规则排列,而1600 cm-1的尖峰代表多肽链按β2-折叠结构反平行排列;振动圆二色光谱的峰型(从低波数到高波数先正后负)证实了反平行排列的二级结构,同时高的峰强度表明多肽水凝胶高度聚集。
(3)EEVVEEEEEE-NH2多肽水凝胶的显微图像测定:显微结构测定采用JEM 1220型透射电子显微镜,其透射电子显微镜图如图3所示,其显示出规则的层叠纳米条带结构。
(4)EEVVEEEEEE-NH2多肽水凝胶包结替莫唑胺的溶胶动力学表征:通过紫外光谱(Cary-300)跟踪替莫唑胺在250 nm处的吸光度值,同时以荧光光谱(Fluoromax3)跟踪水凝胶的溶解;如图4所示,替莫唑胺的吸光度缓慢升高,表示药物分子脱离凝胶体系进入水溶液态,在~4h达到最大释放度;而以ThT(硫黄素T)跟踪多肽聚集过程,其荧光强度的降低表明多肽β2-折叠聚集度的降低即水凝胶的溶解,该过程与替莫唑胺的释放基本同步。
- 还没有人留言评论。精彩留言会获得点赞!