口服诺如病毒亚单位疫苗及LT作为该疫苗佐剂的用途的制作方法
本发明属于生物医药领域,具体而言,涉及口服诺如病毒亚单位疫苗及dmlt作为该疫苗佐剂,用于预防诺如病毒感染的用途。
背景技术:
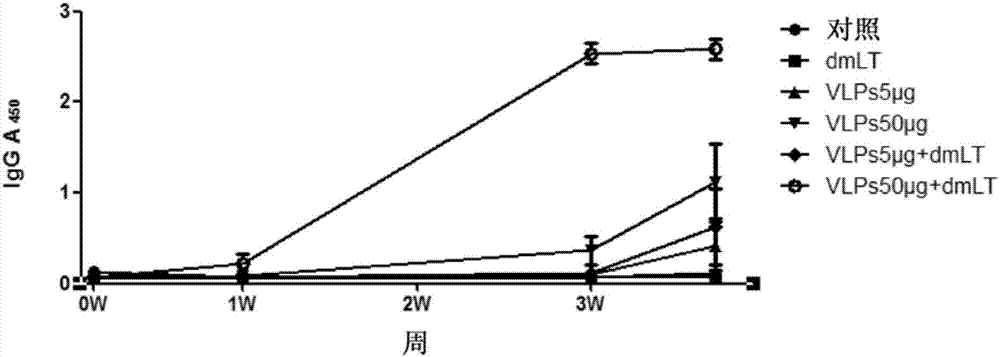
:继轮状病毒疫苗大规模使用后,诺如病毒已成为全球病毒感染性急性胃肠炎的首要病因。流行病学资料显示目前超过50%的病毒性胃肠炎均由诺如病毒感染引起,其传染性较强,可通过污染的水源、食物、物品接触、空气等传播,常在社区、学校、餐馆、医院、托儿所、孤老院及军队等人员密集处引起规模性暴发流行,且在全年各季节中均有发生。由于诺如病毒感染后没有特效抗病毒药物治疗,导致在免疫力较弱的婴幼儿及老年人中的死亡率较高,加之大范围爆发流行会引发一系列公共卫生问题,造成严重的社会经济损失,因此,研发可有效预防该病毒传播导致疾病的疫苗迫在眉睫。长期以来,诺如病毒疫苗的研发受病毒不能培养、缺乏合适的实验模型导致保护效果难以评价的技术瓶颈制约而徘徊不前。目前,通过基因工程技术表达诺如病毒的衣壳蛋白可自我组装形成病毒样颗粒(vlps)。有动物及临床实验结果表明,诺如病毒vlps具有很好的免疫原性,通过注射途径免疫诺如病毒vlps可诱导出较好的系统性体液免疫应答(抗体反应)。由于诺如病毒主要通过胃肠道感染,一个可有效预防病毒感染的疫苗应具备可诱导全面、系统的保护性免疫,包括肠道局部粘膜免疫应答和系统性保护性免疫反应的特质,这对一个新型疫苗是否可发挥有效免疫保护作用至关重要。尤其在病毒感染初期,肠道局部的特异性免疫力将发挥重要的抗病毒作用。然而,免疫学研究表明,通过注射途径呈递的疫苗将难以诱导肠道粘膜局部的免疫应答,只有经粘膜途径呈递疫苗抗原才能同时诱导粘膜局部及系统性免疫反应。目前,尚未见经口服途径呈递免疫诺如病毒vlps引起肠道粘膜局部(包括肠道粘膜表皮内和粘膜下固有层)抗感染类t细胞免疫反应的报道。一个经口服呈递并被证明具有可刺激肠道粘膜局部和全身系统性抗感染保护性免疫反应的疫苗无疑对诺如病毒疫苗的研发是个突破。技术实现要素:本发明的目的是提供一种可经粘膜途径呈递的口服诺如病毒亚单位疫苗,其可以预防诺如病毒感染,或具有潜在的治疗作用。为实现该目的,本发明提供了:(1)一种口服诺如病毒亚单位疫苗,包含一种或多种基因型的诺如病毒vlps,其特征在于所述口服诺如病毒亚单位疫苗包含减毒的且具有粘膜免疫佐剂效应的大肠杆菌不耐热肠毒素作为佐剂,其中所述亚单位疫苗的单次口服剂量为每种所述诺如病毒vlps50-7500μg,佐剂10-100μg。(2)根据(1)所述的口服诺如病毒亚单位疫苗,其中所述亚单位疫苗的单次口服剂量为每种所述诺如病毒vlps50-5000μg,优选100-5000μg,更优选150-3000μg,所述佐剂10-50μg,更优选10-30μg。(3)根据(1)所述的口服诺如病毒亚单位疫苗,其中所述亚单位疫苗通过含服或吞服施用。(4)根据(1)所述的口服诺如病毒亚单位疫苗,其中所述亚单位疫苗的施用方案为,以单次口服剂量免疫2-5次,每次间隔1-2周。(5)根据(1)所述的口服诺如病毒亚单位疫苗,其中所述减毒的且具有粘膜免疫佐剂效应的大肠杆菌不耐热肠毒素为双突变大肠杆菌不耐热肠毒素。(6)根据(5)所述的口服诺如病毒亚单位疫苗,其中所述双突变为a亚基r192g和l211a双突变。(7)根据(1)所述的口服诺如病毒亚单位疫苗,其中所述诺如病毒vlps采用大肠杆菌原核系统、酵母菌表达系统或昆虫细胞表达系统表达。(8)根据(1)所述的口服诺如病毒亚单位疫苗,其中所述诺如病毒vlps的基因型包括gi基因群1、2、3、4、9型;gii基因群1、2、3、4、6、7、p7、17、p17型;以及giv基因群1型。(9)减毒的且具有粘膜免疫佐剂效应的大肠杆菌不耐热肠毒素作为口服诺如病毒亚单位疫苗的佐剂的用途。(10)根据(9)所述的用途,其中所述诺如病毒亚单位疫苗能够引起系统性和肠道局部粘膜保护性体液免疫、以及肠道粘膜抗感染淋巴细胞免疫。本发明与现有技术相比具有以下优点和积极效果:1.根据诺如病毒经粘膜途径感染的特点,经过构思和设计疫苗策略,并且经过大量的实验摸索和验证,本发明在诺如病毒疫苗的配方中引入了减毒的、具有粘膜免疫佐剂效应的大肠杆菌不耐热肠毒素作为疫苗佐剂,从而获得了可经口服呈递的、效果理想的诺如病毒亚单位疫苗。2.本发明进一步通过理论研究和具体实验摸索,确定了诺如病毒vlps和所述粘膜免疫佐剂适于经口服呈递并协同引发粘膜局部和系统性免疫应答,确定了保护性抗感染效应的最佳用量范围。3.本发明通过实验验证发现,所述诺如病毒亚单位疫苗在口服呈递之后,在诱导肠道局部粘膜特异性体液(iga)免疫及抗感染性细胞免疫应答(包括th1、ctl细胞和th17细胞免疫反应)的同时,也诱发了较强的具有中和抗体活性的系统性免疫反应,使得该疫苗能够提供更加全面的保护性免疫,是一种具有极大潜力的针对诺如病毒感染的候选疫苗。4.本发明针对所述疫苗的免疫效果所进行的大量且尽可能全面的实验验证,使得该疫苗的预防效果更加具有明确性和可靠性,从而有助于其实际应用。5.由于本发明的诺如病毒亚单位疫苗可经过口服呈递,其具有可能与其他预防腹泻的口服疫苗(比如轮状病毒疫苗)相联合的显著优势,从而研发出可提供更多病原保护的联合疫苗。附图说明图1示出了昆虫细胞表达的诺如病毒vlps联合dmlt二次和三次口服免疫小鼠后2w的血清igg分析。图2示出了酵母细胞表达的诺如病毒vlps联合dmlt口服免疫小鼠前后的血清igg分析。图3示出了酵母细胞表达的诺如病毒vlps联合dmlt末次口服免疫小鼠3天后的血清igg滴度分析。图4示出了酵母细胞表达的诺如病毒vlps联合dmlt口服免疫小鼠后的血清igg亚型分析。图5示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠前后的血清igg分析。图6示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt末次免疫小鼠3天后的血清igg滴度分析。图7示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠后的血清igg亚型分析。图8示出了酵母细胞表达的诺如病毒vlps联合dmlt口服疫小鼠后的血清igg模拟中和抗体实验分析。图9示出了酵母细胞表达的诺如病毒vlps联合dmlt口服免疫小鼠后的血清中和抗体阻断率。图10示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠后的血清igg模拟中和抗体实验分析。图11示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠后的血清中和抗体阻断率。图12示出了酵母细胞表达的诺如病毒vlps联合dmlt口服免疫小鼠前后的粪便iga分析。图13示出了酵母细胞表达的诺如病毒vlps联合dmlt口服免疫小鼠后的小肠灌洗液iga分析。图14示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠前后的粪便iga分析。图15示出了酵母细胞表达的诺如病毒vlps联合dmlt口服免疫小鼠后的脾脏th17淋巴细胞反应。图16示出了酵母细胞表达的诺如病毒vlps联合dmlt口服免疫小鼠后的大肠局部ielth17淋巴细胞反应。图17示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠后的脾脏th17淋巴细胞反应。图18示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠后的mlnth1淋巴细胞免疫反应。图19示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠后的mlnctl淋巴细胞免疫反应。图20示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠后的大肠局部ielth17淋巴细胞反应。图21示出了提高口服剂量的酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠后的大肠局部lplth17淋巴细胞反应。具体实施方式以下通过具体实施方式的描述并参照附图对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。本发明提供了一种口服诺如病毒亚单位疫苗,包含一种或多种基因型的诺如病毒vlps,其特征在于所述诺如病毒亚单位疫苗包含减毒的且具有粘膜免疫佐剂效应的大肠杆菌不耐热肠毒素作为佐剂,其中所述亚单位疫苗的单次口服剂量为每种所述诺如病毒vlps50-7500μg,佐剂10-100μg。本发明有目的的设计诺如病毒疫苗能够经过口服呈递。然而,将面临并解决诸多技术难点。由于蛋白性疫苗抗原是经过口服呈递,因此将经历胃酸的破坏、胃粘膜屏障的阻碍、肠道微生物的干扰等一系列环节。通常认为口服以蛋白性抗原为主要成分的疫苗难以刺激保护性免疫,尤其是肠道局部粘膜免疫的产生,即使产生免疫反应也将会较弱,难以提供抗感染免疫保护力。本发明通过巧妙的构思和设计,并结合大量具有技术难度的实验方法验证,首次提出并证明了将诺如病毒vlps与粘膜免疫佐剂dmlt组合,经口服可以刺激产生肠道粘膜局部(包括肠道粘膜表皮内和表皮下固有层)保护性免疫反应。本发明进一步通过理论研究和大量的动物实验验证,发现将诺如病毒vlps和减毒的且具有粘膜免疫佐剂效应的大肠杆菌不耐热肠毒素组合制备亚单位疫苗,能够通过口服呈递蛋白性疫苗抗原,突破粘膜免疫屏障,从而实现引起系统性和肠道粘膜局部保护性体液免疫、以及肠道粘膜抗感染淋巴细胞免疫的效果,达到了口服疫苗诱导保护性免疫的作用。此外,本发明通过动物实验,摸索出了在所述疫苗中,诺如病毒vlps和所述佐剂的最适比例和用量范围,并且基于该动物实验的用量范围,将vlps剂量按照50倍放大,得到了该疫苗的临床使用最大剂量,为150μg×50=7500μg/单次剂量,佐剂剂量按照10倍放大,得到了该疫苗的佐剂的临床使用最大剂量,为100μg/单次剂量。理论上,口服制剂通过消化途径投递,除了要避开胃液的低ph对抗原和佐剂的降解之外,还要避开胃液和肠道消化液的消化作用。因此,其临床免疫剂量较注射途径大,一般需要放大为动物试验的10-50倍。如目前已研发、结果发表于lancet的幽门螺杆菌口服蛋白疫苗,在iii期临床研究中显示出较好的安全性和有效性,其抗原用量为15000μg/单次剂量。另一方面,在有适宜投递系统如纳米颗粒、微球制剂等保护疫苗抗原和佐剂的情况下,所需抗原和佐剂的临床用量较小,因此,本发明中的临床最低使用剂量为动物试验中所用的剂量。本文所用的术语“亚单位疫苗”是指利用基因工程重组技术表达的诺如病毒衣壳蛋白自发组装的病毒样颗粒(virus-likeparticles,vlps)。优选地,所述亚单位疫苗的单次口服剂量为每种所述诺如病毒vlps50-5000μg,优选100-5000μg,更优选150-3000μg;所述佐剂10-50μg,更优选10-30μg。本发明所述的亚单位疫苗通过口服施用,例如通过含服或吞服施用。本发明所述亚单位疫苗的施用方案优选为以单次口服剂量免疫2-5次,每次间隔1-2周。在本发明的亚单位疫苗中,所述减毒的且具有粘膜免疫效应的大肠杆菌不耐热肠毒素优选为双突变大肠杆菌不耐热肠毒素。所述双突变可以为a亚基r192g和l211a双突变。在本发明的亚单位疫苗中,所述诺如病毒vlps可以采用大肠杆菌原核系统、酵母菌表达系统或昆虫细胞表达系统表达。该诺如病毒vlps的基因型包括gi基因群1、2、3、4、9型;gii基因群1、2、3、4、6、7、p7、17、p17型;以及giv基因群1型。其中最优选gii基因群4型的vlps。vlps可以是单独的全长或截短的主要结构蛋白vp1或其衍生物自我组装而成,也可以是在此基础上同时包含了次要结构蛋白vp2组装而成。不同基因型的vp1高度变异区上有不同的基因序列,目前认为是免疫识别和受体结合的关键部位。本发明还提供了减毒的且具有粘膜免疫效应的大肠杆菌不耐热肠毒素作为诺如病毒亚单位疫苗的佐剂的用途。所述诺如病毒亚单位疫苗能够引起系统性和肠道粘膜局部体液免疫、以及肠道局部粘膜抗感染淋巴细胞免疫应答。以下通过实施例的方式进一步解释或说明本发明的内容,但这些实施例不应被理解为对本发明的保护范围的限制。实施例实施例所用材料和仪器的来源如下:昆虫细胞表达的vlps由武汉生物制品研究所病毒性疫苗研究一室提供。汉逊酵母细胞表达的vlps由北京生物制品所第六研究室提供。dmlt(a亚基r192g和l211a双突变)来自美国path组织。清洁级动物购自维通利华公司。bsa(牛血清白蛋白,bovogen,货号bsas100)山羊抗小鼠igg酶标抗体(购自博士德生物)igg酶标分型抗体(southernbiotech)iga酶标抗体(abcam)dmem培养基(gibco,货号11885-084)fcs(胎牛血清,gibco,货号10099-141)dtt(二硫苏糖醇,thermo,货号20291)d-hank,s缓冲液(generaybiotech,货号:920091)percoll细胞分离液(ge)胶原酶d(roche,货号11088882001)dnasei(roche,货号10104159001)dispase(roche,货号04942078001)淋巴细胞刺激液(ebioscience,货号:00-4975)cd3-fitc(bd,货号:553061)cd4-apc(bd,货号:553051)cd8-percp(bd,货号:553036)il-17pe(bd,货号:554412)ifn-γpe(bd,货号:559502)离心机(sigma,型号3-18k)37℃孵育箱(thermo,型号371)流式细胞仪(bd,型号facscalibur)酶标仪(thermo,型号mk3)中性亲和素包被微孔板(thermoscientific,货号:15508)h(3型)-paa-生物素(glycotech,货号:01-060)hrp标记的诺如病毒vlps特异性兔多克隆抗体,自制,其方法为本领域的常规方法,故不赘述。以下实施例中用到的诺如病毒vlps是通过昆虫细胞或汉逊酵母细胞表达系统表达的诺如病毒gii基因群4型vlps。其方法为本领域的常规方法,故不赘述。以下实施例中用到的pbs的配方如下:0.02mpbs,ph7.4:5.8gna2hpo4.12h2o,0.593gnah2po4.12h2o,8.0gnacl,加去离子水定容至1000ml。实施例1昆虫细胞表达vlps联合dmlt经口服呈递给balb/c小鼠后的免疫应答将5周龄雌性balb/c小鼠分为5组,包括空白组(未免疫)、pbs组(用pbs免疫)、佐剂dmlt组、低剂量vlps+佐剂dmlt组、高剂量vlps+dmlt组,分组及免疫剂量如表1所示。每组6只小鼠,在第0、7、21天口服灌胃进行免疫,共免疫三次。每次免疫前及末次免疫后2周,采集眼眶血及粪便,分别测定血清igg和粪便iga。表1小鼠试验分组及免疫剂量表组别口服vlps(μg/只/次)dmlt(μg/只/次)1空白对照组002pbs组003dmlt组0104低剂量vlps+dmlt组5105高剂量vlps+dmlt组5010用elisa方法进行血清igg检测,具体如下:将诺如病毒vlps(gii基因群4型vlps)以2μg/ml加入包被液(na2co30.159g,nahco30.293g,去离子水100ml,ph9.6),按100μl/孔包被酶标板,置于4℃包被过夜;倒出包被液,pbst(0.02mpbs+0.05%tween20,ph7.5)洗液洗板3次,加入含1%bsa的封闭液(0.02mpbs+0.2%tween20+1%bsa,ph7.2),37℃封闭2小时;pbst洗液洗涤3次;每孔加入90μl的含1%bsa的pbst,然后加预先400倍稀释的待测样品10μl,37℃孵育30分钟;pbst洗液洗涤5次后加入稀释至工作浓度(1:8000稀释)的酶标抗体(山羊抗小鼠igg酶标抗体),37℃孵育30分钟;pbst洗液洗涤5次后,加入tmb显色液a/b液,37℃孵育10分钟;用2mh2so4终止反应,反应孔由蓝变黄;用酶标仪检测在450nm波长时各个反应孔的光吸收值。结果见图1。图1显示的是elisa法检测昆虫细胞表达的诺如病毒vlps口服免疫balb/c小鼠二次和三次后2周的血清igg平均吸光值(血清1:4000倍稀释)。结果表明在诺如病毒vlps联合使用dmlt佐剂的条件下,抗体表达水平与对照组相比较存在差异(图中*表示p<0.05)。佐剂剂量相同,抗原量提高10倍,二免及三免后14天抗体水平均高于低剂量组。总之,dmlt联合诺如病毒vlps经口服免疫可以有效刺激小鼠产生体液免疫应答。实施例2酵母菌表达诺如病毒vlps联合dmlt经口服呈递给balb/c小鼠后的免疫应答为了证实vlps与粘膜免疫佐剂共同口服免疫小鼠才能引起明显的肠道粘膜免疫应答,在实施例1的基础上增加了单独vlps组,具体的试验分组和免疫剂量见表2。表2试验分组及免疫剂量组别口服vlps(μg/只)dmlt(μg/只)1空白对照组002dmlt组0103vlps低剂量组504vlps高剂量组5005低剂量vlps+dmlt组5106高剂量vlps+dmlt组5010检测方案上,除了按照实施例1的方法免前及末次免疫3天后,采集眼眶血及粪便,分别测定血清igg、粪便iga外,增加了肠道盥洗液iga检测,以及模拟中和抗体检测,并在末次免疫3天后采取小鼠脾、及肠道组织进行细胞免疫分析。用间接elisa法进行血清igg、粪便和肠道盥洗液iga检测,具体如下:将诺如病毒vlps以1μg/ml加入包被液(na2co30.159g,nahco30.293g,去离子水100ml,ph9.6)按0.1μg/孔包被酶标板,置于4℃冰箱过夜;倒掉包被液,加入含5%脱脂奶粉的pbs溶液,37℃封闭2小时;pbst洗液洗涤三次后分别加用pbst稀释液稀释的待测样品(血清1:100或按梯度倍比稀释,粪便收集液及肠道盥洗液均按1:3稀释,37℃孵育2小时;pbst洗液洗涤三次后加入稀释至工作浓度的酶标抗体(山羊抗小鼠igg酶标抗体,igg酶标分型抗体,iga酶标抗体),37℃孵育30分钟;pbst洗液洗涤七次后,加入tmb显色液a/b液,37℃孵育10分钟;用2mh2so4终止反应,反应孔由蓝变黄;用酶标仪检测在波长为450nm时各个反应孔的光吸收值(a)。结果见图2~4和图12~13。图2显示的是血清igg抗体检测结果,二次和三次口服免疫后,vlps50μg+dmlt组能诱导产生较好的血清igg免疫反应。对三次口服免疫后的血清进行igg抗体滴度检测,结果如图3所示,所有抗原组均诱导balb/c小鼠产生了特异性igg抗体。vlps50μg+dmlt组诱导产生的igg抗体水平显著高于未联合dmlt的单独vlps50μg组(图中*表示p<0.05),显示出dmlt较强的粘膜免疫佐剂效应。另外,无论是否联合dmlt,酵母细胞表达的诺如病毒vlps在口服免疫balb/c小鼠时,50μgvlps诱导的igg抗体水平均高于5μg剂量组,显示出剂量效应(图中**表示p<0.01)。对三次口服免疫后vlps50μg+dmlt组血清igg抗体进行亚型分析,结果如图4所示,抗体igg反应主要以igg1为主(图中***表示p<0.001),说明vlps联合dmlt口服免疫小鼠引起的免疫反应以th2为主。三次口服免疫后,采用合成hbga(histobloodgroupantigen,组织血型抗原)-vlps阻断试验作为诺如病毒疫苗中和抗体检测的替代方法,检测血清中和抗体。具体如下:1)将h(3型)-paa-生物素按0.25μg/ml加入亲和素包被微孔板中,置于25℃孵育1h;弃掉板内溶液,pbs-t(0.02mpbs+0.05%tween20,ph7.5)洗板3次,备用;2)待测血清2倍系列稀释;取一新的微孔板,将待测血清与0.096μg诺如病毒vlps等体积充分混合,同时设立阳性对照(无血清)及空白对照(无vlp);将含有稀释样品的微孔板置于37℃孵育1h;3)将vlps-血清复合物100μl,加入步骤1)的微孔板中,微孔板置于4℃孵育2h;弃掉板内溶液,pbst洗液洗板3次;hrp标记的诺如病毒vlps特异性兔多克隆抗体1:16000倍稀释后,加入微孔板中,每孔100μl,置于4℃孵育1h;弃掉板内溶液,pbst洗液洗板3次;4)显色:加入tmb显色液a/b液,37℃孵育10分钟;用2mh2so4终止反应,酶标仪检测(450nm/630nm双波长)各个反应孔的光吸收值。结果见图8、图9。图8显示的是酵母细胞表达的诺如病毒vlps联合dmlt免疫小鼠血清模拟中和抗体检测结果,纵坐标代表小鼠血清hbga半数阻断滴度(bt50)。和血清igg抗体水平的结果一致,vlps50μg+dmlt组诱导产生了较高水平的中和抗体(图中**表示p<0.01),说明dmlt作为诺如病毒vlps粘膜佐剂,能够诱导出高水平的中和抗体。对中和抗体的阻断率进行分析,结果如图9所示,高剂量vlps50μg+dmlt组血清稀释倍数为80时,阻断率仍大于50%。图12显示的粪便iga检测结果,和血清igg抗体检测结果一致,二次和三次口服免疫后,vlps50μg+dmlt组能诱导产生较好的粘膜iga免疫反应。为了更好的显示诺如病毒致病部位的局部分泌性iga抗体反应情况,对三次口服免疫后小肠盥洗液iga进行检测,结果如图13所示,联合了dmlt的vlps50μg+dmlt组和单独vlps50μg组均诱导产生了特异性局部粘膜iga抗体反应(图中*表示p<0.05),其中vlps50μg+dmlt组诱导的siga水平显著高于vlps5μg+dmlt组和单独vlps50μg组(图中**表示p<0.01)。另外,vlps5μg+dmlt组诱导产生的siga水平与未联合dmlt的单独vlps50μg组水平相当(p=0.427),说明dmlt作为酵母细胞表达的诺如病毒vlps粘膜免疫佐剂,除了能诱导产生较好的体液免疫反应外,还能诱导产生较好的局部粘膜免疫反应,在实际应用中可以大大降低口服抗原用量。细胞免疫分析时,先进行淋巴细胞制备,再进行淋巴细胞表面和胞内细胞因子染色,其中脾淋巴细胞的制备如下:摘取小鼠脾脏,应用红细胞裂解法制备脾淋巴细胞,该实验采用领域常规技术,故不赘述。肠道iel(上皮内淋巴细胞)的制备如下:将大小肠分开分别操作。纵向剪开肠壁,涮洗干净肠内容物,将大小肠分别切成0.5-1cm左右的肠段,转入15ml含有1mmdtt的消化液(含10%fcs,1mmdtt的dmem培养基)中,37℃消化45分钟,细胞滤网过滤离心,取沉淀(含iel)。用含10%fcs、40%percoll的dmem培养基悬浮,轻轻吸入到含10%fcs、80%percoll的dmem培养基上(不要混匀),500g,室温离心30分钟,取中层液相即为iel。淋巴细胞表面及胞内细胞因子染色时,使用96孔细胞培养板,每孔加入100μl上述制备的细胞悬液及100μl淋巴细胞刺激液,37℃,5%co2孵育5小时后离心,分别用cd3-fitc、cd4-apc或cd8-percp进行细胞表面染色(即,每孔各加不同荧光标记的抗体试剂1μl,4℃避光放置30分钟),然后用4%多聚甲醛固定,4℃暗处放置过夜。第二天,破膜后用il-17pe或ifn-γpe进行细胞内细胞因子染色(每孔加标定工作浓度(工作浓度是0.5μl/100μl)的荧光标记的抗体试剂0.5μl,4℃避光放置30分钟),4℃300g离心洗涤后,加入细胞染色液(含2%bsa的pbs)悬浮细胞,之后转入流式小管,使用流式细胞仪检测分析。结果见图15及16。图15及16分别显示的是三次口服免疫后,各组小鼠脾脏及大肠iel中分泌il-17的cd4+t淋巴细胞百分比,其中a为流式图,b为统计图。结果显示,vlps50μg+dmlt组小鼠均检测到了明显的th17细胞反应,高于或显著高于空白对照组、单独vlps50μg组和vlps5μg+dmlt组小鼠(图中*表示p<0.05,**表示p<0.01),而且脾脏的th17细胞反应显著高于dmlt组(图中**表示p<0.01)。单独vlps免疫组与空白对照组小鼠无差异,且低剂量vlps组无论是否联合dmlt均未检测到明显的th17细胞反应,说明dmlt作为酵母细胞表达诺如病毒vlps的粘膜免疫佐剂,能诱导balb/c小鼠产生明显的th17细胞免疫反应,且存在抗原剂量依赖效应。实施例3提高剂量的酵母菌表达诺如病毒vlps联合dmlt经口服呈递给balb/c小鼠后的免疫应答由于5μg剂量抗原组联合dmlt佐剂后,没有像50μg剂量抗原组一样诱导出明显可见的th17细胞反应,为了进一步探究酵母细胞表达vlps联合dmlt以后的免疫反应,本实施例在实施例2的基础上,进一步提高了抗原口服剂量,具体的试验分组和免疫剂量见表3。检测方案上,除了不再检测肠道盥洗液iga外,增加了末次免疫3天后大肠固有层淋巴细胞(lpl)及肠系膜淋巴结(mln)淋巴细胞的细胞免疫分析(分析所用检测试剂与实施例2所述相同),其余均同实施例2。其中大肠lpl的制备是将大肠iel制备中消化后的残余组织,用d-hank,s缓冲液清洗干净后,切成1mm左右的肠段,放入消化液(含10%fcs、0.5mg/ml胶原酶d、0.5mg/mldnasei、4mg/mldispase的dmem培养基)中,37℃消化30分钟,细胞滤网过滤后离心,取沉淀,余下操作同实施例2中大肠iel的制备。mln淋巴细胞的制备是摘取小鼠mln,轻轻研磨至单细胞悬液,细胞滤网过滤离心,沉淀用rpmi1640洗一遍即为mln淋巴细胞。表3试验分组及免疫剂量组别口服vlps(μg/只)dmlt(μg/只)1空白对照组002dmlt组0103vlps低剂量组5004vlps高剂量组15005低剂量vlps+dmlt组50106高剂量vlps+dmlt组15010图5显示的是血清igg抗体检测结果,联合dmlt的vlps150μg+dmlt组诱导产生的体液igg免疫反应最为强烈。对三次口服免疫后的血清进行igg抗体滴度检测,结果如图6所示,vlps150μg+dmlt组诱导产生的igg抗体水平高于未联合dmlt的单独vlps150μg组(图中*表示p<0.05),显示出dmlt较强的粘膜免疫佐剂效应。对三次口服免疫后血清igg抗体进行亚型分析,结果如图7所示,抗体igg反应主要以igg1为主。图10显示的是模拟中和抗体实验结果,纵坐标代表达到半数抑制量时血清稀释倍数(bt50)。结果表明150μg剂量组在联合dmlt佐剂后产生了很好的阻断病毒作用,并优于无佐剂组(图中*表示p<0.05),阻断效果最好。图11示出诺如病毒vlps联合dmlt口服免疫血清10倍稀释时的中和抗体阻断率,150μgvlps抗原联合dmlt组的阻断率较高,而单独vlps150μg组只部分产生中和抗体(图中*表示p<0.05),所以dmlt具有非常好的口服免疫佐剂效应。图14显示的是粪便iga检测结果。和血清igg抗体检测结果一致,二次和三次口服免疫后,vlps150μg+dmlt组能诱导产生较好的粘膜iga免疫反应。图17~21分别显示的是三次口服免疫后,各组小鼠脾脏、mln、大肠iel及lpl的检测结果,其中a为流式图,b和c分别为百分率和细胞数量绝对值的统计图。结果显示,即便是将抗原剂量提高至150μg,在没有联合dmlt佐剂的情况下,在脾、大肠及mln中也均不能诱导产生高于空白对照组小鼠的细胞免疫反应,而联合dmlt后则在脾脏中可引起高于空白对照组、dmlt组、单独vlps150μg组和低剂量vlps50μg+dmlt组的th17细胞反应(图中*表示p<0.05),显示dmlt对诺如病毒vlps口服免疫具有良好的佐剂效应,且存在抗原剂量依赖关系,如图17所示。无论是50μg还是150μg剂量组,联合dmlt后与空白对照组和单独vlps组相比,均能引起mln明显的细胞反应,包括th1(见图18,图中*表示p<0.05)和ctl(见图19,图中*表示p<0.05)。更重要的是,提高口服剂量后,诱导了诺如病毒致病部位大肠局部的iel和lpl的th17细胞免疫反应。vlps150μg+dmlt组小鼠,在大肠iel中诱导的th17细胞免疫应答高于空白对照组、dmlt组和单独vlps150μg组,也显示了dmlt的佐剂效应(见图20,图中*表示p<0.05)。对大肠lpl细胞免疫结果的分析显示,联合了dmlt佐剂的vlps组小鼠均产生了高于空白对照组和dmlt组的细胞免疫反应,并且vlps150μg+dmlt组诱导的th17细胞应答高于低剂量vlps50μg+dmlt组(见图21,图中*表示p<0.05),显示了抗原剂量依赖关系。综上所述,酵母细胞表达诺如病毒vlps联合dmlt粘膜免疫佐剂,经口服免疫balb/c小鼠,可以诱导产生显著系统性体液免疫应答,包括血清igg抗体和保护性中和抗体反应,同时可以诱导产生粘膜局部siga和细胞免疫反应,包括脾脏th17细胞免疫反应和腹腔淋巴结(mln)th1细胞免疫反应,以及致病部位的局部th17细胞免疫反应。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1