胺基二硫代甲酸盐衍生物在抗菌领域的应用的制作方法
本发明属于药物化学
技术领域:
,涉及胺基二硫代甲酸盐衍生物作为新型金属β-内酰胺酶抑制剂在抗菌领域的应用。
背景技术:
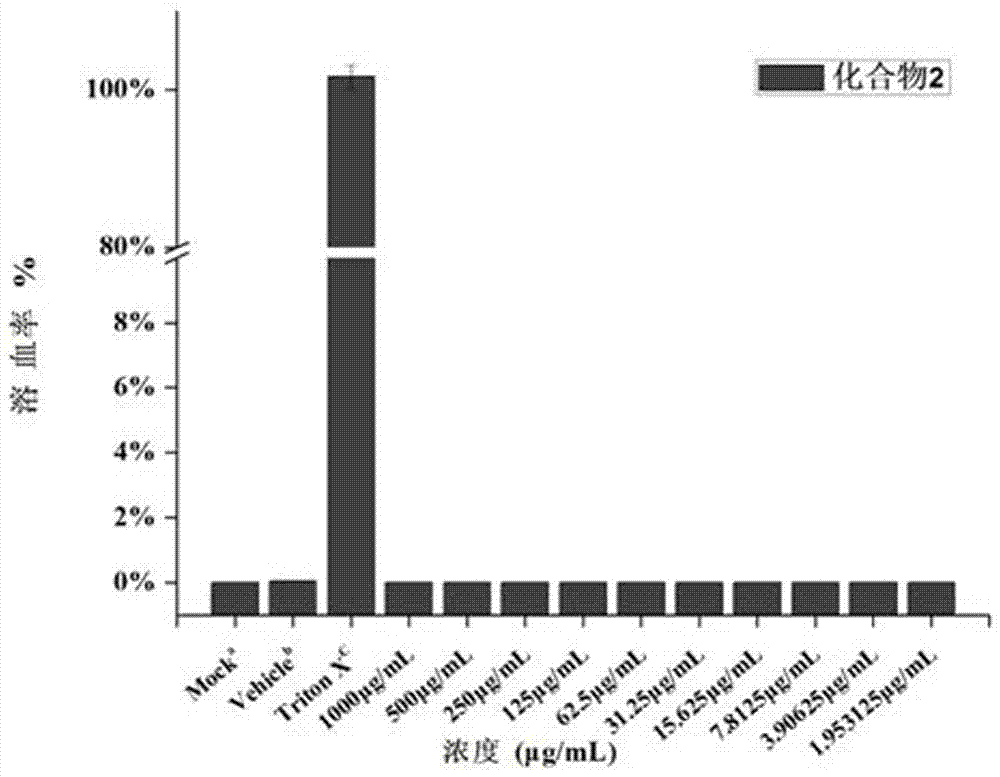
:抗生素耐药(antimicrobialresistance,amr)趋势如同幽灵一般不知不觉的侵袭了全球(microbiologyandmolecularbiologyreviews2010,74,417.)。抗生素产生耐药性已经成为公共卫生安全的主要威胁(naturereviewsmicrobiology2015,13,42.)。细菌耐药的原因可以归结为细菌染色体突变和耐药基因水平传播两个方面。其中,细菌固有耐药是细菌自身所具备的本能。而由耐药基因的水平传播而导致的获得性耐药的产生(nature2004,430,242.)是导致耐药性播散和多重耐药菌产生的重要原因。β-内酰胺类抗生素(青霉素,头孢菌素,碳青霉烯类和单环内酰胺类)是多年来临床广泛使用治疗细菌感染的重要抗生素。β-内酰胺酶的出现是目前临床上使用β-内酰胺类抗生素受限的主要问题,β-内酰胺酶可以通过水解β-内酰胺环,使β-内酰胺类抗生素失效(biochemistry,1999,38,10013.)。在临床用药以及动物生产中β-内酰胺类抗生素的不规范使用和滥用,造成耐药性问题更加严重(emerginginfectiousdiseases2002,8,347.)。碳青霉烯类β-内酰胺抗生素(如亚胺培南和美罗培南)被认为是治疗严重感染和全身感染最有效的药物,因为它们对绝大多数β-内酰胺酶高度稳定。然而,随着碳青霉烯类药物的消费量在过去二十年中一直在稳步增长,能够水解碳青霉烯类抗生素的酶已经出现,并且主要在革兰氏阴性细菌中传播,导致细菌对这一类药物产生抗性,严重威胁临床抗感染治疗。根据氨基酸序列同源性差异,β-内酰胺酶按照ambler分类法被分为a,b,c和d类。其中丝氨酸-β-内酰胺酶包含a,c和d三类,它们通过丝氨酸残基与β-内酰胺抗生素通过共价结合而使抗生素失活(biologicalsciences1980,289,321-331)。临床上所使用的β-内酰胺酶抑制剂为丝氨酸-β-内酰胺酶抑制剂,如克拉维酸,舒巴坦和他唑巴坦等。金属β-内酰胺酶(mbls,amblerb类)在其活性位点含有一个或两个锌离子,其通过极化水分子促进β-内酰胺的亲核攻击(biochemicaljournal1998,331(pt44),703)。mbls对丝氨酸-β-内酰胺酶抑制剂不敏感,并且可以水解在临床中应用的大多数β-内酰胺抗生素,针对其有效的抑制剂目前在临床中还没有应用。2014年,gerardd.wright等人报道了从真菌中得到的一种天然的化合物ama,它可以快速、有效的抑制含有ndm-1型金属β-内酰胺酶的活性,与美罗培南联合用药的情况下可使产ndm-1酶菌株对美罗培南恢复敏感(nature2014,510,503.)。2015年,sabihay.essack等人报道了两种锌离子螯合剂nota和dota,此两种螯合剂可以携带金属β-内酰胺酶的菌株恢复对碳青霉烯类抗生素的敏感性(journalofantimicrobialchemotherapy2015,70,1594.)。2015年,西北大学杨科武课题组报道了一系列巯基乙酸硫酯氨基酸衍生物,其对于金属β-内酰胺酶l1的ic50最小可以达到18nm,但是其体外活性实验证明其恢复美罗培南敏感性效果并不理想(acsmedicinalchemistryletters2015,6,660.)。二硫代甲酸盐是一类运用非常广泛的有机物。其广泛应用于农业、工业、环境污染、医药等领域。其医药领域的研究目前处于发展期,例如,二乙基二硫代氨基甲酸钠(ddtc)被临床用于免疫调节剂用来治疗艾滋病(中国专利,专利号:93100610);ddtc可以抑制细胞超氧化酶的活性,导致细胞缺氧达到治疗癌症的目的(biochemicalpharmacology1979,28,27.);由于其分子中的硫原子带负电可以结合金属离子,所以又作为解毒剂用于人体金属中毒,针对二硫代氨基甲酸盐(dtc)作为碳酸酐酶抑制剂被报道,其中(ibu)2-dtc对于hcai、hcaii和hcaix碳酸酐酶的ki分别为0.97、0.95和4.5(bioorganicmedicinalchemistry2013,21,1516.)。通过小分子药物来进行疾病相关酶的活性干预,是一种对于人类疾病具有前景的药理学干预方法。目前未见胺基二硫代甲酸盐衍生物作为金属β-内酰胺酶抑制剂在抗菌领域的应用。技术实现要素:本发明目的在于提供胺基二硫代甲酸盐衍生物作为新型金属β-内酰胺酶抑制剂在抗菌领域的应用。为实现本发明目的,技术方案如下:首先合成了10个胺基二硫代甲酸盐衍生物,并对它们进行了核磁共振氢谱和碳谱的确证。在随后的抗菌生物评价过程中,发现该类化合物可以提升美罗培南对于耐药菌株的敏感性,它们的结构如下:测试了该类化合物1-10与抗生素美罗培南(mem)的联用实验数据;对部分化合物1,2和7体外红细胞溶血进行了实验;对化合物1,2和7体外hela(海拉癌细胞株)细胞毒进行了实验;对化合物1,2和7体外对于大肠埃希菌(blaimp)的杀菌动力学进行了实验;并进行了化合物1,2,7和nota在体外与美罗培南(mem)、zn2+协同用药对比实验。结果发现,化合物1-10作为胺基二硫代甲酸盐衍生物,可以不同程度上恢复产金属β-内酰胺酶菌株对美罗培南的敏感性。可以作为新型金属β-内酰胺酶抑制剂在抗菌领域应用。本发明优点及创新点在于:发现胺基二硫代甲酸盐衍生物的新用途,将用于抑制碳酸酐酶的抑制剂,作为新型金属β-内酰胺酶抑制剂在抗菌领域得到应用,并且发现该类化合物与美罗培南协同用药具有很好的杀菌效果。由锌离子参与的协同用药所引起结果的改变推测,化合物可能是由于和金属β-内酰胺酶中的锌离子结合导致该酶失活。该应用将有利于开发新型金属β-内酰胺酶抑制剂。附图说明图1为本发明化合物1、2和7的纸片扩散法药敏实验结果,选用乙二胺四乙酸(edta)作为对照药物,美罗培南(mem)作为抗菌化合物,选取产ndm-1或imp酶的菌株14-50(大肠埃希菌,携带blandm-4基因)和15-101(阴沟肠杆菌,携带blaimp基因)进行测试,药敏实验结果的判断与操作遵循美国临床和实验室标准协会(clinicalandlaboratorystandardsinstitute,clsi-m07-a9)规定。使用药敏纸片直径为6mm。1-a图中,a-mem,b-mem和本发明化合物1,c-mem和本发明化合物2,d-mem和edta;1-b图中,a-mem,b-mem和edta,c-mem和本发明化合物7;由图可知,化合物1、2和7在与mem协同用药后使得mem敏感性增大,抑菌圈随之增大。图2为本发明化合物1,2和7体外红细胞溶血性的实验结果,其中,2a-本发明化合物1,2b-本发明化合物2,2c-本发明化合物7。由图可知,本发明化合物1,2和7在1000μg/ml时红细胞的溶血率仍旧小于1%。由此可以证明,本发明化合物1,2和7对红细胞在1000μg/ml的范围内几乎不存在毒性。图3为本发明化合物1,2和7在体外对于hela细胞毒性的实验结果,其中,3a-本发明化合物1,3b-本发明化合物2,3c-本发明化合物7。由图可知,化合物1,2和7在1000μg/ml时对hela细胞的抑制率分别为54.05±1.24%,67.59±1.03%和30.21±1.00%。由此可以初步证明,在体外实验过程中,化合物1,2和7具有较小的细胞毒性。图4为本发明化合物1,2和7在体外对于hela细胞毒性的活死细胞荧光实验结果,图中,a–c阴性对照(不加药组),d–f本发明化合物1(64μg/ml),g–i本发明化合物2(64μg/ml),j–l本发明化合物7(64μg/ml),m-o为阳性对照组0.1%tritonx-100。图中比例尺为20μm。由图可以显著的观察到,本发明化合物1,2和7于64μg/ml作用于hela细胞24小时后,对于细胞维持正常形态的生长几乎没有影响。图5为本发明化合物1,2,7和nota在体外与美罗培南(mem)、zn2+联用后的结果柱状图,由图可知,化合物1,2,7和nota与mem联用16-18h之后几乎可以达到100%的抑制率,但是与锌离子联合使用后药物失效,说明化合物1,2,7和nota与金属β-内酰胺酶中的锌离子结合导致该酶失活,具有可逆性。图6、本发明化合物1,2和7与mem联用后在体外对于大肠埃希菌(菌株编号16,blaimp)的杀菌动力学结果。图中,6a为本发明化合物1,6b为本发明化合物2,6c为本发明化合物7,6d为对照化合物nota。由图可知,当本发明化合物1、2、7和nota在4×mic(本发明化合物与nota终浓度为4×64μg/ml,mem为4×0.03125μg/ml)和8×mic(本发明化合物与nota终浓度为8×64μg/ml,mem为8×0.03125μg/ml)两个浓度作用24h后,对于对数生长初期的细菌有很好的杀菌活性。由图6a可知,当本发明化合物1在4×mic和8×mic两个浓度作用24h后,对于对数生长初期的细菌有很好的杀菌活性。与阳性对照nota的活性相对较优。图7为本发明化合物1,2,7和nota在体外对于大肠埃希菌(菌株编号16,blaimp)的杀菌动力学结果对比图,图中,7a,7b,7c和7d分别为本发明化合物1,2,nota和7与mem协同作用24小时后的菌管照片。其中,7a中,a-空白,b-化合物1的4×mic,c-化合物1的8×mic;7b中,a-空白,b-化合物2的4×mic,c-化合物2的8×mic;7c中,a-空白,b-化合物7的4×mic,c-化合物7的8×mic;7d中,a-空白,b-nota的4×mic,c-nota的8×mic;从7a-d图中,24h后的外观可以清楚地看到,化合物1,2,nota和7作用后的菌液浊度很低,而空白对照组浊度明显大。具体实施方式下面结合具体实施例,进一步阐述本发明。这些实施例仅用于说明本发明而不用于限制本发明要求保护的范围。应用例1本发明化合物药敏实验具体操作步骤:实验用品:一次性无菌培养皿、滤纸片(经过高压灭菌)、mha培养基、美罗培南(mem)、乙二胺四乙酸(edta)、打孔器。实验操作步骤:(1)药物纸片的制备:用打孔机将滤纸剪裁成直径为6mm左右的圆型滤纸,收集50张,装入小西林瓶中,高压灭菌,烘干备用。根据美国临床和实验室标准协会(clsi)所规定的药物含量要求和50片药敏纸片所需总含量,制备药敏纸片。于生物安全柜中,将配置好的mem以及本发明抗菌化合物加入到灭过菌的西林瓶中,牛皮纸密封瓶口。放置到37℃恒温培养箱中烘干待用。待纸片烘干后,取载药不同药敏纸片加入到灭菌后肉汤中,检查是否存在细菌污染,并用西林瓶盖将西林瓶密封,置于4℃冰箱保存。(2)菌液的制备与实验操作:麦氏浊度单位为0.5的耐药菌株用mhb肉汤稀释10倍后用灭菌过的棉棒,均匀涂于制备好的无菌mha琼脂平板上,涂布菌液的平板于生物安全柜内晾干后于背面标记相应的菌株编号,化合物编号等。用灭菌过的镊子取相应药物的药敏纸片贴于mha琼脂平板表面,尽量贴平。阳性对照组滴加10μl0.1mol/ledta溶液,阴性对照组滴加10μl0.1mol/l金属酶抑制剂,37℃过夜培养。(3)结果的判定:抑菌圈直径>20mm为极度敏感,15~20mm为高度敏感,10~14mm为中度敏感,10以下为低度敏感,0为不敏感。实验结果见表1和表2。表1:本发明化合物1和2与mem协同用药后药敏实验结果化合物编号抑菌圈直径(14-55)化合物编号抑菌圈直径(15-101)mem9.6mmmem9.8mmmem+edta22.9mmmem+edta20.3mm本发明化合物1+mem23.9mm本发明化合物1+mem24.28mm本发明化合物2+mem22.1mm本发明化合物2+mem22.84mm表2:本发明化合物7与mem协同用药后药敏实验结果化合物编号抑菌圈直径(14-55)化合物编号抑菌圈直径(101)mem0mmmem0mmmem+edta15.8mmmem+edta11.8mm本发明化合物7+mem18.9mm本发明化合物7+mem17.2mm由表1可知,药物联用结果表明,本发明化合物1、2、7和edta的联用结果都证明了,与mem联用之后,mem对耐药细菌恢复敏感性,并且结果指明该测试菌株对于联用药物高度敏感。表2比表1中数据表示敏感性降低,但是菌株14-55对本发明化合物7和mem联用后依旧为高度敏感。应用例2本发明化合物体外抗菌联合用药活性测试:实验方法微量肉汤稀释法:(1)抗菌药物贮存液制备:制备抗菌药物贮备液的浓度为5120μg/ml,溶解度低的抗菌药物可稍低于上述浓度。所需抗菌药物溶液量或粉剂量可公式进行计算。配制好的抗菌药物贮存液应贮存于-20℃以下环境,保存期不超过6个月。(2)待测菌的制备:用接种环挑取过夜培养的mh(a)培养皿上的单菌落于mh(b)培养基中,校准为0.5麦氏比浊标准,约含菌数1×108cfu/ml,然后稀释100倍,即得到约含菌数1.0×106cfu/ml的菌液,备用。(3)分别将抗菌药物(美罗培南mem)贮备液母液(5120μg/ml)稀释160倍,得到浓度为32μg/ml的抗菌药物溶液。取无菌的96孔板,第一孔加入200μl的抗菌药物,第二至十孔分别加入100μl的mh肉汤培养基,从第一孔吸取100μl加入第二孔,混匀,再吸取100μl至第三孔,依次类推,第十孔吸取100μl弃去。此时各孔药物浓度依次为:16、8、4、2、1、0.5、0.25、0.125、0.0625、0.03125μg/ml,第十二孔加入200μlmh(b)培养基(阴性对照)。(4)然后将稀释好的菌液分装于ep管中,计算需要固定待测化合物的浓度(64μg/ml或32μg/ml),将其加入菌液中,使待测化合物的终浓度为64或32μg/ml。自稀释好mem的96孔板的第1孔至第10孔分别加入菌液和待测化合物的混合溶液。将加完药的96孔板放置37℃培养箱进行培养,16-18h观察菌液生长情况,根据美国临床与实验室标准协会(clsi)的判定标准,肉眼观测完全不长菌的那一孔为抗菌药物的mic。同时用标准株做质控。实验结果见表3-6。表3:本发明化合物1,2,7和nota对含有ndm的菌株的mic(μg/ml)及其与美罗培南(mem)联合用药的mic结果本发明化合物1、2和nota单独用药的结果均为>128μg/ml。a表示mem单独使用情况下,对于菌株的最小抑菌浓度(mic);b表示,在nota浓度为32μg/ml的条件下,mem对于菌株的mic;c表示,在本发明化合物1为64μg/ml条件下,mem对于菌株的mic;d表示,在本发明化合物2为64μg/ml条件下,mem对于菌株的mic。表4:本发明化合物3至10对含有ndm的菌株的mic(μg/ml)及其与美罗培南(mem)联合用药的mic结果本发明化合物3至10单独用药的结果均为>128μg/ml,ni表示联合用药结果>16μg/ml。a本表中的菌株编号与表3菌株编号一样的为同一株临床分离耐药细菌,b-i表示本发明化合物3至10在浓度为64μg/ml的条件下,mem对于菌株的mic。表3和表4为本发明化合物1-10使用微量肉汤稀释法所测定的与mem联用后最小抑菌浓度(mic)的测定结果。如表3所示的作用结果,从中可看出,本发明化合物1和2对于mem的作用结果均有提高。并且有几组与阳性对照nota相比,提高效力高于阳性对照组。从菌株的种属来看,对于大肠埃希菌的作用效力来讲,nota依旧可以将mem的mic恢复至耐药折点左右,但是对于其它菌株却没有此效果。而反观本发明化合物1和2,无论是针对大肠埃希菌还是肺炎克雷伯菌等,均对mem具有一定的提高效力,最大可以提高2560倍。表4所展示结果中,这一组化合物也可以提高mem的效果,但是相对没有表3的化合物效果好。在表4中,活性最好的是化合物7,可以将部分菌株中mem的mic降低至0.03125μg/ml以下。表5:本发明化合物1,2和nota对产imp酶菌株的mic(μg/ml)及其与美罗培南(mem)联合用药的结果本发明化合物1、2和nota单独用药的结果均为>128μg/ml。a表示mem单独使用情况下,对于菌株的最小抑菌浓度(mic);b表示,在nota浓度为32μg/ml的条件下,mem对于菌株的mic;c表示,在本发明化合物1为64μg/ml条件下,mem对于菌株的mic;d表示,在本发明化合物2为64μg/ml条件下,mem对于菌株的mic。表6:本发明化合物3至10对含有imp的菌株的mic(μg/ml)及其与美罗培南(mem)联合用药的mic结果菌株编号amembmemcmemdmemememfmemgmemhmemi1188ni16216<0.03125<0.031251224ni20.5810.513nininini4ni841488ni16<0.0312588815816nini<0.0312516111648ni16<0.03125820.5171616nini<0.0312516<0.03125<0.03125181616ni8<0.0312516421988nini4844201616nini16421本发明化合物3至10单独用药的结果均为>128μg/ml,ni表示联合用药结果>16μg/ml。a本表中的菌株编号与表5菌株编号一样的为同一株临床分离耐药细菌,b-i表示本发明化合物3至10在浓度为64μg/ml的条件下,mem对于菌株的mic。表5与表6所展示的结果为在含有imp基因的菌株中,化合物1-10与mem联用后的mic结果。其中,表5为本发明化合物1和2以及阳性对照药物nota与mem的作用结果。从表中不难看出,除了13与20号菌株的结果改变较小以外,其余的结果都证明了在含有imp耐药基因的菌株测试中,本发明化合物1和2对于mem的恢复作用力较好,最大可以提高2560倍。表6中结果的提高力度依旧不明显,但是本发明化合物7在此次的作用结果中表现良好,16-18号菌株中mem的作用结果都小于0.03125μg/ml。应用例3本发明化合物体外红细胞溶血性实验实验材料:10mlep管,96孔板,新鲜脱脂羊血、磷酸盐缓冲液(ph7.2-7.4)、抗菌药物储备液。质量百分含量5%红细胞悬浮液的制备:将新鲜的脱纤维羊血保存于4℃冰箱中,配置好的pbs缓冲液放置于37℃水浴锅中,即用即取。实验于生物安全柜内进行操作,取10mlep管置于试管架,使用单孔道移液器吸取5700μl的1×pbs加入ep管中,小心缓慢的吸取300μl无菌绵羊血,缓慢加入到pbs溶液中,上下缓慢颠倒混匀,放入离心机1500rmp离心10min,取出ep管,小心移除上清。再重新分别加入5~7mlpbs溶液,重复上述操作。直至离心后上清液不再浑浊。最后一次离心过后,弃掉上清液,红细胞沉积物留置待用。另取10mlep管,向其中加入5700μl的1×pbs(37℃),然后小心缓慢于液面下加入300μl的红细胞沉积物。上下缓慢颠倒混匀,如此,便配置好质量百分含量5%的红细胞悬液。样品溶液的配置:用少量的dmso溶解样品(dmso终浓度不能大于质量百分含量0.5%),并且用相同体积的dmso做阴性对照。溶解后的dmso储备药液,需用pbs于ep管中梯度稀释。操作步骤:取96孔细胞培养板,记录实验编号,药品代码,日期。用单孔道移液器吸取配置好的质量百分含量5%红细胞悬浮液,每孔150μl加入。然后将梯度稀释过后的药物(每个药物平行做三个副孔)对应加入96孔板中。制备完成后放置于37℃恒温箱内孵育1h。最后,将培养板置于-4℃离心机内离心(3500rpm,5min)。离心完毕,另取一块96孔细胞培养板,做好标注。然后对应地吸取100μl上清液(孔孔对应)。吸取完毕后,与酶标仪中测取od540nm值,分析数据,得到hc50。应用例4本发明化合物体外细胞毒性测试1、铺板:将培养中状态良好的hela细胞自培养箱中取出,于生物安全柜中操作。倒掉上清培养基,用2ml1×pbs洗细胞一次,除去残留的培养基。取1ml胰蛋白酶沿壁打入培养皿中,于37℃培养箱,体积百分比0.5%co2中孵育1-2min。取出细胞消化后的培养皿,加入1ml培养基终止消化。将终止消化后的细胞混悬液转移至10mlep管中,800rpm3min离心。缓慢弃掉上清,加入2-4ml培养基,反复吹打50次。从中取10μl细胞混悬液打入细胞计数板中,于显微镜下计数。计算好需要细胞的数目,配置为5000个/孔的细胞混悬液。每孔100μl依次加入96孔板中,于恒温培养箱中孵育24h。2、加药:将待测药物在4mlep管中梯度稀释好后,取出已贴壁生长的96孔板,弃掉上清,将稀释好的待测药物每个浓度三个副孔,每孔200μl加入板中,操作完成后将96孔板放入恒温培养箱中。24h后,使用cck-8试剂盒,每孔7μl依次加入板中,放入37℃恒温培养箱中培养4h后,于酶标仪读取od450nm值,计算抑制率,回归其ic50。应用例5本发明化合物体外活死细胞双染测试荧光染液的配置:由于荧光染液都是生物级别,所以操作于生物安全柜内进行(荧光染液大多数都强致癌,所以操作需谨慎)。钙黄绿素-am的配置参照说明书配置,用dmso进行溶解,分装后锡箔纸包裹外层,保存于-20℃冰箱内,即用即取。碘化丙啶需用ddh2o进行稀释,操作同钙黄绿素。操作步骤:操作同应用例4细胞毒筛选实验相同,区别在于将细胞置于24孔细胞培养板中培养,加药。药物作用24h后,取出,分别收集各个孔上清于ep管中,将ep管好标记,3500rpm5min离心,弃掉上清,1×pbs洗一次,再次弃掉上清。将24孔板用1×pbs每孔各洗一次。用配置好的染料每孔500μl先吹打收集该孔的死细胞,然后将其混合液加入到12孔板的孔中。操作完成后,于37℃恒温培养箱孵育15min。接着,尼康荧光显微镜下拍照,记录。应用例6本发明化合物锌离子敏感性实验此实验操作前期步骤同应用例2,不同之处如下。待测药物的添加:计算需要固定待测化合物的浓度(64μg/ml或32μg/ml),将其加入菌液中,使待测化合物的终浓度为64或32μg/ml,然后加入等摩尔量的zncl2。自稀释好美罗培南的96孔板的第1至第10纵排分别加入菌液和待测化合物的混合溶液。将加完药的96孔板放置37℃培养箱进行培养,16-18h后,于酶标仪读取od600的吸光度,记录。计算不同浓度下的细菌生长率,使用origin8.0生成柱状图。同时用标准菌株大肠埃希菌做质控。应用例7本发明化合物体外杀菌动力学测试实验材料:mhb培养基,mha培养基,1.5ml无菌ep管,96孔板,pbs缓冲液。操作步骤:实验操作于生物安全柜内完成。取两支10mlep管分别加入3ml的mhb培养基,用接种环分别挑取培养皿中的单克隆菌株,放置恒温摇床中,37℃250rpm过夜生长。次日,将两支管中的菌液分别都按1:10000倍进行稀释,将稀释好的菌液分为两批,分别于恒温摇床37℃250rpm继续分别生长2h和5h。待到达生长时间,取出菌液,加入不同浓度mic的抗菌药物和美罗培南。此时,分别从每个样品管里面取出100μl的样品液,于低温离心机内10000g离心,弃掉上清,用1×pbs稀释。取无菌96孔板,每孔180μl加入1×pbs。从上述用1×pbs稀释好的菌液中取出20μl加入第一孔,依次往后倍比稀释。从稀释好的孔中取出10μl的样品液滴加于mha固体培养基上,做好标记,此为0h时的菌落计数。此后的时间点取样方法,依旧依照上述方法,分别对1h、2h、3h……24h等进行菌落计数,使用origin8.0绘制出时间杀菌曲线。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1