一种聚谷氨酸和人表皮生长因子纳米脂质体及其制备方法与流程
本发明属于生物材料技术领域,具体涉及一种聚谷氨酸和人表皮生长因子纳米脂质体及其制备方法。
背景技术:
作为一种新兴的药物载体,脂质体在药物制剂上已经有了比较广泛的应用。然而,由于普通脂质体的粒度过大,难以穿透细胞膜,故其在应用中不可避免地受到了很多的限制。因此,人们开始思考设计一种能突破这种局限性的新型脂质体,于是就诞生了纳米脂质体。纳米尺寸赋予了脂质体良好的穿透性能和特殊的靶向性,多的人将目光投向这种新型脂质体,并致力于将其引入医药和化妆品领域中,使其充分发挥治疗疾病和美容的功效。人们将这种新型脂质体命名为纳米脂质体,它是指在制备、储藏和运用过程中平均粒度大小均为纳米尺寸的脂质囊泡。
γ-聚谷氨酸,简称聚谷氨酸(γ-pga),又名纳豆胶,是由微生物分泌的谷氨酸同聚物,它由谷氨酸分子上α-氨基和另一分子上的γ-羧基通过酰胺键连接而成的一种类多肽物质,分子量从800da-2000000da不等。不同分子量γ-pga功效存在明显差异,其中10000da以下γ-pga皮肤深层调节功效更好,具有抑制透明质酸酶和酪氨酸酶活性,促进皮肤内天然保湿因子和人表皮生长因子的再生;10000da-2000000daγ-pga具有良好的保水锁水功效。γ-聚谷氨酸为类似蛋白结构的生物活性高分子材料,具有极佳的生物相容性、生物可降解性,并且其超强的保湿性能可以有效维持伤口湿润愈合环境,高效吸收伤口渗液,并促进细胞增殖和细胞分化,在人体内分解为谷氨酸,可完全被人体消化吸收参与组织修复再生。
人表皮生长因子(humanepidermalgrowthfactor,hegf)是由53个氨基酸组成的多肽,分子量约为6200da,能刺激细胞增殖、分化和迁移,在伤口愈合和器官发生中扮演着重要角色。它有三个二硫键,这些二硫键是它具有生物活性所必需的,如加入琉基试剂和尿素,则表皮生长因子失活,肽链上的巯基可在空气中自然氧化而完全恢复活性。人表皮生长因子是人体内分泌的一种重要的生长因子,极微量即能强烈促进皮肤细胞的分裂和生长,此外,它还能刺激细胞外一些大分子(如透明质酸和糖蛋白等)的合成和分泌,滋润皮肤,因此它既可作为化妆品的添加剂及用于面部整形手术,促进人皮肤的新陈代谢、减少皮肤畸形;也可在医药上治疗皮肤外伤、术后创口、褥疮、口腔溃疡和坏疽、以及放射治疗引起的皮炎等。它可以加速伤口和溃疡面的愈合。随着生物技术的发展,在细胞信号传导中起着重要作用的细胞因子受到越来越多的关注。
聚谷氨酸和人表皮生长因子是具有生物活性、生物相容性的皮肤修复材料,但其透皮性差、皮肤吸收率低,且使用条件苛刻、化妆品中很多配方成分会使其失活或分解,因此开发出新剂型,提高其透皮性、皮肤吸收率是亟待解决的问题。
中国专利申请201010604906.6公开了一种人表皮生长因子纳米脂质体,包括脂质体微囊和包裹于其中的人表皮生长因子。该专利采用磷脂和胆固醇为主要膜材,其类生物膜结构与皮肤相似,具有较好的表皮透过能力,制得的人表皮生长因子纳米脂质体可进一步制成护肤品,达到皮肤损伤的快速修复,皱纹的修复与祛皱,防晒、辐射、检验后的护理,敏感性皮肤护理、各类疤痕的去除修复等功效。
韩国专利申请20090020407公开了一种纳米脂质体,包括聚谷氨酸、透明质酸、植物甾醇、胆固醇、饱和卵磷脂等,该纳米脂质体能够增强皮肤保湿效果,并且该专利通过降低脂质体的大小,增强皮肤渗透性。
目前,仍然需要能够提高活性成分的透皮性、皮肤吸收率,且性能稳定、包封率较高的无防腐剂纳米脂质体。
技术实现要素:
本发明的目的是提供一种聚谷氨酸和人表皮生长因子纳米脂质体,该纳米脂质体将高、低分子量的聚谷氨酸和人表皮生长因子复配,并利用ε-聚赖氨酸抑菌作用制备了无防腐剂纳米脂质体,取得了皮肤改善和修复的加乘效果,大幅提高了活性成分的透皮性、皮肤吸收率,并且性能稳定、使用配伍性好、包封率较高。
本发明的另一个目的是提供所述纳米脂质体的制备方法,该方法制得的脂质体包封率较高,且操作简便,重复性好。
为实现发明目的,本发明采用的技术方案如下:
聚谷氨酸和人表皮生长因子纳米脂质体
一种聚谷氨酸和人表皮生长因子纳米脂质体,包含分子量≥400000道尔顿的聚谷氨酸和/或其一种或多种盐、分子量≤10000道尔顿的聚谷氨酸和/或其一种或多种盐、人表皮生长因子和脂质体膜材料。
进一步地,所述分子量≥400000道尔顿的聚谷氨酸和分子量≤10000道尔顿的聚谷氨酸的质量比为1∶1~10∶1。
进一步地,所述聚谷氨酸与人表皮生长因子的质量比为5∶1~30∶1,聚谷氨酸和人表皮生长因子的总质量与脂质体膜材料的质量比为1∶40~1∶400。
进一步地,所述纳米脂质体的粒径为50~200nm。
进一步地,所述的脂质体膜材料为磷脂、脂肪酸甘油酯、脂肪酸、蜡质、固醇、天然植物油、维生素中的一种或几种,优选为磷脂和固醇的混合物。
更进一步地,所述磷脂为大豆卵磷脂、蛋黄卵磷脂、磷脂酰胆碱、磷脂酰丝氨酸、聚乙二醇2000-二硬酯酰磷脂酰乙醇胺中的一种或几种,优选为大豆卵磷脂、蛋黄卵磷脂;所述脂肪酸甘油酯为棕榈酸甘油酯、硬脂酸甘油酯、二十二酸单双三甘油酯混合物、棕榈酸硬脂酸甘油酯、链长在c8-c10之间的脂肪酸甘油酯中的一种或几种,优选为棕榈酸甘油酯;所述脂肪酸为硬脂酸、棕榈酸、油酸、亚油酸中的一种或几种,优选为硬脂酸;所述蜡质为十六醇、十八醇、鲸蜡醇十六酸酯、凡士林、石蜡中的一种或几种;所述固醇为胆固醇;所述天然植物油为大豆油、蓖麻油、红花油、橄榄油中的一种或几种;所述维生素为维生素e、维生素a、维生素酯中的一种或几种。
更进一步地,所述的脂质体膜材料为磷脂和固醇的混合物时,磷脂和固醇的质量比为2∶1~10∶1。
进一步地,所述纳米脂质体包含辅料,所述辅料为抑菌剂、透皮吸收剂、无机盐、ph调节剂中的一种或几种。
更进一步地,所述的抑菌剂为ε-聚赖氨酸、苯扎氯胺、苯扎溴铵、尼泊金甲酯、尼泊金乙酯、尼泊金丙酯、三氯叔丁醇、山梨酸中的一种或几种。
更进一步地,所述的透皮吸收促进剂为有机溶剂、月桂氮卓酮及其同系物、角质保湿与软化剂、萜烯中的一种或几种。
优选地,所述有机溶剂为乙醇、丙二醇、乙酸乙酯、二甲基酰胺中的一种或几种,优选丙二醇;所述角质保湿与软化剂为尿素、水杨酸及吡咯酮、吐温系列(吐温20、吐温60、吐温80)、硬质酰谷氨酸钠中的一种或多种,优选吐温系列、硬质酰谷氨酸钠,更优选吐温80;所述萜烯为薄荷醇、樟脑、柠檬烯中的一种或几种,优选薄荷醇。
更进一步地,所述的无机盐为ca、k、na、mg、fe、zn形成的盐酸盐、硫酸盐或磷酸盐中的一种或几种,优选为nacl、mgso4、kcl、mgcl2中的一种或几种。
更进一步地,所述的ph调节剂为氢氧化钠、磷酸、盐酸、硫酸、磷酸二氢钠、磷酸氢二钠、磷酸氢二钾、磷酸二氢钾等中的一种或几种,优选氢氧化钠或磷酸。对ph调节剂的加入量没有特别的限制,能够调节水相ph为5~9即可。
优选地,以100ml纳米脂质体计,其组成为:
分子量≤10000道尔顿的聚谷氨酸和/或其一种或多种盐:1~15mg
分子量≥400000道尔顿的聚谷氨酸和/或其一种或多种盐:1~15mg
人表皮生长因子:0.2~3mg
脂质体膜材料:0.1~6g
抑菌剂:0.1~1.5mg
透皮吸收促进剂:0.02~0.5g
无机盐:0.02~0.2mg
ph调节剂,其加入量使得水相ph为5~9
余量为水。
进一步优选地,以100ml纳米脂质体计,其组成为:
分子量≤10000道尔顿的聚谷氨酸和/或其一种或多种盐:2~9mg
分子量≥400000道尔顿的聚谷氨酸和/或其一种或多种盐:2~9mg
人表皮生长因子:0.5~2mg
卵磷脂和胆固醇:1~5g
ε-聚赖氨酸:0.1~1.5mg
丙二醇:0.02~0.5g
nacl:0.02~0.2mg
ph调节剂,其加入量使得水相ph为5~9
余量为水。
进一步地,所述卵磷脂和胆固醇的质量比为2∶1~10∶1。
进一步地,所述聚谷氨酸盐为螯合了na、k、ca、mn、cu、zn、fe中的一种或多种元素的聚谷氨酸盐。
进一步地,所述的纳米脂质体由薄膜法、逆相蒸发法、复乳法、乙醇注入法、超声法和动态高压微射流技术中的一种或几种相耦合的方法制备得到。
超声法制备纳米脂质体
本发明提供了一种聚谷氨酸和人表皮生长因子纳米脂质体的制备方法,包括如下步骤:将聚谷氨酸、人表皮生长因子溶于水中形成水相,脂质体膜材料与有机溶剂混合形成油相,将油相和水相混合,搅拌,得到脂质体悬液,超声,即得聚谷氨酸和人表皮生长因子纳米脂质体。
进一步地,所述有机溶剂为醇类、酯类、或卤代烷烃类中的一种或几种。
更进一步地,所述的醇类为c1-c8的醇中的一种或几种,优选甲醇、无水乙醇、95%乙醇、丙醇、丁醇、异丙醇或乙二醇中的一种或几种,更优选无水乙醇;所述的酯类为c2-c8的酯中的一种或几种,优选乙酸乙酯、乙酸丙酯、丙酸乙酯、乙酸丁酯,更优选乙酸乙酯;所述的卤代烷烃类为1-4卤代的烷烃中的一种或几种,优选二氯甲烷、氯仿,更优选氯仿。
进一步地,所述聚谷氨酸在水中的质量浓度为0.01~0.5mg/ml,脂质体膜材料与有机溶剂的质量比为1∶10~1∶50。
进一步地,将聚谷氨酸、人表皮生长因子和亲水性的辅料溶于水中形成水相,将脂质体膜材料、亲脂性的辅料与有机溶剂混合形成油相。
薄膜分散-高压法制备纳米脂质体
本发明提供了另一种聚谷氨酸和人表皮生长因子纳米脂质体的制备方法,包括如下步骤:
(1)将聚谷氨酸和人表皮生长因子溶于水中形成水相,将脂质体膜材料与有机溶剂混合形成油相,将油相置于容器中减压蒸发去除有机溶剂,使容器壁上形成一层均匀的薄膜;将水相加入薄膜中,旋转洗膜,得到脂质体悬液;
(2)将制得的脂质体悬液在80~130mpa下,用微射流均质机处理,即得聚谷氨酸和人表皮生长因子纳米脂质体。
进一步地,所述有机溶剂为醇类、酯类、或卤代烷烃类中的一种或几种。
更进一步地,所述的醇类为c1-c8的醇中的一种或几种,优选甲醇、无水乙醇、95%乙醇、丙醇、丁醇、异丙醇或乙二醇中的一种或几种,更优选无水乙醇;所述的酯类为c2-c8的酯中的一种或几种,优选乙酸乙酯、乙酸丙酯、丙酸乙酯、乙酸丁酯,更优选乙酸乙酯;所述的卤代烷烃类为1-4卤代的烷烃中的一种或几种,优选二氯甲烷、氯仿,更优选氯仿。
进一步地,所述聚谷氨酸在水中的质量浓度为0.01~0.5mg/ml,脂质体膜材料与有机溶剂的质量体积比为1∶10~1∶50。
进一步地,将聚谷氨酸、人表皮生长因子和亲水性的辅料溶于水中形成水相,将脂质体膜材料、亲脂性的辅料与有机溶剂混合形成油相。
按照上述两种制备方法制备得到的纳米脂质体在本发明的保护范围之内。
本发明提供的聚谷氨酸和人表皮生长因子纳米脂质体在制备具有皮肤改善或修复作用的药品或美容品中的应用也在本发明的保护范围之内。
有益效果:
(1)本发明首次提出将聚谷氨酸和人表皮生长因子复配包裹在纳米脂质体载体中,提供的纳米脂质载体可将两种成分包裹其中,避免外界环境对聚谷氨酸和人表皮生长因子的影响,提高放置稳定性,使用方便,产品配伍性好。且产品兼具保湿及成膜性,为皮肤修复、伤口愈合提供了有利环境。
(2)纳米脂质载体中的脂质材料卵磷脂和胆固醇与皮肤具有较好的生理相容性,且粒径较小(约50nm-200nm),可通过与角质层的融合、穿透等机制,将聚谷氨酸和人表皮生长因子传递入皮肤内,使聚谷氨酸和人表皮生长因子有效发挥对皮肤细胞及伤口愈合的修复作用。
(3)聚谷氨酸和人表皮生长因子纳米脂质体本身具有良好的皮肤保湿、活化皮肤细胞和调理皮肤的作用,可直接作为护肤或药物使用,应用便捷,在化妆品和医用材料领域应用前景广阔。
(4)高、低分子量聚谷氨酸与人表皮生长因子的复配,并利用ε-聚赖氨酸抑菌作用制备了无防腐剂纳米脂质体,有效提高了促细胞增殖活性,具有皮肤修复的加乘效果,大幅提高了活性成分的透皮性、皮肤吸收率,且性能稳定、使用配伍性好、包封率较高。
(5)本发明提供的制备方法制得的脂质体包封率较高,且操作简便,重复性好。
附图说明
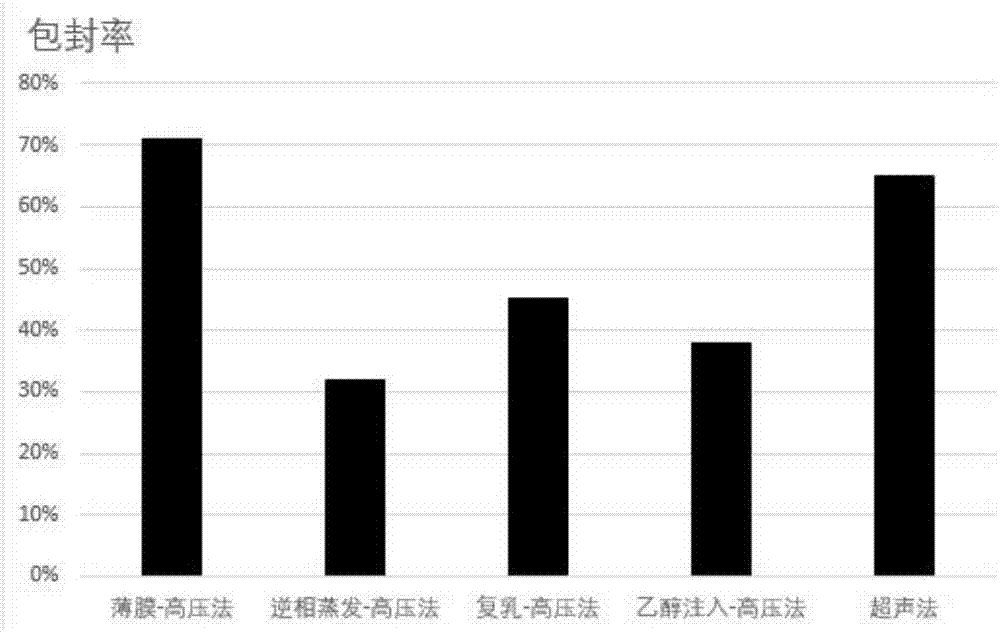
图1:不同制备方法包封率比较图;
图2:聚谷氨酸和人表皮生长因子纳米脂质体电镜图(50,000×);
图3:不同纳米脂质体对细胞增殖活性的影响;
图4:聚谷氨酸和人表皮生长因子纳米脂质体促伤口愈合效果图(a.对照组,b.聚谷氨酸脂质体,c.脂质体1号,d.脂质体2号);
图5:聚谷氨酸和人表皮生长因子纳米脂质体促伤口愈合组织学分析(100×;a.对照组,b.聚谷氨酸脂质体;c.脂质体1号,d.脂质体2号)。
具体实施方式
根据下述实施例,可以更好地理解本发明。然而,本领域的技术人员容易理解,实施例所描述的内容仅用于说明本发明,而不应当也不会限制权利要求书中所详细描述的本发明。
实施例1、不同制备方法包封率比较
本发明采用五种适用于水溶性产品的脂质体制备方法薄膜分散法、逆相蒸发法、复乳法、乙醇注入法和超声法,前四种方法分别联合动态高压微射流技术依次命名为薄膜分散-高压法、逆相蒸发-高压法、复乳-高压法、乙醇注入-高压法来制备聚谷氨酸和人表皮生长因子纳米脂质体。
本实施例五种制备方法所使用的具体配方如下所示:
以100ml纳米脂质体计,其组成为:
分子量为800000da的聚谷氨酸:10mg
人表皮生长因子:0.5mg
大豆卵磷脂:3g
胆固醇:0.5g
ε-聚赖氨酸:0.5mg
丙二醇:0.1g
nacl:0.07mg
磷酸:适量
余量为水。
(1)薄膜分散-高压法:精确称取配方量的大豆卵磷脂、胆固醇、丙二醇与适量无水乙醇混合后形成油相,置于圆底烧瓶中减压蒸发去除乙醇,使烧瓶壁上形成一层均匀的薄膜。然后加入配方量的聚谷氨酸、人表皮生长因子、ε-聚赖氨酸和nacl溶于水溶液形成水相(ph6.5),旋转洗膜15min左右,得到脂质体悬液最后将悬液水浴超声一段时间即制得较均匀的脂质体悬浮液。将上述制得的脂质体悬液在80~130mpa下,用微射流均质机处理两次,即得纳米脂质体。
(2)逆相蒸发-高压法:精确称取配方量的大豆卵磷脂、胆固醇与适量无水乙醇混合形成油相,然后和配方量的聚谷氨酸、人表皮生长因子、ε-聚赖氨酸和nacl溶于水溶液形成的水相(ph6.5)于圆底烧瓶充分混合,再减压蒸发去除乙醇,得到脂质体悬液最后将悬液水浴超声一段时间即制得较均匀的脂质体悬浮液。将上述制得的脂质体悬液在80~130mpa下,用微射流均质机处理两次,即得纳米脂质体。
(3)复乳-高压法:精确称取配方量的大豆卵磷脂、胆固醇与适量无水乙醇混合形成油相,然后加入一小部分配方量的水溶液,置于圆底烧瓶中充分混合,再减压蒸发去除部分乙醇,然后加入剩余的配方量的聚谷氨酸、人表皮生长因子、ε-聚赖氨酸和nacl溶于水溶液形成的水相(ph6.5),再继续减压蒸发去除剩余乙醇,即得脂质体悬液最后将悬液水浴超声一段时间即制得较均匀的脂质体悬浮液。将上述制得的脂质体悬液在80~130mpa下,用微射流均质机处理两次,即得纳米脂质体。
(4)乙醇注入-高压法:精确称取配方量的大豆卵磷脂、胆固醇与适量无水乙醇混合形成油相,该溶液经注射器缓慢注射到磁力搅拌下的配方量的聚谷氨酸、人表皮生长因子、ε-聚赖氨酸和nacl溶于水溶液形成的水相(ph6.5)中,去除乙醇后即得脂质体悬液最后将悬液水浴超声一段时间即制得较均匀脂质体悬浮液。将上述制得的脂质体悬液在80~130mpa下,用微射流均质机处理两次,即得纳米脂质体。
(5)超声法:精确称取配方量的大豆卵磷脂、胆固醇混合后形成油相,精确称取配方量的聚谷氨酸、人表皮生长因子、ε-聚赖氨酸、nacl搅拌均匀溶于水形成水相(ph6.5);将油相倒入搅拌转速在500rpm的水相中,搅拌5min,得到脂质体悬液;将制得的脂质体悬液在超声功率225w下,超声12min,即得纳米脂质体。
实验结果:
图1为不同制备方法包封率比较图。由图1可知,各种脂质体制备方法联用高压后制备的脂质体,其包封率大小相差甚远。以薄膜分散-高压法制得的脂质体包封率最大,超声法包封率仅次于与薄膜分散-高压法,与其相差不大。逆相蒸发-高压法制得的脂质体包封率最小,乙醇注入高压法、复乳-高压法包封率略高于逆相蒸发-高压法。这说明薄膜分散法和高压具有良好的协同性,因此优选用薄膜分散-高压法和超声法制备纳米脂质体。
实施例2、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为10000da的聚谷氨酸:1mg
分子量为1000000da的聚谷氨酸:3mg
人表皮生长因子:0.2mg
大豆卵磷脂:1.2g
胆固醇:0.3g
ε-聚赖氨酸:0.1mg
丙二醇:0.02g
nacl:0.02mg
磷酸:适量
余量为水。
其制备方法是薄膜分散-高压法,具体如下:
步骤1:将聚谷氨酸、人表皮生长因子、ε-聚赖氨酸和nacl溶于一定量的水中形成水相,调至ph6.5;将大豆卵磷脂、胆固醇、丙二醇与38g无水乙醇混合后形成油相;
步骤2:将油相置于圆底烧瓶中减压蒸发去除乙醇,使烧瓶壁上形成一层均匀的薄膜。
步骤3:将水相加入薄膜中,温度控制在65℃,旋转洗膜15min左右,得到脂质体悬液。
步骤4:将制得的脂质体悬液在120mpa下,用微射流均质机处理两次,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为75%,粒度约70nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例3、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为8000da的聚谷氨酸钠:2mg
分子量为600000da的聚谷氨酸钠:2mg
人表皮生长因子:0.5mg
大豆卵磷脂:1.5g
胆固醇:0.3g
ε-聚赖氨酸:0.8mg
丙二醇:0.08g
nacl:0.05mg
氢氧化钠:适量
余量为水。
其制备方法是薄膜分散-高压法,具体如下:
步骤1:将聚谷氨酸钠、人表皮生长因子、ε-聚赖氨酸和nacl溶于一定量的水中形成水相,调至ph9;将大豆卵磷脂、胆固醇、丙二醇与18g氯仿混合后形成油相;
步骤2:将油相置于圆底烧瓶中减压蒸发去除氯仿,使烧瓶壁上形成一层均匀的薄膜。
步骤3:将水相加入薄膜中,温度控制在75℃,旋转洗膜15min左右,得到脂质体悬液。
步骤4:将制得的脂质体悬液在120mpa下,用微射流均质机处理两次,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为77%,粒度约65nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例4、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为8000da的聚谷氨酸钠:4.5mg
分子量为600000da的聚谷氨酸钠:9mg
人表皮生长因子:1.35mg
大豆卵磷脂:2.5g
胆固醇:0.5g
ε-聚赖氨酸:0.7mg
丙二醇:0.25g
nacl:0.1mg
氢氧化钠:适量
余量为水。
其制备方法是薄膜分散-高压法,具体如下:
步骤1:将聚谷氨酸钠、人表皮生长因子、ε-聚赖氨酸和nacl溶于一定量的水中形成水相,调至ph9;将大豆卵磷脂、胆固醇、丙二醇与30g无水乙醇混合后形成油相;
步骤2:将油相置于圆底烧瓶中减压蒸发去除乙醇,使烧瓶壁上形成一层均匀的薄膜。
步骤3:将水相加入薄膜中,温度控制在75℃,旋转洗膜15min左右,得到脂质体悬液。
步骤4:将制得的脂质体悬液在120mpa下,用微射流均质机处理两次,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为76%,粒度约68nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例5、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为8000da的聚谷氨酸钠:9mg
分子量为600000da的聚谷氨酸钠:9mg
人表皮生长因子:2mg
大豆卵磷脂:0.75g
胆固醇:0.25g
ε-聚赖氨酸:1.5mg
丙二醇:0.5g
nacl:0.2mg
氢氧化钠:适量
余量为水。
其制备方法是超声法,具体如下:
步骤1:将聚谷氨酸、人表皮生长因子、吐温-80和nacl溶于一定量的水中形成水相,调至ph5;将卵磷脂、胆固醇与10g无水乙醇混合后形成油相;
步骤2:将油相倒入搅拌转速在500rpm的水相中,搅拌5min,得到脂质体悬液;
步骤3:将制得的脂质体悬液在超声功率225w下,超声12min,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为75%,粒度约66nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例6、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为8000da的聚谷氨酸钠:9mg
分子量为600000da的聚谷氨酸钠:9mg
人表皮生长因子:7mg
大豆卵磷脂:4.4g
胆固醇:0.6g
ε-聚赖氨酸:1mg
丙二醇:0.5g
nacl.0.15mg
氢氧化钠:适量
余量为水。
其制备方法是超声法,具体如下:
步骤1:将聚谷氨酸、人表皮生长因子、吐温-80和nacl溶于一定量的水中形成水相,调至ph5;将卵磷脂、胆固醇与125g无水乙醇混合后形成油相;
步骤2:将油相倒入搅拌转速在500rpm的水相中,搅拌5min,得到脂质体悬液;
步骤3:将制得的脂质体悬液在超声功率225w下,超声12min,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为77%,粒度约68nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例7、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为10000da的聚谷氨酸:1mg
分子量为400000da的聚谷氨酸:1mg
人表皮生长因子:0.2mg
蛋黄卵磷脂:0.075g
胆固醇:0.025g
苯扎氯胺:0.1mg
硬质酰谷氨酸钠:0.02g
mgso4:0.02mg
氢氧化钠:适量
余量为水。
其制备方法是薄膜分散-高压法,具体如下:
步骤1:将聚谷氨酸、人表皮生长因子、苯扎氯胺和mgso4溶于一定量的水中形成水相,调至ph9;将蛋黄卵磷脂、胆固醇、硬质酰谷氨酸钠与5g95%乙醇混合后形成油相;
步骤2:将油相置于圆底烧瓶中减压蒸发去除乙醇,使烧瓶壁上形成一层均匀的薄膜。
步骤3:将水相加入薄膜中,温度控制在60℃,旋转洗膜15min左右,得到脂质体悬液。
步骤4:将制得的脂质体悬液在80mpa下,用微射流均质机处理两次,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为72%,粒度约90nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例8、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为10000da的聚谷氨酸:1mg
分子量为500000da的聚谷氨酸:1mg
人表皮生长因子:0.2mg
磷脂酰胆碱:0.73g
胆固醇:0.15g
尼泊金乙酯:0.01mg
吐温80:0.02g
kcl:0.02mg
磷酸:适量
余量为水。
其制备方法是薄膜分散-高压法,具体如下:
步骤1:将聚谷氨酸、人表皮生长因子、尼泊金乙酯和kcl溶于一定量的水中形成水相,调至ph5;将磷脂酰胆碱、胆固醇、吐温80与22g异丙醇混合后形成油相;
步骤2:将油相置于圆底烧瓶中减压蒸发去除异丙醇,使烧瓶壁上形成一层均匀的薄膜。
步骤3:将水相加入薄膜中,温度控制在70℃,旋转洗膜20min左右,得到脂质体悬液。
步骤4:将制得的脂质体悬液在130mpa下,用微射流均质机处理两次,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为73%,粒度约100nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例9、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为8000da的聚谷氨酸钠:2mg
分子量为600000da的聚谷氨酸钠:2mg
人表皮生长因子:0.8mg
棕榈酸甘油酯:0.18g
胆固醇:0.045g
三氯叔丁醇:0.08mg
薄荷醇:0.06g
mgcl2:0.03mg
氢氧化钠适量
余量为水。
其制备方法是薄膜分散-高压法,具体如下:
步骤1:将聚谷氨酸钠、人表皮生长因子、三氯叔丁醇和mgcl2溶于一定量的水中形成水相,调至ph8;将棕榈酸甘油酯、胆固醇、薄荷醇与6g乙酸乙酯混合后形成油相;
步骤2:将油相置于圆底烧瓶中减压蒸发去除乙酸乙酯,使烧瓶壁上形成一层均匀的薄膜。
步骤3:将水相加入薄膜中,温度控制在55℃,旋转洗膜25min左右,得到脂质体悬液。
步骤4:将制得的脂质体悬液在120mpa下,用微射流均质机处理两次,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为71%,粒度约150nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例10、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为6000da的聚谷氨酸:1mg
分子量为600000da的聚谷氨酸:10mg
人表皮生长因子:3mg
大豆卵磷脂:2.6g
胆固醇:0.4g
吐温-80:0.7mg
丙二醇:0.25g
nacl:0.1mg
磷酸:适量
余量为水。
其制备方法是超声法,具体如下:
步骤1:将聚谷氨酸、人表皮生长因子、吐温-80和nacl溶于一定量的水中形成水相,调至ph5;将卵磷脂、胆固醇与150g无水乙醇混合后形成油相;
步骤2:将油相倒入搅拌转速在500rpm的水相中,搅拌5min,得到脂质体悬液;
步骤3:将制得的脂质体悬液在超声功率225w下,超声12min,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为73%,粒度约120nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例11、纳米脂质体的制备
以100ml纳米脂质体计,其组成为:
分子量为6000da的聚谷氨酸钠:15mg
分子量为600000da的聚谷氨酸钠:15mg
人表皮生长因子:3mg
大豆卵磷脂:5g
胆固醇:1g
吐温-80:1.5mg
丙二醇:0.5g
nacl:0.2mg
氢氧化钠:适量
余量为水。
其制备方法是超声法,具体如下:
步骤1:将聚谷氨酸钠、人表皮生长因子、吐温-80和nacl溶于一定量的水中形成水相,调至ph9;将卵磷脂、胆固醇与150g无水乙醇混合后形成油相;
步骤2:将油相倒入搅拌转速在800rpm的水相中,搅拌5min,得到脂质体悬液;
步骤3:将制得的脂质体悬液在超声功率225w下,超声15min,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为72%,粒度约150nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例12、纳米脂质体1号的制备
聚谷氨酸和人表皮生长因子纳米脂质体1号的精确配方,以100ml纳米脂质体计,其组成为:
分子量为1000000da的聚谷氨酸:14mg
人表皮生长因子:1.2mg
大豆卵磷脂:3g
胆固醇:0.6g
ε-聚赖氨酸:0.2mg
丙二醇:0.3g
nacl:0.05mg
磷酸:适量
余量为水。
其制备方法是薄膜分散-高压法,具体如下:
步骤1:将聚谷氨酸、人表皮生长因子、ε-聚赖氨酸和nacl溶于一定量的水中形成水相,调至ph6.5;将大豆卵磷脂、胆固醇、丙二醇与90g无水乙醇混合后形成油相;
步骤2:将油相置于圆底烧瓶中减压蒸发去除乙醇,使烧瓶壁上形成一层均匀的薄膜。
步骤3:将水相加入薄膜中,温度控制在65℃,旋转洗膜15min左右,得到脂质体悬液。
步骤4:将制得的脂质体悬液在120mpa下,用微射流均质机处理两次,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为71%,粒度约80nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例13、纳米脂质体2号的制备
聚谷氨酸和人表皮生长因子纳米脂质体2号的精确配方,以100ml纳米脂质载体制剂计,其组成为:
分子量5000da的聚谷氨酸:7mg
分子量1000000da的聚谷氨酸:7mg
人表皮生长因子:1.2mg
大豆卵磷脂:3g
胆固醇:0.6g
ε-聚赖氨酸:0.2mg
丙二醇:0.3g
nacl:0.05mg
磷酸:适量
余量为水。
其制备方法是薄膜分散-高压法,具体如下:
步骤1:将聚谷氨酸、人表皮生长因子、ε-聚赖氨酸和nacl溶于一定量的水中形成水相,调至ph6.5;将大豆卵磷脂、胆固醇、丙二醇与90g无水乙醇混合后形成油相;
步骤2:将油相置于圆底烧瓶中减压蒸发去除乙醇,使烧瓶壁上形成一层均匀的薄膜。
步骤3:将水相加入薄膜中,温度控制在65℃,旋转洗膜15min左右,得到脂质体悬液
步骤4:将制得的脂质体悬液在120mpa下,用微射流均质机处理两次,即得聚谷氨酸和人表皮生长因子纳米脂质体。
通过上述方法制备得到的聚谷氨酸和人表皮生长因子纳米脂质体包封率为76%,粒度约70nm,该纳米脂质体包封率高,性能稳定,能在4℃条件下稳定保藏。
实施例14、纳米脂质体显微形态结构和粒度
图2是本发明纳米脂质体电子透射显微镜的局部照片,可知该脂质体是一种类似球形的单室结构。数据统计显示,其粒径相对集中在50~200纳米之间。
实施例15、聚谷氨酸和人表皮生长因子纳米脂质体对细胞增殖活性的影响
利用mtt法检测空脂质体(即无聚谷氨酸和人表皮生长因子)、脂质体1号和脂质体2号促3t3细胞增殖活性。
实验过程:将3t3细胞按1×106每孔接种于12孔培养板中,在其中6孔中细胞液加入纤维敷料材料,另外6孔为空白对照组。分别在培养24,48,72h时加入100μlmtt试剂并在37℃下孵育4h,然后加入150μldmso溶解甲瓒沉淀,通过酶标仪测定培养液在570nm和630nm波长下的吸收值,计算细胞增值率,计算公式为:
实验每组进行6个平行实验,取平均值减小系统误差。
实验结果:不同纳米脂质体对细胞增殖活性的影响见图3。由图3可知,与对照组相比,脂质体1号和2号均有促进细胞增殖作用,脂质体2号较脂质体1号促进作用明显增强,是脂质体1号的促细胞增殖活性的1.5倍,说明高低分子量聚谷氨酸和人表皮生长因子的复配对促进细胞增殖活性有加乘效果,小分子量的聚谷氨酸对细胞的增殖有明显促进作用。
实施例16、聚谷氨酸和人表皮生长因子纳米脂质体伤口愈合能力评价
因聚谷氨酸和人表皮生长因子纳米脂质体优良的促进细胞增殖活性和生物相容性,我们采用大鼠全层皮肤切口模型对脂质体的伤口愈合能力进行评价。
实验过程:实验对象选取24只雄性sprague-dawley大鼠(180-250g,南京军区南京总医院)。所有动物实验操作均符合国际动物保护和伦理道德规范。4组实验分别为空脂质体、聚谷氨酸脂质体、脂质体1号和脂质体2号。首先将24只老鼠随机分为4组(a,b,c,d),每组6只,随后进行腹腔注射麻醉。在麻醉后的老鼠的背部肩胛骨两侧分别用手术刀制造一条1.5cm长的切口,然后分别用空脂质体、聚谷氨酸脂质体、脂质体1号和脂质体2号进行伤口处理。术后7天和14天分别对老鼠伤口进行拍照并取切口处组织进行h&e染色和组织学分析。
实验结果:
图4为聚谷氨酸和人表皮生长因子纳米脂质体促伤口愈合效果图(a.对照组,b.聚谷氨酸脂质体c.脂质体1号,d.脂质体2号)。由图4可知,聚谷氨酸脂质体、脂质体1号和脂质体2号组切口均对合良好,对照组皮肤切缘不能完全闭合。术后7天对照组和聚谷氨酸脂质体组有结痂,脂质体1号有少许红肿,脂质体2号愈合良好。术后14天,四组大鼠的伤口均愈合良好。
图5为聚谷氨酸和人表皮生长因子纳米脂质体促伤口愈合组织学分析图(100×;a.对照组,b.聚谷氨酸脂质体;c.脂质体1号,d.脂质体2号)。由图5可知,术后7天,对照组切口有明显的凹陷,其他组均被肉芽组织填充。术后14天,对照组和聚谷氨酸组仍有明显的肉芽组织,脂质体1号愈合良好,而脂质体2号恢复情况最好,基本恢复正常皮肤结构。
上述结果表明,聚谷氨酸和人表皮生长因子复配不仅具有优良的生物相容性同时具有较好的促进伤口愈合和组织再生的能力。脂质体2号较脂质体1号能够明显加快伤口愈合,说明高低分子量聚谷氨酸和人表皮生长因子的复配对促进伤口愈合有加乘效果,小分子量的聚谷氨酸对伤口愈合有明显促进作用。
实施例17、聚谷氨酸分子量筛选实验
按照实施例2的制备方法,改变聚谷氨酸的高低分子量,分别制备聚谷氨酸和人表皮生长因子纳米脂质体,并通过细胞增殖活性实验(实验过程详见实施例15)来选择最佳参数,以实施例12制备得到的脂质体1号组为对照。实验结果见表1。
表1
由表1可知,相比于脂质体1号组,高、低分子量聚谷氨酸和人表皮生长因子复配对细胞增殖的促进作用明显增强,对促进细胞增殖活性有加乘效果。当分子量≥400000道尔顿的聚谷氨酸与分子量≤10000道尔顿的聚谷氨酸复配时,细胞增殖率优于范围之外的细胞增殖率。
- 还没有人留言评论。精彩留言会获得点赞!