大萼香茶菜乙素二乙酰化物的药物新用途的制作方法
本发明属于医药领域,具体涉及大萼香茶菜乙素二乙酰化物在制备抑制食管鳞癌细胞及非小细胞肺癌细胞增殖的产品中的应用。
背景技术:
胸部是恶性肿瘤的高发部位,主要包括食管癌、贲门癌、肺癌及其他纵隔肿瘤,其中食管癌和肺癌是最常见的胸部恶性肿瘤,并且食管癌和肺癌预后非常差,中国癌症统计报告提示2015年我国新增肺癌患者约73万,因肺癌死亡患者约61万,新增食管癌患者约48万,因食管癌死亡患者约38万,其中肺癌的发病率及死亡率均居所有癌种第1位,食管癌发病率和死亡率分别居于第3位和第4位。由此可见,虽然近些年对于癌症的研究、预防及治疗手段都有了极大的发展,但肺癌和食管癌的发病率及病死率仍居高不下威胁生命,有效的新的治疗手段的研究任务仍然非常紧迫。
食管鳞癌(esophagealsquamouscellcarcinoma,escc)是一种恶性程度非常高的肿瘤,是我国食管癌的主要病理类型。由于食管鳞癌的症状出现较晚,就诊时大多数患者已是临床中晚期,化学药物的治疗占据重要地位。晚期食管癌的化疗至今仍然未能确定标准的化疗方案,顺铂单药有效率约为21%,与5-fu的联合将有效率提高到25-35%;近些年包括紫杉醇、多西他赛和伊立替康等药物与顺铂和/或5-fu联合治疗晚期食管癌有效率可达50%以上。食管癌的靶向治疗、或靶向药物与放化疗联合应用能否提高疗效尚无定论。因此对于晚期食管癌,治疗手段及疗效都非常有限,需要继续寻找更有效的药物以提高有效率,延长患者生存期。
肺癌非小细胞肺癌(non-smallcelllungcancer,nsclc)占据绝大多数。中晚期非小细胞肺癌最佳支持治疗的中位生存期仅为4-5个月、1年生存率为10%。2008年nsclccg(non-smallcelllungcancercollaborativegroup)针对新药物及新的临床研究更新荟萃分析,针对晚期非小细胞肺癌,其中11项研究采用含铂方案,另外4项研究为不含铂的单药化疗方案(依托泊苷、长春瑞滨、吉西他滨和紫杉醇),与最佳支持组相比,化疗患者有显著生存获益,1年相对生存率增加23%,绝对生存率增加9%,中位生存期增加1.5个月。因此化疗可以使患者获益,但传统化疗对晚期nsclc患者的生存时间延长有限,新的更有效的药物的研发任务艰巨。靶向治疗为敏感突变患者提供了新的治疗方案,但拥有敏感突变的患者不足50%,且靶向药物最终都将发生耐药。
唇形科(labiatae)香茶菜属(isodon)植物是我国民间广泛使用的中草药,该属植物以全草或根入药,具有清热利湿、活血散瘀、解毒消肿等功效,富含结构多样的活性二萜类化合物。林生香茶菜(isodonsilvatica)为香茶菜属(isodon)植物,主产于西藏,生于林间隙地。大萼香茶菜乙素二乙酰化物(acetyl-macrocalinb)是从大萼香茶菜(isodonmacrocalyx(dunn)hara)发现的新化合物大萼香茶菜乙素(macrocalinb)通过乙酰化反应得到的6,11-二乙酰化的衍生物,为一合成产物。
技术实现要素:
本发明的一个目的是提供大萼香茶菜乙素二乙酰化物(acetyl-macrocalinb)的药物新用途。
所述大萼香茶菜乙素二乙酰化物的结构式如式(ⅰ)所示:
本发明所提供的大萼香茶菜乙素二乙酰化物的药物新用途是其在制备具有下述1)-18)中至少一种功能的产品中的应用;
1)预防和/或治疗肿瘤;2)抑制肿瘤生成;3)抑制肿瘤细胞增殖;4)抑制肿瘤细胞的克隆形成;5)影响肿瘤细胞周期进程;6)诱导肿瘤细胞周期阻滞;7)抑制肿瘤细胞的dna修复;8)诱导肿瘤细胞的凋亡;9)上调促进细胞凋亡蛋白的表达量;10)上调cleaved-caspase-9的表达量;11)上调cleaved-caspase-3的表达量;12)上调cleaved-parp的表达量;13)激活肿瘤细胞氧化应激;14)增加肿瘤细胞ros水平;15)激活p38mapk信号通路;16)激活caspase-9依赖的凋亡通路;17)抑制肿瘤组织细胞ki67表达;18)抑制肿瘤细胞引起的肿瘤的生长。
本发明的另一个目的是提供一种产品;所述产品具有下述1)-18)中至少一种功能;
1)预防和/或治疗肿瘤;2)抑制肿瘤生成;3)抑制肿瘤细胞增殖;4)抑制肿瘤细胞的克隆形成;5)影响肿瘤细胞周期进程;6)诱导肿瘤细胞周期阻滞;7)抑制肿瘤细胞的dna修复;8)诱导肿瘤细胞的凋亡;9)上调促进细胞凋亡蛋白的表达量;10)上调cleaved-caspase-9的表达量;11)上调cleaved-caspase-3的表达量;12)上调cleaved-parp的表达量;13)激活肿瘤细胞氧化应激;14)增加肿瘤细胞ros水平;15)激活p38mapk信号通路;16)激活caspase-9依赖的凋亡通路;17)抑制肿瘤组织细胞ki67表达;18)抑制肿瘤细胞引起的肿瘤的生长。
本发明提供的产品的活性成分包括大萼香茶菜乙素二乙酰化物;
上述应用或产品中,所述肿瘤为癌,所述癌具体可为食管鳞癌和/或非小细胞肺癌。
上述应用或产品中,所述肿瘤细胞为癌细胞,所述癌细胞具体可为食管鳞癌细胞和/或非小细胞肺癌细胞。所述食管鳞癌细胞具体可为kyse30细胞和kyse450细胞。所述非小细胞肺癌细胞具体可为h1299细胞和a549细胞。
上述应用或产品中,所述5)和6)中,所述细胞周期均为g2/m期。
上述任一所述cleaved-caspase-9的geneid为842。
上述任一所述cleaved-caspase-3的geneid为836。
上述任一所述cleaved-parp的geneid为142。
上述任一所述p38的geneid为1432。
上述应用或产品中,所述大萼香茶菜乙素二乙酰化物具体可为林生香茶菜提取物,所述林生香茶菜提取物具体可为林生香茶菜酮提物,所述酮具体可为丙酮。
所述林生香茶菜提取物的制备方法可包括如下步骤:以林生香茶菜的叶子为原料,依次进行丙酮浸泡、乙酸乙酯萃取、mci脱色、硅胶色谱柱分析和重结晶。
在本发明的具体实施例中,所述林生香茶菜提取物的具体制备方法如下:
1)将林生香茶菜的叶子依次进行干燥和研磨,得到粉末状样品;
2)将所述粉末状样品在丙酮水溶液中浸泡,浸泡后过滤,收集滤液;
3)将所述滤液进行减压蒸馏,去除所述滤液中的丙酮,得到粗提取液;
4)向所述粗提取液中加入乙酸乙酯进行萃取,得到乙酸乙酯萃取液;
5)对所述乙酸乙酯萃取液进行mci脱色,得到黄色胶状物;
6)使用硅胶色谱柱纯化所述黄色胶状物,得到主要级分a-f;然后利用rp-18纯化组分b,得到五个亚级馏分b1-b5;再通过硅胶柱层析分离得到馏分b1,并将所述馏分b1溶于甲醇水溶液中进行重结晶,得到的固体物质即为大萼香茶菜乙素二乙酰化物。
所述大萼香茶菜乙素二乙酰化物的结构式如式(ⅰ)所示。
上述方法中,所述丙酮水溶液具体可为体积分数为70%的丙酮水溶液。所述丙酮水溶液与所述粉末状样品的配比可为7l:5kg,每次浸泡3天,共3次。所述硅胶色谱柱为100-200目和200-300目孔径硅胶的硅胶色谱柱。
所述甲醇水溶液的体积分数为90%。
所述产品可为药物,所述药物可由所述大萼香茶菜乙素二乙酰化物和药物载体组成,所述药物载体可为药理上可接受的所有的药物载体。
上述药物具体可为如下药物:
药物1:大萼香茶菜乙素二乙酰化物,以及利用混合溶剂、纳米药物晶体技术和环糊精制成制剂,按常规加注射用水,精滤,灌封灭菌制成注射液。
药物2:大萼香茶菜乙素二乙酰化物,以及利用混合溶剂、纳米药物晶体技术和环糊精制成制剂,将其溶于无菌注射用水中,搅拌使溶,用无菌抽滤漏斗过滤,再无菌精滤,低温冷冻干燥后无菌熔封得粉针剂。
药物3:大萼香茶菜乙素二乙酰化物,以及利用混合溶剂、纳米药物晶体技术和环糊精制成制剂,与赋形剂重量比为9:1的比例加入赋形剂,制成粉剂。
药物4:大萼香茶菜乙素二乙酰化物,以及利用混合溶剂、纳米药物晶体技术和环糊精制成制剂,按其与赋形剂重量比为1:5-1:10的比例加入赋形剂,制粒压片。
药物5:大萼香茶菜乙素二乙酰化物,以及利用混合溶剂、纳米药物晶体技术和环糊精制成制剂,按常规口服液制法制成口服液。
药物6:大萼香茶菜乙素二乙酰化物,以及利用混合溶剂、纳米药物晶体技术和环糊精制成制剂,按其与赋形剂重量比为5:1的比例加入赋形剂,制成胶囊或颗粒剂或冲剂。
药物7:大萼香茶菜乙素二乙酰化物,以及利用混合溶剂、纳米药物晶体技术和环糊精制成制剂,按其与赋形剂重量比为3:1的比例加入赋形剂,制成胶囊或颗粒剂或冲剂。
本发明首次从林生香茶菜中分离得到大萼香茶菜乙素二乙酰化物(acetyl-macrocalinb),并发现大萼香茶菜乙素二乙酰化物可抑制食管鳞癌细胞及非小细胞肺癌细胞的增殖、抑制食管鳞癌细胞及非小细胞肺癌细胞的克隆形成、影响食管鳞癌细胞及非小细胞肺癌细胞周期进程、诱导食管鳞癌细胞及非小细胞肺癌细胞周期阻滞、抑制食管鳞癌细胞及非小细胞肺癌细胞的dna修复、诱导食管鳞癌细胞及非小细胞肺癌细胞凋亡、上调cleaved-caspase-9、cleaved-caspase-3和cleaved-parp的表达量、激活细胞氧化应激、增加细胞ros水平、激活p38mapk信号通路,进而激活caspase-9依赖的凋亡通路和抑制食管鳞癌细胞引起的肿瘤的生长,具有重要的应用价值。
附图说明
图1为大萼香茶菜乙素二乙酰化物的1h-nmr谱。
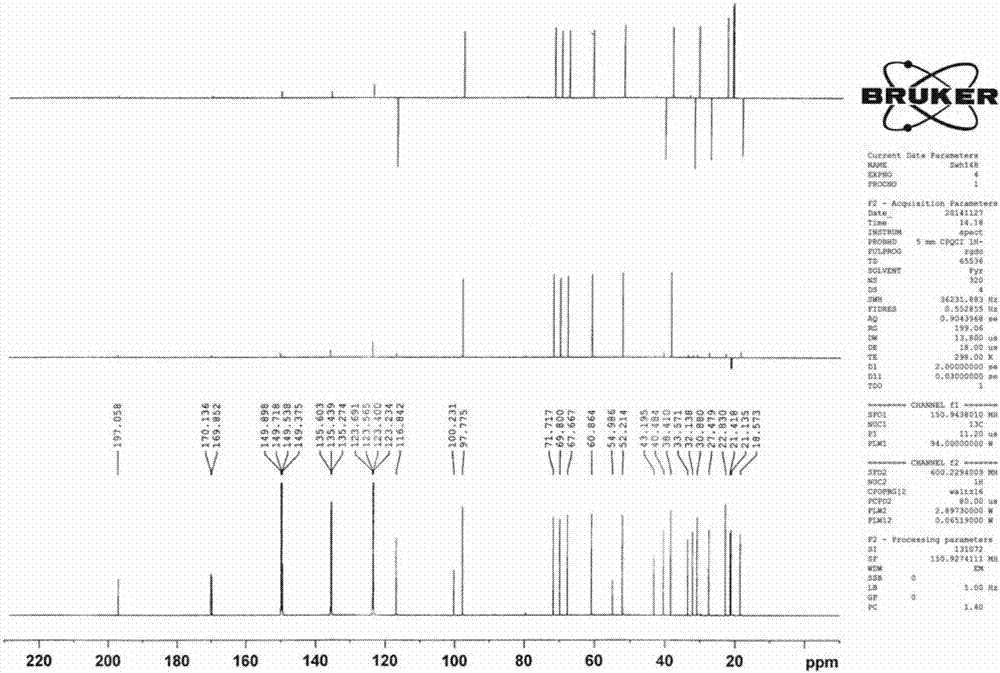
图2为大萼香茶菜乙素二乙酰化物的13c-nmr谱。
图3为大萼香茶菜乙素二乙酰化物的高分辨质谱图(hresims)。
图4为大萼香茶菜乙素二乙酰化物的hplc图谱。
图5为实施例2中大萼香茶菜乙素二乙酰化物作用72h食管鳞癌细胞(kyse30和kyse450)和非小细胞肺癌细胞(h1299和a549)ic50值。
图6为实施例2中大萼香茶菜乙素二乙酰化物作用于食管鳞癌细胞(kyse30和kyse450)和非小细胞肺癌细胞(h1299和a549)增殖曲线及柱状图。
图7为实施例2中大萼香茶菜乙素二乙酰化物抑制食管鳞癌细胞(kyse30和kyse450)和非小细胞肺癌细胞(h1299和a549)克隆形成的结果图。
图8为实施例3中大萼香茶菜乙素二乙酰化物诱导食管鳞癌细胞及非小细胞肺癌细胞凋亡的结果图。
图9为实施例3中westernblot检测大萼香茶菜乙素二乙酰化物作用于食管鳞癌细胞(kyse30和kyse450)和非小细胞肺癌细胞(h1299和a549)后凋亡通路蛋白的表达水平。
图10为实施例4中大萼香茶菜乙素二乙酰化物引起食管鳞癌及非小细胞肺癌细胞内ros升高,抗氧化剂nac可逆转这种现象的结果图。
图11为实施例4中抗氧化剂nac作用逆转大萼香茶菜乙素二乙酰化物造成的食管鳞癌和非小细胞肺癌细胞凋亡。
图12为实施例4中抗氧化剂nac作用逆转大萼香茶菜乙素二乙酰化物造成的食管鳞癌和非小细胞肺癌细胞凋亡的机制。
图13为实施例5中大萼香茶菜乙素二乙酰化物诱导食管鳞癌细胞和非小细胞肺癌细胞g2/m期阻滞。
图14为实施例5中大萼香茶菜乙素二乙酰化物激活食管鳞癌细胞及非小细胞肺癌细胞的chk1/2通路诱导g2/m期阻滞,并通过抑制atm/atr-brca1通路阻碍dna修复功能。
图15为实施例6中食管鳞癌kyse30细胞裸鼠成瘤大萼香茶菜乙素二乙酰化物体内抑制实验结果图。a为各组小鼠处死时的状态,b为各组小鼠的肿瘤组织,c为各组小鼠的肿瘤生长曲线,d为各组小鼠的平均肿瘤重量的统计结果,e为各组小鼠的体重,f为各组小鼠的肝肾he染色;control为对照组,ddp为顺铂组,a-macb为大萼香茶菜乙素二乙酰化物组。
图16为实施例6中非小细胞肺癌h1299细胞裸鼠成瘤大萼香茶菜乙素二乙酰化物体内抑制实验。a为各组小鼠处死时的状态,b为各组小鼠的肿瘤组织,c为各组小鼠的肿瘤生长曲线,d为各组小鼠的平均肿瘤重量的统计结果,e为各组小鼠的体重,f为各组小鼠的肝肾he染色;control为对照组,ddp为顺铂组,a-macb为大萼香茶菜乙素二乙酰化物组。
图17为实施例6中大萼香茶菜乙素二乙酰化物显著抑制食管鳞癌细胞kyse30体内成瘤组织细胞ki67表达,诱导细胞凋亡。
图18为实施例6中大萼香茶菜乙素二乙酰化物显著抑制非小细胞肺癌细胞h1299体内成瘤组织细胞ki67表达,诱导细胞凋亡。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
食管鳞癌细胞(kyse30细胞和kyse450细胞)和非小细胞肺癌细胞(h1299细胞和a549细胞)均由中国医学科学院肿瘤医院肿瘤研究所提供。经过str鉴定,kyse30细胞和kyse450细胞均符合日本细胞库(jcrb)提供的str位点谱,h1299细胞和a549细胞均符合cosmic提供的str位点谱。
结晶紫为碧云天公司的产品,产品目录号为c0121。细胞周期检测试剂盒为江苏凯基生物技术股份有限公司的产品,产品目录号为kga512。cck8为同仁化学研究所的产品,产品目录号为ck04。细胞凋亡检测试剂盒(商品名称为:annexinv,fitcapoptosisdetectionkit)为同仁化学研究所的产品,产品目录号为556547。无胸腺裸鼠为华阜康公司的产品,产品目录号为no.11401300035372。dnadamageantibodysamplerkit、cdc25cantibody、cdc2antibody、phospho-cdc2antibody、cyclinb1antibody、gapdhantibody、apoptosisantibodysamplerkit、caspase8antibody、baxantibody、bcl-2antibody、phospho-histoneh3、cyclina2、cdc25a、p38mapk和phospho-p38mapkpathwaysamplerkit均为cellsignalingtechnology公司的产品,产品目录号分别为#9947、#9555、#9112、#4539、#4138、#5174、#9915、#9746、#2772、#2870、#3377、#4656、#3652、#8690和#9913。
使用dmso配制浓度分别为0.25mm、0.5mm、1mm、1.5mm、2mm、2.5mm、3mm、4mm、5mm、6mm、8mm、10mm、12mm和16mm的大萼香茶菜乙素二乙酰化物母液,用1640完全培养液将上述浓度的大萼香茶菜乙素二乙酰化物母液分别稀释1000倍,得到dmso含量均为0.1%(v/v)、大萼香茶菜乙素二乙酰化物浓度为0.25μm的大萼香茶菜乙素二乙酰化物溶液1、大萼香茶菜乙素二乙酰化物浓度为0.5μm的大萼香茶菜乙素二乙酰化物溶液2、浓度为1μm的大萼香茶菜乙素二乙酰化物溶液3、浓度为1.5μm的大萼香茶菜乙素二乙酰化物溶液4、浓度为2μm的大萼香茶菜乙素二乙酰化物溶液5、浓度为2.5μm的大萼香茶菜乙素二乙酰化物溶液6、浓度为3μm的大萼香茶菜乙素二乙酰化物溶液7、浓度为4μm的大萼香茶菜乙素二乙酰化物溶液8、浓度为5μm的大萼香茶菜乙素二乙酰化物溶液9、浓度为6μm的大萼香茶菜乙素二乙酰化物溶液10、浓度为8μm的大萼香茶菜乙素二乙酰化物溶液11,浓度为10μm的大萼香茶菜乙素二乙酰化物溶液12,浓度为12μm的大萼香茶菜乙素二乙酰化合物溶液13和浓度为16μm的大萼香茶菜乙素二乙酰化合物溶液14。
实施例1、制备大萼香茶菜乙素二乙酰化物(acetyl-macrocalinb)
一、大萼香茶菜乙素二乙酰化物(acetyl-macrocalinb)的制备方法
大萼香茶菜乙素二乙酰化物的结构式如式(ⅰ)所示。自2014年9月开始在我国西藏地区采集林生香茶菜(isodonsilvatica),凭证标本(kib2014090126)存放在中国科学院昆明植物研究所西华植物资源与植物资源国家重点实验室,制备大萼香茶菜乙素二乙酰化物的步骤如下:
1、将采集的林生香茶菜植株叶子部分经干燥处理得到植物原料(5kg),室温环境中粉碎处理浸泡于体积为7l的体积分数为70%的丙酮水溶液中,每3天更换一次新鲜的丙酮水溶液,浸泡9天后过滤,收集滤液。
2、在真空条件下蒸发步骤1获得的滤液,去除滤液中的丙酮,得到粗提取物。
3、将步骤2获得的粗提取物溶于5lh2o中,然后加入乙酸乙酯进行萃取,得到乙酸乙酯萃取液。
4、将上述的乙酸乙酯萃取液过滤,除去不溶于90:10(v/v)ch3oh:h2o溶液的沉积物后,用mci凝胶将乙酸乙酯-可溶级份(180g)用90:10(v/v)ch3oh:h2o脱色,得到黄色胶状物(33g)。
5、将浸膏(黄色胶状物)用100-200目的硅胶柱层析分离,注入由chcl3:丙酮(v/v)比例分别为1:0、9:1、8:2、7:3、6:4和1:1组成的梯度系统进行纯化,得到六个主要级分(a-f)。
6、利用rp-18(30:70至80:20(v/v),ch3oh:h2o)纯化组分b(chcl3:丙酮=9:1(v/v);20g),得到五个亚级馏分b1-b5;然后通过200-300目硅胶柱层析(30:70(v/v),ch3oh:h2o)分离得到馏分b1,并将其溶于体积分数为90%的甲醇水溶液中进行重结晶,得到化合物粉末(10g)。
二、结构鉴定
1、将步骤一的7中获得的化合物粉末分别进行质谱分析、1h核磁共振波谱检测和13c核磁共振波谱检测。
化合物粉末的1h-nmr、13c-nmr和质谱分析结果分别如图1、图2和图3所示。
1hnmr(c5d5n,600mhz):δ1.51(1h,s,h-5),5.57(1h,d,j=1.3hz,h-6α),2.61(1h,s,h-9β),5.33(1h,d,j=5.6hz,h-11α),2.60(1h,m,h-12a),1.86(1h,m,h-12b),3.16(1h,brs,h-13α),4.94(1h,d,j=6.0hz,h-14α),6.14(1h,s,h-17a),5.31(1h,s,h-17b),0.83(3h,s,h3-18),0.81(3h,s,h3-19),5.45(1h,s,h-20),2.31and1.88(each3h,2×oac);
13cnmr(c5d5n,150mhz):δ27.5(t,c-1),18.6(t,c-2),40.5(t,c-3),33.6(s,c-4),60.9(d,c-5),71.7(d,c-6),100.2(s,c-7),55.0(s,c-8),52.2(d,c-9),43.2(s,c-10),67.7(d,c-11),32.1(t,c-12),38.4(d,c-13),69.8(d,c-14),197.1(s,c-15),149.4(s,c-16),116.8(t,c-17),30.9(q,c-18),22.8(q,c-19),97.8(d,c-20),21.4,21.1,170.1,169.9(oac).hrms(m/z):[m]+calcd.forhrms(m/z):[m+na]+calcd.forc24h30o8na,469.1833;found,469.1845。
上述结果表明,本发明分离得到的化合物粉末为白色粉末状的固体物质,其分子式为c24h30o8,高分辨质谱中[m+na]+峰为469.1845,故其分子量为446,结构式如式(ⅰ)所示,为对映-贝壳杉烷二萜类化合物(ent-kauranediterpenoid),其检测结果与文献(程培元,林永乐,徐光漪,大萼香茶菜新二萜成分:大萼香茶菜甲素和乙素的结构.药学学报.1984,19(8):593-598.)报道的关于大萼香茶菜乙素二乙酰化物(acetyl-macrocalinb)的数据进行比对完全吻合。综上所述,确定步骤一中分离得到的化合物粉末为大萼香茶菜乙素二乙酰化物(acetyl-macrocalinb)。
2、在agilent1200液相色谱仪上对步骤一的7中获得的化合物粉末进行纯化分析,使用zorbaxsb-c18色谱柱(4.6mm×250mm,5μm),流动相为ch3cn:h2o(10%-100%,30min),检测波长为238nm,流速:1.0ml/min。结果表明:化合物粉末的纯度大于98%(图4)。
3、用微量天平称取适量化合物粉末,置入ep管中,取dmso溶液加入ep管中,使用移液器反复抽吸混匀使化合物完全溶解后,置于-20℃环境长期干燥保存。
实施例2、大萼香茶菜乙素二乙酰化物对食管鳞癌和非小细胞肺癌细胞的细胞毒性
一、大萼香茶菜乙素二乙酰化物抑制食管鳞癌细胞和非小细胞肺癌细胞的增殖
1、用含10%(v/v)胎牛血清、1%(100u/ml)青霉素和1%(100μg/ml)链霉素的改良型rpmi-1640培养液培养细胞(食管鳞癌kyse30细胞或kyse450细胞;非小细胞肺癌h1299细胞或a549细胞)至对数增殖期,然后消化重悬,得到浓度为2×104个/ml的细胞悬浮液。
2、取96孔细胞培养板,每孔加入100μl步骤1获得的细胞悬浮液(每孔约2000个细胞),细胞贴壁后换液为100μl大萼香茶菜乙素二乙酰化物溶液(大萼香茶菜乙素二乙酰化物溶液1、大萼香茶菜乙素二乙酰化物溶液2、大萼香茶菜乙素二乙酰化物溶液3、大萼香茶菜乙素二乙酰化物溶液4、大萼香茶菜乙素二乙酰化物溶液5、大萼香茶菜乙素二乙酰化物溶液6、大萼香茶菜乙素二乙酰化物溶液7、大萼香茶菜乙素二乙酰化物溶液8或大萼香茶菜乙素二乙酰化物溶液10),5%co2、37℃培养12h、24h、48h或72h;然后每孔加入100μl含10%(10μl/1ml)cck8的1640完全培养液,采用酶标仪检测在450nm处的吸光值。
在96孔细胞培养板中设置阴性对照孔,每个阴性对照孔加入100μl步骤1所得细胞悬液,即每孔约2000细胞。阴性对照组待细胞贴壁后换液为100μl含0.1%dmso(v/v)的1640完全培养液(与大萼香茶菜乙素二乙酰化物溶液同一时间点换液),5%co2、37℃培养12h、24h、48h或72h;然后每孔加入100μl含10%(10μl/1ml)cck8的1640完全培养液,采用酶标仪检测阴性对照孔在450nm处的吸光值。
以大萼香茶菜乙素二乙酰化物在孔中的浓度为横坐标,相对活性为纵坐标,比较大萼香茶菜乙素二乙酰化物处理后待测细胞的增殖程度。相对活性根据下述公式计算:相对活性(%)=(大萼香茶菜乙素二乙酰化物溶液在450nm处的吸光值-无细胞空白对照在450nm处的吸光值)/(阴性对照在450nm处的吸光值-无细胞空白对照在450nm处的吸光值)×100%。
实验结果表明,大萼香茶菜乙素二乙酰化物可显著抑制食管鳞癌kyse30和kyse450细胞以及非小细胞肺癌h1299和a549细胞的增殖。kyse30、kyse450、h1299和a549细胞72h的ic50分别为1.42μm、1.43μm、0.61μm和2.20μm(图5);大萼香茶菜乙素二乙酰化物对食管鳞癌kyse30和kyse450细胞以及非小细胞肺癌h1299和a549细胞的生长抑制呈剂量和时间依赖性(图6)。
二、大萼香茶菜乙素二乙酰化物抑制食管鳞癌细胞以及非小细胞肺癌细胞的克隆形成
1、用含10%(v/v)胎牛血清、1%(100u/ml)青霉素和1%(100μg/ml)链霉素的改良型rpmi-1640培养液培养细胞(食管鳞癌kyse30细胞或kyse450细胞;非小细胞肺癌h1299细胞或a549细胞)至对数增殖期,然后消化重悬,得到浓度为1×104个/ml的细胞悬浮液。
2、取6孔板,每孔加入1950μl1640完全培养液和50μl步骤1获得的细胞悬浮液(每孔约500个细胞),5%co2、37℃培养12h。
3、完成步骤2后,取所述6孔板,弃液相,加入2ml大萼香茶菜乙素二乙酰化物溶液(kyse30、kyse450和h1299为大萼香茶菜乙素二乙酰化物溶液2或大萼香茶菜乙素二乙酰化物溶液3,a549细胞为大萼香茶菜乙素二乙酰化物溶液3或大萼香茶菜乙素二乙酰化物溶液5),5%co2、37℃培养24h。
4、完成步骤3后,取所述6孔板,弃液相,加入2ml1640完全培养液,5%co2、37℃培养7d。
5、完成步骤4后,将采用结晶紫染色,观察集落数目及大小。
按照上述步骤,将步骤3中的“大萼香茶菜乙素二乙酰化物溶液”替换为含0.1%(v/v)dmso的1640完全培养液,其它步骤均不变中,作为对照。
实验结果见图7。结果表明,与对照相比,大萼香茶菜乙素二乙酰化物温育24h后,kyse30、kyse450、h1299和a549细胞形成的集落数目明显减少,面积也较小;大萼香茶菜乙素二乙酰化物的浓度越高,kyse30、kyse450、h1299和a549细胞形成的集落数目越少。
上述结果表明,大萼香茶菜乙素二乙酰化物对食管鳞癌细胞(如kyse30细胞、kyse450细胞)和非小细胞肺癌细胞(如h1299细胞、a549细胞)具有显著的细胞毒性。
实施例3、大萼香茶菜乙素二乙酰化物诱导食管鳞癌细胞和非小细胞肺癌细胞凋亡
一、大萼香茶菜乙素二乙酰化物诱导食管鳞癌细胞和非小细胞肺癌细胞凋亡
实验重复三次取平均值,每次重复的步骤如下:
1、用含10%(v/v)胎牛血清、1%(100u/ml)青霉素和1%(100μg/ml)链霉素的改良型rpmi-1640培养液培养细胞(食管鳞癌kyse30细胞或kyse450细胞;非小细胞肺癌h1299细胞或a549细胞)至对数增殖期,然后消化重悬,得到浓度为5×104个/ml的细胞悬浮液。取培养皿(规格为6cm),加入4ml细胞悬浮液(即每培养皿铺有2×105个细胞),5%co2、37℃培养12h。
2、完成步骤1后,取所述培养皿,弃液相,加入4ml无血清培养液1640,5%co2、37℃培养12h(饥饿培养,目的为使细胞同步化)。
3、取完成步骤2的细胞,弃液相,加入4ml大萼香茶菜乙素二乙酰化物溶液(kyse30和kyse450:2μm大萼香茶菜乙素二乙酰化物溶液5或5μm大萼香茶菜乙素二乙酰化物溶液9;h1299:3μm大萼香茶菜乙素二乙酰化物溶液7或6μm大萼香茶菜乙素二乙酰化物溶液10;a549:4μm大萼香茶菜乙素二乙酰化物溶液8或8μm大萼香茶菜乙素二乙酰化物溶液11),5%co2、37℃培养24h或48h。
4、完成步骤3后,收集上清,并消化细胞,将上清与消化下来的细胞一同离心并收集沉淀。
5、完成步骤4后,取沉淀,先用ph7.4、10mm的pbs缓冲液清洗两遍,然后用细胞凋亡检测试剂盒染色,最后用流式细胞仪检测细胞的凋亡情况。
按照上述步骤,将步骤3中的“大萼香茶菜乙素二乙酰化物溶液”替换为含0.1%(v/v)dmso的1640完全培养液,其它步骤均不变中,作为对照。
实验结果见图8(control和dmso均为对照)。结果表明,与对照相比,大萼香茶菜乙素二乙酰化物处理的食管鳞癌细胞(如kyse30细胞、kyse450细胞)和非小细胞肺癌细胞(如h1299细胞、a549细胞)发生凋亡的比例显著增加,且大萼香茶菜乙素二乙酰化物浓度越高,则发生凋亡的比例越高。因此,大萼香茶菜乙素二乙酰化物可诱导食管鳞癌细胞及非小细胞肺癌细胞凋亡。
二、检测凋亡相关蛋白的变化
已有研究表明,cleaved-caspase-9(geneid:842;以下简称c-cas9)、cleaved-caspase-3(geneid:836;以下简称c-cas3)、cleaved-caspase-8(geneid:841;以下简称c-cas8)、cleaved-parp(geneid:142;以下简称parp)和bax(geneid:581)均为促进细胞凋亡蛋白;bcl-2(geneid:596)为抑制细胞凋亡蛋白。p38(geneid:1432)是mapk家族控制炎症反应最重要的成员,它可因生理性应激、脂多糖、渗透性应激及紫外线照射等因素而激活。p38激活后发生核转位,并且对许多蛋白激酶和转录因子都具有磷酸化和激活的作用。此外,p38通路在细胞凋亡过程中可能在caspase上游和下游均起作用,因此p38信号通路既参与细胞增殖、分化,也参与细胞凋亡,p38激活后可激活下游基因hsp27(geneid:3315)。对上述与细胞凋亡相关的通路中的关键蛋白进行检测。
1、同实施例3步骤一中1。
2、同实施例3步骤一中2。
3、取完成步骤2的细胞,弃液相,加入4ml大萼香茶菜乙素二乙酰化物溶液(kyse30和kyse450:大萼香茶菜乙素二乙酰化物溶液3、5、7、8和9;h1299:大萼香茶菜乙素二乙酰化物溶液3、5、7、8和10;a549:大萼香茶菜乙素二乙酰化物溶液3、5、8、10和11),5%co2、37℃培养24h或48h。
4、完成步骤3后,将细胞总蛋白进行westernblot(采用apoptosisantibodysamplerkit检测parp、c-cas9和c-cas3,采用caspase8antibody检测c-cas8,采用baxantibody检测bax,采用bcl-2antibody检测bcl-2,采用p38mapk抗体检测p38,采用phospho-p38mapkpathwaysamplekit检测p-38mapk(thr180/tyr182)和p-hsp27(ser82),采用gapdhantibody检测gapdh)。
按照上述步骤,将步骤3中的“大萼香茶菜乙素二乙酰化物溶液”替换为含0.1%(v/v)dmso的1640完全培养液,其它步骤均不变中,作为对照。
实验结果见图9(control为对照,上方图为食管鳞癌细胞(kyse30和kyse450),下方图为非小细胞肺癌细胞(h1299和a549))。结果表明,随着大萼香茶菜乙素二乙酰化物浓度的不断提高,p38mapk总量无显著变化,而磷酸化的p38随大萼香茶菜乙素二乙酰化物浓度的升高而不断增高,提示p38显著被大萼香茶菜乙素二乙酰化物激活,其下游的p-hsp27也随之被激活。cleaved-caspase-9、cleaved-caspase-3和cleaved-parp的表达量均不断上升,cleaved-caspase-8和bcl-2几乎不表达,bax的表达量无明显变化。因此,大萼香茶菜乙素二乙酰化物通过激活p38mapk,进而激活caspase-9依赖性内源性凋亡通路导致食管鳞癌细胞凋亡,并且是bax和bcl-2非依赖性的。
实施例4、大萼香茶菜乙素二乙酰化物激活食管鳞癌及非小细胞肺癌细胞ros/p38/caspase-9信号通路诱导细胞凋亡
本实验使用的活性氧(reactiveoxygenspecies,ros)检测试剂盒购买于碧云天(reactiveoxygenspeciesassaykit,货号为s0033)。活性氧检测试剂盒是一种利用荧光探针dcfh-da进行活性氧检测的试剂盒。dcfh-da本身没有荧光,可自由穿过细胞膜,进入细胞后,可以被细胞中的酯酶水解生成dcfh。而dcfh不能通过细胞膜,从而使探针很容易地被装载到细胞中。细胞内的活性氧可以氧化无荧光的dcfh生成有荧光的dcf。检测dcf的荧光就可以了解细胞内活性氧的水平。
一、大萼香茶菜乙素二乙酰化物作用引起食管鳞癌及非小细胞肺癌细胞ros水平升高,造成细胞氧化应激,抗氧化剂nac可逆转这种作用。
使用大萼香茶菜乙素二乙酰化物(a-macb)联合ros抑制剂nac(n-乙酰半胱氨酸,n-acetyl-l-cysteine;s0077,碧云天)对细胞进行诱导,共设置4个处理组,包括dmso对照组、a-macb处理组、10mmnac处理组、a-macb+10mmnac处理组,其中含nac的处理组使用含10mmnac预处理2h。每组设3个平行复孔。
实验重复三次取平均值,每次重复的步骤如下:
1、用含10%(v/v)胎牛血清、1%(100u/ml)青霉素和1%(100μg/ml)链霉素的改良型rpmi-1640培养液培养细胞(食管鳞癌kyse30细胞或kyse450细胞;非小细胞肺癌h1299细胞或a549细胞)至对数增殖期,然后消化重悬,得到浓度为5×104个/ml的细胞悬浮液。取培养皿(规格为6cm),加入4ml细胞悬浮液(即每培养皿铺有2×105个细胞),5%co2、37℃培养12h。
2、完成步骤1后,取所述培养皿,弃液相,加入4ml无血清培养液1640,5%co2、37℃培养12h(饥饿培养,目的为使细胞同步化)。
3、取完成步骤2的细胞,弃液相,含nac的处理组(即10mmnac处理组、a-macb+10mmnac处理组)加入含10mmnac的1640培养液4ml预处理2h,不含nac的处理组(即dmso对照组、a-macb处理组)加入1640完全培养液,5%co2、37℃培养2h。
4、取完成步骤3的细胞,dmso对照组弃液相,加入4ml含0.1%dmso的1640完全培养液;a-macb处理组弃液相,加入4mla-macb溶液(kyse30和kyse450:5μm大萼香茶菜乙素二乙酰化物溶液9;h1299:6μm大萼香茶菜乙素二乙酰化物溶液10;a549:8μm大萼香茶菜乙素二乙酰化物溶液11);10mmnac处理组弃液相,加入4ml含10mmnac的1640培养液;a-macb+10mmnac处理组弃液相(a-macb的浓度同对应的a-macb处理组),加入2ml含20mmnac的1640培养液和2ml含不同浓度的a-macb溶液(其中kyse30和kyse450加2ml大萼香茶菜乙素二乙酰化物溶液12,h1299加2ml大萼香茶菜乙素二乙酰化合物溶液13,a549加2ml大萼香茶菜乙素二乙酰化合物溶液14,使kyse30和kyse450细胞a-macb+10mmnac处理组的a-macb浓度细胞为5μm,h1299细胞a-macb+10mmnac处理组的a-macb浓度为6μm,a549细胞a-macb+10mmnac处理组的a-macb浓度为8μm;所有细胞nac的浓度均为10mm);5%co2、37℃培养24h。
5、完成步骤4后,消化收集细胞。
6、完成步骤5后,先用ph7.4、10mm的pbs缓冲液清洗两遍,然后用活性氧检测试剂盒中荧光探针dcfh-da对细胞进行标记,立即上流式细胞仪检测,使用488nm的激发波长,525nm的发射波长,检测不同处理组别荧光的强弱。
实验结果见图10。结果表明,大萼香茶菜乙素二乙酰化物作用后引起了食管鳞癌细胞(kyse30细胞和kyse450细胞)以及非小细胞肺癌细胞(h1299细胞和a549细胞)内ros增高;使用抗氧化剂nac作用后,可逆转细胞内增高的ros。
二、大萼香茶菜乙素二乙酰化物作用引起食管鳞癌及非小细胞肺癌细胞凋亡,抗氧化剂nac可逆转这种作用。
使用大萼香茶菜乙素二乙酰化物(a-macb)联合ros抑制剂nac(n-乙酰半胱氨酸,n-acetyl-l-cysteine;s0077,碧云天)对细胞进行诱导,共设置4个处理组,包括dmso对照组、a-macb处理组、10mmnac处理组、a-macb+10mmnac处理组,其中含nac的处理组使用含10mmnac预处理2h。每组设3个平行复孔。
实验重复三次取平均值,每次重复的步骤如下:
1、同实施例4步骤一中1。
2、同实施例4步骤一中2。
3、同实施例4步骤一中3。
4、同实施例4步骤一中4。
5、完成步骤4后,消化收集细胞。
6、完成步骤5后,取沉淀,先用ph7.4、10mm的pbs缓冲液清洗两遍,然后用细胞凋亡检测试剂盒染色,最后用流式细胞仪检测细胞的凋亡情况。
实验结果见图11。结果表明,大萼香茶菜乙素二乙酰化物作用后引起了食管鳞癌细胞(kyse30细胞和kyse450细胞)以及非小细胞肺癌细胞(h1299细胞和a549细胞)凋亡的发生;使用抗氧化剂nac作用后,可以逆转细胞凋亡的发生。
三、大萼香茶菜乙素二乙酰化物激活食管鳞癌及非小细胞肺癌细胞ros/p38/caspase-9信号通路诱导细胞凋亡
以上研究发现,大萼香茶菜乙素二乙酰化物作用后引起了食管鳞癌细胞(kyse30细胞和kyse450细胞)以及非小细胞肺癌细胞(h1299细胞和a549细胞)内ros增高,同时引起了细胞凋亡的发生;使用ros抑制剂nac作用后,可逆转细胞内增高的ros同时逆转了细胞的凋亡发生。利用westernblot对造成这些现象的机制进行了探讨。
使用大萼香茶菜乙素二乙酰化物(a-macb)联合ros抑制剂nac(n-乙酰半胱氨酸,n-acetyl-l-cysteine;s0077,碧云天)对细胞进行诱导,共设置4个处理组,包括含nac的处理组(即10mmnac处理组、a-macb+10mmnac处理组)加入含10mmnac的1640培养液4ml预处理2h,不含nac的处理组(即dmso对照组、a-macb处理组)加入1640完全培养液,5%co2、37℃培养2h。每组设3个平行复孔。
实验重复三次取平均值,每次重复的步骤如下:
1、用含10%(v/v)胎牛血清、1%(100u/ml)青霉素和1%(100μg/ml)链霉素的改良型rpmi-1640培养液培养细胞(食管鳞癌kyse30细胞或kyse450细胞;非小细胞肺癌h1299细胞或a549细胞)至对数增殖期,然后消化重悬,得到浓度为5×104个/ml的细胞悬浮液。取培养皿(规格为6cm),加入4ml细胞悬浮液(即每培养皿铺有2×105个细胞),5%co2、37℃培养12h。
2、完成步骤1后,取所述培养皿,弃液相,加入4ml无血清培养液1640,5%co2、37℃培养12h(饥饿培养,目的为使细胞同步化)。
3、取完成步骤2的细胞,弃液相,含nac的处理组(即10mmnac处理组、a-macb+10mmnac处理组)加入含10mmnac的1640培养液4ml预处理2h,不含nac的处理组(即dmso对照组、a-macb处理组)加入1640完全培养液,5%co2、37℃培养2h。
4、取完成步骤3的细胞,dmso对照组弃液相,加入4ml含0.1%dmso的1640完全培养液;a-macb处理组弃液相,加入4mla-macb溶液(kyse30和kyse450:5μm大萼香茶菜乙素二乙酰化物溶液9;h1299:6μm大萼香茶菜乙素二乙酰化物溶液10;a549:8μm大萼香茶菜乙素二乙酰化物溶液11);10mmnac处理组弃液相,加入4ml含10mmnac的1640培养液;a-macb+10mmnac处理组弃液相(a-macb的浓度同对应的a-macb处理组),加入2ml含20mmnac的1640培养液和2ml含不同浓度的a-macb溶液(其中kyse30和kyse450加2ml大萼香茶菜乙素二乙酰化物溶液12,h1299加2ml大萼香茶菜乙素二乙酰化合物溶液13,a549加2ml大萼香茶菜乙素二乙酰化合物溶液14,使kyse30和kyse450细胞a-macb+10mmnac处理组的a-macb浓度细胞为5μm,h1299细胞a-macb+10mmnac处理组的a-macb浓度为6μm,a549细胞a-macb+10mmnac处理组的a-macb浓度为8μm;所有细胞nac的浓度均为10mm);5%co2、37℃培养24h。
5、完成步骤4后,收集总蛋白进行westernblot检测(采用apoptosisantibodysamplerkit检测parp、c-cas9和c-cas3,采用dnadamageantibodysamplerkit中的γh2ax检测γh2ax,采用p38mapk抗体检测p38,采用phospho-p38mapkpathwaysamplekit检测p-38mapk(thr180/tyr182)和p-hsp27(ser82),采用gapdhantibody检测gapdh)。
wb检测发现大萼香茶菜乙素二乙酰化物作用于细胞后可激活p38mapk信号通路(图12,a为食管鳞癌细胞kyse30和kyse450结果,b为非小细胞肺癌h1299和a549结果),加入抗氧化剂nac后,细胞内增高的ros被逆转,同时磷酸化的p38mapk显著下降,提示其不能被激活,相应的其下游hsp27的磷酸化被抑制;当p38mapk活性被抑制后,caspase-9和caspase-3的活化受到抑制,不能切割parp,细胞凋亡被明显逆转。
以上结果表明大萼香茶菜乙素二乙酰化物作用后引起细胞内ros升高,从而激活p38mapk,p38mapk的激活可促进caspase-9和caspase-3的活化,抗氧化剂nac通过抑制ros使得p38活化受到抑制,至少可以部分逆转细胞凋亡。
实施例5、大萼香茶菜乙素二乙酰化物影响食管鳞癌细胞及非小细胞肺癌细胞周期进程,并抑制食管鳞癌细胞及非小细胞肺癌细胞的dna修复
一、大萼香茶菜乙素二乙酰化物影响食管鳞癌细胞周期进程
实验重复三次取平均值,每次重复的步骤如下:
1、用含10%(v/v)胎牛血清、1%(100u/ml)青霉素和1%(100μg/ml)链霉素的改良型rpmi-1640培养液培养细胞(食管鳞癌kyse30细胞或kyse450细胞;非小细胞肺癌h1299细胞或a549细胞)至对数增殖期,然后消化重悬,得到浓度为5×104个/ml的细胞悬浮液。取培养皿(规格为6cm),加入4ml细胞悬浮液(即每培养皿铺有2×105个细胞),5%co2、37℃培养12h。
2、完成步骤1后,取所述培养皿,弃液相,加入4ml无血清培养液1640,5%co2、37℃培养12h(饥饿培养,目的为使细胞同步化)。
3、取完成步骤2的细胞,弃液相,加入4ml大萼香茶菜乙素二乙酰化物溶液(kyse30和kyse450:2μm大萼香茶菜乙素二乙酰化物溶液5或4μm大萼香茶菜乙素二乙酰化物溶液8;h1299:2μm大萼香茶菜乙素二乙酰化物溶液5或4μm大萼香茶菜乙素二乙酰化物溶液8;a549:3μm大萼香茶菜乙素二乙酰化物溶液7或6μm大萼香茶菜乙素二乙酰化物溶液10),5%co2、37℃培养24h。
4、完成步骤3后,离心,收集沉淀。
5、取步骤4收集的沉淀,加入70%(v/v)乙醇水溶液,置于4℃固定12h;然后采用细胞周期检测试剂盒染色,最后用流式细胞仪检测g2/m期细胞、s期细胞、g0/g1期细胞的百分比。
按照上述步骤,将步骤3中的“大萼香茶菜乙素二乙酰化物溶液”替换为含0.1%(v/v)dmso的1640完全培养液,其它步骤均不变中,作为对照。
实验结果见图13(a为食管鳞癌细胞kyse30和kyse450结果,b为非小细胞肺癌h1299和a549结果)。结果表明,与对照相比,大萼香茶菜乙素二乙酰化物处理的g2/m期食管鳞癌细胞(如kyse30细胞、kyse450细胞)以及非小细胞肺癌细胞(如h1299细胞、a549细胞)的百分比显著增加,且大萼香茶菜乙素二乙酰化物浓度越高,则百分比越高。因此,大萼香茶菜乙素二乙酰化物可影响食管鳞癌细胞和非小细胞肺癌细胞周期进程,诱导食管鳞癌细胞和非小细胞肺癌细胞细胞周期阻滞。
二、大萼香茶菜乙素二乙酰化物激活chk1/2通路调节的g2/m阻滞,并阻碍食管鳞癌细胞及非小细胞肺癌细胞的dna修复功能
1、同实施例5步骤一中1。
2、取完成步骤1的细胞,弃液相,加入4ml大萼香茶菜乙素二乙酰化物溶液(大萼香茶菜乙素二乙酰化物溶液3、大萼香茶菜乙素二乙酰化物溶液5、大萼香茶菜乙素二乙酰化物溶液7、大萼香茶菜乙素二乙酰化物溶液8或大萼香茶菜乙素二乙酰化物溶液9),5%co2、37℃培养24h。
3、完成步骤2后,提取细胞总蛋白并检测蛋白浓度。
4、完成步骤3后,将细胞总蛋白进行westernblot(采用dnadamageantibodysamplerkit检测γh2ax、p-chk2、p-chk1、p-atm、p-atr和p-brca1,采用cdc25cantibody检测cdc25c,采用cdc2antibody检测cdc2,采用phospho-cdc2antibody检测p-cdc2,采用cyclinb1antibody检测cyclinb1,采用gapdhantibody检测gapdh)。
按照上述步骤,将步骤2中的“大萼香茶菜乙素二乙酰化物溶液”替换为含0.1%(v/v)dmso的1640完全培养液,其它步骤均不变中,作为对照。
实验结果见图14(a为食管鳞癌细胞kyse30和kyse450结果,b为非小细胞肺癌h1299和a549结果):随着大萼香茶菜乙素二乙酰化物浓度的增加,磷酸化组蛋白γh2ax也显着增加,γh2ax在dna双链断裂造成的损伤反应中起重要作用,是一种dna损伤标志物,γh2ax的升高表明大萼香茶菜乙素二乙酰化物作用后造成了细胞dna的损伤;g2/m期检验点蛋白p-chk2的表达量随大萼香茶菜乙素二乙酰化物浓度增加而增加,p-chk1先升高而后降低;细胞周期蛋白cdc25c的表达量随着chk1/2激活的增加而减少;cdc2的总量以及cyclinb1的表达量,均随大萼香茶菜乙素二乙酰化物的浓度增加递降,抑制性磷酸化位点cdc2(tyr15)水平随大萼香茶菜乙素二乙酰化物的浓度增加递增。结果表明大萼香茶菜乙素二乙酰化物造成的dna损伤激活了chk1/2,而活化的chk1/2抑制了cdc25c的功能;由于cdc2是cdc25c的作用靶点,cdc25c的失活抑制了cdc2功能,从而防止不成熟有丝分裂的发生。此外,cyclinb1的表达同样受到大萼香茶菜乙素二乙酰化物抑制,加强了g2/m期停滞作用。同时大萼香茶菜乙素二乙酰化物作用后通过抑制atm/atr的功能,抑制了同源重组修复蛋白brca1的活性,阻碍受损dna的修复。因此,大萼香茶菜乙素二乙酰化物导致食管鳞癌细胞dna损伤,诱导了g2/m期阻滞,并且抑制食管鳞癌细胞dna修复。
实施例6、大萼香茶菜乙素二乙酰化物抑制食管鳞癌和非小细胞肺癌成瘤裸鼠异种移植物模型中的肿瘤生长
1、大萼香茶菜乙素二乙酰化物抑制食管鳞癌kyse30细胞和非小细胞肺癌h1299细胞成瘤裸鼠异种移植物模型中的肿瘤生长
1.1、大萼香茶菜乙素二乙酰化物抑制食管鳞癌kyse30细胞成瘤裸鼠异种移植物模型中的肿瘤生长
将30只3-4周龄体重为13~17g的健康无胸腺裸鼠随机分成大萼香茶菜乙素二乙酰化物组、顺铂(ddp)组和对照组(每组10只),分别进行如下处理:
大萼香茶菜乙素二乙酰化物组:首先每只无胸腺裸鼠皮下移植1.2×106个kyse30细胞,移植后第9天开始腹腔注射大萼香茶菜乙素二乙酰化物,以后隔天继续腹腔注射大萼香茶菜乙素二乙酰化物,直至上述三组中任一只无胸腺裸鼠的肿瘤生长至2000mm3停止注射。注射剂量均为12mg大萼香茶菜乙素二乙酰化物/kg无胸腺裸鼠。
顺铂组:首先每只无胸腺裸鼠皮下移植1.2×106个kyse30细胞,移植后第9天开始腹腔注射顺铂,以后隔天继续腹腔注射顺铂,直至上述三组中任一只无胸腺裸鼠的肿瘤生长至2000mm3停止注射。注射剂量均为2mg顺铂/kg无胸腺裸鼠。
对照组:首先每只无胸腺裸鼠皮下移植1.2×106个kyse30细胞,移植后第9天开始,腹腔注射0.1%的pluronicf68溶剂(0.1%的pluronicf68溶剂为
1.2、大萼香茶菜乙素二乙酰化物抑制非小细胞肺癌h1299细胞成瘤裸鼠异种移植物模型中的肿瘤生长
将30只3-4周龄体重为13~17g的健康无胸腺裸鼠随机分成大萼香茶菜乙素二乙酰化物组、顺铂(ddp)组和对照组(每组10只),分别进行如下处理:
大萼香茶菜乙素二乙酰化物组:首先每只无胸腺裸鼠皮下移植2.0×106个h1299细胞,移植后第9天开始腹腔注射大萼香茶菜乙素二乙酰化物,以后隔天继续腹腔注射大萼香茶菜乙素二乙酰化物,直至上述三组中任一只无胸腺裸鼠的肿瘤生长至2000mm3停止注射。注射剂量均为12mg大萼香茶菜乙素二乙酰化物/kg无胸腺裸鼠。
顺铂组:首先每只无胸腺裸鼠皮下移植2.0×106个h1299细胞,移植后第9天开始腹腔注射顺铂,以后隔天继续腹腔注射顺铂,直至上述三组中任一只无胸腺裸鼠的肿瘤生长至2000mm3停止注射。注射剂量均为2mg顺铂/kg无胸腺裸鼠。
对照组:首先每只无胸腺裸鼠皮下移植2.0×106个h1299细胞,移植后第9天开始,腹腔注射0.1%的pluronicf68溶剂(0.1%的pluronicf68溶剂为
2、完成步骤1后,测量各小鼠的肿瘤体积并按组取平均值;称量各小鼠的肿瘤重量并按组取平均值;以注射时间为横坐标,平均肿瘤体积为纵坐标,绘制肿瘤生长曲线。
实验结果见图15(图15为食管鳞癌kyse30细胞裸鼠成瘤大萼香茶菜乙素二乙酰化物体内抑制实验,a为各组小鼠处死时的状态,b为各组小鼠的肿瘤组织,c为各组小鼠的肿瘤生长曲线,d为各组小鼠的平均肿瘤重量的统计结果,e为各组小鼠的体重,f为各组小鼠的肝肾he染色;control为对照组,ddp为顺铂组,a-macb为大萼香茶菜乙素二乙酰化物组)和图16(图16为非小细胞肺癌h1299细胞裸鼠成瘤大萼香茶菜乙素二乙酰化物体内抑制实验,a为各组小鼠处死时的状态,b为各组小鼠的肿瘤组织,c为各组小鼠的肿瘤生长曲线,d为各组小鼠的平均肿瘤重量的统计结果,e为各组小鼠的体重,f为各组小鼠的肝肾he染色;control为对照组,ddp为顺铂组,a-macb为大萼香茶菜乙素二乙酰化物组):对于食管鳞癌kyse30细胞成瘤组织,大萼香茶菜乙素二乙酰化物组的肿瘤体积增长与顺铂组类似,增殖能力与对照组相比明显减弱;平均肿瘤重量大萼香茶菜乙素二乙酰化物组与顺铂组相比无显著差异,明显低于对照组;对于非小细胞肺癌h1299细胞成瘤组织,大萼香茶菜乙素二乙酰化物组的肿瘤体积增长与顺铂组类似,增殖能力与对照组相比明显减弱;平均肿瘤重量大萼香茶菜乙素二乙酰化物组与顺铂组相比无显著差异,明显低于对照组。因此,大萼香茶菜乙素二乙酰化物和顺铂均可有效抑制肿瘤生长,具有明显肿瘤抑制活性。
3、完成步骤1后,测量各小鼠的体重并按组取平均值。
实验结果见图15e和图16e(图15e为食管鳞癌kyse30细胞裸鼠成瘤体内实验小鼠体重,图16e为非小细胞肺癌h1299细胞裸鼠成瘤体内实验小鼠体重,control为对照组,ddp为顺铂组,a-macb为大萼香茶菜乙素二乙酰化物组)。结果表明,各组小鼠的体重没有显著的减少,各组无显著差异。
4、完成步骤1后,对各小鼠的肝组织、肾组织和肿瘤组织进行he染色。
实验结果见图15f和图16f(图15f为食管鳞癌kyse30细胞裸鼠成瘤体内实验小鼠肝肾he染色,图16f为非小细胞肺癌h1299细胞裸鼠成瘤体内实验小鼠肝肾he染色,control为对照组,ddp为顺铂组,a-macb为大萼香茶菜乙素二乙酰化物组),以及图17a和图18a(图17a中he染色为食管鳞癌kyse30细胞裸鼠成瘤组织染色,图18a中he染色为非小细胞肺癌h1299细胞裸鼠成瘤组织染色,control为对照组,ddp为顺铂组,a-macb为大萼香茶菜乙素二乙酰化物组)。结果表明,各组小鼠的肝组织和肾组织均无明显损伤;大萼香茶菜乙素二乙酰化物组和顺铂组的肿瘤组织中出现明显的损伤性病理改变,如大空泡化、细胞碎片和坏死巢;对照组的肿瘤组织中弥漫活肿瘤细胞巢,没有看到明显细胞死亡现象。
5、完成步骤1后,按照deadendtmfluorometrictunelsystem(promega公司的产品,产品目录号为g3250)的说明书的步骤对各小鼠的肿瘤组织进行tunel信号检测。tunel(末端脱氧核苷酸转移酶介导的dutp末端标记)用于标记dna被切割的凋亡细胞,是固定组织中的细胞凋亡原位信号。
6、完成步骤1后,对各小鼠的肿瘤组织进行ki67ihc检测(ki67是在增殖细胞中普遍表达的核非组蛋白,与肿瘤细胞增殖和生长密切相关,是一种常用的增殖标志物)。具体步骤如下:取肿瘤组织石蜡切片,常规脱蜡至水,先经0.01mol/l枸橼酸缓冲液微波抗原修复15min;再加入3%(v/v)h2o2水溶液室温孵育10min(目的为消除内源性过氧化氢酶),加入山羊血清室温封闭30min,然后加入ki67特异性抗体(cellsignalingtechnology公司的产品,产品目录号为#9027)孵育12h,最后采用通用型二步法检测系统(中杉金桥,pv-9000)识别抗体并进行信号放大,dab显色。
实验结果见图17和18(图17a中ki67染色为食管鳞癌kyse30细胞裸鼠成瘤组织标记ki67,图17b为食管鳞癌kyse30细胞裸鼠成瘤组织标记tunel信号;图18a中ki67染色为非小细胞肺癌h1299细胞裸鼠成瘤组织标记ki67,图18b为非小细胞肺癌h1299细胞裸鼠成瘤组织标记tunel信号,control为对照组,ddp为顺铂组,a-macb为大萼香茶菜乙素二乙酰化物组,fluo-12-dutp为凋亡信号标志,dapi为细胞核染色,merge为凋亡信号与细胞核染色叠加合成的信号)。结果表明,对照组中显示出弥漫ki-67表达,并且无明显tunel信号;大萼香茶菜乙素二乙酰化物组和顺铂组中ki67几乎不表达,而呈现明显的凋亡信号。
- 还没有人留言评论。精彩留言会获得点赞!