一种广谱抗病毒抑制剂的制作方法
本发明属于医药技术领域。特别地,本发明涉及具有式(I)结构的化合物用于预防和/或治疗病毒感染或由病毒感染所导致的疾病的用途。本申请还涉及具有式(I)结构的化合物用于制备预防和/或治疗病毒感染或由病毒感染所导致的疾病的药物的用途。
背景技术:
病毒性传染病的流行给人类的健康和生活带来巨大的影响。目前,病毒感染的防治主要依赖于疫苗接种和/或抗病毒药物治疗。然而,疫苗因其价格较高,且需要低温储存,使其难以广泛使用;并且,目前针对许多病毒的疫苗研究还无法取得真正的突破。抗病毒药物已经逐渐成为治疗病毒性传染病主流,其中绝大多数抗病毒药物通过抑制病毒基因组的转录来干扰病毒复制。通常,这些药物抑制参与病毒基因组转录的特定蛋白,例如聚合酶或转录酶;然而由于病毒主要依赖于宿主细胞来进行病毒基因组复制,因此这些药物往往会产生不希望的毒性。此外,由于上述药物的高度特异性,病毒基因组中的小突变经常足以产生对该药物具有抗性的病毒株。同时,上述药物通常仅能抑制活跃的病毒复制,并不能彻底消除在宿主中潜伏或隐藏的病毒。
总之,鉴于目前可获得的疫苗和抗病毒药物都受限于一些缺陷,临床中对于许多病毒造成的感染都没有行之有效的预防疫苗与治疗方法,因此,寻找新的广谱抗病毒药物迫在眉睫。
技术实现要素:
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的细胞培养、生物化学、细胞生物学等操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。
如本文中所使用的,术语“埃博拉病毒(Ebola virus,EBOV)”是指,丝状病毒科(Filoviridae)的一种负链RNA病毒,其为引起埃博拉出血热(EBHF,又称为埃博拉病毒病(EVD))的病原体。
如本文中所使用的,术语“马尔堡病毒(Marburg virus,MARV)”是指,丝状病毒科(Filoviridae)的一种负链RNA病毒,其为引起马尔堡出血热(又称为马尔堡病毒病)的病原体。
如本文中所使用的,术语“狂犬病毒(Rabies virus,RV)”是指,弹状病毒科(Rhabdoviridae)狂犬病毒属(Lyssavirus)的一种负链RNA病毒,其为引起狂犬病的病原体。
如本文中所使用的,术语“烷基”包括饱和的脂肪族基团,包括直链烷基(例如甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基等)、支链烷基(例如异丙基、叔丁基、异丁基等)、环烷基(例如环丙基、环戊基、环己基、环庚基、环辛基等)、烷基取代的环烷基基团、或环烷基取代的烷基基团。在本发明中,表述“Cx-Cy烷基”,是指具有特定范围的碳原子的烷基基团。例如,表述“C1-C6直链烷基”是指包括1-6个碳原子的直链烷基,具体的实例包括但不限于甲基、乙基、丙基、正丁基、正戊基或正己基;例如,表述“C1-C6支链烷基”是指包括1-6个碳原子的支链烷基,具体的实例包括但不限于异丙基、叔丁基或异丁基;例如,表述“C3-C6环烷基”是指包括3-6个碳原子的环烷基,具体的实例包括但不限于环丙基、环丁基、环戊基或环己基。
如本文中所使用的,术语“药学上可接受的盐”是指,本发明所提供的化合物中存在的碱性官能团(例如仲胺基团或叔胺基团)与适当的无机或者有机阴离子(酸)形成的盐,并且包括但不限于,无机酸盐,如氢氟酸盐、盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、高氯酸盐、硫酸盐、磷酸盐等;低级烷磺酸盐,如甲磺酸盐、三氟甲磺酸盐、乙磺酸盐等;芳基磺酸盐,如苯磺酸盐、对苯磺酸盐等;有机酸盐,如醋酸盐、苹果酸盐、富马酸盐、琥珀酸盐、柠檬酸盐、酒石酸盐、草酸盐、马来酸盐等;氨基酸盐,如甘氨酸盐、三甲基甘氨酸盐、精氨酸盐、鸟氨酸盐、谷氨酸盐、天冬氨酸盐等。
如本文中所使用的,术语“药学上可接受的酯”是指,本发明所提供的化合物中存在的-OH与适当的酸(例如,羧酸或含氧无机酸)形成的酯。适宜的酯基团包括但不限于,甲酸酯、乙酸酯、丙酸酯、丁酸酯、丙烯酸酯、乙基琥珀酸酯、硬脂肪酸酯或棕榈酸酯。
如本文中所使用的,术语“有效量”是指,足以获得或至少部分获得期望的效果的量。例如,“预防疾病有效量”是指,足以预防、阻止或延迟疾病(例如,病毒感染或由病毒感染所导致的疾病)的发生的量;“治疗疾病有效量”是指,足以治愈或至少部分阻止已患有疾病(例如,病毒感染或由病毒感染所导致的疾病)的患者的疾病和其并发症的量。测定这样的有效量完全在本领域技术人员的能力范围之内。例如,对于治疗用途有效的量将取决于待治疗的疾病的严重度、患者自己的免疫系统的总体状态、患者的一般情况例如年龄、体重和性别,药物的施用方式,以及同时施用的其他治疗等等。
如本文中所使用的,术语“受试者”包括但不限于各种动物,例如哺乳动物,例如牛科动物、马科动物、羊科动物、猪科动物、犬科动物、猫科动物、兔科动物、啮齿类动物(例如,小鼠或大鼠)、非人灵长类动物(例如,猕猴或食蟹猴)或人。在某些实施方式中,所述受试者(例如人)感染病毒,或者,具有感染病毒的风险。
本申请的发明人首次发现,具有特定结构的4-氨基喹啉类化合物可显著抑制病毒的感染,具有明显的抗病毒活性。而在本申请之前,这类化合物的抗病毒活性未曾见报道。
因此,在一个方面,本发明提供了通式(I)所示的化合物或其药学上可接受的盐或酯用于在受试者中预防和/或治疗病毒感染或由病毒感染所导致的疾病的用途,或者用于制备在受试者中预防和/或治疗病毒感染或由病毒感染所导致的疾病的药物的用途;
其中,
R1独立地为氢、卤素或C1-C6烷基;
R2、R3各自独立地为C1-C6烷基或C3-C6环烷基。
在某些优选的实施方案中,R1选自氢、卤素和C1-C3烷基。
在某些优选的实施方案中,R1选自氢和卤素(例如-F、-Cl、-Br或-I)。
在某些优选的实施方案中,R1为卤素(例如-F、-Cl、-Br或-I)。
在某些优选的实施方案中,R1为-Cl。
在某些优选的实施方案中,R2、R3各自独立地为C1-C4直链或支链烷基、或C3-C4环烷基。
在某些优选的实施方案中,R2、R3各自独立地为甲基、乙基、正丙基、异丙基、环丙基、正丁基、仲丁基、叔丁基、异丁基或环丁基。
在某些优选的实施方案中,R2与R3相同。
在某些优选的实施方案中,R2、R3为乙基。
在某些优选的实施方案中,所述化合物具有如下所示的化学式。
在某些优选的实施方案中,所述病毒选自埃博拉病毒(EBOV)、马尔堡病毒(MARV)和狂犬病毒(RV)。
在某些优选的实施方案中,所述由病毒感染所导致的疾病选自埃博拉出血热、马尔堡出血热和狂犬病。
在某些优选的实施方案中,所述药学上可接受的盐为无机酸盐或有机酸盐。在某些优选的实施方案中,所述药学上可接受的盐为有机酸盐,例如柠檬酸盐、富马酸盐、马来酸盐或酒石酸盐。在某些优选的实施方案中,所述药学上可接受的盐为无机酸盐,例如盐酸盐、硫酸盐、磷酸盐、甲磺酸盐或苯磺酸盐。在某些示例性实施方案中,所述药学上可接受的盐是盐酸盐。
在某些优选的实施方案中,所述药物包含预防或治疗有效量的如上所述的化合物。
在某些优选的实施方案中,所述药物可以为医学领域已知的任何形式。例如,所述药物可以是片剂、丸剂、混悬剂、乳剂、溶液、凝胶剂、胶囊剂、粉剂、散剂、颗粒剂、酏剂、锭剂、栓剂、注射剂(包括注射液、注射用无菌粉末与注射用浓溶液)、吸入剂、喷雾剂等形式。在某些优选的实施方案中,所述药物为片剂、丸剂、胶囊剂、颗粒剂、散剂、溶液、混悬剂、注射液或注射用无菌粉末。
在某些优选的实施方案中,所述药物任选地还包括具有抗病毒活性的另外的药学活性剂。
在某些优选的实施方案中,所述另外的药学活性剂是可用于治疗狂犬病毒感染和/或狂犬病的药物,例如狂犬病疫苗、抗狂犬病血清或抗狂犬病免疫球蛋白(例如,抗狂犬病人免疫球蛋白)。
在某些优选的实施方案中,所述另外的药学活性剂是可用于治疗埃博拉病毒感染和/或埃博拉出血热的药物。
在某些优选的实施方案中,所述另外的药学活性剂是可用于治疗马尔堡病毒感染和/或马尔堡病毒出血热的药物。
本领域已知,目前没有任何一种经FDA批准的可用于抗埃博拉病毒或马尔堡病毒的疫苗或药物,治疗手段主要为根据病人临床状况而采取的支持性疗法,例如施用含有电解质的液体进行实施静脉输液或者口服补液。因此,在本发明中,表述“可用于治疗埃博拉病毒感染和/或埃博拉出血热的药物”或“可用于治疗马尔堡病毒感染和/或马尔堡出血热的药物”意指那些具有潜在抗该病毒活性和/或处于临床试验阶段的拟用于该病毒的疫苗或药物。
在某些优选的实施方案中,所述药物包含单位剂量的如上所述的化合物,例如包含1-2000mg的任何量的所述化合物,例如10-1500mg,例如20-1000mg,例如50-500mg,例如50-100mg。在本发明中,所述化合物的给药剂量可根据患者或受试者的病情轻重、年龄、体重、性别、给药方式及疗程等因素进行调整。
在本发明中,所述药物可以通过本领域已知的任何合适的方法来施用,例如口服、肠胃外、直肠、经肺或局部给予等方式。当用于口服时,所述药物可以制成口服制剂,例如口服固体制剂,如片剂、胶囊剂、丸剂、颗粒剂等;或,口服液体制剂,如口服溶液剂、口服混悬剂、糖浆剂等。当制成口服制剂时,所述药物还可以包含适宜的填充剂、粘合剂、崩解剂、润滑剂等;特别地,为了改善疏水性化合物的湿润性并提高其溶解性,所述药物优选地包含亲水性聚合物,例如羟丙基纤维素(HPC)、羟丙基甲基纤维素(HPMC)或羧甲基纤维素(CMC)等。当用于肠胃外时,所述药物可以制成注射剂,包括注射液、注射用无菌粉末与注射用浓溶液。当制成注射剂时,所述药物可以采用现有制药领域中的常规方法来进行生产。当配制注射剂时,所述药物可以含有药学上可接受的载体例如无菌水、林格氏液和等渗氯化钠溶液,也可根据药物的性质加入适宜的附加剂例如抗氧化剂、缓冲剂和抑菌剂。当用于直肠给药时,所述药物可以制成栓剂等。用于经肺给药时,所述药物可以制成吸入剂或喷雾剂等。
在某些优选的实施方案中,所述受试者为哺乳动物,例如非人灵长类动物,例如人。
在另一个方面,本发明提供了一种预防和/或治疗病毒感染或由病毒感染所导致的疾病的方法,其包括对有此需要的受试者施用有效量的通式(I)所示的化合物或其药学上可接受的盐或酯;
其中,
R1独立地为氢、卤素或C1-C6烷基;
R2、R3各自独立地为C1-C6烷基或C3-C6环烷基。
在某些优选的实施方案中,R1选自氢、卤素和C1-C3烷基。
在某些优选的实施方案中,R1选自氢和卤素(例如-F、-Cl、-Br或-I)。
在某些优选的实施方案中,R1为卤素(例如-F、-Cl、-Br或-I)。
在某些优选的实施方案中,R1为-Cl。
在某些优选的实施方案中,R2、R3各自独立地为C1-C4直链或支链烷基、或C3-C4环烷基。
在某些优选的实施方案中,R2、R3各自独立地为甲基、乙基、正丙基、异丙基、环丙基、正丁基、仲丁基、叔丁基、异丁基或环丁基。
在某些优选的实施方案中,R2与R3相同。
在某些优选的实施方案中,R2、R3为乙基。
在某些优选的实施方案中,所述化合物具有如下所示的结构式。
在某些优选的实施方案中,所述病毒选自埃博拉病毒(EBOV)、马尔堡病毒(MARV)和狂犬病毒(RV)。
在某些优选的实施方案中,所述由病毒感染所导致的疾病选自埃博拉出血热、马尔堡出血热和狂犬病。
在某些优选的实施方案中,所述药学上可接受的盐为无机酸盐或有机酸盐。在某些优选的实施方案中,所述药学上可接受的盐为有机酸盐,例如柠檬酸盐、富马酸盐、马来酸盐或酒石酸盐。在某些优选的实施方案中,所述药学上可接受的盐为无机酸盐,例如盐酸盐、硫酸盐、磷酸盐、甲磺酸盐或苯磺酸盐。在某些示例性实施方案中,所述药学上可接受的盐是盐酸盐。
在某些优选的实施方案中,可以将如上所述的化合物作为药物组合物进行配制和施用。在某些优选的实施方案中,所述药物组合物可以包含预防或治疗有效量的如上所述的化合物。在某些优选的实施方案中,所述药物组合物可以为医学领域已知的任何形式。例如,所述药物组合物可以是片剂、丸剂、混悬剂、乳剂、溶液、凝胶剂、胶囊剂、粉剂、颗粒剂、酏剂、锭剂、栓剂、注射剂(包括注射液、注射用无菌粉末与注射用浓溶液)、吸入剂、喷雾剂等形式。在某些优选的实施方案中,所述药物组合物为片剂、丸剂、胶囊剂、颗粒剂、散剂、溶液、混悬剂、注射液或注射用无菌粉末。
在本发明中,所述药物组合物可以通过本领域已知的任何合适的方法来施用,例如口服、肠胃外、直肠、经肺或局部给予等方式。当用于口服时,所述药物组合物可以制成口服制剂,例如口服固体制剂,如片剂、胶囊剂、丸剂、颗粒剂等;或,口服液体制剂,如口服溶液剂、口服混悬剂、糖浆剂等。当制成口服制剂时,所述药物组合物还可以包含适宜的填充剂、粘合剂、崩解剂、润滑剂等;特别地,为了改善疏水性化合物的湿润性并提高其溶解性,所述药物组合物优选地包含亲水性聚合物,例如羟丙基纤维素(HPC)、羟丙基甲基纤维素(HPMC)或羧甲基纤维素(CMC)等。当用于肠胃外时,所述药物组合物可以制成注射剂,包括注射液、注射用无菌粉末与注射用浓溶液。当制成注射剂时,所述药物组合物可以采用现有制药领域中的常规方法来进行生产。当配制注射剂时,所述药物组合物可以含有药学上可接受的载体例如无菌水、林格氏液和等渗氯化钠溶液,也可根据药物的性质加入适宜的附加剂例如抗氧化剂、缓冲剂和抑菌剂。当用于直肠给药时,所述药物组合物可以制成栓剂等。用于经肺给药时,所述药物组合物可以制成吸入剂或喷雾剂等。
在某些优选的实施方案中,所述方法任选地还包括施用具有抗病毒活性的另外的药学活性剂。这种另外的药学活性剂可以在施用如上所述的化合物之前、同时或之后施用。
在某些优选的实施方案中,可以以1~2000mg/kg受试者体重的任何量施用如上所述的化合物,例如以1~1500mg/kg体重/天,1~1000mg/kg体重/天,5~1000mg/kg体重/天,5~500mg/kg体重/天,5~200mg/kg体重/天,5~100mg/kg体重/天或10~100mg/kg体重/天的量施用如上所述的化合物。在某些优选的实施方案中,可以以每日4次、每日3次、每日2次、每日1次、每两日1次或每周1次的方式施用如上所述的化合物,任选地酌情每周或每月重复如上所述的给药方案。在本发明中,所述化合物的给药剂量可根据患者或受试者的病情轻重、年龄、体重、性别、给药方式及疗程等因素进行调整。
在某些优选的实施方案中,所述受试者为哺乳动物,例如非人灵长类动物,例如人。
发明的有益效果
由于缺乏有效的疫苗/药物和治疗手段,目前人类感染埃博拉病毒、马尔堡病毒、狂犬病毒等病毒后的死亡率极高。本申请的发明人通过大量的研究及筛选发现了一种具有广谱抗病毒活性的化合物。该化合物可以明显干扰多种病毒(例如,埃博拉病毒、马尔堡病毒或狂犬病毒)对细胞的感染过程,并在动物模型中展现出了显著的保护作用,具有明显的抗病毒活性。因而,该化合物可用于预防和/或治疗病毒感染或由病毒感染所导致的疾病,这一发现对于埃博拉病毒、马尔堡病毒、狂犬病毒等病毒性传染病的防治具有重大意义。
下面将结合附图和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将理解,下列附图和实施例仅用于说明本发明,而不是对本发明的范围的限定。根据附图和优选实施方案的下列详细描述,本发明的各种目的和有利方面对于本领域技术人员来说将变得显然。
附图说明
图1显示了实施例2中,RV-04对RV假病毒、EBOV假病毒和MARV假病毒抑制率的的分析曲线。其中,横坐标表示RV-04的作用浓度(μM),纵坐标表示抑制率(%)。结果显示,RV-04可显著抑制多种假病毒。
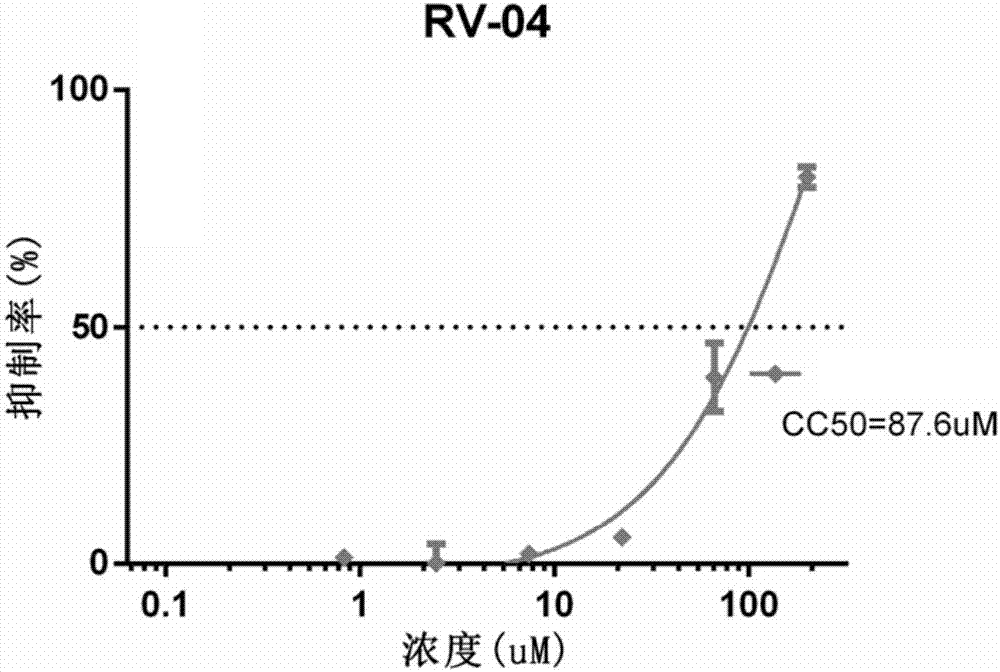
图2显示了实施例3中,RV-04的细胞毒性的分析曲线。其中,横坐标表示RV-04的作用浓度(μM),纵坐标表示抑制率(%)。结果显示,RV-04无明显的细胞毒性。
图3显示了实施例4中,利用荧光显微镜观察RV-04对狂犬活病毒的中和活性的分析结果。结果显示,RV-04具有明显的狂犬活病毒中和活性。
图4显示了实施例4中,RV-04对狂犬活病毒抑制率的的分析曲线。其中,横坐标表示RV-04的作用浓度(μM),纵坐标表示抑制率(%)。结果显示,RV-04可明显抑制狂犬活病毒对细胞的感染。
图5显示了实施例5中,RV-04在埃博拉病毒感染体内模型中的抗病毒活性的分析结果。结果显示,RV-04可明显抑制埃博拉病毒对小鼠的感染。
图6显示了实施例5中,RV-04在马尔堡病毒感染体内模型中的抗病毒活性的分析结果。结果显示,RV-04可明显抑制马尔堡病毒对小鼠的感染。
图7-图9分别显示了实施例6中,通过表面等离子共振技术对RV-04与RV、EBOV和MARV病毒膜蛋白结合活性的检测结果。结果显示,RV-04对多种病毒膜蛋白均具有一定的结合活性。
具体实施方式
现参照下列意在举例说明本发明(而非限定本发明)的实施例来描述本发明。
除非特别指明,否则基本上按照本领域内熟知的以及在各种参考文献中描述的常规方法进行实施例中描述的实验和方法。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。本领域技术人员知晓,实施例以举例方式描述本发明,且不意欲限制本发明所要求保护的范围。本文中提及的全部公开案和其他参考资料以其全文通过引用合并入本文。
在本发明的下述实施例中,RV-04是指盐酸阿莫地喹(国家标准品,由中国食品药品检定研究院标准物质所提供),其具有如下所示的化学式:
实施例1.假病毒的构建
1.1基于假病毒的抗病毒药物筛选原理
病毒上的囊膜蛋白负责识别靶细胞表面的受体从而启动吸附和穿入的过程,从而入侵细胞。此外,当两种病毒同时感染一种细胞时所发生的表型混合现象提示一种病毒的囊膜能够整合到另外一种不同病毒的颗粒表面。基于以上两点,在研究病毒侵入细胞的过程及其组织嗜性和受体等方面产生了一种新的技术——假病毒技术。
目前的假病毒则是指一种反转录病毒能够整合另外一种不同种类病毒的囊膜糖蛋白,从而形成的具有外源性病毒的囊膜,而基因组保持着反转录病毒本身基因组特性的病毒。假病毒颗粒是由包装细胞提供的病毒蛋白携带包裹着外源基因的病毒载体重组体,对靶细胞只有一次感染的能力,为复制缺陷型,感染后不能产生新的病毒颗粒。这种病毒虽然可以侵入细胞,但是在入侵细胞后由于是复制缺陷型,而且组装成病毒的结构蛋白是外源提供的,不能够进行病毒的自我复制,所以非常安全。由于假病毒的亲噬性和感染过程与真病毒相同,因此可以模拟病毒感染的早期过程,而且假病毒内携带有报告基因(荧光素酶),可以快速、方便的进行各种检测和分析,本实验室构建的假病毒不仅可以用来研究病毒与宿主细胞的关系,克隆病毒的受体,更重要的是可以用于筛选抗病毒药物、评价疫苗免疫的效果等。
本发明利用表达病毒糖蛋白的质粒与骨架质粒共转染293T细胞,从而得到假病毒。用此假病毒与倍比稀释后的药物作用一段时间后,加入假病毒敏感细胞,在37℃5%CO2培养箱中继续培养48小时后,检测发光值。如果药物阻止了病毒吸附、进入细胞,则样品孔发光值会衰减或消失;如果药物无抗病毒活性,则样品孔发光值与病毒对照发光值相当。
1.2假病毒的制备
a)狂犬病毒(RV)假病毒的制备
使用转染试剂Lipofectamine 2000,将包膜质粒pCAG.CVSpCMV-CVS和骨架质粒pSG3Δenv.cmv.Fluc(参见Nie J,et al.Sci Rep.2017Feb 20;7:42769.)按照质量比3:1的比例共转染293T细胞,转染后4-6h左右更换培养基,然后置于37℃,5%CO2孵箱中培养48h左右。收集转染后的细胞培养基上清,离心,除去细胞碎片,0.45μm滤器过滤,分装于1.5mL离心管中,于-80℃冰箱保存备用。
b)埃博拉病毒(EBOV)假病毒的制备
使用转染试剂Lipofectamine 3000,将包膜质粒pcDNA3.1-EBOV-ZAIRE-GP-8A(参见Liu,Q.et al.Sci Rep.2017Mar 30;7:45552.)和骨架质粒pSG3Δenv.cmvFluc(参见Nie J,et al.Sci Rep.2017Feb20;7:42769.)按照质量比1:2的比例共转染293T细胞,转染后4-6h左右更换培养基,然后置于37℃,5%CO2孵箱中培养48h左右。收集转染后的细胞培养基上清,离心,除去细胞碎片,0.45μm滤器过滤,分装于1.5mL离心管中,于-80℃冰箱保存备用。
c)马尔堡病毒(MARV)假病毒的制备
使用转染试剂Lipofectamine 3000,将包膜质粒pcDNA3.1-MARV-GP(参见Zhang,L.et al.Hum Vaccin Immunother.2017Aug3;13(8):1811-1817.)和骨架质粒pSG3Δenv.cmv.Fluc(参见Nie J,et al.Sci Rep.2017Feb 20;7:42769.)按照质量比1:2的比例共转染293T细胞,转染后4-6h左右更换培养基,然后置于37℃,5%CO2孵箱中培养48h左右。收集转染后的细胞培养基上清,离心,除去细胞碎片,0.45μm滤器过滤,分装于1.5mL离心管中,于-80℃冰箱保存备用。
d)水泡性口膜炎病毒(VSV)假病毒的制备
使用转染试剂Lipofectamine 2000,将包膜质粒pHEF-VSVG(由美国国立卫生研究所(NIH)aids reagent项目提供)和骨架质粒pSG3Δenv.cmv.Fluc(参见Nie J,et al.Sci Rep.2017Feb 20;7:42769.)质量比1:2的比例共转染293T细胞,转染后4-6h左右更换培养基,然后置于37℃,5%CO2孵箱中培养48h左右。收集转染后的细胞培养基上清,离心,除去细胞碎片,0.45μm滤器过滤,分装于1.5mL离心管中,于-80℃冰箱保存备用。
1.3假病毒滴度测定
1.3.1RV、EBOV、MARV、VSV假病毒的滴定
a)将分装冻存的假病毒从-80℃冰箱取出室温水浴解冻,在96孔板中做5倍系列稀释,11个梯度,4个复孔,终体积100μL,最后一列为细胞对照。
b)取出培养箱中事先准备好的细胞293T细胞(汇合率达80%以上),以T75培养瓶为例,吸弃瓶中的培养基,加入5ml 1×PBS清洗细胞,吸弃1×PBS后,加入2.5ml已稀释5倍的0.25%胰酶-EDTA,使其浸没细胞消化45秒,吸弃胰酶,置于细胞培养箱中静置4分钟,待细胞脱落,加入10ml DMEM培养基中和胰酶,吹打混匀后,细胞计数,用DMEM完全培养基将细胞稀释至5×105个/ml。每孔加入100μL,即5×104/孔,将96孔板放入孵箱,培养48h(RV、EBOV培养48h)或72h(MARV培养72h)。
c)48h后从细胞培养箱中取出96孔板,从样品孔中吸弃100μL上清,加入100μL平衡至室温的Bright-Glo荧光素酶检测试剂,避光反应2min。
d)反应结束后,用多道移液器将反应孔中的液体反复吹吸3-5次,使细胞充分裂解,从每孔中吸出150μL液体,加于对应96孔化学发光检测板中,置于化学发光检测仪中,用BrighGlo程序读取发光值。
1.3.2 TCID50的计算
以高于细胞对照孔的发光值的3倍为cut off值,用Reed-Muench法计算假病毒的TCID50,具体步骤如下所示:
①计算各病毒稀释度阳性孔数目(a)和阴性孔数目(b);
②计算阳性和阴性孔的累积数:阳性孔累积数由下向上累计(c),阴性孔累积数由上向下累计(d);
③计算阳性孔的百分比:比率=(c)/〔(c)+(d)〕×100;
④计算距离比例:距离比例=(大于50%的阳性百分比-50)/(大数于50%的阳性百分比-小于50%的阳性百分比);
⑤TCID50的对数=大于50%的阳性百分比的最高稀释倍数的对数+距离比例×稀释系数的对数。
实施例2.RV-04对多种假病毒的抑制活性的评价
在本实施例中,通过使用实施例1制备获得的RV假病毒、EBOV假病毒和MARV假病毒以评价RV-04对上述3种病毒的抑制活性。
2.1实验步骤
由于本发明使用的假病毒骨架质粒pSG3Δenv.cmvFluc来源于HIV,因此为了排除药物通过阻止骨架HIV的逆转录过程以抑制假病毒的可能性,本发明在利用假病毒初筛药物的同时,利用包含水泡性口膜炎病毒(VSV)膜蛋白嵌合假病毒进行复筛以排除假阳性。计算药物对VSV膜蛋白嵌合假病毒和目标病毒膜蛋白嵌合假病毒(即,RV假病毒、EBOV假病毒或MARV假病毒)的50%抑制浓度(IC50)的比值,当该值大于3时,可以判定排除该药物通过阻止骨架HIV的逆转录过程以抑制假病毒的可能性。其具体实验步骤如下所示:
2.1.1RV-04对RV假病毒、EBOV假病毒、MARV假病毒的抑制活性的评价
a)使用DMSO溶解RV-04至30mmol/L。
b)将RV-04在96孔板中从150倍稀释起始,进行连续3倍系列稀释,8个稀释度,2个复孔,终体积为100μL,第一列和第二列分别为细胞对照(只加培养基和细胞)和病毒对照(只加病毒和细胞)。
c)将RV假病毒、EBOV假病毒、MARV假病毒、VSV假病毒分别稀释至相应的TCID50/ml每孔加入50μL,使终体积中分别含200TCID50/孔的RV假病毒,400TCID50/孔的EBOV假病毒,100-800TCID50/孔的MARV假病毒,200TCID50/孔的VSV假病毒为将96孔板放入37℃,5%CO2培养1h。
d)当孵育时间至半小时,取出培养箱中事先准备好的293T细胞(汇合率达80%以上),胰酶处理细胞同上。用DMEM完全培养基将细胞稀释至5×105个/ml。
e)当孵育时间至1小时,向96孔板中每孔加100μL 5×105个/ml的细胞,使每孔细胞为5×104个,将96孔板放入孵箱,37℃,5%CO2培养48h(RV、EBOV假病毒)或72h(MARV假病毒)。
f)48h或72h后从细胞培养箱中取出96孔板,用多道移液器从每个上样孔中吸弃150μL上清,然后加入100μL Bright-Glo荧光素酶检测试剂,室温避光反应2min。
g)反应结束后,用多道移液器将反应孔中的液体反复吹吸3-5次,使细胞充分裂解,从每孔中吸出150μL液体,加于对应96孔化学发光检测板中,置于化学发光检测仪中,用BrighGlo程序读取发光值。
2.1.2抑制活性的计算方法
a)计算药物的抑制率,抑制率=[1-(样品组的发光强度均值-细胞对照孔发光强度均值)/(病毒对照孔发光强度均值-细胞对照孔发光强度均值)]×100%;并以药物浓度为横坐标,抑制率为纵坐标绘制量效曲线。
b)根据药物的抑制率曲线,利用下列公式计算药物的ID50和IC50。
药物ID50=lg(1/药物低于50%荧光值比例的稀释度)+(50-药物低于50%荧光值比例孔的荧光值百分比)/(高于50%荧光值比例孔的荧光值百分比-低于50%荧光值比例孔的荧光值百分比)×lg(药物稀释倍数)。
药物IC50(μmol/L)=30000/药物ID50。
2.2实验结果
RV-04对RV假病毒、EBOV假病毒及MARV假病毒的抑制率曲线如图1所示,其中RV-04对狂犬病毒假病毒(RV)的IC50为4.2μM,对埃博拉病毒假病毒(EBOV)的IC50为1.8μM,对马尔堡病毒病毒假病毒(MARV)的IC50为1.4μM,对VSV假病毒的IC50为20.4μM;RV-04对VSV假病毒和目标假病毒的IC50比值显著大于3。上述结果表明,RV-04对狂犬、埃博拉、马尔堡假病毒具有显著的抑制作用,并且其通过抑制病毒膜蛋白与靶细胞的结合从而干扰假病毒对细胞的感染。
实施例3.RV-04的细胞毒性评价
3.1实验步骤
在本实施例中,通过ATP定量测定以评价RV-04药物对细胞活性的影响,其检测原理如下:
ATP是活细胞新陈代谢的一个指标,使用发光法细胞活力检测试剂盒,通过对ATP进行定量测定来检测药物和细胞作用后培养物中活细胞数目,细胞裂解和产生的发光信号与存在的ATP量成正比,而ATP量直接与培养物中的细胞数量成正比。通过药物对细胞中ATP发光信号的影响,计算药物的50%细胞毒性浓度(CC50)。计算药物的50%细胞毒性浓度(CC50)与药物对目标病毒的IC50的比值(即,治疗指数SI=CC50/IC50),当该治疗指数大于3时,判定该药物为抑制病毒的阳性药物,即表明该药物具有显著的抑制病毒活性,且无明显的细胞毒性。其具体实验步骤如下所示:
3.1.1RV-04在293T细胞上的细胞毒性评价
a)将RV-04在96孔板中从150倍稀释起始,进行连续3倍系列稀释,8个稀释度,2个复孔,终体积为100μL,第一列和第二列分别为阴性对照(只加培养基,不加细胞)和细胞对照(只加培养基和细胞)。
b)细胞对照和样品孔每孔加入50μL培养基,将96孔板放入37℃,5%CO2培养1h。
c)取出培养箱中事先准备好的293T细胞(汇合率达80%以上),胰酶处理细胞同上。用DMEM完全培养基将细胞稀释至5×105个/ml。于第一列加入100μL完全培养基,其余孔每孔加入100μL已稀释至5×105个/ml的293T细胞,使每孔细胞为5×104个,将96孔板放入孵箱,37℃,5%CO2培养48h。
d)48h后从细胞培养箱中取出96孔板,用多道移液器从每孔中吸弃150μL上清,然后加入100μL 检测试剂,室温避光反应10min。
e)反应结束后,用多道移液器将反应孔中的液体反复吹吸3-5次,使细胞充分裂解,从每孔中吸出150μL液体,加于对应黑色96孔化学发光检测板中,置于化学发光检测仪中,用CellTiter-Glo程序读取发光值。
3.2实验结果
结果如图2所示,其中RV-04对细胞的CC50为87.6μM,表明RV-04在87.6μM以下对细胞没有毒性;并且,RV-04的CC50值与实施例2中所述的3种假病毒(RV假病毒、EBOV假病毒及MARV假病毒)的IC50的比值(即治疗指数SI=CC50/IC50)显著大于3。上述结果进一步表明,RV-04具有显著的抑制狂犬病毒、埃博拉病毒、马尔堡病毒活性,且无明显的细胞毒性。
实施例4.RV-04对狂犬活病毒的中和活性的评价
在本实施例中,使用狂犬活病毒以评价RV-04药物对狂犬病毒的中和活性。
参照FFIT操作,将30mM的RV-04稀释150倍后进行连续的3倍稀释,共8个稀释度,在室温将RV-04与50μL狂犬病毒CVS株(为中国食品药品检定研究院建库保存)(6.25×105荧光滴度/ml)孵育1小时,PBS和DMSO对照组分别将狂犬病毒CVS株与PBS和DMSO孵育1小时;之后,各孔加入BSR细胞(为中国食品药品检定研究院建库保存)混合接种,然后在室温继续细胞培养24hr。随后进行直接荧光染色。细胞培养结束后,弃去细胞培养上清,PBS清洗1遍,以尽可能去除细胞上清中残余的病毒,丙酮固定,荧光染色观察细胞内病毒感染情况。
镜检结果如图3所示,其中,PBS和DMSO对照组均呈荧光强阳性,说明病毒感染BSR细胞,并进行了增殖;而RV-04药物组的荧光强度有明显降低趋势,表明其具有明显的中和狂犬病毒CVS株的效果。RV-04组在第1-4孔中荧光染色很弱,说明病毒被药物中和掉,失去细胞感染能力;并且镜检观察发现在第1-4孔中药物对细胞无影响。通过计算得出RV-04在室温下对狂犬病毒CVS株的IC50为14.8μM(图4)。
上述结果表明,RV-04对狂犬活病毒具有潜在的中和活性。
实施例5.RV-04体内抗病毒活性的评价
在本实施例中,以经EBOV病毒或MARV病毒攻击后BALB/c小鼠为模型,考察了RV-04的体内抗病毒活性。
5.1 RV-04药物在EBOV假病毒感染模型中的抗病毒活性评价
RV-04药物用无菌水溶解,所使用的假病毒为pHIV-ZGP-Fluc假病毒(即由实施例1制备获得的埃博拉假病毒)。4-5周龄雌性BALB/c小鼠20只,购买于中国食品药品检定研究院,分2组,每组10只。实验组:以攻毒当天为D0,在攻毒前两天(Day-2),攻毒前一天(Day-1),攻毒前2小时(-H2)分别进行灌胃给药(剂量为1.8mg/200μL),H0攻毒,攻毒剂量为60AID50 2.67×107TCID50;对照组:与实验组同时以同样的方式灌胃相同体积的无菌水,H0攻毒,攻毒剂量与实验组相同。在攻毒后第四天,给予每只小鼠腹腔注射100μL戊巴比妥钠(240mg/kg)和100μL动物发光底物,反应10分钟后在活体成像仪上进行检光,观察动物发光水平。
结果如图5所示,与对照组相比,RV-04给药组的发光水平明显较弱(图5A),RV-04给药组的总光通量(Total flux)与对照组相比下降了67.24%(图5B)。上述结果表明,在小鼠体内中,RV-04可明显抑制埃博拉病毒的感染,具有显著的体内抗病毒活性。
5.2 RV-04药物在MARV假病毒感染模型中的抗病毒活性评价
RV-04药物用无菌水溶解,所使用的假病毒为pHIV-MARV-GP-Fluc假病毒(即由实施例1制备获得的MARV假病毒)。4-5周龄雌性BALB/c小鼠12只,购买于中国食品药品检定研究院,分2组,每6只。实验组:以攻毒当天为D0,在攻毒前两天(Day-2),攻毒前一天(Day-1),攻毒前2小时(-H2)分别进行灌胃给药(剂量为1.8mg/200μL),H0攻毒,攻毒剂量为1.27×107TCID50;对照组:与实验组同时以同样的方式灌胃相同体积的无菌水,H0攻毒,攻毒剂量与实验组相同。在攻毒后第四天,给予每只小鼠腹腔注射100μL戊巴比妥钠(240mg/kg)和100μL动物发光底物,反应10分钟后在活体成像仪上进行检光,观察动物发光水平。
结果如图6所示,与对照组相比,RV-04给药组的发光水平明显较弱(图6A),RV-04给药组的总光通量(Total flux)与对照组相比下降了84%(图6B)。上述结果表明,在小鼠体内中,RV-04可明显抑制马尔堡病毒的感染,具有显著的体内抗病毒活性。
实施例6.RV-04与多种病毒膜蛋白结合活性的评价
在本实施例中,通过表面等离子共振(SPR)技术分析RV-04对多种病毒膜蛋白(EBOV、MARV、RV)的结合活性。
将EBOV和MARV病毒膜蛋白胞外段(gp-EBOLA,gp-MARV)(由中科院微生物所高福院士课题组馈赠)、RV CTN病毒株(由中国食品药品检定研究院制备保存)分别固定在CM5芯片三个通道上作为固定相,以不同稀释浓度的RV-04为流动相(从100μM开始进行梯度稀释,分别为100μM,50μM,25μM,12.5μM,6.25μM,3.125μM,1.56μM)。Buffer为PBS+0.05%Tween20+5%DMSO,在25℃,Biacor eS200上进行测定。
结果分别如图7-9所示,其中图7A-9A为不同稀释浓度的RV-04的SPR传感图;图7B-9B为稳态响应值相对于不同RV-04浓度的变化曲线,其中垂直线表示平衡解离常数(KD)值,通过BiacoreS200测定得出RV-04与3种病毒膜蛋白(RV、EBOV、MARV)结合的KD值分别为32μmol/L、32μmol/L、22μmol/L,说明RV-04与三种病毒的蛋白均有一定的结合活性。
尽管本发明的具体实施方式已经得到详细的描述,但本领域技术人员将理解:根据已经公布的所有教导,可以对细节进行各种修改和变动,并且这些改变均在本发明的保护范围之内。本发明的全部分为由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!