一种用于预防弓形虫感染的减毒活疫苗及其应用的制作方法
本发明涉及弓形虫减毒活疫苗领域,具体涉及一种用于预防弓形虫感染的减毒活疫苗及其应用。
背景技术:
刚地弓形虫(toxoplasmagondii)是一种专性细胞内寄生的机会性致病原虫,可感染包括人在内的几乎所有的温血动物,在世界范围内广泛分布。弓形虫属于机会致病性病原,当人摄取含有弓形虫组织包囊的生肉或被猫粪便中卵囊污染的水之后,卵囊或组织包囊破裂,虫体入侵到肠粘膜细胞,卵囊释放的子孢子或组织包囊释放的缓殖子会转化成速殖子,最终分布到机体的各个部分,造成宿主弓形虫感染。免疫力正常的人感染弓形虫后,在机体免疫系统的作用下,宿主不表现明显的临床症状,但是对于免疫功能低下的病人,比如器官移植病人,艾滋病患者等,弓形虫感染具有很高的风险,甚至导致宿主死亡。现有药物的治疗仅对虫体的速殖子时期起作用,对于包囊内的缓殖子收效甚微,且药物的使用存在一定的毒副作用。近年来,国内外学者认为开发疫苗免疫宿主可能是防控弓形虫病有效措施。但目前尚无有效疫苗可用于弓形虫病的防控,其关键原因在于未寻找到合适的靶标基因。因此,寻找新型有效的疫苗候选抗原进行抗弓形虫病疫苗研发成为防护人类健康的重要任务。目前,弓形虫病疫苗的研发主要集中在灭活疫苗、亚单位疫苗、核酸疫苗等,但此类疫苗仅能为免疫机体提供部分免疫保护力,而无法达到完全保护,免疫保护效果并不理想。弱毒疫苗具有免疫原性好、免疫期长等优点,成为弓形虫病防控的最佳选择之一,但目前仅有一株s48弓形虫弱毒活疫苗被允许在预防山羊和绵羊的流产中应用,因此加快抗弓形虫病弱毒疫苗的研发便成为了一个重要的研究方向。
本试验首次在弓形虫上进行双基因敲除。其原理为首先将单个毒力基因进行敲除,经筛选获得单个毒力基因缺失虫株。然后在此缺失虫株中再进行另一个毒力基因的敲除,经筛选最终获得双毒力基因缺失虫株。双毒力基因缺失的虫株其安全性要高于单个毒力基因缺失虫株。。
技术实现要素:
针对现有技术的不足,本发明的一个目的旨在提供一种用于预防弓形虫感染的减毒活疫苗;本发明的另一个目的旨在提供所述预防弓形虫感染的减毒活疫苗的应用;该减毒活疫苗能够有效抵抗弓形虫的慢性感染和急性感染,有效预防弓形虫病,并且安全性提高。
为了实现上述目的,本发明所述一种用于预防弓形虫感染的减毒活疫苗,是以pbs为溶剂制成的106个/200μl弓形虫弱毒虫株rh:δgra17δnpt1的速殖子混悬液。
本发明所述一种用于预防弓形虫感染的减毒活疫苗的制备方法,实现步骤如下:
1)敲除质粒的构建:
根据弓形虫基因组网站toxodb中的gra17基因(tgme49_222170)设计sgrna:gactgtccctgaggacccat然后利用q5定点突变试剂盒将psag1::cas9::u6sguprt中的sgrna替换成gra17的即构建质粒psag1::cas9::u6sggra17;dhfr抗性片段dhfr-f:aagcttttacatccgttgc和dhfr-r:gaattcctggcgaaatcaa通过引物从质粒puprt-dhfr-d扩增获得;
npt1(tgme49_215490)基因设计sgrna:gatgaaggtgcaagctcccg然后利用q5定点突变试剂盒将psag1::cas9::u6sguprt中的sgrna替换成npt1的即构建质粒psag1::cas9::u6sgnpt1;
ble-f:aagcttttacatccgttgc和ble-r:gaattcctggcgaaatcaa通过引物从质粒psag1-ble扩增获得;
2)rh:δgra17δnpt1虫株的构建:
将hff细胞接种于25t的细胞培养瓶中,加入8ml10%fbs的dmem培养基,在37℃的co2培养箱中培养,待细胞完全长满之后,换成8ml含2%fbs的dmem培养基,加入500μl刚刚逸出的rh速殖子,培养48h后,收集及纯化速殖子用于弓形虫的电转染;
将psag1::cas9::u6sggra17质粒与dhfr抗性片段电转到弓形虫中,经过乙胺嘧啶及96孔细胞版有限稀释获得单克隆虫株,放大培养后,提取基因组dna,根据引物ko-gra17-f:caatccagggacgaaccatt和ko-gra17-r:tctgcttcacggccatctt验证gra17基因是否敲掉,pcr扩不出来者为阳性rh:δgra17虫株;
在rh:δgra17虫株的基础上将psag1::cas9::u6sgnpt1质粒与ble抗性片段电转到rh:δgra17虫株中,换成8ml含2%fbs的pmri培养基,经过腐草霉素及96孔细胞版有限稀释获得单克隆虫株,放大培养后,提取基因组dna,根据引物ko-npt1-f:acaatgtgggaaagtacc和ko-npt1-r:gaagagcagacaaggaat验证npt1基因是否被敲除,经pcr扩增,无特异性条带出现为rh:δgra17δnpt1虫株;
3)减毒活疫苗的制备:
将hff细胞接种于25t的细胞培养瓶中,加入8ml10%fbs的dmem培养基,在37℃的co2培养箱中培养,待细胞完全长满之后,换成8ml含2%fbs的prmi培养基,加入100μlrh:δgra17δnpt1虫株,37℃co2培养箱中培养至虫体从细胞中逸出,并收集rh:δgra17δnpt1速殖子;将收集所得虫体悬液用3μm滤器过滤除去细胞碎片,然后用无菌pbs调整速殖子的浓度至106个/200μl;制备得到减毒活疫苗。
所述用于预防弓形虫感染的减毒活疫苗可应用于急性弓形虫感染的免疫保护。
所述用于预防弓形虫感染的减毒活疫苗可应用于慢性弓形虫感染的免疫保护。
所述用于预防弓形虫感染的减毒活疫苗可应用于先天性弓形虫感染的免疫保护。
本发明所述一种用于预防弓形虫感染的减毒活疫苗及其应用,其有益效果在于:本发明首次在弓形虫进行双基因敲除,其安全性较单个毒力基因敲除大大提高,提供一种用于预防弓形虫感染的减毒活疫苗,确立了其免疫剂型,探明了该疫苗的免疫接种程序及接种剂量,通过动物实验,发现其对于抗弓形虫急性感染、慢性及先天性感染具有良好的免疫保护效果,可用于预防弓形虫的慢性感染和急性感染,是具有巨大应用价值的减毒活疫苗。
附图说明
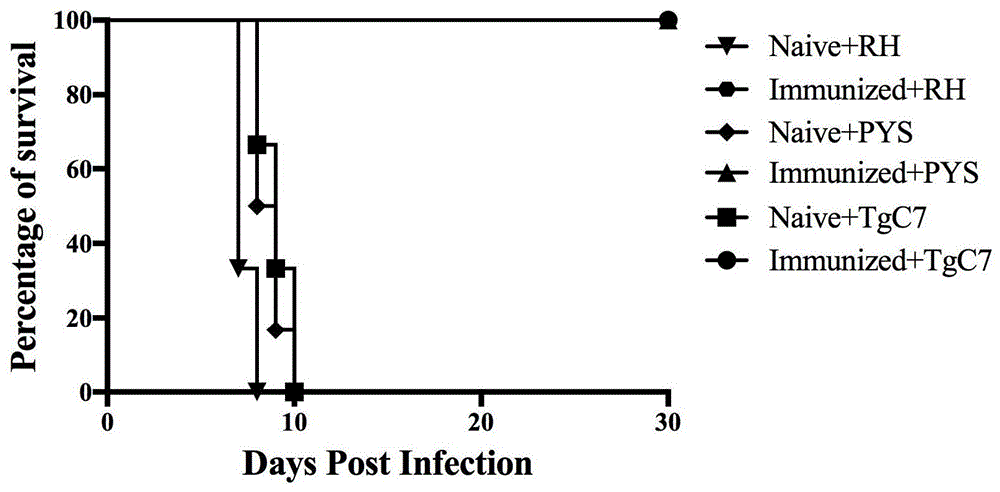
图1为经rh:δgra17δnpt1弱毒疫苗免疫的小鼠在急性感染rh株、pys株及tgc7株速殖子后的存活时间示意图;
图2为经rh:δgra17δnpt1弱毒疫苗免疫的小鼠在感染pru株包囊或卵囊后的存活率的示意图,其中图2a及图2b为免疫的小鼠感染10或100个pru虫株包囊后的存活时间,图2c及图2d为感染10或100个pru虫株卵囊后的存活时间示意图;
图3为经rh:δgra17δnpt1弱毒疫苗免疫的小鼠在慢性感染pru株包囊或卵囊后的脑包囊计数示意图,为免疫的小鼠口服感染10虫株包囊后的脑包囊计数和口服感染10个pru虫株卵囊后的脑包囊计数示意图;
图4为经rh:δgra17δnpt1弱毒疫苗免疫的小鼠在孕期第5天感染10个pru株卵囊,孕鼠产幼鼠数目(图4a)、幼鼠在第30天时的平均体重(图4b)及母鼠在分娩30天时的脑包囊数目(图4c);
图5为经rh:δgra17δnpt1弱毒疫苗免疫的小鼠在免疫后第60天时,血清中igg、igg1及igg2a抗体水平的示意图;
图6经rh:δgra17δnpt1弱毒疫苗免疫的小鼠脾淋巴细胞的各种细胞因子的表达水平的示意图,其中图6分别为rh:δgra17δnpt1弱毒疫苗免疫小鼠在第60天时其脾淋巴细胞在经弓形虫裂解抗原刺激培养后,其上清收取液中il-2、il-10、il-12和ifn-γ浓度的示意图。
具体实施方式
实施例1
本发明所述一种用于预防弓形虫感染的减毒活疫苗的制备方法,实现步骤如下:
一、敲除质粒的构建:
根据弓形虫基因组网站toxodb中的gra17基因(tgme49_222170)设计sgrna:gactgtccctgaggacccat然后利用q5定点突变试剂盒将psag1::cas9::u6sguprt中的sgrna替换成gra17的即构建质粒psag1::cas9::u6sggra17;dhfr抗性片段dhfr-f:aagcttttacatccgttgc和dhfr-r:gaattcctggcgaaatcaa通过引物从质粒puprt-dhfr-d扩增获得;
npt1(tgme49_215490)基因设计sgrna:gatgaaggtgcaagctcccg然后利用q5定点突变试剂盒将psag1::cas9::u6sguprt中的sgrna替换成npt1的即构建质粒psag1::cas9::u6sgnpt1;
ble-f:aagcttttacatccgttgc和ble-r:gaattcctggcgaaatcaa通过引物从质粒psag1-ble扩增获得;
二、rh:δgra17δnpt1虫株的构建:
将hff细胞接种于25t的细胞培养瓶中,加入8ml10%fbs的dmem培养基,在37℃的co2培养箱中培养,待细胞完全长满之后,换成8ml含2%fbs的dmem培养基,加入500μl刚刚逸出的rh速殖子,培养48h后,收集及纯化速殖子用于弓形虫的电转染。将psag1::cas9::u6sggra17质粒与dhfr抗性片段电转到弓形虫中,经过乙胺嘧啶及96孔细胞版有限稀释获得单克隆虫株,放大培养后,提取基因组dna,根据引物ko-gra17-f:caatccagggacgaaccatt和ko-gra17-r:tctgcttcacggccatctt验证gra17基因是否敲掉,pcr扩不出来者为阳性rh:δgra17虫株;
在rh:δgra17虫株的基础上将psag1::cas9::u6sgnpt1质粒与ble抗性片段电转到rh:δgra17虫株中,换成8ml含2%fbs的pmri培养基,经过腐草霉素及96孔细胞版有限稀释获得单克隆虫株,放大培养后,提取基因组dna,根据引物ko-npt1-f:acaatgtgggaaagtacc和ko-npt1-r:gaagagcagacaaggaat验证npt1基因是否被敲除,经pcr扩增,无特异性条带出现为rh:δgra17δnpt1虫株;
三、减毒活疫苗的制备:
将hff细胞接种于25t的细胞培养瓶中,加入8ml10%fbs的dmem培养基,在37℃的co2培养箱中培养,待细胞完全长满之后,换成8ml含2%fbs的prmi培养基,加入100μlrh:δgra17δnpt1虫株,37℃co2培养箱中培养至虫体从细胞中逸出,并收集rh:δgra17δnpt1速殖子;将收集所得虫体悬液用3μm滤器过滤除去细胞碎片,然后用无菌pbs调整速殖子的浓度至106个/200μl;
四、免疫接种小鼠:
免疫前,将购买回来的昆明小鼠先饲养一周的时间以减少应激反应。将小鼠分为两大组,一组为免疫组:每只小鼠腹腔注射免疫200μl(106个)rh:δgra17δnpt1速殖子;另一组为对照组:每只小鼠腹腔注射200μl无菌pbs;
五、免疫效果评:
(1)急性弓形虫感染组:在免疫后第60天,各取18只rh:δgra17δnpt1免疫组及空白对照组昆明鼠,取6只小鼠腹腔注射103个i型rh速殖子、6只小鼠腹腔注射103个toxodb#9pys速殖子、另外6只小鼠腹腔注射103个toxodb#9tgc7,感染后每天观察小鼠健康状态,并记录其存活时间。在感染后第30天,将存活小鼠安乐致死;
(2)慢性弓形虫感染组:在免疫后第60天,各取28只rh:δgra17δnpt1免疫组及空白对照组昆明鼠,其中8只经口感染10个ii型pru包囊、8只经口感染10个ii型pru卵囊、6只经口感染100个ii型pru包囊、6只经口感染100个ii型pru卵囊,并于攻虫后每天观察小鼠健康状态,记录其存活时间;在感染pru包囊后第30天,将存活小鼠安乐致死,并检测其脑组织中的包囊数;
(3)先天性弓形虫感染组:在免疫后第60天,雌雄小鼠2:1同笼,于第二天早上检查雌鼠孕栓,出现孕栓的小鼠标记为孕期第1天,并以体重增加确定为怀孕;取6只rh:δgra17δnpt1免疫组及12只空白对照组昆明鼠,其中6只rh:δgra17δnpt1免疫组及6只空白对照组于孕期第5天经口感染10个pru卵囊,另外6只空白小鼠经口喂服200μlpbs;并于攻虫后每天观察小鼠健康状态,记录其存活时间。在感染幼鼠出生第30天时,称量幼鼠体重后将幼鼠及存活母鼠安乐致死,并检测其脑组织中的包囊数;
六、不同组间抗体及细胞因子监测:
(1)免疫后于第60天采集6只免疫小鼠的血清用于检测igg抗体以及igg1和igg2a抗体亚类水平;
(2)免疫后于60天取6只小鼠将其处死,并无菌摘取脾脏,分离脾淋巴细胞,用弓形虫裂解抗原刺激脾淋巴细胞并收集细胞上清用于il-2、il-10、il-12及ifn-γ的检测。
本发明的有益效果将通过以下数据说明:
(1)弓形虫rh、pys和tgc7株急性感染试验:
分别取6只各试验组小鼠用于腹腔接种弓形虫rh、pys和tgc7株速殖子约103个/只。攻虫当天记为0天,记录小鼠的存活时间。结果图1所示:对照组小鼠在感染rh、pys或tgc7速殖子后均在10天内死亡,而rh:δgra17δnpt1免疫组感染103个rh、pys或tgc7速殖子均不会死亡,存活时间与对照组相比差异显著(p<0.05)。
(2)弓形虫pru包囊或卵囊慢性感染试验
在免疫后第60天,每组取6只小鼠分别经口感染10或100个ii型pru虫株的包囊和10或100个iipru虫株的卵囊,记录小鼠存活时间。感染后第30天安乐处死存活的小鼠,取脑组织研至匀浆,并检测包囊数量。结果如图2所示:对照组经口感染10个包囊后,仅有75%的小鼠活到了30天(图2a);感染100个卵囊后,小鼠全部死亡(图2b);对照组经口感染10个卵囊后,仅有62.5%的小鼠活到了30天(图2c);100个卵囊后,小鼠全部死亡(图2d);rh:δgra17δnpt1免疫组小鼠在感染10个或100个pru虫株的包囊或卵囊后,全部存活至30天。对照感染组存活小鼠及其感染同剂量的免疫组中的小鼠的脑包囊计数,发现rh:δgra17δnpt1免疫组小鼠的脑包囊数量较对照组显著减少(图3),口服包囊减少率约为91.5%和口服卵囊减少率约为95%。
(3)弓形虫pru卵囊先天性感染试验
取6只rh:δgra17δnpt1免疫组及12只空白对照组昆明鼠,其中6只rh:δgra17δnpt1免疫组及6只空白对照组于孕期第5天经口感染10个pru卵囊,另外6只空白小鼠经口喂服200μlpbs。并于攻虫后每天观察小鼠健康状态,记录其存活时间及产幼鼠数目及幼鼠的体重。结果示发现空白感染组的母鼠全部出现流产,没有幼鼠存活且50%的母鼠在实验过程中出现死亡。免疫感染组中的母鼠表现正常,但是发现免疫感染组中母鼠的产幼鼠数目和幼鼠在第30天的体重与空白无感染组比较显示差异显著(p<0.05)和极显著(p<0.001)。rh:δgra17δnpt1在对先天性感染保护中较弱。而对母鼠中脑包囊计数发现rh:δgra17δnpt1免疫组目鼠的脑包囊数量较对照感染组显著减少(图4c),且减少率可达94%(p<0.001)。
(4)评价rh:δgra17δnpt1引起的免疫反应
在免疫后第60天时采集免疫小鼠的血清,用于检测抗弓形虫igg、igg1、igg2a抗体水平。如图5所示:rh:δgra17δnpt1免疫组小鼠的igg和igg1、igg2a的含量显著高于对照组(p<0.001)。用弓形虫可溶性抗原刺激小鼠上脾细胞发现:与对照组相比,rh:δgra17δnpt1免疫组的脾淋巴细胞上清中il-2、il-10、il-12以及ifn-γ含量显著升高(p<0.001)(图6),提示免疫rh:δgra17δnpt1弱毒疫苗可刺激机体产生平衡和显著的th1和th2免疫应答。
- 还没有人留言评论。精彩留言会获得点赞!