一种盐酸二甲双胍片及其制备方法与流程
本发明涉及药物制剂
技术领域:
,具体涉及一种盐酸二甲双胍片及其制备方法。
背景技术:
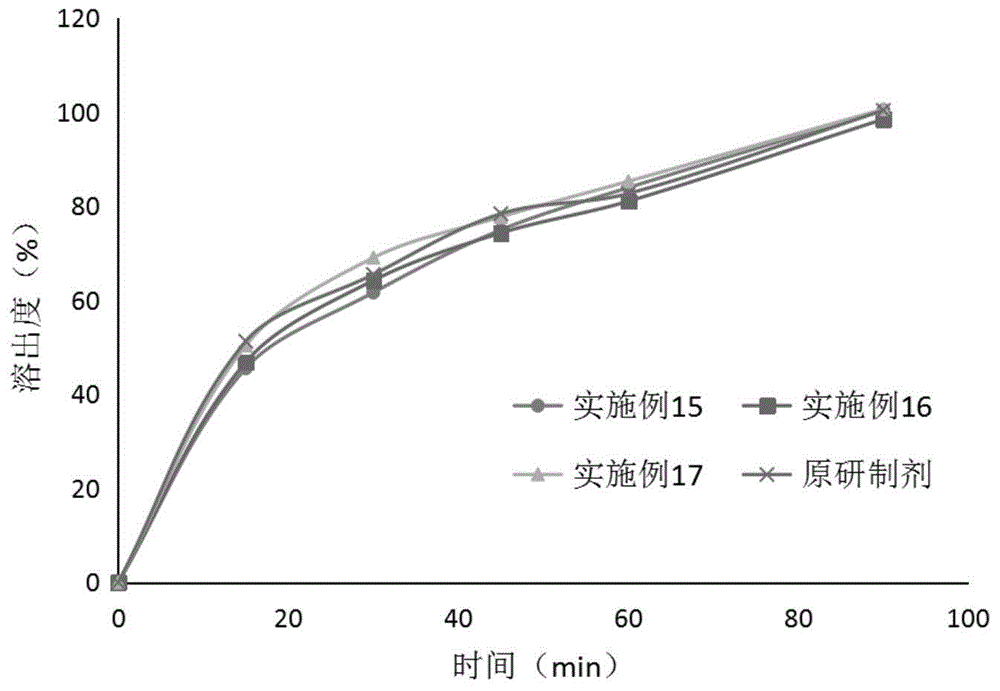
:盐酸二甲双胍是一种用于治疗非胰岛素依赖性(ⅱ型)糖尿病的双胍类降糖药物,尤其对于肥胖和伴有高胰岛素血症者,用本药不但有降血糖作用,还有减轻体重和高胰岛素血症的效果。盐酸二甲双胍可与磺酰脲类、小肠糖苷酶抑制剂或噻唑烷二酮类药物合用,能够达到更好的降糖效果。市售的盐酸二甲双胍常用剂型主要有普通片剂、缓释片、肠溶片和肠溶胶囊等。但盐酸二甲双胍是水溶性药物,其普通制剂经口服后药物容易因局部浓度过高而引起消化道刺激症状。目前盐酸二甲双胍片的原研制剂为德国默克公司的格华止,国内也在进行盐酸二甲双胍片的相关研究,但很难在质量与药效上达到与原研制剂一致的水平,或存在批内、批间的溶出均一性以及批间重现性不佳的问题。技术实现要素:针对现有技术中存在盐酸二甲双胍片批内、批间的溶出均一性以及批间重现性不佳的问题,本发明提供一种盐酸二甲双胍片。以及,本发明还提供一种上述盐酸二甲双胍片的制备方法。为达到上述发明目的,本发明实施例采用了如下的技术方案:一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,所述粘合剂的质量为所述盐酸二甲双胍的1~10%,所述骨架膜材料的质量为所述盐酸二甲双胍的0.25~2.5%,所述润滑剂的质量为所述盐酸二甲双胍的0.25~2.5%,所述骨架膜材料为硬脂酸钠、硬脂酸镁、硬脂酸、硬脂酸钾和硬脂酸富马酸钠中的至少一种。本发明通过采用骨架膜材料的种类和用量,能够使所得盐酸二甲双胍片剂在人工胃液的酸性介质中形成骨架膜而缓慢释放,克服了其在胃中迅速溶出对消化道的刺激症状,并在ph6.0和ph6.8介质中快速释放而起效,与原研厂家欧盟默克公司生产的盐酸二甲双胍片(参比制剂)生物等效批体外溶出相似度高,且批内溶出均一性及批间均一性与原研制剂相比重现性更好,批间差异小,质量稳定。同时,本发明提供的盐酸二甲双胍片能够采用较小的辅料比例,从而使成品片重较小,便于患者吞咽。优选地,所述骨架膜材料的质量为所述盐酸二甲双胍的0.54~2.20%。优选地,所述粘合剂为聚维酮k30、羟丙甲纤维素和羧甲基纤维素钠中的至少一种。优选地,所述粘合剂的质量为所述盐酸二甲双胍的2~5%。优选地,所述润滑剂为硬脂酸钠、硬脂酸镁、硬脂酸、硬脂酸钾、硬脂酸富马酸钠和滑石粉中的至少一种。优选地,所述润滑剂的质量为所述盐酸二甲双胍的0.3~1.5%。以及,本发明实施例还提供一种上述盐酸二甲双胍片的制备方法,将所述粘合剂、骨架膜材料与去离子水制成混悬液,对所述盐酸二甲双胍进行一步制粒,干燥,加入所述润滑剂混匀,压片。以该制备方法制得的盐酸二甲双胍片具有更好的批间重现性,与原研制剂相比具有更小的批间差异,且加速实验和长期实验中表现出更稳定而均一的溶出曲线,质量更稳定。该制备方法操作简单,易于工业化大生产。优选地,所述盐酸二甲双胍的粒径为≤2mm。优选地,干燥至颗粒含水量为0.5~2.5%。颗粒水分过低则可压性下降,含水量过高则颗粒间易结块。优选地,所述制备方法还包括将压片所得片剂进行包衣。包衣剂可由羟丙甲纤维素、二氧化钛、聚乙二醇400和滑石粉组成,包衣增重范围可以为0.5~25%,优选0.5~2.0%。附图说明图1为检验例中实施例15~17所得盐酸二甲双胍片在ph1.2盐酸溶液中的溶出曲线;图2为检验例中实施例15~17所得盐酸二甲双胍片在ph4.5醋酸盐缓冲液中的溶出曲线;图3为检验例中实施例15~17所得盐酸二甲双胍片在ph6.8磷酸盐缓冲液中的溶出曲线;图4为检验例中实施例15~17所得盐酸二甲双胍片在水中的溶出曲线;图5为检验例中实施例4~11所得盐酸二甲双胍片在ph1.2盐酸溶液中的溶出曲线;图6为检验例中实施例4~11所得盐酸二甲双胍片在水中的溶出曲线;图7为检验例中商业批盐酸二甲双胍片和原研制剂在ph1.2盐酸溶液中的批间均一性溶出曲线;图8为检验例中商业批盐酸二甲双胍片和原研制剂在ph4.5醋酸盐缓冲液中的批间均一性溶出曲线;图9为检验例中商业批盐酸二甲双胍片和原研制剂在ph6.8磷酸盐缓冲液中的批间均一性溶出曲线;图10为检验例中商业批盐酸二甲双胍片和原研制剂在水中的批间均一性溶出曲线。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。实施例1本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为聚维酮k30,骨架膜材料为硬脂酸镁,润滑剂为硬脂酸镁。其制备方法为:将40g粘合剂、10g骨架膜材料加去离子水制成质量百分浓度为20%的混悬液,对925g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入5g润滑剂混匀,压片,片重为540mg。实施例2本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为聚维酮k30,骨架膜材料为硬脂酸钠,润滑剂为硬脂酸镁。其制备方法为:将40g粘合剂、10g骨架膜材料加去离子水制成质量百分浓度为20%的混悬液,对925g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入5g润滑剂混匀,压片,片重为540mg。实施例3本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为聚维酮k30,骨架膜材料为硬脂酸,润滑剂为硬脂酸镁。其制备方法为:将40g粘合剂、10g骨架膜材料加去离子水制成质量百分浓度为15%的混悬液,对925g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入5g润滑剂混匀,压片,片重为540mg。实施例4本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为羟丙甲纤维素,骨架膜材料为硬脂酸钾,润滑剂为硬脂酸。其制备方法为:将40g粘合剂、5g骨架膜材料加去离子水制成质量百分浓度为15%的混悬液,对925g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入10g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重1.5%。实施例5本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为聚维酮k30,骨架膜材料为硬脂酸富马酸钠,润滑剂为硬脂酸钾。其制备方法为:将18.9g粘合剂、6g骨架膜材料加去离子水制成质量百分浓度为10%的混悬液,对945g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入2.8g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重2.2%。实施例6本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为羟丙甲纤维素,骨架膜材料为硬脂酸钠,润滑剂为滑石粉。其制备方法为:将40g粘合剂、10g骨架膜材料加去离子水制成质量百分浓度为10%的混悬液,对920g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入10g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重2.0%。实施例7本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为羧甲基纤维素钠,骨架膜材料为硬脂酸镁,润滑剂为硬脂酸富马酸钠。其制备方法为:将20g粘合剂、10g骨架膜材料加去离子水制成质量百分浓度为10%的混悬液,对940g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入10g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重2.5%。实施例8本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为羧甲基纤维素钠,骨架膜材料为硬脂酸,润滑剂为硬脂酸钠。其制备方法为:将40g粘合剂、15g骨架膜材料加去离子水制成质量百分浓度为10%的混悬液,对915g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入10g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重1.8%。实施例9本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为聚维酮k30,骨架膜材料为硬脂酸钾,润滑剂为硬脂酸镁。其制备方法为:将20g粘合剂、15g骨架膜材料加去离子水制成质量百分浓度为10%的混悬液,对935g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入10g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重2.1%。实施例10本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为聚维酮k30,骨架膜材料为硬脂酸富马酸钠,润滑剂为硬脂酸。其制备方法为:将45.5g粘合剂、20g骨架膜材料加去离子水制成质量百分浓度为10%的混悬液,对910g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入13.6g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重2.4%。实施例11本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为羧甲基纤维素钠,骨架膜材料为硬脂酸钠,润滑剂为硬脂酸钾。其制备方法为:将20g粘合剂、20g骨架膜材料加去离子水制成质量百分浓度为10%的混悬液,对930g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入10g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重1.7%。实施例12本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为羟丙甲纤维素,骨架膜材料为硬脂酸钾,润滑剂为硬脂酸富马酸钠。其制备方法为:将9.25g粘合剂、23g骨架膜材料加去离子水制成质量百分浓度为15%的混悬液,对925g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入23g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重1.5%。实施例13本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为聚维酮k30,骨架膜材料为硬脂酸钾和硬脂酸富马酸钠的等质量混合物,润滑剂为滑石粉和硬脂酸镁的等质量混合物。其制备方法为:将92.5g粘合剂、2.3g骨架膜材料加去离子水制成质量百分浓度为15%的混悬液,对925g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入2.3g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重2.0%。实施例14本发明实施例提供了一种盐酸二甲双胍片,成分包括盐酸二甲双胍、粘合剂、骨架膜材料和润滑剂,粘合剂为羟丙甲纤维素,骨架膜材料为硬脂酸钠和硬脂酸的等质量混合物,润滑剂为硬脂酸镁和滑石粉的等质量混合物。其制备方法为:将46.25g粘合剂、18.5g骨架膜材料加去离子水制成质量百分浓度为8%的混悬液,对925g粒径≤2mm的盐酸二甲双胍进行一步制粒,进风温度为60~70℃,出风温度为45~55℃,制粒完成后干燥至水分为0.5~2.5%,出料,16目整粒,加入9.25g润滑剂混匀,压片,片重为540mg。对所得片剂进行普通薄膜包衣至增重2.1%。实施例15将实施例1所得片剂进行普通薄膜包衣至增重0.5%。实施例16将实施例2所得片剂进行普通薄膜包衣至增重1.0%。实施例17将实施例3所得片剂进行普通薄膜包衣至增重2.0%检验例1、对实施例15~17所得盐酸二甲双胍片进行盐酸二甲双胍溶出曲线的考察,介质选择ph1.2盐酸溶液、ph4.5醋酸盐缓冲液、ph6.8磷酸盐缓冲液和水(中国药典2015版)900ml,方法采用《中国药典》2015年版四部通则0931溶出度测定法第二法(桨法),转速设定为50rpm,温度设定为37℃,分别测定不同时间的溶出度。检测结果如表1~4以及图1~4所示。表1ph1.2盐酸溶液中各取样点溶出度时间(min)01530456090实施例15(%)0.0045.5161.6174.9283.90100.41实施例16(%)0.0046.8164.1774.2681.0198.45实施例17(%)0.0050.3568.9977.6785.24100.57原研制剂(%)0.0051.2565.4578.3582.65100.32表2ph4.5醋酸盐缓冲液中各取样点溶出度时间(min)01530456090实施例15(%)0.0042.2258.1269.4677.3499.31实施例16(%)0.0046.6559.2471.7183.4599.67实施例17(%)0.0041.5457.3372.9483.2795.85原研制剂(%)0.0046.8663.1773.5382.62100.01表3ph6.8磷酸盐缓冲液中各取样点溶出度时间(min)01530456090实施例15(%)0.0054.3174.4190.1497.81100.31实施例16(%)0.0053.1370.6684.6292.0199.17实施例17(%)0.0057.8179.6488.1495.4899.76原研制剂(%)0.0063.5776.5692.4698.47100.24表4水中各取样点溶出度时间(min)01530456090实施例15(%)0.0046.0676.4495.19100.14101.85实施例16(%)0.0044.7071.1589.53100.00100.99实施例17(%)0.0042.3669.2892.43100.56101.54原研制剂(%)0.0047.5175.6292.31100.45102.31从以上实验结果可见,本发明实施例所得样品的溶出情况与原研制剂相似,受ph值的影响,在酸性介质中溶出较慢,可以减缓二甲双胍对胃肠道的刺激,在肠溶液中又能迅速释放,快速起效。相对于原研制剂,本发明处方工艺的稳定性更好,生产过程更容易控制,溶出度均一性更好。2、按上述方法对实施例4~11所得盐酸二甲双胍片进行溶出曲线的考察,结果如表5~6以及图5~6所示。表5ph1.2盐酸溶液中各取样点溶出度时间(min)01530456090实施例4(%)0.0046.3261.3284.0996.5399.77实施例5(%)0.0047.5164.1683.1696.16100.15实施例6(%)0.0044.8160.5981.1193.58101.29实施例7(%)0.0043.5962.6379.8296.27101.5实施例8(%)0.0042.6757.7877.9194.4597.51实施例9(%)0.0041.8256.8576.6495.6599.87实施例10(%)0.0038.9153.9173.9489.1695.51实施例11(%)0.0038.9454.9472.8389.5194.63原研制剂(%)0.0051.2565.4578.3582.65100.32表6水中各取样点溶出度从表5~6实验结果可见,用本发明保护的各成分在其优选用量范围内所制得的盐酸二甲双胍片均能形成骨架膜制剂,其溶出行为与原研制剂相似。3、按本发明实施例16的配方和制备方法在北京中惠药业有限公司进行商业批规模的生产,每批72万片,并进行了与原研制剂的生物等效性研究。其溶出情况的批间均一性数据如表7~10及图7~10所示。表7商业批在ph1.2盐酸溶液中各取样点溶出度时间(min)01530456090商业批1(%)0.0047.765.275.581.997.4商业批2(%)0.0048.565.274.683.799.7商业批3(%)0.0044.159.770.879.295.8原研制剂批号1(%)0.0042.856.770.782.1101.7原研制剂批号2(%)0.0047.765.275.581.997.4表8商业批在ph4.5醋酸盐缓冲液中各取样点溶出度时间(min)01530456090商业批1(%)0.0046.659.271.783.496.0商业批2(%)0.0046.063.173.782.697.2商业批3(%)0.0044.064.372.383.596.7原研制剂批号1(%)0.0052.370.187.499.0102.3原研制剂批号2(%)0.0046.963.273.582.6100.0表9商业批在ph6.8磷酸盐缓冲液中各取样点溶出度表10商业批在水中各取样点溶出度时间(min)01530456090实施例15(%)0.0057.375.989.795.696.7实施例16(%)0.0053.170.684.692.094.8实施例17(%)0.0051.271.284.796.499.6原研制剂批号1(%)0.0057.481.396.8100.8102.9原研制剂批号2(%)0.0047.575.692.3100.4102.3由表7~10的实验结果可见,本发明处方工艺的批间稳定性更好,生产过程更容易控制,批间溶出度均一性更好。根据文献可知,美国施贵宝产的格华止和法国默克产的格华止的体外溶出不相同,但其在体内生物等效。且本试验测定的两批原研制剂的溶出曲线确实有很大的差异,但本发明制得的盐酸二甲双胍片的批间差异较小,从而更好的保证了本发明所得产品的质量。4、采用双交叉设计,以药动学参数(cmax,auc)为主要分析指标,对本发明的盐酸二甲双胍片进行生物等效性实验,结果如表11所示。表11生物等效性实验受试者分别服用本发明制得的盐酸二甲双胍片与原研制剂后,二甲双胍主要药代参数(cmax、auc0-t、auc0-∞)几何均值比值及其90%ci都在80.00%~125.00%范围内。综合上述结果,可判断本次空腹试验健康受试者单次口服受试制剂盐酸二甲双胍片(0.5g/片;北京中惠药业有限公司)与原研制剂盐酸二甲双胍片(0.5g/片;mercksantés.a.s)生物等效。5、将上述三批商业批样品在30℃,湿度65%储存,检测放置过程中样品的有关物质和活性成分含量,结果如表12所示。同时测定该稳定性过程中样品在ph1.2和水介质中的溶出曲线,结果如表13所示。表12有关物质稳定性结果表13溶出稳定性数据由表12、13结果可见,商业批盐酸二甲双胍片的稳定性良好。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1