一种制备多囊脂质体的方法与流程
本发明涉及生理活性物质的包封方法
技术领域:
,具体来说,涉及用于制备具有持续释放特性的多囊脂质体制剂的乳化方法以及通过这些方法制备的制剂。
背景技术:
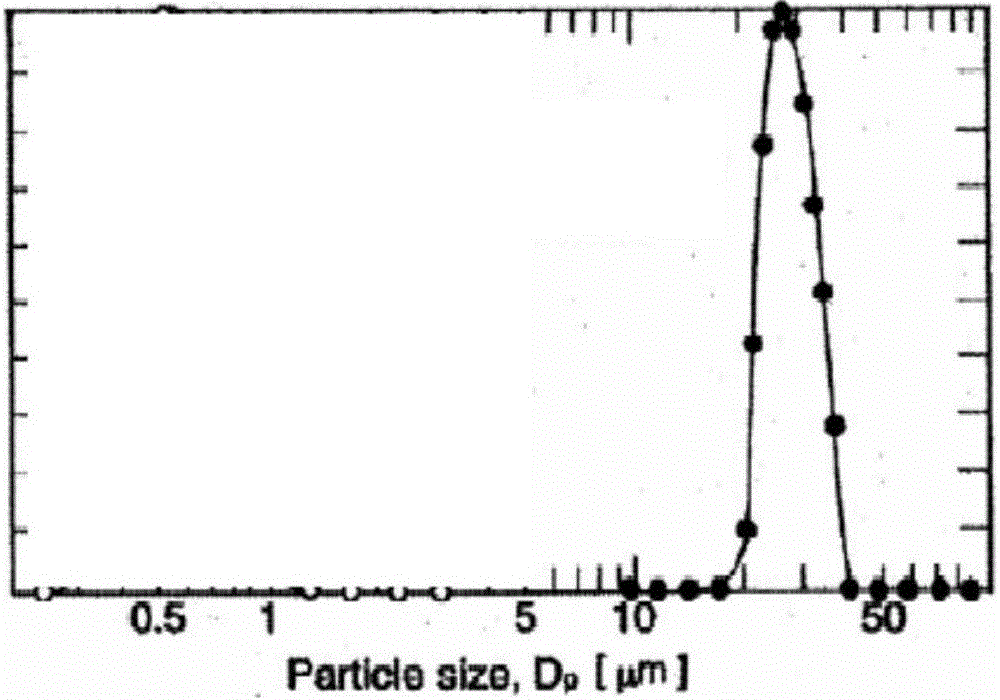
:脂质体(liposomes)主要是由磷脂和胆固醇等组成的类似于生物膜双分子层结构的囊泡,其粒径大小在纳米和微米级,是一种新型的药物载体,脂类成分在体内可以生物降解,耐受性良好。根据脂质体是否同心结构,脂质体可分为同心结构的单室脂质体和多室脂质体以及非同心结构的多囊脂质体(mlv)。同心结构脂质体由一个或多个同心脂质双层组成,结构类似乒乓球或洋葱。由非同心多重脂质层组成的多囊脂质体的结构类似于蜂窝。多囊脂质体内部是由许多个多面体含水腔室以非同心圆的形式构成的,各水性腔室之间又以类脂双分子层磷脂膜相隔,多囊脂质体具有较大的粒径和更多的包封容积,适用于包封水溶性药物。当某个囊泡破裂时,活性物质从破裂囊泡释出,但完整的囊泡仍可保持原状,因而有很好的稳定性和较长的药物释放持续时间。多囊脂质体注射途径广泛,可用于硬膜外,关节腔或软组织等,安全性较高。普通脂质体相比,它由于具有较大的内水相空间,对亲水性药物有很高的包封率,药物释放缓慢,贮存期间稳定性高。目前已经国外有depocyte(阿糖胞苷脂质体)、depodur(硫酸吗啡脂质体)以及exprarel(布比卡因脂质体)等多囊脂质体制剂产品已上市。与未包封的药物相比,多囊脂质体包封明显延长了半衰期,降低药物峰浓度,减少药物的不良反应。目前,制备多囊脂质体主要采用复乳法。通常需要经过以下4个步骤:(1)先将脂质成分溶解于易挥发水不混溶溶剂(通常为氯仿或氯仿与乙醚的混合液)形成油相,再以合适的油水体积比将含药的水溶液(第一水相)与脂质的挥发性溶剂相混合,在室温下超声或机械剪切一定时间制备出均匀的油包水(w/o)型初乳。所用脂质为磷脂、胆固醇和中性脂质(常用甘油三酯)等。中性脂质是mvl的制备中重要的部分,否则只能得到普通脂质体。制备初乳的方法有超声、高速分散、乳匀机等。(2)形成的w/o型初乳中加入一定体积的外水相缓冲液(第二水相),并在一定条件下涡旋或机械剪切再次乳化形成水包油包水(w/o/w)型复乳。(3)以一定的速率惰性气体(如氮气)除去复乳中的挥发性溶剂,可在表面通入氮气或将氮气导管伸入容器底部来除去挥发性溶剂。(4)用适用于储存和生理上可接受的盐溶液(如0.9%氯化钠溶液)置换第二水相,除去未包封的游离药物,浓缩。上述制备工艺中一个较突出的问题是粒径分布不均,主要是由于复乳制备过程中由于搅拌过程分散不均,制备得到复乳粒径也大小不一,不易控制,复乳的粒径范围较宽,影响到最终产品的粒径均匀性。同时搅拌法制备工艺也不易放大,小试的工艺参数在放大后要进行很大的调整,不易放大。技术实现要素:本发明的目的是提供一种克服了现有技术存在的不足之处的多囊脂质体制备工艺,采用膜乳化法制备粒径均一的复乳,进而制备得到粒径均匀一致的多囊脂质体。为实现上述目的,本发明所采取的技术方案:一种制备粒度均一的多囊脂质体的方法,包括以下步骤:a)将内水相和挥发性水不混溶溶剂相进行混合,乳化制备w/o型初乳;b)将上述所得到的w/o初乳通过一个多孔部件压入外水相,得到的w/o/w型复乳;c)除去复乳中挥发性水不混溶溶剂,得到多囊脂质体混悬液。所述的挥发性水不混溶溶剂相是将脂质成分溶解于挥发性水不混溶溶剂中得到。优选地,所述的多孔部件是多孔膜,由无机多孔材料或有机多孔材料组成。优选地,所述多孔膜由无机多孔材料组成,包括但不限于硅砂多孔玻璃膜、陶瓷膜、硅铝多孔膜、沸石基多孔膜、金属氧化物基多孔膜等。优选地,所述的多孔膜由有机高分子多孔材料组成,包括但不限于高分子量聚烯烃薄膜。优选地,所述内水相含有活性物质,所述活性物质包括小分子化学药物、多肽、蛋白质药物中至少一种。优选地,所述内水相与水不混溶溶剂相的体积比为1:1~1:5,所述水不混溶溶剂相与外水相的体积比为1:2~1:60。作为本发明制备多囊脂质体的方法的最佳实施方式,当内水相与水不混溶溶剂相的体积比为1:1.8时,其制备得到的脂质体的性能最佳。优选地,所述挥发性水不混溶溶剂相为磷脂,胆固醇,中性脂类和挥发性不混溶溶剂的混合物。优选地,所述步骤c)挥发性水不混溶溶剂为氯仿或二氯甲烷。优选地,步骤c)中为采用氮气吹扫除去复乳中挥发性水不混溶溶剂。优选地,所述步骤c)后,还包括步骤d)通过置换脂质体混悬液外水相,除去游离药物,浓缩得到多囊脂质体成品。优选地,所述药物包括麻醉类药物,所述麻醉类药物为布比卡因、罗哌卡因、普鲁卡因、左布比卡因,利多卡因及其盐类衍生物。优选地,所述磷脂为卵磷脂pc类与磷脂酰甘油pg类或磷脂酰丝氨酸ps类的混合物,所述磷脂pc选自二油酰基卵磷脂dopc、二肉豆蔻酰基卵磷脂dmpc、二硬脂酰基磷脂酰胆碱dspc、二芥酰基卵磷脂depc、二棕榈酰基卵磷脂dppc、氢化大豆卵磷脂hspc中的一种;所述磷脂酰甘油pg为二油酰磷脂酰甘油dopg、二棕榈酰磷脂酰甘油dppg、蛋黄磷脂酰甘油epg、二硬脂酰磷脂酰甘油dspg中一种;磷脂酰丝氨酸ps为二油酰基磷脂酰丝氨酸dops;所述中性脂选自三油酸甘油酯、三棕榈酸甘油酯、三肉豆蔻酸甘油酯、三亚油酸甘油酯、三丁酸甘油酯、三辛酸甘油酯、三己酸甘油酯、以及三癸酸甘油酯至少一种。优选地,所述活性成分占100-300重量份、磷脂40-80重量份、胆固醇10-40重量份,中性油脂5-20重量份。优选地,所述外水相中含有葡萄糖和赖基酸。优选地,葡萄糖占外水相的质量百分比为3%~5%,所述赖氨酸的摩尔体积浓度为5~40mm。优选地,所述步骤1)中的高剪切设备剪切速度为10000-20000rpm,时间为5~10min。一种多囊脂质体,由上述制备方法制得。本发明的有益效果在于:1、本发明以亲水性无机微孔膜为介质,借助于膜分离的经验和毛细管作用力原理,通过在膜的一侧施加压力,使w/o乳液透过膜孔,以液滴的形式分散在与之不相溶的水溶液之中,形成w/o/w型乳液;由于膜的孔径比较均一,所产生的乳滴尺寸也很均一,再结合溶剂挥发法等工艺,即可得到粒径均一可控的多囊脂质体。2、膜乳化法制备粒度比较均一的复乳,进一步除去复乳中的溶剂,制备得到内外相均为水相的粒径均匀一致的非同心圆结构多囊脂质体,该制剂粒径集中、性质稳定,缓释效果好。本发明提供的脂质体制剂的平均粒径为20-40um,最终包封率为97%以上。3、用膜乳化法制备乳液具有操作简单、能耗小、易于控制。附图说明图1是实施例1的粒径分布图;图2是实施例1与对照组的药物缓释效果图。具体实施方式以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本发明而非用于限定本发明的范围。故凡依本发明专利申请范围所述的方法原理所做的等效变化或修改,均包括于本发明专利申请范围内。一种多囊脂质体的制备方法,包括以下步骤:l)w/o型初乳的制备将亲水性药物溶解于水作为内水相;将磷脂,胆固醇,中性脂类溶于水不混溶挥发性溶剂氯仿或二氯甲烷作为水不混溶溶剂相;将内水相与水不混溶溶剂相混合,用高剪切设备制成w/o型初乳。2)w/o/w复乳的制备将葡萄糖,赖氨酸溶解于水中作为外水相;将上述步骤l)所得到的初乳通过多孔膜压入外水相,得到粒度均一的w/o/w型复乳;3)将步骤2)制得的复乳采用氮气吹扫,除去复乳中的挥发性水不混溶溶剂,得到多囊脂质体;4)再将脂质体通过中空纤维柱切向流系统,采用nacl溶液进行外水相交换,除去游离药物,置换外水相,并浓缩得到多囊脂质体成品。所述多孔膜由多孔膜无机多孔材料或者有机高分子多孔材料组成组成,包括但不限于硅砂多孔玻璃膜、陶瓷膜、硅铝多孔膜、沸石基多孔膜、金属氧化物基多孔膜等。包括但不限于高分子量聚烯烃薄膜。所述亲水性药物包括小分子化学药物、多肽、蛋白质药物中至少一种。所述药物包括麻醉类药物,所述麻醉了类药物为布比卡因、罗哌卡因、普鲁卡因、左布比卡因,利多卡因及其盐类衍生物。所述内水相与水不混溶溶剂相的体积比为1:1~1:5,所述水不混溶溶剂相与外水相的体积比为1:2~1:60。上述药物占100-300重量份、磷脂40-80重量份、胆固醇10-40重量份,中性油脂5-20重量份,葡萄糖占外水相的质量百分比为3%~5%,所述赖氨酸的摩尔体积浓度为5~40mm。上述磷脂pc选自二油酰基卵磷脂dopc、二肉豆蔻酰基卵磷脂dmpc、二硬脂酰基磷脂酰胆碱dspc、二芥酰基卵磷脂depc、二棕榈酰基卵磷脂dppc、氢化大豆卵磷脂hspc中的一种;所述磷脂酰甘油pg为二油酰磷脂酰甘油dopg、二棕榈酰磷脂酰甘油dppg、蛋黄磷脂酰甘油epg、二硬脂酰磷脂酰甘油dspg中一种;磷脂酰丝氨酸ps为二油酰基磷脂酰丝氨酸dops;所述中性脂选自三油酸甘油酯、三棕榈酸甘油酯、三肉豆蔻酸甘油酯、三亚油酸甘油酯、三丁酸甘油酯、三辛酸甘油酯、三己酸甘油酯、以及三癸酸甘油酯至少一种。实施例1本实施例的各组分的原料重量份为,磷酸布比卡因150份、depc60份、dppg20份、胆固醇30份、三辛酸甘油酯10份。将上述原料配制成表1所示含量:本实施例的内水相、水不混溶溶剂相、外水相的处方如下表1所示:表1一种多囊脂质体的制备方法,包括以下步骤:l)w/o型初乳的制备配制60mg/ml磷酸布比卡因的水溶液50ml,作为内水相;将该内水相与50ml溶有卵磷脂和胆固醇,三辛酸甘油酯的二氯甲烷溶液的水不混溶溶剂相相混合,高剪切乳化器t25(ika)10000rpm乳化10min,得到w/o型初乳。2)w/o/w复乳的制备将葡萄糖,赖氨酸等溶解于水中,作为外水相;将80ml的上述步骤l)w/o型初乳用恒定压力15kpa,通过孔径20um的亲水性spg微孔膜(日本spgtechnology株式会社)压入400ml外水相,得到w/o/w型的复乳;3)将步骤2)制得的复乳采用氮气吹扫,除去复乳中的挥发性二氯甲烷,得到多囊脂质体;4)再通过microzaujp中空纤维膜(pall,0.65um),以0.9%氯化钠溶液进行置换,除去未包封药物并进行浓缩,得到布比卡因多囊脂质体。实施例2本实施例的各组分的原料重量份为,盐酸罗哌卡因200份、dopc45份、dppg15份、胆固醇20份、三油酸甘油脂5份。将上述原料配制成表1所示含量:本实施例的内水相、水不混溶溶剂相、外水相的配方组成,如表2所示,表2本实施例的多囊脂质体的制备方法,包括以下步骤:l)w/o型初乳的制备配制67mg/ml盐酸罗哌卡因的水溶液30ml,作为内水相;将该内水相与60ml溶有卵磷脂和胆固醇,三辛酸甘油酯的二氯甲烷溶液的水不混溶溶剂相相混合,高剪切乳化器t25(ika)15000rpm乳化5min,得到w/o型初乳。2)w/o/w复乳的制备将葡萄糖,赖氨酸等溶解于水中,作为外水相;将40ml的上述步骤l)w/o型初乳用的恒定压力15kpa,通过孔径15um高分子量聚烯烃薄膜的压入300ml外水相,得到w/o/w型的复乳;3)将步骤2)制得的复乳采用氮气吹扫,除去复乳中的氯仿,得到多囊脂质体;4)再通过microzaujp中空纤维膜(pall,0.20um),以0.9%氯化钠溶液进行置换,除去未包封药物,并进行浓缩,得到罗哌卡因多囊脂质体样品。实施例3本实施例的各组分的原料重量份为,盐酸普鲁卡因100份、dopc45份、dops15份、胆固醇40份、三癸酸甘油脂20份。将上述原料配制成表1所示含量:本实施例的内水相、水不混溶溶剂相、外水相的配方组成,如表3所示,表3本实施例的多囊脂质体的制备方法,包括以下步骤:l)w/o型初乳的制备配制50mg/ml盐酸普鲁卡因的水溶液40ml,作为内水相;将该内水相与200ml溶有卵磷脂和胆固醇,三癸酸甘油酯的二氯甲烷溶液的水不混溶溶剂相相混合,高剪切乳化器(ika)20000rpm乳化10min,得到w/o型初乳。2)w/o/w复乳的制备将葡萄糖,赖氨酸等溶解于水中,作为外水相;将60ml的上述步骤l)w/o型初乳用的恒定压力15kpa,通过孔径25um的亲水性陶瓷膜(日本spgtechnology株式会社)压入400ml外水相,得到w/o/w型的复乳;3)将步骤2)制得的复乳采用氮气吹扫,除去复乳中的二氯甲烷,得到多囊脂质体;4)再通过microzaump中空纤维膜(pall,0.20um),以0.9%氯化钠溶液进行置换,除去未包封药物,并进行浓缩,得到普鲁卡因多囊脂质体样品。实施例4本实施例的各组分的原料重量份为,盐酸左布比卡因300份、hspc36份、epg4份、胆固醇10份、三辛酸甘油脂4份、三油酸甘油脂4份。将上述原料配制成表1所示含量:本实施例的内水相、水不混溶溶剂相、外水相的配方组成,如表4所示,表4本实施例的多囊脂质体的制备方法,包括以下步骤:l)w/o型初乳的制备配制75mg/ml盐酸左布比卡因的水溶液20ml,作为内水相;将该内水相与80ml溶有卵磷脂和胆固醇,三辛酸/三油酸甘油酯的氯仿溶液的水不混溶溶剂相相混合,高剪切乳化器(ika)20000rpm乳化10min,得到w/o型初乳。2)w/o/w复乳的制备将葡萄糖,赖氨酸等溶解于水中,作为外水相;将80ml的上述步骤l)w/o型初乳用的恒定压力15kpa,通过孔径20um的硅铝多孔膜(日本spgtechnology株式会社)压入4800ml外水相,得到w/o/w型的复乳;3)将步骤2)制得的复乳采用氮气吹扫,除去复乳中的氯仿,得到多囊脂质体;4)再通过microzaump中空纤维膜(pall,0.20um),以0.9%氯化钠溶液进行置换,除去未包封药物,并进行浓缩得到盐酸左布比卡因多囊脂质体样品。效果例1取布比卡因溶液和实例1中制备的布比卡因脂质体各1ml分别置spectrumg2透析管(50kd),分别置于200ml烧杯中,加入150ml释放介质,37度恒温振荡器中振荡(30转/分),分别第0.5、4、24、48、72h取出5ml释放介质,并补入新鲜的释放介质5ml。取出的释放介质过0.22μm微孔滤膜后,hplc进样。计算释放百分比。结果见下图1,普通的布比卡因溶液在5h左右基本全部释放,而本发明的多囊脂质体中药物释放率明显比普通的布比卡因溶液减慢。效果例2取实例1中的复乳测定粒度分布图,可见粒径分布均匀。平均粒度28um。效果例3将实施例1~4制备的多囊脂质体,放置在2-8℃冷藏条件下保存,分布在0个月、3个月、6个月进行性能测试,如表5所示:表5从表5中可看出,本发明实施例1至4制备的在放置6个月后,其ph、粒径、药物、径距、渗透压、包封率改变较小,表明本发明的脂质体具有良好的稳定性,且其粒径均在28μm左右,随着时间的改变,粒径发生微小的改变,说明体系分散性好,稳定,其中径距改变微小,而实施例1~4均有良好的药物包封率,在97%以上。效果例4本发明的多囊脂质体稳定性好、粒径均一等,本效果例考察了内水相与水不混溶溶剂相的体积比对本发明制备的多囊脂质体的性能效果的影响。除了内水相与水不混溶溶剂相的体积比不同外,其余配方以及制备工艺与实施例2相同;其中内水相与水不混溶溶剂相的体积比如下表6所示:表6内水相与水不混溶溶剂相的体积比试验组11:1.5试验组21:1.8试验组31:2试验组41:3将实验组1~4制备的多囊脂质体,放置在2-8℃冷藏条件下保存,分布在0个月、3个月、6个月进行性能测试,如表7所示:表7从表7中可看出,实验组2制备的多囊脂质体的粒径明显小于其他实验组,且其包封率在放置6个月后,达到了98.3%明显高于其他实验组,可得出,内水相与水不混溶溶剂相的体积比为1:1.8时,其效果显著。以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明保护的范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1