碳基纳米材料在制备缓解或者治疗HD药物中的应用的制作方法
本发明属于纳米药物技术,具体涉及一种碳基纳米材料在制备缓解或者治疗HD药物中的应用。
背景技术:
亨廷顿病(Huntington’s disease,HD)是一种迟发性常染色体显性遗传的神经退行性疾病,主要病理学特征是广泛神经元功能障碍和选择性的纹状体神经元退行性病变,表现为小神经节细胞严重破坏,伴有胶质细胞增生,皮层的突出病理表现和萎缩。
HD基因第一外显子中存在CGA三核苷酸重复序列,其编码产物为亨廷顿蛋白(huntingtin, Htt)N端的一段多聚谷氨酰胺片段(Poly-Q),正常人群中,HD基因中CAG的重复数少于35个,正常的Htt(WT)呈弥散性分布于细胞中。突变的HD基因则编码产生具有超长(Poly-Q)结构的突变亨廷顿蛋白(mutanthuntingtin,mHtt)并错误折叠。研究表明,HD发病年龄以及HD的严重程度与poly-Q的长度相关。mHtt以游离型和聚集型在细胞核和细胞质内广泛存在,错误折叠并产生细胞毒性,损害神经元的正常生理功能,导致 HD 神经病理学损害。突变 Htt 的错误折叠是 HD 神经病理学损害的物质基础,因此抑制其形成或促进其清除对延缓HD的病理学进程具有重要意义。
纳米技术用于疾病的诊断,缓解和治疗是一个快速发展和极具前途的领域,但目前仍处于初级阶段。纳米材料作为HD诊断、缓解和治疗的潜在纳米药物,具有极其重要的角色。在过去的几年中,利用纳米粒子被动和主动运输将药物运送到脑部的相关研究已取得较大进展。虽然人们对纳米材料类药物作为“智能”药物并应用于HD 治疗寄予了极大希望,但由于HD的病因仍未完全阐明,以及HD治疗药物难以透过血脑屏障均为HD治疗带来重重困难,纵观各项研究,寻找HD诊断和有效干预手段需要拨云见日的勇气和创新思索,更需要研究者孜孜不倦的追求。另外,与其他两大类蛋白质聚集导致的神经退行性疾病(AD、PD)不同,引起HD发病的Htt蛋白是在细胞内甚至是细胞核内聚集的,这增加了靶向抑制蛋白质聚集的药物在HD中的治疗难度,这要求治疗药物不仅需要具有透过血脑屏障的功能,还需要具有透过细胞并能进入细胞核的功能。
技术实现要素:
本发明公开了一种碳基纳米材料在制备缓解或者治疗HD药物中的应用,该碳纳米材料是一种继富勒烯、碳纳米管和石墨烯之后被发现的新的碳纳米材料,为尺寸小于10 nm、准球形的纳米粒子,具有良好的水溶性、生物相容性、荧光稳定性,并且物理化学性质稳定,易于实现表面功能化,可以抑制mHtt(突变亨廷顿蛋白,又称突变Htt)聚集或者清除以达到HD防治。
本发明采用如下技术方案:
本发明公开了碳基纳米材料在制备mHtt聚集抑制剂或者清除剂中的应用,或者碳基纳米材料在制备治疗或者缓解HD的药物中的应用。
本发明还公开了碳基纳米材料在抑制mHtt聚集或者清除mHtt中的应用。
本发明还公开了一种抑制mHtt聚集的方法,包括以下步骤,将碳基纳米材料水溶液与mHtt单体共孵育,实现mHtt聚集的抑制。
本发明所述碳基纳米材料,其制备方法包括以下步骤,以维生素或者类维生素为原料,经过加热反应,制备碳基纳米材料。mHtt为突变亨廷顿蛋白,又可称为突变Htt;HD为亨廷顿病。
上述技术方案中,将维生素溶液或者类维生素溶液于170 ℃~190 ℃反应1.5 h~2.5 h;然后自然冷却至室温,再过滤;然后将滤液透析后冷冻干燥,得到碳基纳米材料,称为CDs。
上述技术方案中,维生素溶液的浓度为0.1 g/mL;类维生素溶液的浓度为0.1 g/mL;维生素为维生素A、维生素E、维生素D3、维生素B1、维生素B2、维生素B6、维生素C、维生素K3、维生素B12等;类维生素为类维生素A、类维生素D3、类维生素E等。
上述技术方案中,将维生素溶液于180 ℃反应2 h,维生素发生聚合,生成水溶性碳纳米材料。
上述技术方案中,利用500~1000 Da的透析袋透析;透析在水中进行。滤液为碳基纳米材料水溶液,可以直接使用,用于抑制mHtt聚集或者清除mHtt;也可以冷冻干燥得到碳基纳米材料,之后复溶使用。
上述技术方案中,冷冻干燥为-80 ℃、真空度10 Pa的条件下冷冻干燥48 h。优选的,冷冻干燥为先于冰箱中-80 ℃冰冻2 h,然后于冷冻干燥机中-80 ℃、真空度10 Pa的条件下冷冻干燥48 h。
碳量子点的碳源包括石墨结构碳材料、多壁碳纳米管等碳基材料,然而,其昂贵的原料及所需的高能系统都限制了其生产应用;自然生物,例如柚子皮、橙汁等也可制备碳量子点,但这些物质成分复杂,含有较多的杂质,不利于分析,且由于自然生物的个体性差异大,使得技术效果难以重复。
本发明还公开了抑制mHtt聚集的药物、清除mHtt的药物或者治疗HD的药物,包括上述碳基纳米材料。治疗包括其通常被接受的含义,比如阻止、缓解、抑制、改善以及减缓、停止逆转所产生症状或预期病变的发展,本发明涵盖治疗性和缓解性。
本发明的药物还可以包括可药用的载体、可药用的稀释剂和可药用的赋形剂中的至少一种,药物形式可以是片剂、丸剂、散剂、锭剂、小药囊、扁囊剂、酏剂、悬浮剂、乳剂、溶液剂、糖浆剂、气溶胶、软膏、软和硬明胶胶囊、栓剂、无菌注射溶液或无菌包装粉针剂的制剂。本发明中将有效成分碳基纳米材料制备成药物或药物组合物,可采用本领域普通技术人员公知的方法来制备,使其在施用于受试者后速释、缓释或延迟释放有效成分,例如:有效成分可以与载体(生理盐水、缓冲液等)混合,用载体稀释或者包封在载体中;适宜作为载体、赋形剂和稀释剂的一些物质可以举例为乳糖、右旋糖、蔗糖、山梨醇、甘露醇、淀粉、树脂、阿拉伯胶、磷酸钙、海藻酸盐、西黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水糖浆、甲基纤维素、尼泊金甲酯和丙酯、滑石粉、硬脂酸镁和液状石蜡。本发明的药物还可以包括润滑剂、润湿剂、乳化和悬浮剂、防腐剂、甜味剂或矫味剂等助剂。
优选的,本发明的药物为液体,比如碳基纳米材料水溶液,进一步优选的,液体药物中,碳基纳米材料的浓度为0.01~1 mg/mL(图4中CDs水溶液浓度达到了70 mg/ml),优选0.025~0.5 mg/mL。水为注射用水。
抑制mHtt聚集或者清除mHtt是HD 治疗的关键,然而,HD是一个漫长的神经退行性疾病,现有报道的纳米材料/药物能否最终被用于临床不仅由它们缓解和治疗的效果所决定,还取决于它们的生物毒性效应和体内安全性,并且HD是一类中枢神经系统疾病,药物分子能否以无创的方式通过血脑屏障是前提条件。本发明公开的碳基纳米材料具有粒径小、比表面积大、表面功能化基团修饰、低毒和可降解等优点,并且可以通过血脑屏障,尤其是可透过细胞并能进入细胞核抑制mHtt聚集或者(部分)清除mHtt,是对HD缓解、治疗有效的碳基纳米材料。
附图说明
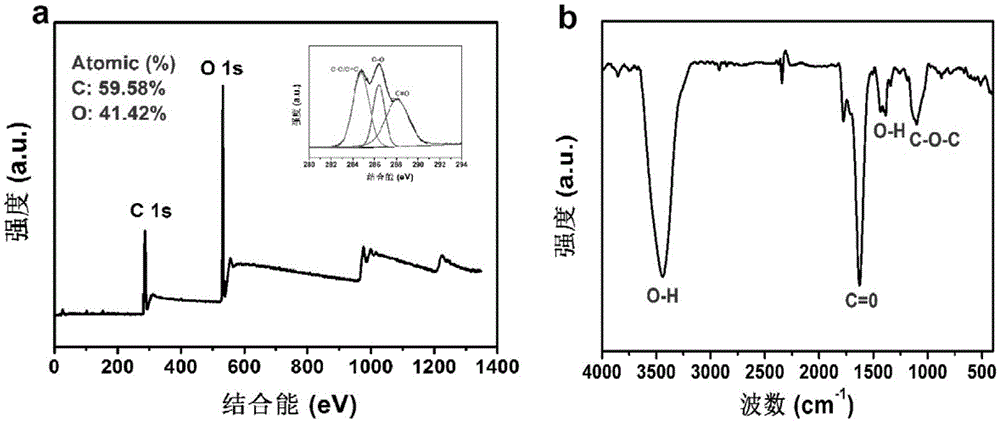
图1为CDs的结构特点(a)X射线光电子能谱分析,(b)CDs红外光谱;
图2为(a)CDs水溶液的紫外-可见吸收光谱,(b)CDs水溶液的光谱性质;
图3为CDs的形貌(a)透射电镜(TEM)进行形貌观察,(b)水合粒径分布图,(c)原子力显微镜检测高度;
图4为不同浓度的CDs水溶液照片;
图5为CDs入细胞核结果图,都是20μm比例尺;(a)正常培养的细胞电镜图,(b)与C2N共同孵育细胞的电镜图,(c)是(b)图细胞边缘外泌体的放大图,(d)与CDs共同孵育后405 nm共聚焦图,(e)Red dot1染细胞核图片,(f)细胞明场图片,(g)三个通道的合图;
图6为CDs抑制mHttQ120(简写为Q120)多肽聚集,(a) Th T荧光试验检测β片层的含量,(b)为点杂交实验检测纤维的生成量,(c)为TEM对聚集物(Q120、Q120+CDs)进行形态学观察;
图7为圆二色谱检测mHttQ120多肽聚集产物的二级结构;
图8为CDs提高mHttQ120转染的N2a细胞的存活率(a)乳酸脱氢酶实验,(b)台盼蓝染色,(c)活细胞/死细胞染色的统计,(d)活细胞/死细胞染色实验图(* P<0.05,**P<0.01);
图9为CCK8检测CDs对SH-SY5Y、PC12细胞系和原代神经元、原代星形胶质细胞的细胞毒性;
图10为CDs红细胞溶解实验,(a)为不同浓度CDs与红细胞共同孵育实拍图,(b)分别为共同孵育后酶标仪540 nm检测上清中血红素的释放率;
图11为CDs改善HD转基因小鼠寿命缩短、体重降低以及运动能力下降等情况,(a)各组小鼠的生存曲线;(b)为各组小鼠在14周时体重的比较;(c)为HD小鼠的转轴实验;(d)为HD小鼠的挂绳耐力测试(* P<0.05,**P<0.01);
图12为免疫荧光实验检测各组HD小鼠皮层、纹状体部位mHtt的聚集情况,其中红色的为mhtt蛋白抗体(MW8)的染色,蓝色为细胞核DAPI染色;
图13为实施例五CDs抑制mHttQ120多肽聚集效果图;
图14为对比例碳材料抑制mHttQ120多肽聚集效果图。
具体实施方式
神经病理学上,HD基因第一外显子中存在CGA三核苷酸重复序列,其编码产物为Htt N端的一段多聚谷氨酰胺片段(Poly-Q),突变的HD基因会编码产生具有超长(Poly-Q)结构的突变亨廷顿蛋白(mutanthuntingtin,mHtt)。正常人群中,HD基因中CAG的重复数少于35个。突变Htt错误折叠,以游离型和聚集型在细胞核和细胞质内广泛存在,产生细胞毒性,损害神经元的正常生理功能,导致HD神经病理学损害。mHtt 的错误折叠是 HD 神经病理学损害的物质基础。因此,抑制mHtt聚集或者清除mHtt是缓解及治疗HD的重要策略。本发明公开的碳基纳米材料具有粒径小、比表面积大、表面功能化基团修饰、低毒和可降解等优点,并且可以通过血脑屏障,尤其是可透过细胞并能进入细胞核抑制mHtt聚集或者清除mHtt,是对HD缓解、治疗有效的碳基纳米材料。
本发明的碳基纳米材料的制备方法如下:将维生素溶液或者类维生素溶液于170℃~190℃反应1.5h~2.5 h;然后自然冷却至室温,再过滤;然后将滤液透析后冷冻干燥,得到碳基纳米材料,称为CDs。
本发明的具体示例性实施方案的描述是为了说明和例证的目的。这些描述并非想将本发明限定为所公开的精确形式,并且很显然,根据本发明教导,可以进行很多改变和变化。对示例性实施例进行选择和描述的目的在于解释本发明的特定原理及其实际应用,从而使得本领域的技术人员能够实现并利用本发明的各种不同的示例性实施方案以及各种不同的选择和改变。本发明的范围意在由权利要求书及其等同形式所限定。
实施例一 碳基纳米材料(CDs)的制备
称取1.00 g 左旋维生素C(L-Vc)并将其溶于10 mL H2O中,超声20 min 使其充分溶解;将溶解好的Vc溶液转移到水热釜,于180 ℃反应2 h,反应结束后自然冷却至室温,接着利用沙星漏斗过滤反应液去掉不溶颗粒,然后利用500-1000 Da透析袋在水中纯化,最后得到棕红色的CDs溶液;将棕红色的CDs溶液于-80 ℃冰箱冰冻2 h,再用Alpha1-4LSCplus RC6冷冻干燥机于-80 ℃、真空度10 Pa的条件下冷冻干燥48 h,得到碳基纳米材料CDs。将获得的碳基纳米材料CDs溶于纯水中,获得碳基纳米材料CDs水溶液,用于实施例二至实施例四。
紫外光谱:取CDs水溶液稀释成一定浓度后转移至比色皿中,用紫外光谱仪测定紫外光谱。电镜样制备及拍照:提前用镊子夹取铜网置于吸水滤纸上,将5 µL CDs水溶液滴于铜网上,放阴凉处自然风干。样品干燥后用FEI Tecnai G20电子显微镜进行拍摄并选取图片,高倍图片用JEM-2010F 高透射电子显微镜进行拍摄。
CDs纳米材料的X射线光电子能谱分析:碳基纳米材料CDs粉末样品进行上机检测;红外光谱测定:将上述CDs冻干粉,取适量样品在红外光谱仪上进行上机检测。
通过傅立叶变换红外(FTIR)光谱和X射线光电子能谱(XPS)分析CDs化学结构及元素组成。从XPS全谱(图1a)中可以看出,该CDs主要含C和O,从C1s的高分辨XPS光谱图可以得出位于284.8、286.3和288.8 eV的三个峰分别归属于C−C,C−O和C=O。图1b是CDs的傅立叶变换红外(FTIR)光谱图,从图中可以看出该碳点含有−OH和−COOH等亲水的官能团,这些官能团使得该CDs具有良好的水溶性。
图2通过紫外-可见吸收光谱和荧光光谱来检测CDs的光学性质。图2a为CDs的紫外-可见吸收光谱图,CDs显示具有两个吸收峰。其中位于243 nm的吸收峰是由于CDs π-π*的跃迁,峰值位于293 nm的吸收是由于CDs n-π*的跃迁。从CDs水溶液的荧光光谱图(图2b)中可以看出CDs在372 nm光的激发下,其于461 nm显示出了最强发射峰。
TEM和高分辨率TEM(HRTEM)图像显示在图3 a中,CDs的平均水合粒径大约在4.5 nm(图3 b所示),AFM显示其高度大约在4 nm,如图3 c所示。
图4为CDs水溶液的照片,其中数字为浓度mg/mL,随着浓度增加,CDs水溶液呈现由浅黄到深棕色,图片中最高浓度达到70 mg/mL。
实施例二 CDs有效抑制mHtt聚集
透射电子显微镜 细胞样品:Neuro-2a(N2a)细胞与C2N材料在无血清的DMEM培养基共同孵育24小时后,使用戊二醛固定细胞10 分钟,刮下细胞后滴于铜网,并进行2%磷钨酸负染色,电子干燥箱过夜后于透射电子显微镜下拍照。蛋白样品:将mHtt单体(100μM)滴于铜网上静置2分钟,滤纸吸去多余的样品,生物样品使用超纯水洗2次,2% 磷钨酸对样品进行负染色2 min,滤纸吸去多余的磷钨酸,干燥过夜即可。
激光共聚焦检测CDs进入细胞核 CDs与N2a细胞共同孵育12 小时,吸去培养基,加入细胞核染料Red Dot1共同孵育10 分钟,然后在共聚焦显微镜下成像观察,CDs使用405 nm激发,Red Dot1 640 nm激发,并对图像进行合图。
CDs能够进入细胞核。很多材料不能进入细胞,或者是进入细胞后被细胞以“外泌体”的形式外排,N2a细胞与C2N材料(现有氮化石墨烯纳米材料)共同孵育后,细胞外壁出现很多外泌体(蓝色箭头),而从图5可以看到,本发明CDs不仅能“自由扩散”进入细胞胞质还能进入细胞核,与核染料Red dot 1共定位。与阿尔茨海默症相关毒性蛋白Aβ在细胞外的聚集方式不同,亨廷顿病相关的mHtt蛋白是在细胞胞质内涵体和细胞核内聚集的,因此,有些纳米材料能够抑制Aβ多肽的聚集以防治AD在HD却没有治疗效果。激光共聚焦实验结果显示,CDs能与N2a细胞的细胞质以及细胞核共定位,说明CDs能够进入细胞质/核,CDs的入核功能为CDs在细胞(核)内抑制mHtt蛋白聚集提供了前提条件。
CDs抑制mHttQ120多肽积聚:采用了Th T荧光实验检测CDs能否抑制mHttQ120的聚集,研究已证实mHttQn(n>35)能够聚集形成富含β片层的纤维,ThT是一种能特异性结合β片层并在特定激发/发射波长(450/485 nm)的染料,其荧光强度的大小反映多肽的聚集程度。将购买的mHtt Q120(上海楚肽生物科技有限公司)冻干粉使用三氟乙酸(TFA)15μg/100μL重悬,超声10分钟,在通风橱中挥发TFA后获得mHtt肽膜,以DMSO溶解肽膜,用PBS稀释成100μM,37 ℃ 300 rpm聚集即得到mHtt聚集体,为对照组。实验组为等浓度的mHtt与200 μg/mL CDs溶液共同孵育,其他条件与对照组一样处理。不同时间取样与20μM ThT混合,在酶标仪上以激发波长450 nm发射波长480 nm数据。每个样品重复三次。
从图6 a可以看出,mHttQ120多肽能在PBS(pH 7.4,37 ℃,300 rpm)中能自发聚集成富含β片层的成熟纤维,Th T的荧光强度随时间延长而增加。而与CDs共同孵育的mHttQ120蛋白聚集体产物中与对照组相比荧光值降低。与此同时,使用特异性识别纤维构象的Anti-Amyloid Fibrils抗体对2组样品进行点杂交实验(1b),进一步验证了CDs抑制mHttQ120多肽聚集形成纤维。另外,使用透射电子显微镜(TEM)观察与CDs共同孵育后的mHttQ120聚集体样品的形貌。如图6(c)所示,对照组(无CDs,0.01M PBS, pH7.4)mHttQ120多肽聚集成典型的纤维结构,而CDs组中的mHttQ120多肽无法形成典型纤维结构,视野范围内观察到的是长度更短、密集度更低,呈现分散状态聚集体。
采用圆二色谱仪检测蛋白质二级结构的变化:使用在J-815分光偏振计测量实验组(mHttQ120+CDs)与对照组(mHttQ120)中聚集体蛋白质二级结构。扫描波长为200 nm-260 nm,谱宽2 nm,扫描速度50 nm/min,响应时间1 s,测定温度为常温,扣除等浓度材料信号背景。每个样品测6次取平均值,最后对曲线进行拟合。图7显示mHttQ120多肽溶液在PBS聚集48小时的CD谱呈现典型的β-片层结构(黑色实线,在220 nm处有一负峰,在200-210 nm处有一强的正峰)。当mHttQ120单体与CDs(200 μg/mL)共同孵育后,β片层典型的峰型消失,取而代之的是一种无规则卷曲的典型峰型。
实施例三 CDs有效减缓mHtt神经元细胞引起的细胞毒性
瞬时转染表达mHtt的N2a细胞模型:HttExon1Q20/120(简写Q20/120)质粒由本实验室保存。10%FBS DMEM培养基培养N2a细胞,转染前一天,以3-4×105/孔密度将细胞种于96孔板中,待细胞融合度长到85%的时候,按照Lipofectamine2000TM试剂盒推荐剂量和步骤进行转染,取无菌1.5ml EP管两支,各加入100 μl Opti-MEM,用来稀释质粒DNA和脂质体,二者的比例为1 μg: 2 μL,混匀后室温孵育5 min;将孵育好的脂质体和质粒混匀,室温静置继续孵育20 min;从培养箱取出接种好的细胞,弃去完全培养基,每孔加入1 ml Opti-MEM;将孵育好的脂质体-质粒混合物按比例加入各孔,做好各孔标记,6孔板紧贴桌面缓慢摇晃使充分混匀;37 ℃,5% CO2培养箱中培养,4-6 h后换成完全培养基,培养48 h后用于后续实验。细胞分为mHtt20组(WT,无毒性polyQ),mHtt120(毒性polyQ),以及各个浓度CDs组。
乳酸脱氢酶(LDH)检测 按照LDH试剂盒说明书操作,用不同浓度的CDs处理N2a-mHtt(Q120)48 小时(每组3个复孔) ,阳性对照组添加2 % Triton,阴性对照组为N2a-Htt(Q20);收集培液,4 ℃、500 g×5 min离心;取100μL 上清液至一新的96孔板(空白对照孔中加入 100 μL正常培液),加入100 μL底物混和物,充分混匀,室温避光孵育 30分钟;加入终止液,酶标仪记录 490nm 吸光度值。LDH释放率(%)=(各组吸光值-无细胞孔吸光度)/(阳性对照组吸光度-无细胞孔吸光度),将阳性对照组的存活率设为100%。
台盼蓝染色,台盼蓝染液是细胞活性染料,常用于检测细胞膜的完整性。细胞损伤或死亡时,台盼蓝可穿透变性的细胞膜,与解体的DNA结合使其着色。而活细胞能阻止染料进入细胞内,故可以检测细胞是否存活。CDs(200 μg/ml)处理N2a-mHttQ120 48小时后,使用台盼蓝染液进行细胞染色后通过显微镜下直接计数。细胞活率(%)=未染色的细胞数/观察的细胞总数×100。
活细胞/死细胞(LIVE/DEAD)染色:LIVE/DEAD试剂盒是一种快速、简便区分死细胞和活细胞的方法:利用能穿过细胞的绿色荧光染料Live-Dye染料对活细胞染色(Ex/Em = 488/518 nm),不能透过细胞膜的红色荧光染料碘化吡啶(PI)染色死细胞(Ex/Em = 488/615),直接在荧光显微镜下观察细胞死亡情况。LIVE/DEAD实验按照试剂盒说明书操作,细胞加入混合好的LIVE/DEAD试剂后在37 ℃ CO2培养箱孵育15 min,转至在荧光显微镜下进行活细胞与死细胞的计数,其中绿色代表活细胞,红色代表死细胞,细胞死亡率%=死细胞/(活细胞+死细胞)。
因为高水平mHttQ120的存在会使细胞产生获得性毒性,检测了CDs对mHttQ20/120细胞毒性的改变。瞬时转染了表达mHttQ120质粒的Neuro2a小鼠神经细胞系(N2a),对照组为HttQ20。首先,使用CDs处理N2a-mHttQ20/120细胞48小时,检测各组细胞培养基中的乳酸脱氢酶释放率,结果参见图8,实验结果显示CDs抑制N2a-mHttQ120细胞的乳酸脱氢酶的释放具有浓度依赖性,当CDs浓度达到200 μg/mL时,乳酸脱氢酶的释放率降低了2.5倍。同时对CDs(200μg/mL)处理N2a-mHttQ20/120细胞48小时进行台盼蓝染色,结果显示CDs能够提高N2a-mHttQ120细胞的细胞存活率,细胞存活率由40%提高到了90%。对各组细胞进行了活细胞/死细胞的染色,mHttQ120细胞可见大量红色荧光亮点,大量死细胞的存在说明过表达mHttQ120蛋白聚集确实具有细胞毒性,而与CDs混合培养的N2a-mHttQ120细胞的细胞毒性明显减少,说明CDs抑制了mHttQ120聚集,从而减弱mHttQ120聚集对细胞毒性作用。
生物相容性是指材料与宿主之间的相容性。它是纳米药物研究中始终贯穿的主题,评价纳米药物/材料的生物相容性要遵循生物安全性和生物功能性两个原则,而生物安全性的最主要指标是无毒性。图9为不同浓度的CDs与SH-SY5Y、PC12细胞、原代神经元(Neuron)、原代星形胶质细胞共孵育24小时后的细胞存活率,由图可以看出,当CDs浓度在400 μg/mL的浓度范围的时候,各组细胞存活率在95%以上,对照组比较没有显著差异,表明400 μg/mL浓度以内的CDs对细胞没有毒性。使用红细胞溶血实验检测不同浓度CDs对红细胞的破坏情况,如图10所示,CDs对红细胞的毒性极小,浓度400 μg/mL时溶血率仅为6.8%。
实施例四 动物实验
实验动物 本实验所用 R6/2(B6CBA-Tg(HDexon1)62Gpb/1J)HD 转基因模型小鼠购买自美国 The Jackson Labortary 公司,于SPF 级动物房饲养并繁殖,24 h昼夜轮换,室温20-22 ℃;小鼠自由获取食物和饮水,实验操作遵循实验动物伦理守则;R6/2转基因小鼠转入人 HD 基因的第一外显子,含有氨基末端的171个氨基酸,表达的 Htt 氨基末端片段中含有 150 个谷氨酰胺重复序列;HD动物基因型鉴定PCR引物购于上海生工生物工程有限公司,引物名称为:oIMR1239、oMR1240、β-actinF、β-actinR。
动物分组及给药方式 小鼠被分为四组:野生型(WT)腹腔注射生理盐水(WT+生理盐水)和CDs(1 mg/kg)(WT+CDs),HD转基因小鼠腹腔注射生理盐水(HD+生理盐水)和(HD+CDs)。动物从5周龄开始接受腹腔注射CDs或CDs,每天评估小鼠的死亡率。
动物行为学分析 通过在5,8和15周龄时使用加速旋转棒(Stoelting,Ugo Basile,Biological Research apparatus; Varese,Italy)评估运动性能。在每周开始时,将小鼠(n = 15)以4.5 rpm的慢速训练30秒。随后,连续三天进行了三次试验。在每次试验中,将小鼠以4.5 rpm的恒定速度放置在旋转棒上5秒,然后以恒定速率加速直至达到45 rpm的终端角速度。记录每只小鼠从旋转棒落下的潜伏期,并使用三次试验的平均值进行统计分析。在9.5和16周龄时测试了线挂耐久性。为此在该实验中,小鼠置于水平金属丝网上,然后轻轻倒置。记录每只小鼠留在线上的时间。连续三天对每只小鼠进行三次试验,并将平均值用于统计分析。使用SAS版本8.2软件中的混合程序分析数据。结果在P <0.05时被认为具有统计学差异的。
CDs改善HD转基因小鼠寿命缩短、体重下降、运动功能下降等情况:为了明确CDs能在动物水平上抑制mHtt聚集导致的亨廷顿病症,观察CDs对HD转基因小鼠(R6/2)的生存率、体重和运动功能影响。从小鼠第5 W起进行CDs腹腔注射至小鼠自然死亡,记录小鼠最终自然死亡时间并用Kaplan-Meier法进行生存率统计学分析,参见图11,结果最示,生理盐水组的HD小鼠寿命为119.7±7.255 d,CDs腹腔注射的的HD小鼠寿命为140.54±14.45 d,即CDs处理能明显延长HG转基因小鼠的寿命;WT小鼠中,CDs处理并未产生平均寿命的显著差异(图11a)。对14 W各组小鼠的体重比较显示,腹腔注射生理盐水小鼠和CDs的WT小鼠体重分别为24.56±2.3 g和26.37±2.9 g;腹腔注射生理盐水的HD小鼠体重为17.32±0.6 g,而腹腔注射CDs的HD小鼠体重为22.19±1.6 g,表明CDs可明显抑制HD小鼠体重的减轻(图11b),WT组生理盐水和CDs各组小鼠在生存率、体重测试上都没有出现显著差异。为了检测HD小鼠的运动平衡能力以及抓握力量,对HD小鼠(生理盐水组和CDs给药组)进行了转轴试验(转棒实验)。结果显示,CDs处理能使HD小鼠在转棒仪上的停留时间从生理盐水组56.64±2.3 s延长到124.26±6.7 s(图11c)。与运动性能的改善一致,观察到在9.5和16周龄时CDs给药小鼠的线挂耐久性显着改善。上述结果说明CDs能明显改善HD小鼠行为学特征,对HD小鼠有良好的质量效果。
CDs降低HD转基因小鼠(R6/2)脑内mHtt的沉积:为了明确CDs是否减少HD转基因小鼠中的mHtt和mHtt聚集,采免疫组织荧光方法观察各组HD转基因小鼠脑组织中mHtt蛋白的聚集情况,参见图12。实验结果显示,CDs处理能明显降低HD小鼠脑内mHtt的免疫反应性,表现为神经元细胞核内和内涵体的mHtt(MW8抗体)阳性染色减少;因此,CDs具有能在在动物水平上有效抑制mHtt的聚集的作用。
实施例五
称取1.00 g 左旋维生素C(L-Vc)并将其溶于10 mL H2O中,超声20 min 使其充分溶解;将溶解好的Vc溶液转移到水热釜,于180 ℃反应2 h,反应结束后自然冷却至室温,接着利用沙星漏斗过滤反应液去掉不溶颗粒,然后利用500-1000 Da透析袋在水中纯化,最后得到棕红色的CDs溶液;将棕红色的CDs溶液于-18℃冰箱冰冻2 h,再用Alpha1-4LSCplus RC6冷冻干燥机于-80℃、真空度10Pa的条件下冷冻干燥48h,得到碳基纳米材料CDs。将获得的碳基纳米材料CDs加入纯水中,获得碳基纳米材料CDs水溶液。参考前文的测试方法,检测了上述CDs抑制抑制mHtt聚集的效果,发现冷冻工艺对碳基纳米材料的效果产生影响,说明不同程度冷冻干燥对碳基纳米材料的形成、性能有影响,参考实施例三的方法,对本实施例CDs(200μg/mL)处理N2a-mHttQ20/120细胞48小时进行台盼蓝染色,结果显示CDs能够提高N2a-mHttQ120细胞的细胞存活率,细胞存活率81%,稍低于实施例一的CDs;图13为本实施例CDs抑制mHttQ120聚集的透射电子显微镜(TEM)结果,看出稍逊于实施例一的CDs。
对比例一
将实施例一的左旋维生素C更换为柠檬酸,同样的方法,也可以制备出水溶性碳材料,最大溶解度为65mg/mL,粒径为7.5nm左右,参考实施例三的方法,对该对比例碳材料(200μg/mL)处理N2a-mHttQ20/120细胞48小时进行台盼蓝染色,结果显示其能够提高N2a-mHttQ120细胞的细胞存活率,细胞存活率48%,低于本发明的CDs,图14为该碳材料抑制mHttQ120聚集的透射电子显微镜(TEM)结果,看出远差于实施例一的CDs,对mHttQ120聚集几乎没有抑制效果。
综上,纳米粒子表面的电荷、配体能、多肽结合的能力都是影响mHtt聚集的关键因素。例如,溶解酵素淀粉样蛋白形成的聚集体可被谷胱甘肽(GSH)所修饰的纳米金破坏,而单独的GSH并没有这种作用;现有碳纳米材料存在水溶性差的缺点,阻碍了它们在生物医学和纳米医学中的应用。本发明研发了具有低成本、尺寸极小、水溶性好,生物相容性高、可降解,效果好等优势的碳基纳米材料(CDs),应用到抗HD的药物制备,发现CDs可以抑制mHtt的聚集,细胞实验和动物实验发现,CDs能够缓解mHtt聚体对神经元的毒性并降低对突触的损害,能够改善HD模型小鼠的运动能力。
- 还没有人留言评论。精彩留言会获得点赞!