一种生物活性多孔陶瓷管状棒材、制备方法及其应用与流程
本发明涉及医用生物材料,特别是涉及一种生物活性多孔陶瓷管状棒材、制备方法及其应用。
技术背景
股骨头缺血性坏死(简称股骨头坏死)是一种以股骨头血供中断或受损而引起骨质细胞及骨髓成分死亡为特点的骨关节疾病,最终导致股骨头结构改变、塌陷和关节病废。股骨头坏死病因复杂,治疗困难,一直以来是骨科的难题;其致残率高,又主要累及30岁~50岁的青壮年人群,给患者本人以及社会带来沉重的负担。
由于股骨头坏死病程进展迅速,发现不及时或治疗措施不当,远期致残率极高,多在发病1~4年内进展为股骨头塌陷,迄今还缺乏逆转股骨头坏死病程的有效治疗方法。临床上多数根据Ficat分期运用不同的施治策略。尽管髋关节置换术已经成功用于Ficat IV期患者,但目前人们在更多地关注对股骨头坏死早中期(I~III期)患者的保髋治疗。常规的保髋手术如髓芯减压术、骨移植术、截骨术等已被证实成功率不高,多数患者在术后3~5年内就出现股骨头塌陷。本质上,早中期股骨头坏死治疗修复的效率、效果是否显著改善,取决于血供的恢复和血液循环能否长期维持,并且在血供恢复期能否较快诱导新骨再生,维持股骨头外形和生物力学,从而持续维系患髋功能。因此,功能性植入物的设计不仅需要有利于促进纤维毛细血管再生、渗入的刺激效应,还必须具备促进骨化的生物活性以及健康股骨头的生物力学性能;尤其是植入物的的组成、微结构所示特异性生物学讯号必须与快速血管化和新生骨重建密切契合,从而避免副反应的发生。众所周知,毛细血管的再生和三维网络内骨微观结构重塑,还必须具有贯通性孔道微结构;反之,若血管化不能长期有效维持,将导致病灶复发,加重坏死。
病理性骨损伤修复需要更加重视从材料-宿主的相互作用、细胞信号传导等层次展开,实现在宿主细胞和组织上接受人工材料表面提供的“特异性生物讯号”并准确、快速应答,加速重建微血管网络。其次,还必须重视股骨头坏死区血供长久维持以及不同节段生物力学功能特定需求也是不可忽视的问题。处理早中期股骨头坏死通常利用多孔性钽棒进行髓芯减压、传到新生骨质和血管长入,但是这种多孔金属材料由于缺乏生物活性,通常只能延缓股骨头塌陷, 推迟髋关节置换时间,难以恢复正常的股骨头应力分布,并增加粗隆下骨折风险。近来本领域推出的β-磷酸三钙多孔陶瓷棒材,虽然比钽棒具有更好的骨传导性,但是其抗弯强度不理想,生物活性效应也不高,同时降解过程势必危及长期力学稳定性需求。同时,棒材内部结构精细微结构构造设计困难,因而对长期有效缓解股骨头坏死功效难以保障。
钙-硅基生物玻璃和玻璃陶瓷被证明具有优良的生物活性和骨传导性,某些钙-硅基材料接触体液仅几分钟即发生生物活性反应;同时硅是人体生长代谢必需的微量元素,与生物体粘多糖的合成密切相关,并在幼骨矿化区聚集。钙-硅基材料已经被广泛证明在促进MSCs分化方面显示出优良的效果(Bsetti M等.Biomaterials.2005,26:3873–3880)。其次,硅诱导多种细胞因子释放,调节细胞内信号转导,通过促进内皮细胞和成纤维细胞的增殖,调控新生血管过程。此外,一些微量元素如铜、锌、硼等在促进血管化和新骨再生、重建方面发挥了独特生物学效应,同时这类微量元素能方便地掺杂于钙-硅基生物活性玻璃和陶瓷,势必能拓展生物医用领域的应用。
含镁的钙硅酸盐是一类典型的钙-硅基物质,根据其稳定性和形成条件的不同会形成如白硅钙石(Ca7Mg(SiO4)4)、镁硅钙石(Ca3Mg(SiO4)2)、镁黄长石(Ca2MgSi2O7)、镁钙橄榄石(CaMgSiO4)和透辉石(CaMgSi2O6)等多种化合物。Nonami报道透辉石陶瓷的抗弯强度、断裂韧性可达300MPa和3.5MPam1/2;该陶瓷尽管比磷灰石陶瓷稳定性还高,但是能较快诱导类骨磷灰石矿物沉积,并与骨组织形成骨性键合(Nonami T等.J Mater Sci Mater Med.1999,10:475–479)。透辉石还在促进成骨细胞增殖、新骨再生或者高效载药并缓释等优良效应。最近几年来人们发现镁钙橄榄石也具有优良生物活性,但是降解极为缓慢。与透辉石等相比,白硅钙石、镁黄长石因其较快降解释放钙、镁、硅离子的能力,其无机离子组合物对BMSCs具有刺激成骨效应,并促进内皮细胞增殖、促进多种血管化因子高表达(Wu C等.Acta Biomater.2010;6:2237–2245);相关研究还证明透辉石比白硅钙石、镁黄长石具有更高的稳定性,降解极为缓慢(Wu C等J Biomed Mater Part B:Appl Biomater.2007;83B:153–160)。
技术实现要素:
为了克服
背景技术:
中多孔棒材存在的问题,通过研究可发现从股骨头坏死持久生物力学支撑的特定需求看,透辉石、镁钙橄榄石的稳定性和良好生物活性是继钽棒、β-磷酸三钙陶瓷后的新一代股骨头坏死植入棒材的更好选择。因此本发明的目的在于提供一种生物活性多孔陶瓷管状棒材、制备方法及其应用,用可降解钙镁硅酸盐修饰生物稳定性高的钙镁硅酸盐生物活性多孔陶瓷管状棒 材,有效解决股骨头坏死髓芯减压、长期性营养传输、稳定血供和高效骨再生等多种功能的协同。
本发明采用的技术方案是:
一、一种生物活性陶瓷管状棒材:
包括不可生物降解的钙镁硅酸盐多孔陶瓷管,多孔陶瓷管呈圆柱形、圆台形或棱台形,相邻孔道相互贯通;
包括覆盖在钙镁硅酸盐多孔陶瓷管孔道壁的可降解的钙镁硅酸盐修饰层,钙镁硅酸盐修饰层是由钙镁硅酸盐修饰改性并烧结处理后覆盖在多孔陶瓷管的孔道壁上。
钙镁硅酸盐多孔陶瓷管的生物降解性极为缓慢,钙镁硅酸盐修饰层生物降解性良好。
所述管状棒材沿轴心线设有贯通的中空管道。
所述管状棒材的外径为6~40mm,管状棒材的中空管道直径与棒材外径之比为1:(4~16)。
所述管状棒材的管壁内孔道尺度为60~800μm,孔隙率为20~80%,孔道壁上钙镁硅酸盐修饰层厚度为20nm~600μm。
所述管状棒材内孔道形态为圆形、三角形、四边形、蜂窝形、多边形或者阿基米德螺旋弧形。
所述的钙镁硅酸盐多孔陶瓷管是透辉石、镁钙橄榄石中的一种或二者的任意比例组合。
所述的钙镁硅酸盐修饰层是镁黄长石、白硅钙石、镁掺杂硅灰石中的一种或几者的任意比例组合;镁掺杂硅灰石中镁代替钙的摩尔百分数为4-15%。
所述的镁黄长石、白硅钙石、镁掺杂硅灰石中还掺杂有微量元素,微量元素为铜、锌和硼中的一种或几者的任意比例组合;微量元素的总掺杂量为其中原有Ca元素含量的15%以下。
所述钙镁硅酸盐多孔陶瓷管采用增材制造方法、多孔泡沫模板或者微球颗粒堆砌模板制备方法构建制成。
所述的增材制造方法为三维打印、陶瓷糊状物书写打印、激光打印烧结法中的一种方法。
二、一种生物活性陶瓷管状棒材的制备方法,包括以下步骤:
1)将将正硅酸乙酯、硝酸依次溶解于去离子水中,再加入钙盐、镁盐,然后再加入微量元素无机盐或酸,然后常温下搅拌水解15~60分钟,再经陈化2~24小时后转化为水凝胶;
2)将钙镁硅酸盐多孔陶瓷管置入水凝胶中,浸渍、抽吸后取出,再真空抽滤吸出孔道内多余的凝胶,继续陈化、干燥后,在800~1200℃下煅烧1~6小时,再自然冷却后,得到最终的生物活性多孔陶瓷管状棒材。
所述步骤1)中镁、钙、正硅酸乙酯的摩尔比为100:(200~2500):(100~2500),正硅酸乙酯与硝酸的摩尔比为100:(4~30)。
所述的微量元素无机盐或酸的加入量为溶液中钙含量的15%以下。
所述的钙盐是硝酸钙或乙酸钙,所述的镁盐是硝酸镁或乙酸镁,所述的微量元素无机盐或酸是硝酸铜、硝酸锌、硼酸中的一种或任意几者的组合。
所述的钙镁硅酸盐多孔陶瓷管是透辉石、镁钙橄榄石中的一种或二者的任意比例组合。
所述的钙镁硅酸盐修饰层是镁黄长石、白硅钙石、镁掺杂硅灰石中的一种或几者的任意比例组合;镁掺杂硅灰石中镁代替钙的摩尔百分数为4-15%。
所述的镁黄长石、白硅钙石、镁掺杂硅灰石中还掺杂有微量元素,微量元素为铜、锌和硼中的一种或几者的任意比例组合;微量元素的总掺杂量为其中原有Ca元素含量的15%以下。
所述钙镁硅酸盐多孔陶瓷管采用增材制造方法、多孔泡沫模板或者微球颗粒堆砌模板制备方法构建制成。
所述的增材制造方法为三维打印、陶瓷糊状物书写打印、激光烧结打印法中的一种方法。
所述钙镁硅酸盐多孔陶瓷管采用以下方法制备而成:将不可生物降解的钙镁硅酸盐粉体使用湿法球磨处理1~10小时后获得颗粒度不超过60μm的超细粉体,将超细粉体分散到有机粘结剂水溶液中,充分搅拌形成混匀糊状物,将糊状物置入储液池中,启动设备,按预设孔道形态和陶瓷多孔材料的球形外观形态构建出多孔材料并烧结处理,得到钙镁硅酸盐多孔陶瓷管。
优选的超细粉体与有机粘结剂水溶液的固液质量比为1:(0.5~2)。
所述的有机粘结剂可采用聚乙烯醇。
三、一种生物活性陶瓷管状棒材的应用:
本发明所述管状棒材应用于骨再生重建,具体优选地可应用为股骨头坏死髓芯减压、大段骨缺损修复领域。
本发明是以生物降解极为缓慢的钙镁硅酸盐陶瓷为基质、再经生物降解性良好的钙镁硅酸盐修饰改性而成。
本发明所说的生物活性陶瓷管状棒材,棒材各区域直径没有严格限制,可以是等外径、外径逐渐增加(即呈圆台形、棱台形)等形式,以有利于方便植 入和各部位力学特定需求。
本发明所说的生物活性陶瓷管状棒材,管壁内孔道尺度和孔隙率沿轴向没有严格限制,靠近坏死区端部孔道尺度和孔隙率提高可以加快坏死区血供和新骨再生和改建。
本发明所说的生物活性陶瓷管状棒材,孔道内修饰层的组成没有严格限制,修饰层中还可以掺杂微量元素铜、锌、硼中的一种或任意组合;
本发明所说的生物活性陶瓷管状棒材,孔道内修饰层制备工艺没有严格限制,可以直接将可降解钙镁硅酸盐的超细粉体用聚乙烯醇溶液调和成浆料,将多孔陶瓷管放入浆料中,再经抽吸灌注、静置干燥和煅烧处理,得到可降解钙镁硅酸盐修饰不可降解钙镁硅酸盐生物活性陶瓷管状棒材。
本发明所说的生物活性陶瓷管状棒材,为改善棒材力学性能和生物学效应的添加物没有严格限制,可在孔道修饰层表面再增加异性荷电生物分子水凝胶,进一步改善棒材的抗弯强度;也可向棒材孔道内灌注成骨相关细胞或有利于血管化的生长因子,从而增进股骨头坏死区骨重建效率。
本发明所说的生物活性陶瓷管状棒材,多孔管状棒材的制备技术没有严格限制,还可以是利用多孔泡沫模板或微球颗粒堆砌模板等制备方法。
本发明所说的生物活性陶瓷管状棒材,对应用范围不存在严格限制,在股骨头坏死、大段骨缺损部位领域均可以用于骨再生重建。
本发明具有的有益效果体现在:
1)在组成上,经高温煅烧处理的降解极为缓慢的钙镁硅酸盐多孔陶瓷管状棒材为主体,有利于棒材在股骨头坏死区内为长期稳定血供提供贯通管道和力学支撑,以生物降解性良好的钙镁硅酸盐为陶瓷管状棒材孔道的修饰物,具有优异的生物活性和促进血管化特性。
2)在微结构上,以增材制造工艺制备的生物活性多孔陶瓷管状棒材,沿轴心线的较大尺度的中空管道有利于维持长期血供、营养传输的通道;管壁内的孔隙率、孔尺度都可以广泛调节,并且相邻孔道完全贯通,非常有利于细胞迁移和成骨。
3)在生物学效应上,以具有显著促进血管化和骨再生的可降解性钙镁硅酸盐修饰极降解极为缓慢的钙镁硅酸盐管状棒材的孔道,有利于在高效血管化、骨再生以及维持棒材长期稳定性上的统一,因而符合理想股骨头坏死髓芯减压和新骨重建的最佳生物学效应需求。
4)在可操作性上,增材制造成型制备管状多孔棒材,任意局部孔道尺度、孔隙率、棒材内外径尺度控制上达到理想需求,凝胶态浸渍修饰改性对多孔管 状棒材表面修饰,降低尖锐棱角对组织的慢性炎症反应;同时在二次煅烧完成后可直接无菌包装,减少管状棒材的孔道内部灭菌处理等复杂问题。
附图说明
图1是本发明的生物活性多孔陶瓷管状棒材示意图。
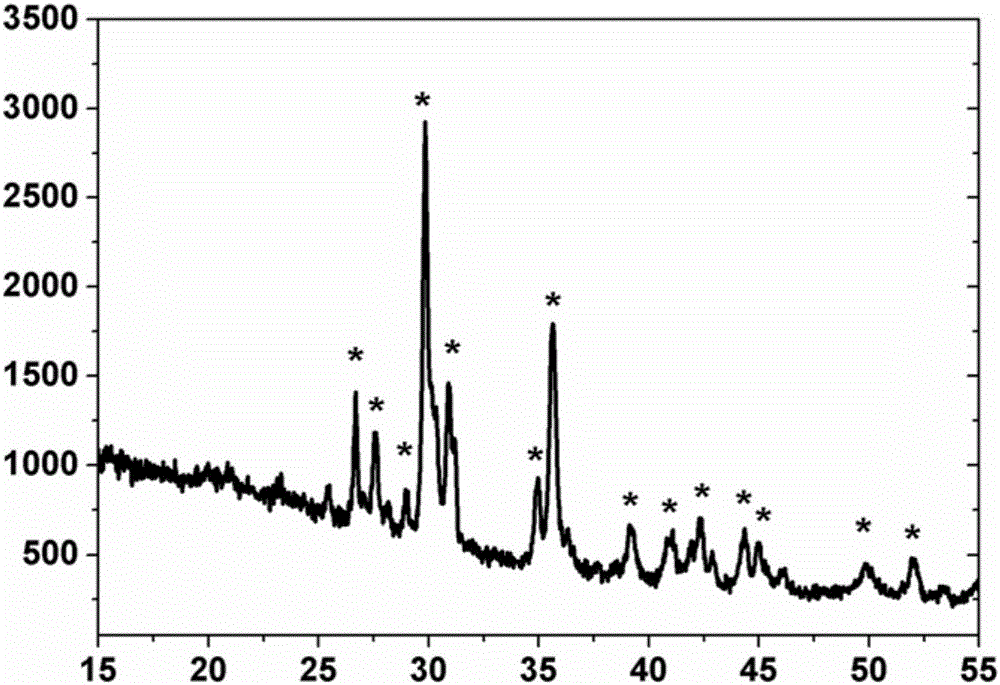
图2是本发明的透辉石多孔陶瓷棒材XRD图谱。
图3是扫描电镜拍摄的本发明管状棒材断面显微形貌图。
图4是本发明的经可降解钙镁硅酸盐修饰改性后多孔陶瓷管状棒材的XRD图谱。
图5是扫描电镜拍摄的本发明管状棒材表面显微形貌图。
图6是钙镁硅酸盐多孔陶瓷管状棒材修饰前后与β-磷酸三钙管状棒材放入静脉内皮细胞共培养过程细胞增殖率变化图(纵坐标表示细胞数量,横坐标表示天数),其中,(a)表示透辉石陶瓷管修饰前管状棒材,(b)表示透辉石陶瓷管修饰掺铜修饰后管状棒材,(c)表示纯β-磷酸三钙管状棒材。
图7是钙镁硅酸盐多孔陶瓷管状棒材经镁掺杂硅灰石修饰前、后与β-磷酸三钙管状棒材放入人骨髓间充之干细胞共培养过程细胞增殖率变化图(纵坐标表示细胞数量,横坐标表示天数),其中,(a)表示透辉石陶瓷管修饰前管状棒材,(b)表示透辉石陶瓷管经镁掺杂硅灰石修饰后管状棒材,(c)表示纯β-磷酸三钙管状棒材。
具体实施方式
下面结合附图和实施例对做本发明进一步说明。以下具体实施例用来解释说明本发明,但不应理解为对本发明的限制,在本发明的精神和权利要求的保护范围内,对本发明作出的任何修改和改变,都落入本发明的保护范围。所有实施例使用试剂不低于分析纯标准。
实施例1:
1)将透辉石粉体放入球磨机中球磨6小时后筛分,获得粒度小于60μm的超细粉体,再将该超细粉体按固液质量比为1:2搅拌分散到浓度为6%的聚乙烯醇水溶液中,形成两相均一的糊状物,再将糊状物浆料置入写入式三维打印机注射储液池中,设定蜂窝形孔道形态(如附图1)、中心孔通道直径为2.6mm,棒材直径为42mm,并按棒材长度的50%、30%和20%分别设置其孔隙率为24%、50%和84%,启动打印设备,按进行三维打印,形成外径和内径分别为42mm和2.6mm的管状多孔棒材,再将该管状多孔棒材在60℃下干燥12小时,在1300℃下烧结4小时,从而得到透辉石多孔陶瓷管。经检测,烧结后的透辉石 多孔陶瓷管形成外径和内径分别为40mm和2.5mm,孔道直径沿轴向在160~800μm范围内,棒材XRD分析图谱见附图2,棒材断面微结构见附图3。
2)将0.40mol正硅酸乙酯溶解于1200ml去离子水中,再加入4ml硝酸后搅拌60分钟,再依次加入0.8mol硝酸钙和0.4mol硝酸镁,常温下搅拌水解45分钟,陈化2小时,混合溶液转化为水凝胶,将步骤1)制备的多孔陶瓷管放置入该水凝胶中,负压抽吸浸渍,然后取出管状棒材,再用真空抽滤孔道内多余凝胶,继续陈化48h、90℃干燥24h后,在1200℃煅烧6小时,自然冷却。经检测,透辉石多孔管状棒材孔道壁表面层积厚度为60μm的镁黄长石(Ca2MgSi2O7)层,最小孔隙率为22%,最大孔隙率为80%,棒材XRD分析图谱如附图4。比较附图2和附图4表明,经修饰处理前后棒材表面物质发生变化,透辉石表面被镁黄长石修饰覆盖。
将实施例1所得镁黄长石修饰透辉石多孔管状棒材和按实施例1方法制备的β-磷酸三钙棒材分别放入20ml细胞培养液a-MEM中,37℃条件下持续浸泡,用ICP检测0~168小时内硅、镁、钙和磷的放情况测定结果显示,在a-MEM中,实施例1的钙镁硅酸盐多孔陶瓷管状棒材中硅浓度持续增长,但是β-磷酸三钙管状棒材的浸泡液中钙、磷的浓度随着时间缓慢上升,表明β-磷酸三钙管状棒材溶出少。
将实施例1中镁黄长石修饰前、后多孔管状棒材和β-磷酸三钙多孔棒材分别放入体外标准条件化无菌培养的人静脉内皮细胞培养瓶中共培养。经检测,培养2、4、6、8天后投入镁黄长石修饰后陶瓷培养瓶中细胞活性存在显著差异,增殖率分别比β-磷酸三钙组高25~45%,比镁黄长石修饰前陶瓷透辉石多孔陶瓷组细胞增殖率高8~20%(图6)。该检测结果表明经可降解镁黄长石修饰改性透辉石的陶瓷管状棒材具有优良的促进血管化密切相关细胞活性功效。
实施例2:
制备方法同实施例1,区别在于:将步骤1)中将超细粉体按固液质量比为1:1搅拌分散到浓度为3%的聚乙烯醇水溶液中,按棒材长度的55%、30%和15%分别设置其孔隙率为21%、55%和81%,启动打印设备,按进行三维打印,形成外径和内径分别为42mm和11.2mm的管状多孔棒材,烧结后得到外径和内径分别为40mm和10mm的透辉石多孔陶瓷管;将步骤2)中制备钙镁硅酸盐修饰层的原料组成调整为:将0.1mol正硅酸乙酯溶解于1000ml去离子水中,再加入1ml硝酸后搅拌15分钟,再加入0.7mol硝酸钙和0.1mol硝酸镁,常温下搅拌水解15分钟,陈化4小时,混合溶液转化为水凝胶,将步骤1)制备的透辉石多孔陶瓷管放置入该凝胶中,浸渍、负压抽吸,取出管状棒材,再用真空抽 滤吸出孔道内多余凝胶,继续陈化36h、95℃干燥24h后,在1100℃煅烧1小时,自然冷却。经检测,最小孔隙率为20%,最大孔隙率为80%,透辉石多孔陶瓷管状棒材孔道壁表面层积厚度为20nm的白硅钙石(Ca7Mg(SiO4)4)层。
实施例3:
制备方法同实施例1,区别在于:将步骤1)中按棒材长度的65%、20%和15%分别设置其孔隙率为35%、50%和65%,将步骤2)中制备钙镁硅酸盐修饰层的原料组成调整为:将0.40mol正硅酸乙酯溶解于90ml去离子水中,再加入2ml硝酸后搅拌15分钟,再加入0.4mol硝酸钙和0.016mol硝酸镁,常温下搅拌水解60分钟,陈化24小时,混合溶液转化为水凝胶,将步骤1)制备的透辉石多孔陶瓷管放置入该凝胶中,负压抽吸浸渍,取出多孔陶瓷管状棒材,再用真空抽滤吸出孔道内多余凝胶,继续陈化36h、95℃干燥36h后,在950℃煅烧2小时,自然冷却。经检测,最小孔隙率为33%,最大孔隙率为62%,透辉石多孔陶瓷管状棒材孔道壁表面层积厚度为600μm的镁掺杂硅灰石(Ca0.96Mg0.04SiO4)层,经XRD分析修饰后陶瓷棒材表面为硅灰石与透辉石的复合物,经ICP定量分析,修饰层硅灰石中镁代替了纯硅灰石中钙的摩尔百分数为4%。
将实施例3制备的镁掺杂硅灰石修饰前、后多孔管状棒材和β-磷酸三钙多孔棒材分别放入体外标准条件化无菌培养的人骨髓间充质干细胞(hBMSCs)培养瓶中共培养。经检测,培养3、6、9、12天后,投入镁掺杂硅灰石修饰后陶瓷培养瓶中hBMSCs细胞增殖率分别比β-磷酸三钙组高50~75%,比镁黄长石修饰前陶瓷透辉石多孔陶瓷组细胞增殖率高30~45%(图7);培养7、10、14、和21天后ALP、OC、OCN的表达也存在显著性差异;培养21天后,修饰后陶瓷组钙化结节密度比修饰前陶瓷和β-磷酸三钙陶瓷分别提高320%和450%。该检测结果表明经可降解的镁掺杂硅灰石修饰改性透辉石的陶瓷管状棒材具有优良的促进诱导成骨活性。
实施例4:
制备方法同实施例1,区别在于:将步骤2)中的正硅酸乙酯、硝酸钙、硝酸镁的添加量分别改为0.30mol、0.40mol和0.1mol。经检测,透辉石多孔陶瓷管孔道壁表面层积厚度为80μm的低结晶性白硅钙石-镁黄长石复合物层。
实施例5:
制备方法同实施例1,区别在于:将步骤1)中采用镁钙橄榄石粉体代替透辉石粉体。经检测,镁钙橄榄石多孔陶瓷管状棒材孔道壁表面层积厚度为580μm的镁黄长石(Ca2MgSi2O7)层。
实施例6:
制备方法同实施例1,区别在于:向步骤2)正硅酸乙酯溶液中按钙的摩尔量6%添加硝酸铜。经检测,透辉石多孔管状棒材孔道壁表面层积厚度为65μm的铜掺杂镁黄长石层。
实施例7:
制备方法同实施例2,区别在于:向步骤2)正硅酸乙酯溶液中按钙的摩尔量15%添加硝酸锌。经检测,透辉石多孔管状棒材孔道壁表面层积厚度为25nm的锌掺杂白硅钙石层,修饰层中镁代替了白硅钙石中钙的摩尔百分数为15%。
实施例8:
制备方法同实施例6,区别在于:向步骤2)正硅酸乙酯溶液中按钙的摩尔量10%添加硼酸和硝酸铜。经检测,透辉石多孔管状棒材孔道壁表面层积厚度为48μm的硼、铜共掺杂镁黄长石层,修饰层中硼、铜共代替了镁黄长石中钙的摩尔百分数为10%。
实施例9:
制备方法同实施例2,区别在于:将步骤1)三维打印预设孔形态为正方形,棒材为圆台形,即棒材一端外径为6.4mm,另一端外径为44mm,沿轴心线贯通通道直径为1.7mm。经检测,烧结后的透辉石多孔陶瓷棒材一端直径为6mm,另一端直径为40mm,沿轴心线贯通通道直径为1.5mm,经可降解白硅钙石修饰改性孔道壁后孔道仍然维持正方形(见图5)。
实施例10:
制备方法同实施例3,区别在于:将步骤1)三维打印预设孔形态为圆形形,棒材为六棱柱,并按棒材长度的60%、30%和10%分别设置其孔隙率为21.5%、50%和70%;将步骤2)镁硅钙石前驱体凝胶修饰后煅烧温度改为800℃。经检测,经镁掺杂硅灰石修饰后的透辉石多孔陶瓷管状棒材内部孔道呈蜂窝形,最小孔隙率为20%,最大孔隙率为66%,修饰层厚度为520μm。
实施例11:
制备方法同实施例1,区别在于:步骤1)中利用孔道尺度在180~450μm的中空圆柱体有机多孔泡沫代替增材制造制备透辉石多孔陶瓷管,即将该泡沫埋入水凝胶中,负压抽吸浸渍,然后取出挂浆后的泡沫,再用真空抽滤孔道内多余凝胶,继续陈化48h、90℃干燥24h后,在1000℃煅烧6小时,从而得到透辉石多孔陶瓷管。管壁修饰处理同实施例1.
实施例12:
制备方法同实施例1,区别在于:步骤1)中利用直径为380μm的石蜡微球制作直径为35mm的堆砌体圆台,沿轴线插入直径4mm的金属棒,在45℃环 境下静置2分钟,然后想微球堆砌体灌注透辉石糊状物浆料,再在60℃干燥24h后,抽出中间金属棒,在900℃煅烧1小时,从而得到透辉石多孔陶瓷管。后续管壁修饰处理同实施例1.
实施例13:
制备方法同实施例1,区别在于:将步骤1)中透辉石超细粉体按固液质量比为1:0.6搅拌分散到浓度为5.5%的聚乙烯醇水溶液中,并按棒材长度的40%、30%和20%分别设置其孔隙率为30%、50%和75%,将步骤2)中烧结调整为800℃烧结1小时。经检测,透辉石多孔管状棒材孔道壁表面层积厚度为587μm的镁黄长石层,最小孔隙率为28%,最大孔隙率为73%。
大鼠实验:
取3月龄雄性SD大鼠,体重245±5g;按10%水合氯醛0.25ml/100g的用量实施腹腔麻醉后,背部备皮,常规消毒铺单。取背部正中纵行切口,长约3cm,游离皮下,显露腰背筋膜,在离正中线约0.6cm处纵向切开腰背筋膜,深至肌层表面,切开约长2.3cm,切口外侧腰背筋膜与肌层表面之间做钝性分离,形成一个袋装结构,分别将实施例1、2、3、4分别制备的镁黄长石、白硅钙石、镁掺杂硅灰石、白硅钙石-镁黄长石复合物修饰后透辉石多孔管状棒材以及β-磷酸三钙棒材切割成厚度为3mm的片状物,灭菌后分别植入该袋装结构中。缝合腰背筋膜切口。仔细止血,清洗伤口后逐层关闭创口,缝合皮肤。术后青霉素40万单位肌肉注射。正常条件喂食。2~4周后分别处死大鼠,观察义眼座与周围组织情况。发现实施例1、2、3的镁黄长石、白硅钙石和镁掺杂硅灰石修饰后的材料周围组织正常,大量血管长入孔道中,无纤维包膜和炎症反应;筋膜面可见清晰的血管长入,但是β-磷酸三钙片状物血管长入程度非常低。
由上述实施例可见,本发明管状棒材能对股骨头坏死髓芯能长期减压、显著改善坏死区血管化、营养传输并促进骨损伤新骨再生;并且生物活性优良,在股骨头坏死和大段骨缺损骨重建中具有应用价值和显著的技术效果。
- 还没有人留言评论。精彩留言会获得点赞!