以非氟非铁盐化合物作为共萃剂提取锂离子的方法与流程
本发明属于化工分离技术领域,涉及一种以非氟非铁盐化合物作为共萃剂提取锂离子的方法,具体涉及一种以非氟非铁盐化合物作为共萃剂从含锂水溶液中提取锂离子的方法。
背景技术:
近年来,随着化石能源的大规模使用,造成了一系列的生态环境问题,如全球温室效应加剧,极端天气出现频次增多等,因此,人们逐渐加大了对新型能源开发和应用的研究力度。锂具有优良的物理化学性质,已被视为一种重要战略资源和新型清洁能源的原料,被誉为“21世纪清洁能源金属”及“推动世界前进的重要元素”。随着全球新型清洁能源技术的迅猛发展,锂资源的需求量持续快速增长。据相关报道,2017年全球锂资源需求量达到22万吨左右,同比增长9%,其中以锂电池的形式被应用于新能源汽车的需求量同比增长44%,约4.5万吨。锂在自然界中主要以两种形式存在,一是以固体形式储存于锂矿石中,二是以液体形式蕴藏于盐湖卤水中。而锂资源大部分以液体形式存在,随着锂矿资源不断开采,固体锂资源日渐枯竭,因此从盐湖卤水中提取锂离子资源有着非常重要的意义。
目前用于从盐湖卤水中提取锂离子的方法包括煅烧法、离子交换树脂法、电渗析法、离子筛吸附法和溶剂萃取法等。其中溶剂萃取法凭借其高选择性、高自动化操作性及易于工业放大等特点,成为当前提取锂离子技术的热点研究方法之一。现有的提取锂离子的溶剂萃取工艺通常采用加入共萃剂通过共萃取的方法来提高锂离子的提取效率。目前共萃剂中以三氯化铁最为常用,且效果较佳,氯化铜、氯化锌、氯化铬及氯化铝等用作共萃剂效果非常差。然而,虽然很多研究学者对于采用三氯化铁作为共萃剂的萃取工艺进行了大量的优化和改进研究,但目前仍存在一些问题,例如,三氯化铁要发挥共萃剂的作用,需先与水溶液中的高浓度氯离子形成四氯化铁络阴离子,即FeCl3+Cl-=FeCl4-,为使有机相能够保持高效循环利用性能,需四氯化铁络阴离子一直稳定存在于有机相中,这就需要含锂水溶液、洗涤剂、反萃剂及有机相再生剂等水溶液中均需含有一定浓度的氯离子;同时有机相再生时一般使用碱溶液中和反萃后所得到的HFeCl4中的氢离子,而铁离子遇碱易形成多种形式的沉淀,从而脱离有机相,致共萃剂损失,影响连续循环萃取效率。而采用六氟磷酸盐和/或氟硼酸盐替代三氯化铁作为共萃取剂用于提取锂离子虽然从一定程度上解决了三氯化铁作为共萃剂带来的一系列问题,但是所用的共萃剂均含氟,在萃取过程中遇水或水蒸气易分解生成氟化氢,不仅对分离设备腐蚀严重,而且对操作工人的身体健康也会带来极大的威胁。
因此,目前亟需研究开发一种萃取效率和选择性高,萃取过程中试剂对设备腐蚀小,对人体危害少,且成本较低的锂离子提取技术。
技术实现要素:
本发明所要解决的技术问题是针对上述现有技术的不足,提供从含锂水溶液中提取锂离子的方法。该方法以含对称立体结构络阴离子的非氟非铁盐化合物作为共萃剂用于萃取提取含锂水溶液中锂离子,所采用的共萃剂展现出较高的单级萃取率、锂镁及锂钾分离因子,经过萃取、洗涤和反萃等步骤,得到组成为LiCl+NaCl的反萃液,然后加入沉淀剂制备Li2CO3产品。该方法工艺简单,采用常规萃取分离设备即可,适用所有含锂水溶液,放大容易,适用于连续工业化生产。
为此,本发明提供了一种从含锂水溶液中提取锂离子的方法,其包括:
步骤B,将共萃剂和有机相溶液加入到含锂水溶液中,进行萃取,获得萃余液和萃取液;
步骤C,用洗涤剂洗涤萃取液,获得净化萃取液和洗涤废液;
步骤D,将反萃剂加入到净化萃取液中,进行反萃取,获得反萃液和反萃余液;
步骤F,向反萃液中加入沉淀剂,制得Li2CO3;
其中,所述共萃剂为非氟非铁盐化合物。
在本发明的一些优选的实施例中,所述共萃剂为含对称立体结构络阴离子的非氟非铁盐化合物。
在本发明的一些具体优选的实施例中,所述含对称立体结构络阴离子的非氟非铁盐化合物包括四苯基硼酸钠、磷钼酸钠和硅钨酸钠中的一种或几种。
根据本发明方法,所述共萃剂与含锂水溶液中锂离子的摩尔比为1:9~9:1。
本发明中,所述洗涤剂为NaCl与LiCl混合溶液。
在本发明的一些实施例中,在所述洗涤剂中,NaCl和LiCl的浓度各自独立地为0.01~6mol/L。
在本发明的一些实施例中,所述萃取液与洗涤剂的体积比为1:20~20:1。
本发明中,有机相溶液为萃取剂和稀释剂的混合溶液。
在本发明的一些实施例中,在所述有机相溶液中,萃取剂和稀释剂的体积比为9:1~1:9。
在本发明的一些实施例中,在步骤B中,所述有机相溶液与含锂水溶液的体积比为1:30~30:1。
本发明中,所述反萃剂为盐酸溶液。
在本发明的一些实施例中,所述盐酸溶液的浓度为0.01~3mol/L。
在本发明的一些实施例中,在步骤D中,净化的萃取液与反萃剂的体积比为1:20~20:1。
本发明中,所述萃取剂为中性有机磷类萃取剂。
在本发明的一些具体实施例中,所述中性有机磷类萃取剂包括磷酸三丁酯、磷酸三辛酯、磷酸三甲酚酯、2-乙基己基二苯基磷酸酯和磷酸三异丁酯中的一种或几种。
根据本发明,所述稀释剂包括酮、酯和卤代烷烃中的一种或几种。
在本发明的一些实施例中,所述酮包括甲基异丁基甲酮和/或乙酰丙酮。
在本发明的一些实施例中,所述酯包括邻苯二甲酸二甲酯。
在本发明的一些实施例中,所述卤代烷烃包括环氧氯丙烷、溴氯甲烷和二氯甲烷中的一种或几种。
根据本发明方法,所述方法还包括在步骤D之后的步骤E,将有机相再生剂与反萃余液混合后,分离,获得再生有机相溶液返回步骤B。
本发明中,所述有机相再生剂为NaOH溶液。
在本发明的一些实施例中,所述NaOH的浓度为0.01~3mol/L。
在本发明的一些实施例中,所述反萃余液与有机相再生剂的体积比1:20~20:1。
本发明的有益效果:(1)使用非氟非铁具有立体对称结构络阴离子的盐化合物取代三氯化铁作为共萃剂用于溶剂萃取法提取含锂水溶液中的锂离子,解决了三氯化铁作为共萃剂产生的问题;(2)此类非氟非铁具有立体对称结构络阴离子的盐化合物不含氟,可有效避免因氟水解产生氟化氢对装置及人体带来的潜在伤害;(3)使用酮、酯或卤代烷烃作为稀释剂,可较好地溶解此类非氟非铁具有立体对称结构络阴离子的盐化合物,萃取、洗涤、反萃及有机相再生过程分相速度快,无第三相产生,稀释剂在含盐溶液中溶损较少;(4)洗涤剂NaCl+LiCl不含酸碱,可有效降低对设备的腐蚀;(5)采用低浓度盐酸作为反萃剂,得到LiCl和NaCl混合溶液,可通过加入沉淀剂(例如Na2CO3)的方式制备Li2CO3产品。
附图说明
为使本发明容易理解,下面将结合附图来详细说明本发明。
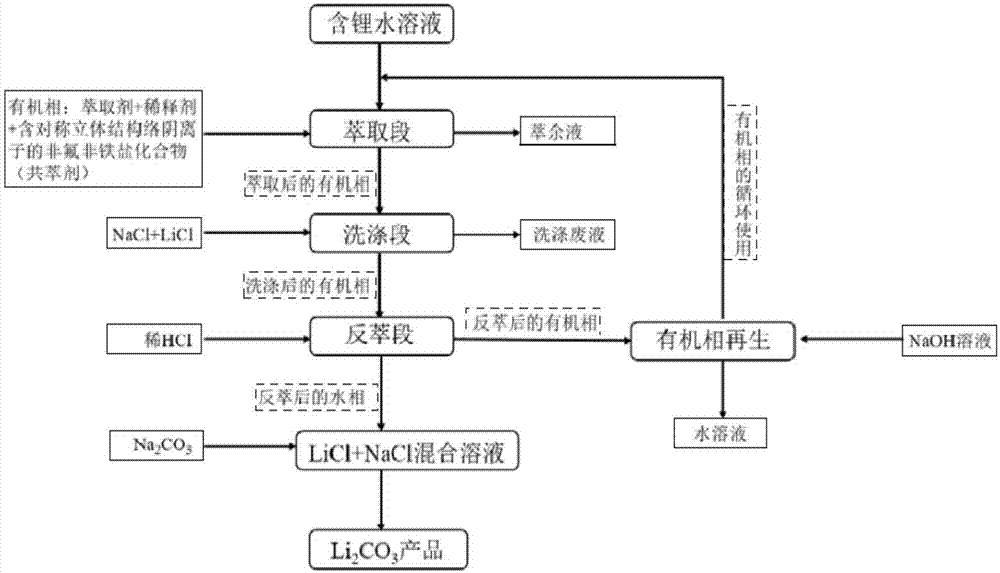
图1为本发明采用非氟非铁盐化合物作为共萃剂从含锂水溶液中提取锂离子的工艺流程图。
具体实施方式
为使本发明更加容易理解,下面将结合本发明的具体实施方案参照附图详细说明如下,但仅作为说明而不是限制本发明。
如前所述,现有的提取锂离子的溶剂萃取工艺通常采用加入共萃剂通过共萃取的方法来提高锂离子的提取效率。目前共萃剂中以三氯化铁最为常用,且效果较佳,氯化铜、氯化锌、氯化铬及氯化铝等用作共萃剂效果非常差。然而,虽然很多研究学者对于采用三氯化铁作为共萃剂的萃取工艺进行了大量的优化和改进研究,但目前仍存在一些问题,例如,三氯化铁要发挥共萃剂的作用,需先与水溶液中的高浓度氯离子形成四氯化铁络阴离子,即FeCl3+Cl-=FeCl4-,为使有机相能够保持高效循环利用性能,需四氯化铁络阴离子一直稳定存在于有机相中,这就需要含锂水溶液、洗涤剂、反萃剂及有机相再生剂等水溶液中均需含有一定浓度的氯离子;同时有机相再生时一般使用碱溶液中和反萃后所得到的HFeCl4中的氢离子,而铁离子遇碱易形成多种形式的沉淀,从而脱离有机相,致共萃剂损失,影响连续循环萃取效率。而采用六氟磷酸盐和/或氟硼酸盐替代三氯化铁作为共萃取剂用于提取锂离子虽然从一定程度上解决了三氯化铁作为共萃剂带来的一系列问题,但是所用的共萃剂均含氟,在萃取过程中遇水或水蒸气易分解生成氟化氢,不仅对分离设备腐蚀严重,而且对操作工人的身体健康也会带来极大的威胁。因此,如何在提高萃取效率和选择性的同时,避免设备腐蚀和工艺操作对人员身体的伤害,并能有效解决三氯化铁作为共萃剂带来的一系列问题成为锂离子提取领域中一直以来人们想要解决而又难以解决的难题。为此,本发明人对锂离子提取工艺进行了大量研究。
本发明人通过对现有萃取提锂技术进行研究发现,中国专利CN87103431A提出了采用50%-70%体积比的TBP为萃取剂,30%-50%体积比的200#溶剂煤油为稀释剂,三氯化铁为共萃剂的萃取提锂工艺,采用稀HCl和6-9mol/L HCl溶液作为洗涤剂和反萃剂,存在的主要问题之一是萃取过程中易出现第三相,导致工艺流程无法连续稳定运行;之二是采用高浓发烟盐酸为反萃剂,易对设备造成严重腐蚀,酸雾也会对操作工人身体造成强烈伤害。中国专利CN102275956A提出了采用极性稀释剂酮或醇代替此前的惰性稀释剂200#溶剂煤油,以期解决萃取易出第三相的问题;并通过调节相比,用LiCl取代部分HCl用作洗涤剂,用NaCl或NH4Cl部分取代HCl用作反萃剂,大大降低了HCl的用量,解决了此前专利中存在的问题。但通过筛选共萃剂发现,与三氯化铁相比,氯化铜、氯化锌、氯化铬及氯化铝等用作共萃剂效果非常差,故共萃剂仍以三氯化铁效果最好。三氯化铁要发挥共萃剂的作用,需先与水溶液中的高浓度氯离子形成四氯化铁络阴离子,即FeCl3+Cl-=FeCl4-,为使有机相能够保持高效循环利用性能,需四氯化铁络阴离子一直稳定存在于有机相中,这就需要含锂原溶液、洗涤剂、反萃剂及洗酸再生剂等水溶液中均需含有一定浓度的氯离子,同时有机相洗酸再生时一般使用碱溶液中和反萃后所得到的HFeCl4中的氢离子,而铁离子遇碱易形成多种形式的沉淀,从而脱离有机相,致共萃剂损失,影响连续循环萃取效率。中国专利CN104404268A提出采用六氟磷酸钾、六氟磷酸钠、六氟磷酸镁、六氟磷酸钙、氟硼酸钾,氟硼酸钠、氟硼酸镁、氟硼酸钙中的一种或两种以上的非铁混合物来取代三氯化铁用作萃取提锂的共萃剂,取得了较好的提锂效果。但所采用的共萃剂均含氟,在萃取过程中遇水或水蒸气易分解生成氟化氢,不仅对分离设备腐蚀严重,而且对操作工人的身体健康也会带来极大的威胁。
本发明人进一步研究发现,采用含对称立体结构络阴离子的非氟非铁盐化合物替代三氯化铁作为共萃剂可以有效解决三氯化铁作为共萃剂带来的潜在问题,还能够避免含氟共萃剂对设备及人体带来的极大伤害,本发明正是基于上述发现作出的。
图1为本发明采用非氟非铁盐化合物作为共萃剂从含锂水溶液中提取锂离子的工艺流程图,从图1可以看出,本发明所涉及的从含锂水溶液中提取锂离子的方法,其包括:
步骤B(萃取段),将共萃剂和有机相溶液加入到含锂水溶液中,进行萃取,获得萃余液和萃取液(萃取后的有机相);
步骤C(洗涤段),用洗涤剂洗涤萃取液,获得净化萃取液(洗涤后的有机相)和洗涤废液;
步骤D(反萃段),将反萃剂加入到净化萃取液中,进行反萃取,获得反萃液(反萃后的水相)和反萃余液(反萃后的有机相);
步骤F(沉淀分离段),向反萃液中加入沉淀剂,制得Li2CO3;
其中,所述共萃剂为非氟非铁盐化合物。
在本发明的一些优选的实施例中,所述共萃剂为含对称立体结构络阴离子的非氟非铁盐化合物。
在本发明的一些具体优选的实施例中,所述含对称立体结构络阴离子的非氟非铁盐化合物包括四苯基硼酸钠、磷钼酸钠和硅钨酸钠中的一种或几种。
根据本发明方法,所述共萃剂与含锂水溶液中锂离子的摩尔比为1:9~9:1,优选为(1~2):1。
本发明中,所述洗涤剂为NaCl与LiCl混合溶液。
在本发明的一些实施例中,例如,在所述洗涤剂中,NaCl的浓度为0.01~6mol/L,优选为1.8~2.0mol/L,LiCl的浓度为0.01~6mol/L,优选为0.1144~0.20mol/L。
在一些具体优选的例子中,在所述洗涤剂中,例如,可以配制浓度为0.1144mol/L LiCl+2.0mol/L NaCl,或者浓度为0.2mol/L LiCl+1.8mol/L NaCl,或者浓度为0.2mol/L LiCl+2.0mol/L NaCl的混合溶液作为洗涤剂。
在本发明的一些实施例中,所述萃取液与洗涤剂的体积比为1:20~20:1,优选为(3~5):1。
本发明中,有机相溶液为萃取剂和稀释剂的混合溶液。
在本发明的一些实施例中,在所述有机相溶液中,萃取剂和稀释剂的体积比为9:1~1:9,优选为1:(1~1.5)。
在本发明的一些实施例中,在步骤B中,所述有机相溶液与含锂水溶液的体积比为1:30~30:1,优选为(0.5~2):1,进一步优选为1:1。
本发明中,所述反萃剂为盐酸溶液。
在本发明的一些实施例中,所述盐酸溶液的浓度为0.01~3mol/L,优选为0.26~0.5mol/L。
在本发明的一些实施例中,在步骤D中,净化的萃取液与反萃剂的体积比为1:20~20:1,优选为(3~6):1。
本发明中,所述萃取剂为中性有机磷类萃取剂。
在本发明的一些具体实施例中,所述中性有机磷类萃取剂包括磷酸三丁酯、磷酸三辛酯、磷酸三甲酚酯、2-乙基己基二苯基磷酸酯和磷酸三异丁酯中的一种或几种,优选为磷酸三丁酯、磷酸三辛酯或磷酸三甲酚酯。
根据本发明,所述稀释剂包括酮、酯和卤代烷烃中的一种或几种。
在本发明的一些实施例中,所述酮包括甲基异丁基甲酮和/或乙酰丙酮。
在本发明的一些实施例中,所述酯包括邻苯二甲酸二甲酯。
在本发明的一些实施例中,所述卤代烷烃包括环氧氯丙烷、溴氯甲烷和二氯甲烷中的一种或几种。
根据本发明方法,所述方法还包括在步骤D之后的步骤E,将有机相再生剂与反萃余液混合后,分离,获得再生有机相溶液循环返回步骤B,同时产生作为废液排出的水溶液。
本发明中,所述有机相再生剂为NaOH溶液。
在本发明的一些实施例中,所述NaOH的浓度为0.01~3mol/L,优选为0.3~0.5mol/L。
在本发明的一些实施例中,所述反萃余液与有机相再生剂的体积比1:20~20:1,优选为(3~5):1。
本发明中,所述反萃液组成为NaCl+LiCl,加入沉淀剂,例如,Na2CO3可制备Li2CO3。
本发明中对于沉淀剂没有特别的限制,可以选用本领域常规沉淀剂,例如,所述沉淀剂包括Na2CO3和/或CO2,优选为Na2CO3。沉淀剂的用量以能够将反萃液中的Li离子完全沉淀为准。
本发明中含锂水溶液中金属离子,包括锂离子、镁离子、钾离子和钠离子的浓度可以采用原子吸收光谱法测量。该原子吸收光谱法采用AA-6880原子吸收分光光度计(日本岛津公司)进行测量,采用乙炔+空气火焰燃烧,火焰燃烧头高度可自动调节,四种金属离子检测上限均为2ppm,配备光学/电子双光束,测定波长范围为185-900nm,配有象差校正型切尼尔-特纳装置,可实现0.1、0.2、0.4、0.7、1.0、2.0nm的6段自动切换,可实现快速自吸收法和2频率同时测光方式,具有8个灯位,可同时点灯2个(1个预热),7和8号位还可驱动高性能空心阴极灯。
本发明所用术语“萃取剂”是指与被萃取物形成溶于有机相的萃合物的化学试剂。在湿法冶金中,萃取剂的作用是与被萃取的金属通过配合化学反应生成萃合物萃入到有机相,又能通过某种化学反应使被萃取的金属从有机相反萃取到水相,由此而达到金属提纯与富集的目的。
本发明中所用术语“共萃取”是指某一元素(通常为微量元素,即待萃取元素)单独存在时不被萃取或萃取率很低,但有另一元素(通常为常量元素)存在时,难萃元素的萃取率大增,这一现象称之为共萃取。相应地,含有另一元素(通常为常量元素),且也能够与萃取剂形成溶于有机相的萃合物的化学试剂即为共萃取剂。
本发明中所用术语“络阴离子”是指在由金属或有机阳离子和含氧或非氧酸根结合而成的盐的结构中呈独立的阴离子团存在的含氧或非氧酸根。例如,本发明的共萃剂,例如,四苯基硼酸钠、磷钼酸钠和硅钨酸钠,均具有由金属或有机阳离子和含氧或非氧酸根结合而成的盐的结构,其中的呈独立的阴离子团存在的含氧或非氧酸根,例如,磷钼酸根、硅钨酸根和四苯基硼酸根,即为“络阴离子”。本发明中上述磷钼酸根、硅钨酸根和四苯基硼酸根络阴离子具有立体对称结构。
本发明中所述“含锂水溶液”一词是指溶有锂离子的由水作溶剂的溶液,例如各种盐湖卤水等。
本发明中所用术语“反萃取”是指使被萃取物从负载有机相(本发明中亦称为萃取相或萃取液)返回水相的过程。为萃取的逆过程。
相应地,本发明中所用术语“反萃剂”是指与被萃取物形成萃合物从而使被萃取物从负载有机相(本发明中亦称为萃取相或萃取液)返回水相的试剂。
本发明中所述用语“萃取有机相”、“有机相”和“有机相溶液”可以互换使用。
本发明中所述用语“负载有机相”、“萃取后的有机相”、“萃取液”和“萃取相”可以互换使用。
本发明中所述用语“净化萃取液”与“洗涤后的有机相”可以互换使用。
本发明中所述用语“反萃余液”与“反萃后的有机相”可以互换使用。
本发明中所述用语“反萃液”与“反萃后的负载水相”可以互换使用。
本发明中所述用语“摩尔浓度”与“浓度”可以互换使用。
本发明中所述“水”一词,在没有特别说明或限定的条件下,是指去离子水,蒸馏水或超纯水。
实施例
为使本发明更加容易理解,下面将结合实施例来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径买到或常规方法制得。
实施例1:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和甲基异丁基酮(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、甲基异丁基酮分别占有机相溶液总体积的40%和60%;
(2)将四苯基硼酸钠(共萃剂)溶解到上述有机相溶液中,四苯基硼酸钠(共萃剂)与锂离子的摩尔比为1.7:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取,分离,获得萃取液和萃余液;
(3)配制浓度为0.1144mol/L LiCl+2.0mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为5:1,洗涤萃取后的有机相,分离,获得净化萃取液和洗涤废液;
(4)配制浓度为0.3mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为5:1,反萃后分离得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.3mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为4:1,经再生后的有机相溶液返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为77%,单级锂钾和锂镁分离因子可达182和235。经过两级萃取,一级洗涤,两级反萃后锂总回收率达93%以上。
实施例2:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和溴氯甲烷(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、溴氯甲烷分别占有机相溶液总体积的50%和50%;
(2)将四苯基硼酸钠(共萃剂)溶解到上述有机相溶液中,四苯基硼酸钠(共萃剂)与锂离子的摩尔比为2:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.1144mol/L LiCl+2.0mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为5:1,洗涤有机相;
(4)配制浓度为0.5mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为6:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.4mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为4:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为86%,单级锂钾和锂镁分离因子可达1408和1861。经过两级萃取,一级洗涤,两级反萃后锂总回收率达96%以上。
实施例3:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和二氯甲烷(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三丁酯、二氯甲烷分别占有机相溶液总体积的40%和60%;
(2)将四苯基硼酸钠(共萃剂)溶解到上述有机相溶液中,四苯基硼酸钠(共萃剂)与锂离子的摩尔比为1.8:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.1144mol/L LiCl+2.0mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为5:1,洗涤有机相;
(4)配制浓度为0.4mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为5:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.3mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为3:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为85%,单级锂镁分离因子可达331。经过两级萃取,一级洗涤,两级反萃后锂总回收率达95%以上。
实施例4:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三辛酯(萃取剂)和甲基异丁基酮(稀释剂)混合,制成萃取有机相(有机相溶液),磷酸三辛酯、甲基异丁基酮分别占有机相溶液总体积的40%和60%;
(2)将四苯基硼酸钠(共萃剂)溶解到上述有机相溶液中,四苯基硼酸钠(共萃剂)与锂离子的摩尔比为1.5:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.1144mol/L LiCl+2.0mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为5:1,洗涤有机相;
(4)配制浓度为0.3mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为4:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.4mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为4:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为78%。经过两级萃取,一级洗涤,两级反萃后锂总回收率达93%以上。
实施例5:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和甲基异丁基酮(稀释剂)混合,制成有机相溶液,磷酸三丁酯、甲基异丁基酮分别占有机相溶液总体积的40%和60%;
(2)将磷钼酸钠(共萃剂)溶解到上述有机相溶液中,磷钼酸钠(共萃剂)与锂离子的摩尔比为1.2:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.2mol/L LiCl+1.8mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为3:1,洗涤有机相;
(4)配制浓度为0.26mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为3:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.3mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为4:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为49%,单级锂钾和锂镁分离因子可达34和122。经过四级萃取,一级洗涤,两级反萃后锂总回收率达90%以上。
实施例6:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和乙酰丙酮(稀释剂)混合,制成有机相溶液,磷酸三丁酯、乙酰丙酮分别占有机相溶液总体积的40%和60%;
(2)将磷钼酸钠(共萃剂)溶解到上述有机相溶液中,磷钼酸钠(共萃剂)与锂离子的摩尔比为1.3:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.2mol/L LiCl+1.8mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为3:1,洗涤有机相;
(4)配制浓度为0.26mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为3:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.4mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为5:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为62%,单级锂镁分离因子可达196。经过三级萃取,一级洗涤,两级反萃后锂总回收率达91%以上。
实施例7:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和环氧氯丙烷(稀释剂)混合,制成有机相溶液,磷酸三丁酯、环氧氯丙烷分别占有机相溶液总体积的40%和60%;
(2)将硅钨酸钠(共萃剂)溶解到上述有机相溶液中,硅钨酸钠(共萃剂)与锂离子的摩尔比为1:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.2mol/L LiCl+2.mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为3:1,洗涤有机相;
(4)配制浓度为0.3mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为4:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.3mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为3:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为63%。经过三级萃取,一级洗涤,两级反萃后锂总回收率达92%以上。
实施例8:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三丁酯(萃取剂)和乙酰丙酮(稀释剂)混合,制成有机相溶液,磷酸三丁酯、乙酰丙酮分别占有机相溶液总体积的40%和60%;
(2)将硅钨酸钠(共萃剂)溶解到上述有机相溶液中,硅钨酸钠(共萃剂)与锂离子的摩尔比为1.2:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.2mol/L LiCl+2.0mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为3:1,洗涤有机相;
(4)配制浓度为0.4mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为4:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.4mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为4:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为42%。经过五级萃取,一级洗涤,两级反萃后锂总回收率达90%以上。
实施例9:
配制模拟盐湖卤水(含锂水溶液),组成为锂(0.05mol/L)、镁(4.0mol/L)、钠(0.08mol/L)、钾(0.02mol/L)和氯(8.15mol/L)。
从上述模拟盐湖卤水中提取锂离子的步骤如下:
(1)将磷酸三甲酚酯(萃取剂)和甲基异丁基酮(稀释剂)混合,制成有机相溶液,磷酸三甲酚酯、甲基异丁基酮分别占有机相溶液总体积的40%和60%;
(2)将四苯基硼酸钠(共萃剂)溶解到上述有机相溶液中,四苯基硼酸钠(共萃剂)与锂离子的摩尔比为2:1,然后将模拟卤水与有机相溶液充分混合,有机相溶液与模拟盐湖卤水的体积比为1:1,进行萃取;
(3)配制浓度为0.1144mol/L LiCl+2.0mol/L NaCl的混合溶液作为洗涤剂,与步骤(2)萃取后分离得到的萃取液(萃取后的有机相)充分混合,萃取后的有机相和洗涤剂的体积比为5:1,洗涤有机相;
(4)配制浓度为0.3mol/L的HCl溶液作为反萃剂,与步骤(3)洗涤后分离得到的净化萃取液(洗涤后的有机相)充分混合,净化萃取液和反萃剂的体积比为4:1,反萃后得到反萃液(LiCl和NaCl混合溶液)和反萃余液,向反萃液中加入Na2CO3制备Li2CO3产品;
(5)配制浓度为0.4mol/L的NaOH溶液作为有机相再生剂,与步骤(4)反萃后分离得到的反萃余液(反萃后的有机相)充分混合,反萃余液与再生剂的体积比为4:1,经再生后的有机相返回萃取段重复利用,继续进行步骤(2)萃取提锂。
本实施例单级锂萃取率为70%。经过三级萃取,一级洗涤,两级反萃后锂总回收率达95%以上。
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
- 还没有人留言评论。精彩留言会获得点赞!