一种碱金属钨青铜粉体的制备方法与流程
本发明属于功能性纳米材料领域,具体涉及一种系列碱金属钨青铜粉体的制备方法。
背景技术:
钨青铜是一种含钨的非整比化合物,通常可用经验式mxwo3来表示,其中m通常是碱金属,也可以是碱土金属、铵离子和稀土金属离子等。x介于0和1之间。钨青铜一般具有金属光泽和特殊的颜色。m的种类和x数值的变化,可使它具有超导、导体或半导体性质。钨青铜一般采用氢气还原、电解还原、气相沉积、熔融或固态反应的方法制备,其中以固态反应最易实现。
钨青铜优异的电磁性能和晶体结构的多样性成为材料与应用领域研究的热点。近年来钨青铜与红外线的相互作用成为应用领域的研究热点之一。红外线是波长介于微波与可见光之间的电磁波,波长在760纳米(nm)到1mm之间,比红光长的非可见光。红外线特别是近红外具有明显的热效应,在不同的领域需要对其进行相应的调控。比如,在建筑或汽车方面,因其易导致温度升温,从而造成如室内或车内的温度升高,从节能的角度出发,通过在玻璃或门窗上涂装红外阻隔涂料或贴装红外阻隔膜可以达到节能的目的。再比如,利用材料对红外线的吸收进行光热转化,可以制备具有蓄热保温功能的纺织品。
目前已经报道的具有较强近红外吸收或反射性能的无机材料主要包括六硼化镧(lab6)、系列导电氧化物(如氧化锡锑(ato)、氧化铟锡(ito)和氧化锌铝(azo)等)及钨青铜类功能材料。这类导电氧化物粉末一般对波长大于1500nm的近红外光线有强的吸收能力。而钨青铜粉体对波长大于950nm的近红外光有强的吸收能力,因而具有更加优异的近红外吸收、遮蔽性能,成为当前应用的主流材料。
诸多文献表明,可以通过传统固相法或软化学法制备性能优异的钨青铜粉体。传统固相法通常需要较高的反应温度和苛刻的反应条件,其中,常用的高温还原反应法为获得还原气氛通常需要在高温过程中通入(h2+n2)混合气。比如,文献journalofappliedphysics114,194304(2013)报导了在800℃条件下利用1.6%h2/n2混合气制备csxwo3粉体。近来,通过低温软化学合成naxwo3、kxwo3及csxwo3等粒子的研究已有报道(比如journalofphysicsandchemistryofsolids,2009,61:2029-2033;journalofsolidstatechemistry,2010,183(10):2456-2460;journalofmaterialschemistry,2010,20:8227-8229;无机化学学报,2007,23(5)867-870及专利文献cn102320662a等)。
在软化学法制备系列钨青铜粉体方面,较早报道的是以溶剂热为主的制备方法。利用溶剂体系的反应过程产生的水进而控制钨青铜相的形成过程。比如文献journalofsolidstatechemistry,2010,183(10):2456-2460;journalofmaterialschemistry,2010,20:8227-8229中以氯化钨(wcl6)和氢氧化铯(csoh)为原料通过溶剂热反应可合成具有较好近红外遮蔽性能的cs0.33wo3。然而,wcl6和csoh原料成本高,并且具有易挥发、易水解、稳定性差、对人体和环境有害以及不易操作等缺点。为改进这些缺点,专利文献cn102320662a、cn104528829a报导了以钨酸溶胶与cs2co3为原料,在水与溶剂的混合体系中加入柠檬酸为还原剂来制备铯钨青铜粉体。其中的钨酸溶胶为通过利用钨酸盐经离子交换树脂脱除阳离子后制备。该过程工艺过程较长,所揭示的原理尚不清晰。
技术实现要素:
鉴于上述钨青铜制备中存在的缺点,本发明的目的在于提供一种反应机理明确,可以简化工艺过程、避免副产物的产生、提高收率、便于控制反应,提高反应稳定性的制备系列碱金属钨青铜粉体的方法。
本发明提供一种制备系列碱金属钨青铜粉体的方法,所述钨青铜粉体基于如下化学反应式形成:
本发明提出了一种全新的一步制备系列碱金属钨青铜粉体的方法,该方法反应机理明确,可以简化工艺过程、避免副产物的产生、提高收率、便于控制反应,提高反应稳定性。
优选地,将所需碱金属源、+6价钨源、二氧化钨经混合后进行煅烧,得到所需碱金属钨青铜粉体。
优选地,所述煅烧在真空下进行。
优选地,煅烧温度为450~800℃,煅烧时间为2~8小时。
优选地,将所需碱金属源、+6价钨源、二氧化钨经混合后进行水热反应,得到所需碱金属钨青铜粉体。
优选地,水热反应液中还含有维持体系还原性的物质。
优选地,所述维持体系还原性的物质为具有水溶性的有机或无机化合物,可选自糖类碳水化合物(如蔗糖、葡萄糖、糖原等)、脂肪族羧酸(如乙酸、甲酸、酒石酸、草酸、苹果酸、枸椽酸、抗坏血酸等)、芳香族羧酸(如苯甲酸、水杨酸、咖啡酸等)、水合肼、醇类(如甲醇、乙醇、乙二醇、丙二醇、丙三醇等)、醛类(如甲醛、乙醛等)中的至少一种。
优选地,水热反应的温度为200~320℃,水热反应的时间为4~48小时。
优选地,所述碱金属源选自碱金属氧化物、碱金属氧化物前体中的至少一种。
优选地,所述碱金属氧化物前体选自碳酸盐、氢氧化物、硫酸盐中的至少一种;所述+6价钨源选自三氧化钨、三氧化钨前体中的至少一种。
优选地,所述三氧化钨前体选自钨酸、偏钨酸铵、正钨酸铵、仲钨酸铵中的至少一种。
优选地,碱金属源、+6价钨源、二氧化钨按所述化学反应式的化学计量比配料。
本发明提出的制备方法便于形成产物物相的控制、工艺简便、产物得率高、适合大规模、低成本生产。
附图说明
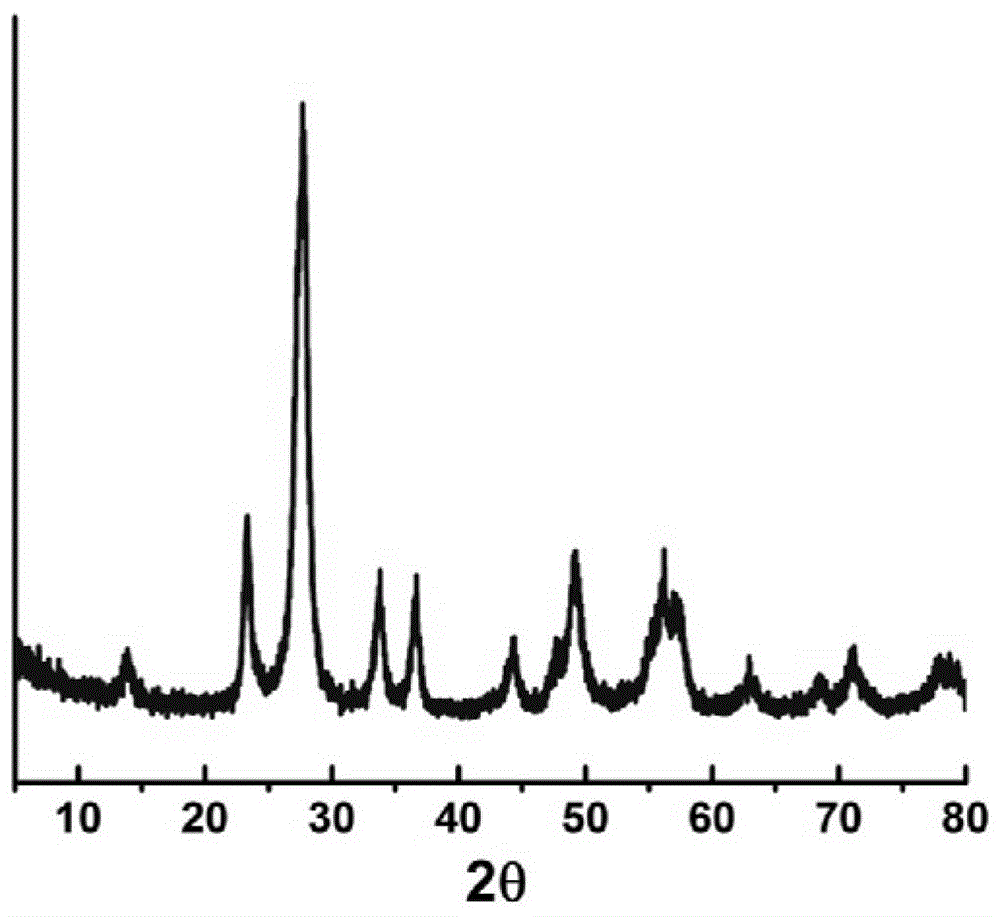
图1为本发明实施例1的铯钨青铜粉体的粉末x衍射(xrd)图。
图2为本发明实施例1的铯钨青铜粉体的透射电镜(tem)图。
图3为本发明实施例11的铯钨青铜粉体的粉末x衍射(xrd)图。
图4为本发明实施例11的铯钨青铜粉体的扫描电镜(sem)图。
图5为比较例1的粉末x衍射(xrd)图。
具体实施方式
以下通过下述实施方式进一步说明本发明,应理解,下述实施方式仅用于说明本发明,而非限制本发明。
本发明一实施方式中,利用基于下式1所列的化学反应机理制备碱金属钨青铜,更便于简化工艺过程、高收率、稳定地制备碱金属钨青铜。
在本设计的反应中,4价的钨作为还原剂与其它原料反应,形成碱金属钨青铜物相。该4价的钨同时兼作钨源的一部分。与现有的使用柠檬酸、乙二醇、水合肼等作为还原剂进行水热反应或在还原气氛或还原剂作用下进行固相反应的制备方法相比,碱金属钨青铜形成机理明确,可以简化工艺过程、避免较危险的还原气氛的使用、避免副产物的产生、提高收率、便于控制反应,提高反应稳定性。在液相水热合成时更具有易清洗、排放副产物少等优点。
式1中的碱金属源(碱金属氧化物)可以直接选择碱金属氧化物(如na2o、cs2o、rb2o及k2o)。但因碱金属氧化物比较活泼,易与空气中的水、二氧化碳等反应而影响计量与操作。发明人发现可以用等物质当量的碱金属氧化物前体进行替代。所述的碱金属氧化物前体是指该物质可以通过反应例如分解、或与水反应等而得到碱金属氧化物。
一些实施方式中,碱金属氧化物源可以选自其相应的氧化物、碳酸盐、氢氧化物、硫酸盐等中的一种或几种的组合。在保持等物质当量的条件下,发明人发现基于式1所示的原理,可以由这几种原料任意组合,而不影响碱金属钨青铜粉体的合成。
式1中的+6价钨源(三氧化钨源)可由三氧化钨和/或三氧化钨前体提供。三氧化钨前体是指该物质可以通过反应例如热分解反应等而得到wo3。一些实施方式中,三氧化钨前体选自钨酸、偏钨酸铵、正钨酸铵、仲钨酸铵等中的一种或几种的组合。在保持等物质当量的前提下,发明人发现选择反应活性更高的物质,比如钨酸、偏钨酸铵、正钨酸铵、仲钨酸铵等中的一种或几种的组合更有利于碱金属钨青铜粉体的合成。
一些实施方式中,将碱金属氧化物源、+6价钨源、二氧化钨经混合后进行煅烧,得到相应的钨青铜粉体。
本发明由于选择二氧化钨作为还原剂,因此,该煅烧无需在还原气氛下进行,而例如可以在真空或非氧化性气氛(例如惰性气氛)下进行。而且,也无需再加入其它还原剂。
碱金属氧化物源、+6价钨源、二氧化钨配料时优选按化学计量比进行配料,所得产物的收率接近理论值。
煅烧温度可以为450~800℃。煅烧时间可以为2~8小时。
当使用非氧化性气体(如氮气、惰性气体等时)作为保护气氛,碱金属氧化物来源于碳酸盐、三氧化钨来源于其相应钨源等有挥发与分解组分在高温下放出时,优选为流通性保护过程。
较优地,煅烧可以在动态反应装置例如回转炉中进行,这样使合成反应更充分、均匀。
一些实施方式中,将碱金属氧化物源、+6价钨源、二氧化钨在水中混合均匀后进行水热反应,得到相应的钨青铜粉体。
碱金属氧化物源、+6价钨源、二氧化钨配料时优选按化学计量比进行配料,所得产物的收率接近理论值。据此可以控制产物在反应体系中的浓度及相应碱金属钨青铜粉体的产量。
在水热反应过程中,二氧化钨作为主还原剂,对钨青铜的形成起主导作用。优选实施方式中,在水热合成过程中在水介质中另外加入维持体系还原性的物质,其可以维持水热反应体系还原性,避免水中溶解氧对依照上述化学反应式形成钨青铜的不利影响,有利于钨青铜物相的形成并提高其获得率。
所述维持体系还原性的物质可选自水溶性有机还原剂、无机还原剂等。
所述水溶性有机还原剂可选自糖类碳水化合物(如蔗糖、葡萄糖、糖原等)、脂肪族羧酸(如乙酸、甲酸、酒石酸、草酸、苹果酸、枸椽酸、抗坏血酸等)、芳香族羧酸(如苯甲酸、水杨酸、咖啡酸等)、醇类(如甲醇、乙醇、乙二醇、丙二醇、丙三醇等)、醛类(如甲醛、乙醛等)中的至少一种。有些水溶性有机还原剂(如蔗糖、葡萄糖、糖原、抗坏血酸等)除了维持体系还原性以外,还可以在水热过程中通过脱水碳化等过程形成碳包覆层,从而得到碳包覆碱金属钨青铜。
无机还原剂可选自水合肼、硼氢化物等中的一种或几种的组合。
维持体系还原性的物质的加入量为少量即可,过量添加维持体系还原性的物质将使体系的还原性过强,而使形成的最终产物不纯。例如,维持体系还原性的物质在水中的质量浓度可为0.01~3%。
反应体系中各原料的浓度可根据所需的最终形成产物的浓度来选择。最终形成产物的浓度对粉体的分散性与颗粒尺寸有影响。优选地,所形成产物的浓度为30%以下,由此可使粉体的分散性较好,且使颗粒尺寸分布较为均匀。更优地,所形成产物的浓度为10~20%。
合成碱金属钨青铜的水热合成温度可为200~320℃,合成时间可为4~48h。当提高水热合成温度时,其形成的时间缩短。
本发明一实施方式中,水热一步法制备碱金属钨青铜粉体主要采用以下步骤。
首先,向水热反应釜中将定量的碱金属源、+6价钨源、二氧化钨及水加入后密封,进行机械搅拌使水溶性原料溶解并使体系混合均匀。
然后,在保持机械搅拌的状态下,升温水热反应釜,在200~320℃下水热反应4~48小时。
反应结束后经自然冷却至100度以下后卸除反应釜压力,取出物料并进行洗涤、收集与干燥后即得相应的碱金属钨青铜粉体。
下面进一步例举实施例以详细说明本发明。同样应理解,以下实施例只用于对本发明进行进一步说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的一些非本质的改进和调整均属于本发明的保护范围。下述示例具体的工艺参数等也仅是合适范围中的一个示例,即本领域技术人员可以通过本文的说明做合适的范围内选择,而并非要限定于下文示例的具体数值。实施例中的原料均购自于中国国药集团化学试剂有限公司。
实施例1:
向10l哈氏合金反应釜中,加入245.6972g碳酸铯、953.4153g钨酸、162.7619g二氧化钨、340g维生素c及5.3kg去离子水,密封后开启机械搅拌,搅拌机转速为300rpm,经30分钟预搅拌后由室温升到300℃并保温10h。经冷却致100℃以下后卸除反应釜中压力,进一步冷却后出料,经洗涤、收集与干燥后得碳包覆铯钨青铜复合纳米粉体。此体系中所形成产物的浓度约20%,所包覆碳层质量为铯钨青铜质量的10%。将经冷却后的物料取出50ml,经离心分离后对上层清液中的金属离子含量利用电感耦合等离子体质谱技术进行分析。
图1为所制备粉体的粉末x衍射(xrd)图。图2为碳包覆铯钨青铜复合粉体的透射电镜(tem)图。从图1中可以看出,所得物相为六方cs0.32wo3铯钨青铜相,未检测出其它杂相。图2表明所得产物为宽约10nm、长为50nm以下的纳米薄片,且碳包覆结构明显,所得包覆层的厚度约5nm。对上层清液进行电感耦合等离子体质谱分析结果为wo3含量为0.064wt%,表明经过该水热反应后钨青铜的转化率>99%。
实施例2:
向10l哈氏合金反应釜中,加入245.6972g碳酸铯、953.4153g钨酸、162.7619g二氧化钨、120g葡萄糖及5.5kg去离子水,密封后开启机械搅拌,搅拌机转速为300rpm,经30分钟预搅拌后由室温升到300℃并保温10h。经冷却致100℃以下后卸除反应釜中压力,进一步冷却后出料,经洗涤、收集与干燥后得碳包覆铯钨青铜复合纳米粉体。物相经xrd检测为六方cs0.32wo3铯钨青铜相,未检测出其它杂相。经tem检测可见明显的包覆结构,所得产物为宽约10nm、长为50nm以下的纳米薄片,碳包覆层的厚度约3nm。此体系中所形成产物的浓度约20%,所包覆碳层质量约为铯钨青铜质量的6%。对上层清液进行电感耦合等离子体质谱分析结果为wo3含量为0.058wt%,表明经过该水热反应后钨青铜的转化率>99%。
实施例3:
向10l哈氏合金反应釜中,加入245.6972g碳酸铯、953.4153g钨酸、162.7619g二氧化钨、340g维生素c、120g葡萄糖及5.5kg去离子水,密封后开启机械搅拌,搅拌机转速为300rpm,经30分钟预搅拌后由室温升到300℃并保温10h。经冷却致100℃以下后卸除反应釜中压力,进一步冷却后出料,经洗涤、收集与干燥后得碳包覆铯钨青铜复合纳米粉体。物相经xrd检测为六方cs0.32wo3铯钨青铜相,未检测出其它杂相。经tem检测可见明显的包覆结构,所得产物为宽约10nm、长为50nm以下的纳米薄片,碳包覆层的厚度约10nm此体系中所形成产物的浓度约20%,所包覆碳层质量约为铯钨青铜质量的16%。对上层清液进行电感耦合等离子体质谱分析结果为wo3含量为0.060wt%,表明经过该水热反应后钨青铜的转化率>99%。
实施例4:
本实施例与实施例1相类似。本实施例不同于实施例1之处在于,体系中以氢氧化铯为铯源,所称取的氢氧化铯的质量为253.2682g,其它条件保持不变。所得结果与实施例1一致。
实施例5:
本实施例与实施例1相类似。本实施例不同于实施例1之处在于,体系中以仲钨酸铵和钨酸为+6价钨源,所称取的仲钨酸铵质量为515.5603g,钨酸质量为499.7g,其它条件保持不变。所得结果与实施例1一致。
实施例6:
本实施例与实施例1相类似。本实施例不同于实施例1之处在于,水热反应的最终保温温度为200℃,水热反应时间为48h。经冷却至100℃以下后卸除反应釜中压力,进一步冷却后出料,经洗涤、收集与干燥后得相应产物。物相经xrd检测为六方cs0.33wo3铯钨青铜相,未检测出其它杂相。经tem检测,所制备产物为碳包覆铯钨青铜复合纳米粉体,所得产物为宽约8nm、长为100nm以下的纳米薄片,碳包覆层的厚度约5nm。对上层清液进行电感耦合等离子体质谱分析结果为wo3含量为0.061wt%,表明经过该水热反应后钨青铜的转化率>99%。
实施例7
本实施例与实施例1相类似。本实施例不同于实施例1之处在于,体系中未加入维生素c,而加入10g一水合肼,以保持体系的还原性。所得粉体经xrd检测为纯相铯钨青铜。对上层清液进行电感耦合等离子体质谱分析结果为wo3含量为0.057wt%,表明经过该水热反应后钨青铜的转化率>99%。
实施例8
向10l哈氏合金反应釜中,加入245.6972g碳酸铯、953.4153g钨酸、162.7619g二氧化钨及5.7kg去离子水,密封后开启机械搅拌,搅拌机转速为300rpm,经30分钟预搅拌后由室温升到300℃并保温10h。经冷却致100℃以下后卸除反应釜中压力,进一步冷却后出料,经洗涤、收集与干燥后得一产物。经物相x衍射分析表明所得产物为以铯钨青铜为主,伴有少量三氧化钨为主要不纯物的混合物。
实施例9
向10l哈氏合金反应釜中,加入110.568g碳酸钾、1798.92g钨酸、172.68g二氧化钨、5g硼氢化钾及7.3kg去离子水,密封后开启机械搅拌,搅拌机转速为300rpm,经30分钟预搅拌后由室温升到300℃并保温10h。经冷却至100℃以下后卸除反应釜中压力,进一步冷却后出料,经洗涤、收集与干燥后一产物。将经冷却后的物料取出50ml,经离心分离后对上层清液中的金属离子含量利用电感耦合等离子体质谱技术进行分析。所得粉体经xrd检测为纯相钾钨青铜(k0.20wo3)。对上层清液进行电感耦合等离子体质谱分析结果为wo3含量为0.055wt%,表明经过该水热反应后钨青铜的转化率>99%。
实施例10
向10l哈氏合金反应釜中,加入127.188g碳酸钠、1698.98g钨酸、259.02g二氧化钨、8g硼氢化钾及7kg去离子水,密封后开启机械搅拌,搅拌机转速为300rpm,经30分钟预搅拌后由室温升到240℃并保温40h。经冷却至100℃以下后卸除反应釜中压力,进一步冷却后出料,经洗涤、收集与干燥后一产物。将经冷却后的物料取出50ml,经离心分离后对上层清液中的金属离子含量利用电感耦合等离子体质谱技术进行分析。所得粉体经xrd检测为纯相钠钨青铜(na0.30wo3)。对上层清液进行电感耦合等离子体质谱分析结果为wo3含量为0.058wt%,表明经过该水热反应后钨青铜的转化率>99%。
实施例11
将1.068kg碳酸铯,3.895kg三氧化钨,0.69kg二氧化钨加入50l回转炉中,封闭炉门,用真空机组抽真空并在整个过程中保持,开启回转装置,2小时内升温至750℃保温5小时。等炉温冷却至100度以下后,回转出料。
收集得到粉体的质量为5.4kg,取样品检测其粉末xrd(图3)发现所得产物为纯相铯钨青铜(cs0.32wo3),其得率约为理论值的98%。其扫描电镜分析(sem)(图4)表明所得产物为不规则颗粒状。
实施例12
本实施例配方与实施例11相同,加工工艺的不同之处在于整个过程中保持向体系中以0.5l/min流量通入氮气。所得产物的xrd与sem分析结果与实施例11一致。产物出料后称重为5.0kg,主要损失的原因为随气体流通有少量细粉被带出。
实施例13
将0.212kg碳酸钠,4.497kg钨酸,0.432kg二氧化钨加入50l回转炉中,封闭炉门,用真空机组抽真空并在整个过程中保持,开启回转装置,2小时内升温至450℃保温8小时。等炉温冷却至100度以下后,回转出料。
收集得到粉体的质量为4.45kg,样品经xrd检测其产物为纯相钠钨青铜(na0.20wo3),其得率约为理论值的94%。其扫描电镜分析表明所得产物为不规则颗粒状。
实施例14
将0.212kg碳酸钾,4.997kg仲钨酸铵,0.518kg二氧化钨加入50l回转炉中,封闭炉门,用真空机组抽真空并在整个过程中保持,开启回转装置,2小时内升温至650℃保温5小时。等炉温冷却至100度以下后,回转出料。
收集得到粉体的质量为4.583kg,样品经xrd检测其产物为纯相钾钨青铜(k0.24wo3),其得率约为理论值的95%。其扫描电镜分析表明所得产物为不规则颗粒状。
实施例15
将0.692kg碳酸铷,3.941kg三氧化钨,0.647kg二氧化钨加入50l回转炉中,封闭炉门,用真空机组抽真空并在整个过程中保持,开启回转装置,2小时内升温至750℃保温5小时。等炉温冷却至100度以下后,回转出料。
收集得到粉体的质量为4.84kg,样品经xrd检测其产物为纯相铷钨青铜(rb0.30wo3),其得率约为理论值的94%。其扫描电镜分析表明所得产物为不规则颗粒状。
比较例1
本比较例与实施例1相类似。本比较例不同于实施例1之处在于,体系中未加入二氧化钨。所得粉体的xrd测试结果见图5,测试结果表明所得产物物相中除有少量铯钨青铜物相外,还混有大量的三氧化钨不纯物相。
比较例2
本比较例配方与实施例11相同,不同之处在于反应于空气中进行。具体方式为称取53.4g碳酸铯,194.7g三氧化钨,34.5g二氧化钨经混合均匀后置入刚玉坩埚中以与实施例相同的烧成制度进行。经烧成后发现物料成块状与坩埚发生反应至粘连。其原因可能为二氧化钨在空气中被氧化成三氧化钨,而三氧化钨与碳酸铯反应,同时碳酸铯与刚玉坩埚也会反应。产物取样经xrd测试,发现应该存在多种物相,未有明确标定结果。
- 还没有人留言评论。精彩留言会获得点赞!