修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
本发明涉及修饰的人类snRNA分子(下文定名为外显子特异性U1——ExSpeU1),其适宜在基因治疗方法中使用。具体地,本发明涉及能够纠正由基因突变导致的并与通常非常严重的具有不同病史的人类疾病相关的异常剪接过程的snRNA分子。
背景技术:
许多人类遗传疾病(约15%)由基因突变导致,其通过干扰正确的信使RNA细胞内成熟,损害随后准确的蛋白生物合成并诱导无功能的蛋白的合成而引起疾病。通常,造成剪接缺陷的点突变涉及对负责加工初级转录物的机器识别该初级转录物关键的基因序列。位于外显子-内含子交界处的供体和受体位点,以及外显子或内含子中的基因特异性调控元件(CartegniL等人,2002;Pagani等人,2004)是其中最重要的序列。这些突变的结果可能引起多种分子事件,其最频繁地与将一个外显子排除在成熟转录物之外有关,即所谓的外显子遗漏(exonskipping)。信使RNA的加工中的分子改变是长久已知的,其涉及例如外显子遗漏,代表多种人类疾病的主要发病机制,所述多种人类疾病其中的乙型血友病、囊性纤维化和脊髓型肌萎缩,其临床过程的严重度一致。不同类型的突变可诱导外显子遗漏和在供体位点(或5’剪接位点)中特异性的突变,在受体位点(3’剪接位点)中的突变,或外显子突变。作为引起外显子遗漏的不同类型的突变的例子,以下为所描述的人类疾病的三种模型。凝血因子IX(FIX)中的缺陷是乙型血友病发病的原因,该病伴随不同程度的出血表现,有时非常严重并使人病废。在一些情况下,该病由剪接缺陷所导致。具体地,在剪接过程中,外显子5被排除出mRNA排除由因子IX基因(F9)的外显子5供体位点中的位置-2处的突变和受体位点中的多嘧啶序列中的位置-8和-9处的突变两者所导致。目前乙型血友病治疗主要基于重组外源性FIX或直接取自血浆的FIX的频繁输注,其局限加强了研究以更高效力和长期效果为特征的替代方法的需要。囊性纤维化(CF)在高加索人群中是最频繁致死的先天性遗传病:2500-2700个出生存活婴儿中就有一个新生儿罹患该病。该病的病理发生续发于定名为CFTR(囊性纤维化跨膜传导调节因子)的蛋白的异常,该蛋白位于上皮细胞的顶膜并具有调节水电解质交换的功能。作为CFTR改变的结果,盐通过细胞膜的传递被抑制,主要导致可定义为“脱水的”分泌物的产生:非常富集钠和氯的汗液与倾向于堵塞导管的浓密和粘稠的粘液,损害了多种器官和系统的功能。在一些研究的过程中,鉴定了CFTR基因序列中的许多改变与囊性纤维化相关联,其引起外显子遗漏。具体地,外显子12的遗漏由位于外显子自身的剪接供体位点中的突变和由外显子突变所导致。脊髓型肌萎缩(SMA,OMIM253300,253550和253400)是隐性的常染色体神经肌肉病,以脊髓α运动神经元的变性为特征,具有估计的1/10,000出生儿的患病率。SMA相关联的临床症状范围从极其严重的出生后危险性肌张力低下和肌无力,到较晚在童年或青春期期间发病的较轻微的形式。迄今为止,尚未鉴定对于这种根据病史的严重度通常在一定年龄导致死亡的疾病的治疗。在95%的病例中,疾病由SMN1基因的缺失所导致。在人类基因组中,存在与SMN1同源的基因,称作SMN2。然而,SMN2的表达由于外显子中的同义突变导致信使RNA的异常成熟和随后外显子7的遗漏并使基因自身失活而受损。设计的提高含外显子7的SMN2转录物的数目的方法将因此允许使用由于SMN2的正确表达而对于SMN1基因的缺失的补偿疗法,极大地暗示了为SMA的可能有效的治疗。在剪接过程中,微核RNA(snRNA)作为负责介导整个mRNA成熟过程的细胞机器的剪接体的必需组分起主要作用。具体地,微小U1RNA(U1snRNA),长度为164核糖核苷酸,由在人类基因组中出现若干拷贝的基因所编码,且代表着核粒子U1snRNP的核糖核酸组分。U1snRNA分子具有茎和环三维结构,且其在5’区域包括通常长为9个核苷酸的单链序列,该单链序列能够通过互补性碱基配对结合前mRNA分子上的剪接供体位点(Horowitz等人,1994)。图1显示了野生型U1snRNA结构的示意图。显示了5’区域中能够识别剪接供体位点的序列与真核基因的初级转录物中的剪接供体位点的共有序列配对。这一序列表现出不同程度的保守,且位于外显子/内含子连接处。由U1snRNA5’区域介导的识别对于界定初级转录物上的外显子/内含子连接位点和剪接体复合物的正确组装是关键的。渐增数目的与前mRNA剪接缺陷相关联的人类遗传疾病,及其临床过程的常见的严重度,在过去几年刺激着针对在分子水平上纠正剪接缺陷的治疗分子的研究。PinottiM等人2008和PinottiM等人,2009中描述了在突变位于5’剪接位点的情况下,能够在体外引起正确的外显子增加并恢复凝血因子VIImRNA的正确剪接的修饰的U1snRNA分子的应用。所示的机制基于修饰的U1snRNA在5’突变的剪接位点上的直接识别和结合。然而,由于5’剪接位点的相对保守和随之而来的干扰从其他功能性野生型基因生成的转录物的成熟的风险,该方法出现治疗snRNA分子对靶基因的一定程度的非特异性作用。并且,其需要使用对5’剪接位点中的每个突变修饰的U1snRNA。
技术实现要素:
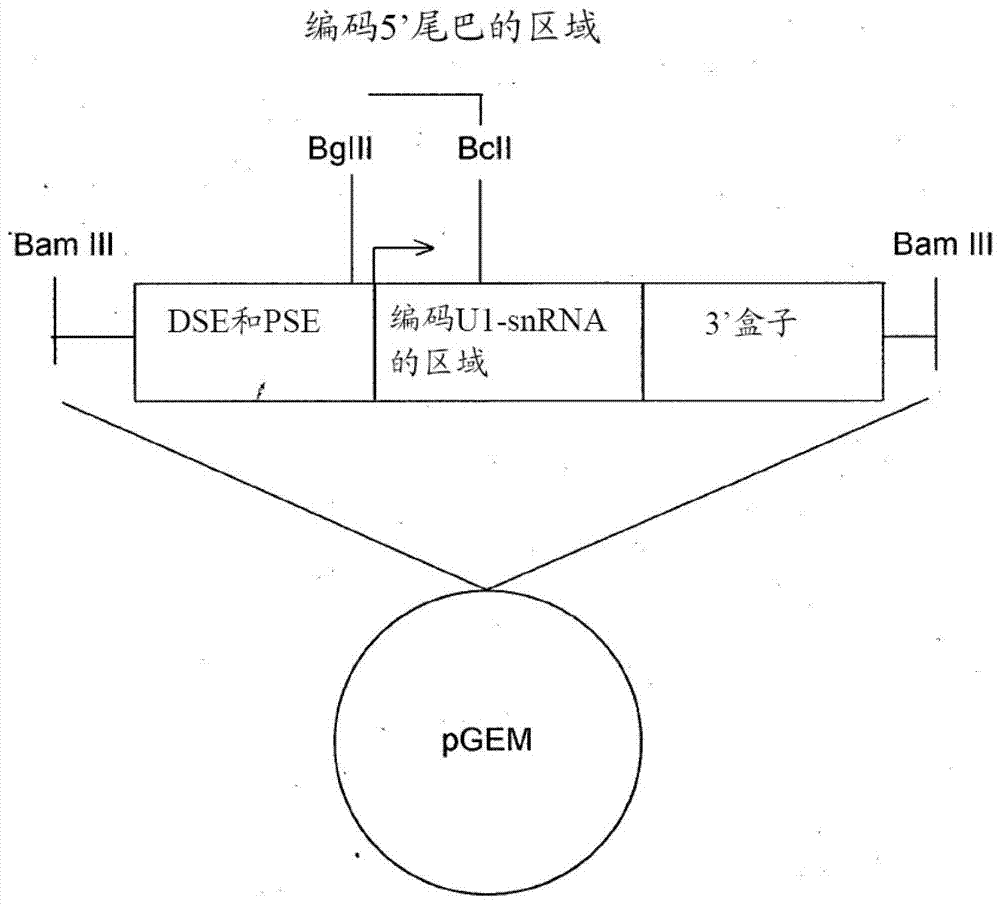
本发明表明了与5’剪接位点的下游内含子序列互补的修饰的U1snRNA(且本文定义为外显子特异性U1,ExSpeU1),在剪接过程中,能够恢复被不同类型的突变损害的外显子增加。在三种治疗感兴趣的不同的人类遗传疾病模型中(脊髓型肌萎缩,血友病和囊性纤维化),本发明表明了,单独的ExSpeU1或ExSpeU1的组能够引起每种疾病模型的相应外显子的增加。单独的ExSpeU1或ExSpeU1的组纠正了由供体位点中的突变、受体位点的多嘧啶区域中的突变和调控外显子序列中的突变导致的外显子遗漏。利用ExSpeU1获得的纠正有效性与现有技术中所描述的相同,但其可能保证对治疗感兴趣的靶基因转录物的作用的更高的选择性。ExSpeU1方法允许使用单独的修饰的U1-snRNA以用于纠正导致外显子遗漏的一套组不同的基因突变。这些和其他目的通过如权利要求1中所定义的修饰的人类U1snRNA分子来达到。修饰的人类U1snRNA分子特征在于野生型人类U1snRNA的5’区域中的部分单链核苷酸序列被能够与治疗感兴趣的含引起异常剪接的突变的靶基因的初级转录物上的靶核苷酸序列杂交的结合单链核苷酸序列所替换。U1snRNA分子的靶核苷酸序列位于由外显子/内含子连接位点(5’剪接位点)的下游2至50个碱基对构成的前mRNA的区域,条件是靶核苷酸序列不包括所述外显子/内含子连接位点。优选地,靶核苷酸序列长度为5至50个核苷酸,更优选地为9至30个核苷酸。与现有技术相比较,本发明的U1snRNA分子主题具有进行靶向的和选择性的(外显子特异性的)作用的优点,因为其结合位于剪接供体位点侧翼的内含子区域中的初级转录物上的靶核苷酸序列,其与外显子/内含子连接位点的序列相比较表现出较低程度的保守。然而,令人惊奇地是,尽管在不包括外显子/内含子连接位点的靶序列上运作,本发明的U1snRNA分子仍然能够在存在包括外显子突变或受体位点上的突变的不同类型的突变时引起外显子的增加。本发明的另外的特征在所附权利要求中定义,其为构成本说明书的技术教导的整体必需的部分。在一个优选的实施方案中,被结合核苷酸序列所替换的野生型U1snRNA的单链5’区域的部分长度为9至12个核苷酸。优选地,被ExSpeU1所纠正的和导致外显子遗漏的突变位于由内含子/外显子连接位点(3’剪接位点)的上游3至50个碱基对构成的序列,外显子突变和剪接供体位点的共有序列中的突变。通过举例的方式在治疗感兴趣的基因中监测凝血因子IX,SMN2和CFTR基因,其为含有与使其利用本发明的ExSpeU1来治疗的疾病相关的突变的那些基因。在一个优选的实施方案中,本发明的修饰的人类U1snRNA分子包括选自由SEQIDNO:1至11,更优选地从SEQIDNO:1至10组成的组的结合核苷酸序列。在一个优选的实施方案中,基因包括启动子序列和聚腺苷酸化信号序列。虽然其他自身已知的容易被本领域中的普通技术人员选择的启动子也可被使用,但是本发明人证实了编码人类U1snRNA的基因的内源性启动子是尤其适宜的。下文通过举例的方式叙述了野生型人类U1snRNA编码基因的正链的序列(在序列表中定名为SEQIDNO:12),其中单链5’区域在修饰的U1snRNA分子中被结合序列所替换的部分为粗体。用于插入结合序列的独特的BglII和BclI限制位点的序列以下划线显示。除以大写字母显示的RNA编码区域外,SEQIDNO:12基因序列还包括其表达所需的一些调控元件,比如启动子和聚腺苷酸化信号。5’-taaggaccagcttctttgggagagaacagacgcaggggcgggagggaaaaagggagaggcagacgtcacttccccttggcggctctggcagcagattggtcggttgagtggcagaaaggcagacggggactgggcaaggcactgtcggtgacatcacggacagggcgacttctatgtagatgaggcagcgcagaggctgacgtcttcgccacttgctgcttcaccacgaaggagttcccgtgccctgggagcgggttcaggaccgctgatcggaagtgagaatcccagctgtgtgtcagggctggaaagggctcgggagtgcgcggggcaagtgaccgtgtgtgtaaagagtgaggcgtatgaggctgtgtcggggcagaggcccaagatctgATACTTACCTGGCAGGGGAGATACCATGATCACGAAGGTGGTTTTCCCAGGGCGAGGCTTATCCATTGCACTCCGGATGTGCTGACCCCTGCGATTTCCCCAAATGTGGGAAACTCGACTGCATAATTTGTGGTAGTGGGGGACTGCGTTCGCGCTTTCCCCTGactttctggagtttcaaaagtagactgtacgctaa-3’(SEQIDNO:12)明显地,仅以举例的方式提供了以上的基因序列。可选地,为构建编码本发明的修饰的U1snRNA的基因,可使用与SEQIDNO:12同源的任何基因序列,即能够编码能够有效地介导剪接供体位点的识别的U1snRNA的基因序列。在实施例的章节中详细描述了含有不同的结合序列的本发明的不同的修饰的U1snRNA分子主题的制备方法。本发明的又一个另外的目的是包括如先前所定义的分离的基因的表达载体。虽然本身已是本领域中的普通技术人员熟知的其他类型的表达载体也可使用,但是通常优选的表达载体是腺相关病毒载体。如先前所描述的,修饰的人类U1snRNA分子,编码所述RNA分子的基因和包括所述基因的载体适用于由异常剪接导致的或与异常剪接相关联的并以外显子遗漏为特征的遗传疾病的治疗性处理。优选地,但非以限制性方式地,所述疾病是囊性纤维化、乙型血友病或脊髓型肌萎缩。为达到该目的,将修饰的U1snRNA分子、所述基因和/或所述载体配制到药物组合物中,所述药物组合物除治疗活性分子外还包括药学上可接受的载体。载体和任选的药物赋形剂的选择是本领域中的普通技术人员所熟知的。本发明的另一方面是用于在培养的细胞中恢复治疗感兴趣的含有引起异常剪接的突变的靶基因的正确剪接的体外方法,所述体外方法通过用如先前所定义的表达载体转染培养的细胞来进行。本发明的修饰的U1snRNA分子主题通过利用本领域中的普通技术人员熟知的常规分子生物学方法来生成。为评估本发明的U1snRNA主题对纠正异常剪接过程的作用,和为鉴定最有效的那种,本发明人广泛使用了微基因方法,该方法的应用在科学文献中广泛记载。这一方法包括将含有导致剪接缺陷的突变的基因部分克隆到表达载体中,且然后将重组载体转染到体外培养的细胞中。通过RT-PCR对源自感兴趣的基因的部分的转录物进行分析,从而允许鉴定来源于异常剪接过程的长度异常的mRNA分子。修饰的U1snRNA与微基因的共转染之后正常长度的感兴趣的转录物的出现及其测序,代表了U1snRNA分子恢复正确的剪接过程的能力的明确指示。然而,正确信使RNA加工的恢复和具有实际治疗意义的最终蛋白水平的恢复之间的类推还不明确。为此,本发明人使用了杂交微基因方法,其允许剪接和所表达的蛋白的研究。该方法由本发明人引入以研究凝血因子VII中的剪接突变(Pinotti等人,2009)。这一方法包括将整个编码序列中的在含有导致剪接缺陷的突变的区域中包含一些内含子的基因的部分克隆到表达载体中(“剪接胜任cDNA构建体”),并随后将重组载体转染到体外培养的细胞中。通过RT-PCR对源自感兴趣的基因的部分的转录物进行的分析,以及合成的蛋白的水平和活性的测量允许对生物功能的恢复的评估。通过示例的方式提供了以下的实施例,且并不限制所附权利要求中所定义的本发明的范围。具体实施方式实施例1:修饰的U1snRNA的生成通过以下程序生成修饰的U1snRNA:用BglII和BclI限制酶消化包含野生型U1-snRNA基因的序列,即未修饰的U1-snRNA的质粒。用含有结合序列的双链寡核苷酸替换由该两个限制位点之间构成的序列。以下表1中描述了每个寡核苷酸的正向序列和反向序列,并以所用的寡核苷酸来命名所得的修饰的U1-snRNA。并且,图2显示了U1snRNA基因元件的示意图。标示了通过其制备不同的修饰的U1snRNA的克隆策略。图2显示了插入到质粒载体(pGEM)中的具有启动子元件DSE和PSE,编码U1snRNA的区域(在中部),和3’加工盒的U1snRNA基因。转录起始位点以箭头示出。BglII和BclI限制位点之间的序列包括编码单链U1snRNA尾巴的区域,其已被用于特异性生成表1中所示的修饰的U1snRNA的寡核苷酸所替换。表1实施例2:将微基因转染到培养细胞中并分析剪接产物通过利用Lipofectamine(脂质体)进行瞬时转染将包含载体插入到细胞中。在用Trizol提取总细胞RNA后,用特异性的引物通过RT-PCR分析RNA。反应在两步中发生:利用随机引物作为模板通过逆转录酶将RNA逆转录为cDNA链,和通过DNA聚合酶扩增所得的cDNA。在终体积25μl的混合物中进行PCR反应,该混合物包含:-5μl的AMV/Tfl5x缓冲液,适宜于上述两种酶正确行使功能;-1μl的10mMdNTP混合物;-50pmol的正向引物和50pmol的反向引物;-2μl的25mMMgSO4;-2μl的细胞提取的RNA;-1μl的AMV-RT(0.1μ/μl),1μl的TflDNA聚合酶;-适量的超纯H2O逆转录步骤在45℃下进行4...
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 靶向脑胶质瘤的双重修饰脂质体给药系统的制备和应用的制作方法与工艺
- 一种基于强电荷修饰的靶向基团作为药物包覆剂的设计方法与流程
- 用于靶向遗传修饰的方法和组合物,以及这些组合物的使用方法与流程
- DUOX2修饰的DC疫苗及其靶向杀伤胰腺癌起始细胞的应用的制造方法与工艺
- 用于猪APN基因编辑的靶向sgRNA、修饰载体及其制备方法和应用与流程
- 脑部引经药修饰的脑靶向纳米给药系统及其制备方法与流程
- 肿瘤抑制基因的杂合修饰和1型神经纤维瘤病的猪模型的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 用于通过单步多重靶向进行靶向遗传修饰的方法和组合物与流程
- 导致单性结实坐果的经修饰的基因的制造方法与工艺
- 一个太子参环肽HB前体蛋白基因及其应用的制作方法与工艺
- 一种新型小分子肽和其在阿尔兹海默症检测中的应用的制作方法与工艺
- 一种脱脂豆粕制备小分子蛋白肽猪饲料的优化工艺的制造方法与工艺
- 两亲性温敏型聚肽嵌段共聚物分子刷及其制备方法和应用与流程
- 两个小分子肽及其制备方法和在制备抗病毒药物中的应用与流程
- 杀虫基因PPTX-15及其编码的杀虫肽与应用的制造方法与工艺
- 可溶性通用的增强ADCC的合成融合基因和融合肽的技术及其应用的制造方法与工艺
- 修饰的人类U1snRNA分子、编码修饰的人类U1snRNA分子的基因、包括该基因的表达载体及其在基因治疗中的用途的制造方法与工艺
- 黑框蟾蜍抗氧化肽及其基因和在制药中的应用的制造方法与工艺
- 一种抗凝肽重组分子、其制备方法及应用与制造工艺