一种酶法合成L‑茶氨酸的方法与流程
一种酶法合成L-茶氨酸的方法技术领域本发明涉及一种L-茶氨酸的合成方法,具体是一种利用微生物酶以L-谷氨酰胺和乙胺盐酸盐为底物制备L-茶氨酸的方法,属于生物工程技术领域。
背景技术:
茶氨酸,又称(C7H14O3N2,又称γ-谷氨酰乙胺),是存在于绿茶中的一种非必须氨基酸,也是茶叶的重要风味物质。饮茶一直以来被人誉为有益身心,放松明智的健康食品,近年来,越来越多的科学研究证明了茶氨酸是绿茶中的活性物质之一,在生理和药理方面有减轻精神压力、提高认知行为和学习能力、抑制肥胖、减低血压、增强免疫力以及防止肿瘤发生的作用。因此,茶氨酸在饮料、功能食品、功能药物等方面有着广泛需求。茶氨酸的主要生产方法有直接提取法、化学合成法和生物法。传统工业中,人们通过通过萃取等手段从干绿茶叶片中直接提取茶氨酸,但由于在干茶叶中,茶氨酸含量仅为茶叶重量的1.5%~2%,因此,此法得率低、成本高,不适于大规模工业化生产。随着工业化的发展,人们发明了化学合成法生产茶氨酸的工艺,化学合成法只要分为三条合成路线:(1)吡咯烷酮酸(焦谷氨酸)法,即用L-吡咯烷酮酸和乙胺生成茶氨酸。主要代表有:1942年,以色列人N.Lichtenstein首次在实验室中用乙胺和L-吡咯烷酮酸在水溶液中反应,合成茶氨酸,但收率低。1951年,日本人桥爪斌改进了合成方法,用L-吡咯烷酮酸和无水乙胺在低温下反应,提高了反应收率。1961年,Yamada等人将L-吡咯烷酮酸先生成铜盐后与纯乙胺反应,利用反应物与生成物的溶解度差异,提高差率。2004年,陈新等人通过营造惰性环境,使L-茶氨酸收率达58%。(2)N-取代的谷氨酸酯的乙胺解反应产生N-取代茶氨酸。(3)N-取代的谷氨酸酐法。该法先利用保护基将谷氨酸的α-氨基保护起来使其分子内脱水形成环状谷氨酸酐后,直接与乙胺作用生产N-取代茶氨酸,再除去保护集团获得茶氨酸。化学合成法主要存在反应时间长、收率低等缺点,同时由于需要采用高压、惰性气体保护和保护集团等方式,增加生产成本。近年来,微生物酶法成为茶氨酸合成新趋势。酶法生产茶氨酸主要利用细菌来源的谷氨酰胺酶、谷氨酰胺合成酶和γ-谷氨酰转肽酶。实例如下:(1)谷氨酰胺酶:1998年,TachikiT等人利用PseudomonasnitroreducensIFO12694来源的谷氨酰胺酶,利用700mML-谷氨酰胺和1.5M乙胺在30℃,pH11下7小时,获得38.57%的底物转化率;随后,AbelianVH等人利用PseudomonasnitroreducensIFO12694的固定化细胞进行连续生产,实现了95%的底物转化率;但多数谷氨酰胺酶的最适作用pH在中性,存在在碱性条件下酶的稳定性差,同时酶的热稳定性不佳等缺点;(2)谷氨酰胺合成酶:利用合成酶进行茶氨酸的生产要消耗能量,因此,Yamamoto等人利用PseudomonastaetrolensY-30来源的谷氨酰胺合成酶与啤酒酵母中的糖酵解途径中相关酶偶联,形成ATP再生系统生产茶氨酸,以200mM谷氨酸钠盐和600mM的乙胺反应,获得85%的底物转化率;谷氨酰胺合成酶的应用需要提供额外ATP功能,反应只能在细胞中进行,反应周期长达数十小时,使用受到限制;(3)γ-谷氨酰转肽酶:2002年,日本人H.Suzuki等首次利用大肠杆菌来源的γ-谷氨酰转肽酶在水溶液欧诺中以L-谷氨酰胺和乙胺为底物,获得60%底物转化率;帅玉英等利用从中国传统发酵食品中分离筛选得到的BacillussubtilisSK11.004的γ-谷氨酰转肽酶,以20mM谷氨酰胺和200mM的乙胺反应,获得80%的底物转化率,应用γ-谷氨酰转肽酶进行茶氨酸生产具有反应过程简单,反应时间短等优点,但存在转化率不高,野生酶发酵酶活力低等缺点,在高底物浓度下的应用研究较少,阻碍其工业化应用过程。目前为止,利用微生物来源或基因工程来源的γ-谷氨酰转肽酶作为催化剂、在适宜工业生产规模的高底物浓度下进行茶氨酸生产获得较高底物转化率的例子还未见文献报道。
技术实现要素:
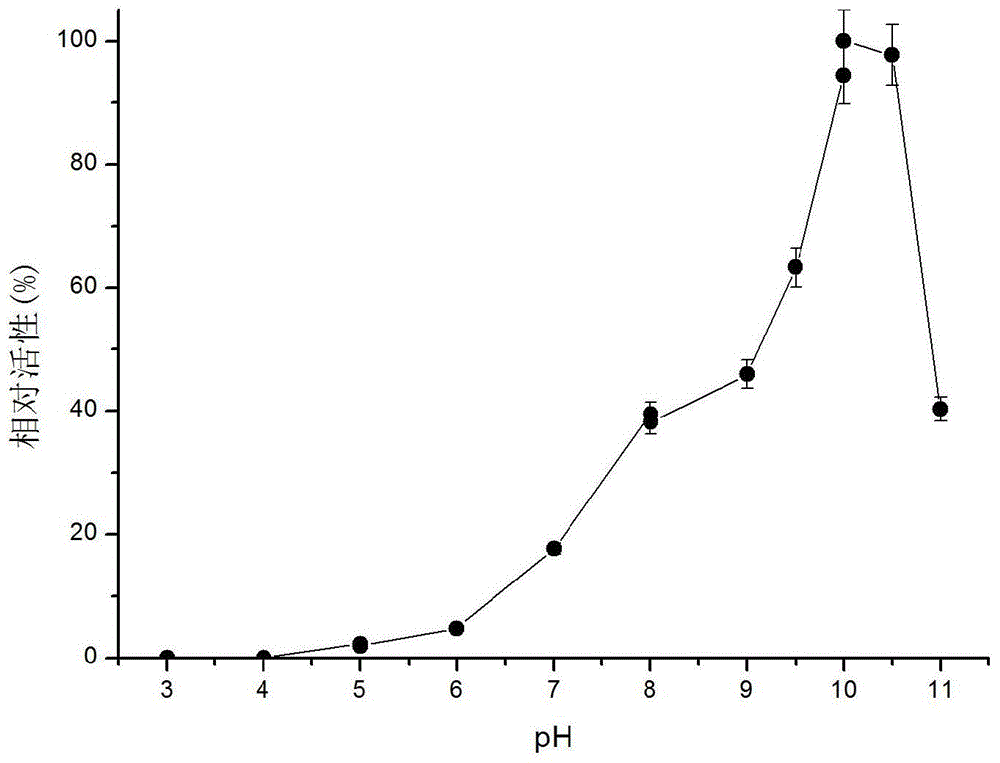
本发明要解决的技术问题是提供一种酶法合成L-茶氨酸的方法,包括以下步骤:(1)以高产γ-谷氨酰转肽酶的基因工程菌发酵生产γ-谷氨酰转肽酶;(2)以发酵所得粗酶液或浓缩酶液为催化剂,以L-谷氨酰胺和乙胺盐酸盐为底物合成L-茶氨酸。所述高产γ-谷氨酰转肽酶的基因工程菌,是将枯草芽孢杆菌168的γ-谷氨酰转肽酶基因在大肠杆菌BL21(DE3)中重组表达获得,包括以下步骤:(1)根据NCBIGeneID:940001所示的基因序列,通过化学合成法得到γ-谷氨酰转肽酶基因;(2)将目的基因扩增后通过割胶回收,与pMD18-Tsimple载体连接,转化大肠杆菌JM109,获得质粒ggt/pMD18-Tsimple,将质粒测序验证;(3)将测序正确的质粒ggt/pMD18-Tsimple载体和pET20b(+)空载体进行双酶切,割胶回收ggt基因片段和pET20b(+)线性载体片段后将两片段连接并转化大肠杆菌JM109,获得质粒ggt/pET20b(+);(4)将质粒ggt/pET20b(+)转化大肠杆菌BL21(DE3),获得ggt-pET20(b)/E.coliBL21(DE3)。所述以高产γ-谷氨酰转肽酶的基因工程菌发酵生产γ-谷氨酰转肽酶,包括以下步骤:将基因工程菌ggt-pET20(b)/E.coliBL21(DE3)接种于含有Amp的LB液体培养基,37℃下培养8~10h;以5%接种量转接至含0.75%甘氨酸的TB(含Amp)液体培养基,37℃培养3h;用0.4mM/LIPTG诱导,降温至25℃恒温培养40~48h诱导产酶,发酵结束后,离心收集上清液,即为粗酶液。所述催化反应是在反应器中分别添加L-谷氨酰胺和乙胺盐酸盐,用乙胺水溶液65%~70%(CP)调节pH,加入发酵所得粗酶液或浓缩酶液,在200rpm的水浴摇床中进行反应。所述L-谷氨酰胺的初始浓度为20mM~1000mM。所述乙胺盐酸盐的初始浓度为0.5M~5M。所述重组γ-谷氨酰转肽酶的浓度为0.2U/ml~9.0U/ml。所述反应在pH9.5~10.5、37~50℃下反应2~5h。本发明通过选择高底物转化率的菌株进行异源表达,获得单位酶活较高的发酵酶液,弥补了野生菌酶活单位低的缺点,为低成本大量制酶奠定基础。同时,本发明获得的γ-谷氨酰转肽酶在碱性pH反应条件下具有良好的活性和稳定性,同时,热稳定性良好,在50℃下半衰期高达130h,弥补了其他酶种在碱性反应条件下稳定性差的缺点。用该酶进行酶反应生产茶氨酸,具有反应方法简便、不需要提供额外生物能量、反应时间短等优点,在不同底物浓度下,均能得到对应底物浓度下的高底物转化率,为工业化放大生产奠定基础。附图说明图1重组酶在50℃下的温度稳定性图2重组酶的最适pH图3重组酶的pH稳定性具体实施方式实施例1:ggt-pET20b(+)/E.coliBL21(DE3)的构建(1)根据NCBI上枯草芽孢杆菌168的γ-谷氨酰转肽酶基因(NCBIGeneID:940001)序列,通过化学合成得到γ-谷氨酰转肽酶基因,以此基因为模版,设计引物P1、P2,P1:5’–ATCCATGGATAAAAAACCGCCCAAAAGCTACGA–3’(下划线为酶切位点NocI),P2:5’–GGCGCTCGAGTTATTTACGTTTTAAATTAATGC–3’(下划线为酶切位点XhoI),通过PCR扩增基因。PCR体系为50μl,PCR程序为:94℃预变性4min,后以“98℃保温10s,55℃保温5s,72℃保温120s“的程序循环30次,最后在72℃保温10min。扩增得到的目的片段通过胶回收、纯化后与pMD18-Tsimple载体连接。连接产物通过化学转化大肠杆菌JM109后,将转化混合物涂布于含100mg/L的氨苄青霉素抗性LB平板,37℃培养6~8h,挑取单菌落在LB/Amp液体培养基中培养8~10h后提取质粒测序验证,验证结果正确。(2)将测序正确的重组质粒ggt/pMD18-T和表达载体pET-20b(+)用NocI和XhoI进行双酶切后,通过胶回收ggt基因片段和pET-20b(+)线性质粒,并用T4连接酶连接过夜,将连接产物转化大肠杆菌JM109,通过涂布,液体培养,提取质粒,获得pET-20b(+)/ggt质粒;(3)将pET-20b(+)/ggt质粒通过化学转化大肠杆菌BL21(DE3),将转化混合物涂布于含100mg/L的氨苄青霉素抗性LB平板后挑取转化子,37℃培养6~8h,挑取单菌落在LB/Amp液体培养基中培养8~10h后进行菌种保藏。实施例2:发酵产酶(1)发酵培养将实施例1中获得的基因工程菌ggt-pET20(b)/E.coliBL21(DE3)接种于LB/Amp液体培养基中在37℃下培养8~10h后以5%接种量转接至含0.75%甘氨酸的TB/Amp液体培养基,在37℃培养3h后用0.4mM/LIPTG(异丙基硫代-β-D半乳糖苷)诱导,降温至25℃恒温培养40~48h诱导产酶。发酵结束后,离心收集上清液即为粗酶液。(2)酶活测定以γ-谷氨酰对硝基苯胺(γ-GpNA)和双甘二肽(Gly-Gly)为底物进行颜色反应。酶活测定体系为1mL(含终浓度为5mmol/Lγ-谷氨酰对硝基苯胺(γ-GpNA),80mmol/L双甘二肽(Gly-Gly),50mM硼砂-NaOH缓冲液,pH10),在37℃下加入20μL适当稀释的酶液反应5min后,加入4M醋酸溶液400μl终止反应,在分光光度计410nm处测定吸光值。该条件下每分钟生成1μmol对硝基苯胺的酶量所需的酶量定义为一个酶活单位(U)。对硝基苯胺标准曲线的绘制:配制0.25mmol/L对硝基苯胺标准样品,用50mmol/L硼砂-NaOH(pH10)缓冲液稀释成浓度为0.125、0.0625、0.03125、0.015625mmol/L的溶液,用分光光度计于λ=410nm测定吸光值。以不同对硝基苯胺的浓度值为横坐标,吸光值为纵坐标,绘制对硝基苯胺的标准曲线。测定结果显示,发酵上清液中酶活达80U/ml。实施例3:粗酶液的浓缩将实施例2中获得的酶液边搅拌边缓慢加入浓度为相对于酶液质量分数60%的硫氨酸,搅拌至硫氨酸溶解,在4℃条件下静置8~10小时沉淀蛋白。混合物经离心(8000rpm,10min)收集沉淀,再用最小体积的50mMTris-HCl缓冲液(pH8)复溶,复溶后经过再次离心除去固形物,收集上清获得浓缩酶液。根据复溶体积的差异,浓缩酶液酶活在300~400U/ml。实施例4:粗酶液温度稳定性的研究将一定体积保存于Tris-HCl缓冲液(50mM,pH8.0)中的酶液(总蛋白含量约1mg/ml,纯酶约0.5mg/ml)在50℃下保温,间隔一定时间取样测定残余酶活。由图1可知,该酶在50℃下半衰期约130h。此外,在30℃和40℃下进行温度稳定性研究,保温1周后残余酶活大于90%。实施例5:粗酶液最适pH和pH稳定性的研究将适度稀释的粗酶液置于不同pH缓冲液(磷酸钾缓冲液,50mM、pH5.0-8.0;Britton-Robinson缓冲液,50mM、pH8.0-10.0;硼酸-NaOH缓冲液,50mmM、pH10.0-11.0)中进行酶活测定,研究重组酶的最适pH,由图2可知,该酶最适pH为10,与酶反应生产茶氨酸最适pH相适应。将粗酶液(总蛋白含量约1mg/ml,纯酶约0.5mg/ml)调节至不同pH,室温下保存24h,测定酶的残余酶活。由图3可知,该酶在pH5~pH8条件下残余酶活大于90%,在pH9~12条件下残余酶活大于80%,但在酸性条件不稳定。实施例6:HPLC检测L-茶氨酸的产量在反应器中加入一定浓度的L-谷氨酰胺溶液、乙胺溶液和酶液,37℃反应一定时间后,取样并加入同体积的三氯乙酸溶液(10%,v/v)终止反应并沉淀蛋白,沉淀4小时后将样品12000rpm离心10min,取上清液适度稀释后用0.45μm超滤膜过滤,并进行HPLC分析。由于大多数氨基酸无紫外吸收也无荧光发射特性。为提高分析测试灵敏度和分离度,通常需要进行衍生化,采用领苯二甲醛(OPA)作为衍生化试剂对样品进行柱前衍生,衍生化过程参考安捷伦公司ZorabaxEclipse-AAA氨基酸柱分析时使用的指导方法,可对底物L-谷氨酰胺、产物L-谷氨酰胺以及副产物L-谷氨酸进行定量分析。色谱条件如下:Agilent1200HPLC色谱仪,Agilent自动进样器,EclipseXDB-C185μm(4.6mm×150mm),LC-9A紫外检测器;流动相(V/V)为无机盐相和有机相双相梯度洗脱,流速0.8mLmin-1;柱温40℃。实施例7:酶法制备L-茶氨酸在反应器中投入终浓度为20mM的L-谷氨酰胺和0.5M的乙胺盐酸盐,用乙胺水溶液65%~70%(CP)将pH调节到10,加入0.2U/ml实施例2中获得的粗酶液或实例3中获得的浓缩酶液,在37℃,200rpm的水浴摇床中反应4小时,反应结束后,采用实施例6中样品处理方法处理样品,在高效液相色谱系统分析检测L-谷氨酰胺、L-谷氨酸和L-茶氨酸的量,L-茶氨酸对底物L-谷氨酰胺的摩尔转化率达89%。实施例8:酶法制备L-茶氨酸在反应器中投入终浓度为200mM的L-谷氨酰胺和2.2M的乙胺盐酸盐,用乙胺水溶液65%~70%(CP)将pH调节到10,加入3.0U/ml实施例3中获得的酶液,在50℃,200rpm的水浴摇床中反应2小时,反应结束后,采用实施例6中用样品处理方法处理样品,用高效液相色谱系统分析检测显示L-茶氨酸对谷氨酰胺的摩尔转化率为75%。实施例9:酶法制备L-茶氨酸在反应器中投入终浓度为0.5M的L-谷氨酰胺和3M的乙胺盐酸盐,用乙胺水溶液65%~70%(CP)将pH调节到10,加入6.0U/ml实施例2中获得的酶液,在40℃,200rpm的水浴摇床中反应5小时,反应结束后,采用实施例6中用样品处理方法处理样品,用高效液相色谱系统分析检测显示L-茶氨酸对谷氨酰胺的摩尔转化率为58%。实施例10:酶法制备L-茶氨酸在反应器中投入终浓度为1M的L-谷氨酰胺和5M的乙胺盐酸盐,用乙胺水溶液65%~70%(CP)将pH调节到10,加入9.0U/ml实施例2中获得的酶液,在37℃,200rpm的水浴摇床中反应5小时,反应结束后,将反应液pH调至弱酸性。采用实施例6中用样品处理方法处理样品,用高效液相色谱系统分析检测显示L-茶氨酸对谷氨酰胺的摩尔转化率为45%。虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1