一种血管紧张受体拮抗剂和中性内肽酶抑制剂复合物的制作方法与工艺
本发明涉及一种血管紧张受体拮抗剂和中性内肽酶抑制剂的复合物,及其制备方法、用途,具体而言,涉及[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]钙钠复合物,特别是涉及[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaXNaY·ZH2O,其中:X=1~3、Y=12~16、Z=9~18、且2X+Y=18,及其制备方法及其用于制备治疗慢性心力衰竭药物中的用途。
背景技术:
心力衰竭主要临床表现为呼吸困难和乏力,以及液体潴留(肺淤血和外周水肿)。对于这类患者需要每日测定体重。已早期发现液体潴留症状,对于生活方式和饮食的调整需要做到限钠限水。心衰患者减少钠的摄入,有利于减少血容量,减轻体内水钠潴留,降低血压,利于心力衰竭患者症状缓解。文献报道,慢性心力衰竭是一种进行性心脏功能损害,泵功能障碍的主要原因是心室肌细胞收缩能力的进行性减退。在慢性心力衰竭过程中,心肌细胞的钙稳态平衡遭到破坏,表现为胞内钙瞬变减小和衰减减慢。这种变化被认为是慢性心力衰竭心肌收缩能力减退的主要原因。因此,增加钙的摄入,可改善水钠潴留和血压,同时维持心肌正常收缩能力。此外,钙离子还是机体各种生理活动不可缺少的离子,它对于维持细胞膜两侧的生物电位,维持正常的神经传导功能,维持正常的肌肉伸缩与舒张功能等具有重要的生理作用。LCZ696(Entresto)是诺华开发的血管紧张素受体脑啡肽酶抑制剂(ARNi),于2015.07.08获得FDA批准,用于射血分数降低的慢性心力衰竭患者,可以降低心血管死亡和心衰住院风险。LCZ696为Sacubitril(AHU-377)和缬沙坦以1:1比例形成的三钠半五水超分子络合物,专利CN200680001733.0保护了超分子络合物三钠半五水及晶型。但本申请发明人经过研究发现,该盐具有很强的引湿性,在高湿条件下放置十天后吸湿为液态。众所周知,吸湿性太强容易导致制剂过程不易制粒,崩解溶出困难等缺陷,最终可能影响产品的有效性、稳定性,且对辅料、制剂生产工艺和药品的保存条件要求更高。因此,开发一种引湿性弱、稳定性更好的对有效提高心肌细胞的钙稳态平衡、药效的新化合物显得尤为重要。
技术实现要素:
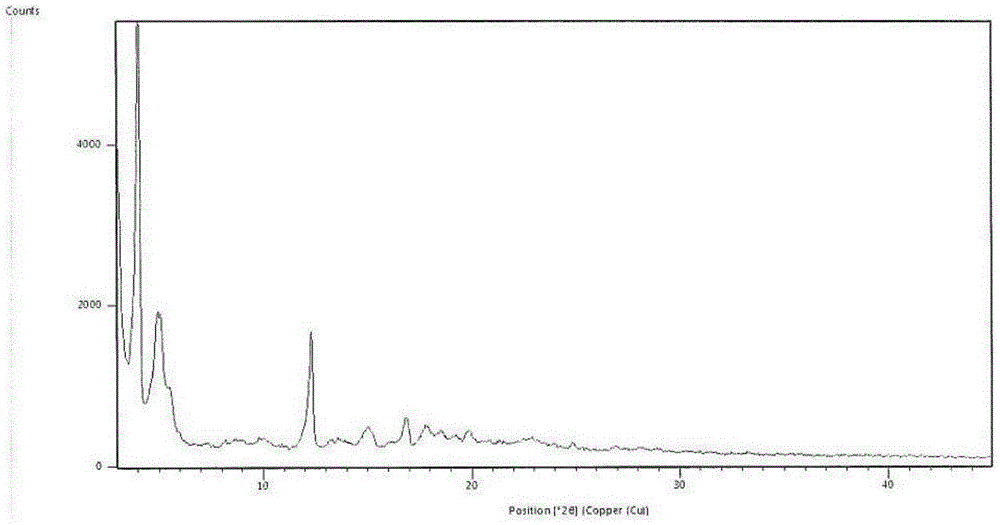
本发明在获得本申请技术方案前,开展了大量的筛选实验,并至少完成了以下研究:1、研究分析了生成[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]钾盐的可能性,但最终经过分析发现不能形成复合盐,而是形成了缬沙坦的钾盐;2、研究分析了钠钾复合物,最终发现复合物中测量钠含量发现其接近LCZ696的钠含量,复合物中未检测到有钾离子,故最终未获得钠钾复合物;3、研究分析了[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]有机碱共晶,如铵离子、三乙醇胺和哌嗪等,但均无法获得结晶固体;4、研究分析了[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]的钙盐复合物,但发现无法获得该复合物;通过上述大量试验筛选,最终获得稳定的[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]的钙钠复合物。本发明提供了一种[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]钙钠复合物,其制备方法及其用于制备治疗慢性心力衰竭药物中的用途。进一步的,本发明钙钠复合物的组成为[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaXNaY·ZH2O,其中:X=1~3、Y=12~16、Z=9~18、且2X+Y=18。优选,X、Y、Z均为整数。具体结构如下所示:其中:X=1~3、Y=12~16、Z=9~18、且2X+Y=18。优选,X、Y、Z均为整数。进一步的,所述的复合物组成中X=1、Y=16、Z=9~18;优选,所述的复合物组成中X=1、Y=16、Z=12~18。进一步优选,复合物组成中当X=1、Y=16时,Z=12、15或18。最优选,当X=1、Y=16时,Z=15。或者,进一步的,所述的复合物组成中X=2、Y=14、Z=9~18;优选,所述的复合物中X=2、Y=14、Z=9~15。进一步优选,复合物组成中当X=2、Y=14时,Z=12、15或9。最优选,当X=2、Y=14时,Z=15。或者,进一步的,所述的复合物组成中X=3、Y=12、Z=9~18;优选,所述的复合物中X=3、Y=12、Z=9~15;进一步优选,复合物组成中当X=3、Y=12时,Z=12、15或9。最优选,当X=3、Y=12时,Z=15。或者,复合物的组成中X=1、Y=16、Z=9;或者X=1、Y=16、Z=12;或者X=1、Y=16、Z=15;或者X=1、Y=16、Z=18;优选X=1、Y=16时,Z=12、15或18。或者,复合物的组成中X=2、Y=14、Z=18;或者X=2、Y=14、Z=15;或者X=2、Y=14、Z=12;或者X=2、Y=14、Z=9。优选X=2、Y=14、Z=9、12、15。或者,复合物的组成中X=3、Y=12、Z=18;或者X=3、Y=12、Z=15;或者X=3、Y=12、Z=12;或者X=3、Y=12、Z=9。优选当X=3、Y=12时,Z=9、12、15。进一步的,上述复合物优选为结晶形式。复合物1的结晶形式:复合物[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaXNaY·ZH2O,其中X=1、Y=16、Z=15,该复合物优选为结晶形式,定义为复合物1的结晶形式,使用Cu-ka射线进行X射线粉末测定,其图谱具有下表所示衍射角、晶面间距和相对强度:其中,2θ衍射角的误差为±0.2。进一步的,复合物1的结晶形式具有下表所示衍射角、晶面间距和相对强度:其中,2θ衍射角的误差为±0.2。更进一步的,复合物1的结晶形式具有基本如附图1所示的X射线粉末衍射图谱。复合物物2的结晶形式:复合物[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaXNaY·ZH2O,其中X=2、Y=14、Z=15该复合物优选为结晶形式,定义为复合物2的结晶形式,使用Cu-ka射线进行X射线粉末测定,其图谱具有下表所示衍射角、晶面间距和相对强度:其中,2θ衍射角的误差为±0.2。进一步的,复合物2的结晶形式具有下表所示衍射角、晶面间距和相对强度:其中,2θ衍射角的误差为±0.2。更进一步的,复合物2的结晶形式具有基本如附图2所示的X射线粉末衍射图谱。复合物3的结晶形式:复合物[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaXNaY·ZH2O,其中X=3、Y=12、Z=15该复合物优选为结晶形式,定义为复合物3的结晶形式,使用Cu-ka射线进行X射线粉末测定,其图谱具有下表所示衍射角、晶面间距和相对强度:其中,2θ衍射角的误差为±0.2。进一步,复合物3的结晶形式具有下表所示衍射角、晶面间距和相对强度:其中,2θ衍射角的误差为±0.2。更进一步的,所述组成为复合物3的结晶形式具有基本如附图3所示的X射线粉末衍射图谱。本发明的另一目的是提供一种[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaXNaY·ZH2O,其中:X=1~3、Y=12~16、Z=9~18、且2X+Y=18,的制备方法,其特征在于,包括以下步骤:(1)AHU-377和AHU-377的钙盐用丙酮溶解搅拌30min至澄清;(2)将缬沙坦或缬沙坦钠盐加入上述溶液内,搅拌至完全溶解;配制NaOH的水溶液,在5min内滴加到体系中,并保持匀速搅拌。约在20-30min内逐渐析出固体;(3)保持搅拌时间大于6小时后过滤固体,用丙酮浸泡洗涤3次,过滤,固体放置干燥处常温风干,收集得复合物。本发明的又一目的是,提供[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]钙钠复合物,特别是复合物[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaXNaY·ZH2O,其中:X=1~3、Y=12~16、Z=9~18,且2X+Y=18,在制备治疗慢性心力衰竭药物中的用途。本发明提供的复合物具有以下优势:1、本发明制备的实施例样品质量稳定可控,化学稳定性好,溶解性与对比样品类似,但吸湿性指标明显优于对比样品,对制剂工艺、储存条件没有特殊要求,与现有技术相比,能够更好地保证产品的有效性、稳定性。2、在比格犬体内药物代谢试验中,本发明实施例1、3样品中缬沙坦的达峰时间比对比样品快,证明实施例1、3样品可以较快的起效;实施例1、3、5样品中缬沙坦、AHU377以及AHU377的代谢产物LBQ657的Cma以及AUC均明显高于对比样品;说明实施例1、3、5样品生物利用度有明显提高。即说明本申请实施例1、3、5样品吸收显著优于对比样品。附图说明附图1:复合物1结晶形式的X射线衍射图谱附图2:复合物2结晶形式的X射线衍射图谱附图3:复合物3结晶形式的X射线衍射图谱具体实施方式以下将结合实施例对本发明作进一步的详细描述,本发明的实施例仅用于说明本发明的技术方案,并非对本发明的限制,凡依照本发明公开的内容所作的任何本领域的等同替换,均属于本发明的保护范围。HPLC谱图的测定采用岛津LC-20A液相色谱仪。本发明所述的X射线粉末衍射(XRPD)的测定是采用辽宁丹东浩元DX-2700X粉末衍射仪进行采集,具体参数如下表:本发明所述的差示扫描量热分析(DSC)和热重分析(TGA)测定数据分别在TAQ2000差示扫描量热仪和TAQ5000热重分析仪上采集,仪器参数如下表所示:DSCTGA样品盘铝盘,压盖铂金盘,敞开温度范围室温-300℃室温-350℃扫描速率10℃/分钟10℃/分钟保护气体氮气氮气本发明复合物中钠元素含量测定采用原子吸收分光光度法(AAS)。实验材料:普析通用TAS-990原子吸收分光光度计(北京普析通用仪器有限责任公司);钠标准溶液:1000ug/ml,GSB-04-1738-2004(153050-2)国家有色金属及电子材料分析测试中心。实验条件:原子化方法:火焰原子化器;波长:589nm;空气压力:0.25MPa;燃气流量:1300ml/min;溶剂:0.1%氯化钾溶液,标准曲线线性范围:0.1ug/ml~0.5ug/ml,供试品溶液浓度:4ug/ml。本发明复合物中钙元素含量测定采用EDTA络合滴定法。实验材料:EDTA滴定液(0.05mol/L),钙紫红素指示剂,氢氧化钠试液,1ml微量滴定管。实验方法:精密称取供试品适量(含钙元素约1.6mg),加水50ml,超声,再加入氢氧化钠试液50ml超声使溶解,加入钙紫红素0.1g,用EDTA滴定液(0.05mol/L)滴定至溶液自紫色转变为纯蓝色,同时以空白试验校正,每1ml滴定液相当于钙2mg。本发明所述“室温”是指温度处于10~25℃之间。实施例1[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaNa16·15H2O的制备AHU-377(2.4g,5.83mmol)和AHU-377的钙盐(1.26g,2.92mmol)用25ml的丙酮溶解搅拌30min至澄清。将缬沙坦(3.81g,8.75mmol)加入上述溶液内,搅拌至完全溶解。配制NaOH(933mg,23.33mmol)的水(2.7mL)溶液,在5min内滴加到体系中,并保持匀速搅拌。约在20-30min内逐渐析出固体,保持搅拌时间大于6小时后过滤固体,用丙酮浸泡洗涤3次,过滤,固体放置干燥处常温风干,收集得复合物7.4g,收率87.5%。该结晶样品采用HPLC外标法计算测得缬沙坦的含量为45.35%,AHU-377的含量为42.86%;采用原子吸收分光光度法(AAS)测得钠元素含量为6.41%;采用EDTA络合滴定法测得钙元素含量0.71%;采用卡尔费休氏法测得水分4.66%。该结晶样品DSC在约120℃、151℃有特征吸收峰。该结晶样品定义为复合物1的结晶,使用Cu-ka射线进行X射线粉末测定,其图谱具有下表所示衍射角、晶面间距和相对强度:该结晶样品的X-射线粉末衍射图谱见附图1。实施例2[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6CaNa16·15H2O的制备AHU-377(2.41g,5.85mmol)和AHU-377的钙盐(1.26g,2.93mmol)用25ml的丙酮溶解搅拌30min至澄清。将缬沙坦钠盐(4.21g,8.78mmol)加入上述溶液内,搅拌至完全溶解。配制NaOH(234mg,5.85mmol)的水(0.3mL)溶液,在5min内滴加到体系中,并保持匀速搅拌。约在20-30min内逐渐析出固体,保持搅拌时间大于6小时后可以过滤固体,用丙酮浸泡洗涤3次,过滤,固体放置干燥处常温风干,收集该复合物6.8g,收率81.0%。该结晶样品采用HPLC外标法计算测得缬沙坦的含量为45.30%,AHU-377的含量为42.89%;采用原子吸收分光光度法(AAS)测得钠元素含量为6.41%;采用EDTA络合滴定法测得钙元素含量0.70%;采用卡尔费休氏法测得水分4.70%。该结晶样品DSC在约121℃、152℃有特征吸收峰。该结晶样品的X-射线粉末衍射图谱与实施例1保持一致。实施例3[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6Ca2Na14·15H2O的制备AHU-377(1.27g,3.08mmol)和AHU-377的钙盐(2.66g,6.17mmol)用25ml的丙酮溶解搅拌30min至澄清。将缬沙坦(4.03g,9.26mmol)加入上述溶液内,搅拌至完全溶解。配制NaOH(864mg,21.60mmol)的水(0.9mL)溶液,在5min内加入到体系中,并保持匀速搅拌。约在20-30min内逐渐析出固体,保持搅拌时间大于6小时后可以过滤固体,用丙酮浸泡洗涤3次,过滤,固体放置干燥处常温风干,收集该复合物7.4g,收率83.5%。该结晶样品采用HPLC外标法计算测得缬沙坦的含量为45.47%,AHU-377的含量为43.03%;采用原子吸收分光光度法(AAS)测得钠元素含量为5.63%;采用EDTA络合滴定法测得钙元素含量1.38%;采用卡尔费休氏法测得水分4.76%。该结晶样品DSC在约125℃、155℃有特征吸收峰。该结晶样品定义为复合物2的结晶,使用Cu-ka射线进行X射线粉末测定,其图谱具有下表所示衍射角、晶面间距和相对强度:该结晶样品的X-射线粉末衍射图谱见附图2。实施例4[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6Ca2Na14·15H2O的制备AHU-377(1.27g,3.08mmol)和AHU-377钙盐(2.66g,6.17mmol)用25ml的丙酮溶解搅拌30min至澄清。将缬沙坦钠盐(4.44g,9.26mmol)加入上述溶液内,搅拌至完全溶解。配制NaOH(123mg,3.08mmol)的水(0.15mL)溶液,在5min内加入到体系中,并保持匀速搅拌。约在20-30min内逐渐析出固体,保持搅拌时间大于6小时后可以过滤固体,用丙酮浸泡洗涤3次,过滤,固体放置干燥处常温风干,收集该复合物7.2g,收率81.4%。该结晶样品采用HPLC外标法计算测得缬沙坦的含量为45.33%,AHU-377的含量为42.95%;采用原子吸收分光光度法(AAS)测得钠元素含量为5.64%;采用EDTA络合滴定法测得钙元素含量1.38%;采用卡尔费休氏法测得水分4.77%。该结晶样品DSC在约123℃、154℃有特征吸收峰。该结晶样品的X-射线粉末衍射图谱与实施例3保持一致。实施例5[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6Ca3Na12·15H2O的制备AHU-377钙盐(2.66g,6.17mmol)用25ml的丙酮溶解搅拌30min至澄清。将缬沙坦钠盐(2.96g,6.17mmol)加入上述溶液内,搅拌至完全溶解。室温搅拌30min-60min后,逐渐析出白色固体,保持搅拌8小时以后,过滤,滤饼用丙酮浸泡洗涤三次,抽滤,固体放置干燥处常温风干,即收集该复合物4.6g,收率78.0%。该结晶样品采用HPLC外标法计算测得缬沙坦的含量为45.61%,AHU-377的含量为43.01%;采用原子吸收分光光度法(AAS)测得钠元素含量为4.76%;采用EDTA络合滴定法测得钙元素含量2.06%;采用卡尔费休氏法测得水分4.65%。该结晶样品DSC在约117℃、153℃有特征吸收峰。该结晶样品定义为复合物3的结晶,使用Cu-ka射线进行X射线粉末测定,其图谱具有下表所示衍射角、晶面间距和相对强度:该结晶样品的X-射线粉末衍射图谱见附图3。实施例6[3-((1S,3R)-1-联苯-4-基甲基-3-乙氧基羰基-1-丁基氨基甲酰基)丙酸-(S)-3'-甲基-2'-(戊酰基{2”-(四唑-5-基负离子)联苯-4'-基甲基}氨基)丁酸]6Ca3Na12·15H2O的制备AHU-377钙盐(2.66g,6.17mmol)用25ml的丙酮溶解搅拌20min至澄清。将缬沙坦(2.69g,6.17mmol)加入上述溶液内,搅拌至完全溶解澄清,再配置NaOH(494mg,12.34mmol)的水(0.5mL)溶液,在5min内滴加入反应体系中。室温搅拌30min-60min后,逐渐析出白色固体,保持搅拌8小时以后,过滤,滤饼用丙酮浸泡洗涤三次,抽滤,固体放置干燥处常温风干,即收集该复合物4.8g,收率81.5%。该结晶样品采用HPLC外标法计算测得缬沙坦的含量为45.57%,AHU-377的含量为42.93%;采用原子吸收分光光度法(AAS)测得钠元素含量为4.84%;采用EDTA络合滴定法测得钙元素含量2.13%;采用卡尔费休氏法测得水分4.72%。该结晶样品DSC在约119℃、154℃有特征吸收峰。该结晶样品的X-射线粉末衍射图谱与实施例5保持一致。对比样品LCZ696的制备按照ZL200680001733.0专利说明书实施例1第[282]-[285]段公开的内容制备。试验例1化学稳定性考察试验将实施例1、2、3、4、5、6样品和对比样品分别放入洁净的培养皿中敞口平摊放置,考察在高温(60℃)、高湿(25℃、RH90%±5%)、强光(4500lx±500Lx)条件下样品的稳定性,分别在5天和10天取样测定其HPLC纯度,检测结果见下表1:表1稳定性试验纯度测定结果稳定性考察结果表明,实施例1、2、3、4、5、6样品和对比样品在高温(60℃)、高湿(25℃、RH90%±5%)、强光(4500lx±500lx)等条件下敞口放置10天,HPLC纯度无明显变化,即本发明各种复合物晶型的化学稳定性均较好。试验例2平衡溶解度试验为了考察本发明实施例1、2、3、4、5、6样品和对比样品的溶解性,本发明在37℃条件下分别在pH=1.0(0.1mol/L)的盐酸、pH=3.5的乙酸铵-氨缓冲溶液中,pH=6.8的磷酸二氢钾-氢氧化钠缓冲溶液和水中,测定上述样品的平衡溶解度,结果如下表2所示:表2平衡溶解度试验结果上述溶解度试验结果表明,在pH3.5的缓冲液及pH1.0盐酸溶液中本发明实施例样品和对比样品的溶解度无明显差异;在pH值为6.8的缓冲液和水中,本发明实施例样品溶解度比对比样品溶解度略差。试验例3引湿性试验将实施例1、2、3、4、5、6样品和对比样品分别放入洁净的称量瓶中敞口平摊放置,考察在25℃±1℃,RH80%±2%条件下放置24小时的吸湿增重情况,结果如下表3所示:表3引湿性试验结果实施例样品引湿增重0小时性状24小时性状实施例1样品6.95%类白色粉末类白色粉末实施例2样品6.98%类白色粉末类白色粉末实施例3样品4.55%类白色粉末类白色粉末实施例4样品4.51%类白色粉末类白色粉末实施例5样品2.12%类白色粉末类白色粉末实施例6样品2.09%类白色粉末类白色粉末对比样品22.34%类白色粉末几乎成液态上述吸湿性实验表明,24小时内本申请实施例1-6样品引湿增重均在7%以下,实施例6样品仅为2.09%,性状未改变;而对比样品引湿增重已明显大于15%,24小时后已几乎成液态,极具引湿性,引湿性太强将会对后续处方工艺、储存条件等提出更高的要求。因此,与对比样品相比,本申请实施例样品采用常规工艺条件和储存条件即可,能有效确保产品存储过程与制剂制备过程中的质量稳定。试验例4Beagle犬体内的药代动力学试验1、试验目的考察等摩尔剂量下,Beagle犬单次分别口服实施例1、3、5样品和对比样品后,血浆中的缬沙坦、AHU377以及AHU377的代谢产物LBQ657的浓度水平及其基本的药代动力学特点,并比较主要参数Cmax,Tmax,AUClast等的差异。2、材料和方法2.1、受试药物实施例1样品胶囊:用实施例1样品制备的胶囊,由成都苑东药业公司制剂研究部提供,规格312μmol/颗,批号:150901;实施例3样品胶囊:用实施例3样品制备的胶囊,由成都苑东药业公司制剂研究部提供,规格312μmol/颗,批号:150901;实施例5样品胶囊:用实施例5样品制备的胶囊,由成都苑东药业公司制剂研究部提供,规格312μmol/颗,批号:150901;对比样品LCZ696胶囊:由LCZ696制备的胶囊,由成都苑东药业公司制剂研究部提供,规格312μmol/颗,批号:150831;2.2、试验动物:Beagle犬4只,雄性,体重8±2kg,年龄10-12个月,购自于成都达硕生物科技有限公司,合格证号:SCXK(川)2013-24。2.3、试验设计给药周期:采用Beagle犬4×4交叉预试验,一次试验共4个周期,每个周期有4只犬,分别服用4种不同的药物胶囊。每一个周期试验结束后,有2天消除期,待药物完全代谢后,再进行下一周期的试验,详细如下表4所示:表4Beagle犬药代动力学对比试验备注:MD=maledog。2.4、样品的收集每个周期单次给药前、给药后5min,15min,0.5h,1h,2h,3h,4h,6h,8h,10h,24h,36h,48h,于前肢或后肢静脉取血1ml,置于EDTA-K2管中,3000r/min,离心10min,分离血浆,-70℃冰箱冷冻保存。2.5、LC/MS/MS生物样品分析:取50ul血浆与5ul工作液或空白稀释液混匀,加入150ul含内标乙腈沉淀剂,涡旋2min,以12000rpm离心5min,取上清100ul与100ul纯水混匀后,以10ul体积进样分析。2.6、统计学方法采用SPSS进行统计,实验数据采用均数加减标准差表示,多组试验之间比较采用ANOVA方差分析,组间两两比较采用LSD检验。2.7、试验结果表5主要药动学参数考察结果治疗方案Tmax,hCmax,ng/mLAUC0-last,ng*h/mL缬沙坦实施例1样品胶囊0.56±0.31*6765±1724*23166±3467*实施例3样品胶囊0.75±0.297034±1672*24784±4979*实施例5样品胶囊2.00±1.406584±1533*21713±1667*对比样品胶囊2.25±1.253937±174817628±2834AHU377实施例1样品胶囊0.56±0.311278±222*2499±320*实施例3样品胶囊0.63±0.251377±331*2541±383*实施例5样品胶囊0.44±0.121320±285*3249±603*对比样品胶囊0.63±0.25758±3521829±415LBQ657实施例1样品胶囊1.13±0.631486±346*5693±548*实施例3样品胶囊1.50±0.581474±362*5818±722*实施例5样品胶囊1.75±0.501574±421*5899±796*对比样品胶囊1.63±0.75869±3344579±698“※P”:与对比样品相比,P<0.05;比格犬单次口服胶囊后,实施例1、3样品中缬沙坦的Tmax相较于对比样品有明显的提前,特别是实施例1样品与对比样品有统计学意义(※P<0.05);实施例1、3、5中缬沙坦、AHU377以及AHU377的代谢产物LBQ657的Cmax以及AUC都明显高于对比样品(※P<0.05),证明缬沙坦、AHU377在比格犬体内吸收较好,优于对比样品。2.8、结论在比格犬体内药物代谢试验中,实施例1、3样品中的缬沙坦达峰时间比对比样品快,证明实施例1、3样品可以较快的起效;实施例1、3、5样品中的缬沙坦、AHU377以及AHU377的代谢产物LBQ657的Cmax以及AUC明显高于对比样品;说明相对生物利用度也明显提高。即在本次试验条件下,本申请实施例1、3、5样品吸收显著优于对比样品。根据上述结果表明本发明实施例样品生物利用度明显提高,可以用于防止心力衰竭的用途。对于本领域的普通技术人员而言明显的是在不偏离本发明的精神或者范围,可对本发明复合物、晶型、以及工艺等进行多种修饰和变化,只要所述修饰或变化处于权利要求和其等同实施方式所涵盖的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1