酰胺酶及其编码基因和应用的制造方法与工艺
本发明涉及基因工程领域,尤其涉及一种酰胺酶及其编码基因和应用。
背景技术:
酰胺酶是一类能够催化酰胺水解生成相应羧酸和氨的水解酶。酰胺酶的底物范围很广,能够水解各种天然及人工合成的脂肪族和芳香族酰胺。一些酰胺酶通常具有较严格的化学、区域和立体选择性,尤其对α位含手性中心的底物具有很好的立体选择性。其在制备光学纯酰胺、羧酸及其相应衍生化合物方面具有巨大的潜力,正日益受到工业界的重视。光学纯酰胺、羧酸及其衍生物是重要的化工产品和手性药物中间体。由于对手性药物和中间体需求的增长,利用生物法或酶法合成手性化合物日益得到人们的重视和工业化应用。生物法合成手性化合物的关键问题在于寻找具有高度立体选择性催化功能的生物催化剂。酰胺酶在微生物界分布很广,获得了众多科研工作的研究,也取得了众多科研成果。其中公开号为US6617139B1的专利公开了一种酰胺酶其可以立体选择性水解α-氨基酰胺和α-羟基酰胺类化合物;公开号为US7070963B2的专利公开了一种酰胺酶其可以用来生产光学纯的D-氨基酸;公开号为CN100547067C的专利公开了一株新的菌株-表皮短杆菌ZJB-07021(BrevibacteriumepidermidisZJB-07021)及其在微生物制备(S)-2,2-二甲基环丙烷甲酰胺中的应用。该菌株含有R-异构体立体选择性的酰胺酶,通过将(R)-2,2-二甲基环丙烷甲酰胺水解为(R)-2,2-二甲基环丙烷甲酸,在底物转化率为52%时,剩余产物(S)-2,2-二甲基环丙烷甲酰胺的ee值为99.2%。但是目前所研究的酰胺酶还存在着底物谱不够广的问题,尤其很多酰胺酶不能有效的水解大分子芳香族类酰胺化合物。再者用微生物野生菌株来直接进行底物的催化反应,还存在着酰胺酶的产量低和大量副产物的生成使得产品纯度降低等问题。因此,如何筛选到立体选择性好、活力高并且底物谱广的酰胺酶,并实现该酰胺酶的高效异源表达,减少副产物的生成,成为我们有待解决的重要问题。
技术实现要素:
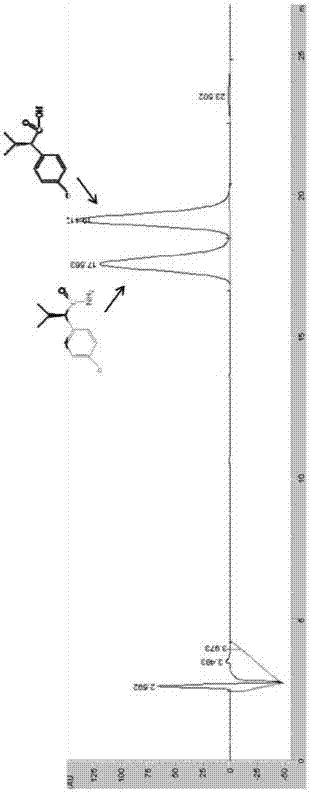
本发明提供了一种立体选择性好、活力高、底物谱广且高效异源表达的酰胺酶。本发明采用的技术方案是:一种酰胺酶,氨基酸序列如SEQIDNO.2所示。由于氨基酸序列的特殊性,任何含有SEQIDNO.2所示氨基酸序列的肽蛋白的片段或其变体,只要该肽蛋白的片段或肽蛋白变体与前述氨基酸序列同源性在90%以上,且具有相同的酶活力,均属于本发明保护范围之列。具体的,所述改变可包括氨基酸序列中氨基酸的缺失、插入或替换。本发明还提供了一种编码所述的酰胺酶的基因。优选的,所述的基因的碱基序列如SEQIDNO.1所示。该碱基序列来源于产酸克雷伯菌KCTC1686(KlebsiellaoxytocaKCTC1686),由1515个碱基组成。由于核苷酸序列的特殊性,任何SEQIDNO.1所示多核苷酸的变体,只要其与该多核苷酸具有90%以上同源性,均属于本发明保护范围之列。所述多核苷酸的变体是指一种具有一个或多个核苷酸改变的多核苷酸序列。此多核苷酸的变体包括取代变异体、缺失变异体和插入变异体。如等位变异体,它可能是一个多核苷酸的取代、缺失或插入,但是这种变化不会从本质上改变其所编码的蛋白质的功能。本发明还公开了一种所述基因的表达盒、重组载体和转化子。所述重组载体是用常规方法将本发明的酰胺酶基因的核苷酸序列连接于各种载体上构建而成,载体可以是市售的质粒、噬菌体、粘粒或病毒载体等,如pUC,pET-30a(+),pET-21a(+),pET-22b(+),pET-28a(+),pETDuet-1,pACYCDuet-1,pCDFDuet-1和RSFDuet-1,但又不仅限于所述的这些载体。优选,将PCR扩增到的酰胺酶基因产物通过限制性内切酶进行双酶切,然后用T4连接酶将其连接到用相同限制性内切酶进行双酶切的表达载体pET-30a(+)上,形成酰胺酶基因的表达载体pET-30a(+)-AmiH。诱导剂IPTG的浓度、诱导温度和诱导时间也是影响酰胺酶表达量和活性的重要因素。作为优选,所述诱导酰胺酶基因表达的条件为:培养液的OD600达到0.8~1.2左右时,加入诱导剂IPTG至其浓度为0.4~0.8mM,16~22℃下诱导20小时。本发明还公开了所述的酰胺酶在催化酰胺水解中的应用。酰胺酶水解酰胺的反应式如下:式(I)~(III)中:R1为甲基、乙基、异丙基、羟基、或卤素原子;R2为苯基、苯羟基或卤素取代苯基;R3为氢原子。本发明又公开了所述的酰胺酶在催化水解2-(4-氯苯基)-3-甲基丁酰胺制备2-(4-氯苯基)-3-甲基丁酸中的应用。与现有技术相比,本发明具有以下有益效果:(1)本发明从产酸克雷伯菌KCTC1686(KlebsiellaoxytocaKCTC1686)的基因组中克隆到酰胺酶基因,该酰胺酶基因表达后成功获得了具有较高催化活力和立体选择性酰胺酶,可以用于制备光学纯的手性化合物,特别是重要的医药中间体2-(4-氯苯基)-3-甲基丁酸。用该重组酰胺酶催化外消旋底物2-(4-氯苯基)-3-甲基丁酰胺,当底物转化率接近50%时,所得S构型的2-(4-氯苯基)-3-甲基丁酸光学纯度为98.5%;(2)本发明酰胺酶不仅具有高催化活力和立体选择性,还具有非常广的底物谱,既可以制备光学纯的手性酰胺和羧酸类化合物,也可以水解大分子芳香族酰胺类化合物。附图说明图1为本发明酰胺酶基因的PCR扩增电泳图;M:核酸Marker,1和2:酰胺酶基因的PCR扩增产物。图2为本发明重组质粒pET-30a(+)-AmiH的图谱。图3为本发明基因工程菌株E.coliBL21(DE3)/pET-30a(+)-AmiH诱导表达产物的SDS-PAGE电泳图;M:低分子量标准蛋白质;1:pET-30a(+)空载质粒对照破胞液;2:基因工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH诱导后菌体破胞液;3:基因工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH诱导菌体破胞上清液;4:基因工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH诱导菌体破胞沉淀。图4为外消旋底物2-(4-氯苯基)-3-甲基丁酰胺的高效液相检测图谱。图5为本发明重组酰胺酶水解外消旋底物2-(4-氯苯基)-3-甲基丁酰胺的高效液相检测图谱。具体实施方式下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并非仅限于此。实施例中的材料与方法如下:本发明中的实验方法如无特别说明均为常规方法,具体可参见J.萨姆布鲁克等编写的《分子克隆实验指南》。本发明实施例中所使用的限制性内切酶EcoRI、HindIII和T4DNA连接酶购自TaKaRa,宝生物工程(大连)有限公司;基因组提取试剂盒、质粒提取试剂盒、DNA回收纯化试剂盒购自Axygen杭州有限公司;E.coliDH5α、E.coliBL21(DE3)、质粒pET-30a(+)购自Novagen公司;DNAmarker、FastPfuDNA聚合酶、低分子量标准蛋白质、琼脂糖电泳试剂购自北京全式金生物技术有限公司;引物合成与序列测序工作由上海生工生物工程技术有限公司完成。以上试剂使用方法参考商品说明书。本发明采用的产酸克雷伯菌KCTC1686(KlebsiellaoxytocaKCTC1686)购自韩国典型微生物保藏中心(KoreanCollectionforTypeCultures(KCTC))实施例1一、从产酸克雷伯菌KCTC1686(KlebsiellaoxytocaKCTC1686)基因组中克隆AmiH基因。根据KlebsiellaoxytocaKCTC1686基因组DNA序列(GenBank登录号:CP003218.1)设计引物AmiH-F和AmiH-R。AmiH-F序列:5’-CCGGAATTCATGGCTATTCAACGTCCCACTG-3’AmiH-R序列:5’-TTCCCAAGCTTGTTAAAACGTCCGCCAGTCAC-3’在上、下游引物中分别加入限制性酶切位点EcoRI、HindIII(下划线所示)。以KlebsiellaoxytocaKCTC1686基因组DNA为模板,AmiH-F和AmiH-R为引物进行PCR扩增,PCR反应体系和反应条件如下:PCR扩增体系:PCR扩增条件:1)预变性:95℃5min;2)变性:98℃10s;退火:55℃15s;延伸:72℃60s;共循环30次;3)延伸:72℃10min;4)4℃保存2.0h。用0.8%琼脂糖凝胶电泳检测PCR扩增产物,产物为单一条带,大小为1500bp左右(如图1所示)。用DNA回收纯化试剂盒对PCR扩增产物进行纯化回收,具体步骤参照该试剂盒说明书。二、表达载体和工程菌的构建先将纯化回收后的目的片段和pET-30a(+)质粒分别用限制性内切酶EcoRI和HindIII进行双酶切。之后用DNA回收纯化试剂盒对酶切产物进行纯化回收以去除限制性内切酶和酶切下来的核苷酸小片段。最后用T4DNA连接酶将目的片段与pET-30a(+)质粒进行连接,连接体系如下表1所示:表1pET-30a(+)-AmiH重组表达质粒连接体系将上述各试剂进行轻轻混合,并放于金属浴中16℃下连接12h。之后用连接产物转化E.coliDH5a感受态细胞,涂平板、挑单菌落进行LB液体培养,PCR法鉴定构建成功的阳性转化子。用Axygen质粒提取试剂盒从E.coliDH5a阳性转化菌株中提取重组质粒pET-30a(+)-AmiH,并用其转化表达宿主E.coliBL21(DE3)感受态细胞。经Kan抗性培养基筛选并做菌落PCR,验证转化的重组子。验证无误后的基因工程菌即为E.coliBL21(DE3)/pET-30a(+)-AmiH。三、酰胺酶的表达将构建的基因工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH接于20mL含50μg/mlKan的LB液体培养基中,37℃震荡培养过夜。取1mL培养液转接至50mL同样含50μg/mlKan的新鲜LB液体培养基中,37℃震荡培养至OD600达到0.8左右时,加入IPTG至其浓度为0.5mM,20℃下诱导18h。其诱导表达产物的SDS-PAGE电泳图,如图3所示。实施例2酰胺酶水解丁酰胺取50mL实施例1中的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH发酵液,10000rpm离心收集菌体,然后用50mMTris-HCl(pH7.5)的缓冲液重悬菌体细胞,即得工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH的静息细胞悬液。控制细胞负载量为3g干细胞/L。向重悬液中投入丁酰胺至其终浓度为20mM,35℃下进行催化反应,反应2小时。之后用气相色谱法检测反应体系内的丁酰胺和丁酸的含量。结果发现反应体系内已无丁酰胺,全部转化为丁酸。实施例3酰胺酶水解己酰胺取50mL实施例1中的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH发酵液,10000rpm离心收集菌体,然后用50mMTris-HCl(pH7.5)的缓冲液重悬菌体细胞,即得工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH的静息细胞悬液。控制细胞负载量为3g干细胞/L。向重悬液中投入己酰胺至其终浓度为30mM,30℃下进行催化反应,反应2小时。之后用气相色谱法检测反应体系内的己酰胺和己酸的含量。结果发现反应体系内已无己酰胺残留,全部转化为己酸。实施例4酰胺酶水解苯甲酰胺取50mL实施例1的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH发酵液,10000rpm离心收集菌体,然后用50mMTris-HCl(pH7.0)的缓冲液重悬菌体细胞,即得工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH的静息细胞悬液。控制细胞负载量为3g干细胞/L。向重悬液中投入苯甲酰胺至其终浓度为20mM,37℃下进行催化反应,反应2小时。之后用高效液相色谱法检测反应体系内的苯甲酰胺和苯甲酸的含量。结果发现反应体系内已无苯甲酰胺残留,全部转化为苯甲酸。所用高效液相色谱仪为Agilent1100,色谱柱为C18柱(5μm,4.6×150mm)。实施例5酰胺酶水解烟酰胺取50mL实施例1的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH发酵液,10000rpm离心收集菌体,然后用50mMTris-HCl(pH8.5)的缓冲液重悬菌体细胞,即得工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH的静息细胞悬液。控制细胞负载量为3g干细胞/L。向重悬液中投入烟酰胺至其终浓度为20mM,25℃下进行催化反应,反应2小时。之后用高效液相色谱法检测反应体系内的烟酰胺和烟酸的含量。结果发现反应体系内已无烟酰胺残留,全部转化为烟酸。所用高效液相色谱仪为Agilent1100,色谱柱为C18柱(5μm,4.6×150mm)。实施例6酰胺酶水解苯乙酰胺取50mL实施例1的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH发酵液,10000rpm离心收集菌体,然后用50mMTris-HCl(pH8.0)的缓冲液重悬菌体细胞,即得工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH的静息细胞悬液。控制细胞负载量为3g干细胞/L。向重悬液中投入苯乙酰胺至其终浓度为10mM,37℃下进行催化反应,反应2小时。之后用高效液相色谱法检测反应体系内的苯乙酰胺和苯乙酸的含量。结果发现反应体系内已无苯乙酰胺残留,全部转化为苯乙酸。所用高效液相色谱仪为Agilent1100,色谱柱为C18柱(5μm,4.6×150mm)。实施例7酰胺酶水解2·苯基乙酰胺取50mL实施例1的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH发酵液,10000rpm离心收集菌体,然后用50mMTris-HCl(pH7.5)的缓冲液重悬菌体细胞,即得工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH的静息细胞悬液。控制细胞负载量为3g干细胞/L。向重悬液中投入2-苯基乙酰胺至其终浓度为10mM,35℃下进行催化反应,反应2小时。之后用高效液相色谱法来分析转化率和产物的光学纯度。通过分析得知,底物转化率接近50%,所得S构型的2-苯基乙酸光学纯度为99%。所用高效液相色谱仪为Agilent1100,色谱柱为AY-RH手性柱(5μm,4.6×150mm,CHIRALPAK)。实施例8酰胺酶水解2,2·二甲基环丙酰胺取50mL实施例1的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH发酵液,10000rpm离心收集菌体,然后用50mMTris-HCl(pH7.5)的缓冲液重悬菌体细胞,即得工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH的静息细胞悬液。控制细胞负载量为3g干细胞/L。向重悬液中投入2,2-二甲基环丙酰胺至其终浓度为10mM,35℃下进行催化反应,反应3小时。之后用高效液相色谱法来分析转化率和产物的光学纯度。通过分析得知,底物转化率接近50%,所得S构型的2,2-二甲基环丙酸光学纯度为99%。所用高效液相色谱仪为Agilent1100,色谱柱为AY-RH手性柱(5μm,4.6×150mm,CHIRALPAK)。实施例9酰胺酶水解2·(4·氯苯基)·3·甲基丁酰胺取50mL实施例1的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH发酵液,10000rpm离心收集菌体,然后用50mMTris-HCl(pH7.5)的缓冲液重悬菌体细胞,即得工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH的静息细胞悬液。控制细胞负载量为3g干细胞/L。向重悬液中投入2-(4-氯苯基)-3-甲基丁酰胺至其终浓度为10mM,35℃下进行催化反应,反应6小时。之后用高效液相色谱法来分析转化率和产物的光学纯度。通过分析得知,底物转化率接近50%,所得S构型的2-(4-氯苯基)-3-甲基丁酸光学纯度为98.5%。所用高效液相色谱仪为Agilent1100,色谱柱为AY-RH手性柱(5μm,4.6×150mm,CHIRALPAK)。对比例lShun-IchiMasutomo(BioscienceBiotechnologyandBiochemistry,59(4),720-722,1995)等用假单胞菌B21C9(pseudomonassp.B21C9)来催化2-(4-氯苯基)-3-甲基丁酰胺的水解反应。发现该野生菌含有的酰胺酶能将2-(4-氯苯基)-3-甲基丁酰胺水解为2-(4-氯苯基)-3-甲基丁酸,并表现出严格的(S)型立体选择性,但是其活性较低,仅为0.5×10-4μmol/min/mg干细胞。本发明的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH催化2-(4-氯苯基)-3-甲基丁酰胺时,其酶活力达到3.5×10-2μmol/min/mg干细胞。对比例2Sang-HyunLee(JoumalofMicrobiologyandBiotechnology,24(7),936-942,2014)等将来源于多噬伯克霍尔德氏菌LG31-3(BurkholderiamultivoransLG31-3)的酰胺酶进行了纯化,并研究了该纯化的酰胺酶催化外消旋2-(4-氯苯基)-3-甲基丁酰胺的水解反应。结果发现该酰胺酶表现出(S)型立体选择性,当底物转化率为39%时,所得S构型的2-(4-氯苯基)-3-甲基丁酸光学纯度为98%。本发明的工程菌E.coliBL21(DE3)/pET-30a(+)-AmiH催化2-(4-氯苯基)-3-甲基丁酰胺,当底物转化率为39%时,所得S构型的2-(4-氯苯基)-3-甲基丁酸光学纯度为100%;当底物转化率为50%时,所得S构型的2-(4-氯苯基)-3-甲基丁酸光学纯度为98.5%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1