大豆转基因事件MON87751以及其检测和使用方法与流程
本申请要求2013年6月14日申请的美国临时申请No.61/834,899的权益,所述申请以引用的方式整体并入本文。
序列表的引用
在文件名MONS357WO_ST25.txt中所包含的序列表是43千字节(如Microsoft中测量的大小)并且创建于2014年6月12日,其在此通过电子提交申请并且以引用的方式并入本文。
发明领域
本发明涉及称为MON87751的转基因大豆(Glycine max/soybean)事件。所述事件通过提供先前在大豆植物中不可用的杀昆虫毒素蛋白的独特组合来提供对大豆鳞翅目侵染的两种不同的抗性作用模式。这些杀昆虫毒素蛋白的组合对于防治大豆植物特有的鳞翅目物种侵染高度有效。本发明还涉及与事件MON87751有关的大豆植物、植物部分、植物种子、植物细胞、后代植物、农业产品、以及方法,并且提供所述事件所独有的核苷酸分子,所述核苷酸分子结合将转基因DNA插入大豆(Glycine max/soybean)细胞基因组中生成且可用于检测此事件在含有大豆核酸的生物样品中的存在。
发明背景
大豆(Glycine max)是世界许多地区的重要作物,并且已将生物技术方法应用于这种作物以产生具有所需性状的大豆品种。一种此类所需性状是昆虫抗性。昆虫抗性转基因在植物中的表达可赋予对植物所需的昆虫抗性性状,但转基因的表达可受许多不同因素的影响,包括驱动转移到植物染色体的单个基因表达的盒的取向和组成、染色体位置、以及转基因插入的基因组结果。例如,已在植物中观察到在转基因的染色体插入位点上不同但在其它方面相同的单个事件中的转基因表达的水平和模式方面存在变化。在事件之间还存在非所需的和/或所需的表型或农艺学差异。因此,经常必需的是,产生和分析大量单个植物细胞转化事件以选择兼备适于获得商业成功的所需性状及最优表型和农业特征的事件。选择优选转基因事件需要广泛的分子表征以及许多年来在多个地方且在多种条件下许多事件的温室和田间试验。收集显著量的效力、表型及分子数据,并且随后由科学家和农学家小组分析所得到的数据和观察结果,目标在于选择一个或多个商业上合适的事件。这样一个事件一旦选择便被用于使用植物育种方法将所需的转基因性状基因渗入其它遗传背景中,由此产生含有所需性状且适当地适于特定局部农艺学条件的许多不同作物品种。
依赖于针对昆虫侵染的杀昆虫防治的单一毒素表达的转基因大豆可处于耐久性有限的风险中,这是因为昆虫害虫对毒素的抗性发展的可能性提高。类似地,含有不提供多重独特作用模式的毒性试剂的转基因大豆也可处于耐久性有限的风险中。产生对鳞翅目有毒性的蛋白的第一可利用大豆含有单一毒素蛋白Cry1Ac。已经公开含有Cry1Ac和Cry1F毒素蛋白的最近的大豆转基因事件。如果出现对Cry1Ac的抗性,那么Cry1Ac和Cry1F转基因事件将留下来,其中仅有Cry1F毒素作为其效力来源。因此,必需提供具有两种或更多种以上毒性试剂的大豆植物,这些毒性试剂是由Cry1Ac来防治害虫,其中毒性试剂都不结合靶昆虫中肠中由Cry1Ac结合的相同或基本上相同的受体。本文所述的本发明提供一种转基因大豆事件MON87751,其通过提供对鳞翅目害虫物种有毒性的两种或更多种试剂克服了如上对于在现有技术中所述的大豆转基因事件所述的耐久性问题,其中两种毒性试剂先前出于靶向大豆鳞翅目害虫的防治目的都未包括在任何大豆植物中。
为了制备含有单一转化事件的转基因植物,将一部分重组DNA构建体转移到大豆细胞的基因组中,且大豆细胞随后长成植物。使事件最初所转移至的大豆细胞再生以产生R0代。可测试R0植物及来自R0植物的后代植物的任何所需性状,但事件的有效性可受到相对于转化事件中的整合位点的顺式和/或反式因子的影响。由所述事件赋予的表型也可受到DNA构建体的大小和设计的影响,其可通过表达盒中的遗传元件的组合、转基因的数目、表达盒的数目、及此类元件和此类盒的构型而变化。鉴别具有所需性状的事件可进一步通过以下因素而复杂化:如转基因表达的植物发育模式、昼行模式、时间模式或空间模式;或外源因素,例如环境植物生长条件、可用水、可用氮、热或应力。因此,获得赋予一组所需的表型性状的事件的能力是不容易预测的。
发明概述
本发明提供包含事件MON87751的转基因大豆植物,其与现有的转基因大豆植物及同时构建的新事件相比展现优良的性质和性能。大豆事件MON87751在大豆基因组中的单一插入基因座处含有独立地赋予对鳞翅目昆虫害虫的抗性性状的两个连接的表达盒。在大豆事件MON87751中组合这两个连接的表达盒提供针对包括以下鳞翅目中的昆虫害虫物种的两种作用模式:夜蛾属(Chrysodeixis spp.)、灰翅夜蛾属(Spodoptera spp.)、铃夜蛾属(Helicoverpa spp.)、Crocidosema spp.、Rachiplusia spp.、干煞夜蛾属(Anticarsia spp.)、玉米苗斑螟属(Elasmopalpus spp.)、以及绿夜蛾属(Plathypena spp.)。双重作用模式提供针对鳞翅目害虫物种的杀昆虫防治的冗余,且显著地降低发展对害虫防治性状的抗性的可能性。
事件MON87751的特征在于适用于检测样品中事件的存在的特异性独特DNA区段。样品意在是指基本上纯大豆DNA的组合物或含有大豆DNA的组合物。不论发生哪种情况,样品都是生物样品,即,其含有生物材料,包括但不限于直接地或间接地获自或源自于包含事件MON87751的大豆基因组的DNA。“直接”是指熟练技术人员通过压裂大豆细胞(或通过获得含有压裂的大豆细胞的大豆样品)并且出于检测目的暴露基因组DNA而直接从大豆基因组中获得DNA的能力。“间接”是指熟练技术人员通过除了经由压裂大豆细胞或获得含有压裂的大豆细胞的大豆样品的直接方式外的手段获得靶或特异性参照DNA的能力,即,本文所述的新型和独特的接合区段,其用于诊断事件MON87751在特定样品中的存在。此类间接手段包括但不限于扩增含有由被设计来特异性结合至靶序列的特定探针所靶向的DNA序列的DNA区段、或扩增可量测和表征的DNA区段,即通过经由一些高效基质如琼脂糖或丙烯酰胺凝胶等从其它DNA区段分离所测量的或通过扩增子的直接序列分析或扩增子向载体中的克隆以及在此类载体内存在的插入扩增子的直接测序所表征的。或者,对应于大豆染色体内于此转基因DNA被插入大豆染色体且可用于限定事件MON87751的位置的DNA区段可通过各种手段来克隆且随后针对其在特定样品或特定大豆基因组中的存在来鉴别和表征。此类DNA区段被称为接合区段或序列,且可为插入的DNA及邻近的(侧翼)大豆染色体DNA的任何长度,只要在插入的DNA与大豆基因组之间的连接点被归入所述区段即可。SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、及SEQ ID NO:10以及这些序列各自的相反互补物代表此类区段。
本文鉴别的特定序列可在事件MON87751或其中所包含的构建体中独特地存在,并且这些序列不管是通过直接序列分析、通过检测结合至此类序列的探针、还是通过观察本文所述的特定扩增子的大小和或许组成(当存在于特定的大豆种质或基因组和/或存在于含有大豆DNA的特定生物样品中时)的鉴别都用于诊断事件MON87751或其中所包含的构建体在此类样品中的存在。众所周知,侧翼基因组区段(即,邻近于插入的转基因DNA的DNA序列的大豆基因组区段)具有轻微变异且因此,至少99%或更大同一性的限制是参照大豆基因组之间的此类异常或多态性。与本文所参照的特定诊断序列相比在其长度上完全互补的核苷酸区段意图在本发明的范围内。
本发明的核苷酸区段相对于彼此且在大豆基因组内的位置示于图1中并且各自的核苷酸序列如SEQ ID NO:10中给出的示出。表征事件MON87751且诊断样品中事件MON87751或其中所包含的构建体的存在的核苷酸区段包括SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、或SEQ ID NO:26。这些核苷酸序列中的一个或两个或更多个在样品中的存在当此类样品含有大豆组织及由此的大豆DNA时用于诊断事件MON87751或其中所包含的构建体的存在。
通过利用词语“源自”,意图在于特定的DNA分子是在大豆植物基因组中并且能够在大豆植物DNA中被检测到。“能够被检测到”是指特定的DNA区段扩增及其大小和或序列通过DNA序列分析来表征或阐明的能力,并且也可是指探针特异性地结合至特定DNA区段、即靶DNA区段的能力以及随后检测探针与靶标结合的能力。本发明的特定DNA区段或靶DNA区段存在于含有插入事件MON87751的大豆内。
提及大豆意图在于大豆细胞、大豆种子、大豆植物部分及大豆植物在本发明的范围内,只要每个实施方案含有可检测量的对应于本文所述的用于诊断大豆事件MON87751 DNA的存在的区段中的任何一个、两个或更多个的DNA即可。大豆植物部分包括细胞;花粉;胚珠;花;豆荚;种子;根组织;茎组织;及叶片组织。由其中可检测量的本文所述的DNA区段用于诊断事件MON87751的存在的大豆制成的商品产品在本发明的范围内。此类商品产品可包括完整的或加工的大豆种子、大豆油、大豆蛋白、大豆粕、大豆粉、大豆坯片、大豆豆皮、豆浆、大豆干酪、大豆酒、包含大豆的动物饲料、包含大豆的纸、包含大豆的乳酪、大豆生物质、以及使用大豆植物及大豆植物部分生产的燃料产品。
大豆事件MON87751的DNA可存在于含有所述事件的大豆植物、大豆种子及大豆组织的每个细胞以及一个染色体上的每个基因组中。由于大豆基因组以孟德尔方式遗传给后代,所以如果大豆植物对于事件MON87751插入是纯合的,那么每个后代大豆植物及细胞将在含有事件MON87751插入的亲本染色体的每个等位基因上含有事件DNA并且从亲代遗传给后代。然而,如果含有事件MON87751 DNA的大豆基因组是杂合或杂种亲代,那么由杂种亲代交配中所涉及的约50%花粉和约50%胚珠将含有大豆事件MON87751DNA,由此产生含有事件MON87751 DNA的后代的混合种群,并且由此类与杂种的杂交产生的这种后代的百分比可为约50%至约75%范围内的任何值,其中事件MON87751 DNA被遗传给这种后代。
本发明的DNA分子可独特于插入的转基因事件MON87751 DNA的任一末端上的两个单独的接合点及邻近于(即侧接有)MON87751插入的DNA的每个末端的大豆基因组DNA,或者独特于大豆事件MON87751插入的DNA。这些分子当存在于通过本文所述的方法使用探针、引物且在一些情况下使用DNA序列分析分析的特定样品中时可用于诊断事件MON87751大豆在那个样品中的量的存在。独特于大豆事件MON87751 DNA的此类DNA分子可以许多方式来鉴别和表征,包括通过利用被设计来特异性地结合至独特的DNA分子的探针核酸分子接着检测此类探针与独特的DNA的结合,并且通过使用至少两个不同的DNA分子的热扩增方法,此类分子可充当探针但其序列与如上所述的探针相比特异性稍低。熟练技术人员理解特定的靶DNA与探针或引物在适当的杂交条件下的接触将造成探针或引物与靶DNA区段的结合。
本发明的DNA分子可以是DNA的靶区段,所述靶区段能够扩增并且当检测为通过扩增特定样品方法获得的所示长度的一个或多个扩增子时,可用于诊断事件MON87751或其中所包含的构建体在此类样品中的存在。此类DNA分子或多核苷酸区段可具有在以下各者中列出的核苷酸序列:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26,并且在本文及以下实施例中进一步限定。引物分子和/或探针可以试剂盒形式连同必需的试剂(包括对照)及包装和使用说明书一起提供。
本发明的重组DNA分子可存在于微生物内或源自于微生物。微生物意在包括任何显微细胞,不管是原核生物或真核生物或另外含有在基因组或染色体内的DNA或染色体外DNA结构,其更通常被称为质粒或载体。在一个实施方案中,显微有机体可包括细菌(原核生物)和对应于高级生命形式(真核生物)的细胞,其在普通人的视觉范围下,通常在五十立方微米下且更一般在十立方微米下。细菌是可含有载体或质粒的常见显微微生物,所述载体或质粒含有一个或多个或所有本发明的新型DNA区段,包括如在SEQ ID NO:9中所示给出的各自的表达盒中的每一个。本发明的植物细胞且尤其是大豆植物细胞可含有任何一个、两个、或更多个或所有本发明的新型DNA区段。
本文使用的探针可包含以下DNA分子或多核苷酸区段,其长度足以在如本文所定义的严格杂交条件下发挥作用以便与特定的靶DNA区段结合,即其中存在并用于诊断事件MON87751 DNA在样品中的存在的独特的DNA区段。此类探针可被设计来仅结合至单一接合点或仅在大豆事件MON87751DNA中存在的其它新型序列,或结合至两个或更多个此类单个接合区段。检测此类探针与DNA分子在疑似含有大豆DNA的特定样品中的结合用于诊断大豆事件MON87751在样品中的存在。
引物可包含一对不同的寡核苷酸或多核苷酸区段以用于扩增特定的DNA靶区段的热扩增反应中。在所述对中的每个引物都被设计来结合至其内或靠近目标DNA区段的更确切些的DNA特定区段以用于扩增。引物以一定方式结合以使得其充当核酸序列聚合的局部区域,从而产生一个或多个扩增子(DNA的扩增靶区段)。在本发明中,使用被设计来结合至特定的生物样品中的大豆事件MON87751 DNA的独特区段并扩增含有本文所述的接合区段中的一个或多个的特定扩增子的引物以及一旦聚合酶反应完成或终止便检测和/或表征此类扩增子用于诊断大豆事件MON87751在特定样品中的存在。熟练技术人员熟知此扩增方法并且在此无需对扩增细节的详述。
本发明的大豆植物、大豆植物细胞、大豆植物组织及大豆种子可对鳞翅目昆虫害虫侵染有抗性,这些鳞翅目昆虫害虫包括但不限于:夜蛾属(Chrysodeixis spp.)、灰翅夜蛾属(Spodoptera spp.)、铃夜蛾属(Helicoverpa spp.)、Crocidosema spp.、Rachiplusia spp.、干煞夜蛾属(Anticarsia spp.)、玉米苗斑螟属(Elasmopalpus spp.)、以及绿夜蛾属(Plathypena spp.)。对鳞翅目物种侵染的抗性是对于两个不同DNA区段的表达而出现,所述DNA区段编码两个不同的杀昆虫蛋白并且在插入的转基因DNA内可操作地且共价地连接:由如SEQID NO:10中列出且在图2中示出的插入的转基因DNA的5'近端处的表达盒表达的Cry2Ab蛋白;和由如SEQ ID NO:10中列出且在图2中示出的插入的转基因DNA的3'端处的表达盒表达的Cry1A.105蛋白。Cry2Ab蛋白是由At.Act2启动子表达,而Cry1A.105蛋白是由At.RbcS4启动子表达。Cry2Ab和Cry1A.105蛋白是对鳞翅目昆虫害虫物种有毒性的试剂。
用于生成大豆事件MON87751的构建体具有如下启动子:其驱动位于转录的相对串联取向上的Cry2Ab和Cry1A.105蛋白的表达以使得来自各自的Cry蛋白的每个启动子的表达在同一方向上继续进行但每个都来自其各自单独的启动子(参见图2)。被评估的其它构建体在使用以下表达元件的组合方面有变化:即增强子(E)、启动子(P)、前导序列(L)、内含子(I)、叶绿体靶向肽(CTP)及3'UTR(T)。构建体还含有Cry蛋白(Cry2Ab和Cry1A.105)的载体堆叠或含有单一Cry蛋白,即Cry2Ab或Cry1A.105在表达构建体中的进一步变化是在载体堆叠构建体中Cry蛋白的两个盒的相对取向。具体来说,两个盒是在转录的串联取向上,或两个盒是在趋异取向上以使得来自两个Cry蛋白的每个启动子的表达远离两个启动子之间的中心点,即每个表达盒的转录在相反方向上继续进行且不会汇合。编码Cry1A.105的DNA序列是在一些构建体中相对于插入事件MON87751中的转基因中的序列多样化的序列。最终,在具有以转录的相反方向取向的两个Cry表达盒的两个构建体中,转录增强子是位于不同启动子之间(参见图2)。
基于与以下的比较来选择事件MON87751:数千个不同的独立转基因事件,每个转基因事件用含有如图2所示的T-DNA区段的构建体转化;及事件MON87701和/或事件GM_A19478(与MON87701同时生成,且两者均表达Cry1Ac);转基因事件40-3-2(赋予对除草剂草甘膦的耐受性);以及非转基因对照大豆(A3555或A5547)。以下在实施例中说明的结果显示事件MON87751由于Cry2Ab和Cry1A.105蛋白的表达而展现优良的性质。使用用于生成事件MON87751的构建体产生的多个转基因事件各自比用其它构建体产生的其它事件更可能展现有效的鳞翅目昆虫害虫防治。
各自含有对应于事件MON87751的DNA的大豆植物及其部分(包括种子)在本发明的范围内。此类植物及其部分(包括种子)对鳞翅目侵染有抗性。在某些实施方案中,此类植物及种子包括杂种和自交系、以及仅含有一个事件MON87751等位基因的植物和种子,即如参看对应于事件MON87751 DNA的基因座而杂合所表征的基因组。此类杂种可通过对包含事件MON87751的植物进行育种而产生,其具有作为商业品种发育过程的一部分的所需种质及大豆的其它农业上所需性质。杂种可通过许多方法产生,但优选方法利用在事件MON87751 DNA所插入的基因座处的两个染色体上含有事件MON87751特异性等位基因的第一近交(纯合)亲本并且将所述第一近交种连同不含有MON87751 DNA的第二近交种一起育种。两个亲本近交品种将具有一个或多个在后代种子(即杂种种子)中所需的有利性质,并且这些杂种种子对于事件MON87751等位基因是杂合的。
转基因性质或赋予含有事件MON87751 DNA的植物以一些额外性状的等位基因可能是所需的。赋予所需性状的其它此类转基因等位基因可包括除草剂耐受性:GTS 40-3-2、MON87708、MON89788、A2704-12、A2704-21、A5547-35、A5547-127、BPS-CV127-9、DP356043、GU262、W62、W98、DAS-44406-6、DAS-68416-4、FG72、BPS-CV127-9、SYHT04R、SYHT0H2、3560.4.3.5、EE-GM3、pDAB4472-1606、pDAB4468-0416、pDAB8291.45.36、127、AAD-12;昆虫抗性;MON87701、DAS-81419-2;增加的增强的油组成;DP-305423、G94-1、G94-19、G168、OT96-15、MON87705、MON87769;提高的产率;MON 87712、或固氮性状、调节水使用的性状、对真菌侵染的抗性、对线虫侵染的抗性等等。非转基因性质(例如QTL或成熟期组)也可赋予所需的性状且本领域技术人员将知晓如何繁殖大豆以含有此类非转基因性状及事件MON87751 DNA。
本发明的上述及其它方面将由以下详细说明变得更清楚。
附图简述
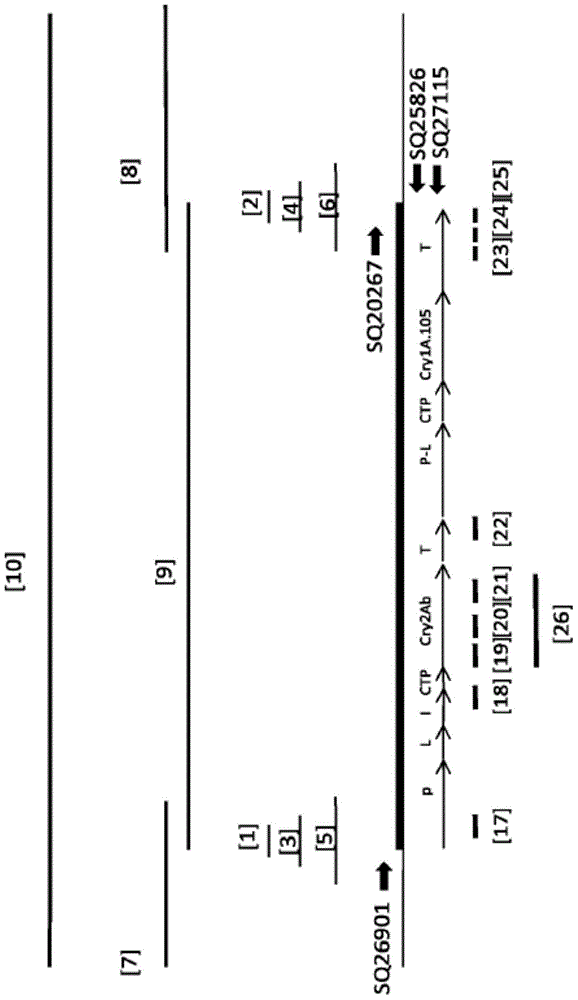
图1是由每条水平线示出的异源转基因DNA的区段、侧翼基因组DNA、任意指定的5’和3’基因组/插入的DNA接合点的相对位置及可用于鉴别大豆事件MON87751的独特于异源转基因DNA内的事件MON87751的相对序列位置的图示;水平线对应于SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25及SEQ ID NO:26分别标记了[1]、[2]、[3]、[4]、[5]、[6]、[7]、[8]、[9]、[10]、[17]、[18]、[19]、[20]、[21]、[22]、[23]、[24]、[25]及[26];具有粗段的水平线表示插入事件MON87751(SEQ ID NO:9)中的异源转基因DNA与5'和3'侧翼基因组DNA两者的复合物并且代表含有SEQ ID NO:7、SEQ ID NO:9及SEQ ID NO:8的SEQ ID NO:10;粗水平箭头指定分别对应于SEQ ID NO:15、SEQ ID NO:11、SEQ ID NO:12及SEQ ID NO:14的SQ26901、SQ20267、SQ25826及SQ27115;细水平箭头表示事件MON87751的异源转基因插入DNA的两个单独表达盒的相对组织,P表示启动子元件,L表示前导序列,P-L表示启动子和前导序列,I表示内含子,CTP表示叶绿体转运肽,Cry2Ab表示Cry2Ab蛋白的编码区域,T=3’转录终止及多腺苷酸化元件(3’UTR),且Cry1A.105表示Cry1A.105蛋白的编码区域。
图2示出在用于生成在大豆事件MON87751的选择期间评估的转基因大豆事件的11个转化构建体中编码Cry蛋白表达盒的T-DNA区段,以及在每个构建体内的每个Cry蛋白表达盒的组成。
图3是与非转基因大豆品系(A3555)相比,在以构建体1、构建体2及构建体3生成的事件中Cry蛋白表达的ELISA分析结果的图示。图A.显示在植物生长的R1和R3阶段收集的叶片组织中的Cry2Ab蛋白水平。图B.显示在植物生长的R1和R3阶段收集的叶片组织中的Cry1A.105蛋白水平。
图4是与非转基因大豆品系(A3555)相比,在以构建体1、构建体5、构建体6及构建体4生成的事件中Cry蛋白表达的ELISA分析结果的图示。图A.显示在来自在两个单独的荫棚试验中生长的植物的植物生长的R3阶段收集的叶片组织中的Cry2Ab蛋白水平。图B.显示在来自在两个单独的荫棚试验中生长的植物的植物生长的R3阶段收集的叶片组织中的Cry1A.105蛋白水平。
图5是针对植物生长的R3和R5阶段收集的叶片样品,用构建体1、构建体2、构建体3、构建体4、构建体5、构建体6、构建体9、构建体7及构建体11生成的事件中Cry2Ab蛋白表达的ELISA分析结果的图示。
图6是针对植物生长的R3和R5阶段收集的叶片样品,用构建体1、构建体2、构建体3、构建体4、构建体5、构建体6、构建体9、构建体7及构建体11生成的事件中Cry21A.105蛋白表达的ELISA分析结果的图示。图A在0-5000ppm干重下绘制Y轴且图B在0-500ppm干重下绘制Y轴以便在图B中更好地说明R3阶段的数据。
序列简述
SEQ ID NO:1是表示大豆基因组DNA的5’接合区及整合的转基因表达盒的二十个核苷酸序列。SEQ ID NO:1位于SEQ ID NO:10中的核苷酸位置1325-1344处。
SEQ ID NO:2是表示大豆基因组DNA的3’接合区及整合的转基因表达盒的二十个核苷酸序列。SEQ ID NO:2位于SEQ ID NO:10中的核苷酸位置11444-11463处。
SEQ ID NO:3是表示大豆基因组DNA的5’接合区及整合的转基因表达盒的六十个核苷酸序列。SEQ ID NO:3位于SEQ ID NO:10中的核苷酸位置1305-1364处。
SEQ ID NO:4是表示大豆基因组DNA的3'接合区及整合的转基因表达盒的六十个核苷酸序列。SEQ ID NO:4位于SEQ ID NO:10中的核苷酸位置11424-11483处。
SEQ ID NO:5是表示大豆基因组DNA的5'接合区及整合的转基因表达盒的一百个核苷酸序列。SEQ ID NO:5位于SEQ ID NO:10中的核苷酸位置1285-1384处。
SEQ ID NO:6是表示大豆基因组DNA的3'接合区及整合的转基因表达盒的一百个核苷酸序列。SEQ ID NO:6位于SEQ ID NO:10中的核苷酸位置11404-11503处。
SEQ ID NO:7是表示5'侧翼大豆基因组序列直至并包括基因组DNA及转基因插入的DNA的接合点的1626个核苷酸序列,并且包括(5'至3')侧翼基因组DNA的1334个核苷酸及插入的转基因DNA的任意指定5'端的292个核苷酸。
SEQ ID NO:8是表示侧翼大豆基因组序列直至并包括基因组DNA及转基因插入的DNA的接合点的1452个核苷酸序列,并且包括(5'至3')插入的转基因DNA的任意指定3'端的265个核苷酸及3'侧翼基因组DNA的1187个核苷酸。
SEQ ID NO:9是对应于插入大豆事件MON87751的基因组中的转基因DNA的10119个核苷酸序列。
SEQ ID NO:10是对应于插入事件MON87751中的转基因基因组DNA与5'侧翼基因组DNA核苷酸序列和3'侧翼基因组DNA核苷酸序列的复合核苷酸序列的12640个核苷酸序列并且包括SEQ ID NO:7及SEQ ID NO:9及SEQ ID NO:8。
SEQ ID NO:11是对应于称为SQ20267的热扩增引物的27个核苷酸序列,其是用于鉴别样品中的大豆事件MON87751 DNA,并且与对应于SEQ ID NO:10的位置11400至11426的核苷酸序列相同。
SEQ ID NO:12是对应于称为SQ25826的热扩增引物的26个核苷酸序列,其是用于鉴别样品中的大豆事件MON87751 DNA,并且与对应于SEQ ID NO:10的位置11454至11479的核苷酸序列的相反互补序列相同。
SEQ ID NO:13是对应于称为PB10263的探针的19个核苷酸序列,其是用于鉴别样品中的大豆事件MON87751 DNA,并且与对应于SEQ ID NO:10的11428至11446的核苷酸序列相同。
SEQ ID NO:14是对应于称为SQ27115的热扩增引物的24个核苷酸序列,其是用于鉴别样品中的大豆野生型等位基因DNA和/或大豆事件MON87751 DNA的存在并且与对应于SEQ ID NO:10的位置11458至11481的核苷酸序列的相反互补物相同。
SEQ ID NO:15是对应于称为SQ26901的热扩增引物的30个核苷酸序列,其在合子型测定中用于鉴别源自于大豆的样品中的野生型等位基因DNA的存在,并且与对应于SEQ ID NO:10的位置1288至1317的核苷酸序列相同。
SEQ ID NO:16是对应于称为PB11254的探针并且在合子型测定中用于鉴别源自于大豆的样品中的野生型等位基因DNA的存在的18个核苷酸序列。
SEQ ID NO:17是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的112个核苷酸序列,并且与在SEQ ID NO:9中的位置36-147及在SEQ ID NO:10中的位置1370-1481相同。
SEQ ID NO:18是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的52个核苷酸序列,并且与在SEQ ID NO:9中的位置1305-1356及在SEQ ID NO:10中的位置1639-1690相同。
SEQ ID NO:19是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的283个核苷酸序列,并且与在SEQ ID NO:9中的位置1561-1843及在SEQ ID NO:10中的位置2895-3177相同。
SEQ ID NO:20是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的486个核苷酸序列,并且与在SEQ ID NO:9中的位置2340-2825及在SEQ ID NO:10中的位置3674-4159相同。
SEQ ID NO:21是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的179个核苷酸序列,并且与在SEQ ID NO:9中的位置3326-3504及在SEQ ID NO:10中的位置4660-4838相同。
SEQ ID NO:22是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的106个核苷酸序列,并且适用于鉴别样品中的事件MON87751 DNA且与在SEQ ID NO:9中的位置3749-3854及在SEQ ID NO:10中的位置5083-5188相同。
SEQ ID NO:23是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的60个核苷酸序列,并且适用于鉴别样品中的事件MON87751 DNA且与在SEQ ID NO:9中的位置9320-9379及在SEQ ID NO:10中的位置10654-10713相同。
SEQ ID NO:24是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的66个核苷酸序列,并且适用于鉴别样品中的事件MON87751 DNA且与在SEQ ID NO:9中的位置9620-9685及在SEQ ID NO:10中的位置10954-11019相同。
SEQ ID NO:25是对应于插入大豆事件MON87751中的转基因DNA(SEQ ID NO:9)中的独特核苷酸序列的156个核苷酸序列,并且适用于鉴别样品中的事件MON87751 DNA且与在SEQ ID NO:9中的位置9720-9875及在SEQ ID NO:10中的位置11054-11209相同。
SEQ ID NO:26是对应于编码大豆事件MON87751中表达的Cry2Ab蛋白的开放阅读框的1905个核苷酸序列。
详述
本发明者已鉴别了一种转基因大豆事件MON87751,其展现对以下鳞翅目中的农业上重要昆虫害虫的商业上可接受的抗性:尤其如草地夜蛾(草地粘虫,FAW)、南部灰翅夜蛾(亚热带粘虫,SAW)、甜菜灰翅夜蛾(甜菜夜蛾,BAW)、黄条行军虫(黄条粘虫,YSAW)、Crocidosema aporema(豆梢蛾,BSM)、薄荷灰夜蛾(向日葵尺蠖,SFL)、黎豆叶蛾(藜豆夜蛾,VBC)、黄豆银纹夜蛾(大豆夜蛾,SBL)、谷实夜蛾(大豆豆荚虫,SPW)、Helicoverpa gelotopeon(南美棉铃虫)、南美玉米苗斑螟(小玉米茎蛀虫)、Estigmene acrea(棉黑纹灯蛾)以及Plathypena scabra(苜蓿绿夜蛾)。所述事件提供两个不同的可操作连接的表达盒,一个编码Cry2Ab且另一个编码Cry1A.105杀昆虫蛋白,并且提供针对大豆鳞翅目侵染的两个不同的抗性作用模式。其它转基因大豆事件在本领域中是已知的,即MON 88701,其表达Cry1Ac苏云金芽孢杆菌(Bt)毒素蛋白(MacRae等人2005,Fischhoff&Perlak 1995)。MON 88701提供对大豆的主要鳞翅目昆虫害虫的单一抗性作用模式,但针对灰翅夜蛾属的效力不显著。较佳提供表达两种或更多种不同杀昆虫蛋白的转基因大豆,这些杀昆虫蛋白展现对主要大豆害虫的效力并且包括灰翅夜蛾属的防治。本发明者以大豆事件MON87751形式提供至少一种对此问题的解决方法,其将大豆基因组内的两个共价连接的表达盒组合在一个基因座中,这些盒赋予扩大的鳞翅目物种抗性性状,且另外,向大豆细胞、大豆组织、大豆叶片、大豆豆荚、大豆种子及大豆植物提供一种以上作用模式以防止或延迟抗性在鳞翅目物种中的发展。
大豆事件MON87751是通过用质粒构建体1进行大豆分生组织的农杆菌介导的转变过程而产生。此质粒构建体含有两个区域,每个由农杆菌边界区段(T-DNA区段)来界定。第一T-DNA区段含有两个连接的植物表达盒,一个表达盒编码可选择标记且一个表达盒编码可评分标记。第二T-DNA区段含有两个连接的植物表达盒,其中调控遗传元件为在大豆植物细胞中表达两种不同的杀昆虫蛋白Cry2Ab和Cry1A.105所必需。由于在质粒构建体1中的两个T-DNA区段,含有选择/可评分标记基因的T-DNA区段随机插入大豆基因组中且在与含有Cry2Ab和Cry1A.105表达盒的T-DNA区段的整合位点分离的位点处,因此允许在自身和/或回交的加工期间(例如,筛选转基因植物的R1和更高代)在转化大豆植物的基因组内两个T-DNA区段的分离。转化的大豆细胞再生成完整的大豆植物且单独的植物是选自显示编码Cry2Ab和Cry1A.105蛋白的第二T-DNA区段完整性的植物群体。在R1及随后几代中,事件是基于编码Cry2Ab和Cry1A.105蛋白的第二T-DNA区段的完整性来选择,并且在编码可选择的/可评分标记盒的第一T-DNA区段不存在(即分离)下且对于不含有任何质粒主链序列的植物来说。Cry2Ab和Cry1A.105杀昆虫毒性蛋白在大豆事件MON87751的细胞中的表达当事件MON87751的大豆细胞提供于昆虫膳食中时赋予对鳞翅目昆虫害虫的抗性。
插入大豆事件MON87751的基因组中的质粒DNA的特征为详细的分子分析。这些分析包括:插入数量(整合位点在大豆基因组内的数量)、基因组插入位置(在大豆基因组中插入出现的特异性位点)、拷贝数量(T-DNA的拷贝在一个基因座内的数量)、以及转基因插入DNA的完整性。含有插入大豆基因组中的两个连接的表达盒从而得到事件MON87751的质粒构建体含有多重区段(在用于建造或构建若干表达盒的元件之间的接合序列),不知道这些多重区段是天然地存在于大豆基因组中还是在大豆的其它载体或转基因事件中或者其它(例如,如下列出的序列:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26)中。另外,在事件MON87751中得到插入的转基因DNA的转化事件在本文中表征为插入到大豆基因组中的单一基因座中,从而产生两个新的基因座或在插入的DNA与大豆基因组DNA之间的接合序列。在本文中还表征在被插入事件MON87751的大豆基因组中且具有足够长度以使得仅对包含事件MON87751 DNA的大豆基因组独特的异源DNA内的另外的独特序列。这些接合序列适用于检测事件MON87751 DNA在大豆细胞、大豆组织、大豆种子及大豆植物或大豆植物产品(大豆商品产品)中的存在。本文描述DNA分子探针和引物对,其已被开发用于鉴别这些各种接合区段在含有或疑似含有包含事件MON87751 DNA的大豆细胞、大豆种子、大豆植物部分或大豆植物组织的生物样品中的存在。数据显示事件MON87751含有具有插入的转基因DNA的一个拷贝的单一T-DNA插入。除了用于将转基因DNA从植物转化质粒转移到大豆基因组中的根癌土壤杆菌左边界和右边界区域的部分,未在事件MON87751 DNA中鉴别到来自转化构建体1的另外的元件。最终,进行产生用于诊断此类事件MON87751 DNA在样品中的存在的特异性扩增子的热扩增以及DNA序列分析以测定任意分配的5'和3'插入到植物中的基因组接合点、证实元件在插入物内的组织并且测定大豆事件MON87751中的插入的转基因DNA(SEQ ID NO:9)的完整DNA序列。
使用用于产生转基因大豆事件MON87751的转化构建体1产生许多转基因事件,并且生成十个另外的转化构建体且用于产生许多许多与大豆事件MON87751及相似的大豆事件相比较的其它转基因大豆事件。通过ELISA测定就两种杀昆虫蛋白Cry2Ab和Cry1A.105在叶片组织中的表达对这些事件进行测试。在小块荫棚试验中就用于防治鳞翅目昆虫害虫的效力对由每个转化及大多数构建体产生的事件子集进行测试。可以确定植物表达元件及Cry2Ab和Cry1A.105表达盒在转化构建体1中的相对取向提供具有针对所测试的最广泛的鳞翅目昆虫害虫的最佳效力的事件。
除非本文另作说明,本领域普通技术人员将根据常规用法来理解术语。在分子生物学中的常见术语的定义还可见于Rieger等人,Glossary of Genetics:Classical and Molecular,第5版,Springer-Verlag:New York,1991;及Lewin,Genes V,Oxford University Press:New York,1994中。如本文所用,术语“大豆(soybean)”意指大豆(Glycine max)且包括可用含有事件MON87751 DNA的大豆植物育种的所有植物品种,包括野生大豆物种以及属于容许物种之间的育种的大豆属的那些植物。如本文所用,术语“包含”意指“包括但不限于”。
本发明提供已用含有至少两个表达盒的DNA构建体转化的转基因植物;第一表达盒表达毒性量的杀昆虫蛋白Cry2Ab且第二表达盒表达毒性量的杀昆虫蛋白Cry1A.105。毒性量意指有效量、杀昆虫量、有效杀昆虫量、杀虫有效量、靶昆虫抑制量、有效杀虫量、在鳞翅目昆虫膳食中的杀昆虫量、以及本领域普通技术人员根据常规用法了解的其它类似术语根据本文所公开的方法且用本文所公开的DNA构建体转化的大豆植物对鳞翅目昆虫害虫有抗性。相关的农业性状提供将这些性状一起保持在育种群体中的方便性,并且展现对比仅含有赋予鳞翅目昆虫害虫以抗性的单一基因(即Cry1Ac)的植物更广泛的鳞翅目昆虫害虫的抗性。
转基因“植物”是通过以下操作产生:用异源DNA,即包括许多目标有效特征的多核酸构建体转化;使由转基因插入植物细胞基因组中产生的植物再生,并且选择特定的植物,所述植物的特征为插入至特定的基因组位置中及再生的转基因植物的有效特征的数目。术语“事件”是指来自包含插入的DNA且侧接有紧邻于插入的DNA的基因组序列的原始转化体的DNA。此类DNA是独特的且预期将转移到接受插入的DNA的后代中,所述插入的DNA含有目标转基因,所述转基因是作为一个含有插入的DNA(例如,原始转化体及由自身产生的后代)的亲本系与不含有插入的DNA的亲本系的有性杂交的结果。本发明还提供原始转化体植物及包含异源DNA的转化体的后代。此类后代可通过包含事件的植物与另一植物之间的有性异型杂交而产生,其中所述后代包含异源DNA。甚至在与轮回亲本的多次重复杂交之后,所述事件还是存在于杂交后代中的相同染色体位置处。本发明涉及转基因事件、包含MON87751的大豆植物、其后代、以及其中所含的DNA组合物。
“探针”是可连接有常规的可检测标记或报道分子(例如放射性同位素、配体、化学发光剂或酶)的分离的核酸。此类探针与靶核酸的一条链互补,在本发明情况下,与来自MON87751(不管是来自含有MON87751的植物还是来自包含MON87751 DNA的样品)的DNA的一条链互补。根据本发明的探针不仅包含脱氧核糖核酸或核糖核酸,而且包含聚酰胺及其它探针材料,其特异性地结合至靶DNA序列且可用于检测靶DNA序列的存在。
DNA引物是分离的多核酸,所述多核酸通过核酸杂交退火成互补的靶DNA链以在引物与靶DNA链之间形成杂合体,然后沿着靶DNA链通过聚合酶例如DNA聚合酶来延伸。本发明的DNA引物对或DNA引物组是指适用于例如通过聚合酶链反应(PCR)或其它常规的多核酸扩增方法扩增靶核酸序列的两个DNA引物。
DNA探针和DNA引物可以是11个多核苷酸或更长,或可以是18个多核苷酸或更长、24个多核苷酸或更长、或30个多核苷酸或更长。选出具有足够长度的此类探针和引物以便在高度严格的杂交条件下特异性地杂交至靶序列。优选地,根据本发明的探针和引物与靶序列具有完全的序列相似性,尽管保留杂交至靶序列的能力的不同于靶序列的探针可通过常规方法来设计。
基于本文所公开的侧翼基因组DNA及插入序列的引物和探针可用于通过常规方法、例如通过再克隆和对此类DNA分子测序来证实(且必要时校正)所公开的DNA序列。
本发明的核酸探针和引物在严格条件下杂交至靶DNA分子。任何常规的核酸杂交或扩增方法都可用于鉴别来自转基因植物的DNA在样品中的存在。又被称为其核酸区段或片段的多核酸分子能够在某些情况下特异性地杂交至其它核酸分子。如本文所用,两个多核酸分子据说能够特异性地彼此杂交,如果这两个分子能够形成反平行双链核酸结构的话。一个核酸分子据说是另一个核酸分子的“互补物”,如果它们展现完全互补性的话。如本文所用,当分子中一个的每个核苷酸与另一个的核苷酸互补时,所述分子据说展现“完全互补性”。如果两个分子可以足够的稳定性彼此杂交以容许它们在至少常规的“低严格”条件下保持彼此间退火,那么这两个分子据说是“最低限度互补的”。类似地,如果分子可以足够的稳定性彼此杂交以容许它们在常规的“高严格”条件下保持彼此间退火,那么这些分子据说是“互补的”。常规的严格条件是由Sambrook等人,1989且由Haymes等人在Nucleic Acid Hybridization,A Practical Approach,IRL Press,Washington,DC(1985)中描述。因此,与完全互补的偏差是允许的,只要此类偏差不完全排除分子形成双链结构的能力。为了使核酸分子能用作引物或探针,其仅需在序列上足够互补以便能够在特定的溶剂和所用的盐浓度下形成稳定的双链结构。
如本文所用,基本上同源的序列是将在高严格条件下特异性地杂交到被比较的核酸序列的互补序列的核酸序列。本领域技术人员已知促进DNA杂交的适当的严格条件,例如在约45℃下6.0x氯化钠/柠檬酸钠(SSC),接着是在50℃下2.0 x SSC的洗涤,或者这些条件可见于Current Protocols in Molecular Biology,John Wiley&Sons,N.Y.(1989),6.3.1-6.3.6中。例如,洗涤步骤中的盐浓度可选自在50℃下约2.0x SSC的低严格性至在50℃下约0.2 x SSC的高严格性。另外,在洗涤步骤中的温度可从在室温下(约22℃)的低严格条件提高到在约65℃下的高严格条件。温度和盐都可变化,或者温度或盐浓度中的一个可保持恒定,而另一个变量变化。在一个优选实施方案中,本发明的多核酸将在中等严格条件,例如在约2.0 x SSC和约65℃下特异性地杂交至在以下列出的核酸分子中的一个或多个:SEQ ID NO:1、2、3、4、5、6、7、8、9、10、17、18、19、20、21、22、23、或24、或其互补序列或任一片段。在一个特别优选实施方案中,本发明的核酸将在高严格性条件下特异性地杂交至在以下列出的核酸分子中的一个或多个:SEQ ID NO:1、2、3、4、5、6、7、8、9、10、17、18、19、20、21、22、23、或24、或互补序列或任一片段。在本发明的一个方面中,本发明的优选标记核酸分子具有在以下中列出的核酸序列:SEQ ID NO:1、或SEQ ID NO:2、或SEQ ID NO:3、或SEQ ID NO:4、或SEQ ID NO:5、或SEQ ID NO:6、或SEQ ID NO:7、或SEQ ID NO:8、或SEQ ID NO:9、或SEQ ID NO:10;或SEQ ID NO:17、或SEQ ID NO:18、或SEQ ID NO:19、或SEQ ID NO:20、或SEQ ID NO:21、或SEQ ID NO:22、或SEQ ID NO:23、或其互补序列或任一片段。探针与靶DNA分子的杂交可通过本领域技术人员已知的许多方法来检测,这些方法可包括但不限于荧光标签、放射性标签、基于抗体的标签以及化学发光标签。
对于使用特定的扩增引物对的靶核酸序列(例如通过PCR)的扩增,“严格条件”是容许引物对仅杂交到具有相应的野生型序列(或其互补序列)的引物将结合的靶核酸序列且优选在DNA热扩增反应中产生独特的扩增产物(即扩增子)的条件。
术语“特异于(靶序列)”指示在严格的杂交条件下仅杂交至包含靶序列的样品中的靶序列的探针或引物。
如本文所用,“扩增的DNA”或“扩增子”是指针对作为多核酸模板的一部分的靶多核酸分子的多核酸扩增方法的产物。例如,为了确定由有性杂交产生的大豆植物是否含有来自包含本发明的事件MON87751的大豆植物的转基因植物基因组DNA,从大豆植物组织样品中提取的DNA可经受使用引物对的多核酸扩增方法,所述引物对包含源自于在侧接有事件MON87751的异源插入的DNA的区域中的基因组DNA序列且在插入的DNA的5’至3’方向上通过聚合酶来延长的第一引物。第二引物源自于异源插入的DNA分子,其是通过聚合酶在第一引物所源自的侧翼基因组DNA的5'至3'方向上延长。扩增子在长度上可在引物对加一个核苷酸碱基对、或加约五十个核苷酸碱基对、或加约两百五十个核苷酸碱基对、或加约四百五十个核苷酸碱基对或更长的组合长度范围内。或者,引物对可源自于插入的异源DNA的两侧上的基因组序列以便产生包含整个插入多核苷酸序列(例如,从SEQ ID NO:10的5’端上的基因组部分分离的正向引物和从SEQ ID NO:10的3’端上的基因组部分分离的相反引物,其扩增包含在本文中在含有事件MON87751的基因组中鉴别的插入的异源DNA序列(SEQ ID NO:9)的DNA分子)的扩增子。源自于邻近于插入的转基因DNA的植物基因组序列的引物对的一个成员与插入的DNA序列相距一段距离,此距离可在一个核苷酸碱基对至高达约二万个核苷酸碱基对的范围内。术语“扩增子”的使用特别排除引物二聚体,其可在DNA热扩增反应中形成。
出于实用目的,应该设计产生具有有限尺寸范围(例如,在100与1000个碱基之间)的扩增子的引物。较小(长度较短的多核苷酸)尺寸的扩增子一般在热扩增反应中更可靠地产生,允许较短的周期时间且可易于在琼脂糖凝胶上分离和目测或适用于终点样测定中。较小的扩增子可通过本领域中已知的DNA扩增子检测方法来产生和检测。另外,使用引物对产生的扩增子可被克隆至载体中,繁殖,分离并且测序或可用在本领域中沿用已久的方法直接测序。源自于SEQ ID NO:7与SEQ ID NO:9的组合或SEQ ID NO:8与SEQ ID NO:9的组合的任何引物对是本发明的一个方面,这些引物对适用于DNA扩增方法中以产生用于诊断包含MON87751的植物或其后代的扩增子。包含SEQ ID NO:7的至少15个连续核苷酸或其互补序列的任何单个分离的DNA多核苷酸引物分子是本发明的一个方面,所述引物分子适用于DNA扩增方法中以产生用于诊断包含MON87751的植物或其后代的扩增子。包含SEQ ID NO:8的至少15个连续核苷酸或其互补序列的任何单个分离的DNA多核苷酸引物分子是本发明的一个方面,所述引物分子适用于DNA扩增方法中以产生用于诊断包含MON87751的植物或其后代的扩增子。包含SEQ ID NO:9的至少15个连续核苷酸或其互补序列的任何单个分离的DNA多核苷酸引物分子是本发明的一个方面,所述引物分子适用于DNA扩增方法中以产生用于诊断包含MON87751的植物或其后代的扩增子。
多核酸扩增可通过本领域中已知的各种多核酸扩增方法中的任一种完成,包括聚合酶链反应(PCR)。扩增方法是本领域中已知的并且尤其描述于美国专利No.4,683,195和4,683,202及PCR Protocols:A Guide to Methods and Applications,Innis等人编著,Academic Press,San Diego,1990中。已经开发了PCR扩增方法来扩增高达22kb(千碱基)基因组DNA和高达42kb噬菌体DNA(Cheng等人,Proc.Natl.Acad.Sci.USA 91:5695-5699,1994)。这些方法以及DNA扩增领域中已知的其它方法可在本发明的实践中使用。异源DNA插入物的序列或来自大豆事件MON87751的侧翼基因组DNA序列可通过以下操作来验证(且必要时校正):使用源自于本文所提供的序列的引物扩增来自含有事件MON87751 DNA的大豆种子或由含有事件MON87751 DNA(以登记号PTA-120166由ATCC保藏)的大豆种子长成的大豆植物的此类DNA分子,然后进行PCR扩增子或其克隆的DNA片段的标准DNA测序。
通过这些方法产生的诊断性扩增子可通过多个技术来检测。一种此类方法是Genetic Bit Analysis(Nikiforov等人Nucleic Acid Res.22:4167-4175,1994),其中设计一种DNA寡核苷酸,其迭盖邻近的侧翼基因组DNA序列和插入的DNA序列两者。所述寡核苷酸被固定在微量滴定板的孔中。在目标区域的PCR(在插入序列中使用一个引物且在邻近的侧翼基因组序列中使用一个引物)之后,单链PCR产物可杂交至固定的寡核苷酸并且充当用于使用DNA聚合酶和对预期下一个碱基有特异性的标记的双脱氧核苷酸三磷酸(ddNTP)的单碱基延伸反应的模板。读出过程可以是基于荧光的或基于ELISA的。信号指示由于成功的扩增、杂交和单碱基延伸导致的转基因/基因组序列的存在。
另一种方法是如Winge(Innov.Pharma.Tech.00:18-24,2000)描述的焦磷酸测序技术。在此方法中,设计一种寡核苷酸,其迭盖邻近的基因组DNA和插入的DNA接合点。寡核苷酸杂交至来自所关注区域的单链PCR产物(一个引物在插入序列中且一个引物在侧翼基因组序列中)并且在DNA聚合酶、ATP、硫酸化酶、荧光素酶、三磷酸腺苷双磷酸酶、腺苷5’磷酸硫酸及荧光素存在下培养。单独加入DNTP且掺入产生测量的光信号。光信号指示由于成功的扩增、杂交和单或多碱基延伸导致的转基因/基因组序列的存在。
如Chen等人描述的荧光偏振(Genome Res.9:492-498,1999)是可用于检测本发明的扩增子的方法。使用此方法设计一种寡核苷酸,其迭盖基因组侧翼和插入的DNA接合点。寡核苷酸杂交至来自所关注区域的单链PCR产物(一个引物在插入的DNA中且一个引物在侧翼基因组DNA序列中)并且在DNA聚合酶和荧光标记的ddNTP存在下培养。单碱基延伸导致ddNTP的掺入。可使用荧光计将掺入测量为在偏振方面的变化。在偏振方面的变化指示由于成功的扩增、杂交和单碱基延伸导致的转基因/基因组序列的存在。
(PE Applied Biosystems,Foster City,CA)被描述为检测和定量DNA序列的存在的方法并且在由制造商提供的说明书得到充分认识。简单说来,设计一种FRET寡核苷酸探针,其迭盖基因组侧翼和插入DNA接合点。FRET探针和PCR引物(一个引物在插入的DNA序列中且一个在侧翼基因组序列中)在热稳定聚合酶和dNTP存在下循环。FRET探针的杂交导致FRET探针上荧光部分从淬火部分裂解和释放。荧光信号指示由于成功的扩增和杂交导致的转基因/基因组序列的存在。
如Tyangi等人(Nature Biotech.14:303-308,1996)中所述,已描述了用于序列检测的分子信标。简单说来,设计一种FRET寡核苷酸探针,其迭盖侧翼基因组和插入的DNA接合点。FRET探针的独特结构造成其包含二级结构,该二级结构使荧光和淬火部分保持邻近。FRET探针和PCR引物(一个引物在插入的DNA序列中且一个在侧翼基因组序列中)在热稳定聚合酶和dNTP存在下循环。在成功的PCR扩增之后,FRET探针与靶序列的杂交导致探针二级结构的消除和荧光部分与淬火部分的空间隔离。得到荧光信号。荧光信号指示由于成功的扩增和杂交导致的侧翼/转基因插入序列的存在。
基于DNA扩增方法的DNA检测试剂盒含有DNA引物分子,所述DNA引物分子特异性地杂交至靶DNA并且在适当的反应条件下扩增诊断性扩增子。所述试剂盒可提供一种基于琼脂糖凝胶的检测方法或本领域中已知的检测诊断性扩增子的许多方法。DNA检测试剂盒可使用本文所公开的组合物开发且适用于鉴别样品中的大豆事件MON87751 DNA并且可应用于用于育种含有事件MON87751 DNA的大豆植物的方法。含有与如SEQ ID NO:10中列出的大豆基因组区域的任何部分及SEQ ID NO:10中列出的插入的转基因DNA的任何部分同源或互补的DNA引物的试剂盒是本发明的一个目标。DNA分子可用于DNA扩增方法(PCR)中或用作多核酸杂交方法(即DNA分析、RNA分析)中的探针。
接合序列可由来自由以下组成的组的序列表示:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。例如,接合序列可任意地由如SEQ ID NO:1和SEQ ID NO:2所提供的核苷酸序列表示。或者,接合序列可任意地由如SEQ ID NO:3和SEQ ID NO:4所提供的核苷酸序列表示。或者,接合序列可任意地由如SEQ ID NO:5和SEQ ID NO:6所提供的核苷酸序列表示。这些核苷酸通过磷酸二酯键连接且在大豆事件MON87751中作为重组植物细胞基因组的一部分存在。SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26中的一个或多个在源自于大豆植物、大豆种子或大豆植物部分的样品中的鉴别决定了DNA是获自大豆事件MON87751且用于诊断在含有来自大豆事件MON87751的DNA的样品中的存在。本发明因此提供含有如以下所提供的至少一个核苷酸序列的DNA分子:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。源自于足以包含至少一个如以下所提供的序列的转基因大豆事件MON87751的DNA的任何区段都在本发明的范围内:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、或SEQ ID NO:26。另外,包含与此段落中所述的任何序列互补的序列的任何多核苷酸都在本发明的范围内。
本发明提供示范性DNA分子,其可用作引物或探针用于检测源自于包含事件MON87751 DNA的大豆植物的DNA在样品中的存在。此类引物或探针对靶核酸序列有特异性且因而适用于通过本文所述的本发明方法鉴别大豆事件MON87751核酸序列。
“引物”可以是高度纯化的、分离的多核苷酸,其被设计用于涉及热扩增的特异性退火或杂交方法中。一对引物可与模板DNA(如大豆基因组DNA的样品)在如聚合酶链反应(PCR)的热扩增中一起使用以产生扩增子,其中由此类反应产生的扩增子将具有对应于位于其中引物杂交至模板的两个位点之间的模板DNA序列的DNA序列。如本文所用,“扩增子”是已使用扩增技术合成的DNA的片段(piece/fragment)的复制。本发明的扩增子可包含如SEQ ID NO:11或SEQ ID NO:12所提供的至少一个序列。引物通常被设计来杂交至互补的靶DNA链以形成引物与靶DNA链之间的杂种,并且引物的存在是通过聚合酶识别的点以使用靶DNA链作为模板开始引物的延伸(即,另外的核苷酸聚合至加长的核苷酸分子中)。如本发明中使用的引物对意在指示使用双链核苷酸区段的两个引物结合相反链,以便通常在热扩增反应或其它常规的核酸扩增方法中线性地扩增在靶向由引物对的单个元件结合的位置之间的多核苷酸区段。适用作引物的示例性DNA分子作为SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:14或SEQ ID NO:15来提供。作为SEQ ID NO:11和SEQ ID NO:12提供的引物对适用作第一DNA分子和不同于第一DNA分子的第二DNA分子,并且两者都具有足够长度的SEQ ID NO:10的连续核苷酸以用作DNA引物,所述DNA引物当在热扩增反应中与源自于大豆事件MON87751的模板DNA一起使用时产生用于诊断样品中的大豆事件MON87751 DNA的扩增子。
“探针”是与靶核酸的一条链互补的分离的核酸。根据本发明的探针不仅包含脱氧核糖核酸或核糖核酸,而且包含聚酰胺及其它探针材料,其特异性地结合至靶DNA序列且此类结合的检测可适用于诊断、区分、测定、或证实靶DNA序列在特定样品中的存在。探针可连接至常规的可检测标记或报道分子,例如放射性同位素、配体、化学发光剂或酶。适用作探针的示例性DNA分子作为SEQ ID NO:13和SEQ ID NO:16来提供。
根据本发明的探针和引物可与靶序列具有完全的序列同一性,尽管保留优先地杂交至靶序列的能力的不同于靶序列的引物和探针可通过常规方法来设计。为了使核酸分子能用作引物或探针,其仅需在序列上足够互补以便能够在特定的溶剂和所用的盐浓度下形成稳定的双链结构。任何常规的核酸杂交或扩增方法都可用于鉴别来自大豆事件MON87751的转基因DNA在样品中的存在。探针和引物一般是至少约11个核苷酸、至少约18个核苷酸、至少约24个核苷酸、或至少约30个核苷酸或更长。此类探针和引物在严格的杂交条件下特异性地杂交至靶DNA序列。常规的严格条件是由Sambrook等人,1989且由Haymes等人在Nucleic Acid Hybridization,A Practical Approach,IRL Press,Washington,DC(1985)中描述。
本领域技术人员所熟知的许多方法都可用于分离和操纵在本发明中所公开的DNA分子或其片段,包括热扩增方法。也可以通过其它技术获得DNA分子或其片段,如通过化学方法直接合成片段,正如通常使用自动寡核苷酸合成仪所进行的实践。
本文所提供的DNA分子及相应的核苷酸序列因此尤其适用于鉴别大豆事件MON87751,选择包含大豆事件MON87751的植物品种或杂种,检测源自于样品中的转基因大豆事件MON87751的DNA的存在,以及监测样品中大豆事件MON87751或源自于包含事件MON87751的大豆植物的植物部分的存在和/或不存在。
本发明提供大豆植物、大豆植物细胞、大豆种子、大豆植物部分(如花粉、胚珠、豆荚、花组织、根组织、茎组织及叶片组织)、大豆后代植物、大豆油、大豆酒、豆浆、大豆蛋白、以及大豆商品产品。这些大豆植物、大豆植物细胞、大豆种子、大豆植物部分、大豆后代植物、大豆油、大豆酒、豆浆、大豆蛋白及大豆商品产品含有可检测量的本发明的多核苷酸,即如具有如下所提供的至少一个序列的多核苷酸:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、或SEQ ID NO:26。本发明的大豆植物、植物细胞、种子、植物部分、及后代植物还可含有一个或多个另外的转基因。此类另外的转基因可以是编码赋予包括但不限于以下的所需性状的蛋白或RNA分子的任何核苷酸序列:提高的昆虫抗性、增加的水分利用率、提高的产量表现、提高的抗旱性、提高的种子质量、改善的营养状况和/或提高的除草剂耐受性,其中所需性状是相对于缺少此类另外的转基因的大豆植物来测量。
本发明提供源自于含有事件MON87751 DNA的转基因大豆植物的大豆植物、大豆植物细胞、大豆种子、大豆植物部分(如花粉、胚珠、豆荚、花组织、根组织、茎组织及叶片组织)、大豆后代植物。含有事件MON87751 DNA的大豆种子的代表性样品已根据布达佩斯条约(Budapest Treaty)保藏在美国典型培养物保藏中心。ATCC保藏库已将专利保藏名称PTA-120166分配给含有事件MON87751 DNA的种子。
本发明提供一种包含具有选自在其基因组中存在的以下的至少一个序列的DNA分子的微生物:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。此类微生物的一个实例是转基因植物细胞。微生物如本发明的植物细胞适用于许多工业应用中,包括但不限于:(i)用作科学探究或工业研究的研究工具;(ii)在用于产生内源或重组碳水化合物、脂质、核酸或蛋白产物或小分子的培养中使用,这些物质可用于随后的科学研究或用作工业产品;以及(iii)与现代植物组织培养技术一起用于产生转基因植物或植物组织培养物,其随后可用于农业研究或生产。如转基因植物细胞的微生物的生产和使用利用现代微生物学技术和人工干预以产生人工的、独特的微生物。在此过程中,将重组DNA插入植物细胞基因组中以生成转基因植物细胞,所述转基因植物细胞是单独的且独特于天然存在的植物细胞。此转基因植物细胞可然后像细菌和酵母细胞一样使用现代微生物学技术来培养并且可以未分化的单细胞状态存在。转基因植物细胞的新遗传组成和表型是通过将异源DNA整合到细胞的基因组中而产生的技术效果。本发明的另一方面是一种使用本发明微生物的方法。使用本发明微生物如转基因植物细胞的方法包括(i)通过将重组DNA整合到细胞的基因组中产生转基因细胞,然后使用此细胞得到具有相同的异源DNA的另外的细胞的方法;(ii)使用现代微生物学技术培养含有重组DNA的细胞的方法;(iii)从培养细胞产生和纯化内源或重组碳水化合物、脂质、核酸或蛋白产物的方法;以及(iv)用转基因植物细胞使用现代植物组织培养技术产生转基因植物或转基因植物组织培养物的方法。
本发明的植物可将事件MON87751 DNA,包括插入大豆事件MON87751中的转基因,遗传给后代。如本文所用,“后代”包括包含源自于祖先植物的事件MON87751 DNA和/或包含具有选自由以下组成的组的至少一个序列的DNA分子的任何植物、种子、植物细胞和/或可再生的植物部分:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。植物、后代、及种子对于转基因可以是纯合的或杂合的。后代可从由含有大豆事件MON87751的植物产生的种子和/或从由用来自含有大豆事件MON87751的植物的花粉受精的植物产生的种子长成。
后代植物可通过自花授粉(又名“自交”)产生真正的植物育种系,即对转基因纯合的植物。适当的后代自交可产生对于加入的外源性基因是纯合的植物。
或者,后代植物可异型杂交,例如用另一不相关的植物育种,产生品种或杂种种子或植物。另一不相关的植物可以是转基因或非转基因的。本发明的品种或杂种种子或植物可因此通过将缺少大豆事件MON87751的特异性及独特的DNA的第一亲代与包含大豆事件MON87751的第二亲代有性地杂交由此产生包含大豆事件MON87751的特异性及独特的DNA的杂种而得到。每个亲代可以是杂种或近交种/品种,只要所述杂交或育种产生本发明的植物或种子,即具有至少一个含有大豆事件MON87751的DNA的等位基因和/或具有选自以下的至少一个序列的DNA分子的种子:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。两个不同的转基因植物可因此杂交产生含有两个独立分离的、加入的、外源性基因的杂种后代。例如,含有赋予大豆以双重昆虫抗性作用模式的Cry2Ab和Cry1A.105的MON87751可与其它转基因大豆植物杂交产生具有两种转基因亲代特征的植物。一个实例将是含有赋予大豆以双重昆虫抗性作用模式的Cry2Ab和Cry1A.105的MON87751与具有一个或多个如除草剂耐受性(例如,大豆事件MON89788或大豆事件MON 87708)和/或昆虫防治(例如大豆事件MON 88701)的另外的性状的植物的杂交,从而产生具有对鳞翅目昆虫害虫以双重抗性作用模式且具有至少一个或多个另外的性状的后代植物或种子。还可以与亲本植物进行回交和与非转基因植物进行异型杂交,以及无性繁殖。通常用于不同性状和作物的其它育种方法的描述可见于若干参考文献的一篇中,例如Fehr,Breeding Methods for Cultivar Development,Wilcox J.编著,American Society of Agronomy,Madison WI(1987)。
本发明提供一种源自于包含事件MON87751的大豆植物的植物部分。如本文所用,“植物部分”是指由源自于包含事件MON87751的大豆植物的材料构成的植物的任何部分。植物部分包括但不限于花粉、胚珠、豆荚、花、根或茎组织、纤维、以及叶片。植物部分可以是活的、非存活的、可再生的、和/或非可再生的。
本发明提供一种源自于包含事件MON87751的大豆植物且含有可检测量的对事件MON87751有特异性的核酸的商品产品。如本文所用,“商品产品”是指由源自于含有大豆事件MON87751 DNA的大豆植物、完整或加工的大豆种子、一个或多个植物细胞和/或植物部分的材料构成的任何组合物或产物。商品产品可以出售给消费者并且可以是活的或非存活的。非存活的商品产品包括但不限于非存活的种子;完整的或加工的种子、种子部分、及植物部分;大豆油、大豆蛋白、大豆粕(soybean meal)、大豆粉(soybean flour)、大豆坯片、大豆豆皮、豆浆、大豆干酪、大豆酒、包含大豆的动物饲料、包含大豆的纸、包含大豆的乳酪、大豆生物质、以及使用大豆植物及大豆植物部分生产的燃料产品。活的商品产品包括但不限于种子、植物、及植物细胞。包含事件MON87751的大豆植物因此可用于制造通常从大豆获取的任何商品产品。源自于包含事件MON87751的大豆植物的任何此类商品产品都可含有至少可检测量的对应于大豆事件MON87751的特异性及独特的DNA,并且具体说来可含有可检测量的包含具有至少一个选自以下的序列的DNA分子的多核苷酸:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。可使用用于核苷酸分子的任何标准检测方法,包括本文所公开的检测方法。商品产品在本发明的范围内,如果存在任何可检测量的具有至少一个选自以下的序列的DNA分子的话:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。
本发明的植物、后代、种子、植物细胞、植物部分(如花粉、胚珠、豆荚、花、根或茎组织、以及叶片)及商品产品因此尤其适用于为了出于农业目的产生包含大豆事件MON87751的种子和/或植物部分而使植物生长,为了植物育种和研究目的产生包含大豆事件MON87751的后代,为了工业和研究应用而与微生物学技术一起使用,以及出售给消费者。
提供用于产生昆虫抗性大豆植物的方法,所述大豆植物包含特异于及独特于本发明的事件MON87751的DNA序列。在这些方法中使用的转基因植物对于转基因可以是纯合的或杂合的。通过此等方法产生的后代植物可以是品种或杂种植物;可以从由含有大豆事件MON87751的植物产生的种子和/或从由用来自含有大豆事件MON87751的植物的花粉受精的植物产生的种子长成;并且对于转基因可以是纯合或杂合的。后代植物可随后通过自花授粉产生真正的植物育种系,即对于转基因是纯合的植物,或替代地,可以异型杂交,例如,用另一不相关的植物育种以产生品种或杂种种子或植物。
提供检测源自于包含大豆事件MON87751的大豆细胞、大豆组织、大豆种子或大豆植物的DNA在样品中的存在的方法。一种方法由以下步骤组成:(i)从至少一种大豆细胞、大豆组织、大豆种子或大豆植物提取DNA样品,(ii)使所述DNA样品在适于DNA测序的条件下与能够产生对事件MON87751DNA有特异性的DNA序列的至少一个引物接触,(iii)进行DNA测序反应,以及然后(iv)证实核苷酸序列包含对事件MON87751或其中所包含的构建体有特异性的核苷酸序列,如选自由以下组成的组中的一个:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。另一种方法由以下步骤组成:(i)从至少一种大豆细胞、大豆组织、大豆种子或大豆植物提取DNA样品,(ii)使所述DNA样品在适于DNA扩增的条件下与能够产生来自事件MON87751 DNA的扩增子的引物对接触,(iii)进行DNA扩增反应,以及然后(iv)检测扩增子分子和/或证实扩增子的核苷酸序列包含对事件MON87751有特异性的核苷酸序列,如选自由SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、及SEQ ID NO:6组成的组中的一个。扩增子应是对事件MON87751有特异性的扩增子,如包含SEQ ID NO:1、或SEQ ID NO:2、或SEQ ID NO:3、或SEQ ID NO:4、或SEQ ID NO:5、或SEQ ID NO:6的扩增子。检测扩增子中对事件MON87751有特异性的核苷酸序列对于大豆事件MON87751特异性DNA在样品中的存在是决定性的和/或诊断性的。能够在适于DNA扩增的条件下产生来自事件MON87751 DNA的扩增子的引物对的一个实例是作为SEQ ID NO:11和SEQ ID NO:12来提供。其它引物对可易于由本领域技术人员来设计并且将产生包含SEQ ID NO:1、或SEQ ID NO:2、或SEQ ID NO:3、或SEQ ID NO:4、或SEQ ID NO:5、或SEQ ID NO:6的扩增子,其中此类引物对在侧接有插入物的基因组区域内包含至少一个引物且在插入物内包含第二引物。检测源自于包含大豆事件MON87751的大豆细胞、大豆组织、大豆种子、或大豆植物的DNA在样品中的存在的另一种方法由以下步骤组成:(i)从至少一种大豆细胞、大豆组织、大豆种子或大豆植物提取DNA样品,(ii)使所述DNA样品与对事件MON87751 DNA有特异性的DNA探针接触,(iii)允许探针与DNA样品在严格的杂交条件下杂交,以及然后(iv)检测在探针与靶DNA样品之间的杂交。对事件MON87751 DNA有特异性的DNA探针序列的一个实例是作为SEQ ID NO:13或SEQ ID NO:16来提供。其它探针可易于由本领域技术人员来设计并且将包含侧接有插入物的基因组DNA的至少一个片段及插入物DNA的至少一个片段,如在包括但不限于以下的各物中所提供的序列:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、及SEQ ID NO:10。检测探针与DNA样品的杂交对于大豆事件MON87751特异性DNA在样品中的存在有诊断性。替代地,杂交的不存在对于大豆事件MON87751特异性DNA在样品中的不存在有诊断性。
提供DNA检测试剂盒,其适用于鉴别样品中的大豆事件MON87751DNA并且还可应用于育种含有适当的事件DNA的大豆植物的方法。此类试剂盒含有包含以下片段的DNA引物和/或探针:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。此类试剂盒的一个实例包含长度足以用作DNA探针的至少一个SEQ ID NO:10连续核苷酸的DNA分子,所述DNA探针适用于检测源自于包含事件MON87751的转基因大豆植物的DNA在样品中的存在和/或不存在。源自于包含事件MON87751的转基因大豆植物的DNA将包含具有至少一个选自以下的序列的DNA分子:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26。提供足以用作DNA探针的DNA分子,其适用于测定、检测或诊断作为SEQ ID NO:13提供的大豆事件MON87751 DNA在样品中的存在和/或不存在。其它探针可易于由本领域技术人员来设计并且应包含至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少26个、至少27个、至少28个、至少29个、至少30个、至少31个、至少32个、至少33个、至少34个、至少35个、至少36个、至少37个、至少38个、至少39、或至少40个SEQ ID NO:10的连续核苷酸且对大豆事件MON87751 DNA具有足够的独特性以便鉴别源自于所述事件的DNA。另一种类型的试剂盒包含适用于产生扩增子的引物对,所述扩增子适用于检测源自于转基因大豆事件MON87751的DNA在样品中的存在和/或不存在。此类试剂盒将采用一种包括以下操作的方法:将靶DNA样品与如本文所述的引物对接触;然后进行足以产生扩增子的核酸扩增反应,所述扩增子包含具有至少一个选自以下的序列的DNA分子:SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26;且然后检测所述扩增子的存在和/或不存在。此类方法还可包括对扩增子或其片段进行测序,这对于大豆事件MON87751特异性DNA在靶DNA样品中的存在将是决定性的(即诊断性的)。其它引物对可易于由本领域技术人员来设计并且应包含在包括但不限于SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10;SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、及SEQ ID NO:26中提供的至少15个、至少16个、至少17个、至少18个、至少19个、至少20个、至少21个、至少22个、至少23个、至少24个、至少25个、至少26个、至少27个、至少28个、至少29个、或至少30个连续的核苷酸序列且对大豆事件MON87751 DNA具有足够的独特性以便鉴别源自于所述事件的DNA。
本发明的试剂盒及检测方法尤其适用于鉴别大豆事件MON87751,选择包含大豆事件MON87751的植物品种或杂种,检测源自于样品中的包含事件MON87751的转基因大豆植物的DNA的存在,以及监测样品中包含事件MON87751的大豆植物或源自于包含事件MON87751的大豆植物的植物部分的存在和/或不存在。
异源DNA插入物序列、接合序列或来自大豆事件MON87751的侧翼序列可通过以下操作来验证(且必要时校正):使用源自于本文所提供的序列的引物扩增来自所述事件的此类序列,然后进行扩增子或克隆的DNA的标准DNA测序。
包括以下实施例用于说明本发明的某些优选实施方案的实施例。本领域技术人员应当了解,在以下实施例中公开的技术代表发明人发现在实践本发明中运行良好的方法,且因此可以被认为构成了实施本发明的优选实施例。然而,本领域技术人员应理解可以根据本公开内容对所公开的特定实施方案进行许多改变,且仍然可以获得相似或类似的结果,而不会脱离本发明的精神和范围。
保藏信息
含有事件MON87751 DNA的大豆种子的代表性样品的保藏已经根据布达佩斯条约在美国典型培养物保藏中心(ATCC)于2013年2月28日完成且分配了ATCC登记号PTA-120166,该中心地址在10801University Boulevard,Manassas,Virginia USA,邮编20110。本专利申请待批期间专利和商标专员及一旦请求便由专员确定给予的人可获得所述保藏物。所有对公众的可获得性的限制都将在专利申请被公布后不可撤回地取消。保藏物将在保藏机构中维持30年的时间、或者在最后一次请求后5年、或者到专利的有效期满,取其中期限较长的,在此期间根据需要可以进行保藏物的替换。
实施例1
此实施例描述大豆事件MON87751的转化和选择。已知外源基因在植物中的表达受其染色体位置的影响,或许是由于染色质结构(例如异染色质)或转录调控元件(例如增强子)靠近整合位点的接近度(Weising,1988)。为此,经常必需筛选大量事件以鉴别特征为目标引入基因的最优表达的事件。例如,在植物且在其它有机体中已观察到,在事件之中可能存在引入基因的表达水平上的广泛变化。在表达的空间或时间模式上也可能存在差异,例如,在各种植物组织中转基因的相对表达的差异,其可能不响应于根据存在于引入的基因构建体中的转录调控元件所期待的模式。为此,在事件MON87751的选择期间在转化的大豆中生成并测试11个不同的表达载体。
将11个不同的表达构建体在植物中转化并测试。单独的表达构建体在使用以下表达元件的组合方面有变化,即增强子(E)、启动子(P)、前导序列(L)、内含子(I)、叶绿体靶向肽(CTP)、以及3'转录终止及多腺苷酸化信号(T)。T-DNA区段还含有编码Cry蛋白两者(Cry2Ab和Cry1A.105)的两个表达盒或含有编码单一Cry蛋白(即Cry2Ab或Cry1A.105)的一个表达盒。在具有含有Cry2Ab和Cry1A.105两个表达盒的T-DNA区段的表达构建体中的进一步变化是编码Cry蛋白的两个盒的相对取向。具体来说,两个Cry蛋白表达盒位于转录的相对串联取向上以使得从各Cry蛋白的每个启动子表达在相同方向上进行,但每个来自其单独各自的启动子(参见图2),或者两个Cry蛋白表达盒在相反取向上以使得从两个Cry蛋白的每个启动子表达远离两个启动子之间的中心点,即每个Cry蛋白表达盒的转录在相反方向上进行并且不会汇合(参见图2)。与构建体1和3相比,编码Cry1A.105的DNA序列是在构建体4、6、7、8及9中多样化的序列。在又一个变型中,在具有以转录的相反方向取向的两个Cry表达盒的两个构建体中,转录增强子是位于分散的启动子之间(参见图2)。
11个表达构建体通过大豆分生组织的农杆菌介导的转化在三个单独的时间转化。所述方法描述于美国专利No.8,030,544中,其允许在不利用愈伤组织的情况下生成转化的植物。简单说来,分生组织是由发芽的A3555大豆种子的胚胎切除的(Asgrow,St Louis,MO)。构建体1包含两个单独的T-DNA区段,每个由农杆菌边界序列(T-DNA区段)来界定。转化构建体的第一T-DNA区段含有两个表达盒,其中第一表达盒编码来自大肠杆菌的Tn7腺苷酸转移酶基因的区域(其赋予壮观霉素和链霉素抗性;aadA-SPR)且用于选择;并且第二表达盒编码来自根癌土壤杆菌菌株C58的蔗糖磷酸化酶基因的区域(其催化蔗糖转化成果糖和葡萄糖-1-磷酸;STR+OriRi)且用作可评分标记。不同的转化构建体的第二T-DNA区段含有仅编码Cry2Ab的一个表达盒(构建体2、5、10或11)或仅编码Cry1A.105的一个表达盒(构建体3或6);或不同的转化构建体的第二T-DNA区段含有编码Cry2Ab的一个表达盒及编码Cry1A.105的一个表达盒(构建体1、4、7、8或9)(示于图2中)。因为转化构建体的每个T-DNA区段都是由单独的农杆菌边界序列界定,所以包含选择和可评分标记盒的T-DNA区段可整合到大豆细胞基因组中的不同于编码Cry2Ab和/或Cry1A.105表达盒的T-DNA区段的整合位点的位点处。因此,可就选择和可评分标记序列的分离和丢失对事件进行筛选。就主链的不存在及选择/可评分标记盒序列的不存在来选择所有事件。在与携带转化构建体的农杆菌共培养之后,将分生组织置于含有壮观霉素、羧苄青霉素二钠盐、头孢噻肟钠盐及羧噻吩青霉素二钠盐/克拉维酸钾混合物的选择培养基上以抑制未转化的植物细胞及过量的农杆菌的生长。然后将分生组织置于有利于芽和根发育的培养基中。选择具有正常表型特征的生根植物(R0)并且转移到土壤中用于生长和进一步评定。
用于生成事件MON87751的表达构建体1以植物表达元件的5'至3'相对顺序含有编码两个不同Cry蛋白的T-DNA区段(有或无间插序列):源自于拟南芥肌动蛋白2基因(P-At.Act2)的启动子、前导序列和第一内含子;包含源自于拟南芥5-烯醇丙酮酰莽草酸-3-磷酸合酶(EPSPS)基因的N端叶绿体转运肽编码序列的嵌合编码序列,所述N端叶绿体转运肽编码序列同框融合至来自苏云金芽孢杆菌(Bt)(其具有针对植物表达而修饰的核苷酸(CTP2-Cry2Ab))的编码Cry2Ab的基因(其编码赋予昆虫抗性的蛋白)中;源自于稻金属硫蛋白样蛋白基因(T.OsMth)的3’转录终止和多腺苷酸化元件(3’UTR)、在第一Cry蛋白表达盒与第二Cry蛋白表达盒之间的间插序列;源自于拟南芥核酮糖1,5-二磷酸羧化酶小亚基1A基因(P-At.RbcS4)的启动子和前导序列,此启动子-前导序列连接至包含源自于拟南芥核酮糖1,5-二磷酸羧化酶小亚基1A蛋白基因(CTP1)的叶绿体转运肽编码序列的嵌合编码序列,CTP1还含有编码转运肽切割位点的重复序列及来自成熟蛋白的3个氨基酸的编码序列,所述编码序列与编码Cry1A.105的基因(其编码赋予昆虫抗性的蛋白)同框融合,所述编码Cry1A.105的基因由编码Cry1Ab1(结构域I和II)、Cry1Fa1(结构域III)、及Cry1Ac1(毒素原结构域)的基因区段组成,其来自具有针对植物表达而修饰的核苷酸的苏云金芽孢杆菌(Bt);源自于蒺藜苜蓿磷酸盐转运蛋白1基因的3'UTR(T-Mt.Pt1)。在构建体1表达盒中,含有两个单独的Cry2Ab和Cry1A.105表达盒的T-DNA盒具有在任意指定的5'端上的农杆菌右边界,其对于Cry2Ab盒是5';及在任意指定的3'端上的农杆菌左边界,其对于Cry1A.105盒是3'。Cry2Ab盒(启动子至终止子)位于SEQ ID NO:9的位置123-3785处,且Cry1A.105盒(启动子至终止子)位于SEQ ID NO:9的位置3831-9754处。
构建体2(Cry2Ab)和构建体3(Cry1A.105)的T-DNA盒含有单个Cry-蛋白编码盒,其具有构建体1中使用的各Cry-蛋白编码基因的相同元件,参见图2。
构建体4、5、及6在元件取向上分别与构建体1、2、及3相似,但对于两个Cry2Ab和Cry1A.105盒有不同的启动子-前导序列-内含子及叶绿体转运肽。相应的Cry蛋白盒(具有T-Os.Mth的Cry2Ab或具有T-Mt.Pt1的Cry1A.105)的终止子在所有表达构建体1至11中是相同的(参见图2)。
在构建体7-11的每一个中启动子-前导序列-内含子及叶绿体转运肽、Cry-蛋白编码序列及用于两种Cry2Ab和Cry1A.105盒的终止子与构建体4、5、及6中使用的相同。然而,对于构建体7、8、及9,Cry2Ab盒和Cry1A.105盒的取向相对于彼此是逆向或相反的并且转录的取向是在相反方向上,每个来自其各自的启动子,参见图2。构建体7、8、及9在以下方面是不同的:两个盒之间的增强子不存在(构建体7)、或增强子存在;构建体8具有增强子1(E1)、或构建体9具有增强子2(E2),参见图2。构建体10和构建体11是具有E1(构建体10)或E2(构建体11)的单个Cry2Ab盒。
在转化并转移(R0)事件至土壤中之后,进行广泛的分子学分析、农艺学分析、及表型分析以选择事件用于进一步测试。另外,事件是自花授粉的并且将来自所选事件的得到的种子用于田间及另外的分子测试。
分子测试包括以下:测定拷贝数的测定、确定含有两个Cry蛋白的表达盒(构建体1、4、7、8、及9)的完整性的测定、编码Cry蛋白的T-DNA盒(单个Cry蛋白表达盒(构建体2、3、6、10、或11)或两个Cry蛋白表达盒(构建体1、4、7、8、或9))的存在的测定;如通过ELISA测量测定蛋白表达的测定、以及测定T-DNA表达盒的分离率(1:2:1或1:3)的测定。农艺学测定包括(对于由构建体1、2、及3生成的R0事件,通过叶盘生物测定针对两种害虫物种(黎豆夜蛾(Anticarsia gemmatalis,velvetbean caterpillar,VBC)和黄豆银纹夜蛾(大豆夜蛾,SBL))的昆虫效力)。R0植物生长至成熟,事件是自花授粉的,且确定每个事件的种子组。
R0事件的数量通过用11个单独的构建体转化并且转移到变化的土壤中而生成,并且范围在420个事件至大于5000个事件(参见表1)。对于用构建体1进行的转化,由其生成事件MON87751,存在总共1102个植根于土壤中的R0植物,其中由此仅281个事件通过初始分子分析。通过用构建体1进行转化生成的这些281个事件的另外的分子学、农艺学及表型分析仅产生29个R1事件以针对另外的温室分析进行评估。
表1.显示转移到土壤中的事件数量及通过拷贝数测定的事件数量的由11个转化构建体产生的R0事件。
对于由用构建体1转化生成并且评估用于进一步分析的29个R1事件,将R1种子种植于温室中以便用包括以下的测定进行R1事件的分析:(a)R1萌芽(100%萌芽);(b)鉴别纯合植物;(c)证实纯合植物不再含有选择/可评分标记序列(其已经独立地分离)的PCR测定;(d)如通过针对黄豆银纹夜蛾(SBL)的左盘生物测定所确定的昆虫效力;以及(e)如通过针对草地夜蛾(草地粘虫,FAW)的叶盘生物测定所确定的昆虫效力,(f)通过ELISA测定在V7阶段叶片组织上的蛋白表达,晚期事件的Cry2Ab和Cry1A.105蛋白水平>4ppm。除分子测定和昆虫叶盘生物测定结果之外,还收集来自四个选择/事件的农艺学表型观察结果及种子组。基于这些数据总体,来自通过用构建体1转化而生成的21个R1事件的R2种子在农艺学田间试验及效力荫棚试验中进行评估。
实施例2
设计农艺学田间试验来评估表达Cry2Ab和Cry1A.105的大豆事件与对照A3555(亲本背景)相比的表型特征和产率。在这些农艺学田间试验中,对照和事件属于大豆品种A3555,相对成熟度组3(RM3)。试验种植是在随机完全区组设计(RCBD)下经四季且在两个地理位置处进行。在一个地理位置处,每个季节在25个田间地点进行农艺学田间试验,且在第二地理位置处,每个季节在14个田间地点进行农艺学田间试验。在针对所有试验的种植和数据收集中遵循标准农艺实践。所收集的数据包括出苗率、幼苗活力、开花期、花颜色观察、表型观察、绒毛颜色、成熟度、倒伏情况、植物高度、裂开评分、收获日期、种子重量/曲线、种子含水量/曲线、以及以蒲式耳/英亩(bu/ac)来计的产量。
对于数据分析,由于收获前质量问题(即静水、土壤水分不足、出苗不良、因雹暴所致的晚期豆荚裂开)丢弃一些位置,或由于超过15%的变异系数(CV)和/或高位置质量指标(LQI)丢弃一些位置。
在测试的所有位置中,所采取的表型测量指示事件的农艺学评定等级在对照A3555的正常范围内。并不是所有观察都在所有地点进行且一些数据(例如出苗)可能已经收集,而产量并未测定,这是因为由于在早期表型数据收集后出现的问题而丢弃所述位置。
对于农艺学田间试验,由构建体1、2、3、4、5、或6生成且在每个田间试验在两个地理位置处测试的事件数量以及所测试的大豆事件世代(即R3、R4、R5、R6、或R7)示于表2中。
表2.在两个季节和两个地理位置的农艺学田间试验期间为每个构建体测试的事件(和大豆事件世代)数目(n.t.意指未测试)。
在每个季节、每个地理位置及田间试验每个测试平均产量(bu/英亩)中测试的事件的农艺学田间试验的Meta分析显示事件MON87751与对照A3555相比在产量上存在统计上显著的提高(表2)。仅表达Cry2Ab的事件与对照A3555相比在产量上不具有统计上显著的差异,参见表3。仅表达Cry1A.105的事件与对照A3555相比在产量上具有统计上显著的下降,参见表3。
表3.当与非转基因大豆品系A3555相比时在每个季节、每个地理位置及每个田间试验测试产量中测试的事件的农艺学田间试验的Meta分析。
实施例3
进行效力荫棚试验来评估由来自具有两个表达盒的单一构建体的T-DNA区段的插入物表达两种Cry蛋白(即Cry2Ab和Cry1A.105)或单个Cry蛋白(即仅Cry2Ab或仅Cry1A.105)的实验性大豆事件针对荫棚封闭体中所包含的的鳞翅目害虫群体的人工侵染的效力。单基因与双基因事件的比较被用于确定每个单个Cry蛋白对在双基因表达构建体事件中观察到的效力的相对作用。在两个地理位置处在多个季节中进行荫棚试验。在一个地理位置处,测试5种靶害虫物种:黎豆夜蛾(velvetbean caterpillar,VBC)、黄豆银纹夜蛾(大豆夜蛾,SBL)、南部灰翅夜蛾(亚热带粘虫,SAW)、草地夜蛾(草地粘虫,FAW)、及谷实夜蛾(大豆豆荚虫,SPW)。在第二地理位置处,测试3种靶害虫物种:Crocidosema aporem(豆梢蛾,BSM)、薄荷灰夜蛾(向日葵尺蠖,SFL)、及草地夜蛾(草地粘虫,FAW)。
在这些荫棚试验中测试的事件(即条目)是通过用每一分离转化构建体进行转化而生成。由构建体1、2、或3生成的转化事件是在荫棚试验中在R2代中评估并且包括二十个表达两种蛋白的事件(通过用构建体1进行转化而生成的事件)、六个仅表达Cry2Ab的事件(通过用构建体2进行转化而生成的事件)、及六个仅表达Cry1A.105的事件(通过用构建体3进行转化而生成的事件)。其中,12个具有Cry2Ab和Cry1A.105两者的事件(构建体1)、两个仅具有Cry2Ab的事件(构建体2)、及三个仅具有Cry1A.105的事件(构建体3)是在荫棚试验中在R3代中评估的。十一个具有Cry2Ab和Cry1A.105两者的事件(构建体1)在R4代荫棚试验中进一步评估。3个具有Cry2Ab和Cry1A.105两者的事件(构建体1)、一个仅具有Cry2Ab的事件(构建体2)、及一个仅具有Cry1A.105的事件(构建体3)是在R5、R6、及R7荫棚试验中评估的。十个表达Cry2Ab和Cry1A.105的事件(通过用构建体4进行转化生成的事件)、三个仅有Cry2Ab的事件(通过用构建体5进行转化生成的事件)、及三个仅有Cry1A.105的事件(通过用构建体6进行转化生成的事件)是在R3代荫棚试验中评估。两个具有Cry2Ab和Cry1A.105两者的事件、一个仅具有Cry2Ab的事件、及一个仅具有Cry1A.105的事件是在R4荫棚试验中评估的,且一个事件各自在R5荫棚试验中评估。在增强子存在下在相反的5’至3’朝向上表达Cry2Ab和Cry1A.105两者的三个事件(通过用构建体8进行转化而生成的事件)、在增强子不存在下在相反的5’至3’朝向上表达Cry2Ab和Cry1A.105两者的3个堆叠事件(通过用构建体7进行转化而生成的事件)、及2个仅有Cry2Ab的事件(通过用构建体10进行转化而生成的事件)是在R2代中在荫棚试验中评估。阳性转基因大豆对照包括MON87701或事件GM_A19478(与MON87701同时生成)并且两者均表达Cry1Ac。非转基因大豆品系A3555(MON87751事件的亲本背景,相对成熟度3(RM3))和A5547(MON87701和GM_A19478的亲本背景,RM5)被纳入所有荫棚和田间试验中作为阴性对照。纳入非转基因大豆品系AG3705作为一些试验中的白花检查。
在确立和进行荫棚试验中遵循标准实践。在每次侵染之后在对阴性检查的最大损害之时对这些块评估一次(通常在蛹被置于荫棚内之后的3-4周)。在每次评价时,记录以下农艺学观察结果:植物生长的日期和阶段。另外,对于食叶昆虫,记录每个块中估算的落叶%。对于C.aporema,在每个块中随机选择十个植物并且记录具有损害的植物数量。在一些情况下,还记录活幼虫的数量。
落叶数据进行ANOVA以确定品系之中的显著变异来源并且在0.05概率水平(P)下在每个位置处针对每种昆虫进行重复实验。使用Tukey-Kramer测试(Kramer 1956)在P=0.05下测定平均值之中的显著差异。
在第二地理位置处,在一季中使用薄荷灰夜蛾和C.aporema用于侵染进行三个小块荫棚试验。试验设计包括随机完全区组设计(RCBD)测试组,其中每个事件或对照重复三次,所测试的事件展示于表4中。一个试验在大豆生长的中间营养阶段且再次在大豆生长的早期生殖阶段期间用C.aporema侵染。两个试验在大豆生长的中间营养阶段期间用薄荷灰夜蛾侵染。
对于C.aporema试验,实现极重的压力。重复实验并非损害的显著变异来源(F=0.8794;df=2,69;P=0.4196),但事件是高度显著的(F=11.9398;df=23,48;P<0.0001)。受损植物的最大百分比(表4)在阴性检查中平均为83-100%,但在Cry1Ac阳性对照中不存在。由转化构建体1生成且表达Cry2Ab和Cry1A.105的事件展现0-13%的受损植物,而仅表达Cry2Ab或仅表达Cry1A.105的那些分别展现10-17%和10-13%。少量但显著数量的在此试验中记录为受损的植物可应归于当记录损害等级时由个体所使用的准则。
对于薄荷灰夜蛾试验,在一个荫棚试验中实现高压力。重复实验并非落叶的显著变异来源(F=0.203;df=2,69;P=0.8167),但事件是高度显著的(F=20.2461;df=23,48;P<0.0001)。最大落叶(表4)在阴性检查中平均为60–63%,但在Cry1Ac阳性对照及由表达Cry2Ab+Cry1A.105的转化构建体1生成的事件或由仅表达Cry2Ab的转化构建体2生成的事件中不存在。由仅表达Cry1A.105的转化构建体3生成的事件展现稍微较高的落叶(4-10%)。在评估薄荷灰夜蛾的第二荫棚试验中实现中等高压。重复实验并非任一试验中落叶的显著变异来源(F=0.2542;df=2,69;P=0.7763),但事件是高度显著的(F=16.1793;df=23,48;P<0.0001)。最大落叶(表4)在阴性检查中平均为38-40%,但在Cry1Ac阳性对照中是可以忽略的(4%)并且在用构建体1生成并表达Cry2Ab+Cry1A.105的事件或用构建体2生成并仅表达Cry2Ab的事件中不存在。用构建体3生成并且仅表达Cry1A.105的事件展现稍微较高的落叶(2-7%)。
在这些荫棚试验中,大豆事件MON87751未展现因昆虫害虫C.aporema或薄荷灰夜蛾的侵染所致的受损的植物,其与同一试验中的对照的损害和/或落叶相比是显著的(表4)。
表4.使用构建体1、2、或3生成并在人工侵染的荫棚中评估的事件由C.aporema造成的损害及由薄荷灰夜蛾幼虫造成的落叶。
在第二地理位置处进行的随后季节的小块荫棚试验中,将薄荷灰夜蛾、C.aporema及草地夜蛾的局部实验室群体用于侵染。用于进行试验的方案基本上如上所述,并且所测试的事件和对照展示于表5中。
对于用C.aporema侵染的试验,实现高压力。重复实验并非损害的显著变异来源(F=0.2742;df=2,33;P=0.7619),但事件是高度显著的(F=8.2313;df=11,24;P<0.0001)。最大损害在阴性检查中平均为每株植物4.2-5.5个损害点,其中80-100%的植物展现损害,但在阳性对照及所有测试事件中是可以忽略的(表5)。
对于用薄荷灰夜蛾侵染的试验,实现中等高压。重复实验并非损害中的显著变异来源(F=0.041;df=2,33;P=0.9599),但事件是高度显著的(F=143.5526;df=11,24;P<0.0001)。最大损害在阴性检查中平均为33.3-40.0%落叶(大大高于经济阈值),但在阳性对照及所有测试事件中是不存在的或可以忽略的,除通过用仅表达TIC105的构建体6转化而生成的事件外(表5)。
对于用草地夜蛾侵染的试验,实现轻微压力。重复实验并非损害的显著变异来源(F=0.1187;df=2,33;P=0.8884),但事件是高度显著的(F=12.8602;df=11,24;P<0.0001)。最大损害在阴性检查中平均为7.5-15.0%落叶--正好达到经济阈值。一些损害还在通过用构建体2或构建体5进行转化而生成的仅表达Cry2Ab的事件中注意到,但损害在阳性对照及所有其它测试事件中是不存在或可以忽略的(表5)。
在这些荫棚试验中,大豆事件MON87751不展现归因于昆虫害虫、C.aporema、薄荷灰夜蛾、草地夜蛾的侵染的损害植物,其当与对同一试验中的的阴性对照的破坏相比时是显著的(表5)。大豆事件MON87751当与通过用仅表达Cry1A.105的构建体6转化而生成的转基因大豆事件相比时具有显著较少的薄荷灰夜蛾带来的损害(表5),但注意到在通过用构建体6转化而生成的事件中存在较低的Cry1A.105蛋白表达。这些结果还首次表明扩大范围的昆虫害虫草地夜蛾的防治。
表5.在评估用构建体1、2、3、4、5、或6生成的事件且与阳性和阴性对照相比的人工侵染的荫棚中由C.aporema所致的最大损害以及由薄荷灰夜蛾和草地夜蛾幼虫所致的平均落叶百分比。
使用谷实夜蛾的实验室群体的侵染,在第一地理位置处进行一小块荫棚试验。试验设计包括随机完全区组设计(RCBD)测试区组,其中每个事件重复三次,并且所测试的事件和对照展示于表6中。存在两次谷实夜蛾的侵染并且对于第一侵染在侵染后19-27天(大豆生长的R2-R3阶段)评定落叶,且对于第二侵染在侵染后25-28天(大豆生长的R5阶段)。测试昆虫害虫谷实夜蛾的荫棚试验的结果如下:实现中等高压。重复实验并非落叶的显著变异来源(F=0.326;df=2,105;P=0.7225),但事件是高度显著的(F=13.8864;df=35,72;P<0.0001)。最大落叶(表6)在阴性检查中平均为32-33%,但在Cry1Ac阳性对照(1%)和用构建体1生成并表达Cry2Ab+Cry1A.105的事件(2-4%)中是可以忽略的。在用表达Cry2Ab+Cry1A.105的构建体4生成的事件(5-12%)、用仅表达Cry2Ab的构建体5生成的事件(13-17%)或用仅表达Cry1A.105的构建体6生成的事件(8-12%)中观察到稍微较高的落叶。
大豆事件MON87751在此荫棚试验中当与对相同试验中的阴性对照的损害相比时展现显著较小的谷实夜蛾损害。对谷实夜蛾的此防治水平在此大豆害虫物种的可接受的商用防治水平内。另外,在此荫棚试验中,大豆事件MON87751当与用仅表达Cry2Ab的构建体5生成的转基因大豆事件(表6)相比时具有显著较少的损害,表明扩大的防治水平。然而,Cry2Ab的表达在用构建体5生成的事件中比在用构建体2生成的事件中低,并且用仅表达Cry2Ab事件的构建体5生成的显著落叶可指示在用构建体5生成的事件中可能存在由Cry2Ab针对谷实夜蛾的降低的效力。
表6.当与阳性和阴性对照相比时在人工侵染的荫棚试验中由谷实夜蛾幼虫所致的用构建体1、4、5、或6生成的事件的最大季节性落叶。
在第一地理位置处进行的另一季的小块荫棚试验中,测试对昆虫害虫南部灰翅夜蛾(1龄虫或3龄虫)、黎豆叶蛾(1龄虫)、及黄豆银纹夜蛾(1龄虫)的实验室群体侵染的抗性。来自这些试验的结果如下:用1龄虫南部灰翅夜蛾实现极限压力,且用黎豆叶蛾实现中等压力。由黎豆叶蛾(1龄虫)和南部灰翅夜蛾(1龄虫)幼虫所致的最大落叶百分比(平均值±S.E.)报道于表7中。
表7.在评估用构建体1、2、3、4、5、6、7、8、及10生成的事件且与阳性和阴性对照相比的人工侵染的荫棚中由黎豆叶蛾(1龄虫)和南部灰翅夜蛾(1龄虫)幼虫所致的最大落叶百分比。
对于测试黄豆银纹夜蛾(1龄虫)和南部灰翅夜蛾(3龄虫)的试验,针对两种昆虫害虫实现极限压力。在这些人工侵染的荫棚中由黄豆银纹夜蛾(1龄虫)幼虫及南部灰翅夜蛾(3龄虫)幼虫所致的最大落叶百分比(平均值±S.E.)报道于表8中。
表8.在评估用构建体1、2、3、4、5、6、7、8、及10生成的事件且与阳性和阴性对照相比的人工侵染的荫棚中由黄豆银纹夜蛾(1龄虫)和南部灰翅夜蛾(3龄虫)幼虫所致的最大落叶百分比。
这些荫棚试验的结果显示大豆事件MON87751当与在相同试验中的阴性对照的损害相比时展现由南部灰翅夜蛾(1龄虫或3龄虫)、黎豆叶蛾(1龄虫)、或黄豆银纹夜蛾(1龄虫)所致的损害显著减小(表7和表8)。另外,在这些荫棚试验中,大豆事件MON87751当与表达Cry1Ac的转基因大豆事件(表7和表8)相比时具有由南部灰翅夜蛾(1龄虫和3龄虫)幼虫所致的显著较小的损害,表明事件MON87751相对于现行用于鳞翅目害虫防治的转基因大豆事件来说性能的扩大。此外,在这些荫棚试验中,大豆事件MON87751具有当与以下相比时由南部灰翅夜蛾幼虫所致的显著较少的损害:[1]用构建体4、5、或6生成的任何事件(3龄虫幼虫)、或用仅表达Cry1A.105事件的构建体6生成的事件(1龄虫幼虫)、或用仅表达Cry1A.105事件的构建体3生成的事件(1龄虫幼虫和3龄虫幼虫)及[2]当与用在无增强子的情况下表达Cry2Ab和Cry1A.105的构建体7生成的事件(1龄虫幼虫和3龄虫幼虫)相比时,表明事件MON87751相对于用构建体4、5、6或7生成的事件来说性能要优越(表7和表8)。
实施例4
进行空旷田间效力试验来评估实验性大豆事件MON87751和使用不同转化构建体1、2、3、4、5、及6生成的事件对鳞翅目害虫群体的天然田间侵染的效力。用构建体2或5生成的事件(仅表达Cry2Ab)和用构建体3或6生成的事件(仅表达Cry1A.105)与用构建体1或4生成的事件(表达Cry1Ab和Cry1A.105两者)的比较被用于确定每个单Cry蛋白(即仅Cry2Ab或仅Cry1A.105)对在表达来自单一构建体的两个Cry蛋白(即Cry2Ab和Cry1A.105)的事件中观察到的效力的相对作用。在多个季节、多个田间试验场所且在三个地理位置中进行地方性大豆害虫的地方种群的效力田间试验。
在一个地理位置处进行的初始效力田间试验中,所评估的事件(即条目)包括12个由构建体1生成并表达两个Cry蛋白Cry2Ab和Cry1A.105的事件(且包括事件MON87751)、两个由构建体2生成并仅表达Cry2Ab的事件、以及三个由仅表达Cry1A.105的构建体3生成的事件。在第二地理位置处进行的初始效力田间试验中,评估由构建体1、2及3生成的事件并且包括11个表达两个Cry蛋白Cry2Ab和Cry1A.105的事件(由用构建体1转化生成并且包括事件MON87751)、两个仅表达Cry2Ab的事件(由用构建体2转化生成的事件)、以及三个仅表达Cry1A.105的事件(由用构建体3转化生成的事件)。在3个地理位置处进行的第二季效力田间试验中,所评估的事件(即条目)包括3个表达两个Cry蛋白Cry2Ab和Cry1A.105的事件(由用构建体1转化生成并且包括事件MON87751的事件)、一个仅表达Cry2Ab的事件(由用构建体2转化生成的事件)、以及一个仅表达Cry1A.105的事件(由用构建体3转化生成的事件)。在空旷田间效力试验中评估的事件包括R3代至R7代。
对于每个效力田间试验场所,将测试组种植并且使靶鳞翅目昆虫的天然害虫群体的天然侵染发生。测试组保持未用针对靶害虫(鳞翅目)的杀虫剂处理。然而,测试组可能已被喷雾以防止受到非靶昆虫害虫的显著损害。所有实验事件都在相对成熟度组3(RM3)的大豆种质背景A3555中。在试验中的其它条目包括阳性对照MON87701(表达Cry1Ac)或GM_A19459(RM5);阴性亲本检查A3555(紫花,RM3);以及阴性商用检查A5547(白花,MG5)或CMA5805(白花,RM5)。
在确立和进行空旷田间效力试验中遵循标准实践。从靶鳞翅目活动的开始以及当靶鳞翅目活动停止或植物达到R7生长期结束,定期记录(即,每5-14天)鳞翅目害虫的幼虫发生率、落叶、以及植物生长阶段。从行1和行4处收集害虫发生率数据,仅为了避免在行2与3中的植物损害,收获其用于产量数据。监测并记录害虫发生率数据如下发生:落叶鳞翅目(即黎豆叶蛾、黄豆银纹夜蛾、薄荷灰夜蛾、灰翅夜蛾属)是使用罩布或垂直拍式薄片来监测,其中每块至少两个罩布或四个垂直拍式薄片取样。所遇到的每种靶物种的幼虫总数及在每块内的取样数量被记录为所遇到的每个靶物种的每m行的平均幼虫数量(幼虫总数÷取样数量÷以米计的布/薄片长度)。随后的取样是以避免在每块的相同区域中重复取样的方式来完成。在一个地理位置处进行的效力田间试验中,还在两个试验场通过随机选择20或33个植物/位置并记录幼虫进食损害的数目记录谷实夜蛾所致的机会性损害的数据。在第二地理位置处,通过随机选择10株植物/块并记录豆荚总数及每株植物的受损豆荚数目来为一个试验的谷实夜蛾定等级。
通过对在具有由于幼虫进食导致的损害(枯萎、死亡或死的)的每块中植物的总数计数记录南美玉米苗斑螟的浸染数据。此昆虫的损害数据是当注意到最大损害时在单一时间点收集。
除靶害虫之外,非靶害虫,主要是具有超过经济阈值的潜能的那些(例如蝽),定期通过捕虫网、修饰的捕虫网或垫布在测试组内的随机选择的位置处监测,并且评定其是否达到或接近于经济损伤水平。
在试验成熟时,收获每块中行2和3的整个长度并且记录每块的总重量和含水百分数。收获期间,注意到在收获的行中的明显间隙(植物不相互接触)并且记录这些间隙的总长度。在将种子重量校正至13%含水量之后计算产量。使幼虫发生率、落叶、及产量数据进行ANOVA以确定品系之中的显著变异来源并且在0.05概率水平(P)下在每个位置处重复实验。使用Tukey-Kramer测试(Kramer 1956)在P=0.05下测定平均值之中的显著差异。
在田间试验场所1处进行的空旷田间试验,落叶毛虫在R3生长阶段首次遭遇,并且到生长阶段R6时增至中等损害程度。遇到的物种包括黎豆叶蛾(98%)、薄荷灰夜蛾(2%)及灰翅夜蛾属(1%)。重复实验并非幼虫发生率(F=0.0435;df=2,57;P=0.9575)、落叶(F=0.0807;df=2,57;P=0.9226)或产量(F=0.0213;df=2,57;P=0.979)的显著变异来源,但事件对于所有三个都是高度显著的(幼虫发生率:F=69.6956;df=19,38;P<0.0001;落叶:F=25.9918;df=19,40;P<0.0001;产量F=3.357;df=19,38;P=0.0007)。累积幼虫发生率(表9)在阴性检查中达到139-189个幼虫/m行,而实际上在任何转基因条目中都未遇到幼虫。最大落叶(表9)在阴性检查中平均为21-27%且在所有转基因条目中不存在。产量(表9)在两个阴性检查中相对于所有转基因条目是减少的,尽管产量变异性降低这些减少的显著性。
事件MON87751当与非转基因对照相比时具有及显著较低的落叶鳞翅目幼虫(季节累积值)发生率及显著较低的落叶百分比(季节最大值)。
表9.在田间试验场所1进行的天然侵染的空旷田间效力试验中用构建体1、2或3生成的事件的落叶鳞翅目幼虫(季节累积值)及落叶(季节最大值)的发生率。
在田间试验场所2处进行的另一空旷田间试验中,落叶毛虫首次在生长的晚期营养阶段遭遇到,且到R3生长阶段时增加到高度受损水平。遇到的物种包括黎豆叶蛾(53%)、“尺蠖”(或许是黄豆银纹夜蛾,但也可能是薄荷灰夜蛾)(44%)及灰翅夜蛾属(3%)。重复实验并非幼虫发生率(F=0.0085;df=2,57;P=0.9915)或落叶(F=0.0027;df=2,57;P=0.9973)的显著变异来源,而事件对于两者(幼虫发生率:F=19.644;df=19,40;P<0.0001;落叶:F=671.3147;df=19,40;P<0.0001)是高度显著的。累积的幼虫发生率(表10)在阴性检查中达到43-50个幼虫/m行,而在转基因条目中遇到可忽略的数量。最大落叶(表10)在阴性检查中的平均值是87-90%,而在所有转基因条目中仅观察到不超过痕量的水平。
事件MON87751当与非转基因对照相比时具有显著较低的落叶鳞翅目幼虫(季节累积值)发生率及显著较低的落叶百分比(季节最大值)。
表10.在田间试验位点2处进行的天然侵扰的空旷田野效力试验中由构建体1、2或3产生的事件的落叶鳞翅目幼虫发生率(季节累积值)和落叶(季节最大值)。
在田间试验位点3处进行的另一空旷田野试验中,重复实验并非每株植物总体(F=0.312;df=2,24;P=0.7349)或受损(F=0.0438;df=2,24;P=0.9572)豆荚或产率(F=0.2221;df=2,24;P=0.8025)的显著变异来源。然而,事件为每株植物总体(F=4.3643;df=8,18;P=0.0045)和受损(F=34.5288;df=8,18;P<0.0001)豆荚的显著变异来源,不过并非产率(F=0.6237,df=8,18,P=0.7475)的显著变异来源。阴性检查平均值为每株植物25.0–26.0个豆荚,其中30.8–31.0%豆荚受损,而测试事件(包括事件MON87751)平均值为每株植物28.9–38.9个豆荚,其中<2%的豆荚受损(表11)。在阴性检查中每株植物减少的豆荚数目有可能是由豆虫损害引起的早熟豆荚脱落的结果,因为在阴性检查(但非测试事件)中观察到众多受损豆荚落在植物下方的地上(表11)。
表11.在田间试验位点3处进行的豆虫侵扰的空旷田野效力试验中每株植物的总体和受损豆荚,从而评估由构建体1、2或3产生的事件。
在田间试验位点4处进行的空旷田野试验中,在R3生长阶段遇到落叶毛虫,且直至R6–R7生长阶段增加至高度损害程度。所遇到的物种包括黎豆夜蛾(77%)、三叶草夜蛾(苜蓿绿夜蛾)(17%)和黄豆银纹夜蛾(6%)。重复实验并非幼虫发生率(F=0.0219;df=2,69;P=0.9783)、落叶(F=0.0007;df=2,69;P=0.9993)或产率(F=1.1477;df=2,69;P=0.3233)的显著变异来源。事件对于所有三者(幼虫发生率:F=96.9673;df=23,48;P<0.0001;落叶:F=363.8854;df=23,48;P<0.0001;产率:F=1.7814;df=23,48;P=0.046)都是显著的至高度显著的。在阴性检查中累积幼虫发生率(表12)达到每m行117–123个幼虫,而在任何转基因条目中实际上未遇到幼虫。最大落叶(表12)在阴性检查中平均值为68–83%且在包括事件MON87751的所有转基因条目中均不存在。
表12.在田间试验位点4处进行的天然侵扰的空旷田野试验中由构建体1、2或3产生的事件的落叶鳞翅目幼虫发生率(季节累积值)和%落叶(季节最大值)。
在田间试验位点5处进行的另一空旷田野试验中,在R2生长阶段首次遇到落叶毛虫,且在R5–R6生长阶段期间增加至高度损害程度。所遇到的物种包括黎豆夜蛾(93%)、黄豆银纹夜蛾(5%)和黄条行军虫(2%)。重复实验并非幼虫发生率(F=0.0206;df=2,69;P=0.9796)、落叶(F=0.0054;df=2,69;P=0.9946)或产率(F=0.2379;df=2,69;P=0.7889)的显著变异来源。事件对于所有三者(幼虫发生率:F=122.46;df=23,48;P<0.0001;落叶:F=623.0217;df=23,48;P<0.0001;产率:F=2.9366;df=23,48;P=0.0008)都是高度显著的。在阴性检查中累积幼虫发生率(表13)达到每m行76-137个幼虫,而在任何转基因条目中实际上未遇到幼虫。最大落叶(表13)在阴性检查中平均值为82-88%且在包括事件MON87751的所有转基因条目中均不存在。
表13.在田间试验位点5处进行的天然侵扰的空旷田野试验中由构建体1、2或3产生的事件的落叶鳞翅目幼虫发生率(季节累积值)和落叶(季节最大值)。
在田间试验位点6处进行的另一空旷田野试验中,在R6生长阶段期间遇到落叶毛虫(主要为谷实夜蛾和黄豆银纹夜蛾),但从未达到高度显著数目。然而,在边界、缓冲液和阴性检查中由南美玉米苗斑螟对植物造成的实质损害在所述季节的早期发生,直至R5–R6生长阶段造成枯萎、垂死和死亡植物,此时记录损害数据。重复实验并非由南美玉米苗斑螟损害的植物(F=0.3431;df=2,69;P=0.71)的显著来源。事件对于由南美玉米苗斑螟损害的植物为高度显著的:F=16.7555;df=23,48;P<0.0001)。由南美玉米苗斑螟损害的植物的百分比(表14)在阴性检查中平均值为10–28%,而在任何转基因条目中并无植物展现损害,包括事件MON87751。
表14.在田间试验位点6处进行的天然侵扰的空旷田野效力试验中由南美玉米苗斑螟(LCSB造成的落叶损害的发生率,从而评估由构建体1、2或3产生的事件。
在田间试验位点7处进行的另一空旷田野试验中,在R1–R2生长阶段首次遇到落叶毛虫,且直至R4–R6生长阶段增加至高度损害程度。所遇到的物种包括黄豆银纹夜蛾(54%)、甜菜灰翅夜蛾(43%)和盐泽枝灯蛾(2%)。重复实验并非幼虫发生率(F=0.0866;df=2,69;P=0.9172)或落叶(F=0.1129;df=2,69;P=0.8934)的显著变异来源。事件对于两者(幼虫发生率:F=69.918;df=23,48;P<0.0001;落叶:F=21.6603;df=23,48;P<0.0001)都是高度显著的。在阴性检查中累积幼虫发生率(表15)达到每m行152-166个幼虫,而在Cry1Ac阳性对照或由表达Cry2Ab和/或Cry1A.105的构建体1、2或3产生的事件中实际上未遇到幼虫。最大落叶(表15)在阴性检查中平均值为24%,但在由表达Cry2Ab和/或Cry1A.105的构建体1、2或3产生的事件(包括事件MON87751或Cry1Ac阳性对照)中并未超过痕量级。
表15.在田间试验位点7处进行的天然侵扰的空旷田野试验中由构建体1、2或3产生的事件的落叶鳞翅目幼虫发生率(季节累积值)、落叶(季节最大值)和产率。
在田间试验位点8处进行的另一空旷田野试验中,在R4–R6生长阶段期间出现由落叶毛虫黄豆银纹夜蛾(41%)、黎豆夜蛾(38%)、草地贪夜蛾(13%)和黄条行军虫(8%)造成的中等压力。重复实验并非幼虫发生率(F=0.0924;df=3,52;P=0.9639)或落叶(F=0.372;df=3,52;P=0.7735)的显著变异来源。事件为幼虫发生率(F=40.008,df=13,42,P<0.0001)和落叶(F=11.9356,df=13,42,P<0.0001)的显著变异来源。在阴性检查中累积幼虫发生率和最大落叶平均值分别为每m行9.1–13.9个幼虫和31–35%(后者适度地在经济阈值以上),但在阳性对照和包括事件MON87751的所有测试事件中并未超过痕量(表16)。在试验中未注意到非靶害虫的显著出现。
表16.在田间试验位点8处进行的天然侵扰的空旷田野效力试验中的落叶鳞翅目幼虫的累积发生率、最大百分比落叶和产率。
在田间试验位点6处进行的第二个季节的空旷田野试验期间,在R3–R5生长阶段期间出现由谷实夜蛾造成的极大压力。重复实验并非受损豆荚(F=0.0280;df=3,52;P=0.9936)的显著变异来源。事件为受损豆荚(F=15.4758,df=13,42,P<0.0001)的显著变异来源。阴性检查平均值为64–78%受损豆荚,而在包括事件MON87751的任何测试事件中实际上未出现损害(表17)。
表17.在第二季节期间在田间试验位点6处进行的天然侵扰的空旷田野效力试验中的落叶鳞翅目幼虫的累积发生率、最大百分比落叶、豆荚产量、由实夜蛾亚科幼虫损害的豆荚的百分比和产率。
在这一实施例中描述的多个空旷田野试验的结果与多个荫棚试验的结果(描述于实施例3中)组合进一步确认在五代植物后代(R2至R7)之中由构建体1、2或3产生的转基因大豆事件遇到的所有鳞翅目大豆害虫的幼虫群体的有效、整个季节抑制作用,表明在后代内和后代之中的稳定转基因表达。
组合结果证明在由所有四种主要的靶害虫(在一个地理位置中的黎豆夜蛾和黄豆银纹夜蛾,和在第二地理位置中的相同靶害虫加上薄荷灰夜蛾和C.aporema)造成的阈上压力的条件下,由构建体1、2或3产生的转基因事件(包括事件MON87751)的效力等于表达Cry1Ac且先前证明控制大豆的鳞翅目昆虫害虫的转基因事件。分别由构建体2或3产生且仅表达Cry2Ab蛋白或仅表达Cry1A.105蛋白的事件还证明与表达Cry1Ac蛋白的转基因事件相等的效力,表明在事件MON87751中表达Cry2Ab和Cry1A.105蛋白将通过改进的昆虫抗性管理而具有相比Cry1Ac转基因事件改进的耐久性。
在由构建体1产生的事件(包括事件MON87751)中相等的效力也已经针对众多的次要靶害虫得到证明,所述次要靶害虫包括三个粘虫物种(甜菜灰翅夜蛾、草地贪夜蛾和南方灰翅夜蛾)、两种实夜蛾亚科豆虫(谷实夜蛾和H.gelotopeon)、一种茎钻孔昆虫(南美玉米苗斑螟)和一种食叶害虫(三叶草夜蛾)。
实施例5
这一实施例描述事件MON87751的分子表征,其包括蛋白表达和广泛分子表征。这种分子表征对正在农艺学田野试验、效力荫棚试验和效力田野试验中测试的事件同时完成。
对于事件MON87751的分子表征,使用Southern分析和终点测定的组合来测定转基因插入序列(包含Cry2Ab和Cry1A.105盒,SEQ ID NO:9)的拷贝数。所述分子分析确认,仅存在单一插入(含有用于Cry2Ab和Cry1A.105蛋白的表达盒且由SEQ ID NO:9表示的T-DNA表达盒)而未检测到载体骨架,并且未检测到含有选择/可评分标志物序列的T-DNA盒。在事件MON87751基因组DNA中所述单一插入(SEQ ID NO:9)的全长序列确认,所述序列与转化构建体的序列相同。
对于蛋白表达,从对于事件MON87751等位基因纯合的植物和由冻干样品制备的提取物收集叶样品,根据分别用Cry2Ab或Cry1A.105的特异性抗体测量Cry2Ab或Cry1A.105蛋白水平的标准方案进行ELISA,且结果表述为干重的百万分率(ppm)。对于通过由构建体1、2或3转化而产生的事件和非转基因对照A3555在植物生长的R1和R3阶段收集叶样品。ELISA结果指示由构建体1和构建体2产生的事件的Cry2Ab水平介于约20ppm至约50ppm干重范围内,例外为事件8(其经确定具有来自可选择/可评分标志物T-DNA的连接的病毒启动子,而无其它序列,且事件8未进一步进行评估),并且由构建体3产生的事件(仅表达Cry1A.105)或非转基因对照并无Cry2Ab表达(图3A)。此外,对于R1和R3生长阶段,Cry2Ab蛋白表达水平近似相等。ELISA结果指示由构建体1和构建体3产生的事件的Cry1A.105水平介于约150ppm至约800ppm干重范围内,并且由构建体2产生的事件(仅表达Cry2Ab)或非转基因对照并无Cry1A.105表达(图3B)。此外,叶样品的Cry1A.105蛋白表达水平在R3生长阶段相比于R1生长阶段介于较高范围内。
另外ELISA结果显示由构建体1产生的事件的Cry2Ab蛋白水平相对于由构建体5或构建体4产生的事件较高,且如预期,对于非转基因对照或由构建体6产生的事件(仅表达Cry1A.105)未检测到Cry2Ab(图4A)。在相同的叶样品集合中,ELISA结果显示当与由构建体6或构建体4产生的事件相比时,对于由构建体1产生的事件存在两倍或更高水平的Cry1A.105表达,而对于MON87751具有大致2倍高的表达,且如预期,对于非转基因对照或由构建体5产生的事件(仅表达Cry2Ab)未检测到Cry1A.105表达(图4B)。对于这些ELISA,从在两个独立的效力荫棚试验位置中的每一个位置处生长的植物的R3生长阶段收集叶样品。
进一步的ELISA结果显示在来自由构建体1产生的事件和由构建体2产生的事件的提取物中的Cry2Ab蛋白水平是a)相对于由构建体4、构建体5或构建体7产生的事件较高;b)相对于由构建体9或构建体11产生的事件近似相等或略微较低;以及c)如预期,关于非转基因对照(未展示)或由构建体3或构建体6产生的事件(仅表达Cry1A.105)未检测到Cry2Ab(图5)。对于这些ELISA,在R3和R5生长阶段收集叶样品,并且对于由构建体1和构建体2产生的事件,Cry2Ab水平在R5生长阶段较高,并且Cry2Ab水平在由构建体9和构建体11产生的事件中较高(图5)。在相同的叶样品集合中,ELISA结果显示在来自由构建体1和构建体3产生的事件的提取物中Cry1A.105蛋白水平相对于由构建体4、构建体6、构建体9或构建体7产生的事件显著较高,且如预期,对于非转基因对照(未显示)或由构建体2或构建体5产生的事件(仅表达Cry2Ab)未检测到Cry1A.105(图6)。对于这些ELISA,在R3和R5生长阶段收集叶样品,并且对于由构建体1和构建体3产生的事件,Cry1A.105水平在R5生长阶段相比于由构建体4、构建体6、构建体9或构建体7产生的事件数量级较高,参见图6A以0–5000ppm干重绘图的Y轴和图6B以0-500ppm干重绘图的Y轴。ELISA数据指示与由构建体4、构建体7或构建体9产生的事件相比,在由构建体1产生的事件中存在较高的Cry2Ab和Cry1A.105的表达,所有事件均含有两个Cry蛋白表达盒,-一个编码Cry2Ab的表达盒和一个编码Cry1A.105的表达盒。另外,注意到在由构建体1(包括事件MON87751)、构建体2和构建体3产生的事件中的相对高的蛋白表达在至少4个大豆后代(R0、R1、R2和R3)中稳定,并且Cry1A.105蛋白水平在从处于R3至R5生长阶段的纯合事件收集的叶组织中增加。
实施例6
这一实施例描述用于鉴定大豆样品中事件MON87751 DNA的存在的方法。一对PCR引物和探针设计用于达成鉴定在事件MON87751的基因组DNA与插入的DNA的任意指定3’末端之间形成的独特接合点(即,3’接合点)的目的并且涵盖于SEQ ID NO:10、SEQ ID NO:8、SEQ ID NO:2、SEQ ID NO:4或SEQ ID NO:6中。
寡核苷酸正向引物SQ20267的序列(SEQ ID NO:11)与对应于SEQ ID NO:10的位置11400至11426和SEQ ID NO:8的位置212至238以及SEQ ID NO:9的位置10066至10092的核苷酸序列相同。寡核苷酸反向引物SQ25826的序列(SEQ ID NO:12)与对应于SEQ ID NO:10的位置11454至11479和SEQ ID NO:8的位置266至291和SEQ ID NO:6的位置51至76以及SEQ ID NO:4的位置31至56的核苷酸序列的反向补体相同。寡核苷酸探针PB10263的序列(SEQ ID NO:13)与对应于SEQ ID NO:10的位置11428至11446和SEQ ID NO:9的位置10094至10112和SEQ ID NO:8的位置240至258和SEQ ID NO:6的位置25至43以及SEQ ID NO:4的位置5至23的核苷酸序列相同。PCR引物SQ20267(SEQ ID NO:11)和SQ25826(SEQ ID NO:12)扩增在事件MON87751的正确接合点处独特的基因组/插入DNA的80个核苷酸扩增子。这一可经荧光标记(例如,6FAMTM荧光标记)的具有探针PB10263(SEQ ID NO:13)的相同引物对可用于终点PCR测定以鉴定样品中源于事件MON87751的DNA的存在。
除SQ20267(SEQ ID NO:11)、SQ25826(SEQ ID NO:12)和PB10263(SEQ ID NO:13)以外,对于本领域的技术人员应显而易知,还可设计其它引物和/或探针以扩增和/或杂交SEQ ID NO:10内对于检测样品中源于事件MON87751的DNA的存在独特并且用于检测样品中源于事件MON87751的DNA的存在的序列。
根据标准分子生物学实验室规范,开发用于事件鉴定的PCR测定来用于检测样品中的事件MON87751 DNA。由用于检测样品SQ20267(SEQ ID NO:11)、SQ25826(SEQ ID NO:12)和PB10263(SEQ ID NO:13)中源于事件MON87751的DNA的存在的引物对和探针(即,由如6FAMTM的荧光标签标记的探针)的各集合优化标准PCR测定或PCR测定的参数。PCR反应的对照包括对大豆基因组中的单一拷贝基因具特异性的内部对照引物和内部对照探针(例如,VICTM标记)。本领域的技术人员应知晓如何设计对大豆基因组中的单一拷贝基因具特异性的引物。一般来说,针对样品中事件MON87751 DNA的检测优化的参数包括引物和探针浓度、模板DNA的量以及PCR扩增循环参数。模板DNA样品和对照如下:[1]从将要测定的叶样品或单一种子样品提取的DNA;[2]阴性对照DNA(非转基因大豆DNA);[3]阴性水对照(无模板);以及[4]阳性对照MON87751 DNA。本领域的技术人员已知产生鉴定样品中的事件MON87751 DNA的扩增子的其它方法在本领域的技能内。
合子型测定用于确定包含事件的植物是否对事件DNA纯合,即在染色体对的各染色体上的相同位置中包含外源DNA;或是否对事件DNA杂合,即在染色体对的仅一个染色体上包含外源DNA;或对事件DNA无效,即野生型。终点热扩增方法用于开发用于事件MON87751的合子型测定。对于这种测定,三种引物和两种探针与用于所述测定的样品混合在一起。所述三种引物为SQ20267(SEQ ID NO:11),其特定地从插入的外源DNA的3’区杂交且延伸;引物SQ27115(SEQ ID NO:14),其特定地从侧接插入的外源DNA的3'侧的大豆基因组DNA杂交且延伸;以及引物SQ26901(SEQ ID NO:15),其特定地从侧接插入的外源DNA的5'侧的大豆基因组DNA杂交且延伸。当存在模板DNA中存在的插入的外源DNA的拷贝时,即对于事件MON87751,引物SQ20267和SQ27115以及探针PB10263(SEQ ID NO:13)(6-FAMTM标记)为诊断性的。当不存在基因组DNA中存在的插入的外源DNA的拷贝时,即野生型,引物SQ26901和SQ27115以及探针PB11254(SEQ ID NO:16)(VICTM标记)为诊断性的。当所述三种引物和两种探针在PCR反应中与从对于事件MON87751纯合的植物提取的DNA混合在一起时,仅存在来自6-FAMTM标记的探针PB10263的荧光信号,所述信号指示对于事件MON87751纯合的植物且具诊断性。当所述三种引物和两种探针在PCR反应中与从对于事件MON87751杂合的植物提取的DNA混合在一起时,存在来自6-FAMTM标记的探针PB10263和VICTM标记的探针PB11254两者的荧光信号,所述信号指示对于事件MON87751杂合的植物且具诊断性。当所述三种引物和两种探针在PCR反应中与从对于事件MON87751无效的植物(即,野生型)提取的DNA混合在一起时,仅存在来自VICTM标记的探针PB11254的荧光信号,所述信号指示对于事件MON87751无效的植物(即,野生型)且具诊断性。模板DNA样品和对照如下:[1]从将要测定的叶样品或单一种子样品提取的DNA;[2]阴性对照DNA(非转基因DNA);[3]阴性水对照(无模板);[4]来自已知的杂合样品的阳性对照MON87751基因组DNA;以及[5]来自已知的纯合样品的阳性对照MON87751基因组DNA。
实施例7
以下实施例描述使用大豆事件MON87751如何可鉴定具有任何育种活性的后代内的事件MON87751。
DNA事件引物对用于产生对于大豆事件MON87751具诊断性的PCR扩增子。对于MON87751具诊断性的扩增子包含以SEQ ID NO:1或SEQ ID NO:2或SEQ ID NO:3或SEQ ID NO:4或SEQ ID NO:5或SEQ ID NO:6形式提供的至少一种接合序列。将产生用于MON87751的诊断性扩增子的引物对包括基于侧接序列和插入的表达盒(SEQ ID NO:9)的引物对。为了获得其中发现SEQ ID NO:1或SEQ ID NO:3或SEQ ID NO:5的诊断性扩增子,将设计基于SEQ ID NO:7的碱基1至1334的正向引物分子和基于插入的表达盒DNA序列(SEQ ID NO:9的位置1至10119)的反向引物分子,其中所述引物分子具有足够长度的邻近核苷酸以特异性地杂交于SEQ ID NO:7和SEQ ID NO:9。为了获得其中发现SEQ ID NO:2或SEQ ID NO:4或SEQ ID NO:6的诊断性扩增子,将设计基于插入的表达盒DNA序列(SEQ ID NO:9的位置1至10119)的正向引物分子和基于3’侧接序列(SEQ ID NO:8的位置266至1452)的反向引物分子,其中所述引物分子具有足够长度的邻近核苷酸以特异性地杂交于SEQ ID NO:8和SEQ ID NO:9。
用于这种分析的扩增条件的实例说明于实施例4中。然而,对这些方法或产生对于MON87751具诊断性的扩增子的对于MON87751的转基因插入(SEQ ID NO:9)中所含的遗传元件的SEQ ID NO:7或SEQ ID NO:8或DNA序列纯合或互补的DNA引物的用途的任何修改均在本领域内。诊断性扩增子包含对于至少一种转基因/基因组接合DNA(SEQ ID NO:1或SEQ ID NO:2或SEQ ID NO:3或SEQ ID NO:4或SEQ ID NO:5或SEQ ID NO:6)纯合或互补的DNA分子,或其大部分。或者,诊断性扩增子包含对于至少一种独特的转基因序列(SEQ ID NO:17或SEQ ID NO:18或SEQ ID NO:19或SEQ ID NO:20或SEQ ID NO:21或SEQ ID NO:22或SEQ ID NO:23)纯合或互补的DNA分子。
用于事件MON87751植物组织样品的分析应包括来自事件MON87751的阳性组织对照、来自并非事件MON87751的大豆植物的阴性对照(例如但不限于A3555)以及不含大豆基因组DNA的阴性对照。将扩增内源大豆DNA分子的引物对将用作DNA扩增条件的内部对照。额外引物序列可由DNA扩增方法领域的技术人员选自SEQ ID NO:7、SEQ ID NO:8或SEQ ID NO:9,且对于由实施例4中所示的方法产生扩增子所选择的条件可不同,但产生对于事件MON87751 DNA具诊断性的扩增子。在对实施例4的方法进行修改的情况下使用这些DNA引物序列在本发明的范围内。由至少一种源于SEQ ID NO:7、SEQ ID NO:8或SEQ ID NO:9的DNA引物序列产生的对于MON87751具诊断性的扩增子为本发明的一个方面。
DNA检测试剂盒含有至少一种源于SEQ ID NO:7、SEQ ID NO:8或SEQ ID NO:9的具有足够长度的连续核苷酸的DNA引物,所述引物在用于DNA扩增方法时产生用于MON87751或其后代的诊断性扩增子为本发明的一个方面。当在DNA扩增方法中测试时将产生对于MON87751具诊断性的扩增子的MON87751大豆植物、植物部分、植物细胞、种子或商品产品为本发明的一个方面。用于MON87751扩增子的测定可通过使用Applied Biosystems PCR系统9700(在最大速度下运行)或MJ Research DNA Engine PTC-225热循环仪或可如实施例4中所示用于产生MON87751的诊断性扩增子的任何其它扩增系统来执行。
实施例8
为了产生包含增强的农艺学、杀昆虫或除草特性的大豆植物或其植物部分,使含有事件MON87751的大豆植物与潜在地含有任何其它大豆事件或其组合的大豆植物杂交且评估表型以测定后代植物的所得特性。赋予由所述植物育种产生的后代植物的特性可延伸超过事件MON87751的鳞翅目抗性,包括但不限于地上害虫控制、除草剂耐性、杀线虫特性、抗旱性、病毒抗性、抗真菌控制、细菌抗性、雄性不育性、耐寒性、耐盐性、增加的产率、增强的油组成、增加的油含量、增强的营养物使用效率或改变的氨基酸含量。具有改进的农艺学性状的转基因事件的实例为本领域中众所周知的。以下为可用于由事件MON87751育种的可能的转基因大豆品系的非限制性清单以赋予大豆植物、植物部分、种子或商品产品中增强的特性。育种可包括以下任何和所有组合:除草剂耐性:大豆GTS 40-3-2、MON87708、MON89788、A2704-12、A2704-21、A5547-35、A5547-127、BPS-CV127-9、DP356043、GU262、W62、W98、DAS-44406-6、DAS-68416-4、FG72、BPS-CV127-9、SYHT04R、SYHT0H2、3560.4.3.5、EE-GM3、pDAB4472-1606、pDAB4468-0416、pDAB8291.45.36.、127、AAD-12;昆虫抗性:MON87701、DAS-81419-2;增加的增强的油组成:DP-305423、G94-1、G94-19、G168、OT96-15、MON87705、MON87769;增加的产率:MON 87712。
本说明书中所引用并且对本发明重要的所有出版物和公开的专利文件均以引用的方式并入本文,程度如同明确且单独地指示每个单独出版物或专利申请以引用的方式并入。
- 还没有人留言评论。精彩留言会获得点赞!