反应性质量标记物的集合的制作方法
技术领域
本发明涉及可用于标记所关注分子,特别是生物分子,例如肽和蛋白质的化合物。具体地说,本发明涉及标记分析物从而能用质谱法检测,以及通过质谱法分析质量标记的分析物的相关方法。本发明尤其有助于生物分子的相对定量。
背景技术:
本领域已知标记所关注分子的各种方法,包括放射性原子、荧光染料、发光试剂、电子捕捉试剂和吸光染料。这些标记系统各自的特征适合于某种应用而不适合其它应用。出于安全考虑,对非放射性标记系统的关注导致荧光标记方法得到广泛的商业开发,特别是用于遗传学分析。荧光标记方法能同时标记少量分子,通常可同时使用4种标记物,最多可能8种。然而,检测设备的成本和分析所得信号的困难限制了荧光检测方法中可同时使用的标记物数量。
近年来,作为检测标记物的方法,质谱领域有了长足发展,所述标记物可切割地连接于它们的所关注结合分子。许多分子生物学应用需要在分析之前分离所关注的分子。所述分离一般是液相分离。近年来,质谱学开发了许多液相分离界面,从而使得质谱法作为这些类型应用的检测系统特别有效。近年来,液相色谱质谱用于直接检测分析物离子或其片段离子,然而对于许多应用,例如核酸分析,可通过间接标记测定分析物的结构。这对于质谱法的应用特别有利,因为复杂的生物分子,例如DNA的质谱图复杂,检测灵敏度不佳。间接检测表示可利用结合的标记分子鉴定原始分析物,其中所述标记物设计用于(实现)灵敏的检测和简单的质谱。简单的质谱表示可同时利用多种标记物来分析多种分析物。
PCT/GB98/00127描述了共价连接于可利用质谱检测的可切割标记物的核酸探针阵列,所述标记物能辨别该共价相连核酸探针的序列。该申请的标记探针的结构是Nu-L-M,其中Nu是与L共价相连的核酸,而L是与M共价相连的可切割接头,而M是质量标记物。该申请中,优选的可切割接头能在该质谱仪的离子源内切割。优选的质量标记物是取代的聚芳基醚。该申请披露了各种电离方法,并利用四极质量分析器、TOF分析器和扇形磁场仪(magnetic sector instrument)作为采用质谱法分析质量标记物的具体方法进行了分析。
PCT/GB94/01675披露了与质量标签分子可切割地相连的配体,特别是核酸。优选的可切割接头是光可切割的。该申请披露了衬质辅助激光解吸电离(MALDI)飞行时间(TOF)质谱法作为采用质谱法飞行质量标记物的具体方法。
PCT/US97/22639披露了非挥发性质量标记分子。在优选的实施方式中,这些标记物包括聚合物,通常是与反应基团或配体可切割相连的生物聚合物,即探针。优选的可切割接头看来是在化学或酶学上可切割的。该申请披露了MALDI TOF质谱法作为采用质谱法分析质量标记物的具体方法。
PCT/US97/01070、PCT/US97/01046和PCT/US97/01304披露了与质量标签分子可切割地相连的配体,特别是核酸。优选的可切割接头看来是化学或光可切割的。这些申请披露了各种电离方法,并利用四极质量分析器、TOF分析器和扇形磁场仪作为采用质谱法分析质量标记物的具体方法进行了分析。
这些现有申请无一述及采用串联或连续的质量分析来分析质量标记物。
Gygi等(Nature Biotechnology 17:994-999,“利用同位素编码的亲和力标签定量分析复杂的蛋白质混合物”(Quantitative analysis of complex protein mixtures using isotope-coded affinity tags)1999)披露了利用“同位素编码的标签”捕捉蛋白质的肽,从而能分析蛋白质表达。在该文中,作者描述了利用巯基反应性的生物素接头捕捉含半胱氨酸的肽。某来源的蛋白质样品与生物素接头反应,用内肽酶切割。然后可用亲和素化的小珠分离生物素化的含半胱氨酸肽,随后用于质谱学分析。可用生物素接头标记一种样品,用变性形式的生物素接头标记另一种样品来定量比较两种样品。然后样品中的各肽在质谱图上表现为一对峰。将质谱图上对应于各标签的这些峰积分表明与这些标签相连的肽的相对表达水平。
应用生物系统公司(Applied Biosystems)将称为iTRAQ的试剂投入市场,其是用于多重蛋白质定量的胺修饰标记试剂。一般标记多种样品要提供多种等压试剂(isobaric reagent)。例如,对于一组4种等压试剂,可以多重操作4种样品。然而,仍希望改进这些试剂的性能。这些试剂通常用于LC/MS/MS方法。
PCT/GB01/01122披露了两种或多种质量标记物的集合,该集合中的各标记物含有经可切割接头与质量标准化部分(mass normalisation moiety)相连的质量标记部分(mass marker moiety),该质量标记部分不易断裂。该集合中各标记物的总质量(aggregate mass)可以相同或不同,该集合中各标记物的质量标记部分的质量可以相同或不同。在该集合内质量标记部分具有共同质量的任何标记物组中,各标记物的总质量不同于该组中所有其它标记物;在该集合内具有共同总质量的任何标记物组中,各标记物所含质量标记部分的质量不同于该组中所有其它质量标记部分的质量,从而能通过质谱法彼此区分该集合中的所有质量标记物。该申请还披露了含有上述质量标记物的两种集合或多种集合的质量标记物阵列。阵列中任一集合的各质量标记物的总质量不同于任一其它集合的各质量标记物的总质量。该申请还披露了分析方法,包括采用质谱法鉴定分析物的独特质量标记物或质量标记物组合来检测该分析物。该申请披露了大量不同的特异性质量标记物。优选的质量标记物如结构M-L-X所示,其中M是质量标准化基团,L是可切割的接头,X是质量标记部分。不具体限定M和X的性质。优选的质量标准化基团是任选用一个或多个F原子取代的苄基。优选的接头是酰胺键。优选的质量标记部分是任选用一个或多个F原子取代的吡啶基。
PCT/GB02/04240披露了两种或多种质量标记物的集合,该集合中的各标记物含有经至少一个酰胺键与质量标准化部分相连的质量标记部分。质量标记部分含有氨基酸,质量标准化部分含有氨基酸。对于PCT/GB01/01122,该集合中各标记物的总质量可以相同或不同,该集合内中各标记物的质量标记部分的质量可以相同或不同,从而能通过质谱法彼此区分该集合中的所有质量标记物。对于PCT/GB01/01122,该申请还披露了质量标记物阵列和分析方法。该申请特别涉及分析含质量标准化部分和质量标记部分的肽和质量标记物,所述质量标准化部分和质量标记部分含有至少一个氨基酸。
虽然PCT/GB01/01122和PCT/GB02/04240披露的质量标记物和分析方法获得极大成功,但仍需要提供改良的质量标记物和通过质谱法鉴定质量标记物的分析物检测方法。具体地说,虽然这些新质量标记物和分析方法能同时定量分析多份样品而不会显著增加质谱图的复杂性,但仍需要提供质谱仪易于鉴定并能灵敏定量的改良质量标记物。还需要易与待鉴定分析物反应并能在质谱仪分析前方便地除去剩余质量标记物的改良质量标记物。
技术实现要素:
因此,本发明的目的是解决该领域现有技术中的问题并提供能用质谱法明确鉴定以及定量提高的改良标记物。本发明的目的还包括提供易与分析物反应并在质谱仪分析前与待鉴定分析物相连的质量标记物分开方便的改良质量标记物。
本发明的目的还包括提供分析生物分子的改良方法,该方法利用本发明标记物来最大程度提高这些方法的灵敏度,特别是肽分析。
本发明第一方面提供标记和通过质谱法检测生物分子的质量标记物,该标记物如以下结构所示:
X-L-M
其中X是含有以下基团的质量标记部分:
其中环状单元是芳族或脂族并在任意两个毗邻原子之间独立含有0-3个双键;各Z独立为N、N(R1)、C(R1)、CO、CO(R1)(即–O-C(R1)-或–C(R1)-O-)、C(R1)2、O或S;X是N、C或C(R1);各R1独立为H、取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基;y是0-10的整数,L是包含酰胺键的可切割接头,M是质量标准化部分。
本文所用的术语“质量标记物”应指适合于为测定标记分析物的部分。术语“标记物”与术语“标签”同义。
本文所用的术语“质量标记部分”应指可通过质谱法检测的部分。
本文所用的术语“质量标准化部分”应指无需通过质谱法检测的部分,但其存在确保质量标记物具有所需总质量。质量标准化部分在结构上不作具体限定,但只是用于改变质量标记物的总质量。
在以上通式中,当Z是C(R1)2时,碳原子上的各R1可以相同或不同(即,各R1是独立的)。因此,C(R1)2基团包括例如CH(R1)等基团,其中一个R1是H,另一个R1是选自以上R1定义的另一基团。
在以上通式中,X和非环Z之间的键根据该位置所选择的X和Z基团可以是单键或双键。例如,当X是N或C(R1)时,X到非环Z的键必须是单键。当X是C时,根据所选择的非环Z基团和环Z基团,X到非环Z的键可以是单键或双键。当非环Z基团是N或C(R1)时,根据所选择的X基团和与非环Z相连的基团,非环Z到X的键是单键,或者如果y是0,其可以是双键。当非环Z是N(R1)、CO(R1)、CO、C(R1)2、O或S时,到X的键必须是单键。根据上式,本领域技术人员不难选择化合价正确(单键连接或双键连接)的合适X、Z和(CR12)y基团。
本发明还提供用于标记和通过质谱法检测生物分子的上述质量标记物,该标记物如以下结构所示:
X-L-M
其中X是含有以下基团的质量标记部分:
其中环状单元是芳族或脂族并在任意两个毗邻原子之间独立含有0-3个双键;各Z1和Z2独立为N、N(R1)、C(R1)、CO、CO(R1)(即–O-C(R1)-或–C(R1)-O-)、C(R1)2、O或S;X是N、C或C(R1);其中Z1和X中的至少一个是N;各R1独立为H、取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基;y是0-10的整数,L是包含酰胺键的可切割接头,M是质量标准化部分。
本发明还提供用于标记和通过质谱法检测生物分子的上述质量标记物,该标记物如以下结构所示:
X-L-M
其中X是含有以下基团的质量标记部分:
其中环状单元是芳族或脂族并在任意两个毗邻原子之间独立含有0-3个双键;各Z1独立为N、N(R1)、C(R1)、CO、CO(R1)(即–O-C(R1)-或–C(R1)-O-)、C(R1)2、O或S;Z2是N、N(R2)、C(R1)、CO、CO(R1)(即–O-C(R1)-或–C(R1)-O-)、C(R1)2或S;X是N、C或C(R1);各R1独立为H、取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基;R2是取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基,y是0-10的整数,L是包含酰胺键的可切割接头,M是质量标准化部分。
本发明还提供用于标记和通过质谱法检测生物分子的上述质量标记物,该标记物如以下结构所示:
X-L-M
其中X是含有以下基团的质量标记部分:
其中环状单元是芳族或脂族并在任意两个毗邻原子之间独立含有0-3个双键;各Z1独立为N、N(R1)、C(R1)、CO、CO(R1)(即–O-C(R1)-或–C(R1)-O-)、C(R1)2、O或S;Z2是N、N(R1)、C(R1)、CO、CO(R1)(即–O-C(R1)-或–C(R1)-O-)、C(H)R3、C(R1)(R2)、O或S;X是N、C或C(R1);各R1独立为H、取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基;R2是取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基;R3是H、取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团或取代或未取代的杂环基;y是0-10的整数;L是包含酰胺键的可切割接头,M是质量标准化部分。
本发明还提供用于标记和通过质谱法检测生物分子的上述质量标记物,该标记物如以下结构所示:
X-L-M
其中X是含有以下基团的质量标记部分:
其中环状单元是芳族或脂族并在任意两个毗邻原子之间独立含有0-3个双键;各Z独立为N、N(R1)、C(R1)、CO、CO(R1)(即–O-C(R1)-或–C(R1)-O-)、C(R1)2、O或S;X是N、C或C(R1);各R1独立为H、取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基;和y是0-10的整数,L是包含酰胺键的可切割接头,M是质量标准化部分,其中当y是3或4,L中的酰胺键毗邻(CR12)y时,(CR12)y中至少一个R1选自取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基。
在一优选的实施方式中,一个或多个上式所示的本发明质量标记物不包括一个或多个以下结构式或化合物:
其中CHRCO2H基团是天然存在的氨基酸;
其中R是C1-C4烷基、C2-C3烯基、最多具有6个碳原子的环烷基或任选被一个或多个卤素或一个或多个低级烷基取代的苯基或萘基;
其中R是H或低级烷基,A是酰氧基,卤素,羟基,酸性氮化合物的残基,该化合物的氢已被替代从而使得除去了氢的氮直接与汞原子结合,或–S-R’基团,其中R’是单羧基取代的低级烷基、多羧基取代的低级烷基、单羧基取代的芳族基团、多羧基取代的芳族基团、低级一元醇基团和低级多元醇基团及其盐,以及用于制备它们的中间体化合物;
其中R代表卤素、C1-C4烷基、氰基、C1-C4烷氧基、三氟甲基或三氟甲氧基;R1代表哌啶基、1,2,3,6-四氢-4-吡啶基、吡啶基或吡咯烷基;R2代表C1-C4烷基的氢;R3和R4独立代表氢、C1-C4烷基或者R3与R4结合代表C3-C7环烷基;R5代表三氟甲基、S(O)qC1-C4烷基、C1-C4烷基、C1-C4烷氧基、三氟甲氧基、卤素或氰基;L是单键或双键;n是1-3的整数;m是0或1-3的整数,q是0或1-2的整数;
N-(3,5-二-三氟甲基-苄基)-3-(4-氟-苯基)-N-甲基-3-哌啶-4-基-丙酰胺;
N-(3,5-二氯-苄基)-3-(4-氟-苯基)-N-甲基-3-哌啶-4-基-丙酰胺;
N-[1-(3,5-二氯-苯基)-乙基]-3-(4-氟-苯基)-N-甲基-3-哌啶-4-基-丙酰胺;
N-[1-(3,5-二氯-苯基)-乙基]-3-(4-氟-苯基)-N-甲基-3-[1-(2-甲氧基乙基)-哌啶-4-基]-丙酰胺;
N-(3,5-二氯-苄基)-3-(4-氟-苯基)-3-(4-氟-哌啶-4-基)-N-甲基-丙酰胺;
N-{[3,5-二(三氟甲基)苯基]甲基}-3-(4-氟苯基)-N-甲基-3-{1-[2-(甲氧基)乙基]-4-哌啶基}丙酰胺-N-{-1-[3,5-二(三氟甲基)苯基]乙基}-3-(4-氟苯基)-N-甲基-3-(4-哌啶基)丙酰胺;
N-{1-[3,5-二(三氟甲基)苯基]-1-甲基乙基}-3-(4-氟苯基)-3-(4-哌啶基)丙酰胺;
N-{[3-溴-4-(甲氧基)苯基]甲基}-3-(4-氟苯基)-N-甲基-3-(4-哌啶基)丙酰胺;
N-[(3,5-二甲基苯基)甲基]-3-(4-氟苯基)-N-甲基-3-(4-哌啶基)丙酰胺;
N-[(3,4-二溴苯基)甲基]-3-(4-氟苯基)-N-甲基-3-(4-哌啶基)丙酰胺;
N-[(3-氟-2-甲基苯基)甲基]-3-(4-氟苯基)-N-甲基-3-(4-哌啶基)丙酰胺;
N-{[2-氯-3-(三氟甲基)苯基]甲基}-3-(4-氟苯基)-N-甲基-3-(4-哌啶基)丙酰胺;
N-{-1-[3,5-二(三氟甲基)苯基]乙基}-3-(4-氟苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺;
N-[(3,5-二溴苯基)甲基]-3-(4-氟苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺;
N{-1-[3,5-二(三氟甲基)苯基]乙基}-3-(2,4-二氯苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺;
N-{-1-[3,5-二(三氟甲基)苯基]乙基}-3-(4-氟-2-甲基苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺;
N-[(3,5-二溴苯基)甲基]-3-(4-氟-2-甲基苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺;
N-[(3,5-二溴苯基)甲基]-3-(3,4-二氯苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺;
N-{[3,5-二(三氟甲基)苯基]甲基}-3-(4-氟苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺;
3-(4-氯苯基)-N-[(3,5-二溴苯基)甲基]-3-(4-氟-4-哌啶基)-N-甲基丙酰胺;
N-{[3,5-二(三氟甲基)苯基]甲基}-3-(4-氟苯基)-N-甲基-3-(3-亚哌啶基(piperidinylidene))丙酰胺;
N-[(3,5-二溴苯基)甲基]-3-(4-氟苯基)-N-甲基-3-(4-亚哌啶基)丙酰胺;
N-{[3,5-二(三氟甲基)苯基]甲基}-3-(4-氟-2-甲基苯基)-N-甲基-3-(1,2,3,6-四氢-4-吡啶基)丙酰胺;
N-{(1R)-1-[3,5-二(三氟甲基)苯基]乙基}-3-(4-氟-2-甲基苯基)-N-甲基-3-(1,2,3,6-四氢-4-吡啶基)丙酰胺;
N-{[3,5-二(三氟甲基)苯基]甲基}-3-(4-氟苯基)-N-甲基-3-(3-吡咯烷基)丙酰胺;
N-{[3,5-二(三氟甲基)苯基]甲基}-3-(4-氟苯基)-3-(3-氟-3-哌啶基)-N-甲基丙酰胺;
N-{-1-[3,5-二(三氟甲基)苯基]乙基}-3-(4-氟苯基)-N-甲基-3-(2-吗啉基)丙酰胺;
N-{[3,5-二(三氟甲基)苯基]甲基}-3-(4-氟苯基)-N-甲基-3-(3-哌啶基)丙酰胺;
N-{(3,5-二(三氟甲基)苯基)甲基}-3-(4-氟苯基)-N-甲基-3-(4-吡啶基)丙酰胺;
及它们的对映体、非对映体、药学上可接受的盐(例如盐酸盐)和溶剂合物;和
N{(1R)-1-[3,5-二(三氟甲基)苯基]乙基}-3-(4-氟苯基)-N-甲基-3-(4-哌啶基)丙酰胺(非对映体1);
N{(1S)-1-[3,5-二(三氟甲基)苯基]乙基}-3-(4-氟苯基)-N-甲基-3-(4-哌啶基)丙酰胺(非对映体2);
N{(1R)-1-[3,5-二(三氟甲基)苯基]乙基}-3-(4-氟苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺(非对映体1);
N-[(3,5-二溴苯基)甲基]-3-(4-氟苯基)-3-(4-氟-4-哌啶基)-N-甲基丙酰胺(对映体2);
N-{[3,5-二(三氟甲基)苯基]甲基}-3-(4-氟苯基)-3-(3-氟-3-哌啶基)-N-甲基丙酰胺(非对映体A);
和它们药学上可接受的盐(例如,盐酸盐)或溶剂合物;
其中A代表低级亚甲基,R1代表取代或未取代的环烷基-低级烷基、环烷基、四氢吡喃基-低级烷基、低级亚烷二氧基(alkylenedioxy)取代的低级烷基、取代的苯基-低级烷基或低级烷基-取代的哌啶基-低级烷基,R2代表取代或未取代的5-或6-元、饱和或不饱和的杂环-低级烷基、四氢吡喃硫基(pyranylthio)-低级烷基、吡啶硫基(pyridylthio)-低级烷基、低级亚烷基-二氧基-取代的低级烷基或取代或未取代的低级烷基,喹诺酮骨架的3-位和4-位之间的碳-碳键代表单键或双键;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2,4-二甲氧基-苯基)-哌啶-1-基]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2-乙氧基-4-甲基-苯基)-哌啶-1-基]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2-乙氧基-4-乙基-苯基)-哌啶-1-基]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(4-乙基-2-甲氧基-苯基)-哌啶-1-基]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(4-异丙基-2-甲氧基-苯基)-哌啶-1-基]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2-乙氧基-4-异丙基-苯基)-哌啶-1-基]-丁基}-苯甲酰胺;
4’-三氟甲基-联苯基-4-羧酸(4-{4-[2,5-二甲基-4-(吡啶-2-基甲氧基l)-苯基]-哌啶-1-基}-丁基)-酰胺;
4-(4-氯-苯甲酰基氨基)-N-[4-(4-苯并[1,3]间二氧杂环戊烯-5-基-哌啶-1-基)-丁基]-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-[4-(4-萘-2-基-哌啶-1-基)-丁基]-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(5,6,7,8-四氢-萘-2-基)-哌啶-1-基]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(4-萘-1-基-哌啶-1-基)-丁基]-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2-三氟乙氧基-4-甲基-苯基)-哌啶-1-基]-丁基}-苯甲酰胺;
4'-三氟甲基-联苯基-4-羧酸{4-[4-(2-甲基硫烷基l-苯基)-哌啶-1-基]-丁基}-酰胺;
4'-三氟甲基-联苯基-4-羧酸{4-[4-(1-甲基-1H-吲哚-3-基)-哌啶-1-基]-丁基}-酰胺;
4'-三氟甲基-联苯基-4-羧酸{4-[4-(1H-吲哚-3-基)-哌啶-1-基]-丁基}-酰胺;
4'-三氟甲基-联苯基-4-羧酸[4-(4-苯并[b]噻吩-3-基-哌啶-1-基)-丁基]-酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2,4-二甲氧基-苯基)-哌嗪-1-基]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2,4-二甲氧基-苯基)-[1,4]二氮杂环辛烷(diazocan)-1-基]-丁基}-苯甲酰胺;
4'-三氟甲基-联苯基-4-羧酸{4-[4-(2-乙氧基l-4-甲基-苯基氨基)-哌啶-1-基]-丁基}-酰胺;
4'-三氟甲基-联苯基-4-羧酸(4-{4-[苯磺酰基-(2-乙氧基-4-甲基-苯基)-氨基]-哌啶-1-基}-丁基)-酰胺;
4'-三氟甲基-联苯基-4-羧酸{4-[4-(萘(naphtalen)-1-氧基)-哌啶-1-基]-丁基}-酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2-甲氧基-4-甲基-苯基)-哌嗪-1-基]-丁基}-苯甲酰胺;
4'-三氟甲基-联苯基-4-磺酸{4-[4-(2-乙氧基-4-甲基-苯基)-哌啶-1-基]-丁基}-酰胺;
5-[4-(2-乙氧基-4-甲基-苯基)-哌啶-1-基]-戊酸(4'-三氟甲基-联苯基-4-基)-酰胺;
4'-{5-[4-(1-甲氧基-萘-2-基)-哌啶-1-基]-戊氧基}-联苯基-4-腈;
4'-{4-[4-(1-甲氧基-萘-2-基)-哌啶-1-基]-丁氧基}-联苯基-4-腈;
4-甲基-2-(4-三氟甲基-苯基)-噻唑-5-羧酸{4-[4-(4-异丙基-2-甲氧基l-苯基)-哌啶-1-基]-丁基-酰胺;
2-(4-氯-苯基)-1-甲基-1H-吲哚-5-羧酸{4-[4-(2-乙氧基-4-甲基-苯基)-哌啶-1-基]-丁基}-酰胺;
2-(4-三氟甲基-苯基)-苯并呋喃-5-羧酸{4-[4-(2-乙氧基l-4-甲基-苯基)-哌啶-1-基]-丁基}-酰胺;
2-(4-氯-苯基)-苯并呋喃-5-羧酸{4-[4-(2-乙氧基l-4-甲基-苯基)-哌啶-1-基]-丁基}-酰胺;
2-(3,4-二氯-苯基)-苯并呋喃-5-羧酸{4-[4-(1-环丙基甲氧基-5,6,7,8-四氢-萘-2-基)-哌啶-1-基]-丁基}-酰胺;
2-(6-三氟甲基-吡啶-3-基))-苯并呋喃-5-羧酸{4-[4-(1-环丙基甲氧基-5,6,7,8-四氢-萘-2-基)-哌啶-1-基]-丁基}-酰胺;
N-{4-[4-(2-乙氧基-4-甲基-苯基)-哌啶-1-基]-丁基}-4-(4-三氟甲基-苯基)-乙烯基]-苯甲酰胺;
N-{4-[4-(2-乙氧基-4-甲基-苯基)-哌啶-1-基]-丁基}-4-(4-三氟甲基-苄氧基)-苯甲酰胺;
4-[2-(3,5-二氯-苯基)-次乙基]-N-{4-[4-(2,4-二甲氧基-苯基)-哌嗪-1-基]-丁基}-苯甲酰胺;
4-[2-(3,5-二氯-苯基)-乙基]-N-{4-[4-(2,4-二甲氧基-苯基)-哌嗪-1-基]-丁基}-苯甲酰胺;
4-(4-苯甲酰基)-N-{4-[4-(4-异丙基-2-甲氧基l-苯基)-哌啶-1-基]-丁基}-苯甲酰胺;
4'-三氟甲基-联苯基-4-羧酸{4-[4-(2,4-二乙氧基-苄基)-哌啶-1-基]-丁基}-酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(2,4-二甲氧基-苯甲酰基)-哌啶-1-基]-丁基}-苯甲酰胺;
4'-氰基-联苯基-4-羧酸{4-[4-(1-甲基-1H-吲哚-3-基)-哌啶-1-基]-丁基}-酰胺
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(5-甲基-2-哌啶-4-基-苯酚)]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(5-乙基-2-哌啶-4-基-苯酚)]-丁基}-苯甲酰胺;
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(1-羟基-5,6,7,8-四氢-萘-2-基)-哌啶-1-基]-丁基}-苯甲酰胺;或
4-(4-氯-苯甲酰基氨基)-N-{4-[4-(1-羟基-萘-2-基)-哌啶-1-基]-丁基}-苯甲酰胺;
或它们的生理上可接受的盐、溶剂合物或衍生物。
在以上结构式和化合物中,当述及“低级”基团时,该术语“低级”表示对于所研究的具体基团,技术人员认为一定数量的碳原子数量较少。该术语最好表示C1-C6。
本发明第二方面提供用于标记和通过质谱法检测生物分子的反应性质量标记物,其包含用于将该质量标记物连接于生物分子和上述质量标记物的反应性官能团。该反应性官能团可以连接于该质量标记物的质量标准化部分或连接于该质量标记物的质量标记部分。
本发明人发现利用质谱仪不难鉴定上述质量标记物,还能灵敏地定量测定。
在一优选的实施方式中,质量标记物的总分子量的600道尔顿或更低,优选500道尔顿或更低,还要优选400道尔顿或更低,最优选300-400道尔顿。质量标记物特别优选的分子量是324、338、339和380道尔顿。尤其优选这些较佳的实施方式,因为小体积的质量标记物表示当用本发明的质量标记物标记时,待检测生物分子大小的增加最少。因此,用质谱法分析时,本发明质量标记物标记的生物分子可以与未标记生物分子在同一质谱窗中观察。这有助于鉴定质量标记物自身的峰。
在一优选的实施方式中,质量标记部分的分子量为300道尔顿或更低,优选250道尔顿或更低,更优选100-250道尔顿,最优选100-200道尔顿。尤其优选这些较佳的实施方式,因为小体积的质量标记部分表示能在质谱图的沉默区(silent region)产生峰,从而便于从质谱图中鉴定质量标记,还能灵敏地定量测定质量标记。
本文所用的术语质谱图(例如MS/MS图谱)的“沉默区”指质谱图中背景“噪声”低的区域,该“噪声”是与存在标记肽片段化所产生片段有关的峰导致。MS/MS图谱是以MS-方式分裂峰获得,从而在MS/MS图谱中不会出现污染物,例如缓冲试剂、变性剂和洗涤剂。在此方法中优选以MS/MS方式定量测定。因此,术语“沉默区”指质谱图中待检测生物分子相关峰导致的背景“噪声”低的区域。当待检测的生物分子是肽或蛋白质,质谱图的沉默区低于200道尔顿。当待检测的生物分子是DNA、RNA、寡聚物或核酸碱基时,质谱图的沉默区低于500道尔顿。
本发明人还发现当上述质量标记物和反应性质量标记物未与代检测的生物分子相连时,不难先将它们与用本发明质量标记物标记的生物分子分开,再用质谱仪分析。
本发明还发现上述反应性质量标记物易和生物分子快速反应,从而形成标记的生物分子。
本发明还提供一种分析方法,该方法包括通过质谱法鉴定与分析物有关的质量标记物来检测生物分子或生物分子混合物,其中所述质量标记物是上述质量标记物。
在第三方面,本发明提供两种或多种质量标记物或反应性质量标记物的集合,其中该集合中各标记物如上所述,各质量标准化部分确保质量标记物具有所需的总质量,其中该集合包括:
-一组具有共同质量的质量标记部分的标记物,该组中各标记物具有唯一独特的总质量;或
-一组具有质量标记部分的标记物,各质量标记部分的质量不同于该组中所有其它质量标记部分的,该组中各标记物具有共同的总质量;
其中可通过质谱法彼此区分该集合中的所有质量标记物。
该集合中标记物的数量不作具体限定,只要该集合包括多种标记物。然而,优选该集合包括两种或多种、三种或多种、四种或多种、或五种或多种标记物,更优选六种或多种标记物,最优选八种或多种标记物。
本文的术语“总质量”指质量标记物的总质量,即质量标记部分、可切割接头、质量标准化部分和质量标记物的任何其它组分的质量总和。
质量标准化部分只受其质量的限制,其在某集合中不同质量标记物之间可能不同。例如,当某组合包含质量标记部分的质量不同但总质量相同的一组标记物时,该集合中各标记物的质量标准化部分的质量不同。在此情况中,各质量标记物中质量标准化部分的质量等于共同的总质量减去该质量标记物中具体质量标记部分的质量并减去可切割接头的质量。当该集合包含质量标记部分的质量相同但总质量不同的一组标记物时,明显需要改变质量标准化部分的质量,从而使得该组中所有标记物的总质量不同。
采用质谱法可以彼此区分该集合中的所有质量标记物。因此,质谱仪能区分质量标记物,即各质量标记物所获得的峰可以清楚地彼此分开。质量标记部分之间或质量标记物之间的质量差异表示质谱仪能区分不同质量标记物或质量标记部分所获得的离子。
本发明还通过一种质量标记物阵列,其包含上述质量标记物的两种或多种集合,其中任一集合中各质量标记物的总质量不同于该阵列的其它各集合中各质量标记物的总质量。
在本发明的优选实施方式中,阵列的质量标记物优选在化学上均相同,通过同位素取代改变质量标准化部分和质量标记部分的质量。
在本发明的其它优选实施方式中,质量标记物可包含灵敏度增强基团。质量标记物优选以下形式:
灵敏度增强基团-X-L-M-反应性官能团
在该例子中,灵敏度增强基团通常与质量标记部分相连,由于要增强用质谱仪检测该部分的灵敏度。反应性官能团如上式所示,其与灵敏度增强基团不同的部分相连。然而,质量标记物不限于这种情况,在一些情况中可含有灵敏度增强基团而不含反应性官能团。在其它实施方式中,灵敏度增强基团可以连接于和反应性官能团相同的部分。
在本发明的某些实施方式中,质量标记物含有亲和捕捉试剂。亲和捕捉试剂优选生物素。亲和捕捉配体通过捕捉标记的分离物而将其与未标记的分离物分开,例如采用亲和素化的固相。
在第四方面,本发明还提供一种方法,该方法采用质谱法鉴定生物分子或生物分子混合物相关的质量标记物或质量标记物组合来分析分析物或分析物的混合物,所述分析物或分析物的混合物优选生物分子或生物分子的混合物,其中所述质量标记物是上述质量标记物集合或阵列的质量标记物。
该方法优选包括以下步骤:
1.使生物分子或生物分子混合物与本发明质量标记物反应;
2.任选通过电泳或色谱方法单独标记的生物分子;
3.使标记的生物分子电离;
4.用质量分析仪选择离子,其预定质荷比对应于标记生物分子的优选离子的质荷比;
5.通过碰撞诱导这些选择的离子解离;
6.检测碰撞产物来鉴定指示质量标记物的碰撞产物离子。
在该实施方式中,质量标记物含有亲和力标签时,可利用反配体捕捉作亲和力标记的生物分子来单独标记的生物分子和未标记的生物分子。最好先进行该步骤再进行任选的上述第二步骤。
在某些实施方式中,用串联仪器的第一质量分析仪实施选择具有预定质荷比的离子的步骤。根据第4步骤,随后将所选择的离子导入单独的碰撞室,在该处它们与气态或固态表面碰撞。根据第5步骤,然后将碰撞产物导入串联仪器的另一质量分析仪中来检测碰撞产物。典型的串联仪器包括三重四极质谱仪(triple quadrupole mass spectrometer)、串联扇形仪器(tandem sector instrument)和四极飞行时间质谱仪(quadrupole time of flight mass spectrometer)。
在其它实施方式中,在质谱仪的同一区域进行选择具有预定质荷比的离子的步骤,使选择的离子与气体碰撞的步骤和检测碰撞产物的步骤。这可用,例如离子阱质量分析仪(ion trap mass analyser)和傅里叶变换离子回旋共振质谱仪(Fourier Transform Ion Cyclotron Resonance mass spectrometer)实施。
在本发明中,可以采用衬质辅助激光解吸/电离(MALDI)技术。MALDI要求将生物分子溶液包埋在摩尔过量的光可激发“衬质”中。应用频率合适的激光激发了衬质,进而导致该衬质与其捕捉的生物分子一起快速蒸发。质子从酸性衬质转移至生物分子产生了质子化形式的生物分子,其可用阳离子质谱仪,特别是飞行时间(TOF)质谱仪检测。MALDI TOF还可能实施阴离子质谱法。该技术赋予离子显著量的平动能,尽管如此,但不易诱导过分断裂。采用此技术可利用将潜在差异应用于加速源离子的激光能量和定时,从而能控制断裂。该技术因为质量范围大、图谱中普遍是单电荷离子和能同时分析多种肽而极其有利。本发明可采用TOF/TOF技术。
光激发衬质包含“染料”,即强烈吸收特定频率的光的化合物,该化合物最好不通过荧光或磷光发射能量,而是通过热力消散能量,即通过振动的方式。激光激发所导致的衬质振动造成染料快速升华,同时携带将所包埋的分析物成为气相。
虽然本发明可采用MALDI技术,但本发明不限于该类技术,如果需要,本发明的技术人员可采用该领域公知的其它技术。
在另一方面,本发明提供含有上述质量标记物的标记生物分子。生物分子可以是感兴趣的任何生物分子,例如DNA、RNA、寡核苷酸、核酸碱基、蛋白质、肽和/或氨基酸或上述任何分子的类似物。生物分子可以连接于质量标记物的质量标记部分或质量标记物的质量标准化部分。
本发明还提供以下形式的质量标记生物分子的多种集合或阵列:
生物分子-接头-标记物
其中所述标记物是本发明集合或阵列的质量标记物,所述接头是下述接头,生物分子可以是感兴趣的任何生物分子,例如DNA、RNA、寡核苷酸、核酸碱基、蛋白质、肽和/或氨基酸或上述任何分子的类似物。
该实施方式的一个优选方面是集合或阵列中的所述生物分子(一种、多种或甚至所有生物分子)是质量已知或具有预定色谱特性的标准生物分子。本发明方法可以利用这种标准品来比较未知的生物分子,例如分析色谱分离步骤的结果时。
文中质谱仪的术语“MS/MS”指能选择离子、对所选择的离子进行碰撞诱导解离(CID)并进一步分析片段离子的质谱仪。
术语“串联仪器”指能实施MS/MS的质谱仪,其中串联装配质量分析仪,用相连的质量分析仪依次进行MS/MS过程的各步骤。典型的串联仪器包括三重四极质谱仪、串联扇形仪器、四极飞行时间质谱仪和TOF/TOF质谱仪。
附图说明
下文将参考附图(仅是举例)进一步详细描述本发明,其中:
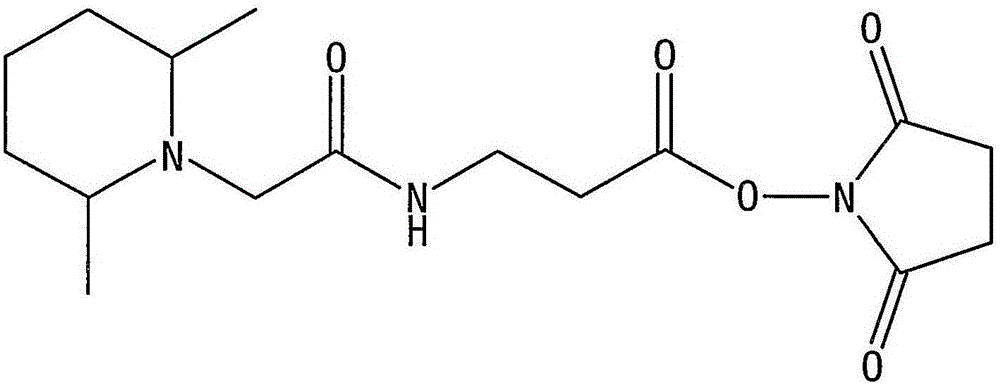
图1a-1e显示了本发明的5种反应性质量标记物,图1a是3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(DMPip-βAla-OSu);图1b是3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-βAla-OSu);图1c是6-[(嘧啶-2-基硫烷基)-乙酰氨基]-己酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-C6-OSu);图1d是2-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(DMPip-Ala-OSu);图1e是[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-Gly-OSu);
图2显示了本发明质量标记物的两种同位素形式;
图3显示了本发明质量标记物的五种同位素形式;
图4显示了的DMPip-βAla-LGEHNIDVLEGNEQFINAA(DMPip-βAla-)K形成;
图5显示了DMPip-βAla-VATVSLPR的形成;
图6显示了Pyrm-βAla-VATVSLPR的形成;
图7显示了DMPip-βAla-VATVSLPR的MS/MS分析;
图8显示了DMPip-βAla-DYEGATLSDIGALIR的MS/MS分析;
图9显示了DMPip-βAla-LGEHNIDVLEGNEQFINAA(DMPip-βAla-)K的MS/MS分析;
图10显示了Pyrm-βAla-VATVSLPR的MS/MS分析;
图11显示了Pyrm-βAla-DYEGATLSDIGALIR的MS/MS分析;
图12显示了Pyrm-C6-VATVSLPR的MS/MS分析;
图13显示了Pyrm-C6-DYEGATLSDIGALIR的MS/MS分析;
图14显示了Pyrm-βAla-Osu双体物质(duplex reagent)的逆合成;
图15显示了DMPip-βAla-OSu双体物质的逆合成;
图16显示了DMPip-Ala-VATVSLPR的形成;
图17显示了DMPip-Ala-VATVSLPR的MS/MS分析;
图18显示了DMPip-Ala-DYEGATLSDIGALIR的MS/MS分析;
图19显示了DMPip-Gly-VATVSLPR的MS/MS分析;
图20显示了DMPip-Gly-DYEGATLSDIGALIR的MS/MS分析;
图21显示了所检测的肽比例(H:L+H)×100对预计的肽比例(H:L+H)×100的作图;
图22显示了本发明质量标记物的六种同位素形式,包括质量标记部分片段(X)的分子量;
图23a和23b显示了用本发明质量标记物标记的蛋白质的基峰色谱图;
图24a和24b显示了用本发明质量标记物标记的蛋白质的基峰色谱图;
图25显示了用本发明质量标记物标记的蛋白质混合物(人工混合物)的相对定量数据;
图26显示了图25所示用本发明质量标记物标记的蛋白质混合物中各蛋白质的相应CV;
图27显示了应用阈值过滤以除去在MS/MS图谱中是低强度质量标记部分片段的肽后,用本发明质量标记物标记的蛋白质混合物(人工混合物)的相对定量数据;
图28显示了图27所示用本发明质量标记物标记的蛋白质混合物中各蛋白质的相应CV;
图29a和29b显示了从不含人工混合物的强阳离子交换色谱酵母部分鉴定的不同蛋白质比例的分布情况;
图30a和30b显示了从以1:1比例掺加了人工混合物的强阳离子交换色谱酵母部分鉴定的不同蛋白质比例的分布情况;
图31a和31b显示了从以1:0.1比例掺加了人工混合物的强阳离子交换色谱酵母部分鉴定的不同蛋白质比例的分布情况;
图32显示了用本发明6重质量标记物(6-plex mass label)标记的三种肽的相对蛋白质检测值;
图33显示了用本发明质量标记物标记的肽的特征离子区域(signature ion region);
图34显示了用本发明6重质量标记物标记的肽的相对定量测定情况;
图35显示了用本发明质量标记物标记的肽的特征离子区域;
图36显示了应用阈值过滤后,用本发明6重质量标记物标记的肽的相对定量测定情况;
图37显示了应用阈值过滤后,用本发明6重质量标记物标记的肽的相对定量测定情况。
具体实施方式
下文将详细描述本发明。
质量标记部分
在一优选的实施方式中,本发明提供上述质量标记物,其中质量标记部分的分子量是300道尔顿或较低,优选250道尔顿或较低,更优选100-250道尔顿,最优选100-200道尔顿。质量标记部分的特别优选分子量是125、126、153和154道尔顿,或者其中一个或多个或全部12C原子被13C原子取代的质量,例如未取代的质量标记部分的质量是125,其分别用1、2、3、4、5和6个13C原子取代和/或一个或多个或全部14N原子被15N原子取代的经取代相应部分的质量可以是126、127、128、129、130和131道尔顿。
本发明质量标记部分的组分优选不易断裂,从而能通过引入易为碰撞诱导解离(CID)所打断的连接键来控制标记的断裂位点。
本发明质量标记部分包含以下基团:
其中环状单元是芳族或脂族并在任意两个毗邻原子之间独立含有0-3个双键;各Z独立为N、N(R1)、C(R1)、CO、CO(R1)(即–O-C(R1)-或–C(R1)-O-)、C(R1)2、O或S;X是N、C或C(R1);各R1独立为H、取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基;y是0-10的整数,L是包含酰胺键的可切割接头,M是质量标准化部分。
质量标记部分的取代基不作特别限定,可以包含任何有机基团和/或周期表中IIIA、IVA、VA、VIA或VIIA任一族的一个或多个原子,例如B、Si、N、P、O或S原子或卤素原子(例如,F、Cl、Br或I)。
当取代基包含有机基团时,所述有机基团优选包含烃基团。烃基团可以包含直链、支链或环状基团。烃基团可以独立包含脂族或芳族基团。烃基团还可独立包含饱和或不饱和的基团。
当烃基团包含不饱和基团时,其可包含一个或多个烯烃官能团和/或一个或多个炔烃官能团。当烃基团包含直链或支链基团时,其可包含一个或多个伯烷基、仲烷基和/或叔烷基。当烃基团包含环状基团时,其可包含芳环、脂环、杂环基团和/或这些基团的稠环衍生物。因此,环状基团可以包含苯、萘、蒽、茚、芴、吡啶、喹啉、噻吩、苯并噻吩、呋喃、苯并呋喃、吡咯、吲哚、咪唑、噻唑和/或唑基团及以上基团的区域异构体(regionisomer)。
烃基团中的碳原子数不作具体限定,但优选含有1-40个C原子的烃基团。因此,烃基团可以是低级烃(1-6个C原子)或高级烃(7个或更多个C原子,例如7-40个C原子)。环状基团的环中原子数不做具体限定,但优选环状基团的环包含3-10个原子,例如3、4、5、6或7个原子。
含有上述杂原子的基团以及上述任何其它基团可包含周期表中IIIA、IVA、VA、VIA或VIIA任一族的一个或多个杂原子,例如B、Si、N、P、O或S原子或卤素原子(例如,F、Cl、Br或I)。因此,取代基可包含一个或多个有机化学共同官能团,例如羟基、羧酸基团、酯基团、醚基团、醛基、酮基、氨基、酰氨基、亚胺基、巯基、硫醚基团、硫酸根基团、磺酸基团和磷酸根基团等。取代基还可包含这些基团的衍生物,例如羧酸酐和羧酸卤化物。
此外,任何取代基可含有上述两种或多种取代基和/或功能基团的组合。
在本发明中,述及含有上述基团的质量标记部分表示根据质量标记物发生切割的位置,该质量标记部分还可包含其它基团。如下所示,在接头的切割发生在CO和NH之间的酰胺键之处的实施方式中,质量标记部分还可包含CO基团:
如下所示,在接头的切割发生在NH基团后的键之处的另一实施方式中,质量标记部分还可包含CO和NH基团:
如下所示,在接头在CO基团之前切割的另一实施方式中,质量标记部分只包含以下基团:
在一优选的实施方式中,y是0、1或2,更优选y是0或1。
在一优选的实施方式中,环状单元的芳族,该环状单元中各Z是N。还优选X是C。还优选不在环状单元中的Z是S。
在另一优选的实施方式中,环状单元是脂族,该环状单元中各Z是C(R1)2。还优选X是N。还优选不在环状单元中的Z是C(R1)2。
在一优选的实施方式中,质量标记部分含有以下基团之一:
和
根据质量标记物发生切割之处,以上基团还可包含其它基团。如下所示,在接头的切割发生在CO和NH之间的酰胺键之处的实施方式中,以上质量标记部分基团还可包含CO基团:
如下所示,在接头的切割发生在NH基团后的键之处的另一实施方式中,以上质量标记部分基团还可包含CO和NH基团:
如下所示,在接头在CO基团之前切割的另一实施方式中,质量标记部分只包含以下基团:
在更优选的实施方式中,质量标记部分含有以下基团之一:
和
根据质量标记物发生切割之处,以上基团还可包含其它基团。如下所示,在接头的切割发生在CO和NH之间的酰胺键之处的实施方式中,以上质量标记部分基团还可包含CO基团:
如下所示,在接头的切割发生在NH基团后的键之处的另一实施方式中,以上质量标记部分基团还可包含CO和NH基团:
如下所示,在接头在CO基团之前切割的另一实施方式中,质量标记部分只包含以下基团:
接头
本发明质量标记物的可切割接头包含酰胺键。所述可切割接头优选可通过碰撞切割的接头。接头的结构不作具体限定,只要其包含酰胺键。然而,所述接头优选由酰胺键构成。
在上下文中,提及了可用于将感兴趣分子连接于本发明质量标记化合物的接头基团。本领域知道可用于引入本发明质量标记物和它们的共价相连生物分子之间的各种接头。一些接头可以被切割。寡聚或多聚乙二醇或它们的衍生物可用作接头,例如Maskos,U.和Southern,E.M.Nucleic Acids Research 20:1679-1684,1992中所述的那些。还广泛使用琥珀酸接头,虽然这些接头不优选用于涉及标记寡核苷酸的应用,因为它们通常是碱不稳定的,因此与许多寡核苷酸合成器中使用的碱介导脱保护步骤不相容。
丙炔醇(propargylic alcohol)是能在寡核苷酸合成条件下提供稳定连接键的双功能接头,其是本发明所用涉及寡核苷酸应用的优选接头。类似地,6-氨基己醇是适当连接职能化分子的有用双功能试剂,其也是优选的接头。
各种已知的可切割接头基团可与本发明化合物,例如光可切割的接头联用。邻-硝基苄基是已知的光可切割接头,特别是2-硝基苄基酯和2-硝基苄胺,其在苄胺键处切割。可切割接头的综述可参见Lloyd-Williams等,Tetrahedron49,11065-11133,1993,该篇文章包括各种光可切割和化学可切割的接头。
WO 00/02895披露了作为可切割接头的乙烯基砜,它们也可用于本发明,特别是应用于涉及多肽、肽和氨基酸的标记。该申请的内容纳入本文作为参考。
WO 00/02895披露了硅化合物作为接头的应用,它们在气相可由键切割。这些接头也可应用于本发明,特别是应用于涉及寡核苷酸的标记。该申请的内容纳入本文作为参考。
质量标准化部分
本发明质量标记物的质量标准化部分的结构不作具体限定,只要其适合于确保质量标记物具有所需的总质量。然而,质量标准化部分优选包含直链或支链C1-C20取代或未取代的脂族基团和/或一个或多个取代或未取代的氨基酸。
直链标准化部分优选包含C1-C6取代或未取代的脂族基团、更优选C1、C2、C3、C4、C5取代或未取代的脂族基团、还要更优选C1、C2或C5取代或未取代的脂族基团或C1甲基取代的基团。
所述一个或多个取代或未取代的氨基酸可以是任何必需或非必需的天然产生的氨基酸或非天然产生的氨基酸。优选的氨基酸是丙氨酸、β-丙氨酸和甘氨酸。
质量标准化部分的取代基不作具体限定,可以包含任何有机基团和/或周期表中IIIA、IVA、VA、VIA或VIIA任一族的一个或多个原子,例如B、Si、N、P、O或S原子或卤素原子(例如,F、Cl、Br或I)。
当取代基包含有机基团时,所述有机基团优选包含烃基团。烃基团可以包含直链、支链或环状基团。烃基团可以独立包含脂族或芳族基团。烃基团还可独立包含饱和或不饱和的基团。
当烃基团包含不饱和基团时,其可包含一个或多个烯烃官能团和/或一个或多个炔烃官能团。当烃基团包含直链或支链基团时,其可包含一个或多个伯烷基、仲烷基和/或叔烷基。当烃基团包含环状基团时,其可包含芳环、脂环、杂环基团和/或这些基团的稠环衍生物。因此,环状基团可以包含苯、萘、蒽、茚、芴、吡啶、喹啉、噻吩、苯并噻吩、呋喃、苯并呋喃、吡咯、吲哚、咪唑、噻唑和/或唑基团及以上基团的区域异构体。
烃基团中的碳原子数不作具体限定,但优选含有1-40个C原子的烃基团。因此,烃基团可以是低级烃(1-6个C原子)或高级烃(7个或更多个C原子,例如7-40个C原子)。环状基团的环中原子数不做具体限定,但优选环状基团的环包含3-10个原子,例如3、4、5、6或7个原子。
含有上述杂原子的基团以及上述任何其它基团可包含周期表中IIIA、IVA、VA、VIA或VIIA任一族的一个或多个杂原子,例如B、Si、N、P、O或S原子或卤素原子(例如,F、Cl、Br或I)。因此,取代基可包含一个或多个有机化学共同官能团,例如羟基、羧酸基团、酯基团、醚基团、醛基、酮基、氨基、酰氨基、亚胺基、巯基、硫醚基团、硫酸根基团、磺酸基团和磷酸根基团等。取代基还可包含这些基团的衍生物,例如羧酸酐和羧酸卤化物。
此外,任何取代基可含有上述两种或多种取代基和/或功能基团的组合。
反应性质量标记物
用于标记和通过质谱法检测生物分子的本发明反应性质量标记物包含反应性官能团以促进上述质量标记物与生物分子相连或将上述质量标记物与生物分子相连。在本发明的优选实施方式中,反应性官能团能使质量标记物与生物分子,例如但不限于核苷酸、寡核苷酸、多核苷酸、氨基酸、肽或多肽中合适的官能团共价反应。反应性官能团可以经可切割或不可切割的接头连接于质量标记物。反应性官能团可以连接于质量标记物的质量标记部分或质量标记物的质量标准化部分。
可将各种反应性官能团引入本发明的质量标记物。反应性官能团的结构不作具体限定,只要其能与待标记的生物分子上的一个或多个反应位点反应。反应性官能团优选亲核或亲电。
在最简单的实施方式中,其可以是N-羟基琥珀酰亚胺酯。N-羟基琥珀酰亚胺活化的质量标记物还可与肼反应得到酰肼反应性官能团,其可用于标记例如高碘酸盐氧化的糖部分。在一些应用中,氨基或巯基可用作反应性官能团。可利用碳二亚胺作为偶联剂,用赖氨酸偶联质量标记物或游离的羧基官能团。赖氨酸还可用作将其它反应性官能团引入本发明质量标记物的起点。可通过赖氨酸ε氨基与马来酸酐反应引入巯基反应性马来酰亚胺官能团。可将半胱氨酸巯基用作合成各种烯基砜化合物的起点,这些化合物是能与巯基和氨基反应的有用蛋白质标记试剂。例如氨基己酸等化合物可用于在质量修饰的质量标记部分或质量标准化部分和反应性官能团之间提供间隔基团。
下表1列出了一些反应性官能团,它们可与生物分子中发现的亲核官能团反应从而在两个实体之间产生共价键。对于涉及合成寡核苷酸的应用,常将伯胺或巯基引入分子的末端以进行标记。可将下表列出的任何官能团引入本发明化合物,从而能使质量标记与感兴趣的生物分子相连。如果需要,可利用反应性官能团引入含有其它官能团的其它接头基团。表1不是穷尽性的,本发明不限于仅利用所列的官能团。
表1
在本发明优选的实施方式中,反应性官能团包含以下基团:
其中,各R2独立为H、取代或未取代的直链或支链C1-C6烷基、取代或未取代的脂族环状基团、取代或未取代的芳族基团或取代或未取代的杂环基。
反应性官能团的取代基不作具体限定,可以含有有机基团和/或周期表中IIIA、IVA、VA、VIA或VIIA任一族的一个或多个原子,例如B、Si、N、P、O或S原子或卤素原子(例如,F、Cl、Br或I)。
当取代基包含有机基团时,有机基团优选包含烃基团。烃基团可包含直链、支链或环状基团。烃基团可独立包含脂族或芳族基团。烃基团还可独立包含饱和或不饱和的基团。
当烃基团包含不饱和基团时,其可含有一个或多个烯烃官能团和/或一个或多个炔烃官能团。当烃基团包含直链或支链基团时,其可包含一个或多个伯烷基、仲烷基和/或叔烷基。当烃基团包含环状基团时,其可包含芳环、脂环、杂环基团和/或这些基团的稠环衍生物。因此,环状基团可以包含苯、萘、蒽、茚、芴、吡啶、喹啉、噻吩、苯并噻吩、呋喃、苯并呋喃、吡咯、吲哚、咪唑、噻唑和/或唑基团及以上基团的区域异构体。
烃基团中的碳原子数不作具体限定,但优选含有1-40个C原子的烃基团。因此,烃基团可以是低级烃(1-6个C原子)或高级烃(7个或更多个C原子,例如7-40个C原子)。环状基团的环中原子数不做具体限定,但优选环状基团的环包含3-10个原子,例如3、4、5、6或7个原子。
含有上述杂原子的基团以及上述任何其它基团可包含周期表中IIIA、IVA、VA、VIA或VIIA任一族的一个或多个杂原子,例如B、Si、N、P、O或S原子或卤素原子(例如,F、Cl、Br或I)。因此,取代基可包含一个或多个有机化学共同官能团,例如羟基、羧酸基团、酯基团、醚基团、醛基、酮基、氨基、酰氨基、亚胺基、巯基、硫醚基团、硫酸根基团、磺酸基团和磷酸根基团等。取代基还可包含这些基团的衍生物,例如羧酸酐和羧酸卤化物。
此外,任何取代基可含有上述两种或多种取代基和/或功能基团的组合。
在更优选的实施方式中,反应性官能团包含以下基团:
在本发明一优选实施方式中,反应性质量标记物具有以下结构之一:
3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(DMPip-βAla-OSu)
3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-βAla-OSu)
6-[(嘧啶-2-基硫烷基)-乙酰氨基]-己酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-C6-OSu)
2-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-己酸-(2,5-二氧代-吡咯烷-1-基)-酯(DMPip-Ala-OSu)
[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-Gly-OSu)。
根据本发明第三方面的优选实施方式,集合中各标记物所含的质量标记部分具有共同质量,集合中各标记物具有独特的总质量,(第一标记物类型)。
在另一更优选的实施方式中,集合中各标记物具有共同的总质量,集合中各标记物含有质量独特的质量标记部分,(第二标记物类型)。
如上所述,标记物集合不限于上述两种优选的实施方式,例如可以包含两种类型的标记物,只要能通过质谱法区分所有标记物。
在第二类型的标记物集合中,优选该集合中各质量标记部分具有共同的基础结构,该集合中各质量标准化部分具有共同的基础结构,该集合中各质量标记物包含一个或多个质量调整部分,所述质量调整部分与质量标记部分的基础结构和/或质量标准化部分的基础结构相连或位于其中。在该实施方式中,集合中各质量标记部分包含不同数量的质量调整部分,而集合中各质量标记物具有相同数量的质量调整部分。
在本说明书中,共同的基础结构表示两个或多个部分共有结构骨架、主链或核心基本上相同的某结构。骨架包含以上结构式所示的质量标记部分或上述质量标准化部分,但还可包含经酰胺键相连的许多氨基酸。然而,还可以存在其它单位,例如芳基醚单位。骨架或主链可含有垂下的取代基,或在其中含有原子或同位素取代而不改变共同的基础结构。
在一优选实施方式中,上述第一和/或第二类型的质量标记物或反应性质量标记物的集合包含具有以下结构的质量标记物:
M(A)y-L-X(A)z
其中M是质量标准化部分,X是质量标记部分,A是质量调整部分,L是可切割接头,y和z是0或更大的整数,y+z是1或更大的整数。M优选不易断裂的基团,L是经与另一分子或原子碰撞后易于断裂的接头,X优选预电离的不易断裂基团。
如果质量标记物集合是上述第二种类型,该集合中所有成员的M和X质量总和相同。M和X优选具有相同的基础结构或核心结构,该结构由质量调整部分修饰。质量调整部分确保该集合中所有质量标记物的M和X质量总和相同,还确保各X具有不同的(独特的)质量。
质量调整部分(A)优选:
(a)位于质量标记部分和/或质量标准化部分内的同位素取代基,和
(b)与质量标记部分和/或质量标准化部分相连的取代原子或基团。
质量调整部分优选卤素原子取代基、甲基取代基和2H、15N、18O或13C同位素取代基。
在本发明第三方面的优选实施方式中,上述质量标记物集合中各质量标记物具有以下结构:
X(*)n-L-M(*)m
其中X是质量标记部分,L是可切割接头,M是质量标准化部分,*是同位素质量调整部分,n和m是0或更大的整数,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
X优选包含以下基团:
其中R1、Z、X和y如上所述,该集合中各标记物包含0、1或更多个*,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
在一优选实施方式中,质量标记部分所含基团选自以下基团:
和
其中该集合包含0、1或更多个*,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
在另一优选实施方式中,质量标记部分包含选自以下的基团:
和
其中该集合包含0、1或更多个*,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
在另一优选实施方式中,本发明的反应性质量标记物包含以下反应性官能团:
其中R2如上所述,该集合包含0、1或更多个*,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
反应性官能团优选含有以下基团:
其中该集合包含0、1或更多个*,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
在一优选实施方式中,反应性质量标记物集合包含两种或多种以下任一结构所示的质量标记物:
其中*代表氧是18O,碳是13C或者氮是15N,其中该集合中各标记物包含0、1或更多个*,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
在一优选实施方式中,反应性质量标记物集合包含两种或多种以下任一结构所示的质量标记物:
其中*代表碳是13C或者氮是15N,其中该集合中各标记物包含0、1或更多个*,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
上述反应性质量标记物更优选包含两种或多种以下任一结构所示的质量标记物:
其中*代表碳是13C或者氮是15N,其中该集合中各标记物包含0、1或更多个*,从而使得:
该集合中各标记物所含质量标记部分具有共同的质量,该集合中各标记物具有独特的总质量,或
该集合中各标记物所含质量标记部分具有独特的质量,该集合中各标记物具有共同的总质量。
在所有上述优选的化合物和结构式中,特别优选同位素原子*位于质量标记部分和/或接头和/或质量调整部分内,而不是在促进标记物与分析物相连的任何反应性部分上。最优选*存在于质量标记部分,X内。同位素取代基的数量不作具体限定,可以根据集合中标记物的数量来确定。*原子的数量通常是0-20,更优选0-15,最优选1-10,例如1、2、3、4、5、6、7或8。在两个标记物的集合中,*原子的数量优选1,在5个标记物的集合中,该数量优选4,而在6个标记物的集合中,该数量优选5。然而,该数量可根据标记物的化学结构而不同。
如果标记物含有一个或多个硫原子,则需要时,还可将S的同位素变体用作质量调整部分。
在质量调整部分是15N或13C的特别优选实施方式中,反应性质量标记物集合包含具有以下结构的两种质量标记物:
在质量调整部分是15N或13C的特别优选实施方式中,反应性质量标记物集合包含具有以下结构的五种质量标记物的集合:
在质量调整部分是15N或13C的另一特别优选实施方式中,反应性质量标记物集合包含具有以下结构或这些结构的立体异构体的六种质量标记物I-IV:
本发明还包括多个上述质量标记物集合的阵列。本发明质量标记物的阵列不作具体限定,只要它们含有本发明质量标记物的多个集合。阵列优选含有两个或更多个、三个或更多个、四个或更多个或五个或更多个集合的质量标记物。阵列中各质量标记物优选具有以下结构之一:
(S)x-M(A)y-L-X(A)z
M(A)y-(S)x-L-X(A)z
其中S是质量系列修饰基团(mass series modifying group),M、X和L如上所述,A是质量调整部分,x是0或更高的整数,y和z是0或更高的整数,y+z是1或更高的整数。质量系列修饰基团使质量标记物集合彼此分开。该基团可以是任何类型的基团,但优选氨基酸或芳基醚基团。与不同集合的标签相比,通过在各部分中包含不同数量的氨基酸可以在质量上将各集合分开。
下文参考“荷电官能团”和增溶基团。可将这些基团引入质量标记物,例如本发明的质量标记物,从而促进电离和溶解。标记的选择取决于要应用阳离子还是阴离子检测。下表2列出了可引入质量标记物中以促进正电离或负电离的一些官能团。该表格不是穷尽性的清单,本发明不限于仅使用所列的官能团。
表2
为促进质量标记物电离,WO 00/02893披露了金属离子结合部分,例如冠醚或卟啉类化合物。这些部分也可应用于本发明的质量标记物。
本发明还提供两种或多种探针的集合,该集合中各探针不同并与上述质量标记物集合或阵列的独特质量标记物或质量标记物的独特组合相连。
还提供了包含两个或多个探针集合的探针阵列,其中任一集合中各探针与上述质量标记物集合的独特质量标记物或质量标记物的独特组合相连,其中任一集合中的多个探针与同一质量标记物集合的质量标记物相连。各探针集合与上述质量标记物阵列的独特质量标记物集合相连。
在一个实施方式中,各探针优选与质量标记物的独特组合相连,各组合因存在或不存在质量标记物集合中的各质量标记物和/或与该探针相连的各质量标记物的数量而相区别。这称为本发明的“混合模式”,因为探针可与质量标记物的混合物相连。
在以上方面,探针的性质不作具体限定。然而,各探针优选包含生物分子。可利用任何生物分子,但优选DNA、RNA、寡核苷酸、核酸甲基、肽、多肽、蛋白质和氨基酸。
在一优选实施方式中,本发明提供以下形式的质量标记的生物分子,例如核苷酸、寡核苷酸和多核苷酸的集合和阵列:
生物分子-接头-标记物
其中所述接头是上述接头,标记物是上述任一集合和阵列的质量标记物。
可利用任何生物分子,但优选DNA、RNA、寡核苷酸、核酸甲基、肽、多肽、蛋白质和氨基酸。
在一个实施方式中,各生物分子优选与质量标记物的独特组合相连,各组合因存在或不存在质量标记物集合中的各质量标记物和/或与探针相连的各质量标记物的数量而相区别。如上所述,这称为本发明的“混合模式”,因为探针可与质量标记物的混合物相连。
如上所述,本发明提供一种分析方法,该方法包括采用质谱法鉴定生物分子的独特质量标记物或质量标记物组合来检测生物分子,其中所述质量标记物是上述质量标记物集合或阵列的质量标记物。方法的类型不作具体限定,只要该方法从使用本发明质量标记物中获益从而能鉴定生物分子。该方法可以是,例如核酸测序方法或通过检测样品中的蛋白质含量来测定一种或多种基因表达分布的方法。该方法特别有利,因为采用该方法不难同时分析多种生物分子。然而,该方法还对单独分析一种生物分子有利,因为利用本发明质量标记物所产生的质谱图比常规图谱更清晰,从而使得该方法精确而灵敏。
在另一优选的实施方式中,本发明提供一种方法,该方法包括:
(a)使一种或多种生物分子与探针集合或探针阵列接触,该集合或阵列中的各探针对于至少一种生物分子具有特异性,其中这些探针如上所述;
(b)通过检测该生物分子的特异性探针来鉴定生物分子。
在该实施方式中,优选先将质量标记物从探针上切下,再通过质谱法检测质量标记物。
该具体方法的性质不作具体限定。然而,该方法优选包括使一种或多种核酸与杂交探针集合接触。杂交探针集合通常包含最多256种4-聚体的集合,该集合中各探针所具有核酸碱基的组合不同。该方法适用于鉴定是否存在靶核酸,或者可用于一种或多种核酸模板的引物延伸测序的分步方法。
本发明的质量标记物特别适用于两维分析方法,主要是因为可同时区分大量标记物。因此,这些标记物可用于两维凝胶电泳方法,或两维质谱方法。
质量改变的质量标记部分和质量标准化部分
如上所述,可在合成质量标记物期间掺入一个或多个同位素作为质量调整部分,从而能改变质量标记部分和质量标准化部分的质量。合适的同位素包括氘(2H)、13C、14C、15N、18O。图2和3显示了一组质量标记物。图2显示了一组两种质量标记物,二者具有相同的总质量,但各质量标记物所含的质量标记部分(TMT片段)的质量不同,因为该质量标记部分或质量标准化部分中含有同位素。图3显示了一组5种质量标记物,其中所有5种质量标记物的总质量相同,但各质量标记物具有质量彼此不同的质量标记部分,因为在质量标记部分和/或质量标准化部分中含有同位素。图22(用星号标记是碳13或氮15)显示了一组6种质量标记物,所有6种质量标记物的总质量相同,但各质量标记物具有质量彼此不同的质量标记部分,因为在质量标记部分和/或质量标准化部分中含有同位素。
含有同位素的本发明质量标记物的合成见实施例4和5。图14显示了3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-βAla-OSu)双体物质的逆合成反应方案。图15显示了3-[2-(2,6-二甲基-哌啶-1-基)-乙酰基氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(DMPip-βAla-OSu)双体物质的逆合成反应方案。
质量标记部分或质量标准化部分中质量改变的氨基酸
在一优选的实施方式中,当质量标记部分或质量标准化部分还含有一个或多个氨基酸时,可利用各种氨基酸。质量标准化部分中优选中性氨基酸。下表5显示了许多可市售购得的用同位素改变质量的氨基酸。本发明质量标记部分或质量标准化部分中可存在该清单的1种、2种、3种或4种或更多种氨基酸的任何组合。
表5
可获得利用许多上述氨基酸的D-型或L-型(例如,购自俄亥俄州迈阿密斯伯格的同位素技术公司(ISOTEC Inc.)),二者均可用于制备本发明质量标准化部分。如果要将本发明标签用于层析分离的话,还可获得D型和L型的混合物,但不推荐。对于一些(氨基酸),还可获得FMOC或t-BOC保护的衍生物。还可获得氘取代氢或13C和15N同位素取代12C和13N同位素的质量改变的氨基酸,这些氨基酸同样适用于合成本发明的质量标准化部分。通常在肽中未发现的各种氨基酸也可用于本发明的质量标准化部分,例如氨基丁酸的氘化形式可市售购得。为本发明的目的,出于安全原因优选无放射性的稳定同位素,但不一定限制于稳定的同位素。
还可获得许多氨基酸的氟化衍生物。下表6显示了一些可市售购得的氟化氨基酸。
表6
对于上述大多数氟化氨基酸,可获得D型和L型混合试剂。与同位素取代的变体相比,一般不推荐氨基酸的氟化变体。可利用氟化化合物产生质量相同但在化学上不同的一系列质量标记物,这表示它们在质谱仪中的特性比同位素取代的质量标记物变化更大。此外,这些质量标记物不具有相同的层析特性,如果要将它们用于层析分离的话。
亲和捕捉配体
在本发明的某些实施方式中,质量标记物含有亲和捕捉配体。亲和捕捉配体是具有高度特异性的结合伴侣的配体。这些结合伴侣使得用配体标记的分子能为结合伴侣所选择性地捕捉。优选用结合伴侣衍生固体支持物,因此可用固相支持物选择性捕捉亲和力配体标记的分子。优选的亲和捕捉配体是可通过本领域已知的标准方法引入本发明质量标记物的生物素。具体地说,可在质量标记部分或质量标准化部分后掺入赖氨酸残基,从而能将胺反应性生物素连接于质量标记物(参见例如,Geahlen R.L.等,Anal Biochem 202(1):68-67,“制备在羧基端生物素化的肽的通用方法”(A general method for preparation of peptides biotinylated at the carboxy terminus.),1992;Sawutz D.G.等,Peptides 12(5):1019-1012,“[Lys]缓激肽的生物素化类似物的合成和分子表征”(Synthesis and molecular characterization of a biotinylated analogue of[Lys]bradykinin.),1991;Natarajan S.等,Int J Pept Protein Res 40(6):567-567,“位点特异性生物素化,一种新方法及其对于内皮素-1类似物和PTH-类似物的应用”(Site-specific biotinylation.A novel approach and its application to endothelin-1analogues and PTH-analogue.),1992)。还可使用亚胺生物素(iminobiotin)。可使用生物素的各种亲和素反配体,包括单体和四聚体的亲和素及链霉亲和素,这些均可用于许多固体支持物上。
其它亲和捕捉配体包括洋地黄毒苷、荧光素、硝基苯基部分和许多肽表位,例如c-myc表位,其选择性单克隆抗体以反配体存在。还可利用金属离子结合配体,例如易于结合Ni2+离子的六组氨酸。例如,可市售购得提供亚氨基二乙酸螯合Ni2+离子的层析树脂。可利用这些固定化镍柱捕捉质量标记物。此外,亲和捕捉官能团可与适当衍生的固相支持物选择性反应。例如,已知硼酸能与邻位顺式二醇和化学上相似的配体,例如水杨基羟肟酸选择性反应。
质谱灵敏度增强基团和质量区分
在本发明的优选实施方式中,肽质量标签包含灵敏度增强基团。甲基化和胍化可用作增强灵敏度的方法。胍基和叔胺基均是电喷雾质谱法的有用灵敏度增强基团。
也已开发了衍生肽的各种其它方法。对于阳离子质谱法,这些方法包括利用季铵衍生物,季衍生物和吡啶衍生物。卤化化合物,特别是卤化芳香族化合物是熟知的生电团(electrophore),即它们易于获得热电子(thermal electron)。已开发了氟化芳香族化合物的各种衍生试剂(Bian N.等,Rapid Commun Mass Spectrom 11(16):1781-1784,“通过激光解吸和质谱法检测多重生电团标记的白蛋白”(Detection via laser desorption and mass spectrometry of multiplex electrophore-labelled albumin.),1997)用于电子捕捉检测,这是可与阴离子质谱法联用的高度灵敏的电离和检测方法(Abdel-Baky S.和Giese R.W.,Anal Chem63(24):2986-2989,“zeptomole水平的气相色谱/电子捕捉阴离子质谱法”(Gas chromatography/electron capture negative-ion mass spectrometry at the zeptomole level.)1991)。氟化芳族基团还可用作灵敏度增强基团。芳族磺酸也已用于增强阴离子质谱法的灵敏度。
各类灵敏度增强基团具有不同的优点,这取决于所用的电离方法和所用的质量分析方法。各类基团增强灵敏度的机制可能不同。一些衍生方法能增加碱性,从而促进质子化及电荷定位,而其它方法能增加作标记肽的表面活性,从而能增强表面解吸技术,例如衬质辅助激光解吸电离(MALDI)和快原子轰击(FAB)的灵敏度。阴离子质谱法常更灵敏,因为背景噪声较少。当采用碰撞诱导解离时,电荷衍生也可改变衍生肽的断裂产物。具体地说,一些衍生技术简化了断裂模式,这是非常有利的。所采用的质谱技术决定灵敏度增强基团的选择(综述见Roth等,Mass Spectrometry Reviews 17:255-274,“电荷衍生肽用于质谱法分析”(Charge derivatisation of peptides for analysis by mass spectrometry),1998)。为本发明的目的,所有已知的衍生技术可使用本发明肽质量标记物。可采用未作改进的公布方法在固相肽合成后衍生本发明肽质量标记物,或者如果需要,不难在固相肽合成期间应用这些方法。
通过质谱法分析肽
质谱法的基本特征如下所示:
输入系统(Inlet System)->离子源(Ion Source)->质量分析器(Mass Analyser)->离子检测器(Ion Detector)->数据捕捉系统(Data Capture System)
这些是分析肽的优选输入系统、离子源和质量分析器。
输入系统
在本发明的一些方面,优选层析或电泳分离先降低样品的复杂性,再通过质谱法分析。各种质谱技术与分离技术,特别是毛细管区带电泳和高效液相层析(HPLC)相容。如果电离技术,例如从固体表面使物质融化的MALDI和FAB(下述的)不适于层析分离,在某种程度上电离源的选择受限。对于大多数目的,采用这些技术之一在线连接层析分离与质谱分析连接非常昂贵。基于喷雾的动态FAB和电离技术,例如电喷雾、热喷雾和ACPI均不难与在线层析分离相容,而执行这种液相层析质谱分析的设备可以市售购得。
电离技术
许多生物质谱领域采用称为“软”电离的技术。这些技术能将大分子,例如蛋白质和核酸基本上完整地电离。这些液相技术能使生物学大分子以溶液形式进入质谱仪,所述溶液pH温和并且浓度低。许多技术适用于本发明,包括但不限于电喷雾电离质谱法(ESI-MS)、快原子轰击(FAB)、衬质辅助的激光解吸电离质谱法(MALDI MS)和大气压化学电离质谱法(APCI-MS)。
电喷雾电离
电喷雾电离需要分析物生物分子的稀溶液“雾化”进入质谱仪,即以细微的喷雾注射。例如,将溶液从带电针头的尖端喷入干燥氮气流和静电场中。电离的机制还未完全了解,但据信大概是如下所示作用。溶剂在氮气流中蒸发。小液滴导致分析物分子得到浓缩。由于大多数生物分子具有净电荷,这增强了溶解分子的静电斥力。随着蒸发的继续,该斥力最终变得大于液滴的表面张力,液滴崩解成较小的液滴。有时该过程称为“库仑爆炸”。静电场帮助进一步克服液滴的表面张力并协助喷雾过程。较小的液滴进一步蒸发进而反复爆炸直至生物分子基本上处于均是溶剂的气相。该技术对于使用质量标记物特别重要,因为与其它技术相比,该技术在电离过程中赋予离子较低的能量,并且群体中的能量分布处于较狭窄的范围内。利用适当放置的电极设置电场,进而利用电场使离子加速离开电离室。可改变电场的极性以吸引阴离子或阳离子。这些电极之间可能的差异决定了是阳离子还是阴离子进入质量分析器,还决定了这些离子进入质量分析器所携带的动力学能量。考虑到离子在质谱仪中断裂时,这极有意义。赋予离子群的能量越大,(离子)源中存在的分析物分子与浴气通过碰撞而发生断裂的可能性越大。通过调节加速电离室中离子所用的电场,可能控制离子断裂。优选将离子断裂用作除去标记的生物分子的标记物的手段。特别优选电喷雾电离,因为其可与液相层析一起使用,称为液相色谱-质谱(LC-MS)。
衬质辅助的激光解吸电离(MALDI)
MALDI需要将生物分子溶液包埋在摩尔过量的光可激发“衬质”中。应用频率合适的激光激发了衬质,进而导致衬质快连同其捕捉的生物分子一起速蒸发。质子从酸性衬质转移至生物分子产生了质子化形式的生物分子,其可用阳离子质谱法,特别是飞行时间(TOF)质谱法检测。MALDI TOF还可能实施阴离子质谱法。该技术赋予离子显著量的平动能(translational energy),尽管如此,但不易诱导过分断裂。然而采用此技术可再次使用加速电压来控制断裂。
快原子轰击
快原子轰击(FAB)描述了使相对不挥发分子蒸发和电离的许多技术。在这些技术中,样品通过与氙原子或铯离子的高能量束碰撞而从表面解吸。将样品涂布到简单的衬质表面,通常是不挥发的物质,例如间硝基苄醇(NBA)或甘油。FAB技术还与液相输入系统相容-从毛细管电泳入口或高压液相层析系统洗脱的液体流过玻璃料,分析物溶液基本上涂满了玻璃料表面,通过原子轰击使分析物溶液从玻璃料表面电离。
质量分析器
本发明采用通过碰撞诱导解离来使肽断裂,从而能鉴定蛋白质上的标记物。可将各种几何构造的质量分析器应用于片段肽并测定这些片段的质量。
肽的MS/MS和MSn分析
串联质谱仪能选择具有预定质荷比的离子并通过碰撞诱导解离(CID)使之断裂。然后可以检测这些片段来提供有关所选择离子的结构信息。当用串联质谱仪通过CID分析肽时,观察到特征性切割模式,从而能测定肽的序列。天然肽通常在肽主链的酰胺键处随机断裂,从而产生该肽的特征性离子。对于在第n个肽键处的切割,离子的电荷保留在其N-末端片段上的CID片段系列称为an、bn、cn等。类似地,电荷保留在离子的C-末端片段上的片段系列称为xn、yn、zn等。
胰蛋白酶和凝血酶是串联质谱法的优选切割试剂,因为它们可产生在分子的两末端含有碱性基团的肽,即在N-末端具有α-氨基,在C-末端具有赖氨酸或精氨酸侧链。这有利于形成双电荷离子,其中荷电中心位于该分子的相对末端。这些双电荷离子在CID后产生了C-末端和N-末端离子系列。这有助于测定肽的序列。一般而言,某给定肽的CID图谱中只能观察到一种或两种可能的离子系列。在四极仪器的典型低能量碰撞中,主要是N-末端片段的b-系列或C-末端片段的y-系列。如果分析了双电荷离子,随后通常检测两种系列。y-系列离子一般比b-系列占优势。
肽片段所经历的机制涉及酰胺主链质子化和随后的分子内亲核攻击,通常形成5-元唑酮结构并切割质子化的酰胺键(Schlosser A.和Lehmann W.D.J.Mass Spectrom.35:1382-1390,“在肽的单分子反应中形成5元环:控制低能量碰撞诱导解离的关键结构元件”(Five-membered ring formation in unimolecular reactions of peptides:a key structural element controlling low-energy collision induced dissociation),2000)。图16a显示了所提出的一种该类断裂的发生机制。该机制需要毗邻N-末端侧的质子化酰胺的酰胺键的羰基实施亲核攻击。如图16a所示,荷电的唑酮离子产生了b-系列离子,而质子从N-末端片段向C-末端片段转移产生了y-系列离子。需要适当定位的羰基不能解释N-末端未保护时在毗邻N-末端氨基酸的酰胺键处的切割及通常观察不到肽中N-末端和第二氨基酸之间酰胺键的b-系列离子。然而,含有乙酰化N-末端的肽确实符合该机制的结构要求,经由该机制可在紧接第一氨基酸后的酰胺键处发生断裂。如图16c所示,通过唑酮机制含有硫代乙酰化N-末端的肽特别容易切割,因为硫原子比同一位置的氧原子更具亲核性。还可通过主链甲基化调节肽酰胺主链的断裂。肽中酰胺氮的甲基化可促进该甲基化酰胺C-末端的下一酰胺键断裂,还促进形成b-离子。如图16b所示,断裂增强可能部分因为甲基化酰胺的供电子作用,而b-离子形成增加可能是所形成的唑酮离子不能将质子转移至C-末端片段所致。在本发明中,可采用标记物二肽的N-末端的硫代乙酰化增强该标记物肽在下一酰胺键处的切割。类似地,N-末端乙酰基或硫代乙酰基的氮原子的甲基化还增强了毗邻酰胺键的切割。
多肽或肽酰胺主链断裂的容易程度也明显受到肽的侧链官能团的调节。因此,肽的序列确定了其最易于断裂之处。通常难于预测肽序列中酰胺键易于断裂之处。这对于设计本发明的肽质量标记物有至关重要的作用。然而,已作出的某些观察结果能设计在所需酰胺键处断裂的肽质量标记物。例如,已知脯氨酸能促进在其N-末端酰胺键处断裂(Schwartz B.L.,Bursey M.M.,Biol.Mass Spectrom.21:92,1997),因为在C-末端酰胺(键)处断裂会产生能量上不利的应变双环唑酮结构。天冬氨酸也能促进在其N-末端酰胺键处断裂。然而,Asp-Pro连接键在低能量CID分析中特别不稳定(Wysocki V.H.等,J Mass Spectrom.35(12):1399-1406,“流动和固定的质子:理解肽解离的框架”(Mobile and localized protons:a framework for understanding peptide dissociation.),2000),在这种情况中,天冬氨酸看来能促进其C-末端侧的酰胺键切割。因此,脯氨酸和asp-pro连接键还能用于本发明标记物肽以促进肽内特定位置的断裂。
典型的串联质谱仪几何构造是三重四极(triple quadrupole),包括由碰撞室(也是四极)隔开的两台四极质量分析器。该碰撞四极(collision quadrupole)在两台质量分析器四极之间起着离子引导的作用。可将气体引入碰撞四极与第一质量分析器的离子流碰撞。第一质量分析器根据离子的质荷比进行选择,这些离子通过使其片段化的碰撞室。这些离子片段在第三重四极中分离和检测。可采用除三重四极以外的构造进行诱导切割。离子阱质谱仪通过将气体引入本身会与所捕捉离子碰撞的收集器而促进片段化。离子阱通常含有浴气,例如氦,但加入例如氖可促进片段化。类似地,可将光子诱导片段化应用于捕捉的离子。另一有利的构造是四极/正交飞行时间串联仪器(Quadrupole/Orthogonal Time of Flight tandem instrument),该构造结合了四极的高扫描率与反射TOF质量飞行器的较高灵敏度从而能鉴定片段化产物。
常规“扇形”仪器是串联质谱法中另一种常用的构造。扇形质量分析器包含两个分开的“扇形片”,其是一种电扇形片(electric sector),其利用电场将离开(离子)源的离子束聚焦成具有相同动力学能量的离子流。磁性扇形片根据离子的质量将它们分开,从而在检测器处产生了图谱。对于串联质谱法,可利用两个该类型的扇形质量分析器,其中电扇形片提供第一质量分析器平台,磁性扇形片提供第二质量分析器,而碰撞室安置在两个扇形片之间。由碰撞室隔开的两个完全扇形质量分析器还可用于分析质量标记的肽。
离子阱
离子阱质量分析器涉及四极质量分析器。离子阱通常具有3电极构造-各端的圆柱形电极与“帽”电极形成一空腔。将正弦射频电压施加于该圆柱形电极,而用DC或AC电压使帽电极偏置。利用该圆柱形电极的振荡电场强制注射入该空腔的离子采取稳定的环形轨迹。然而,对于该振荡电压的某给定振幅,某些离子具有不稳定的轨迹,会从离子阱中射出。通过改变振荡射频电压,可将注射入离子阱的样品离子根据它们的质荷比依次从离子阱中射出。然后可检测射出的离子从而产生质谱。
通常在离子阱空腔中有少量“浴气”,例如氦存在下操作该离子阱。这提高了该装置的分辨率和灵敏度,因为通过与浴气碰撞,进入离子阱的离子基本上冷却至浴气的环境温度。碰撞既提高了样品引入离子阱时的电离程度,又使离子轨迹的振幅和速度衰减,从而能使它们维持于接近该离子阱的中心。这表示当振荡电压改变时,与衰减的循环离子相比,轨迹变得不稳定的离子能更快获得能量并以更紧的束状离开离子阱,从而获得更狭窄但更大的峰。
离子阱能模拟串联质谱仪几何构造,事实上它们能模拟多个质谱仪几何构造,从而能对所捕获离子进行复杂分析。样品的一种质量物质可以保留在离子阱中,即可将所有其它物质射出,然后通过在第一振荡频率上叠加第二振荡频率来小心激发保留的物质。随后,激发的离子与浴气碰撞,如果激发充分的话其会片段化。然后可进一步分析这些片段。通过射出其它离子,之后激发片段化的离子使之片段化,从而能保留片段离子用于进一步分析。可重复该过程,只要足够的样品离开,从而能作进一步分析。应该注意,这些仪器在诱导片段化后通常保留高比例的片段离子。这些仪器和FTICR质谱仪(下述)代表了时间分辨串联质谱法(temporally resolved tandem mass spectrometry)的形式,而不是线性质谱仪(linear mass spectrometer)中所见的空间分辨串联质谱法(spatially resolved tandem mass spectrometry)的形式。
傅立叶转换离子回旋共振质谱法(FTICR MS)
FTICR质谱法与离子阱的相似特征在于离子样品保留在一空腔中,但FTICR MS中,通过交叉的电磁场将离子捕获在高真空室中。通过构成某盒子两侧的一对平板电极产生电场。该盒子位于超导磁体的(磁)场中,该超导磁体与两块平板(捕获平板)相连,强制注射的离子在两块捕获平板之间采取垂直于所施加磁场的循环轨迹。通过给构成该盒子相对另两侧的两块“传递平板”施加射频脉冲来激发这些离子的更大轨迹。这些离子的摆线运动在构成“接收平板”的该盒子其余相对两侧中产生了电场。激发脉冲激发了离子的更大轨迹,这些轨迹随离子通过碰撞丧失相干运动而衰减。通过傅立叶转换(FT)分析将接收平板检测到的相应信号转变成质谱。
这些仪器能以类似于离子阱的方式实施诱导片段化实验,即能将除感兴趣的一种以外的所有离子从离子阱中射出。可将碰撞气体引入离子阱中并诱导片段化。随后可分析片段离子。如果采用FT分析来分析“接收平板”检测到的信号,联用片段化产物和浴气获得的分辨率通常不佳,然而,可将片段离子从空腔中射出,并以例如具有四极的串联配置分析。
通过层析或电泳分离标记的肽
在本发明第四方面的任选第二步骤中,标记的生物分子先进行层析分离再通过质谱法分析。优选能与质谱仪直接耦合的高效液相层析(HPLC),从而能随着肽从层析柱上洗脱而在线分析它们。采用HPLC可进行各种分离技术,但反相层析是先分离肽再进行质谱法的常用方法。毛细管区带电泳是可与质谱仪直接耦合从而能自动分析洗脱的样品的另一分离方法。可先应用这些和其它分级技术来降低生物分子混合物的复杂程度,再通过质谱法分析。还可联用分离技术,包括正交分离。
本发明的应用
标记肽和多肽并通过LC-MS-MS分析
在本发明的优选实施方式中,利用质量标记物通过液相色谱串联质谱法(LC-MS-MS)分析肽的混合物。下文将在肽分析的范围内讨论本发明质量标记物在这些方面的应用。可利用反应性质量标记物,例如图1a-e所示的那些来标记肽。
与质量标记物相连后,标记的肽的质量将偏移该标记物的质量。肽的质量可能足以辨认源蛋白(source protein)。在该情况中,只需检测质量标记物,这可通过下文详述的以三重四极进行选择反应监测来实现。简言之,所述三重四极的第一重四极设置为允许质荷比对应于感兴趣肽的离子通过,根据质量标记部分的质量而调整。然后在第二重四极中选择的离子进行碰撞诱导解离(CID)。在肽分析所用的分选条件下,这些离子大多在分子的酰胺键处片段化。虽然质量标记物均具有相同的质量,但末端部分因取代基有差异而不相同。因此质量标记部分可以彼此区分。存在与特定质量的离子相结合的标记片段证明该离子是肽,不同样品的标签的相对峰高提供了该肽在其样品中相对含量的有关信息。如果该质量不足以鉴定肽,因为样品中的许多末端肽具有相同的末端质量或因为肽是未知的,则可采用完全CID图谱分析来测定序列信息。可利用肽片段化峰来鉴定肽,而质量标记物峰提供了这些肽的相对含量的有关信息。
所得图谱的“噪声”会使通过串联质谱法分析蛋白质,特别是肽的混合物变复杂。从生物样品中分离肽常受到缓冲剂、变性剂和洗涤剂的污染,所有这些会在质谱中引入峰。结果,图谱中的污染峰常多于肽峰,鉴定对应于各肽的峰成为主要问题,特别是难于分离的蛋白质小样品。因此,先采用各种方法来测定哪个峰对应于肽,再进行详细的CID分析。三重四极仪器能进行“前体离子扫描”(参见Wilm M.等,Anal Chem 68(3):527-33,“未分离的肽混合物的母离子扫描”(Parent ion scans of unseparated peptide mixtures.)(1996))。三重四极以“单反应监测”模式操作,其中第一重四极扫描整个质量范围,各分选离子在第二重四极中进行CID(分析)。第三重四极设定为只检测一种特定的片段离子,其常是肽的特征性片段离子,例如亚铵(immonium)离子。采用该分选技术还能检测是否存在磷酸基团。四极/飞行时间质谱仪所用的另一种方法通过鉴定进行CID时会产生质荷比高于母离子的子离子的离子来扫描双荷电离子。鉴定双荷电离子的另一方法是在图谱中寻找相应强度比例只间隔0.5道尔顿的多组峰,这些峰表明这些离子是相同的,其差别只在于分子中存在的13C比例。
通过利用本发明的质量标记物标记肽,可以设想一种新的前体离子扫描形式,在对标记肽进行CID后通过是否存在对应于本发明质量标记物的片段来鉴定肽峰。具体地说,可用多种质量标记物标记通过本发明方法从各样品分离的肽。用于所有样品的“前体离子扫描”质量标记物和样品特异性质量标记物的等摩尔混合物可用于标记各样品中的肽。以此方法,不同样品中肽水平的变化不会对鉴定前体离子扫描中的肽峰产生不利作用。
鉴定和选择了肽离子后,对其进行CID。CID图谱常很复杂,确定CID图谱中哪些峰对应于有意义的肽片段系列是通过质谱法测定肽序列的另一问题。Shevchenko等(Rapid Commun.Mass Spec.11:1015-1024(1997))描述了涉及用1:1 16O/18O水配制的胰蛋白酶处理所分析蛋白质的另一种方法。水解反应获得两类肽,第一类的末端羧基含有16O,第二类的末端羧基含有18O。因此,样品中的各肽应有强度相同的双峰,其中所述双峰间隔2道尔顿。固有的肽同位素峰稍微变得复杂一些,但能自动扫描CID图谱的双峰。可以测定双峰之间质量的差异来鉴定两个片段相差的氨基酸。如果N-末端肽得到分离,该方法可适用于本发明方法。
蛋白质表达分布情况
为了解癌组织的变化,例如,需要了解该组织中所有的分子变化,最好将这些变化与正常组织相联系。为测定所有的分子变化,需要能检测基因表达、蛋白质表达和最终代谢中的变化。采用微阵列技术可以在信使RNA水平(mRNA)同时比较大量基因在不同组织样品之间的表达(参见,例如Iyer V.R.等,Science 283(5398):83-87,“人成纤维细胞对血清起反应中的转录程序”(The transcriptional program in the response of human fibroblasts to serum.)1999),然而mRNA水平与组织中的蛋白质水平不直接相关。为测定组织的蛋白质表达分布,广泛使用2-维凝胶电泳。不幸的是,该技术极其费力,并且难以在2D凝胶上同时比较两份或多份样品,因为难以实现再现性。如上所述,可以采用本发明方法有效分析肽。本发明的质量标记物使得可以采用LC-MS-MS鉴定不同样品的相同肽。此外,可以测定不同样品中相同肽的相对含量。能快速且灵敏地测定许多样品中肽的身份和相对含量就能(测定)表达分布。因此,本发明的目标是提供根据肽的选择性分离和标记来比较性分析复杂蛋白质样品的改进方法。讨论了两种公布的整体分析蛋白质表达的方法,下文还描述了分析特定蛋白质状态,例如磷酸化和碳水化合物修饰的各种方法。
用于整体蛋白质表达分布测定的末端肽分离
已将分离N-或C-末端肽描述为测定蛋白质样品整体表达分布的方法。分离末端肽确保每个蛋白质至少有一个而且只有一个肽得到分离,因此确保了所分析样品的复杂程度不会具有比原始样品多的组分。将大的多肽缩小为较短肽使得样品更易通过质谱法分析。从多肽的末端分离肽的方法见PCT/GB98/00201、PCT/GB99/03258。
分离碳水化合物修饰的蛋白质
碳水化合物常以蛋白质的翻译后修饰物存在。已知分离这些种类的蛋白质的各种亲和层析技术(其综述可参见Gerard C.,Methods Enzymol.182:529-539,“糖蛋白的纯化”(Purification of glycoproteins.)1990)。已知碳水化合物的各种天然蛋白质受体。称为凝集素的该类受体成员对于特定碳水化合物官能团具有高度选择性。用特定凝集素衍生的亲和柱可用于分离具有特定碳水化合物修饰的蛋白质,而含有各种不同凝集素的亲和柱可用于分离具有各种不同碳水化合物修饰的蛋白质群。在本发明的一个实施方式中,分析蛋白质样品(含有碳水化合物修饰的蛋白质)的方法包括以下步骤:
1.用序列特异性切割试剂,例如胰蛋白酶或Lys-C处理样品;
2.使蛋白质样品流过含有凝集素或硼酸衍生物的亲和柱从而只分离碳水化合物修饰的肽;
3.利用本发明质量标记物在通过序列特异性切割产生的游离α氨基处对捕获的糖修饰肽作标记;和
4.通过LC-MS-MS分析标记的肽。
可利用N-羟基琥珀酰亚胺活化的质量标记物标记游离的α-氨基。如果使用Lys-C,则随后各碳水化合物修饰的肽会具有游离的ε氨基以及游离的α氨基,二者均可作标记。
许多碳水化合物具有邻位二醇基团,即在毗邻的碳原子上存在羟基。含有1,2-顺-二醇构型的邻位二醇的碳水化合物与硼酸衍生物反应形成环状酯。碱性pH有利于该反应,但在酸性pH易于逆转。树脂固定的苯基硼酸衍生物已用作亲和配体来捕捉具有含顺式二醇的碳水化合物的蛋白质。在本发明第六方面的一个实施方式中,合成了一组亲和配体肽质量标记物,其含有与苯基硼酸实体相连的生物素。这些硼酸标签可用于标记包含具有碳水化合物修饰的肽或蛋白质的两种不同样品,所述碳水化合物修饰含有邻位顺式二醇。在本发明的另一实施方式中,分析含有碳水化合物修饰多肽的蛋白质样品的方案包括以下步骤:
1.在碱性pH下使至少一种蛋白质样品与硼酸亲和配体质量标记物反应,
2.用序列特异性内切蛋白酶切割多肽,
3.用亲和素衍生的固体支持物捕捉标记的肽;和
4.通过LC-MS-MS分析所捕捉的标记肽。
可在样品与亲和配体质量标记物反应前或后用序列特异性内切蛋白酶消化样品。
例如,还可通过高碘酸盐的氧化切割将唾液酸中的邻位-二醇转化成羰基。用半乳糖氧化酶酶促氧化含有末端半乳糖或半乳糖胺的糖也能将这些糖中的羟基转化成羰基。还可用碳水化合物切割酶,例如神经氨酸酶(neuramidase)处理复杂的碳水化合物,其特异性除去特定的糖修饰物而留下可以氧化的糖。可以标记这些羰基,从而能检测或分离携带这种的修饰物的蛋白质。酰肼试剂,例如生物胞素酰肼(Biocytin hydrazide)(P&W有限公司(Pierce&Warriner Ltd),切斯特,英国)可与含羰基的碳水化合物中的羰基反应(E.A.Bayer等,Anal.Biochem.170:271–281,“生物胞素酰肼–采用亲和素生物素技术的糖缀合物中的唾液酸、半乳糖和其它糖的选择性标记物”(Biocytin hydrazide–a selective label for sialic acids,galactose,and other sugars in glycoconjugates using avidin biotin technology),1988)。或者,可采用还原性烷化(Means G.E.,Methods Enzymol 47:469-478,“氨基的还原性烷化”(Reductive alkylation of amino groups.)1977;Rayment I.,Methods Enzymol 276:171-179,“还原性烷化赖氨酸残基以改变蛋白质的结晶特性”(Reductive alkylation of lysine residues to alter crystallization properties of proteins.)1997)用修饰的生物素,例如生物胞素和EZ-LinkTMPEO-生物素(EZ-LinkTMPEO-Biotin)(P&W有限公司,切斯特,英国)标记羰基。因此可以生物素化复杂混合物中携带碳水化合物修饰物的蛋白质,所述碳水化合物修饰物含有邻位二醇。然后可利用亲和素化的固体支持物分离生物素化(由是碳水化合物修饰的)的蛋白质。
可合成一组本发明的肽质量标记物来分析用高碘酸盐氧化的碳水化合物修饰肽。
本发明的进一步实施方式包括以下步骤:
1.用高碘酸盐处理多肽样品,从而使得糖肽上具有邻位顺式二醇的碳水化合物获得羰基官能团;
2.用与生物素相连的酰肼活化质量标记物标记该羰基官能团;
3.用序列特异性蛋白酶消化蛋白质样品;
4.用亲和衍生的固体支持物捕捉标记的肽;和
5.通过LC-MS-MS分析生物素化的肽。
可在样品与亲和配体质量标记物反应前或后用序列特异性内切酶消化蛋白质样品。
分离磷酸肽
磷酸化是在几乎所有生物体的大多数信号传导途径中出现的普遍存在可逆翻译后修饰,因为磷酸化广泛用作瞬时信号来介导各蛋白质状态的变化。能分析磷酸化的动力学对于完全了解细胞如何对刺激起反应,包括细胞对药物的反应是至关重要的研究领域和工具。
熟知分析含有磷酸丝氨酸和磷酸苏氨酸的肽的技术。一类这种方法根据磷酸β消除的熟知反应。该反应导致磷酸丝氨酸和磷酸苏氨酸形成脱氢丙氨酸和甲基脱氢丙氨酸,二者是米氏受体(Michael acceptor)并能与二醇反应。该反应已用于引入疏水性基团以进行亲和层析(参见,例如Holmes C.F.,FEBS Lett215(1):21-24,“选择性分离含磷酸丝氨酸的肽的新方法”(A new method for the selective isolation of phosphoserine-containing peptides.)1987)。还可用二醇接头将荧光素和生物素引入含有磷酸丝氨酸和磷酸苏氨酸的肽中(Fadden P,Haystead TA,Anal Biochem 225(1):81-8,“肽和蛋白质上磷酸丝氨酸的定量和选择性荧光团标记:通过毛细管电泳和激光诱导的荧光在阿托摩尔水平表征”(Quantitative and selective fluorophore labelling of phosphoserine on peptides and proteins:characterization at the attomole level by capillary electrophoresis and laser-induced fluorescence.)1995;Yoshida O.等,Nature Biotech 19:379–382,“磷酸化蛋白质的富集分析作为检测磷酸蛋白质组的工具”(Enrichment analysis of phosphorylated proteins as a tool for probing the phosphoproteome),2001)。对于亲和富集在丝氨酸和苏氨酸处磷酸化的蛋白质,可利用如图8所示马来酰亚胺标签改进Yoshida等的方法,从而能比较多份样品。这对于分析磷酸化级联反应的动力学特别有用。
许多研究组报道制备了能与各种蛋白质中磷酸酪氨酸残基结合的抗体。(参见,例如A.R.Frackelton等,Methods Enzymol 201:79-92,“制备抗磷酸酪氨酸的单克隆抗体以及它们对于亲和纯化含磷酸酪氨酸的蛋白质的应用”(Generation of monoclonal antibodies against phosphotyrosine and their use for affinity purification of phosphotyrosine-containing proteins.),1991和该出版物Methods Enzymol中的其它文章)。这表示利用这些抗体作为亲和柱配体通过亲和层析能分离采用酪氨酸磷酸化进行翻译后修饰的显著比例蛋白质。
本发明可利用这些磷酸化结合抗体从含有磷酸化酪氨酸残基的蛋白质中分离肽。可以利用抗-磷酸酪氨酸抗体亲和柱分离复杂混合物中酪氨酸被磷酸化的蛋白质。在本发明的另一实施方式中,包含酪氨酸被磷酸化的蛋白质样品的分析方案包括以下步骤:
1.用序列特异性切割试剂,例如胰蛋白酶或Lys-C处理样品;
2.使蛋白质样品流过含有抗磷酸酪氨酸抗体的亲和柱从而只分离磷酸酪氨酸被修饰的肽;
3.利用本发明质量标记物在通过序列特异性切割产生的游离α氨基处对捕获的磷酸肽作标记;和
4.通过LC-MS-MS分析标记的肽。
可利用N-羟基琥珀酰亚胺活化的标签标记游离的α-氨基。
固定化金属亲和层析(IMAC)代表了分离磷酸蛋白质和磷酸肽的其它技术。磷酸附着于包含三价金属离子,特别是镓(III)离子的树脂(Posewitch,M.C.和Tempst,P.,Anal.Chem.,71:2883-2892,“磷酸肽的固定化镓(III)亲和层析”(Immobilized Gallium(III)Affinity Chromatography of Phosphopeptides),1999)。优选该技术,因为该技术能同时分离丝氨酸/苏氨酸磷酸化的和酪氨酸磷酸化的肽和蛋白质。
因此,IMAC还可用于本发明来分析磷酸化蛋白质样品。在本发明的进一步实施方式中,包含磷酸化蛋白质的蛋白质样品的分析方法包括以下步骤:
1.用序列特异性切割试剂,例如胰蛋白酶或Lys-C处理样品;
2.使蛋白质样品流过包含固定化金属离子的亲和柱从而只分离磷酸化的肽;
3.利用本发明质量标记物在通过序列特异性切割产生的游离α氨基处对捕获的磷酸肽作标记;和
4.通过LC-MS-MS分析标记的肽。
可利用N-羟基琥珀酰亚胺活化的标记物标记游离的α-氨基。
在本发明的另一实施方式中,可通过分离磷酸化蛋白质,然后分析该磷酸蛋白的N或C末端肽来分析磷酸化蛋白质样品。许多专利申请,例如WO98/32876、WO 00/20870和EP 01304975.4披露了分离末端肽的技术。含有磷酸化蛋白质的蛋白质样品的分析方法包括以下步骤:
1.使蛋白质样品流过包含固定化金属离子的亲和柱从而只分离磷酸化的蛋白质;
2.分离所捕获磷酸化蛋白质的C和/或N末端肽;
3.利用本发明质量标记物标记所捕获的末端肽;和
4.通过LC-MS-MS分析标记的肽。
参考以下具体实施方式,下文将仅借助实施例进一步详细描述本发明。
实施例
实施例1-7描述了本发明优选质量标记物的合成。除了以下这些,所有试剂购自西格玛-阿尔德里奇公司(西格玛-阿尔德里奇化学品股份有限公司(Sigma-Aldrich Chemie GmbH),埃琛斯特拉斯(Eschenstrasse)5,82024塔夫克里琛(Taufkirchen),德国)。
同位素试剂溴-2-13C-乙酸和3-15N-氨基丙酸购自坎普罗科学公司(Campro Scientific)(坎普罗科学股份有限公司(Campro Scientific GmbH),10414柏林,德国)。产品3-氨基丙酸苄酯、2-氨基丙酸和氨基乙酸购自默克生物科学公司(Merck Biosciences)(默克生物科学股份有限公司(Merck Biosciences GmbH),65824斯瓦尔巴哈(Schwalbach),德国)。
安伯来特(Amberlite)XAD-16是用于纯化的非离子型聚合吸附剂。弗洛里西(Florisil)是用于层析的合成活化硅酸镁凝胶。
采用标准方法活化相应的羧酸以得到N-羟基琥珀酰亚胺酯来合成串联质量标签。试剂(吡啶-2-基硫烷基)-乙酸(a)、溴乙酸(c)、3-氨基丙酸(e)、6-氨基己酸(d)和2,6-二甲基哌啶(b)可商品化购得。
用字母标记不同合成方法中描述的可商品化购得的化合物。
实施例1–合成6-[(嘧啶-2-基硫烷基)-乙酰氨基]-己酸-(2,5-二氧代-吡咯烷-1-基)-酯(3)
三步合成6-[(嘧啶-2-基硫烷基)-乙酰氨基]-己酸-(2,5-二氧代-吡咯烷-1-基)-酯(3)。
1.合成(嘧啶-2-基硫烷基)-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯(1)
0℃将2.30g(20mMol)N-羟基琥珀酰亚胺和4.50g(22mMol)N,N'-二环己基碳二亚胺加入溶解于50ml DMF中的3.40g(20mMol)(嘧啶-2-基硫烷基)-乙酸溶液。室温下搅拌反应混合物16小时。过滤残留物,真空蒸发黑色的滤液至干。将剩余产物在回流下溶解于100ml乙酸乙酯中,过滤热溶液并蒸发。将残留物溶解于CH2Cl2中后,用NaHCO3洗涤溶液,硫酸钠干燥并用活性炭纯化。溶液过滤后,蒸发溶剂。然后用乙酸乙酯重结晶该化合物。
产量:1.7g(26%)
保留系数(RF)=0.26(乙酸乙酯/甲醇5:1)
1H-NMR(d6-DMSO)δ2.80(s,4H,O-Su),4.41(s,2H,S-CH2),7.28(t,1H,pyr5-CH),8.65(d,2H,pyr4,6-CH)
2.合成6-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-己酸2
将1g(3.74mMol)(嘧啶-2-硫烷基)-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯溶解于50ml DMF中。向溶液中加入0.5g(3.75mM)6-氨基己酸和1.05ml(7.5mMol)三乙胺后,将反应混合物搅拌过夜。除去溶剂后,将产物溶解于50ml水中,用2N NaOH将溶液调节至pH 9.5。然后用CH2Cl2洗涤水溶液5次,并用2N HCl将溶液的碱度调节至pH 8。随后用活性炭处理该混合物,过滤并用2N HCl将滤液的pH调节至pH 2,再蒸发溶液。用少量冷水处理残留物使之糊化。过滤该糊剂并用水和丙酮洗涤。
产量:0.17g(16%)
RF=0.40(丙酮/甲醇/水/二氯甲烷/乙酸乙酯/乙酸9:2:2:6:2:1)
1H-NMR(d6-DMSO)δ1.20-1.45(m,6H,CH2),2.18(t,2H,CH2-CO),3.06(m,2H,N-CH2),3.81(s,2H,S-CH2),7.22(t,1H,pyr5-CH),8.10(s,1H,NH),8.64(d,2H,pyr4,6-CH)
3.合成6-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-己酸-(2,5-二氧代-吡咯烷-1-基)-酯3
将0.17g(0.6mMol)6-[2-(嘧啶-2-基硫烷基-乙酰氨基)-己酸2加入5ml二氯甲烷配制的69mg(0.6mMol)N-羟基琥珀酰亚胺和124mg(0.6mMol)N,N'-二环己基碳二亚胺中。室温下搅拌反应混合物16小时。过滤溶液,真空蒸发滤液至干。将残留物溶解于25ml二氯甲烷中后,利用乙酸乙酯层析(弗洛里西)纯化产物。然后用二异丙醚重结晶该化合物。
产量:0.19g(82%)
RF=0.23(乙酸乙酯)
Mp:103-105℃
1H-NMR(d6-DMSO)δ1.20-1.45(m,6H,CH2),2.66(t,2H,CH2-CO),2.83(s,4H,O-Su),3.06(m,2H,N-CH2),3.86(s,2H,S-CH2),7.22(t,1H,pyr5-CH),8.08(s,1H,NH),8.61(d,2H,pyr4,6-CH)
实施例2–合成3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(8).
五步合成3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(8)。
1.合成(2,6-二甲基-哌啶-1-基)-乙酸-叔丁酯(4)
回流下使15.1ml(102mMol)溴乙酸-叔丁酯(c)和30ml(234mMol)2,6-二甲基-哌啶(b)在150ml THF中搅拌5小时。除去溶剂后,将产物溶解于水中,用2N NaOH将溶液的pH调节至pH 11.5。用乙酸乙酯萃取该异质反应混合物,用水洗涤,硫酸钠干燥。蒸发溶剂后,用二异丙醚将残留物从硅胶柱上洗脱。
产量:23g(>99%)
RF=0.58(二异丙醚)
1H-NMR(CDCl3)δ1.09(d,6H,N-C-CH3),1.16-1.67(m,6H,pip3,4,5-CH2);1.43(s,9H,tert-Bu);2.81(m,2H,N-CH);3.45(s,2H,N-CH2)
2.合成(2,6-二甲基-哌啶-1-基)-乙酸盐酸盐(5)
60℃将23g(0.1Mol)(2,6-二甲基-哌啶-1-基)-乙酸-叔丁酯(4)与25ml(300mMol)12N HCl在100ml水中搅拌2小时。真空蒸馏水和剩余的HCl,用甲苯恒沸干燥残留物。
产量:21.03g(>99%)
RF=0.18(CH2Cl2/CH3OH=5:1)
1H-NMR(d6-DMSO)δ1.1-1.38(m,6H,N-C-CH3);1.4-1.9(m,6H,pip3,4,5-CH2);3.35-3.65(m,2H,N-CH);4.05(s,2H,N-CH2);9.05(br.s,1H,N-H);10.85(s,1H,COOH)
3.合成(2,6-二甲基-哌啶-1-基)-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯(6)
将100ml DMF配制的12.60g(60mMol)(2,6-二甲基-哌啶-1-基)-乙酸盐酸盐(5)加入7.02g(60mMol)N-羟基琥珀酰亚胺和12.58g(60mMol)N,N'-二环己基碳二亚胺中。室温下搅拌该反应混合物16小时。过滤残留物并真空蒸发滤液至干。将残留物溶解于300ml CH2Cl2中后,用NaHCO3洗涤该溶液,硫酸钠干燥,蒸发溶剂。然后用二异丙醚(活性炭)重结晶该化合物。
产量:12.61g(77%)
Mp 73℃
1H-NMR(CDCl3)δ1.14(d,6H,N-C-CH3),1.18-1,7(m,6H,pip3,4,5-CH2);2.75-2.85(m,2H,N-CH);2.82(s,4H,O-Su);3.9(s,2H,N-CH2)
4.合成3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸(7)
将50ml DMF配制的2.68g(10mMol)(2,6-二甲基-哌啶-1-基)-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯(6)加入0.9g(10mMol)3-氨基丙酸和2.02g(20mMol)三乙胺中。室温下搅拌该反应混合物16小时。蒸发溶液,将残留物溶解于水中,用2N HCl将溶液的pH调节至pH 3。用XAD-16纯化该异质反应混合物。蒸发溶剂后,用水分离器以甲苯干燥残留物。
产量:4.98g(>99%)
RF=起点(甲醇/二氯甲烷1:1)
1H-NMR(CDCl3)δ1.14(d,6H,N-C-CH3),1.18-1,7(m,6H,pip3,4,5-CH2);2.18(t,2H,CH2-CO);2.75-2.85(m,2H,N-CH);3.90(s,2H,N-CH2)
5.合成3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(8)
将50ml DMF配制的4.98g(10mMol)3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸(7)加入1.15g(60mMol)N-羟基琥珀酰亚胺和4.12g(60mMol)N,N'-二环己基碳二亚胺中。室温下搅拌该反应混合物16小时。用100ml CH2Cl2稀释该混合物后,过滤溶液,真空蒸发滤液至干。将残留物溶解于30ml乙酸乙酯中后,洗涤溶液,过滤并蒸发溶剂。利用乙酸乙酯通过层析(弗洛里西,27mm×320mm)纯化产物。
产量:3g(88%)
RF=0.3(乙酸乙酯)
1H-NMR(CDCl3)δ0.98(d,6H,N-C-CH3),1.15-1.63(m,6H,pip3,4,5-CH2);2.42(br.s,2H,CH2-CO);2.85(m,2H,N-CH);2.81(s,4H,O-Su);2.99(m,2H,NH-CH2);3.44(s,2H,N-CH2);7.94(t,1H,N-H)
实施例3–合成3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯
三步合成3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯。
1.合成(嘧啶-2-基硫烷基)-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯(9)
在-35℃将12.31g(107mMol)N-羟基琥珀酰亚胺和22.70g(110mMol)二环己基碳二亚胺加入溶解于200ml DMF的18.27g(107mMol)(嘧啶-2-基硫烷基)-乙酸(a)溶液中。在氩气气氛中搅拌该反应混合物16小时。过滤残留物,真空蒸发滤液至干。在回流下将剩余的产物溶解于400ml乙酸乙酯,过滤热溶液,用乙酸乙酯层析纯化(弗洛里西)该混合物。
产量:4.90g(17%)
1H-NMR(d6-DMSO)δ2.80(s,4H,O-Su),4.41(s,2H,S-CH2),7.28(t,1H,pyr5-CH),8.65(d,2H,pyr4,6-CH)
2.合成3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸(10)
将2.68g(10mMol)(嘧啶-2-基硫烷基)-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯(9)溶解于50ml DMF中。将0.90g(10mMol)3-氨基丙酸(e)和2.78ml(20mMol)三乙胺加入该溶液后,室温下搅拌该反应混合物过夜。除去溶剂后,将产物溶解于100mL水中,用2N NaOH将溶液的pH调节至pH 10。用CH2Cl2洗涤水溶液5次。用活性炭处理该混合物,过滤并用2N HCl将滤液的pH调节至pH 3。再次过滤溶液,用XAD-16纯化滤液。用丙酮重结晶该化合物。
产量:0.64g(26,5%)
RF=起点(乙酸乙酯)
1H-NMR(d6-DMSO)δ2.23(t,2H,CH2-CO),3.42(m,2H,N-CH2),3.86(s,2H,S-CH2),7.23(t,1H,pyr5-CH),8.31(t,1H,NH),8.60(d,2H,pyr4,6-CH)
3.合成3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(11)
将0.305g(2.65mMol)N-羟基琥珀酰亚胺和0.547g(2.65mMol)N,N'-二环己基-碳二亚胺加入10ml CH2Cl2配制的0.64g(2.65mMol)3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸(10)中。室温下搅拌该反应混合物16小时。过滤残留物,真空蒸发滤液至干。将残留物溶解于二氯甲烷后,用乙酸乙酯层析纯化(弗洛里西)产物。蒸发洗脱液的溶剂后,在回流下将残留物溶解于乙酸乙酯,用活性炭纯化。过滤热溶液并蒸发溶剂。用少量冷乙酸乙酯处理残留物使之糊化。过滤该糊剂并用二异丙醚洗涤。
产量:0.50g(56%)
RF=0.28(乙酸乙酯/甲醇5:1)
1H-NMR(d6-DMSO)δ2.84(m,6H,CH2-CO,O-Su),3.39(m,2H,N-CH2),3.88(s,2H,S-CH2),7.22(t,1H,pyr5-CH),8.31(t,1H,NH),8.62(d,2H,pyr4,6-CH)
实施例4–合成3-[2-(2,6-二甲基-哌啶-1-基)-2-13C-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯
用六步合成3-[2-(2,6-二甲基-哌啶-1-基)-2-13C-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯
1.合成溴-2-13C-乙酸-苄酯12
将5g(34.47mMol)溴-2-13C-乙酸(e)加入溶解于150ml二氯甲烷的4.22g(39mMol)苄醇(g)、8.50g(39mMol)N,N'-二环己基碳二亚胺和0.40g4-N,N-二甲基氨基吡啶。室温下搅拌该反应混合物过夜。过滤残留物,用饱和的NaHCO3洗涤滤液。用二氯甲烷萃取水层三次,用Na2SO4干燥合并的有机相,真空蒸发溶剂。利用二氯甲烷作为洗脱剂通过快速层析纯化产物。
产量:7.37g(91%)
RF=0.5(CH2Cl2)
2.合成(26-二甲基-哌啶-1-基)-2-13C-乙酸苄酯13
回流下将7.37g(32mMol)溴-2-13C-乙酸-苄酯(12)和9ml(70mMol)2,6-二甲基-哌啶(b)在150ml THF中搅拌5小时。蒸发溶剂后,将产物溶解于150ml水和150ml乙酸乙酯的乳液中,用2N NaOH将水层的pH调节至pH11.6。分离水层后,用乙酸乙酯萃取水相三次,合并有机相,用饱和NaCl溶液洗涤,Na2SO4干燥。蒸发溶剂后,用二异丙醚作为洗脱剂通过快速层析纯化残留物。
产量:8.32g(>99%)
RF=0.3((iPr)2)
3.合成(2,6-二甲基-哌啶-1-基)-2-13C-乙酸14
将8.32g(32mMol)(2,6-二甲基-哌啶-1-基)-2-13C-乙酸-苄酯(13)溶解于100ml甲醇中。向该溶液中加入0.5g Pd/C(5%),用730ml氢在常压和室温下氢化30分钟。过滤反应混合物,蒸发溶剂并用少量冷的二异丙醚处理残留物使之糊化。过滤除去溶剂,真空干燥产物。
产量:5.28g(96%)
RF=0.1(CH2Cl2/CH3OH5:1)
4.合成3-[2-(2,6-二甲基-哌啶-1-基)-2-13C-乙酰氨基]-丙酸苄酯15
将5.28g(30.6mMol)(2,6-二甲基-哌啶-1-基)-乙酸(14)加入溶解于50ml DMF的9.40g(61.2mMol)1-羟基苯并三唑和12.62g(61.2mMol)N,N'-二环己基碳二亚胺混合物中。室温下搅拌30分钟后,向该反应混合物中加入10.75g(30.6mMol)3-氨基丙酸苄酯和6.18g(61,2mMol)三乙胺,室温下搅拌过夜。蒸发溶剂,将残留物溶解于200ml乙酸乙酯中,过滤溶液,用80ml 1N NaOH溶液洗涤滤液三次,用饱和NaCl溶液洗涤一次。MgSO4干燥有机相,蒸发溶剂。利用乙酸乙酯通过第一快速层析纯化残留物,利用CH2Cl2:CH3OH 50:1作为洗脱剂通过第二次快速层析洗脱产物。
产量:9.07g(89%)
RF=0.47(CH2Cl2/CH3OH 10:1)
5.合成3-[2-(2,6-二甲基-哌啶-1-基)-2-13C-乙酰氨基]-丙酸16
将9.07g(27,20mMol)3-[2-(2,6-二甲基-哌啶-1-基)-2-13C-乙酰氨基]-丙酸苄酯(15)溶解于200ml甲醇中。将0.5g Pd/C(5%)加入该溶液中,用640ml氢在常压和室温下氢化30分钟。过滤反应混合物并蒸发溶剂。
产量:6.80g(>99%)
RF=0.1(CH2Cl2/CH3OH 5:1)
6.合成3-[2-(2,6-二甲基-哌啶-1-基)-2-13C-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯17
将4.98g(10mMol)3-[2-(2,6-二甲基-哌啶-1-基)-2-13C-乙酰氨基]-丙酸(16)加入溶解于200ml二氯甲烷的3.22g(28mMol)N-羟基琥珀酰亚胺和5.78g(28mMol)N,N'-二环己基碳二亚胺中。室温下搅拌反应混合物16小时。过滤该溶液,真空蒸发滤液至干。用二异丙醚洗涤产物。
产量:8g(84%)
Mp=108-109℃
实施例5–合成3-[2-(2,6-二甲基-哌啶-1-基)乙酰基-15N-氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯7
用七步合成3-[2-(2,6-二甲基-哌啶-1-基)乙酰基-15N-氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯7
1.合成溴乙酸-苄酯18
将5g(34.47mMol)溴乙酸(h)加入溶解于150ml二氯甲烷的4.22g(39mMol)苄醇(f)、8.50g(39mMol)N,N'-二环己基碳二亚胺和0.40g 4-二甲基氨基吡啶中。室温下搅拌反应混合物过夜。过滤残留物,用饱和NaHCO3洗涤滤液。用二氯甲烷萃取水层3次,Na2SO4干燥合并的有机相,真空蒸发溶剂至干。用二氯甲烷作为洗脱剂通过快速层析纯化产物。
产量:7.45g(92%)
RF=0.5(CH2Cl2)
2.合成(2,6-二甲基-哌啶-1-基)-乙酸-苄酯19
回流下将7.39g(32mMol)溴乙酸-苄酯(18)和9ml(70mMol)2,6-二甲基-哌啶(b)在150ml THF中搅拌5小时。蒸发溶剂后,将产物溶解于150ml水和150ml乙酸乙酯的乳液中,用16.5ml 2N NaOH将水层的pH调节至pH 11.6。分离各层后,用乙酸乙酯萃取水相3次,合并有机层,用饱和NaCl乳液洗涤,Na2SO4干燥。蒸发溶剂后,用二异丙醚作为洗脱剂通过快速层析纯化残留物。
产量:8g(95%)
RF=0.3((iPr)2O)
3.合成(2,6-二甲基-哌啶-1-基)-乙酸20
将8g(31mMol)(2,6-二甲基-哌啶-1-基)-乙酸-苄酯(19)溶解于100ml甲醇中。向该溶液中加入0.5g Pd/C(5%),用725ml氢在常压和室温下氢化30分钟。过滤反应混合物,蒸发溶剂并用少量冷的二异丙醚处理残留物使之糊化。过滤除去溶剂,真空干燥产物。
产量:5g(94%)
RF=0.1(CH2Cl2:CH3OH 5:1)
Fp=179-180℃
4.合成3-15N-氨基丙酸苄酯氢-对-甲苯磺酸盐(3-15N-amino propanoic acid benzyl ester hydro-p-tosylate)21
利用水分离器将20ml甲苯配制的3.13g(16.5mMol)对甲苯磺酸加热回流1小时。向冷却的该溶液中加入6.6ml(63.4mMol)苄醇和1.5g(16.5mMol)3-15N-氨基丙酸。回流下加热该反应混合物1小时以上。将冷却的该溶液中加入90mL二异丙醚。使该溶液维持于-20℃过夜后,过滤沉淀物并用二异丙醚洗涤。
产量:4.68g(81%)
Mp=122–125℃
5.合成3-[2-(2,6-二甲基-哌啶-1-基)-乙酰基-15N-氨基]-丙酸苄酯22
将2.28g(13.33mMol)(2,6-二甲基-哌啶-1-基)-乙酸(21)加入溶解于100ml DMF的4.08g(26.66mMol)1-羟基苯并三唑和5.50g(61,2mMol)N,N'-二环己基碳二亚胺的混合物中。室温下搅拌30分钟后,向反应混合物中加入4.68g(13.33mMol)3-15N-氨基丙酸苄酯和3.69ml(66.66mMol)三乙胺,室温下搅拌过夜。蒸发该混合物,将残留物溶解于200ml乙酸乙酯中,过滤溶液,用80ml 1N NaOH溶液洗涤滤液三次,用饱和NaCl溶液洗涤一次。用MgSO4干燥有机相,蒸发溶剂。利用乙酸乙酯通过第一快速层析纯化残留物,利用CH2Cl2:CH3OH 50:1作为洗脱剂通过快速层析洗脱产物。
产量:0.87g(20%)
RF=0.47(CH2Cl2/CH3OH 10:1)
6.合成3-[2-(2,6-二甲基-哌啶-1-基)乙酰基-15N-氨基]-丙酸23
将0.87g(2.60mMol)3-[2-(2,6-二甲基-哌啶-1-基)乙酰基-15N-氨基]-丙酸苄酯(22)溶解于50ml甲醇。向该溶液中加入0.15g Pd/C(5%),用58ml氢在常压和室温下氢化30分钟。过滤反应混合物并蒸发溶剂。
产量:0.59g(>93%)
RF=0.1(CH2Cl2/CH3OH 5:1)
7.合成3-[2-(2,6-二甲基-哌啶-1-基)乙酰基-15N-氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯24
将0.59g(2,42mMol)3-[2-(2,6-二甲基-哌啶-1-基)乙酰基-15N-氨基]-丙酸(23)加入20ml二氯甲烷配制的0.28g(2.42mMol)N-羟基琥珀酰亚胺和0.5g(2.42mMol)N,N'-二环己基碳二亚胺中。室温下搅拌反应混合物16小时。过滤溶液,真空蒸发滤液至干。用二异丙醚重结晶产物。
产量:0.7g(85%)
Mp=109-110℃
实施例6–合成3-[2-(2,6-二甲基-哌啶-1-基)乙酰基-15N-氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯5
用四步合成3-[2-(2,6-二甲基-哌啶-1-基)乙酰基-15N-氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯5
1.合成2-氨基丙酸苄酯氢对-甲苯磺酸盐(2-amino propanoic acid benzyl ester hydro-p-tosylate)25
将4.45g(50mMol)2-氨基丙酸加入10ml甲苯配制的9.7(51mMol)对-甲苯磺酸和20ml(193mMol)苄醇。利用水分离器将该反应混合物加热回流2小时。将30ml二氯甲烷既然冷却的反应混合物中。利用CH2Cl2:CH3OH50:1通过快速层析纯化产物。
产量:8.5g(49%)
2.合成2-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸苄酯26
将3.11g(15mMol)(2,6-二甲基-哌啶-1-基)-乙酸(20)加入溶解于50mlDMF的4.59g(30mMol)1-羟基苯并三唑、6.19g(30mMol)N,N'-二环己基碳二亚胺混合物中。室温下搅拌30分钟后,向该反应混合物中加入3.11g(15mMol)2-氨基丙酸苄酯(1)和4.15ml(30mMol)三乙胺,室温下搅拌过夜。过滤该混合物,蒸发溶液。将残留物溶解于250ml乙酸乙酯中,用200ml 0.5N NaOH溶液洗涤该溶液三次,用饱和NaCl溶液洗涤一次。用MgSO4干燥有机相,蒸发溶剂。利用CH2Cl2:CH3OH 95:5作为洗脱剂通过快速层析纯化残留物。
产量:3.92g(80%)
RF=0.75(CH2Cl2/CH3OH 5:1)
3.合成2-[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-丙酸27
将8.30g(25mMol)2-[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-丙酸苄酯(26)溶解于150ml甲醇中。向该溶液中加入0.5g Pd/C(5%),用560ml氢在常压和室温下氢化30分钟。过滤反应混合物并蒸发溶剂。
产量:6.3g(>99%)
RF=0.1(CH2Cl2/CH3OH 5:1)
4.合成2-[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯28
利用水分离器将4.75g(25mMol)对-甲苯磺酸在20ml甲苯中加热回流1小时。蒸发溶剂后,将6.30g(25mMol)2-[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-丙酸(27)、2.88g(25mMol)N-羟基琥珀酰亚胺和5.15g(25mMol)N,N'-二环丙基碳二亚胺加入溶解于100ml二氯甲烷的残留物中。室温下搅拌该反应混合物16小时。过滤溶液,真空蒸发滤液至干。用二异丙醚重结晶该产物。
产量:12g(93%)
Mp=109-110℃
实施例7–合成[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯5.
用三步合成[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯5
1.合成[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-乙酸苄酯29
将7.69g(37mMol)(2,6-二甲基-哌啶-1-基)-乙酸(20)加入溶解于100mlDMF的11.34g(74mMol)1-羟基苯并三唑和15.27g(74mMol)N,N'-二环己基碳二亚胺混合物中。室温下搅拌30分钟后,将溶解于100ml DMF和10.25ml(74mMol)三乙胺的12.5g(37mMol)氨基乙酸苄酯(1)加入该反应混合物中,室温下搅拌过夜。过滤该反应混合物,蒸发溶液。将残留物溶解于250ml二氯甲烷,再次过滤溶液,然后蒸发。将残留物溶解于100ml乙酸乙酯后,用200ml 0.5N NaOH溶液洗涤该溶液三次,用饱和NaCl溶液洗涤一次。用MgSO4干燥有机相,蒸发溶剂。滤液乙酸乙酯作为洗脱剂通过第一快速层析纯化残留物,利用CH2Cl2:CH3OH 10:1从第二硅胶柱上洗脱产物。
产量:6.54g(56%)
RF=0.77(CH2Cl2/CH3OH 5:1)
2.合成[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-乙酸30
将6.54g(20mMol)[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-乙酸苄酯(29)溶解于150ml甲醇。向该溶液中加入0.5g Pd/C(5%),用470ml氢在常压和室温下氢化30分钟。过滤反应混合物并蒸发溶剂。
产量:4.54g(>99%)
RF=0.1(CH2Cl2/CH3OH 5:1)
3.合成[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-乙酸-(2,5-二氧代-吡咯烷-1-基)-酯31
将4.54g(20mMol)[2-(2,6-二甲基-哌啶-1-基)乙酰氨基]-乙酸(30)加入溶解于150ml二氯甲烷的2.30g(20mMol)N-羟基琥珀酰亚胺和4.12g(20mMol)N,N'-二环己基碳二亚胺中。室温下搅拌反应混合物16小时。过滤溶液,真空蒸发滤液至干。将残留物溶解于50mL二氯甲烷中,用炭处理。过滤后,真空蒸发该溶液至干,用乙酸乙酯重结晶该产物。
产量:4.03g(62%)
Mp=150-151℃
实施例8-将串联质量标记物与模型胰蛋白酶肽相偶联
-所用的模型胰蛋白酶肽:
VATVSLPR 分子量:842,01
DYEGATLSDIGALIR 分子量:1593,75
LGEHNIDVLEGNEQFINAAK 分子量:2211,42
-所测试的反应性质量标记物:
6-[(嘧啶-2-基硫烷基)-乙酰氨基]-己酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-C6-OSu)
3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(Pyrm-βAla-OSu)
3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(DMPip-βAla-OSu)
2-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯(DMPip-Ala-OSu)
-与模型肽的通用偶联反应方案
将35μL水和37.5μL(400mM)pH 7.5–7.8的硼酸盐缓冲液(Borat-Puffer)与溶解于水/ACN(3:1比例)的37.5μL(750nMol)肽混合。将TMT试剂(反应性质量标记物)(40mM)溶解于40μL DMF,然后加入肽溶液。室温下搅拌3小时后,采用HPLC(飞诺曼克斯露娜(Phenomenex Luna)-250mm/4,6mm-5μC18)纯化反应混合物,用MS分析标记的肽。
图4显示模型肽LGEHNIDVLEGNEQFINAAK和反应性质量标记物3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯之间反应形成标记的肽DMPip-βAla-LGEHNIDVLEGNEQFINAA(DMPip-βAla-)K,反应在3小时后完成。
图5显示模型肽VATVSLPR和反应性质量标记物3-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯之间反应形成标记的肽DMPip-βAla-VATVSLPR,反应在3小时后完成。
图6显示模型肽VATVSLPR和反应性质量标记物3-[2-(嘧啶-2-基硫烷基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯之间反应形成标记的肽Pyrm-βAla-VATVSLPR,反应在3小时后完成。
图16显示模型肽VATVSLPR和反应性质量标记物2-[2-(2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸-(2,5-二氧代-吡咯烷-1-基)-酯之间反应形成标记的肽DMPip-Ala-VATVSLPR,反应在3小时后完成。
实施例9–质量标记的肽的MS/MS分析
MS/MS实验方案
用QTOF2质谱仪(英国曼彻斯特市的微质公司(Micromass))进行MS和MS/MS分析。用CAP-LC HPLC系统(美国马萨诸塞州米尔福德的沃特斯公司(Waters Corporation))(柱:戴尔奈克斯公司(Dionex)的PepMapTMC18HPLC柱,其内径为75μm,长150mm;溶剂:95%水到95%乙腈,二者均含0.2%甲酸)进行HPLC分析。
通过对各肽图谱求和与平滑来测定其在电喷雾源中电离时的离子丰度比例,然后测定TMT片段的峰强度。
图7-13和17-20显示了用TMT标记的双荷电或三荷电肽序列离子的MS和MS/MS图谱,所述肽序列分别是:DMPip-βAla-VATVSLPR、DMPip-βAla-DYEGATLSDIGALIR、DMPip-βAla-LGEHNIDVLEGNEQFINAA(DMPip-βAla)-K、Pyrm-βAla-VATVSLPR、Pyrm-βAla-DYEGATLSDIGALIR、Pyrm-C6-VATVSLPR、Pyrm-C6-DYEGATLSDIGALIR、DMPip-Ala-VATVSLPR、DMPip-Ala-DYEGATLSDIGALIR、DMPip-Gly-VATVSLPR、DMPip-Gly-DYEGATLSDIGALIR。在各图中,第一幅图显示了相应标记的肽的MS-模式TOF图谱。第二幅图显示了标记的肽在规定的碰撞能量下的CID图谱。箭头表明DMPip-Gly、DMPip-Ala、DMPip-βAla存在m/z为126的预计标签片段(TMT片段)或Pyrm-βAla和Pyrm-C6存在m/z为153的预计标签片段。
实施例10–采用双重方案的相对定量
利用5种不同的胰蛋白酶模型肽相对定量掺合比例(confected ratio)。所测试的肽和比例如下所示:
5种不同的肽FSWGAEGER
VATVSLPR
LGEHNIDVLEGNEQFINAAK
EIQAEGNR
DIAIHHPWIR
7种不同的比例:0:100
10:90
25:75
50:50
75:25
90:10
100:0
如下所示,作为轻片段和重片段,所利用的TMT标签是DMPip-βAla-Osu:
用5种所述肽的7种不同预计和观测比例的回归线拟合TMT标签片段ESI-MS/MS数据。分析相应的TMT标记肽。通过分析标签片段离子峰C13(重标签(=H)m/z为127)和C12(轻标签(=L)m/z为126)处的峰最高值测定丰度比例。
实施例11合成同位素标记的3-[2-((2S,6R)-2,6-二甲基-哌啶-1-基)-乙酰氨基]-丙酸2,5-二氧代-吡咯烷-1-基酯;通用合成方案:
利用下表所示同位素标记的起始物质,部分或全部采用以上反应方案合成6种同位素标记的质量标记物(TMT化合物)I-VI:
直接从未标记的可商品化购得的顺-2,6-二甲基哌啶8合成化合物I和II(参见以上反应方案)。
化合物IV的合成详述如下:
(i)合成1,7-13C2-庚二酸1
在氮气气氛下将124ml(0.885mmol)二异丙胺加入590ml干燥的四氢呋喃中。冷却至-20℃后,滴加己烷配制的560ml 1.6摩尔正-丁基锂(BuLi)。将温度升至0℃,加入70ml六甲基磷酰胺(HMPA)。0℃搅拌10分钟后,先滴加23ml(0.396mol)乙酸-1-13C(b),再加入140ml HMPA,均在0℃操作。该溶液在0℃搅拌1小时,在室温搅拌2小时。冷却至0℃后,加入20.4ml(0.2mol)1,3-二溴丙烷(a)。室温下搅拌该溶液过夜。用800ml水稀释后,分离有机相并用乙醚/水(2:1)和水萃取。合并水性萃取物,用乙醚洗涤,用浓盐酸酸化至pH 3,用氯化钠饱和并用乙醚萃取。合并醚萃取物,硫酸钠干燥。真空除去溶剂,利用二异丙醚作为洗脱剂,通过快速层析纯化得到的油状物。分别用0.2mol和0.174mol的乙酸-1-13C(b)重复该反应两次。
产量:34.5g(37%)
RF=0.63(乙酸乙酯/甲醇5:1)
(ii)合成(2R,6S)-2,6-二溴-1,7-13C2-庚二酸-二甲酯2
向32.4g(0.2mol)1,7-13C2-庚二酸1的400ml 1,2-二氯乙烷混悬液中加入150ml 1,2-二氯乙烷配制的34.82ml(0.477mol)亚硫酰氯。回流1.5小时后,蒸馏除去150ml 1,2-二氯乙烷,滴加150ml 1,2-二氯乙烷配制的29.35ml(0.576mol)溴。再回流10小时后,将热溶液滴加入沸腾的甲醇中。使混合物回流0.5小时,真空除去溶剂。将残留物溶解于1500ml二异丙醚中,用亚硫酸氢钠溶液、碳酸氢钠溶液、饱和的氯化钠溶液和水洗涤。硫酸钠干燥该溶液,过滤并真空除去溶剂。
产量:70g(>99%)
RF=0.63(二氯甲烷)
(iii)合成(2R,6S)-1-苄基-哌啶-2,6-二-(1-13C-羧酸)二甲酯3
将76.5ml(0.722mol)苄胺的250ml甲苯溶液加热至回流,滴加150ml甲苯配制的70g(0.2mol)(2R,6S)-2,6-二溴-1,7-13C2-庚二酸二甲酯2。回流5小时后,真空除去溶剂。将残留物溶解于2000ml二异丙醚/饱和的碳酸氢钠溶液(1:1)中,分离醚相。用二异丙醚萃取水相,用氯化钠溶液洗涤合并的醚萃取物,硫酸钠干燥,过滤并真空除去溶剂。利用二异丙醚/己烷(1:3)通过快速层析纯化残留物。
产量:25.5g(43.5%)
RF=0.53(二异丙醚)
(iv)合成((2R,6S)-1-苄基-6-羟基-13C-甲基-哌啶-2-基)-13C-甲醇4
在氮气气氛下向5.6g(0.148mol)氢化铝锂的600ml干燥乙醚溶液中加入200ml干燥乙醚配制的25.5g(87mmol)(2R,6S)-1-苄基-哌啶-2,6-二-(1-13C-羧酸)二甲酯3。回流1小时后,依次加入5.6ml水、5.6ml 15%氢氧化钠溶液和16.8ml水,室温下搅拌该混合2小时。过滤该混悬液,用乙醚洗涤,真空除去溶剂。利用乙酸乙酯/甲醇(5:1)作为洗脱剂,通过快速层析纯化残留物。
产量:20g(99%)
RF=0.38(乙酸乙酯/甲醇5:1)
(v)合成((2S,6R)-6-羟基-13C-甲基-哌啶-2-基)-13C-甲醇5
向20g(87mmol)((2R,6S)-1-苄基-6-羟基-13C-甲基-哌啶-2-基)-13C-甲醇4的250ml甲醇溶液中加入1g碳载钯催化剂(Pd/C)(5%)。用1800ml氢在常压和室温下进行氢化。过滤溶液,真空除去溶剂。将残留物溶解于二氯甲烷中,通过过滤使之澄清并真空除去溶剂。
产量:11.14g(87%)
RF=0.06(乙酸乙酯/甲醇5:1)
(vi)合成(2R,6R)-2,6-二-((甲苯-4-磺酰基)-氧基-13C-甲基)-哌啶-1-基-甲苯磺酰胺6
0℃向11.14g(76.72mmol)((2S,6R)-6-羟基-13C-甲基-哌啶-2-基)-13C-甲醇5的300ml二氯甲烷溶液中滴加250ml二氯甲烷配制的32ml(231.6mmol)三乙胺和250ml配制的44.16g(231.6mmol)4-甲苯磺酰氯。溶液在0℃搅拌3小时,再于室温搅拌5天。用水洗涤反应混合物,硫酸钠干燥,真空除去溶剂。利用乙酸乙酯/己烷(1:1)作为洗脱剂,通过快速层析纯化残留物。
产量:11.5g(25%)
RF=0.41(己烷/乙酸乙酯6:4)
(vii)合成(2R,6S)-2,6-二-13C-甲基-1-(搅拌-4-磺酰基)-哌啶7
向7g(0.184)氢化铝锂的50ml四氢呋喃溶液中滴加50ml四氢呋喃配制的11.5g(18.9mmol)(2R,6R)-2,6-二-((甲苯-4-磺酰基)-氧基-13C-甲基)-哌啶-1-基-甲苯磺酰胺6,溶液回流4小时。用300ml乙醚和7ml水稀释反应混合物,依次加入7ml 15%氢氧化钠溶液和21ml水。在冰上搅拌该混悬液1小时,过滤,用乙酸乙酯和二氯甲烷洗涤,真空除去溶剂。利用二异丙醚/己烷(1:1)作为洗脱剂,通过快速层析纯化残留物。
产量:3.4g(67%)
RF=0.83(二异丙醚)
(viii)合成(2R,6S)-2,6-二-13C-甲基-哌啶8
在氮气气氛下将10.54g(72mmol)萘和1.87g(72mmol)钠的170ml1,2-二甲氧基乙烷溶液搅拌过夜,加入3.4g(12.6mmol)(2R,6S)-2,6-二-13C-甲基-1-(甲苯-4-磺酰基)-哌啶7。再搅拌2小时后,加入乙醚配制的100ml1摩尔盐酸,真空除去溶剂。将残留物悬浮在50ml水中,用二异丙醚洗涤,真空除去溶剂。将残留物溶解于30ml 2摩尔氢氧化钠溶液中,用氯化钠饱和,用乙酸乙酯萃取。合并乙酸乙酯萃取物,硫酸钠干燥,用乙醚配制的30ml 1摩尔盐酸稀释,真空除去溶剂。
产量:1.75g(91.6%)(盐酸盐)
(ix)合成溴-13C2-乙酸-苄酯9
向20g(0.14mmol)溴-13C2-乙酸(c)的500ml二氯甲烷溶液中加入16.2ml(0.157mol)苄醇(d)、1g 4-N,N-二甲基氨基吡啶和32.2g(0.156mol)N,N'-二环己基碳二亚胺。室温下搅拌该反应混合物过夜。过滤残留物,用饱和的碳酸氢钠溶液洗涤滤液。用二氯甲烷洗涤水层三次,用氯化钠溶液洗涤合并的有机相,硫酸钠干燥,真空除去溶剂。利用二氯甲烷/己烷(1:1)作为洗脱剂,通过快速层析纯化残留物。
产量:28.2g(87%)
RF=0.67(二氯甲烷)
(X)合成((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酸苄酯10
将0.85g(5.6mmol)(2R,6S)-2,6-二-13C-甲基-哌啶8(盐酸盐)在0.222g(5.55mmol)氢氧化钠的2ml水溶液中搅拌5分钟,加入50ml四氢呋喃和0.8g(3.5mmol)溴-13C2-乙酸-苄酯9。回流5小时后,真空除去溶剂。间残留物溶解于二异丙醚中,用碳酸氢钠溶液洗涤,硫酸钠干燥,真空除去溶剂。利用二异丙醚/己烷(1:1)作为洗脱剂,通过快速层析纯化残留物。
产量:0.61g(82%)
RF=0.5(二异丙醚)
(xi)合成((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酸11
将0.61g(2.3mmol)((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酸苄酯10溶解于25ml甲醇中。向该溶液中加入0.1g碳载钯(5%),用55ml氢在常压和室温下氢化30分钟。过滤反应混合物,真空除去溶剂。
产量:0.37g(92.5%)
RF=0.05(二异丙醚)
(xii)合成3-15N-氨基-丙酸苄酯12
使1.4g(15.55mmol)β-丙氨酸-15N、3.18g 4-甲苯磺酸和13.14ml(127mmol)苄醇的120ml甲苯溶液回流4小时。冷却至室温后,用75ml异丙醚稀释该溶液,维持于4℃过夜,滤得沉淀物,用异丙醚洗涤,真空干燥。
产量:5.32g(97.5%)(甲苯磺酸盐)
(xiii)合成3-[2-((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酰基-15N-氨基]-丙酸苄酯13
将0.37g(2.1mmol)((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酸11、0.64g(4.18mmol)1-羟基苯并三唑、0.87g(4.2mmol)N,N'-二环己基碳二亚胺和0.58ml(4.2mmol)三乙胺溶解于25ml二甲基甲酰胺。室温下搅拌30分钟后,向该反应混合物中加入0.78g(2.21mmol)3-15N-氨基-丙酸苄酯12(甲苯磺酸盐)和0.58ml(4.2mmol)三乙胺,室温下搅拌过夜。蒸发溶剂,将残留物溶解于200ml乙酸乙酯中,过滤溶液,用1摩尔氢氧化钠溶液和饱和氯化钠溶液洗涤。硫酸镁干燥有机相并蒸发溶剂。利用乙酸乙酯通过第一快速层析纯化残留物,利用二氯甲烷/甲醇50:1作为洗脱剂通过第二次快速层析洗脱产物。
产量:0.69g(97%)
RF=0.56(二氯甲烷/甲醇10:1)
(xiv)合成3-[2-((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酰基-15N-氨基]-丙酸14
将0.69g(2mMol)3-[2-((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酰基-15N-氨基]-丙酸苄酯12溶解于20ml甲醇中。向该溶液中加入0.5g碳载钯(5%),用50ml氢在常压和室温下氢化30分钟。过滤反应混合物并蒸发溶剂。
产量:0.4g(81%)
RF=0.05(乙酸乙酯/甲醇5:1)
(xv)合成3-[2-((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酰基-15N-氨基]-丙酸2,5-二氧代-吡咯烷-1-基酯15
将0.39g(1.55mmol)3-[2-((2S,6R)-2,6-二-13C-甲基-哌啶-1-基)-13C2-乙酰基-15N-氨基]-丙酸13加入溶解于10ml二氯甲烷的170.5mg(1.48mmol)N-羟基琥珀酰亚胺和305.4mg(1.48mmol)N,N'-二环己基碳二亚胺中。室温下搅拌反应混合物16小时。过滤溶液,真空蒸发滤液至干。用二异丙醚洗涤该产物。
产量:450mg(84%)
Mp=108-109℃
实施例12–通过以下掺加实验评估双重质量标记物(TMT)方案应用于复杂生物样品的定量性能:
获自8蛋白质混合物的质量标记(TMT)肽代表了要掺加入复杂生物样品中的起始物质,蛋白质消化物的SCX部分来自酵母菌总裂解样品。
蛋白质混合物由等摩尔量(1nmol)的甘油醛-3-磷酸脱氢酶(G3P_RABIT)、溶菌酶(LYC_CHICK)、肌红蛋白(MYG_HORSE)、β-半乳糖苷酶(BGAL_ECOLI)、乳酸脱氢酶(LDHA_RABIT)、磷酸化酶b(PHS2_RABIT)、丙酮酸激酶(KPYM_RABIT)和BSA(ALBU_BOVIN)构成,这些物质均购自德国塔夫克里琛市的西格玛公司(Sigma)。采用双重方案以明确的比例标记蛋白质混合物:G3P_RABIT,比例为1:1;MYG_HORSE,比例为1:1;PHS2_RABIT,比例为1:3;LYC_CHICK 1:1;BGAL_ECOLI,比例为3:1;KPYM_RABIT,比例为2:1;ALBU_BOVIN,比例为1:2;LDHA_RABIT,比例为1:1。质量(TMT)标记过程如下所示:简言之,将所得的2种掺合蛋白质样品溶解于50mM硼酸盐缓冲液和1%SDS pH7.5中,用1mM三[2-羧乙基膦](TCEP)和7.5mM碘乙酰胺(IAA)还原和烷化Cys残基。然后胰蛋白酶消化(pH 7.8,37℃,20小时,SDS<0.1%)这2种蛋白质混合物,合并,用本发明的二甲基哌啶(DMP)双重标签进行质量(TMT)标记(20mM,3小时,pH 7.5)。
然后用N-羟胺(0.25%NH2OH,30分钟)处理样品。
质量标记物(TMT)双重方案还以1:1的比例应用于酵母菌总裂解组分。将等量的两部分酵母菌组分(各自为500μg)以与人工蛋白质混合物相同的方式应用于质量(TMT)标记方法。
将质量(TMT)标记方法应用于2份样品后,首先用C18保护柱纯化得到的2份质量(TMT)标记的肽混合物,然后采用SCX层析分级。采用以下分步梯度(8mL/分钟),用日火C18保护柱(SunFire C18guard column)(4.6×20mm,5μm,沃特斯公司,埃施波恩(Eschborn),德国)实施2个肽部分的纯化和脱盐步骤:100%缓冲液A(H2O/ACN/TFA:99.8/0.1/0.1),3分钟;50%缓冲液A和50%缓冲液B(ACN/H2O/TFA:99.8/0.1/0.1),6分钟;100%缓冲液B,8分钟。利用多聚磺乙基A柱(PolySulfoethyl A column)(4.6×100mm,5μm,200A,美国马里兰州哥伦比亚市的多聚LC公司(PolyLC Inc)),通过强阳离子交换(SCX)层析分级源自酵母菌样品和肽混合物的质量(TMT)标记肽混合物。用两次连续的线性梯度洗脱肽,一次始于0-250mM KCl(25%v/vCAN,5mM KH2PO4,pH 3),20分钟,接着是250-500mM KCl(25%v/v CAN,5mM KH2PO4,pH 3),流速均是2ml/分钟,以1分钟为间隔收集各组分。
以QTof II分别对人工蛋白质混合物和酵母菌样品SCX组分的质量(TMT)标记肽混合物的收集组分进行LC-MS/MS分析,从而能利用基峰痕迹(base peak trace)评估它们的浓度。人工混合物与酵母菌裂解物的比例是1:1-1:10w/w(1:1;1:1.5;1:2;1:3;1:4;1:5;1:8;1:10)。采用QToF II以LC-MS/MS分析不同掺加样品。然后在这种复杂蛋白质组背景中定量8种人工蛋白质混合物的母离子的相对比例。此外,对于SCX组分,我们评估了所有MS/MS分布情况来确定许多酵母菌蛋白质并测定通过质量标记物(TMT)双重试剂所报道的相对浓度。
数据分析和解析:利用SEQUEST和蛋白质预测(ProteinProphet)搜索引擎鉴定肽和蛋白质。利用酵母菌数据库鉴定酵母菌组分的蛋白质,内部开发的小数据库用于鉴定8蛋白质混合物的肽。应用SEQUEST检索来鉴定8蛋白质混合物。从SEQUEST数据文件提取质量标记物(TMT)片段(质量标记部分,X)的签名(signature)-离子峰区域来进行相对定量。然后利用我们的原型软件工具使定量数据与所鉴定肽序列的清单相匹配。根据从数据文件提取的质量标记物(TMT)报道离子(质量标记部分)的积分值计算相对丰度比例。首先给予未经阈值过滤除去质量标记物(TMT)报道(离子)强度较低(MS/MS图谱中计数>90)的肽的定量结果,然后给予经阈值过滤除去质量标记物(TMT)报道(离子)强度较低(MS/MS图谱中计数>90)的肽的定量结果。
结果
酵母菌裂解物中人工混合物的蛋白质的相对丰度:
相同母体蛋白质中所有肽的相对丰度的CV范围是1-10%。当重新分析数据以除去TMT报道(离子)强度较低的肽时,CV的最高水平提高了6.8%。与预计的比例相比,所报道比例的精确度范围是-0.7-+9.8%。在所有的情况中,所报道的比例基本上不受人工混合物与酵母菌裂解物的比例影响。
图23a和23b显示了(a)8蛋白质混合物和(b)酵母菌蛋白质组分的TMT标记肽混合物的储备溶液的基峰色谱。
图24a.掺入酵母菌蛋白质组分的复杂TMT标记肽混合物时,不同稀释度的8蛋白质混合物的TMT标记肽混合物的基峰色谱。
图24b.从蛋白质LDHA_RABIT(P13491)鉴定的肽D*YSVTANSK*的基峰色谱。所述基峰色谱显示掺加实验中肽的质量强度,所述实验利用掺入酵母菌组分的TMT质量标记肽混合物中,8蛋白质混合物的8种不同浓度的TMT质量标记肽混合物,即1:1、1:1.5、1:2、1:3、1:4、1:5、1:8、1:10,分别从底端向顶端显示。
图25.各稀释实验和蛋白质的人工混合物:蛋白质比例的相对定量数据。蛋白质1代表βGAL_ECOLI,蛋白质2代表PHS2_RABIT,蛋白质3代表ALBU_BOVIN,蛋白质4代表KPYM_RABIT,蛋白质5代表G3P_RABIT,蛋白质6代表LDHA_RABIT,蛋白质7代表MYG_HORSE,蛋白质8代表LYS_CHICK。各蛋白质显示了对应于掺入酵母菌消化组分中的人工混合物稀释液的8个不同的点。
图26.各蛋白质对于各种稀释度的相应CV。数据与图25的比例相联系。
图27.应用阈值过滤以除去MS/MS图谱中TMT报道离子(质量标记部分)强度低的肽后,各种稀释实验和蛋白质的人工混合物:蛋白质比例的相对定量数据。
图28.各蛋白质对于各种稀释度的相应CV。数据与图27的比例相联系。
酵母菌裂解物中酵母菌蛋白质的相对丰度
根据所利用的蛋白质混合物和MS过滤算法,本实验中运行的标准MS/MS参数能鉴定和定量测定94-126种不同的酵母菌蛋白质。所有实验的酵母菌蛋白质的预计比例是0.5,虽然TMT质量标记物双重试剂始终报道的比例是0.42-0.43。未过滤数据的CV范围通常是15-25%,当应用低强度过滤时,其明显提高了5-6%。
图29a和b.不含人工混合物的SCX酵母菌组分中所鉴定的不同蛋白质的比例分布。
图29a.考虑了所有肽,含509种肽的129种鉴定的蛋白质的平均值是0.43,平均CV是24.3%。74.5%的肽显示CV在0-10%之间,6.1%的肽显示在10-20%之间,19.4%的肽显示高于20%。
图29b.通过应用阈值过滤以除去MS/MS中TMT报道(离子)(质量标记部分)计数低于90的肽,含393种肽的116种鉴定的蛋白质的平均值是0.42,平均CV是5%。这样,94.3%的肽显示CV在0-10%之间,2.3%的肽显示在10-20%之间,只有3.4%的肽显示高于20%。
图30a和b.以1:1的比例掺加了人工混合物的SCX酵母菌组分中所鉴定的不同蛋白质的比例分布。
图30a.考虑了所有肽,含363种肽的103种鉴定的蛋白质的平均值是0.43,这些蛋白质显示的平均CV是16.5%。确切地说,69.9%的蛋白质显示CV在0-10%之间,12.3%的蛋白质显示在10-20%之间,17.8%的蛋白质显示高于20%。
图30b.通过应用阈值过滤以除去MS/MS中TMT报道(离子)(质量标记部分)计数低于90的肽,含276种肽的94种鉴定的蛋白质的平均值是0.42,平均CV是6.4%。这样,88.5%的蛋白质显示CV在0-10%之间,8.2%的蛋白质显示在10-20%之间,只有3.3%的蛋白质显示高于20%。
图31a和b.以1:0.1的比例掺加了人工混合物的SCX酵母菌组分中所鉴定的不同蛋白质的比例分布。
图31a.考虑了所有肽,含401种肽的107种鉴定的蛋白质的平均值是0.42,这些蛋白质显示的平均CV是14.6%。确切地说,76.7%的蛋白质显示CV在0-10%之间,12.8%的蛋白质显示在10-20%之间,10.5%的蛋白质显示高于20%。
图31b.通过应用阈值过滤以除去MS/MS中TMT报道(离子)(质量标记部分)计数低于90的肽,含303种肽的103种鉴定的蛋白质的平均值是0.42,平均CV是5.1%。这样,89%的蛋白质显示CV在0-10%之间,9%的蛋白质显示在10-20%之间,不到1%的蛋白质显示高于20%。
实施例13–评估6重质量标记物(TMT试剂)的定量性能的实验
1-肽混合物:用于评估6重方案的定量性能的模型胰蛋白酶肽:
肽1:FSWGAEGQR分子量:1037,11
肽2:VATVSLHPR分子量:979,16
肽3:VATVSLPR分子量:842,01
-6重方案的反应性质量(TMT)标记物:用星号标记时是碳13或氮15。
-模型肽的通用偶联反应方案:
使溶解于83μl水/ACN(比例为1:9)的肽混合物(各肽为0.2μmol)与83μl硼酸盐缓冲液(200mM)混合,将该溶液的pH调节至7.8。然后将溶解于23μlDMF的TMT试剂(反应性质量标记物)(15mM)加入该肽溶液。室温搅拌2小时后,以给定的比例将各肽反应混合物合并到一起。然后采用HPLC(飞诺曼克斯露娜-250mm/4,6mm-5μC18)纯化最终的混合物,用LC-MS-MS/MS分析标记的肽。
图32.图32显示了6重方案中,用TMT试剂标记的3种肽的相对蛋白质检测。各肽以等摩尔比例标记(对于126:127:128:129:130:131为1:1:1:1:1:1)。按照以下TMT/(TMT+对照)检测比例,其中它们的峰面积代表了对照和TMT(质量标记物)值。各肽的预计比例是0.5。
图33.TMT报道离子(质量标记部分)系列126.1、127.1、128.1、129.1、130.1和131.1反映了以1:1:1:1:1:1比例标记的肽TMT-VATVSLHPR TMT的签名离子区域的例子。
图34.相对定量测定所述3种胰蛋白酶模型肽的掺合比例。用6种TMT试剂(质量标记物)以1:5:2:1:0.5:0.2的比例标记各肽的等份试样。用3种所述肽各自的5种不同预计和观测比例的回归线拟合TMT报道片段(质量标记部分)ESI-MS/MS数据。通过检测126.1、127.1、128.1、129.1、130.1和131.1处的峰面积来测定各报道离子的强度。TMT报道离子(质量标记部分)126取作对照来计算所述5种比例。按照以下TMT/(TMT+对照)检测比例,其中它们的峰面积代表了对照和TMT值。各蛋白质的预计比例是0.83、0.67、0.50、0.33和0.16。
图35.TMT报道离子(质量标记部分)系列126.1、127.1、128.1、129.1、130.1和131.1反映了以1:5:2:1:0.5:0.2的比例标记的肽TMT-VATVSLHPRTMT的签名离子区域的例子。
2-蛋白质混合物:蛋白质混合物中用于评估6重方案定量性能的蛋白质:蛋白质1,βGAL_ECOLI;蛋白质2,PHS2_RABIT;蛋白质3,ALBU_BOVIN;蛋白质4,KPYM_RABIT;蛋白质5,G3P_RABIT;蛋白质6,LDHA_RABIT。
以下实施例显示了依据六蛋白混合物分析的标记方案的精确性和分析变异性。
实施例14
图36.用6重TMT的不同成员标记6种蛋白质各自的6份等量试样。然后合并所有36种蛋白质-标签混合物,以一次LC-MS/MS运行进行分析。显示了应用阈值过滤以除去MS/MS图谱中TMT报道离子强度低的肽后,5种比例的各蛋白质的相对定量数据。各蛋白质以等摩尔比例标记(对于126:127:128:129:130:131为1:1:1:1:1:1),TMT片段126取作对照片段来计算5种比例。按照以下TMT/(TMT+对照)检测比例,其中它们的峰面积代表了对照和TMT值。在该情况中,预计比例是0.5。
实施例15
图37.用各TMT6重成员标记6种不同数量的各蛋白质,从而产生所示的5种比例。描述了应用阈值过滤以除去MS/MS图谱中TMT报道离子强度低的肽后,5种比例的各蛋白质的相对定量数据。以不同比例(对于126:127:128:129:130:131为1:5:2:1:0.5:0.2)标记各蛋白质。TMT片段126取作对照片段,按照以下TMT/(TMT+对照),例如127/(127+126)检测各比例,其中它们的峰面积代表了对照和TMT值。各蛋白质的预计比例是0.83、0.67、0.50、0.33和0.16。
质量标记的肽的MS/MS分析
MS/MS实验方案:
利用QTOF2质谱仪(英国曼彻斯特市的微质公司)进行MS和MS/MS分析。用CAP-LC HPLC系统(美国马萨诸塞州米尔福德的沃特斯公司)(柱:戴尔奈克斯公司的PepMapTMC18HPLC柱,其内径为75μm,长150mm;溶剂:95%水到95%乙腈,二者均含0.2%甲酸)进行HPLC分析。
通过对各肽图谱求和与校平测定其在电喷雾源中电离时的离子丰度比例,然后测定相应TMT报道离子的峰面积。
- 还没有人留言评论。精彩留言会获得点赞!